
Analiza wody do picia i celów komunalnych.
ANALIZA WODY DO PICIA I CELÓW KOMUNALNYCH
1. Wymagania stawiane wodzie do picia i na potrzeby gospodarcze
Jakość wody przeznaczonej do picia i na potrzeby gospodarcze w Polsce określają załączniki
nr 1 ÷ 3 do rozporządzenia Ministra Zdrowia z dnia 4 września 2000 r. W różnych krajach wskaź-
niki jakości wody są różne i zależą od stopnia zanieczyszczenia wód naturalnych kraju oraz tech-
nicznych i ekonomicznych możliwości oczyszczania wody.
2. Wybrane parametry oceny przydatności wody do picia i celów gospodarczych
2.1. Badania fizyczne wody
W celu ustalenia właściwości fizycznych wody wykonuje się m.in. oznaczenia: temperatury,
barwy, mętności, przewodności elektrycznej, zapachu, potencjału redukcyjno – oksydacyjnego.
Pomiar temperatury wody.
Temperatura wód powierzchniowych i zaskórnych ulega dużym wahaniom w skali roku. Na-
tomiast temperaturę wód podziemnych cechuje stała jej wartość. Wynosi ona na głębokościach po-
wyżej 35 m 8 -12
0
C. Na znacznych głębokościach temperatura ta może być wyższa (wraz ze wzro-
stem głębokości temperatura wewnątrz ziemi wzrasta). Zmiana temperatury wody podziemnej w
zależności od pory roku świadczy o zanieczyszczaniu jej przez napływające wody powierzchniowe.
Znajomość temperatury wody wymagana jest praktycznie we wszystkich badaniach. Przykładowo
można wymienić: badania limnologiczne (limnologia - nauka o zbiornikach wód śródlądowych,
głównie jezior) kiedy niezbędna jest znajomość temperatury wody na różnych głębokościach zbior-
nika, obliczanie zasadowości, stopnia nasycenia wodorowęglanem wapnia, przewodności właści-
wej, potencjału redox itp. Temperatura wody ma wpływ na procesy samooczyszczania zbiorników
wodnych, rozwój biocenoz wodnych, zwiększa intensywność procesów nitryfikacji, zwiększa wraż-
liwość organizmów żywych na działanie substancji toksycznych. Od temperatury wody zależy ilość
rozpuszczonych w niej gazów. Liczne zakłady przemysłowe wymagają danych o temperaturze wo-
dy w związku z procesami technologicznymi, w których jest ona wykorzystywana.
Pomiar temperatury należy wykonać natychmiast po pobraniu próbki wody lub bezpośrednio
w odbiorniku za pomocą odpowiednich urządzeń pomiarowych. Równocześnie należy dokonać
pomiaru temperatury powietrza.
Pomiaru temperatury w zbiornikach wód powierzchniowych dokonuje się za pomocą termo-
metru czerpakowego lub przyrządu probierczego zaopatrzonego w termometr (np. przyrząd Ruttne-

Analiza wody do picia i celów komunalnych.
ra) zanurzonego na odpowiednią głębokość, na co najmniej 5 minut w celu wyrównania temperatu-
ry. Odczytu temperatury dokonuje się natychmiast po wyciągnięciu przyrządu z wody. Jeżeli na-
czynie probiercze nie jest zaopatrzone w termometr, to po co najmniej 5 minutowym kontakcie tego
naczynia z badaną wodą, po jego wyciągnięciu z wody umieszcza się w nim termometr pomiarowy
w taki sposób, aby był zanurzony w niej całkowicie. Odczytu temperatury dokonuje się po upływie
5 minut od chwili zanurzenia termometru. Ilość próbki potrzebna do wykonania pomiaru wynosi co
najmniej 1 dm
3
. Temperaturę wody można również mierzyć za pomocą termometrów oporowych i
termoelementów. Jej odczytu dokonuje się po 5 minutowym zanurzeniu czujnika w punkcie pomia-
rowym.
Pomiar temperatury z urządzeń wodnych takich jak pompy, krany itp. przeprowadza się w na-
czyniu, przez które w ciągu co najmniej 10 minut przepływa badana woda. Odczytu temperatury
dokonuje się nie przerywając przepływu wody.
Wyniki pomiaru temperatury należy podawać wraz z temperaturą powietrza w miejscu po-
miaru w postaci ułamka temperatura powietrza / temperatura wody z dokładnością do 0,5 K.
Pomiaru temperatury powietrza dokonuje się za pomocą termometru procowego na wysoko-
ści 1 m nad ziemią w miejscu pomiaru temperatury wody. Termometr procowy jest termometrem
rtęciowym w specjalnej obudowie, który przywiązuje się do sznura o długości 1m, wprawia w ruch
obrotowy przez 1 – 2 minuty po czym odczytuje się temperaturę.
W czasie pomiaru temperatury wszystkie naczynia służące do pomiaru należy odizolować od
ubocznych wpływów cieplnych.
Oznaczenie barwy wody
Barwa wody może być wywołana zawartymi w wodzie substancjami humusowymi, plankto-
nem, roślinnością, jonami żelaza i manganu, ściekami przemysłowymi i komunalnymi. Rozróżnia
się barwę rzeczywistą wody i barwę pozorną. Barwa rzeczywista wody jest to barwa wody klarow-
nej po usunięciu mętności, natomiast barwę pozorną powodują drobne zabarwione cząstki zawie-
szone w wodzie łącznie z substancjami rozpuszczonymi. Barwę pozorną oznacza się bez uprzed-
niego sączenia lub odwirowania wody.
Wody naturalne mają zabarwienie zielonkawożółte o różnej intensywności. Ich barwa wynosi
na ogół 5 - 25 mg/dm
3
Pt (jednostka barwy w skali platynowo – kobaltowej). Intensywność barwy
świadczy o zanieczyszczeniu wody. Wody przepływające przez tereny leśne, torfowiska, pokłady
węgla brunatnego posiadają zabarwienie od żółtego do koloru mocnej herbaty i charakteryzują się
wysoką ilością jednostek barwy. W przypadku silnego zabarwienia woda staje się nieapetyczna –
budzi odrazę. Dlatego barwa wody kierowanej do zasilania sieci wodociągowej nie powinna prze-
kraczać 20 mg/dm
3
Pt. Wody studzienne wykorzystywane do picia i celów gospodarczych nie po-
2

Analiza wody do picia i celów komunalnych.
winny mieć barwy większej niż 25 mg/dm
3
. Wody zanieczyszczone przez niektóre ścieki przemy-
słowe posiadają barwę specyficzną odbiegającą od naturalnej. W przypadku tych wód nie stosuje
się zwykłych metod oceny barwy lecz metodę opisową.
Oznaczenie barwy należy do grupy oznaczeń, które należy wykonać możliwie szybko po po-
braniu próbki, gdyż podczas przechowywania mogą zachodzić różne przemiany tak fizykochemicz-
ne jak i biologiczne powodujące zmianę barwy wody. Próbki do oznaczenia nie powinno się utrwa-
lać.
Barwę wody można oznaczać:
• według skali platynowo – kobaltowej,
• według skali dwuchromianowo – kobaltowej,
• metodą opisową w przypadku barwy specyficznej,
• metodą oznaczania liczby progowej barwy,
• metodą spektrofotometryczną
W badaniach terenowych można stosować skalę szklaną, skalibrowaną wg skali platynowo –
kobaltowej.
Za jednostkę barwy przyjmuje się zabarwienie jakie posiada roztwór zawierający 1 dm
3
wody
destylowanej, 1mg platyny w postaci chloroplatynianu potasu ( K
2
PtCl
6
) i 0,5 mg kobaltu w posta-
ci chlorku kobaltu (II) (CoCl
2
· H
2
O) i oznacza w mg/dm
3
. Zasada oznaczenia barwy według skali
platynowo – kobaltowej polega na wizualnym porównaniu barwy badanej próbki ze skalą wzorców.
Przy oznaczaniu barwy przeszkadza nawet niewielka mętność, którą usuwa się przez odwirowanie z
szybkością dostosowaną do jej mętności lub sączenie na sączku ilościowym o średniej grubości.
Ponieważ na barwę wpływa także odczyn dlatego też należy podawać przy jakim pH badana była
barwa.
Skalę dwuchromianowo - kobaltową stosuje się zastępczo zamiast skali platynowo – kobal-
towej w przypadku braku chloroplatynianu potasu a zasada oznaczenia jest taka sama.
Jeżeli woda ma barwę odbiegającą od skali platynowo – kobaltowej należy wówczas scharak-
teryzować opisowo rodzaj i intensywność barwy.
Oznaczenie barwy wg liczby progowej wykonuje się jeżeli odbiega ona od skali platynowo –
kobaltowej. Polega ono na ustaleniu objętości badanej wody rozcieńczonej do 100 ml wodą desty-
lowaną, przy której po raz pierwszy zaobserwowana została barwa. Jako próbkę odniesienia uży-
wana jest woda destylowana (100 ml), a wynik oznaczenia oblicza się ze wzoru:
V
L
p
100
=
gdzie: V – objętość wody użyta do oznaczenia gdy pojawiła się po raz pierwszy barwa.
3

Analiza wody do picia i celów komunalnych.
Oznaczenie mętności wody
Mętnością nazywa się optyczne właściwości drobnych zawiesin występujących w wodzie,
które powodują zjawisko rozproszenia światła. Wywołują ją rozproszone w wodzie: glina i iły,
związki żelaza, manganu i glinu oraz rozdrobnione substancje organiczne, plankton, mikroorgani-
zmy itp. Woda do picia i celów gospodarczych powinna być klarowna.
Mętność wody oznacza się przez porównanie ze wzorcami zawierającymi zawiesinę krze-
mionki. Za jednostkę mętności uważa się mętność, jaką posiada wzorzec sporządzony z 1 mg od-
powiednio przygotowanej krzemionki rozpuszczonej w 1 dm
3
wody destylowanej i wyraża się ją
jako mg/dm
3
. Jednostka ta nie jest jednak równoważna z ilości zawiesin zawartych w wodzie ozna-
czonych wagowo, gdyż mętność jest cechą optyczną wody, która nie koreluje z oznaczeniem gra-
wimetrycznym (ze względu na różny kształt, wielkość cząstek, współczynnik załamania światła,
gęstość właściwą poszczególnych zawiesin). Jako wzorzec mętności stosuje się również formazynę.
W krajach zachodnich w oznaczaniu mętności stosuje się jednostkę 1 NTU (nephelometric turbidity
unit), która jest równoważna stosowanej w Polsce jednostce 1 mg/dm
3
. Oznaczenie mętności po-
winno być wykonane w dniu pobrania próbki. W przypadku, gdy zachodzi konieczność dłuższego
przechowywania próbkę można przechowywać w ciemnym miejscu w czasie 24 godzin. Przed
oznaczaniem mętności próbki należy dokładnie wymieszać.
Mętność wody można oznaczyć następującymi metodami:
• wizualną, turbidymetryczną w zakresie 0 ÷ 5 mg/dm
3
,
• wizualną, turbidymetryczną w zakresie 5 ÷ 50 mg/dm
3
,
• nefelometryczną.
Odwrotnością mętności jest przezroczystość. Oznacza się ją w terenie (badanie jezior, zbior-
ników zaporowych) za pomocą tzw. krążka Secchiego. Biały krążek zawieszony na lince opuszcza
się w wodzie i obserwuje na jakiej głębokości przestanie być widoczny. Głębokość wyrażona w
metrach jest miarą przezroczystości.
Oznaczenie mętności metodami wizualnymi w obu wymienionych zakresach polega na wizu-
alnym porównaniu właściwości optycznych (intensywności przepuszczanego światła) próbki wody
z odpowiednio przygotowanymi wzorcami. W oznaczeniu przeszkadzają: barwa, szybko opadające
zawiesiny, pęcherzyki powietrza obecne w próbce. Wody naturalne posiadają przeważnie mętność
większą od 5 mg/dm
3
.
Oznaczenie mętności wody metodą nefelometryczną polega na porównaniu intensywności
światłą rozproszonego od koloidalnych cząstek i drobnych zawiesin z odpowiednio przygotowa-
nymi wzorcami. Intensywność rozproszonego światłą jest proporcjonalna do mętności badanej wo-
dy, której wartość oznacza się za pomocą nefelometrów. Przed przystąpieniem do pomiaru mętno-
4

Analiza wody do picia i celów komunalnych.
ści sporządza się krzywą wzorcową mętności (zależność między wielkością mętności a odczytem
na nefelometrze), na podstawie której w czasie pomiaru wyznacza się mętność badanej próbki.
Przewodność właściwa wody
Rozpuszczone w wodzie sole, kwasy, zasady dysocjują na jony dodatnie (kationy) i ujemne
(aniony). Po wprowadzeniu do takiego roztworu (elektrolitu) dwóch elektrod, do których przyłoży
się napięcie, to przez warstwę pomiędzy elektrodami przepływa prąd elektryczny.
Przewodnością elektryczną nazywamy zdolność roztworu wodnego do przewodzenia prądu
elektrycznego. Wielkość ta jest odwrotnością oporności. Jednostką przewodności elektrycznej jest S
(simens), który jest odwrotnością oma. Natomiast przewodność słupa cieczy o grubości 1 cm i
przekroju 1cm
2
nazywana jest przewodnością właściwą χ, jej jednostką jest S/ cm lub 1/Ω
·
cm.
Teoretyczna przewodność właściwa czystej chemicznie wody w temperaturze 297 K spowo-
dowana włącznie dysocjacją na jony H
+
i OH
-
wynosi 5·10
-8
S/cm, natomiast świeżo destylowaną
woda ma przewodność 0,5 ÷ 2 µS/cm. Przechowywanie wody destylowanej będącej w kontakcie z
powietrzem otoczenia prowadzi do wzrostu jej przewodności właściwej na skutek rozpuszczenia w
niej dwutlenku węgla i ewentualnie amoniaku. Przewodność wód naturalnych waha się natomiast w
granicach 50 ÷ 1000 µS/cm. Duży wpływ na wartość przewodności właściwej wody ma stopień jej
zanieczyszczenia zwłaszcza ściekami przemysłowymi. Wysoka wartość przewodności właściwej
wody świadczy o jej zanieczyszczeniu związkami mineralnymi, gdyż przewodność wody wynikają-
ca z obecności w niej związków organicznych, które praktycznie nie dysocjują w wodzie jest nie-
wielka.
Na podstawie pomiaru przewodności właściwej można określić przybliżoną zawartość katio-
nów lub anionów w mval/ dm
3
w wodzie mnożąc wynik przewodności w µS/cm przez 0,01 oraz
oszacować zawartość w wodzie suchej pozostałości. Należy wówczas pomnożyć wartość przewod-
ności właściwej badanej wody przez wyznaczony doświadczalnie współczynnik, który zależy od
składu rozpuszczonych substancji i mieści się w przedziale 0,55 – 0,9.
Ponieważ przewodność właściwa zależy od temperatury, pomiary należy wykonywać w stałej
temperaturze, zwykle 25
0
C. Przeliczanie wartości przewodności zmierzonej w innej temperaturze
na przewodność w temperaturze 25
0
C obarczone jest błędem wynikającym z różnic w współczyn-
nikach temperaturowych dla różnych jonów. Można jednak przyjąć, że przewodność właściwa wo-
dy wzrasta w przybliżeniu o 2% przy wzroście temperatury o 1
0
C. W pomiarach przewodności
właściwej wykonanych za pomocą konduktometrów z automatyczną kompensacją temperatury nie
ma potrzeby dokonywania korekty wskazań.
W pomiarze przewodności wody przeszkadza obecność tłuszczów i olejów, które zanieczysz-
czają elektrody i mogą być przyczyną błędów w oznaczaniu. W przypadku ich obecności w wodzie
5

Analiza wody do picia i celów komunalnych.
pomiar przewodności należy wykonać przy użyciu elektrod gładkich, nie pokrytych czernią platy-
nową albo najlepiej usunąć je z wody przed wykonaniem oznaczenia.
Zasada oznaczania przewodności właściwej polega na pomiarze przewodności elektrolitycz-
nej właściwej słupa wody ograniczonego dwiema elektrodami czujnika wchodzącego w skład urzą-
dzenia pomiarowego. Istnieje szereg rozwiązań konstrukcyjnych konduktometrów. Niektóre z nich
posiadają wewnętrzny standardowy opornik i czujniki pomiarowe o znanej stałej konduktometrycz-
nej. Pozwalają one na odczyt pomiaru bezpośrednio na skali przyrządu bez konieczności przelicza-
nia i uwzględniania stałej konduktometrycznej.
Oznaczanie zapachu wody
Jednym z ważniejszych wskaźników oceniających jakość wody do picia i do celów gospodar-
czych jest zapach. Jest on niekiedy czulszym wskaźnikiem obecności w wodzie niektórych związ-
ków niż chemiczne metody ich wykrywania. Zapach może być wywołany obecnością w wodzie
gazów, lotnych związków organicznych, ścieków. Może pochodzić między innymi od technologii
uzdatniania wody, np. chlorowania (zapach chloru lub chlorofenolu w przypadku gdy w wodzie są
obecne są fenole). Zapach mogą powodować również niektóre organizmy wodne.
Ze względu na różnorodność zapachów wody i subiektywność ich wykrywania zapachy zo-
stały podzielone na zapachy pochodzenia naturalnego i nienaturalnego. Zapach naturalny wynika z
obecności w wodzie substancji organicznych nie będących w stadium gnicia. Może on pochodzić
np. z gleby, być wydzielany przez plankton. Ten rodzaj zapachu nazywany jest zapachem roślin-
nym i oznaczany jest literą R (zapach siana, mchu, torfu itp.). Zapach nienaturalny pochodzący z
rozkładu gnilnego substancji organicznych nazywany jest zapachem gnilnym i oznacza literą G
(zapach pleśni, siarkowodoru, fekalny itp.) Zapachy pochodzenia nienaturalnego wywołane mogą
być również obecnością w wodzie związków specyficznych np. smoły, ropy naftowej, fenolu.
Oznaczane są one literą S.
Charakter zapachu określa się opisowo podając jego rodzaj i intensywność. Do tego celu na-
leży używać butelek szklanych z doszlifowanym korkiem (butelki plastikowe nie nadają się do
oznaczania zapachu). W celu usunięcia zapachu chloru po chlorowaniu należy do próbki dodać kil-
ka miligramów tiosiarczanu sodowego. Wykonanie oznaczenia należy wykonać niezwłocznie po
pobraniu, a jeżeli konieczne jest przechowanie próbki należy ją przechowywać w ciemnym miejscu
w temperaturze 2 - 5
0
C. Przetrzymywanie wody w chłodni nie eliminuje zmian w jej zapachu lecz
jedynie je zmniejsza. Przy podawaniu wyniku oznaczania zapachu należy podać temperaturę, w
której zapach badano. Ma ona duży wpływ na intensywność zapachu. Badania zapachu wody za-
wierającej substancje trudnolotne powinno wykonywać się w temperaturze standardowej w której
6

Analiza wody do picia i celów komunalnych.
określa się zapach progowy na gorąco tj. 60
0
C. Do określania zapachu wody stosuje się następują-
ce metody:
• metoda organoleptyczna bezpośrednia,
• metoda zapachu progowego.
Metoda organoleptyczna polega na określeniu grupy i intensywności zapachu za pomocą po-
wonienia. W oznaczeniu przeszkadza chlor czynny i siarkowodór, gdy nie są one przedmiotem
oznaczania (usuwa się je odpowiednio kilkoma kroplami 10% roztworu tiosiarczanu sodowego i
octanu kadmu. Przed oznaczeniem należy unikać obcych źródeł zapachu (tytoniu, mydła itp.). W
przypadku oznaczania zapachu kilku próbek wody należy zacząć od określania zapachu próbki o
najsłabszym zapachu.
W wyniku oznaczania należy podać czy zapach był oznaczany na zimno (z) czy na gorąco
(g), jego intensywność mierzoną w skali 1÷5 oraz grupę zapachu (roślinny – R, gnilny – G, specy-
ficzny – S). Pięciostopniowa skala intensywności zapachu oznacza:
0 – brak zapachu,
1 – zapach bardzo słaby ( trudno wyczuwalny),
2 – słaby (dość trudno wyczuwalny),
3 – wyraźny (mogący dyskwalifikować wodę do picia),
4 – silny (dyskwalifikujący wodę do picia i do celów gospodarczych),
5 – bardzo silny (dyskwalifikuje wodę do użytku w ogóle).
W przypadku zapachu specyficznego należy dodatkowo określić jego rodzaj. Przykładowo
wynik z2S (chlor) oznacza zapach specyficzny chloru o słabej intensywności oznaczany na zimno.
Oznaczanie zapachu metodą zapachu progowego polega na określeniu stopnia rozcieńczenia
próbki badanej wody wodą bez zapachu, przy którym zapach wody badanej staje się bardzo słaby i
odpowiada 1 w pięciostopniowej skali intensywności zapachu. W metodzie tej zapach określa się za
pomocą tzw. liczby progowej L
p
, która jest krotnością rozcieńczenia badanej próbki kiedy zapach
staje się słabo wyczuwalny. Oznaczenie liczby progowej zapachu przeprowadza się na zimno w
temperaturze 20
0
C i na gorąco 60
0
C.
Oznaczanie potencjału redukcyjno – oksydacyjnego (redox)
Reakcje utleniania i redukcji są najczęściej zachodzącymi reakcjami chemicznymi w środo-
wisku wodnym. Wody zanieczyszczone zawierają dużo substancji redukujących mało zaś substan-
cji utleniających. Potencjał redox takiej wody jest niski. W wyniku samooczyszczania wody na sku-
tek zachodzących procesów biochemicznego utleniania potencjał ten rośnie, gdyż maleje ilość sub-
stancji redukcyjnych a rośnie zawartość substancji utleniających. Potencjał redox może więc służyć
zarówno do oceny stopnia czystości zbiorników wodnych jak i prawidłowości przebiegu procesów
7

Analiza wody do picia i celów komunalnych.
ich samooczyszczania. Istotne znaczenie na potencjał redox przy ocenie procesu chlorowania wody
w stacjach jej uzdatniania. Mierząc wartość potencjału redox można pośrednio określić stężenie
chloru w dezynfekowanej wodzie oraz wykonać ciągły pomiar poziomu jego zawartości w wodzie.
Wartość potencjału oksydacyjno-redukcyjnego można wyznaczyć w oparciu o prawo Nernsta ze
wzoru:
.
.
0
ln
reduk
utlen
r
c
c
nF
RT
E
E
+
=
K
p
r
E
E
E
−
=
)
(
lg
2
H
p
rH
−
=
gdzie : E
r
– potencjał redox,
E
0
– potencjał normalny elektrody,
R – stała gazowa,
T – temperatura,
F – stała Faradaya,
n – liczba elektronów biorących udział w reakcji,
c
utlen.
- stężenie (aktywność) substancji utleniających,
c
reduk.
– stężenie (aktywność) substancji redukujących.
W przypadku wód naturalnych z uwagi na brak możliwości wyznaczenia stężeń substancji
utleniających i redukujących w wodzie nie jest możliwe bezpośrednie wykorzystanie powyższego
wzoru do wyznaczenia potencjału. Potencjał redox E
r
mierzy się w praktyce elektrochemicznie. Za
wartość potencjału, który podaje się w mV, przyjmuje się potencjał elektrody z metalu szlachetnego
E
p
zanurzonej w badanej wodzie w stosunku do kalomelowej elektrody odniesienia E
k
.
Taki sposób określania potencjału oksydacyjno – redukcyjnego zależy od szybkości reakcji
zachodzących na powierzchni elektrody i nie odzwierciedlają wszystkich procesów
redox zacho-
dzących w wodzie i dają jedynie przybliżoną informację o zawartości substancji redukujących i
utleniających w próbce. Wykonując pomiar potencjału
redox należy pamiętać o pomiarze tempera-
tury badanej wody, gdyż potencjał elektrody odniesienia zmienia się wraz z temperaturą.
Często właściwości
redox wody wyraża się za pomocą tzw. wykładnika wodorowego rH.
Wykładnik ten jest równoważny ciśnieniu wodoru, które ustala się powierzchni gładkiej elektrody
platynowej, zanurzonej do badanego roztworu. Wykładnik wodorowy rH można zdefiniować jako
logarytm ze znakiem ujemnym z wartości ciśnienia cząstkowego wodoru
p(H
2
).
8

Analiza wody do picia i celów komunalnych.
Przyjmuje się, że roztwory o rH < 15 posiadają charakter redukujący, zaś roztwory o warto-
ściach rH > 25 mają charakter utleniający. Wartość rH w zakresie 15-25 posiadają roztwory nie
wykazujące właściwości
redox.
2.2 Badania chemiczne wody
2.2.1. Ocena zawartości substancji organicznych w wodzie
Do oceny ogólnego zanieczyszczenia wody substancjami organicznymi wykorzystuje się naj-
częściej następujące wskaźniki: BZT
5
(biochemiczne zapotrzebowanie tlenu), ChZT (chemiczne
zapotrzebowanie tlenu), utlenialność, które w Polsce są standardowo oznaczane oraz OWO (ogólny
węgiel organiczny) i RWO (rozpuszczony węgiel organiczny).
Biochemiczne zapotrzebowanie tlenu
Biochemiczne zapotrzebowanie tlenu – BZT jest to ilość tlenu, wyrażona w mg/dm
3
, potrzeb-
na do utlenienia związków organicznych obecnych w wodzie na drodze biochemicznej, w warun-
kach aerobowych (przy obecności tlenu) w temperaturze 20
0
C. Procesy biochemicznego utleniania
zachodzą w wodzie wg schematu:
Związki organiczne + tlen
→ dwutlenek węgla + woda+ bakterie
enzymy
bakterie
3
2
NO
NO
tlen
tlen
→
→
Końcowym produktem biochemicznego utleniania jest głównie dwutlenek węgla i woda.
Część substancji organicznych na drodze syntezy tworzy nowe komórki, które z kolei ulegają tle-
nowemu rozkładowi.
Drugą fazą procesów biochemicznych zachodzących w wodzie, która następuje zwykle po
biochemicznym utlenianiu jest nitryfikacja związków azotowych. Czasami jednak procesy te za-
chodzą na siebie. Produktem końcowym nitryfikacji są azotany. Przebieg procesu nitryfikacji moż-
na przedstawić za pomocą schematu:
NH
3
Przebieg procesów biochemicznych zachodzących w wodzie można zilustrować za pomocą
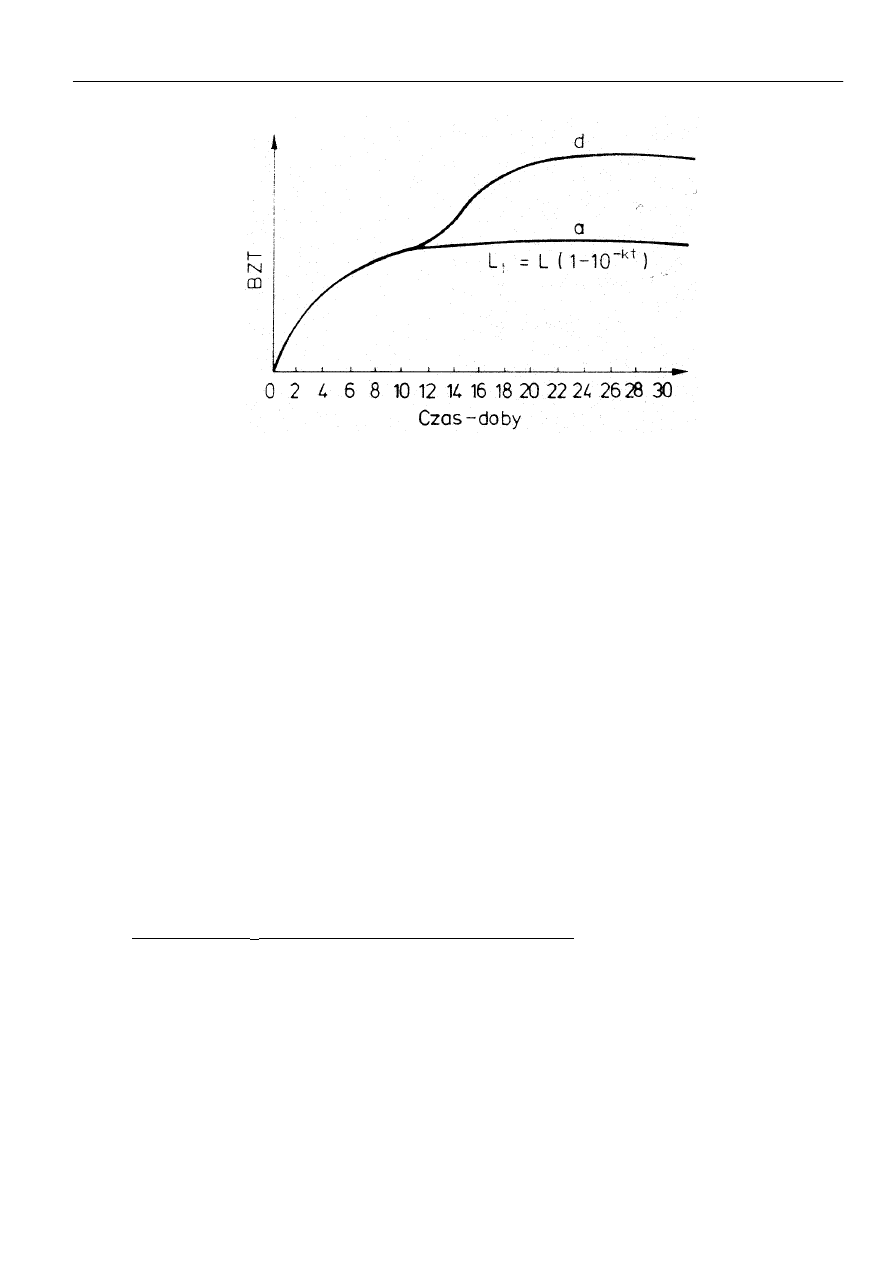
krzywej BZT, która jest wypadkową procesów utleniania i nitryfikacji (rys 1).
Przyjmuje się że prawie całkowita mineralizacja substancji organicznych zawartych w wodzie
(ok. 99%) występuje po okresie 20 dni (wskaźnik BZT
20
). Najintensywniej przebiegają jednak pro-
cesy w pierwszych 5 dniach (BZT
5
) i dlatego parametr ten jest uważany za wskaźnik zanieczysz-
czenia wody substancjami organicznymi. Oznaczenie BZT
5
nie obejmuje zwykle procesów nitryfi-
kacji.
9
Analiza wody do picia i celów komunalnych.
Rys. 1.
Krzywa przebiegu BZT
a) biochemiczne utlenianie związków węglowych,
d) biochemiczne utlenianie związków azotowych.
Ze względu na ciągle przebiegające procesy biochemiczne oznaczenie BZT należy przepro-
wadzić możliwie szybko po pobraniu próbki. W oznaczeniu przeszkadzają substancje toksyczne,
chlor, kwasy, zasady, które przed przystąpieniem do oznaczenia należy wyeliminować. Po ich wy-
eliminowaniu badaną próbkę wody należy zaszczepić. Do oznaczania BZT stosuje się najczęściej
metodę bezpośrednią i metodę rozcieńczeń. W przypadku dużego zanieczyszczenia wody BZT
można oznaczyć również
metodą manometryczną (BZT > 500 mg O
2
/dm
3
) lub
metodą automatycz-
ną z wykorzystaniem Sapromatu.
W przypadkach jeżeli woda badana jest silnie zanieczyszczona substancjami łatwo utleniają-
cymi się można wykonać oznaczenie natychmiastowego zapotrzebowania tlenu (NZT), które pole-
ga na oznaczeniu różnicy w zawartości tlenu natychmiast po pobraniu i po 15 min od chwili pobra-
nia próbki po jej uprzednim rozcieńczeniu.
Oznaczenie BZT
5
metodą bezpośrednią i metodą rozcieńczeń.
Zasada oznaczenia polega określeniu zużycia tlenu na procesy mineralizacji związków orga-
nicznych w temperaturze 20
0
C w okresie pięciodniowej inkubacji próbki wody. Wartość wskaźni-
ka BZT
5
jest różnicą w zawartości tlenu zawartego w badanej wodzie na początku oznaczania i po 5
dniach przetrzymywania wody w wymaganej temperaturze. W przypadku wód silnie zanieczysz-
czonych (utlenialność powyżej 10 mg O
2
/dm
3
) ilość zawartego w wodzie tlenu jest niewystarczają-
ca i wówczas stosuje się rozcieńczenie wodą specjalnie przygotowaną, która dostarcza potrzebnego
tlenu.
10

Analiza wody do picia i celów komunalnych.
Oznaczanie BZT
5
(metoda bez rozcieńczenia) przeprowadza się w 4 czystych butelkach z do-
szlifowanymi ukośnymi korkami, których używa się tylko do tego oznaczenia. Jeżeli w badanej
wodzie znajdują się substancje przeszkadzające należy je wyeliminować, po czym próbkę należy
zaszczepić używając do tego celu specjalnie przygotowanych ścieków bytowo- gospodarczych w
ilości 0,5 – 1,0% objętości próbki użytej do oznaczenia. Butelki należy napełniać w taki sposób aby
nie pozostawić pod korkiem pęcherzy powietrza. W dwóch wziętych do oznaczania butelkach nie-
zwłocznie oznacza się zawartość tlenu a pozostałe pozostawia w termostacie (20
0
C) na okres 5 dni
zabezpieczając je dodatkowo zamknięciem wodnym. Po tym czasie należy oznaczyć w nich w za-
wartość tlenu. Jako wynik oznaczenia BZT
5
podaje się różnicę w zawartości tlenu przed i po inku-
bacji wyrażoną w mg O
2
/dm
3
.
Jeżeli badana woda jest silnie zanieczyszczona (utlenialność powyżej 10 mg O
2
/dm
3
) to BZT
5
wykonać należy metodą rozcieńczeń. W tym celu próbkę badanej wody rozcieńcza się specjalnie
przygotowaną wodą (zawartość tlenu 8 – 9 mg/dm
3
, BZT
5
poniżej 0,5 mg O
2
/dm
3
). Zwykle dla wód
średnio zanieczyszczonych stosuje się trzy rozcieńczenia: 1+1; 1+3; 1+9. Przygotowane w odpo-
wiedni sposób próbki (unikać należy napowietrzania) należy odlewarować do butelek ( po 3 butelki
dla każdego rozcieńczenia), z których dwie kieruje się do termostatu, a w jednej oznacza się zawar-
tość tlenu natychmiast po napełnieniu. Równolegle wykonuje się oznaczenie BZT
5
wody użytej do
rozcieńczania napełniając nią dwie butelki, z których w jednej oznacza się tlen bezpośrednio po
napełnieniu, a w drugiej po 5 - dniowej inkubacji w temperaturze 20
0
C. Za miarodajny wynik do
obliczenia BZT
5
uważa się to rozcieńczenie, w którym zużycie tlenu wynosi przynajmniej 2
mg/dm
3
, a ilość tlenu pozostałego po inkubacji nie jest mniejsza od 1 mg/dm
3
. Jako wynik oznacza-
nia przyjmuje się różnicę w zawartości tlenu przed i po inkubacji z uwzględnioną poprawką na
zmianę zawartości tlenu w czasie inkubacji wody użytej do rozcieńczania.
Chemiczne zapotrzebowanie tlenu ChZT
Chemiczne zapotrzebowanie tlenu ChZT jest to ilość tlenu równoważna ilości utleniacza zu-
żytego do utlenienia substancji zawartych w jednostce objętości badanej wody. W zależności od
użytego środka utleniającego rozróżnia się zapotrzebowanie tlenu nadmanganianowe ChZT-Mn
(utlenialność, indeks nadmanganianowy) oraz dwuchromianowe zapotrzebowanie tlenu ChZT-Cr.
W czasie oznaczania ChZT utleniane są głównie substancje organiczne i niektóre nieorganiczne.
Wyniki otrzymywane przy zastosowaniu metody nadmanganianowej i dwuchromianowej są prze-
ważnie różne dla tej samej próbki wody. Stopień utleniania substancji zawartych w wodzie zależy
bowiem od szeregu czynników, do których można zaliczyć: właściwości utleniacza, jego stężenie,
temperaturę, czas działania, pH roztworu itp.. W związku z tym w celu zapewnienia powtarzalności
wyników oznaczania należy ściśle określić warunki w jakich należy je wykonać. Znajomość ChZT
11

Analiza wody do picia i celów komunalnych.
pozwala na pośrednie określenie w wodzie zawartości związków organicznych. Niekiedy zachodzi
koreleacja między wartościami ChZT, BZT i OWO.
Utlenialność wody
Utlenialność wody jest to właściwość wody polegająca na redukowaniu nadmanganianu pota-
su w wyniku utleniania obecnych w wodzie związków organicznych. Również niektóre związki
nieorganiczne ( np. sole żelaza II, azotyny) ulegają w tych warunkach utlenieniu. Jest to jedynie
orientacyjny wskaźnik informujący o zanieczyszczeniu wody związkami organicznymi. Pełniej-
szych informacji o zanieczyszczeniu wody tymi substancjami dostarcza oznaczenie wskaźnika
ChZT, w którym utlenieniu ulega więcej substancji organicznych oraz oznaczenie ogólnego węgla
organicznego OWO. Podwyższona utlenialność wody towarzysząca zwiększonej zawartości związ-
ków azotu, chlorków i zwiększonej opalescensji wody świadczy o jej zanieczyszczeniu związkami
organicznymi pochodzenia zwierzęcego. Natomiast w przypadku zanieczyszczenia wody związka-
mi organicznymi pochodzenia roślinnego, podwyższonej utlenialności towarzyszy zwykle podwyż-
szona barwa.
Przez utlenialność rozumie się ilość miligramów tlenu zużytego przez badaną próbkę ogrze-
waną we wrzącej łaźni wodnej w ciągu 30 min. z roztworem nadmanganianu potasu w środowisku
kwaśnym. Wynik oznaczenia utlenialności podaje się w mg O
2
/dm
3
. Wody powierzchniowe nie
zanieczyszczone charakteryzują się utlenialnością ok. 4,0 mg O
2
/dm
3
. Znacznie wyższą utlenial-
ność, dochodzącą do kilkunastu mg O
2
/dm
3
posiadają wody zanieczyszczone substancjami humu-
sowymi. Utlenialność wody do picia nie powinna przekraczać 3 mg O
2
/dm
3
.
Wskaźnik ChZT wody oznaczony metodą dwuchromianową (PN-74/C-04578)
Do oznaczania ChZT wody, obok metody nadmanganianowej, stosuje się najczęściej metodę
dwuchromianową. Metoda ta polega na utlenianiu zawartych w wodzie związków organicznych i
niektórych nieorganicznych za pomocą mieszaniny utleniającej składającej się dwuchromianu pota-
su (K
2
Cr
2
O
7
) i stężonego kwasu siarkowego(VI), a następnie odmiareczkowaniu nieprzereagowa-
nego dwuchromianu za pomocą siarczanu żelaza(II)amonu [Fe(NH
4
)
2
(SO
4
)
2
]
wobec ferriony jako
wskaźnika. Utlenianie prowadzi się przy udziale katalizatora (Ag
2
SO
4
) w zestawie destylacyjnym z
chłodnicą zwrotną utrzymując próbkę w stanie wrzenia przez 10 min. W oznaczeniu przeszkadzają
chlorki, jodki i bromki. Jeżeli zawartość chlorków przekracza 700 mg/dm
3
oznaczenie należy wy-
konać na próbce rozcieńczonej. Trudności związane z obecnością chlorków, które zużywają dwu-
chromian utleniając się do chloru gazowego można wyeliminować przez dodanie do badanej wody
HgSO
4
. Maskuje on obecne w wodzie chlorki wiążąc je w rozpuszczalny kompleks chlorortęciowy.
W przypadku gdy do oznaczenia nie dodaje się siarczanu rtęci(II) należy wynik oznaczenia ChZT
12

Analiza wody do picia i celów komunalnych.
skorygować odejmując poprawkę na obecne w wodzie chlorki. Wartość poprawki ustala się wów-
czas na podstawie analizy zawartości chlorków, którą należy pomnożyć przez 0,226 (1 mg Cl
-
jest
równoważny 0,226 mg O
2
).
W oznaczaniu ChZT stosuje się katalizator Ag
2
SO
4
, który przyspiesza
utlenianie prostołańcuchowych związków alifatycznych, lecz reaguje jednocześnie z chlorkami,
jodkami i bromkami strącając osady. Ulegają one jednak tylko częściowemu utlenieniu.
Metoda dwuchromianowa ma tą wyższość nad innymi, że cechuje się prostotą wykonania,
jest odtwarzalna i daje wysoki stopień utlenienia substancji organicznych dochodzący 95÷100%
wartości teoretycznej. Utlenieniu nie ulegają jedynie benzen, toluen i w małym stopniu pirydyna. W
przypadku nieobecności katalizatora Ag
2
SO
4
pewne związki nie ulegają utlenieniu np. kwas octo-
wy, który utlenia się na drodze biochemicznej. Dwuchromian potasu nie utlenia też związków amo-
nowych i amoniaku wydzielonego z rozkładu związków białkowych.
W metodzie dwuchromianowej w celu oznaczenia wskaźnika ChZT przekraczającego 50 mg
O
2
/dm
3
stosuje się stężony roztwór dwuchromianu potasu, natomiast użycie rozcieńczonego roz-
tworu dwuchromianu pozwala na oznaczenie ChZT poniżej 50 mg O
2
/dm
3
. Należy tym miejscu
zaznaczyć, że uzyskiwane wyniki oznaczenia poniżej 10 mg O
2
/dm
3
są obarczone większym błę-
dem i wykorzystywane są głównie do celów szacunkowych.
Standardowa wg PN metoda dwuchromianowa oznaczania wskaźnika ChZT posiada szereg
nowelizacji - metoda Teksas, metoda spektrofotometryczna firmy HACH. Na uwagę zasługuje me-
toda z wykorzystaniem spektrofotometru zaproponowana przez firmę HACH. W metodzie tej pro-
ces utleniania substancji organicznych obecnych w wodzie przebiega w specjalnych fiolkach zawie-
rających ściśle odmierzone roztwory dwuchromianu i kwasu siarkowego uzupełnione katalizatorem
(siarczanem srebra) i ewentualnie siarczanem rtęci(II), do których odmierza się próbkę badanej wo-
dy. Fiolki te umieszcza się następnie na 2 godziny w specjalnym reaktorze, w którym utrzymywana
jest temperatura 150
0
C. Po ochłodzeniu fiolki z badaną próbką i przereagowanymi odczynnikami
poddaje się analizie spektrofotometrycznej. W czasie utleniania zanieczyszczeń obecnych w wodzie
chrom znajdujący się w dwuchromianie potasu na
+
6 stopniu utlenienia ulega redukcji do chromu
na
+
3 stopniu utlenienia, który ma charakterystyczną zieloną barwę. Mierzona spektofotometrem
intensywność powstałego zielonego zabarwienia jest proporcjonalna do ilości zredukowanego
chromu i jednocześnie miarą ilości tlenu potrzebnego do utlenienia związków zawartych w wodzie.
W metodzie tej stosuje się trzy rodzaje odczynników umożliwiających oznaczenie ChZT w zakre-
sie: 0 – 150 mg O
2
/dm
3
; 0 – 1500 mg O
2
/dm
3
; 0 – 10 000 mg O
2
/dm
3
.
Oznaczanie zawartości ogólnego węgla organicznego OWO
Oznaczenie węgla ogólnego jest jednym z najdokładniejszych sposobów określenia zanie-
czyszczenia wody substancjami organicznymi. Węgiel organiczny oznacza się najczęściej spalając
13

Analiza wody do picia i celów komunalnych.
w strumieniu tlenu lub powietrza zawarte w wodzie substancje organiczne. Powstający w wyniku
spalania węgla dwutlenek analizowany jest metodą spektrofotometryczną w podczerwieni (analiza-
tor OWO), lub miareczkową z dwuchromianem potasu.
Oznaczanie zawartości fenoli w wodzie
Terminem fenole określa się wodorotlenowe pochodne benzenu i inne aromatyczne hydrok-
syzwiązki. Fenole dzieli się na fenole lotne, które z roztworu kwaśnego destylują z parą wodną oraz
fenole nielotne (nie oddestylowują z parą). Sumę fenoli lotnych i nielotnych określa się mianem
fenoli ogólnych.
Fenole dostają się do wód powierzchniowych wraz ze ściekami zarówno komunalnymi jak i
przemysłowymi (przeważnie obciążone są większą zawartością fenoli niż ścieki komunalne).
Wśród ścieków przemysłowych największy ładunek fenoli niosą ze sobą ścieki koksownicze, rafi-
neryjne, ścieki z zakładów tworzyw sztucznych i farmaceutycznych. Wprawdzie fenole ulegają
dość szybkiej biodegradacji ale w okresie zimowym proces ten jest praktycznie zatrzymany. W
związku z tym oznaczenie fenoli w wodzie należy wykonać bezpośrednio po pobraniu próbki, a gdy
jest to niemożliwe należy ją utrwalić obniżając pH do około 4,0 a następnie dodać siarczanu mie-
dziowego w ilości 1 g/dm
3
wody. Fenole w ilościach normalnie spotykanych w wodach naturalnych
nie są szkodliwe dla zdrowia. Jednakże już zawartość w wodzie fenoli rzędu 0.005 mg/dm
3
prze-
szkadza w procesie jej chlorowania. Powstające wówczas chlorofenole nadają chlorowanej wodzie
odrażający zapach. Obecny w wodzie (większych ilościach) fenol akumuluje się w mięsie ryb i na-
daje im nieprzyjemny smak a tym samym dyskwalifikuje je jako produkt spożywczy.
Do oznaczania fenoli w wodzie oraz w ściekach stosuje się najczęściej dwie metody: metodę
kolorymetryczną z 4- aminoantypiryną (PN-72/C-04602.02,03.) posiadającą trzy modyfikacje, które
stosuje się w zależności od stopnia zanieczyszczenia wody fenolami oraz metodę miareczkową –
bromometryczną (PN-72/C-04602.04).
Oznaczanie fenoli lotnych metodą kolorymetryczną z 4- aminoantypiryną
Metoda kolorymetryczna oznaczania fenoli lotnych polega na wydzieleniu ich z wody lub
ścieków na drodze destylacji z roztworu kwaśnego i następnie reakcji z 4-aminoantypiryną w śro-
dowisku alkalicznym w obecności żelazicyjanku potasu jako czynnika utleniającego. W wyniku
reakcji fenolu z 4–aminoantypiryną powstaje żółtoczerwony barwnik indofenolowy. Intensywność
jego brarwy zależy od zawartości fenoli w badanej próbce. Zawartość fenoli oznacza się spektrofo-
tometrycznie lub na drodze wzrokowego porównania z uprzednio przygotowanymi wzorcami. W
takich warunkach z 4- aminoantypiryną reagują: fenol, jego orto- i metapochodne oraz te parapo-
chodne, których podstawnikiem jest grupa: karboksylowa, metoksylowa, sulfonowa lub halogeno-
14

Analiza wody do picia i celów komunalnych.
wa. Nie reagują natomiast te pochodne fenolu, które w położeniu para mają grupę: alkilową, alde-
hydową, arylową, benzoilową, nitrową lub nitrozową. W oznaczeniu fenoli przeszkadzają: substan-
cje utleniające, oleje i smoły, związki siarki (S
-2
, H
2
S, SO
2
), mętność i barwa oraz jony metali two-
rzące z żelazicyjankiem barwne związki. Usuwa się je na etapie przygotowania próbki oraz w cza-
sie destylacji.
Nowelizacją standardowej wg PN metody oznaczania fenoli lotnych jest procedura zapropo-
nowana przez firmę HACH, która w oznaczeniu wykorzystuje odpowiednio zpreparowane odczyn-
niki (testy) - 4-aminoantypirynę oraz żelazicyjanek potasu. Testy te dozuje się do odmierzonej do
rozdzielacza próbki, wody uprzednio zbuforowanej roztworem o pH = 10,0 ±0,2. Powstały w reak-
cji fenolu z 4-aminoantypiryną w obecności żelazicyjanku potasu jako utleniacza barwnik indofeno-
lowy ekstrahuje się chloroformem. W zależności od ilości fenoli zawartych w wodzie wyekstraho-
wany barwnik przyjmuje kolor od jasnożółtego w przypadku niskiej zawartości fenoli do krwisto-
czerwonego w przypadku wysokiej zawartości. Intensywność zabarwienia określana jest spektro-
fometrycznie np. w spektrofotometrze DR-2000.
Oznaczanie fenoli ogólnych i substancji bromujących się w wodzie i ściekach..
Metodę tą można stosować zarówno do oznaczania zawartości w wodzie fenoli lotnych (nale-
ży wówczas przeprowadzić destylacje z parą wodną ze środowiska kwaśnego), jak i ogólnych – bez
destylacji. W metodzie tej oprócz fenoli oznacza się równocześnie substancje, które w opisanych
poniżej warunkach ulegają bromowaniu. W czasie oznaczenia do kolby stożkowej z doszlifowanym
korkiem odmierza się próbkę wody, ścieków bądź destylatu w przypadku oznaczania fenoli lotnych
(objętość uzależniona jest od stężenia fenoli) i dodaje mianowanego roztworu bromiano – bromku
potasu oraz stężonego kwasu solnego w celu uzyskania środowiska kwaśnego. Zachodzą wtedy
reakcje:
KBrO
3
+ 5KBr + 6HCl → 3Br
2
+ 6KCl + 3H
2
O
C
6
H
5
OH + 3Br
2
→ C
6
H
2
Br
3
OH + 3HBr
Zawarty w próbce fenol reaguje z wolnym bromem, którego nadmiar oznacza się jodome-
trycznie miareczkując powstały wolny jod roztworem tiosiarczanu sodowego wobec skrobi jako
wskaźnika. Odpowiednie reakcje przebiegają następująco:
Br
2
+ 2KJ → 2KBr + J
2
J
2
+ 2Na
2
S
2
O
3
→ 2NaJ + Na
2
S
4
O
6
Zawartość fenoli w badanej próbce oblicza się na podstawie różnicy w ilości bromiano –
bromku wprowadzonego do próbki i pozostałego po bromowaniu. Ilość odczynnika użytego do
bromowania ustala się przeprowadzając próbę kontrolną na wodzie destylowanej, do której dodaje
się te same ilości odczynników jak w próbie właściwej.
15

Analiza wody do picia i celów komunalnych.
16

Analiza wody do picia i celów komunalnych.
Oznaczanie zawartości w wodzie tłuszczów i olejów mineralnych
Źródłem tłuszczów i olejów mineralnych obecnych w wodzie są ścieki miejskie lub przemy-
słowe pochodzące z rzeźni, mleczarni, pralni, zakładów włókienniczych itp. Występują one w wo-
dzie jako emulsje i roztwory koloidalne. Ilość zawartych w wodzie tłuszczów i olejów określa się
najczęściej poprzez ich ekstrakcję z roztworu kwaśnego eterem naftowym, a następnie oznacza wa-
gowo po odparowaniu rozpuszczalnika i wysuszeniu ekstraktu w temperaturze 105
0
C. W tych wa-
runkach ekstrahowane są z wody: oleje mineralne, tłuszcze, mydła, woski, smary, kwasy tłuszczo-
we, smoła, ciężkie frakcje węglowodorów. Ponieważ ilość obecnych w wodzie substancji ekstrahu-
jących się eterem naftowym oznaczana jest wagowo po etapie suszenia w temperaturze 105
0
C, wy-
niki analizy nie obejmują tych substancji, które posiadają niższą od 105
0
C emperaturę wrzenia lub
wykazują w tej temperaturze wysoki stopień lotności. Niekiedy ekstrahowane związki (np. kwasy
tłuszczowe) ulegają łatwo utlenieniu dlatego podczas oznaczania powinny być skrupulatnie prze-
strzegane: czas i temperatura oznaczania. Do oznaczania zawartości tłuszczów i olejów w wodzie
stosuje się następujące metody:
• metodę bezpośredniej ekstrakcji (PN-74/C-04573),
• metodę półmikroekstrakcji,
• ekstrakcji w aparacie Soxleta.
Ważnym zagadnieniem rzutującym na jakość oznaczania tłuszczów i olejów jest sposób po-
bierania próbki wody do analizy. Próbki te należy pobierać do butelek o szerokim otworze, wcze-
śniej wypłukanych eterem naftowym. Butelek nie należy napełniać do pełna ze względu możliwość
straty tłuszczów w czasie zamykania korkiem. Butelki po wylaniu próbki należy ponownie przemyć
w celu usunięcia osadzonych tłuszczów. Jeśli oznaczenie nie może być wykonane przed upływem
24 godzin od momentu pobrania, próbkę należy utrwalić dodając kwas solny w celu osiągnięcia
pH=3.
2.2.2. Ocena zawartości substancji nieorganicznych zawartych w wodzie.
W zależności od stężeń, w jakich występują, substancje nieorganiczne rozpuszczone w wo-
dzie dzieli się na:
• składniki podstawowe, które występują w wodzie w ilości od kilkunastu do kilkuset g/m
3
,
• makroskładniki (od kilkuset mg/m
3
do kilkunastu g/m
3
),
• mikroskładniki, które występują w ilościach śladowych poniżej kilkuset mg/m
3
.
Do podstawowych składników naturalnych wód powierzchniowych zalicza się, kationy Ca
+2
,
Na
+
, Mg
+2
oraz aniony HCO
3
-
, SO
4
-2
, Cl
-
a także krzemionka. Przykładem makroskładników wystę-
17

Analiza wody do picia i celów komunalnych.
pujących w wodach powierzchniowych jest żelazo i występujący często z żelazem mangan a także
sód, potas oraz azot amonowy. Do mikroskładników zalicza się m.in. metale ciężkie.
Oznaczanie odczynu pH, kwasowość i zasadowość wody.
Oznaczanie odczynu pH wody
Odczyn wody jest istotnym wskaźnikiem składu chemicznego wody i ma duże znaczenie
techniczne w procesach uzdatniania wody, kontroli korozyjności wody w wodociągach, a przede
wszystkim dla organizmu człowieka i przebiegu procesów biochemicznych w przyrodzie. Zwykle
wody powierzchniowe posiadają pH w zakresie 6,5 – 8,5 co odpowiada wymaganiom stawianym
wodzie do picia. Zdarzają się jednak wody o mniejszych i większych wartościach pH. Wyraźnie
kwaśny odczyn wody (pH ok. 4) obserwowany jest m in. podczas „kwaśnych deszczów” i w przy-
padkach zanieczyszczenia wody kwaśnymi ściekami. Wysokie wartości pH są najczęściej wyni-
kiem zanieczyszczenia wody ściekami alkalicznymi oraz występują w wodach zeutrofizowanych,
kiedy nadmierny rozwój glonów powoduje wzrost intensywności fotosyntezy, w czasie której zu-
żywane są znaczne ilości dwutlenku węgla. W tym przypadku obserwuje się charakterystyczne wa-
hania pH w czasie doby. Na wartość pH wód wpływa rodzaj podłoża, przez które przepływają wo-
dy. Wody przepływające przez podłoże kwarcowe charakteryzują się odczynem kwaśnym, nato-
miast przepływając przez podłoże wapienne – odczyn zasadowy.
Do oznaczania odczynu wody stosuje się metodę elektrometryczną, której zasada polega na
pomiarze siły elektromotorycznej SEM ogniwa złożonego z elektrody pomiarowej i elektrody od-
niesienia zanurzonych w badanym roztworze. Zmierzony potencjał jest proporcjonalny do stężenia
jonów wodorowych – pH. Obecnie do pomiaru wskaźnika pH stosuje się najczęściej elektrodę
szklaną jako elektrodę pomiarową w zestawieniu z kalomelową elektrodą odniesienia. Przy pomia-
rze pH roztworu powyżej 10 do pomiaru stosuje elektrody specjalne. W przypadku gdy pomiar wy-
konano elektrodą szklaną należy wprowadzić poprawkę uwzględniającą tzw. błąd sodowy. Wartość
poprawki podawana jest przez producenta elektrody. Na wyniki pomiaru pH ma wpływ temperatu-
ra, w związku z czym powinien on być wykonywany w określonej temperaturze. Przed pomiarem
wskaźnika pH należy przeprowadzić kalibrację pehametru we wzorcowych roztworach buforo-
wych, które powinny być tak dobrane aby odpowiadały zakresowi pomiarowemu badanej wody.
Pomiar pH należy wykonać według instrukcji dołączonej przez producenta danego typu pehametru
zwracając szczególną uwagę na czystość używanych elektrod.
Oznaczanie kwasowości wody
Kwasowością nazywana jest zdolność wody do zobojętniania dodawanych do niej mocnych
zasad lub węglanów potasowców. Kwasowość wody powodują rozpuszczone w niej: dwutlenek
18

Analiza wody do picia i celów komunalnych.
węgla, kwasy mineralne i organiczne oraz produkty hydrolizy soli. Czynniki powodujące kwaso-
wość mogą pochodzić z: atmosfery, gleby, odczynników dodawanych w procesie jej uzdatniania i
zanieczyszczeń dostających się do wody. Jeżeli pH wody jest mniejsze od 4,6 występuje wówczas
tzw. kwasowość mineralna i woda cechuje się korozyjnym charakterem wobec metali i betonu. Ten
rodzaj kwasowości bardzo rzadko występuje w czystych wodach powierzchniowych. W zakresie
pH 4,6 – 8,3 występuje tzw. kwasowość ogólna, która współistnieje wraz zasadowością ogólną. W
wodach tych występuje równowaga między stężeniami węglanów i wodorowęglanów, które powo-
dują zasadowość a dwutlenkiem węgla wywołującym kwasowość. Mówi się wówczas o istnieniu
tzw. równowagi węglanowej:
CO
2
+ H
2
O ↔ H
2
CO
3
↔ H
+
+ HCO
3
-
↔ H
+
+ CO
3
-
Równowaga ta zostaje zachwiana gdy do wody dostają się zanieczyszczenia o charakterze
kwaśnym. Wielkość tych zanieczyszczeń można określić za pomocą miareczkowania potencjome-
trycznego, bądź metodą miareczkowania roztworem wodorotlenku sodu lub węglanu sodu wobec
odpowiedniego wskaźnika:
• fenoloftaleiny w przypadku oznaczania kwasowości ogólnej,
• oranżu metylowego w oznaczeniu kwasowości mineralnej.
Wyniki oznaczania kwasowości podaje się w mmol/dm
3
(dawniej mval/dm
3
).
Kwasowość wody do picia ma bezpośrednie znaczenie jedynie wtedy, gdy wywołana jest
przez kwasy nieorganiczne, które powodują niski odczyn wody. W tych warunkach woda może
rozpuszczać szkodliwe dla zdrowia metale. W czystych wodach naturalnych współwystępują za-
równo wodorowęglany jak i kwas węglowy, które tworzą naturalny układ buforowy. Dzięki pojem-
ności buforowej wody mogą zobojętniać pewną ilość mocnych kwasów nieorganicznych i pewną
ilość mocnych zasad nie zmieniając swojego pH. Gwałtowna zmiana pH wynikająca z zanieczysz-
czenia wody, powoduje zniszczenie układu buforowego, czego skutkiem są niekorzystne zmiany w
biocenozie wodnej.
Oznaczanie zasadowości wody
Zasadowość jest to zdolność wody do zobojętniania kwasów do określonego pH. Wywołana
jest ona obecnością w wodzie wodorowęglanów i węglanów głównie metali alkalicznych wapnia i
magnezu oraz wodorotlenków w przypadku wód o pH powyżej 8.3. W zależności od zakresu war-
tości pH wody rozróżnia się zasadowość ogólną (pH= 4,6 – 8,3) oraz zasadowość wobec fenolofta-
leiny ( pH > 8,3). Spotyka się również podział w zależności od rodzaju związku, który nadaje wo-
dzie odczyn zasadowy – zasadowość węglanowa, zasadowość wodorowęglanowa i wodorotlenowa.
Zasadowość wody z punktu widzenia oceny sanitarnej nie ma większego znaczenia, natomiast
ma istotne znaczenie w przypadku wód do celów przemysłowych i gospodarczych.
19

Analiza wody do picia i celów komunalnych.
Zasadowość wody i ścieków oznaczana jest następującymi metodami:
• miareczkowania wobec wskaźników (fenoloftaleiny, oranżu metylowego),
• miareczkowania potencjometrycznego.
Oznaczanie zasadowości metodą miareczkowania wobec wskaźników
Metoda polega na określeniu zawartości w wodzie związków zasadowych reagujących z mia-
nowanym roztworem mocnego kwasu wobec fenoloftaleiny (zasadowość wobec fenoloftaleiny –
pH = 8,3) oraz oranżu metylowego (zasadowość ogólna – pH = 4,6). Możliwe jest również wyko-
nanie oznaczenia zasadowości wobec fenoloftaleiny i wobec oranżu metylowego na jednej próbce
wody. Wówczas wykonuje się miareczkowanie wobec fenoloftaleiny do zmiany zabarwienia z ró-
żowego do momentu odbarwienia próbki, a następnie miareczkuje wobec oranżu metylowego do
zmiany zabarwienia z żółtego na pomarańczowe. Jeżeli poddawana badaniom próbka nie zabarwi
się po dodaniu do niej fenoloftaleiny świadczy to o tym, że zasadowość wobec fenoloftaleiny wy-
nosi zero. Wyniki oznaczania zasadowości podaje się w mmol/dm
3
(dawniej mval/ dm
3
). W ozna-
czaniu przeszkadzają mętność powyżej 30 mg/dm
3
, którą eliminuje się przez sączenie lub wirowa-
nie oraz barwa powyżej 50 mg Pt/dm
3
. W przypadku próbek, których barwa przekracza 50 mg
Pt/dm
3
zasadowość oznacza się potencjometrycznie.
Oznaczanie twardości wody
Twardość wody wywołują zawarte w niej jony wapnia i magnezu a także żelaza, glinu, man-
ganu oraz metali ciężkich. Ponieważ w wodzie dominują kationy wapnia i magnezu rozróżnia się
twardość wapniową i magnezową. Kationom tym towarzyszą głównie aniony węglanowy i wodo-
rowęglanowy. Mamy wówczas do czynienia z tzw. twardością węglanową (dawniej nazywana
twardością przemijającą). Obok anionów węglanowego i wodorowęglanowego występują w wodzie
aniony siarczanowy i chlorkowy, które wywołują tzw. twardość niewęglanową (dawniej nazywana
twardością stałą). Aniony te obecne są w wodzie w zdecydowanie mniejszej ilości. Suma twardości
węglanowej i niewęglanowej stanowi twardość ogólną wody. Gdy twardość ogółna jest większa od
zasadowości ogólnej to ta część twardości, która jest równa zasadowości ogólnej określana jest jako
twardość węglanowa, natomiast nadwyżka twardości w stosunku do twardości ogólnej jest twardo-
ścią niewęglanową. W przypadku, gdy twardość wody jest równa zasadowości ogólnej bądź mniej-
sza od niej to twardość ogólna składa się tylko z twardości węglanowej, a wartość twardości niewę-
glanowej wynosi zero.
Wartość twardości wody podaje się najczęściej w jednostkach: mmol/dm
3
(dawniej
mval/dm
3
), mg CaCO
3
/dm
3
lub w stopniach twardości: niemieckich, francuskich, angielskich Naj-
częściej stosowany, stopień niemiecki twardości wody (1
0
N), odpowiada stężeniu 10 mg CaO w
20
Analiza wody do picia i celów komunalnych.
1dm
3
. Przyjmując że: 1 mmol/dm
3
= 56 mg CaO można obliczyć, że 1 mmol/dm
3
= 5,6
o
N, a z kolei
1
o
N = 0,178 mmol/dm
3
. Ze względu na twardość wodę można podzielić według kryterium przed-
stawionego w tabeli1.
Z punktu widzenia higieny twardość wody ma drugorzędne znaczenie, natomiast jest niepo-
żądana ze względów gospodarczych. Ma duże znaczenie w energetyce w procesach chłodzenia i
przy zasilaniu kotłów oraz w przemyśle spożywczym.
Do oznaczania twardości stosuje się najczęściej metody:
• obliczeniową (w oparciu o wyniki oznaczeń zawartości wapnia i magnezu w wodzie),
• wersanianową.
Tabela 1.
Kryterium twardości wody
Stopnie twardości mg
CaCO
3
/dm
3
Skala twardości wody
0 – 5
5 -10
10 – 15
15 – 20
20 – 30
powyżej 30
0 – 90
90 – 180
180 – 270
270 – 360
360 – 450
powyżej 450
bardzo miękka
miękka
średniej twardości
znacznej twardości
twarda
bardzo twarda
Oznaczanie twardości metodą wersenianową
Metoda wersenianowa oznaczania twardości wody polega na kompleksometrycznym mia-
reczkowaniu próbki wody wersenianem dwusodowym wobec barwnika czerni eriochromowej T w
środowisku alkalicznym (pH=10,0). Barwnik ten tworzy z kationami wapnia i magnezu związki
kompleksowe o zabarwieniu czerwonym. Ponieważ związki te są mniej trwałe niż związki wapnia i
magnezu z wersenianem, w trakcie miareczkowania jony wapnia i magnezu uwalniają czerń, co
prowadzi do zmiany zabarwienia roztworu z czerwonej na niebieską. W oznaczeniu przeszkadzają
jony: baru, cynku, glinu, kadmu, kobaltu, manganu, miedzi, niklu, ołowiu, strontu, żelaza oraz wy-
soka mętność i znaczna ilość substancji organicznych. Wpływ większości z wymienionych jonów,
przeszkadzający w oznaczaniu twardości, eliminuje się poprzez stosowanie odczynników maskują-
cych powstające w reakcji z wersenianem sodu związki kompleksowe. Odczynnikami tymi są roz-
twory siarczku sodu oraz chlorowodorku hydroksylaminy NH
2
- OH · HCl. Jedynie tylko jony
strontu i baru to oznaczane są one jako składniki twardości wody.
21
Odmianą metody wersenianowej jest procedura opracowana przez firmę HACH, w której do
oznaczania twardości stosuje się metodę spektrofotometryczną.

Analiza wody do picia i celów komunalnych.
Oznaczanie zawrtości azotu: amonowego, azotynowego i azotanowego w wodzie.
Najczęściej występującymi w wodzie nieorganicznymi związkami azotu są: azot amonowy
(NH
4
+
), azot azotynowy (NO
2
-
), azot azotanowy (NO
3
). Sole azotanowe i amonowe są wykorzy-
stywane przez rośliny w procesie asymilacji, który można zapisać w sposób uproszczony:
NO
3
-
+ 2H
2
→ NH
3
+ O
2
+ OH
-
NH
3
+ CO
2
+ chlorofil + światło słoneczne → białko
Białko roślinne jak i pochodzenia zwierzęcego jest ważnym źródłem azotu amonowego, który
trafia do wody. Woda do picia i celów gospodarczych nie może zawierać azotu amonowego pocho-
dzenia zwierzęcego. Sygnałem obecności azotu pochodzenia zwierzęcego w wodzie jest współo-
becność z nim znacznych ilości chlorków, bakterii, związków organicznych mierzonych jako utle-
nialność oraz substancji opalizujących. Azot amonowy powstały w wyniku rozkładu białek (rów-
nież mocznika) może być powtórnie wykorzystany w procesie asymilacji, a w warunkach tleno-
wych i przy udziale bakterii nitryfikujących może ulegać utlenieniu do azotynów, a następnie do
azotynów. Proces nitryfikacji można w uproszczony sposób zapisać w postaci:
NH
4
+
+ 3/2 O
2
NO
→
Bakterie
→
Bakterie
2
-
+ 2H
2
+ H
2
O
+
energia
(1)
NO
2
-
+ ½ O
2
NO
3
-
+ energia
(2)
Dlatego w przypadku obecności w wodzie azotu amonowego i braku obecności azotu azoty-
nowego może świadczyć o „świeżym” zanieczyszczeniu wody związkami organicznymi np. ście-
kami bytowo – gospodarczymi. Jeżeli woda zawiera amoniak i azotyny, które powstają wyniku
rozkładu amoniaku wg reakcji /1/ świadczyć to może o tym, że od chwili zanieczyszczenia wody
upłynął już jakiś czas. W przypadku, gdy w wodzie obecne są tylko azotany to zanieczyszczenie
wody nastąpiło na tyle dawno, że zaszły procesy samooczyszczenia wody.
Jednym ze źródeł azotynów i azotanów w wodzie jest proces nitryfikacji. Jeżeli w wodzie wy-
stępuje niedobór tlenu jony azotanowe mogą być redukowane do azotynów a następnie do azotu
wolnego. Proces ten zwany denitryfikacją zachodzi najczęściej warstwach przydennych oraz w osa-
dach dennych przy udziale bakterii denitryfikujących.
Bardzo częstym źródłem związków azotowych w wodzie są spływy z terenów rolniczych,
które były nawożone nawozami azotowymi zarówno mineralnymi, jak i naturalnymi.
Źródłem amoniaku mogą być również ścieki przemysłowe np. koksownicze.
Oznaczanie zawartości azotu amonowego w wodzie
Oznaczenie zawartości amoniaku w wodzie powinno być przeprowadzone bezpośrednio po
pobraniu próbki. Amoniak oznacza się następującymi metodami:
22

Analiza wody do picia i celów komunalnych.
• bezpośredniej nessleryzacji, którą stosuje się w przypadku wysokiej zawartości amoniaku
w wodzie,
• destylacyjną, gdy w wodzie występuje duża ilość substancji przeszkadzających w ozna-
czeniu kolorymetrycznym,
• kolorymetryczną z salicylianem sodu i podchlorynem,
• potencjometryczą.
Metoda kolorymetrytczna z salicylianema i podchlorynem
Metoda jest oparta na reakcji zachodzącej między jonami amonowymi, salicylowymi i pod-
chlorynowymi, w wyniku której tworzy się barwny związek kompleksowy. Intensywność zabar-
wienia badanej próbki, analizowana spektrofotometrycznie, jest proporcjonalna do ilości jonów
amonowych w zawartych próbce. Źródłem jonów podchlorynowych uczestniczących w reakcji jest
hydroliza dwuchlorocyjanuranu sodu przebiegająca w środowisku alkalicznym (pH = 12,6). Reak-
cja dwuchlorocyjanuranu z salicylianem sodu i amoniakiem zachodzi w obecności nitroprusydku
sodu.
Metoda destylacyjna oznaczania azotu amonowego
Wśród metod oznaczania zawartości amoniaku w wodzie na szczególną uwagę zasługuje me-
toda destylacyjna. Stosuje się ją najczęściej w przypadkach gdy analizowana woda zawiera zanie-
czyszczenia przeszkadzające w oznaczaniu amoniaku innymi metodami. Metoda ta polega na odde-
stylowaniu amoniaku z próbki wody o odczynie słabo alkalicznym i oznaczeniu amoniaku w desty-
lacie metodą kolorymetryczną lub poprzez miareczkowanie. Wykorzystując metodę miareczkową
amoniak oddestylowany z próbki wiązany jest za pomocą mianowanego roztworu kwasu, którego
nadmiar jest miareczkowany roztworem wodorotlenku.
Oznaczanie zawartości azotu azotynowego w wodzie
Azotyny zawarte w wodzie są produktem nietrwałym, łatwo przechodzącym w azotany lub w
amoniak i dlatego w ich oznaczaniu czynnikiem bardzo istotnym jest czas. Zawartość azotynów w
wodzie oznacza się najczęściej kolorymetrycznie. Metoda ta polega na reakcji azotynów z kwasem
sulfanilowym w środowisku kwaśnym (pH 2,0-2,5), w czasie której tworzy się dwuazozwiązek,
który łączy się następnie z α-naftyloaminą daje azobarwnik o zabarwieniu czerwono fioletowym.
Intensywność tego zabarwienia świadczy o zawartości azotynów w wodzie. W oznaczeniu prze-
szkadzają: barwa, jony żelaza występujące w większych stężeniach oraz chlor.
Oznaczenie azotu azotanowego w wodzie.
23
Ze względu na reakcje utleniania i redukcji jakim podlegają związki azotowe obecne w wo-
dzie oznaczenie azotanów powinno być wykonane bezpośrednio po pobraniu próbki . Do oznacza-
nia stosuje się następujące metody:

Analiza wody do picia i celów komunalnych.
• metoda kolorymetryczna z salicylanem sodu,
• metoda kolorymetryczna z p-fluorofenolem,
• kolorymetryczna metoda redukcyjna.
Metoda kolorymetryczna z salicylanem sodu oznaczania azotanów
W środowisku kwaśnym jony azotanowe reagują z salicylanem sodu. W wyniku tej
reakcji powstaje mieszanina kwasów 3- nitrosalicylowego i 5- nitrosalicylowego. Powstałe po do-
daniu alkalicznego roztworu winianu sodu i potasu sole tych kwasów mają żółte zabarwienie, któ-
rego intensywność mierzona jest spektrofotometrycznie.
Oznaczanie azotanów kolorymetryczną metodą redukcyjną
W metodzie tej azot azotanowy jest przeprowadzany na drodze redukcji przy pomocy kadmu
w azot azotynowy. Otrzymany azot azotynowy i pierwotnie obecny w próbce poddaje się reakcji
dwuazowania z sulfanilamidem i sprzęgania z N- (1-naftylo)-etylenodiaminą. W wyniku tych reak-
cji powstaje barwnik azowy, którego intensywność koreluje ze stężeniem azotynów w badanej
próbce. Na podstawie tak oznaczonej sumy azotanów i azotynów po odjęciu pierwotnej, oznaczonej
oddzielnie, zawartości azotynów w próbce można ustalić stężenie azotu azotanowego w badanej
wodzie.
Oznaczanie zawartości żelaza w wodzie
Żelazo występuje w wodzie w postaci jonów Fe
+2
i Fe
+3
. W wodach powierzchniowych wy-
stępuje najczęściej jako wodorotlenek Fe(OH)
3
, a w wodach z terenów bagiennych i leśnych może
być obecne w połączeniach ze związkami humusowymi. Jeżeli wody były zanieczyszczone ścieka-
mi fosforowymi, żelazo może być również obecne w postaci fosforanów. W warstwach przyden-
nych głębokich zbiorników wodnych w warunkach ograniczonej zawartości tlenu występuje żelazo
dwuwartościowe. Żelazo może być obecne wodzie w formie rozpuszczonej, koloidalnej lub jako
zawiesina. Pochodzić może z gruntu, ze ścieków, wód kopalnianych oraz z korozji rur i zbiorników.
Zwykle w powierzchniowych wodach naturalnych stężenie żelaza nie przekracza kilku mg/dm
3
i
jest go znacznie mniej niż w wodach podziemnych. Duża zawartość żelaza w wodzie (powyżej 0,5
mg/dm
3
) jest niepożądana, gdyż pogarsza ono właściwości organoleptyczne wody. W prawdzie
żelazo jest organizmowi ludzkiemu niezbędne (składnik krwi) jednak wydalanie żelaza z organizmu
jest niewielkie i wskutek tego jego zapasy wystarczają na dłuższy czas.
Żelazo ogólne w wodzie oznacza się metodami: rodankową i z fenantroliną oraz instrumen-
talnie.
Metoda rodankowa oznaczania żelaza ogólnego
24

Analiza wody do picia i celów komunalnych.
Metoda ta polega na reakcji jonów żelaza Fe
+3
z roztworem rodanku potasowego lub amo-
nowego w środowisku kwaśnym wyniku czego powstaje krwistoczerwone zabarwienie, którego
intensywność jest proporcjonalna do zawartości żelaza w badanej próbce. W celu oznaczenia za-
wartości żelaza ogólnego należy przed dodaniem rodanku przeprowadzić utlenianie żelaza dwuwar-
tościowego w formę trójwartościową. W oznaczeniu przeszkadzają obecne w wodzie fluorki i fos-
forany, które tworzą z żelazem związki kompleksowe oraz srebro, kadm, rtęć i antymon tworzące
kompleksy z rodankiem. Czynnikami przeszkadzającymi są również barwa i mętność.
Metoda kolorymetryczna z fenantroliną oznaczania żelaza ogólnego
W metodzie tej zawarte w wodzie żelazo trójwartościowe redukuje się do żelaza (II) za po-
mocą hydroksyloaminy a następnie poddaje reakcji z 1,10- fenantroliną. W zakresie pH 2,9 – 9,0
powstaje różowopomarańczowy związek, którego zabarwienie jest proporcjonalne do stężenia żela-
za (II) w wodzie. Ponieważ najintensywniejsze zabarwienie otrzymuje się przy pH = 2,9 – 3,5, dla-
tego oznaczenie należy wykonać przy takim odczynie. W oznaczeniu przeszkadzają obecne więk-
szych stężeniach związki tworzące z fenantroliną osad, substancje organiczne i utleniające oraz
barwa wody.
Oznaczanie zawartości chromu
Związki chromu w wodach naturalnych podziemnych występują rzadko. Natomiast w wodach
powierzchniowych źródłem związków chromu są ścieki przemysłowe z garbarni, galwanizerni,
zakładów chemicznych. Chrom może występować w wodzie w postaci chromu(III) i chromu (VI).
Chrom trójwartościowy jest formą trwałą i w zwykłych warunkach nie utlenia się do chromu (VI).
W środowisku obojętnym sole chromu (III) są częściowo zhydrolizowane, w środowisku alkalicz-
nym wytrącają się w postaci wodorotlenku. Chrom (VI) w środowisku alkalicznym może występo-
wać jako jon chromianowy w kwaśnym jako dwuchromianowy. W środowisku nie zawierającym
związków redukcyjnych chrom(VI) jest trwały, w obecności substancji redukcyjnych redukuje się
do chromu (III). Związki chromu (VI) są rakotwórcze.
Do oznaczania chromu stosowane są następujące metody:
• miareczkowa jodometryczna,
• kolorymetryczną z dwufenylokarbazydem.
Metoda kolorymetryczna z dwufenylokarbazydem oznaczania chromu (VI)
Dwufenylokarbazyd reaguje w środowisku kwaśnym z jonami chromu(VI), tworząc związek
o czerwonofioletowym zabarwieniu. Intensywność tego zabarwienia jest proporcjonalna do zawar-
tości chromu(VI) w badanej próbce. W oznaczeniu przeszkadza żelazo i wanad oraz związki rtęci
(I) i rtęci(II).
25

Analiza wody do picia i celów komunalnych.
2.2.3. Oznaczanie zawartości gazów rozpuszczonych w wodzie
Najczęściej spotykanymi gazami rozpuszczonymi w wodzie są: azot, tlen, dwutlenek węgla,
rzadziej siarkowodór i metan. W wodach powierzchniowych gazy rozpuszczone pochodzą z atmos-
fery oraz z rozkładu zanieczyszczeń obecnych w wodzie i osadach dennych. Rozpuszczalność w
wodzie gazów jest funkcją temperatury, ciśnienia parcjalnego gazu nad wodą oraz zależy od stopnia
mineralizacji wody. W wodzie naturalnej najwięcej rozpuszczonego jest gazowego azotu. Wpływa
na to głównie jego wysokie ciśnienie parcjalne nad powierzchnią wody. Jest ono większe od tlenu i
pomimo tego, że rozpuszczalność tlenu w wodzie jest większa to ilość gazowego azotu rozpuszczo-
nego w wodzie jest większa. Dwutlenek węgla w wodach powierzchniowych powstaje z rozkładu
związków organicznych, wietrzenia i wymywania skał węglanowych. Ponieważ dwutlenek węgla w
wodach powierzchniowych występuje w ilościach większych niż wymaga tego stan równowagi
rzadko jest pochłaniany z atmosfery. W formie rozpuszczonej dwutlenek węgla występuje w wo-
dzie przy pH< 4,5. W wodach naturalnych dwutlenek węgla występuje głównie w formie węglanów
i wodorowęglanów, a wody te charakteryzuje stan równowagi węglanowowapniowej.
Tlen rozpuszczony w wodzie powierzchniowej pochodzi głównie z powietrza oraz z proce-
sów fotosyntezy, które zachodzą w środowisku wodnym. Ilość tlenu pochodzącego z fotosyntezy
jest zdecydowanie mniejsza od tlenu z atmosfery i nie przekracza zwykle 1g O
2
/m
3
·doba. Wartość
ta wzrasta w przypadku większych zakwitów glonów. Natomiast szybkość poboru tlenu z atmosfery
zależy od:
• deficytu tlenu w wodzie,
• wielkość powierzchni wody kontaktującej się z atmosferą (zależy od szybkości przepływu
wody, jej turbulencji i falowania),
• temperatury,
• ciśnienia atmosferycznego.
Stężenie tlenu rozpuszczonego w wodzie zależy również od poziomu zanieczyszczenia wód
związkami zredukowanymi. Często zamiast zawartości tlenu w wodzie podawany jest stopień nasy-
cenia wody tlenem, który jest stosunkiem tlenu rozpuszczonego w wodzie do maksymalnej jego
zawartości w wodzie destylowanej w danej temperaturze i przy ciśnieniu normalnym. Stopień nasy-
cenia tlenem może być parametrem oceniającym poziom zanieczyszczenia wód powierzchniowych.
Dla wód czystych procent nasycenia tlenem wynosi prawie 100%, nieznacznie zanieczyszczonych
80-95, wyraźnie zanieczyszczonych 40-50, a w wodach bardzo zanieczyszczonych pojawia się de-
ficyt tlenowy. Braki tlenu mogą występować również w warstwach przydennych w głębokich jezior
26

Analiza wody do picia i celów komunalnych.
i zbiorników zaporowych. Możliwe są również przypadki przesycenia wody tlenem powyżej 100%.
Zjawisko to obserwowane jest w płytkich i silnie nasłonecznionych wodach, w których intensywnie
przebiegają procesy fotosyntezy. Zmienność stopnia nasycenia tlenem wywołaną różną intensyw-
nością procesów biologicznych zachodzących w wodzie obserwuje się zarówno w ciągu roku, jak
również w ciągu dnia. Poza fotosyntezą na ilość tlenu zawartego w wodzie mogą mieć również
wpływ procesy chemoautotroficzne, w których tlen zużywany jest przez organizmy wytwarzające
substancje organiczne z substratów nieorganicznych.
Do oznaczania tlenu rozpuszczonego w wodzie stosuje się metody:
• miareczkową Winklera, która posiada szereg modyfikacji,
• metody elektrochemiczne z zastosowaniem czujników membranowych (stosowane w ba-
daniach terenowych wody).
Oznaczanie tlenu rozpuszczonego metodą Winklera
W metodzie Winklera oznaczania zawartości tlenu rozpuszczonego w wodzie wyróżnić moż-
na dwa etapy. W pierwszym zawarty w próbce tlen utlenia mangan (II) w wodorotlenku manganu
do manganu (IV). W drugim etapie, po zakwaszeniu roztworu kwasem siarkowym, następuje re-
dukcja manganu(IV) do manganu(II) za pomocą jodku potasu. Wydzielający się wolny jod w ilości
równoważnej ilości tlenu rozpuszczonego w próbce jest miareczkowany roztworem tiosiarczanu
sodowego.
W opracowanej przez firmę HACH do oznaczenia tlenu rozpuszczonego używa się specjal-
nych ampułek próżniowych z gotowymi reagentami, które wchodzą w reakcje z wodą zassaną po
złamaniu kapilarnej szyjki ampułki zanurzonej w badanej wodzie.
Oznaczanie zawartości chloru pozostałego
W wodach naturalnych chlor nie występuje, a jego obecność w wodzie związana jest z proce-
sem chlorowania wody. Operacja uzdatniania wody do celów gospodarczych ma na celu jej dezyn-
fekcję oraz dodatkowo poprawienie różnych jej cech. Używany do dezynfekcji chlor może być po-
dawany do wody w formie chloru gazowego, wody chlorowej, podchlorynów i innych związków
chloru. Pozostały w wodzie może występować jako chlor użyteczny wolny w postaci kwasu pod-
chlorawego (HClO), anionu kwasu podchlorawego (ClO
-
), chloru molekularnego (Cl
2
) lub ich mie-
szaniny oraz jako chlor użyteczny związany w formie chloroamin i innych związków chlorowych.
Suma chloru użytecznego wolnego i związanego stanowi tzw. chlor ogólny.
Przebieg chlorowania można zapisać następująco:
H
2
O + Cl
2
→ HOCl + Cl
2
27

Analiza wody do picia i celów komunalnych.
Powstały kwas podchlorawy działa jako wolny chlor użyteczny. Jako słaby kwas dysocjuje
zgodnie z reakcją, która jest reakcją odwracalną:
HOCl ↔ H
+
+ OCl
_
Chlor może łączyć się z niektórymi związkami azotowymi tworząc chloroaminy:
NH
3
+ Cl
2
→ NH
2
Cl (jednochloroamina)
NH
3
+ 2Cl
2
→ NHCl
2
+ 2 HCl (dwuchloroamina),
Chloroaminy ulegają hydrolizie i działają bakteriobójczo. Działanie wolnego chloru użytecz-
nego jest znacznie intensywniejsze od chloru użytecznego związanego.
Do oznaczania chloru pozostałego w wodzie stosowane są następujące metody:
• metoda jodometryczna (miareczkowa),
• metoda miareczkowa DFD (dietyloparafenylenodiaminą),
• metoda kolorymetryczna z leukofioletem krystalicznym,
• metoda kolorymetryczna ortolidynowa lub ortolidynowo – arsenianowa.
Metoda jodometryczna oznaczania chloru pozostałego
Metoda ta polega na wydzieleniu przez chlor zawarty w wodzie wolnego jodu z jodku potasu
(pH 3 – 4). Ilość wydzielonego jodu miareczkuje się za pomocą roztworu tiosiarczanu sodowego
wobec skrobi jako wskaźnika. Odczyn kwaśny uzyskuje się dodając roztwór kwasu octowego lub
jeśli nie ma czynników przeszkadzających (jony Fe
+3
, Mn
+4
, NO
2
-
) może być stosowany kwas siar-
kowy.
Metoda DFD oznaczania chloru pozostałego
W metodzie tej zawarty w wodzie chlor reaguje z DFD (dietyloparafenylenodiaminą) tworząc
barwny związek – merichinon (kolor czerwony). Stężenie barwnika w badanej próbce jest propor-
cjonalne do zawartości chloru, którą oznacza się miareczkując próbkę roztworem soli
Mohra (siar-
czan żelaza II i amonu – Fe(NH
4
)
2
SO
4
· 6H
2
O) do zaniku zabarwienia. Ilość chloru można też ozna-
czać spektrofotometrycznie wykorzystując związek pomiędzy intensywnością zabarwienia próbki a
stężeniem chloru (procedura HACH).
28

Analiza wody do picia i celów komunalnych.
WYKONANIE ĆWICZENIA
Cel ćwiczenia: Celem ćwiczenia jest zapoznanie się z wymaganiami jakie powinna spełniać
woda przeznaczona do picia i do celów gospodarczych, poznanie metod oceny jej jakości, przepro-
wadzenie badań wybranych właściwości fizykochemicznych wody z prawidłowym zaplanowaniem
kolejności ich wykonania.
Zadania do wykonania:
1)
Pobranie wody w ilości umożliwiającej wykonanie wymaganych analiz – miejsce
poboru kran lub woda dostarczona przez zainteresowanych.
2)
Oznaczenie temperatury i pH wody.
3)
Oznaczenie barwy wody i zapachu wody metodą organoleptyczną,
4) Oznaczenie
ChZT
wody
metodą dwuchromianową (spektrofotometrycznie).
5) Oznaczenie
twardości wody.
6) Oznaczenie
zawartości tlenu rozpuszczonego w wodzie.
7)
Oznaczenie azotu amonowego, azotanowego i azotynowego w wodzie.
8) Oznaczenie
zawartości żelaza ogólnego w wodzie.
9) Oznaczenie
zawartości chloru pozostałego (ogólnego).
10) Oznaczanie
zawartości chromu(VI) w wodzie.
Uwaga: Badania należy wykonać w oparciu o procedury opracowane przez HACH Company
znajdujące się w laboratorium.
LITERATURA
1. Kowal
A.,
Świderska Bróż - Oczyszczanie wody, Wyd. Naukowe PWN, Wrocław,
1998.
2.
Hermanowicz W. i inni – Fizykochemiczne badanie wody i ścieków, „Arkady”, War-
szawa, 1999.
3.
Gajkowska – Stefańska L. i inni – Laboratoryjne badania wody, ścieków i osadów
ściekowych, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1997 .
29
Document Outline
- 1. Wymagania stawiane wodzie do picia i na potrzeby gospodarcze
- 2. Wybrane parametry oceny przydatnoœci wody do p
- 2.1. Badania fizyczne wody
- 2.2 Badania chemiczne wody
- 2.2.1. Ocena zawartoœci substancji organicznych w
- Oznaczenie BZT5 metod¹ bezpoœredni¹ i metod¹ ro
- Chemiczne zapotrzebowanie tlenu ChZT
- UtlenialnoϾ wody
- WskaŸnik ChZT wody oznaczony metod¹ dwuchromiano
- Oznaczanie zawartoœci ogólnego wêgla organiczneg
- Oznaczanie zawartoœci fenoli w wodzie
- Oznaczanie fenoli lotnych metod¹ kolorymetryczn¹
- Oznaczanie fenoli ogólnych i substancji bromuj¹c
- Oznaczanie zawartoœci w wodzie t³uszczów i olej
- 2.2.2. Ocena zawartoœci substancji nieorganicznyc
- Oznaczanie odczynu pH, kwasowoϾ i zasadowoϾ wo
- Oznaczanie odczynu pH wody
- Oznaczanie kwasowoœci wody
- Oznaczanie zasadowoœci wody
- Oznaczanie zasadowoœci metod¹ miareczkowania wob
- Oznaczanie twardoœci wody
- Oznaczanie twardoœci metod¹ wersenianow¹
- Oznaczanie zawrtoœci azotu: amonowego, azotynoweg
- Oznaczanie zawartoœci azotu amonowego w wodzie
- Oznaczanie zawartoœci azotu azotynowego w wodzie
- Oznaczenie azotu azotanowego w wodzie.
- Oznaczanie zawartoœci ¿elaza w wodzie
- Oznaczanie zawartoœci chromu
- 2.2.3. Oznaczanie zawartoœci gazów rozpuszczonyc
- WYKONANIE ÆWICZENIA
- LITERATURA
Wyszukiwarka
Podobne podstrony:
2 Analiza?kteriologiczna wody do?lów sanitarnych 2
Niedobór wody do picia, zatrucie solą kuchenną bydło
NADZÓR NAD JAKOŚCIĄ WODY DO PICIA
Wykorzystanie technik membranowych w uzdatnianiu wody do picia, technologia membranowa
2 Analiza?kteriologiczna wody do?lów sanitarnych 1
BRAK WODY DO PICIA
NADZÓR NAD JAKOŚCIĄ WODY DO PICIA
Kubek wody do picia
2. Analiza bakteriologiczna wody do celów sanitarnych - 4, 2. Analiza bakteriologiczna wody do celów
2. Analiza bakteriologiczna wody do celów sanitarnych - 3, 2. Analiza bakteriologiczna wody do celów
MIKROBIOLOGIA laboratorium 8 Analiza mikrobiologiczna wody do celów sanitarnych, Studia, OŚ, Mikrobi
FIZYKOCHEMIA, teoria do 33, Wykonywane są dwa rodzaje analiz wody:
więcej podobnych podstron