
A L K I N Y
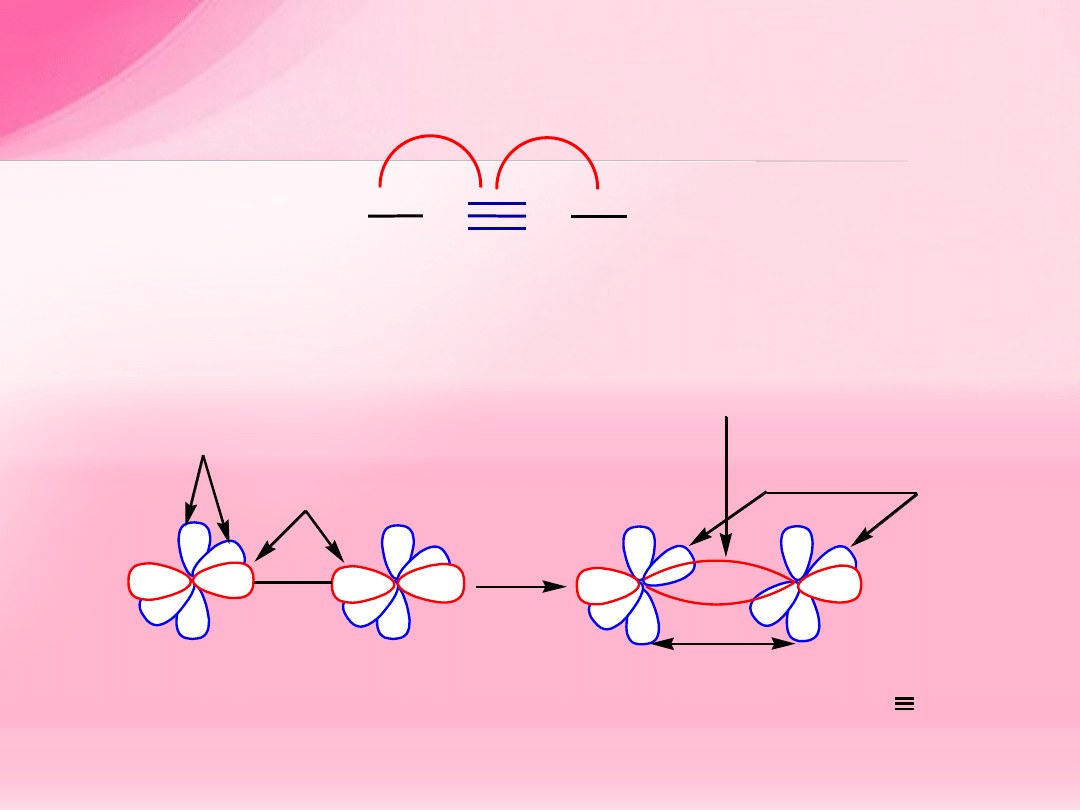
C
C
R
R
R
=
H; alkil; aryl
180
o
180
o
sp
sp
orbitale
sp
orbitale
p
wi
ązanie
(p-p)
wi
ązanie
(p-p)
wi
ązanie
(sp-sp)
orbitale atomowe C
o hybrydyzacji
sp
orbitale cz
ąsteczkowe wiązania C C
Nomenklatura
Nazwy alkinów tworzy się przez dodanie do nazwy węglowodoru
macierzystego końcówki
yn
lub
in
i umieszczenie lokantu przed
końcówką, np. hept-2-yn, pent-3-yn.
(CH
3
)
3
CC
CH
3,3-dimetylobut-1-yn
HC
CH
etyn
acetylen
C
CH
fenyloetyn
fenyloacetylen
C
CCH
3
1-propynylocykloheks-1-en
Nazwy odpowiednich reszt organicznych:
CH-CH
CH
2
5-allilocyklopentano-1,3-dien
H
CH
2
CH-CH
2
pent-4-en-1-yn
(3-winyloprop-1-yn)
C
CH
-C
CH
-CH CH
2
winyl
etynyl
-CH
2
-CH CH
2
allil
C
CH
etynylocyklopropan
cyklopropyloetyn

Otrzymywanie alkinów
1. Etyn można otrzymać przez hydrolizę węglika wapnia (karbidu):
2. Przemysłowa metoda otrzymywania etynu – piroliza lekkich
węglowodorów (głównie metanu):
1500
o
C
HC
CH
etyn
3H
2
+
2CH
4
377 kJ
+
reakcja
endotermiczna
HC
CH
tlenek
wapnia
etyn
CaO + 3C
1800 - 2100
o
C
CaC
2
+ CO
węglik
wapnia
tlenek
w
ęgla
CaC
2
+
2H
2
O
Ca(OH)
2
+
wodorotlenek
wapnia

3. Eliminacja halogenowodorów za pomocą zasad z wicinalnych
lub geminalnych dihalogenoalkanów:
CHCH
2
CHBr
2
(CH
3
)
2
1. NaNH
2
, NH
3
CHC
(CH
3
)
2
CH
1,1-dichloro-2-metylobutan
2-metylobut-1-yn
2. H
2
O
2. H
2
O
C
CH
1,2
-dibromobutan
CH
3
CH
2
1. NaNH
2
, NH
3
CH
3
CH
2
CHCH
2
Br
Br
but-1-yn
2. H
2
O
C
CH
1,1
-dichlorobutan
CH
3
CH
2
1. NaNH
2
, NH
3
CH
3
CH
2
CH
2
CHCl
2
but-1-yn

Addycja (A
E
)
halogenowodorów
Właściwości chemiczne alkinów
RC
CR'
alkin
H
X
H
X
RCH
CR'
X
RCH
2
CR'
X
X
pent-2-yn
CH
3
CH
2
C
CCH
3
2
H
F
2,2-difluoropentan
CH
3
CH
2
C
H
2
CCH
3
F
F

Addycja
HX
do alkinów jest procesem regioselektywnym,
w środowisku kwaśnym powstaje produkt zgodnie
z regułą Markownikowa. Addycja pierwszej cząsteczki HX
następuje w sposób
trans-
(anion
X
-
przyłącza się po
przeciwnej stronie płaszczyzny wiązania C=C w stosunku
do przyłączonego wcześniej atomu wodoru
H
).
hept-3-yn
CH
3
CH
2
C
CCH
2
CH
2
CH
3
H
Cl
AcOH
C
C
Cl
CH
3
CH
2
CH
2
CH
2
CH
3
H
cis-3-chlorohept-3-en

Addycja
HBr
w obecności nadtlenków biegnie mechanizmem
rodnikowym i powstaje produkt niezgodnie
z regułą Markownikowa.
but-1-yn
CH
3
CH
2
C
CH
H
Br
nadtlenki
1-bromobut-1-en
CH
3
CH
2
C
H
CH
Br
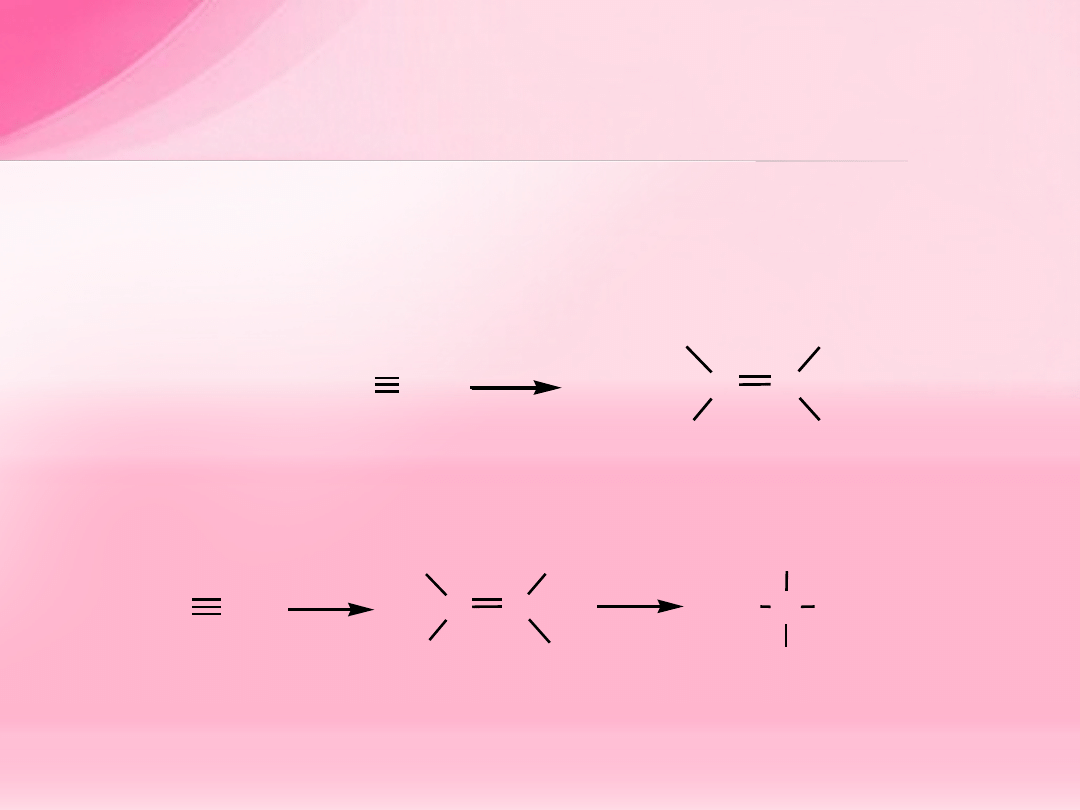
Addycja halogenu
pent-1-yn
CH
3
CH
2
CH
2
C
CH
Br
2
CCl
4
C
C
Br
CH
3
CH
2
CH
3
Br
trans-2,3-dibromopent-2-en
Addycja jednego ekwiwalentu
X
2
(X = Cl, Br) daje
trans
dihalogenoalken. Addycja drugiej cząsteczki
X
2
prowadzi do
tetrahalogenoalkanu.
prop-1-yn
CH
3
C
CH
Cl
2
CCl
4
C
C
Cl
CH
3
H
Cl
trans-1,2-dichloroprop-1-en
Cl
2
CCl
4
C CH
Cl
2
Cl
CH
3
1,1,2,2-tetrachloropropan
Cl

Kwas, w którym proton odrywany jest od atomu
węgla nazywa się
C-kwasem
(np.terminalny alkin jest
przykładem
C-kwasu
).
O-Kwasy
–
H
2
SO
4
, HNO
3
, H
3
PO
4
, RSO
3
H
N
-Kwasy –
NH
3
(amidek sodu
NH
2
Na
jest solą,
która powstała ze słabego kwasu
NH
3
.
Sole, które się tworzą ze słabych kwasów są
silnymi zasadami,
np. amidek sodu jest silną zasadą.
Silniejszy kwas wypiera słabszy z jego soli, dlatego
alkiny
(pKa=26) wypierają NH
3
z amidków
(pKa NH
3
=35).

Kwasowość terminalnych alkinów
C
C
R
H
+
NH
2
-
Na
+
C
C
R
Na
+
+
acetylenek sodu
NH
3
amidek sodu
etyn
alkin
HC
CH
eten
alken
CH
2
CH
2
etan
alkan
CH
3
CH
3
NH
3
amoniak
pKa = 26
pKa = 35
pKa = 45
pKa = 62
wzrost kwasowo
ści

Alkilowanie anionu acetylenkowego
Acetylenki są silnymi zasadami i dobrymi odczynnikami nukleofilowymi.
Ulegają one alkilowaniu, np. halogenkami alkilowymi, w wyniku czego
otrzymujemy węglowodory o przedłużonym łańcuchu węglowym.
Reakcja biegnie mechanizmem
S
N
2
dlatego acetylenki
ulegają alkilowaniu tylko halogenkami 1
o
, metylu, allilu i benzylu.
C
C
(CH
3
)
3
C
H
+
NH
2
-
Na
+
Na
+
+
3,3-dimetylobut-1-yn
NH
3
amidek sodu
S
N
2
C
C
(CH
3
)
3
C
CH
3
I
C
C
(CH
3
)
3
C
CH
3
4,4-dimetylopent-2-yn

pent-1-yn
CH
3
CH
2
CH
2
C
CH
NaNH
2
, NH
3
CH
3
CH
2
Br
hept-3-yn
CH
3
CH
2
CH
2
C
CCH
2
CH
3
S
N
2
CH
3
CH
2
CH
2
C
C
-
Na
+
acetylen
etyn
HC
CH
NaNH
2
, NH
3
acetylenek sodu
etynek sodu
HC
C
-
Na
+
CH
3
CH
2
CH
2
Br
S
N
2
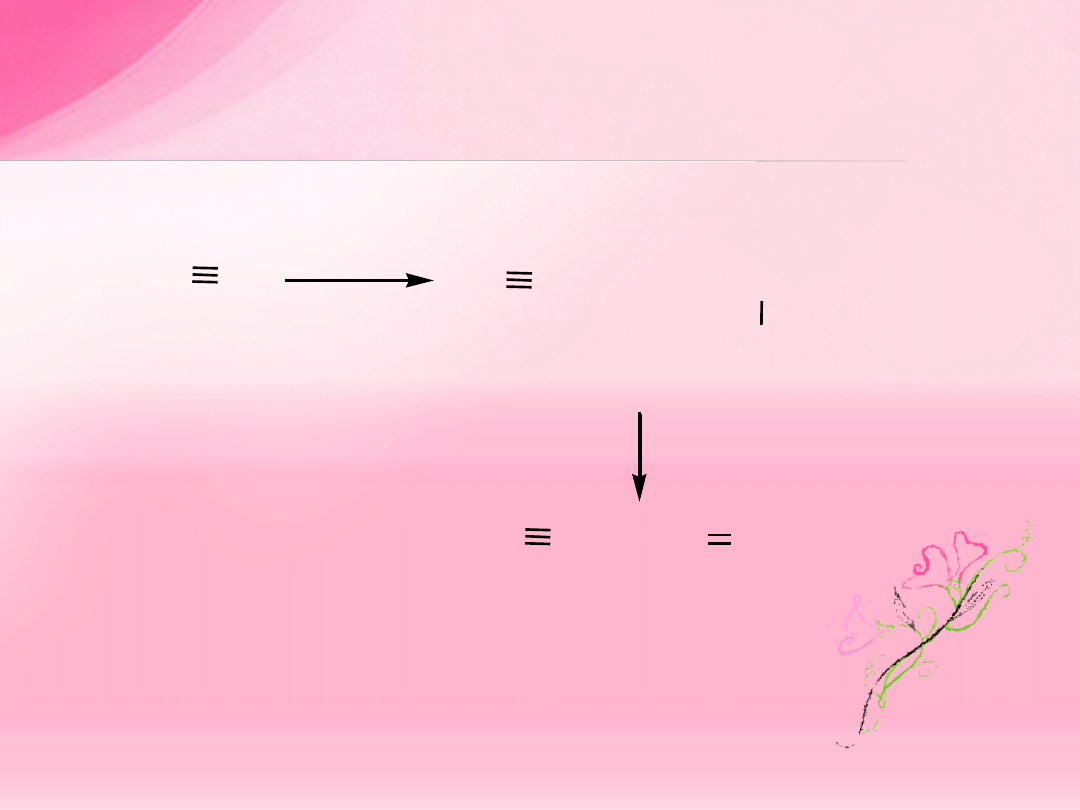
Acetylenki z halogenkami 2
o
dają produkt eliminacji.
acetylen
HC
CH
NaNH
2
, NH
3
bromek izopropylu
HC
C
-
Na
+
+
CH
3
CHCH
3
Br
E2
acetylen
HC
CH
+
prop-1-en
CH
2
CHCH
3
Kwasowo-katalizowana addycja wody
CH
3
CH
2
C
CH
H
2
O, H
+
Hg
2+
CH
3
CH
2
C CH
3
O
CH
3
CH
2
C CH
2
OH
Enol
– związek organiczny zawierający przy C=C (
en
) grupę OH (
ol
):
en + ol =
enol
Enole
są zwykle nietrwałe i w procesie tautomeryzacji (przeniesienia atomu
H z O na C) ulegają przekształceniu w związki karbonylowe.
Symbol tautomerii:
C
CH
R
H
2
O, H
2
SO
4
HgSO
4
C CH
3
R
O
C
CH
2
R
OH
enol
forma karbonylowa
C
CH
R
H
2
O, H
2
SO
4
HgSO
4
C CH
3
R
O
C
CH
2
R
OH
enol
keton metylowy
C
C
R
H
2
O, H
2
SO
4
HgSO
4
R'
C R'
RCH
2
O
mieszanina ketonów
+
C CH
2
R'
R
O
C
C
H
H
2
O, H
2
SO
4
HgSO
4
C
H
CH
3
O
C H
CH
2
OH
enol
aldehyd
H
Hydroborowanie z następczym utlenianiem
Addycja boranu BH
3
do alkinów daje borany winylowe, które po
utlenieniu H
2
O
2
i tautomerii prowadzą do aldehydów lub ketonów.
3CH
3
CH
2
CH
2
C CH
BH
3
pent-1-yn
pentanal
CH
3
(CH
2
)
2
C
C
B
H
H
2
O
2
H
CH
3
(CH
2
)
2
C
C
H
H
H
C
C
(CH
2
)
2
CH
3
H
CH
3
(CH
2
)
2
C
C
H
H
OH
3CH
3
CH
2
CH
2
CH
2
C
O
H
pentan-1-ol
enol
3
Ozonoliza –
reakcja rozkładu pod wpływem ozonu
C
C
R
R'
1. O
3
2. H
2
O
COOH
R
+
COOH
R'
kwasy karboksylowe
C
C
R
R'
KMnO
4
COOH
R
+
COOH
R'
kwasy karboksylowe
Utlenianie nadmanganianem potasu (silny utleniacz)
prowadzi do kwasów karboksylowych

Redukcja alkinów
Uwodornienie katalityczne
Alkiny w obecności katalizatorów (Pt, Pd, Ni, Rh) przyłączają
2 mole wodoru dając alkany. Reakcja nie zatrzymuje się
na etapie alkenów. Oba etapy są egzotermiczne.
CH
3
CHCH
2
C
CH
CH
3
+
2H
2
Pd/C
CH
3
CHCH
2
CH
2
CH
3
CH
3
4-metylopent-1-yn
2-metylopentan
+
2H
2
R C C R'
Pd lub Pt lub Ni lub Rh
R CH
2
CH
2
R'
alkan
alkin
Uwodornienie na katalizatorze
Lindlara
(Pd/CaCO
3
+ Pb(OAc)
2
+ chinolina)
- otrzymujemy
cis
alkeny
CH
3
CH
2
CH
2
C
C
CH
3
H
+
H
2
CH
3
CH
2
CH
2
C
CCH
3
heks-2-yn
kat. Lindlara
H
cis
-heks-2-en
CH
3
(CH
2
)
7
C
C
H
(CH
2
)
7
COOH
H
2
CH
3
(CH
2
)
7
C
C(CH
2
)
7
COOH
kwas stearolowy
kwas oktadec-9-ynowy
kat. Lindlara
H
kwas oleinowy
kwas
Z
-oktadec-9-enowy
Redukcja alkinów za pomocą metali alkalicznych
w ciekłym amoniaku
Redukcja alkinów litem lub sodem w ciekłym amoniaku daje
trans
-alkeny i reakcja zatrzymuje się na etapie alkenów.
Atom metalu przekazuje elektron cząsteczce organicznej i w procesie zwanym
przeniesieniem pojedynczego elektronu (
SET
) tworzy się anionorodnik.
Anionorodnik z cząsteczką rozpuszczalnika (NH
3
) tworzy rodnik winylowy,
który w reakcji z atomem metalu daje karboanion.
+
SET
R C C R'
Na
+
R C C R'
Na
+
anionorodnik
R C C R'
anionorodnik
NH
2
H
R C C
R'
rodnik winylowy
H
- Na
+
Na
R C C
R'
karboanion
H

Karboanion stabilizuje się odrywając proton z cząsteczki rozpuszczalnika
NH
3
. Proton ten przyłącza się do pary elektronowej znajdującej się po
przeciwnej stronie wiązania C=C w stosunku do uprzednio przyłączonego
atomu wodoru dając izomer
trans
.
C
C
R
H
trans-
alken
NH
2
R'
H
C
C
R
H
R'
H
karboanion

CH
3
CH
2
CH
2
C
C
CH
3
H
Li
CH
3
CH
2
CH
2
C
CCH
3
heks-2-yn
H
trans
-heks-2-en
NH
3
CH
3
(CH
2
)
7
C
C
H
(CH
2
)
7
COOH
1. Na, NH
3
CH
3
(CH
2
)
7
C
C(CH
2
)
7
COOH
kwas stearolowy
kwas oktadec-9-ynowy
H
kwas elaidynowy
kwas
E
-oktadec-9-enowy
2. H
3
O
+
Pytanie
Zaproponuj metodę syntezy:
a) but-1-ynu z etanolu
b)
n
-oktanu z acetylenu
Odpowiedź
2. CH
3
CH
2
Br
1. NaNH
2
, NH
3
but-1-yn
HC
CCH
2
CH
3
S
N
2
CH
3
CH
2
OH
etanol
H
2
SO
4
CH
2
CH
2
Br
2
BrCH
2
CH
2
Br
2. H
2
O
1. NaNH
2
, NH
3
eten
1,2-dibromoetan
acetylen
HC
CH
a.
okt-1-yn
HC
CCH
2
(CH
2
)
4
CH
3
CH
3
(CH
2
)
4
CH
2
Br
S
N
2
acetylen
HC
CH
NaNH
2
, NH
3
HC
C
-
Na
+
H
2
, Pt
acetylenek sodu
b.
CH
3
CH
2
CH
2
(CH
2
)
4
CH
3
n-oktan

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
Alkeny i alkiny id 58008 Nieznany (2)
alkany alkeny alkiny id 57988 Nieznany
Alkeny i alkiny id 58008 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron