ZJAWISKA NA GRANICY FAZ - ADSORPCJA
Ćwiczenie A -1
Wyznaczanie izotermy adsorpcji dla układu ciecz - ciało stałe
Celem ćwiczenia jest wyznaczenie izotermy adsorpcji Freundlicha kwasu octowego na węglu aktywnym.
Zadanie sprowadza się do wyznaczenia doświadczalnego współczynników k i 1/n w równaniu Freundlicha dla konkretnego węgla aktywnego. Należy ustalić zależność ilości zaadsorbowanego kwasu na jednostkę masy, w zależności od stężenia tego kwasu.
Odczynniki i aparatura
Roztwór kwasu octowego (CH3COOH) o stężeniu C = 0,52 mol/dm3
Roztwór wodorotlenku sodowego (NaOH) o stężeniu C = 0,1 mol/dm3
Fenoloftaleina - wskaźnik
Węgiel aktywny
Zestaw do miareczkowania
Wytrząsarka laboratoryjna
Szkło laboratoryjne
5 kolbek miarowych o pojemności 100 cm3
5 kolbek stożkowych ze szlifowanym korkiem
5 kolbek stożkowych do sączenia
lejki, pipety, bagietki
Sączki z bibuły o średniej szybkości filtracji
Wykonanie ćwiczenia
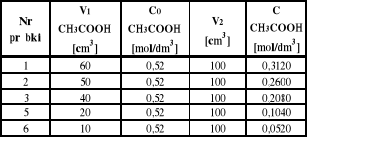
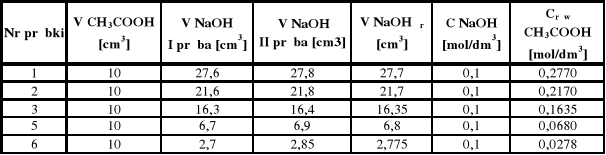
W kolbach miarowych o pojemności 100 cm3 należy sporządzić pięć roztworów kwasu octowego o następujących stężeniach : 0,3; 0,25; 0,2; 0,1; 0,05 mol/dm3 w ilości po 100 cm3 każdego (korzystając z roztworu kwasu octowego o stężeniu 0,52 mol/dm3). Otrzymane roztwory dokładnie mianuje się roztworem wodorotlenku sodowego o stężeniu 0,1 mol/dm3 wobec fenoloftaleiny jako wskaźnika. W tym celu należy odmierzyć 10 cm3 roztworu kwasu octowego o danym stężeniu do suchej kolby stożkowej i miareczkować dwukrotnie. Analogicznie wykonać miareczkowanie pozostałych roztworów kwasu octowego.
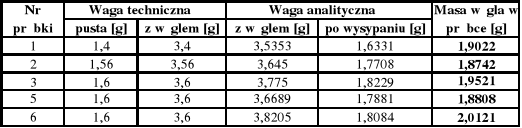
Korzystając z wagi technicznej a następnie analitycznej należy dokładnie odważyć na folii aluminiowej pięć odważek węgla (po około 2 g każda). Następnie odważki węgla wsypać kolejno do pięciu kolbek ze szlifem. Później do tych kolbek należy dodać po 50 cm3 każdego z przygotowanych roztworów kwasu octowego. Kolbki zamknąć szczelnie korkiem i zawartość wytrząsać przez około 10 minut na wytrząsarce. Otrzymane zawiesiny przesączyć, z każdego przesączu pobrać do miareczkowania próbki o objętości 10 cm3, celem oznaczenia stężenia równowagowego kwasu octowego (niezaadsorbowanego). Wszystkie miareczkowania należy wykonać dwukrotnie.
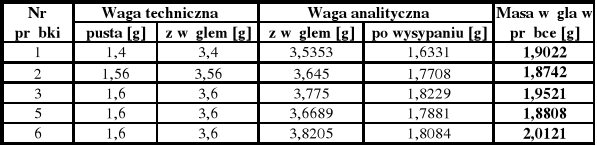
Wyniki pomiarów
Stężenie kwasu octowego w poszczególnych próbkach
C = C0 * V1 / V2
Gdzie:
C - stężenie kwasu octowego w badanej próbie
C0 - stężenie początkowe wzorcowego kwasu octowego (przed
rozcieńczeniem)
V1 - objętość kwasu octowego użyta do rozcieńczenia
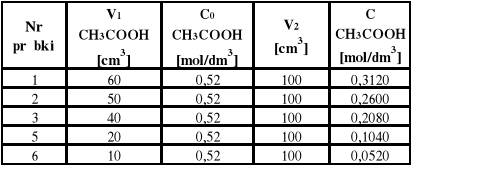
V2 - końcowa objętość roztworu po rozcieńczeniu kwasu
C1 = 0,52 * 60 / 100 = 0,312
C2 = 0,52 * 50 / 100 = 0,260
C3 = 0,52 * 40 / 100 = 0,208
C5 = 0,52 * 20 / 100 = 0,104
C6 = 0,52 * 10 / 100 = 0,520
Stężenie kwasu octowego po adsorpcji na węglu aktywnym
Crów = VNaOH * CNaOH / VCH3COOH
Gdzie:
Crów - stężenie kwasu octowego po adsorpcji na węglu aktywnym
VNaOH - objętość zużytego titranta [dm3]
CNaOH - stężenie titranta (0,1 [mol/dm3)]
VCH3COOH - objętość kwasu octowego wzięta do miareczkowania
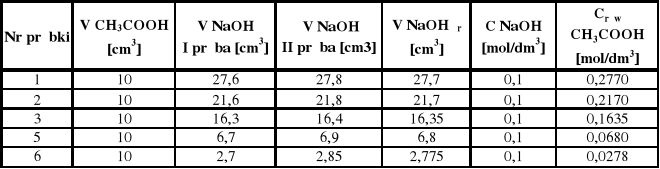
Crów I = 27,7 * 0,1 / 10 = 0,277
Crów II = 21,7 * 0,1 / 10 = 0,217
Crów III = 16,35 * 0,1 / 10 = 0,1635
Crów V = 6,8 * 0,1 / 10 = 0,068
Crów VI = 2,775 * 0,1 / 10 = 0,0278
Opracowanie wyników:
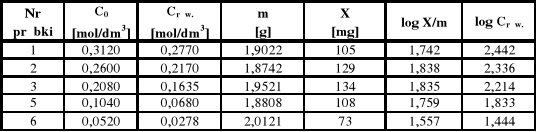
Z różnicy stężeń przed i po adsorpcji obliczam X, to jest liczbę miligramów zaadsorbowanego kwasu octowego na węglu aktywnym.
C0 = V1NaOH * CNaOH / VCH3COOH
Crów. = V2NaOH * CNaOH / VCH3COOH [mol/dm3] ( * 1000 [mmol/dm3])
X = 1000 * Vkw. * (C0 - Crów.) * 60 [mg]
Gdzie:
V1, V2 - objętości zasady zużyte na miareczkowanie
VCH3COOH - objętość próbki kwasu octowego (10 cm3)
Vkw. - objętość kwasu zużyta do adsorpcji (0,05 dm3)
60 - masa molowa CH3COOH
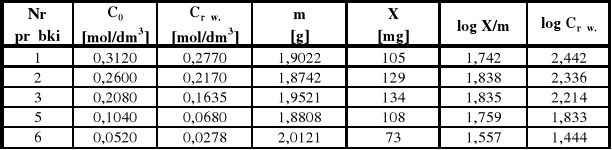
X1 = 1000 * 0,05 * (0,312 - 0,277) * 60 = 105
X2 = 1000 * 0,05 * (0,26 - 0,217) * 60 = 129
X3 = 1000 * 0,05 * (0,208 - 0,1635) * 60 = 134
X5 = 1000 * 0,05 * (0,104 - 0,068) * 60 = 108
X6 = 1000 * 0,05 * (0,052 - 0,0278) * 60 = 73
log X/m1 = log 105/1,9022 = 1,742
log X/m2 = log 129/1,8742 = 1,838
log X/m3 = log 134/1,9521 = 1,835
log X/m5 = log 108/1,8808 = 1,759
log X/m6 = log 73/2,0121 = 1,557
log Crów I = log 277 = 2,442
log Crów II = log 217 = 2,336
log Crów III = log 163,5 = 2,214
log Crów V = log 68 = 1,833
log Crów VI = log 27,8 = 1,444
Z wykresu wyznaczam logK i 1/n :
logK = 1,557 K = 101,557 = 36,058
α = 250 tg250 = 1/n
0,4663 = 1/n
n = 2,1445
Równanie izotermy Frundlicha przyjmuje postać:
log X/m = 1,557 + 0,4663 logC
Wyszukiwarka
Podobne podstrony:
19 ADSORBCJA NA GRANICY FAZ CIAŁO STAŁE CIECZ WYZNACZANIE ADSORBCJI BARWNIKA NA WĘGLU AKTYWNYM
ćw. 8 - Adsorpcja na granicy faz ciało stałe-ciecz, Chemia fizyczna
Sprawko+ +Adsorpcja+na+granicy+faz+ciało+stałe ciecz +Wyznaczanie+adsorpcji+barwnika+na+węglu+aktywn
adsorbcja na granicy?z sprawko
adsorpcja czasteczek spc na granicy faz woda, WSZKiPZ, semestr III, surowce test
chemia, ogniwa, Potencjał elektrochemiczny - różnica potencjału na granicy faz metal/roztwór
adsorpcja na granicy faz
Adsorpcja na granicy faz ciało stałe ciecz Wyznaczanie izotermy adsorpcji na węglu aktywnym
RASFF odrzucenia na granicy
F19 fale na granicy o rodk w
FW14 fale na granicy osrodkow 0 Nieznany
Przesunięcie wiaty usytuowanej na granicy działki
Odmowa wydania pozwolenia na budowę garażu w granicy działki
Interpolacja jednostkowych oporów granicznych pod podstawą oraz na pobocznicy pala dla gruntów uwars
Analiza porównawcza stanów granicznych na ścinanie masywnych konstrukcji z betonu
Metody prezentacji zjawisk na mapach
więcej podobnych podstron