Krew jest jednym z płynów ustrojowych. Spełnia swoje funkcje tylko wówczas, gdy jest wprawiona w ruch w naczyniach krwionośnych. Składa się z krwinek (czerwonych i białych), płytek krwi i osocza.
Funkcje krwi
Transport
tlen, dwutlenek węgla, produkty metabolizmu, składniki odżywcze, ciepło i hormony
Regulacja
pH -dzięki buforom
temperatury organizmu
Protekcja przed infekcjami i utratą krwi
Fizyczna charakterystyka krwi
gęstość (lepkość )większa niż wody i szybkość przepływu mniejsza niż wody
temperatura 36,6 oC
pH 7.4 (7.35-7.45)
objętość krwi
5 do 6 l u dorosłych mężczyzn
4 do 5 l u dorosłych kobiet
hormonalne sprzężenie zwrotne utrzymuje stałą objętość i ciśnienie tętnicze
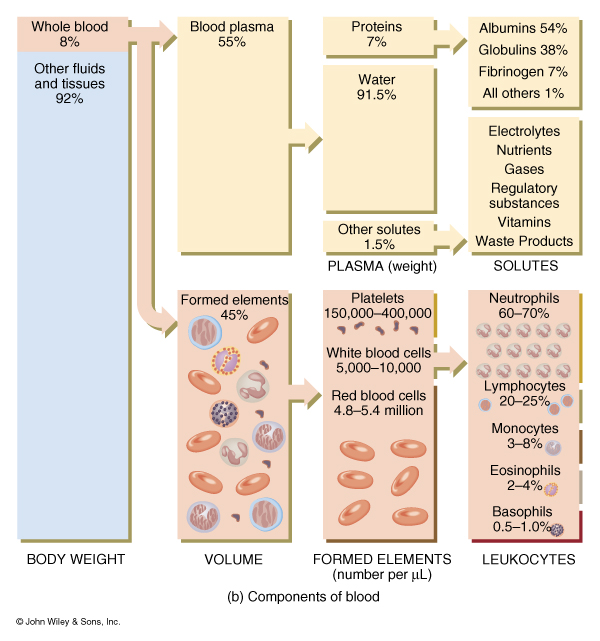
Skład krwi
55% osocze
45% komórki
99% RBCs ( Red Blood Cells) - erytrocyty
< 1% WBCs ( White blood cells ) leukocyty i płytki
Osocze krwi to koloidalny roztwór białek umożliwiający zawieszenie w nim elementów morfotycznych krwi w formie rozproszonej.
Skład osocza :
ponad 90% woda
7% białka osocza
tworzone w wątrobie
transportowane do krążenia
w skład białek osocza wchodzą :
albuminy
ciśnienie osmotyczne krwi
transport
globuliny (immunoglobuliny)
obrona
fibrynogen
krzepnięcie
2% innych substancji
elektrolity, składniki odżywcze, hormony, gazy, produkty resztkowe
Układy grupowe krwi
Immunologiczne zróżnicowanie krwi dotyczy wszystkich elementów morfotycznych krwi oraz białek osocza. Odpowiedzialne za to zróżnicowanie są substancje grupowe, które mają charakter antygenu.
Antygen to wieloskładnikowa substancja, która jest rozpoznawana jako obca przez komórki kompetentne układu immunologicznego, czego efektem jest uruchomienie odpowiedzi immunologicznej w postaci produkcji swoistych przeciwciał oraz powstania swoistej odpowiedzi komórkowej. Jest to więc cząsteczka, która reaguje swoiście z przeciwciałem lub komórką uczuloną.
Podział antygenów ze względu na pochodzenie.
zewnątrzpochodne : bakteryjne, wirusowe, roślinne ( np. pyłki ), pasożytnicze, chemiczne
wewnątrzpochodne : są to antygeny znajdujące się na komórkach ustroju np. na krwinkach czerwonych
( ABO, Kell, MN, Rh, Lewis ) na krwinkach białych ( ABO, HLA, nieHLA ), płytek
krwi ( ABO, HLA, Zw, Ko )
autoantygeny czyli antygeny znajdujące się na komórkach organizmu, które na skutek różnych procesów patologicznych stają się obce dla własnego organizmu, czego efektem jest powstanie przeciwciał skierowanych przeciwko własnym komórkom. Są one podłożem chorób autoimmunologicznych.
Uodpornienie antygenami tego samego gatunku nosi nazwę alloimmunizacji ( np. uodpornienie matki antygenami płodu, lub uodpornienie biorcy antygenami dawcy w następstwie transfuzji ).
Reakcja ustroju na antygeny obcogatunkowe nosi nazwę heteroimmunzacji .
W wyniku bodźcowego działania antygenu w ustrojach zwierząt wyższych i człowieka, powstają immunoglobuliny. Są one produkowane przez ustrój w ramach mechanizmu obronnego, jako odpowiedź na obcy antygen elementów morfotycznych krwi, albo niektóre substancje wykrywane w świecie zwierzęcym i roślinnym.
Immunoglobuliny produkowane są przez plazmocyty ( należące do linii limfocytów B ). Podstawową jednostką strukturalną immunoglobulin jest monomer, w skład którego wchodzą 4 łańcuchy połączone z sobą wiązaniami dwusiarczkowymi.
Dwa z tych łańcuchów, identyczne, o dużej masie cząsteczkowej - nazwano łańcuchami ciężkimi ( H - heavy ). Łańcuchy ciężkie występują w 5 rodzajach gamma, alfa, mi, delta, epsilon.
Pozostałe dwa ,też identyczne, o małej masie cząsteczkowej nazwano lekkimi ( L - light). Występują w dwóch rodzajach - kappa i lambda
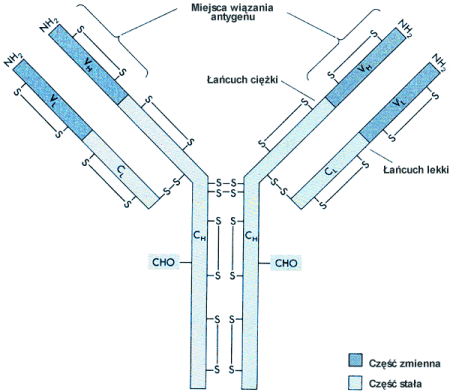
Łańcuchy ciężkie determinują klasę immunoglobulin np:
dwa łańcuchy α w cząsteczce IgA
dwa łańcuchy γ w cząsteczce IgG
dwa łańcuchy δ w cząsteczce IgD
dwa łańcuchy μ w cząsteczce IgM
dwa łańcuchy ε w cząsteczce IgE
Łańcuchy lekkie determinują typ immunoglobulin dwa łańcuchy κ w typie I
dwa łańcuchy λ w typie II
Charakterystyka biologiczna przeciwciał
IgG - norma 9 -14 g/l, ilościowo najliczniejsza grupa.
4 podklasy ( różnice w części Fc ) : IgG~ , lgG2 , IgG3 , IgG4 ,
monomery - mała cząsteczka, przechodzą przez śródbłonek i łożysko
IgG1 , IgG2 , IgG3 , po związaniu np z bakteriami, wiążą składową C 1 q dopełniacza i uruchamiają klasyczną drogę aktywacji dopełniacza.
mają zdolność do opsonizacji
IgA - norma 1,6 g/I, immunoglobulina wydzielnicza, chroni błony śluzowe
występuje w formie monomeru lub dimeru w ślinie, łzach, wydzielinie z nosa, soku żołądkowym, w śluzie w układzie oddechowym
IgA wydzielnicza ma fragment sekrecyjny ( glikoproteina ) chroniący przed działaniem enzymów proteolitycznych. IgA ma dwie podklasy, nie wiąże dopełniacza, nie ma własności bakteriobójczych, neutralizuje wirusy i toksyny.
IgM - norma 0,9 g/l, pentamer - nie przechodzi przez śródbłonek.
Jest syntetyzowana jako - pierwsza podczas rozwoju układu immunologicznego a także jest pierwszą immunoglobuliną w pierwotnej odpowiedzi immunologicznej. Wiąże Clq dopełniacza, pobudzając klasyczną drogę aktywacji dopełniacza.
należą tu naturalne izoaglutyniny układu ABO
IgD - norma 0,1 g/1, cząsteczki niestabilne, w warunkach " in vivo" szybko się rozpadają.
występują w surowicy krwi oraz na powierzchni limfocytów B
rola niejasna, być może kontrola funkcji limfocytów B, udział w pamięci immunologicznej
IgE - norma 0,3x10-3g/l, wytwarzana w migdałkach, węzłach chłonnych okołooskrzelowych, otrzewnowych, podskórnych oraz śluzówce przewodu pokarmowego i drzewa oskrzelowego
wiążą się z fragmentem Fc znajdującym się na komórkach tucznych i bazofilach co umożliwia, po kontakcie z odpowiednim antygenem, uwalnianie z tych komórek mediatorów reakcji zapalnej
Układ grupowy ABO
Antygeny układu grupowego ABO są uwarunkowane przez trzy główne allele - A, B i O. Jeden z nich może zajmować loci ABO w jednym z pary chromosomów. Gen O jest genem amorficznym, tzn. nie steruje produkcją żadnego antygenu. Jest to gen recesywny i dlatego u osób grupy A i B nie można określić genotypu. Umożliwiają to dopiero badania rodzinne.
Podstawową substancją, z której pod kontrolą odpowiednich genów rozwijają się antygeny A i B, jest antygen H. Gen H i jego allel h dziedziczą się niezależnie od genów allelicznych A, B i O. Gen h jest genem amorficznym. Na podstawie występowania lub braku odpowiednich antygenów w krwinkach czerwonych przyjęto podział na cztery grupy krwi : A, B, O i AB. Niekiedy spotyka się osoby, które dziedziczą odmiany antygenów A i B. Podział na odmiany jest oparty na różnicy sił ekspresji antygenów A i B. Odmiany antygenu A występują częściej niż odmiany antygenu B. Stwarzają więc więcej problemów diagnostycznych.
W obrębie antygenu A wyodrębnia się dwie podstawowe odmiany : mocny antygen nazwany A1, występujący u około 80% osób grupy A i AB oraz słabszy antygen nazwany A2. Inne odmiany antygenu A, np. A3, Ax, Am występują rzadko. W przypadku mocnego antygenu A1, cała substancja podstawowa (antygen H) jest zużyta do syntezy antygenu A. Natomiast, w przypadku słabych odmian zużywana jest tylko część antygenu H. Tak więc, im słabsza odmiana, tym więcej antygenu H pozostaje w krwinkach w formie niezmienionej.
Antygeny grupowe A i B rozwijają się już we wczesnym okresie życia płodowego. Istnieje jednak pewna niedojrzałość antygenu, zwłaszcza antygenu A, co uniemożliwia ostateczne oznaczenie odmiany grupy krwi płodu. Grupy krwi pozostają niezmienione przez całe życie. Jednakże, pod wpływem schorzeń nowotworowych mogą one ulec okresowej zmianie. Obecność antygenów A, B i H jest związana nie tylko z krwinkami czerwonymi. Występują one również we wszystkich tkankach organizmu, za wyjątkiem tkanki nerwowej, a takie u około 80% populacji w płynach ustrojowych, wydzielinach i wydalinach. Największe ilości substancji grupowych ABH zawiera ślina. Dlatego też wykorzystuje się ślinę do oznaczania podgrup. Wydzielanie substancji grupowych jest kontrolowane przez parę aleli Se i se zwanych genami wydzielania ( sekrecji). Geny te są niezależne od aleli ABO i genu H. Gen Se jest genem sekrecji, natomiast gen se jest genem amorficznym i dlatego u osób homozygotycznych tzw. niewydzielaczy, brak jest substancji grupowych w płynach ustrojowych.
Przeciwciała układu ABO, anty-A i anty-B, są produkowane w wieku niemowlęcym ( nie wcześniej niż w czwartym miesiącu życia). Występują one jako stały składnik surowic i dlatego noszą nazwę przeciwciał naturalnych regularnych.
Regularne przeciwciała anty-A i anty-B są kompletnymi aglutyninami typu zimnego, klasy IgM. Optimum ich działania przypada na temp. 4°C. Ponieważ jednak aktywność przeciwciał anty-A i anty-B zmienia się nieznacznie pod wpływem temperatury, dlatego rutynowe badania grup ABO przeprowadzamy w temperaturze pokojowej. Błąd w oznaczaniu grupy układu ABO u chorego lub dawcy może spowodować groźne odczyny poprzetoczeniowe. Jest to związane przede wszystkim ze zdolnością wiązania komplementu przez przeciwciała układu ABO, co prowadzi do wewnątrznaczyniowej hemolizy krwinek czerwonych.
U niektórych osób, poza regularnie występującymi przeciwciałami anty-A i anty-B, spotyka się nieregularne przeciwciała z tego układu : anty-A1 lub anty-H.
Przeciwciała anty-A1, mogą występować w surowicy osób grupy A2 lub grupy A2B. Natomiast u osób posiadających mocny antygen, czyli grupę A1 lub A1B rzadziej grupę B, można wykryć przeciwciała anty-H. Przeciwciała te mają charakter aglutynin typu zimnego. Czasami mogą one przybierać postać przeciwciał odpornościowych, aktywnych w temp. 37°C.
Niekiedy w surowicy krwi występują także odpornościowe przeciwciała anty-A i anty-B. W warunkach laboratoryjnych występują one jako aglutyniny i hemolizyny o poszerzonej amplitudzie cieplnej. Są to przeciwciała klasy IgM i IgG. Tylko przeciwciała klasy IgG mają zdolność przechodzenia przez łożysko i mogą być przyczyną choroby hemolitycznej noworodków.
Występowanie antygenów i przeciwciał w danej grupie krwi zostało określone przez odkrywcę układu ABO, Karola Landsteinera i sformułowane w postaci tzw.
reguł Landsteinera
w surowicy zawsze występują przeciwciała dla antygenów nieobecnych w krwinkach
surowica nie zawiera przeciwciał dla własnych krwinek.
Wyróżniamy następujące , podstawowe grupy krwi w układzie ABO
Nazwa grupy antygen izoaglutyniny
w krwinkach regularne nieregularne
-------------------------------------------------------------------------------------------------------------
A1 A1 anty - B anty - H
A2 A2 anty - B anty - A1
B B anty - A1 anty - H
A1B A1 i B brak anty - H
A2B A2 i B brak anty - A1
O H anty- A1 i anty B brak
Układ grupowy Rh
Genetykę układu Rh wyjaśnia powszechnie uznawana teoria Fishera i Race'a, która zakłada obecność trzech par genów allelomorficznych : D, d C, c, E i e zajmujących w tej kolejności trzy miejsca w chromosomie 1 . Gen d jest genem amorficznym, a pozostałe geny determinują obecność odpowiednich antygenów w krwinkach czerwonych. Obecność ich określa 8 kombinacji genowych: cde, CDe, cDE, Cde, cDe, cdE, CDE i CdE. W parze chromosomów liczba teoretycznie możliwych kombinacji zwiększa się do 36. Wśród rasy białej przeważają chromosomy o następujących zespołach genowych : cde, Cde, cDE, częstość pozostałych kombinacji wynosi niespełna 10%.
Antygeny układu Rh są obecne tylko na krwinkach czerwonych. Nie znaleziono ich ani w płynach ustrojowych ani w przyrodzie i dlatego uodpornienie na te antygeny może nastąpić tylko poprzez zetknięcie z krwinkami czerwonymi. Antygeny Rh pojawiają się we wczesnych etapach życia płodowego, a u noworodka ich aktywność serologiczna odpowiada aktywności u osób dorosłych.
Charakterystyka antygenów układu Rh
Antygen D - występuje u 80% ludności rasy białej ( w Polsce 82% ), najsilniejszy ze wszystkich antygenów tego układu. Słabsza odmiana to Du.
Antygen C - występuje u 70% ludności rasy białej. Odmiany Cu, Cx - bardzo słabe i rzadkie, częstszy i silniejszy Cw, ( 5% populacji w Polsce ).
W krwiolecznictwie największe znaczenie ma antygen D, ponieważ jest on najbardziej immunogenny spośród wszystkich antygenów układu Rh. Z tego względu wprowadzono podział populacji na dwie grupy : Rh-plus i Rh-minus.
Określenie Rh-plus odnosi się do krwinek, które zawierają antygen D lub jego odmianę Du.
Krwinki, które nie posiadają tych antygenów są określane jako Rh minus.
Przeciwciała układu Rh mają charakter wyłącznie odpornościowy i pojawiają się w ustroju najczęściej po transfuzji krwi niezgodnej grupowo oraz w następstwie uodpornienia matki antygenami płodu. W większości są to przeciwciała klasy IgG, niekompletne, czynne w temperaturze 37°C. Optymalną metodą wykrywania przeciwciał układu Rh jest test enzymatyczny z zastosowaniem odczynnika LEN. Przeciwciałom niekompletnym towarzyszą czasem przeciwciała kompletne, wykrywane w roztworze NaCI w temperaturze 37°C. Przeciwciała kompletne pojawiają się po długotrwałej stymulacji antygenem i dlatego są najczęściej przyczyną ciężkiej postaci choroby hemolitycznej noworodków.
Ze względu na stosowanie immunoglobuliny anty-D jako profilaktyki przed wystąpieniem konfliktu serologicznego w układzie Rh, liczba kobiet uodpornionych antygenem D gwałtownie spada. Immunoglobulina anty-D powinna być stosowana już w czasie ciąży, bowiem podawanie jej po porodzie nie zapobiega skutecznie uodpornieniu się na antygen D około 2% kobiet z układem Rh-minus.
Inne układy grupowe krwinek czerwonych.
Kell - w jego skład wchodzi kilka antygenów, najbardziej znany to antygen Kell ( K ) oraz antygen cellano ( k ). W warunkach " in vitro " antygeny te są nietrwałe. W transfuzjologii układ ten ma duże znaczenie ponieważ jego antygeny mają duże własności immunogenne. U wielokrotnych biorców przeciwciała anty-K pod względem częstości występowania i powikłań poprzetoczeniowych zajmują miejsce tuż za przeciwciałami anty-D.
Duffy ( Fy ) znane są dwa antygeny tego układu Fya i Fyb o małej imunogenności. Przeciwciała układu Duffy należą do IgG, niektóre z nich wiążą dopełniacz i są przyczyną ciężkich hemolitycznych powikłań poprzetoczeniowych.
Kidd ( Jk ) w skład tego układu wchodzą antygeny Jka i Jkb o małej immunogenności. Przeciwciała tego układu mają zdolność wiązania komplementu i powodują odczyn poprzetoczeniowy z hemolizą wewnątrznaczyniową.
Lewis ( Le ). Znane są dwa antygeny tego układu : Lea i Leb. Przeciwciała z układu Lewis nie mają znaczenia w immunopatologii ciąży. Mimo, że są bardzo często wykrywane w krwi pacjenta, rzadko mają znaczenie kliniczne, ponieważ są wiązane przez substancje Lewis obecne w osoczu dawcy.
Przetaczanie krwi i jej pochodnych
Serologiczną podstawą krwiolecznictwa są następujące zasady
należy przetaczać krew zgodną w zakresie antygenów układu ABO oraz antygenu D z układu Rh u biorcy i dawcy
przetaczana krew nie może zawierać antygenów reagujących z przeciwciałami biorcy ani przeciwciał reagujących z krwinkami biorcy.
jeżeli biorca kiedykolwiek wytworzył allo- lub autoprzeciwciała należy dobierać mu krew fenotypowo zgodną z wszystkimi antygenami układu Rh i antygenem K z układu Kell
wszystkim kobietom do okresu menopauzy i dziewczynkom należy przetaczać krew Kell ujemną
należy wykonać próbę zgodności przy przetoczeniu koncentratu krwinek płytkowych gdy preparat płytkowy zawiera powyżej 5 ml krwinek czerwonych
W próbie zgodności przeprowadzamy badanie surowicy biorcy z krwinkami dawcy w teście enzymatycznym metodą LEN oraz w teście antyglobulinowym metodą LISS lub klasyczną metodą probówkową. Równocześnie wykonujemy badania kontrolne w tych testach ( surowica biorcy, krwinki biorcy ). Uzupełnieniem próby zgodności jest kontrola antygenów układu ABO biorcy i dawcy oraz kontrola antygenu D biorcy i dawcy, w przypadku gdy biorca jest Rh minus. W próbie zgodności pomijamy badanie surowicy dawcy z krwinkami biorcy.
Oznaczając grupę krwi biorcy i dawcy przeprowadzamy badanie na obecność przeciwciał odpornościowych w ich surowicy. W przypadku wykrycia u dawców przeciwciał odpornościowych osocze można użyć do produkcji surowicy diagnostycznej. Do przetaczania używamy natomiast tylko przemyte krwinki czerwone. Najczęściej jednak osoba posiadająca w krwi przeciwciała odpornościowe nie może być dawcą krwi.
Diagnostyka konfliktu serologicznego oraz choroby hemolitycznej noworodków (ChHN)
Choroba hemolityczna noworodków jest następstwem niezgodności serologicznej pomiędzy matką a płodem. Jeżeli płód odziedziczy antygeny ojca, których nie posiada matka, może dojść do konfliktu serologicznego.
Konflikt występuje, gdy w surowicy matki stwierdzamy odpornościowe przeciwciała, natomiast na krwinkach płodu odpowiedni dla tych przeciwciał antygen. Przeciwciała matki powstają na skutek obecności obcego dla matki antygenu w poprzedniej ciąży lub wcześniejszym przetoczeniem krwi obcogrupowej.
Wyjątek stanowią przeciwciała z układu ABO. Jeżeli immunizacja jest następstwem ciąży, bodźcem antygenowym są krwinki płodu posiadające obce antygeny, których nie posiada matka. Niewielkie ilości krwinek płodu przedostają się do układu krwionośnego matki już w drugiej połowie ciąży. Jest to najczęściej niewystarczająca ilość krwinek do immunizacji matki podczas pierwszej ciąży. Wyjątkowo więc może się ona rozpocząć w czasie pierwszej ciąży. Najczęściej do immunizacji dochodzi z powodu krwawienia płodowo-matczynego przy porodzie. Immunizacja może być także następstwem amniopunkcji, poronienia lub pęknięcia ciąży pozamacicznej. Szczególne znaczenie w immunizacji kobiet mają przetoczenia krwi. Jednorazowe przetoczenie dużej ilości krwinek dawcy stwarza możliwość immunizacji nawet bardzo słabym antygenem. Wytworzone przeciwciała mogą przetrwać wiele lat. W takim przypadku obcogrupowa ciąża może spowodować wzmożoną produkcję przeciwciał we wczesnym okresie ciąży pod wpływem niewielkich ilości krwinek płodu.
Z tych względów w celu wykrycia konfliktu serologicznego pomiędzy matką a płodem, wszystkie kobiety w ciąży są objęte badaniami serologicznymi. Wykonywane są one w pierwszym trymestrze ciąży i obejmują oznaczenia grupy układu ABO, antygenu D oraz wykrywanie przeciwciał odpornościowych.
Jeżeli nie wykrywamy przeciwciał odpornościowych to wystarczy pod koniec ciąży powtórzyć badania przeglądowe przeciwciał.
W przypadku kobiet ciężarnych u których wykrywamy przeciwciała należy określić ich swoistość, bowiem nie wszystkie przeciwciała mają znaczenie w immunopatologii ciąży. Bardzo ważna jest także informacja czy przeciwciała obecne w krwi matki niosą ryzyko dla płodu, sama obecność przeciwciał nie decyduje bowiem o wystąpieniu choroby hemolitycznej noworodków. Dlatego też konieczne są badania krwi ojca mające na celu oznaczenia grupy układu ABO, Rh oraz antygenu dla którego stwierdzono swoistość przeciwciał.
Przechodzenie przeciwciał z krwi matki do krwi noworodka odbywa się przez łożysko. Taką zdolność przechodzenia mają tylko przeciwciała klasy IgG.
Do ChHN dochodzi, gdy krwinki czerwone płodu zostają opłaszczone przez alloprzeciwciała matki skierowane przeciw antygenowi, który płód odziedziczył po ojcu. Krwinki uczulone przeciwciałami ulegają przyśpieszonemu niszczeniu zarówno przed, jak i po porodzie. Niezależnie od swoistości przeciwciał mechanizm choroby hemolitycznej jest podobny. Poszczególne przypadki mogą różnić się przebiegiem procesu chorobowego, aż do wewnątrzmacicznej śmierci płodu. W przewidywaniu ChHN jest konieczna okresowa kontrola miana przeciwciał. Narastanie miana przeciwciał jest przydatne w przewidywaniu choroby w czasie ciąży i po porodzie.
Konflikt w układzie ABO
Konflikt w układzie ABO stwierdzamy wtedy, gdy w surowicy matki wykrywamy odpornościowe przeciwciała anty-A lub anty-B, natomiast krwinki noworodka posiadają odpowiednio antygen A lub B odziedziczony po ojcu.
P r z e c i w c i a ł a k l a s y I g G, które powodują ChHN w układzie ABO prawie zawsze pojawiają. się w krążeniu matki, bez wcześniejszej immunizacji krwinkami czerwonymi. Są one następstwem uodpornienia antygenami A i B pochodzenia obcogatunkowego. Dlatego ChHN może zdarzyć się w pierwszej ciąży z podobną częstością jak podczas następnych.
Jeżeli istnieje konflikt serologiczny w układzie ABO ryzyko ChHN wynosi tylko 30%. Stosunkowo mała częstość występowania ChHN ABO jest uwarunkowana swoistością przeciwciał z tego układu jakie znajdują się w krwi kobiet ciężarnych oraz niedojrzałością antygenu grupowego w krwinkach płodu i noworodka.
Najczęściej ChHN ABO zdarza się u dzieci z grupą krwi A lub B urodzonych przez matki z grupą krwi O, bardzo rzadko u dzieci urodzonych przez matki z grupą krwi A lub B.
W przypadku niezgodności grup układu ABO rodziców, nie oznaczamy w czasie ciąży przeciwciał odpornościowych z tego układu. Badania te są mało przydatne w przewidywaniu ChHN. Rozwija się ona dopiero po urodzeniu. Wykrywanie przeciwciał w okresie ciąży przeprowadzamy tylko u tych kobiet, których poprzednie dziecko miało ciężką postać ChHN układu ABO.
Konflikt w układzie Rh
Do konfliktu w układzie Rh może dojść wtedy, gdy istnieje niezgodność serologiczna pomiędzy matką a płodem w zakresie antygenów z układu Rh. Najwięcej ciężkich przypadków ChHN powodują przeciwciała anty-D.
Konflikt w zakresie antygenu D występuje wówczas, gdy w surowicy matki z układem Rh minus znajdują się przeciwciała anty-D, a krwinki płodu zawierają antygen D. Immunizacja matki zależy od ilości krwinek płodu, które przedostają się do krwioobiegu matki. Antygen D jest bardzo immunogenny. Uodpornienie tym antygenem może wywołać krew płodu w objętości mniejszej niż 0,1 cm3.
ChHN spowodowana przeciwciałami anty-D rzadko zdarza się w pierwszej ciąży. Przeciwciała anty-D wykrywane są podczas pierwszej ciąży tylko u około 1% kobiet. Powodują one łagodną postać ChHN. Immunizacja antygenem D zdarza się rzadziej, gdy istnieje niezgodność matki z dzieckiem w układzie ABO. Ochronna rola tej niezgodności polega na szybkiej wewnątrzmacicznej hemolizie krwinek płodu przez fizjologiczne przeciwciała matki.
Stosując test enzymatyczny do wykrywania przeciwciał anty-Rh bardzo wcześnie można wykryć uodpornienie antygenami układu Rh. Wykryte przeciwciała anty-D w krwi kobiety ciężarnej są groźne tylko dla płodu z układem Rh+. Z tego względu u ojca oznaczamy układ Rh oraz fenotyp tego układu. Na podstawie fenotypu Rh można przewidywać genotyp ojca, a zatem prawdopodobieństwo odziedziczenia antygenu D przez płód.
Jeżeli u matki zostały wykryte przeciwciała obowiązuje kontrola miana przeciwciał raz w miesiącu lub częściej. Wzrost miana przeciwciał sugeruje niebezpieczeństwo wystąpienia ciężkiej postaci ChHN, a nawet ryzyko wewnątrzmacicznej śmierci płodu. Wzrost miana przeciwciał nie zawsze odpowiada nasileniu procesu hemolitycznego u płodu. Ta zależność jest największa w pierwszej ciąży, w której wystąpiły przeciwciała.
Dużą liczbę przypadków ChHN powodują również przeciwciała anty-c, jakkolwiek rzadziej niż przeciwciała anty-D powodują one ciężką postać ChHN.
Przeciwciała anty-E, anty-e oraz anty-C powodują w wymienionej kolejności znacznie rzadziej ChHN.
Po porodzie oznaczamy w krwi noworodka grupy układu ABO i Rh oraz BTA ( bezpośredni test antyglobulinowy ). Fenotyp Rh oznaczamy tylko wtedy, jeżeli inny antygen z układu Rh jest odpowiedzialny za uodpornienie matki. W ChHN spowodowanej przeciwciałami anty-Rh BTA jest zwykle silnie dodatni.
Podstawą do rozpoznania ChHN jest :
wykrycie antygenu u noworodka, który spowodował uodpornienie matki oraz
dodatni wynik BTA.
W przypadku kiedy nie ma możliwości pobrania krwi od matki, a wynik BTA jest dodatni wykonujemy elucję przeciwciał z krwinek noworodka.
Zasadniczym leczeniem ChHN w układzie Rh jest transfuzja wymienna. Przetaczamy krew zgodną z krwią dziecka w grupie układu ABO, a w układzie Rh nie zawierającej antygenu, dla którego u matki określono swoistość przeciwciał. Przy nieprawidłowym, zwykle spóźnionym leczeniu może dojść do ciężkiego, nieodwracalnego uszkodzenia układu nerwowego.
W Polsce powszechnie stosuje się profilaktykę konfliktu Rh D po porodzie. Polega ona na biernym wprowadzeniu przeciwciał anty-D do organizmu kobiety z układem Rh- w celu zabezpieczenia jej przed uodpornieniem krwinkami płodu z układem Rh+.
W powszechnym użyciu jest preparat o nazwie Gamma anty-D. Jest to czysta frakcja immunoglobuliny G uzyskana z osocza osób uodpornionych krwią Rh+.
Profilaktyczne podanie 150 µg immunoglobuliny anty D w 28 tygodniu ciąży wszystkim kobietom Rh (-) bez przeciwciał anty Rh uzupełnione podaniem poporodowym zwiększa skuteczność profilaktyki do przeszło 99%.
Konflikt serologiczny może powstawać również w zakresie grup głównych A, B, AB oraz antygenów Kell, Duffy, Kid. Występują one jednak znacznie rzadziej i nie stanowią takiego zagrożenia dla płodu.
FIZJOLOGIA KRWINEK CZERWONYCH I BIAŁYCH
Teoria neounitarystyczna zakłada istnienie komórek macierzystych wspólnych dla mielopoezy i limfopoezy Komórką zróżnicowaną w kierunku mielopoezy jest komórka określana mianem CFU-S, która ma zdolność różnicowania się w kierunku erytrocytarnym, megakariocytowym i granulocytarno-makrofagowym przez następujące typy komórek prekursorowych:
I . granulocytarno-makrofagowe - CFU-GM,
2. erytroidalne CFU-E i BFU-E,
3. megakariocytarne CFU-Meg.
Hematopoeza ( tworzenie krwinek ):
a/ w życiu płodowym - erytropoeza mezoblastyczna przy długości zarodka 2,5 - 5,0 mm erytroblasty powstają wewnątrznaczyniowo w wysepkach krwiotwórczych pęcherzyka żółtkowego ( pozazarodkowo ). Synteza hemoglobiny zaczyna się już w II miesiącu życia płodowego
b/ erytropoeza wątrobowa od II do VII miesiąca życia płodowego. Od V miesiąca powolny zanik, krwinki czerwone powstają zewnątrznaczyniowo w wyspach krwiotwórczych wątroby.
Od IV do V miesiąca życia płodowego erytropoeza zachodzi w śledzionie.
c/ erytropoeza szpikowa - początek V miesiąc życia płodowego, od VII miesiąca życia płodowego jedyne miejsce tworzenia krwinek czerwonych.
ll. W życiu pozapłodowym - erytropoeza szpikowa.
Fizjologia krwinki czerwonej
Regulacja erytropoezy
1. Wpływ hormonów:
a) erytropoetyna - hormon specyficznie pobudzający i regulujący erytropoezę, składający się z komponenty ciepłostałej pobudzającej do podziałów dojrzałe prekursory erytropoezy -CFU-E oraz cipłochwiejnej zwiększającej syntezę hemoglobiny. 90% erytropoetyny wytwarzane jest w nerkach przez aparat przykłębkowy a 10% przez tkanki pozanerkowe np. wątrobę.
Wykryto dwa inhibitory erytropoetyny:
- osoczowy inhibitor erytropoezy, produkowany przez monocyty i makrofagi, uniemożliwia działanie erytropoetyny na komórki krwiotwórcze,
- nerkowy inhibitor erytropoezy - reguluje syntezę erytropoetyny w samej nerce,
b) limfokina BPA ( burst promoting activity ) - produkowana przez komórki zrębu szpiku, makrofagi, limfocyty pobudzone czynnikami mitogennymi, pobudza komórki macierzyste szpiku do proliferacji i determinuje je w kierunku erytropoetycznym.
c) inne hormony - np. ACTH, TSH, hormony tarczycy, glikokortykoidy, testosteron - działają pobudzając proces erytropoezy. Testosteron pobudza wytwarzanie receptorów dla erytropoetyny w komórkach BFU-E.
2. Wpływ witamin na erytropoezę :
a) witamina B12 ( cjanokobalamina ) wchłaniana w jelicie krętym po połączeniu
z wewnętrznym czynnikiem Castle'a. Ze śluzówki jelita witamina B12 przechodzi do osocza, gdzie tworzy transkobalaminę I , po połączeniu z alfa 2-globuliną ( forma magazynująca ) oraz transkobalaminę II w połączeniu z alfa,-globuliną ( forma transportująca ).
Głównym narządem magazynującym wit. B12 jest wątroba. Witamina B12 jest koenzymem niezbędnym w biosyntezie kwasów nukleinowych, przy niedoborze wit B12 dochodzi do upośledzenia w różnym stopniu syntezy DNA, nierównomiernego i asynchronicznego dojrzewania elementów jądrowych i cytoplazmy komórek. Niedobór wit B12 ( np.: wskutek chorób żołądka lub jelita cienkiego ) doprowadza do niedokrwistości megaloblastycznej.
b) kwas foliowy - koenzym niezbędny w syntezie tyminy i łańcuchów peptydowych w rybosomach. Jego niedobór powoduje asynchroniczne dojrzewanie jądra i cytoplazmy wszystkich komórek, m.in. odnowę megaloblastyczną krwinek czerwonych.
c) witamina B6 - fosfopirydoksal bierze udział w mitochondrialnym etapie syntezy hemu, wpływa na przyswajanie żelaza i miedzi.
Wpływ metali na erytropoezę.
Żelazo - w ustroju znajduje się w ilości 4 -5 g z tego:
- 65 - 75% w hemoglobinie.
- 13% w ferrytynie ( związek magazynujący żelazo m.in.: w jednojądrzastych makrofagach wątroby, śledziony, szpiku oraz nabłonku jelita cienkiego. Główną rolę odgrywa tu białko apoferrytyna - odbiorca żelaza dwuwartościowego.
- 12% w hemosyderynie ( koloidowa forma tlenku żelaza związanego z białkiem, tworzy się przy maksymalnym wypełnieniu depot ferrytyną, odkłada się również w jednojądrzastych komórkach fagocytujących.
- ok. 5% Fe zawarte jest w mioglobinie, poniżej 1% w enzymach np. katalazie
i cytochromach, poniżej 1% w transferynie ( beta 1 -globulina związana luźno z dwoma atomami Fe+, znajduje się w osoczu i transportuje Fe do miejsc, gdzie powstaje ferrytyna
i do dojrzewających krwinek czerwonych w szpiku.
Erytroblasty posiadają na powierzchni receptory, którymi przytrzymują transferynę i odbierają jej żelazo do syntezy Hb.
Leukocyty
Regulacja leukopoezy
1. Wpływ układu nerwowego - pobudzające działanie układu współczulnego na granulopoezę
2. Czynniki humoralne swoiste - granulopoeza regulowana jest na każdym etapie rozwoju czynnikami granulopoetycznymi ujętymi ogólną nazwą - CSF ( czynnik stymulujący powstawanie kolonii ). CSF produkowany jest przez komórki zrębu szpiku, makrofagi, pobudzone limfocyty, komórki śródbłonka oraz niektóre komórki nowotworowe. W obrębie CSF wyróżniamy:
a) eozynopoetynę - czynnik stymulujący powstawanie kolonii eozynofilnych,
b) bazopoetynę - czynnik stymulujący powstawanie kolonii bazofilnych
c) GM - CSF - czynnik stymulujący powstawanie kolonii monocytarno - makrofagowych. W dojrzałych granulocytach występuje czynnik hamujący - CIA, zapobiegający uwalnianiu CSF przez monocyty aż do następnego bodźca pobudzającego granulopoezę. D) interleukina-3 (IL-3 ) jest czynnikiem multipotencjalnym , pobudzającym do wzrostu kolonie szpikowych komórek (multi-CSF ) oddziałując na komórki pnia nieukierunkowane do proliferacji i powstawania komórek pnia ukierunkowanych. Czynniki te poza pobudzeniem komórek do wzrostu i różnicowania wywierają inne działania, powodując np. dojrzewanie krwinek, utrzymują zdolność do życia oraz zwiększają ich aktywność.
3. Czynniki humoralne nieswoiste - ACTH i glikokortykoidy zmniejszają liczbę eozynofilów
i limfocytów. Hormony przysadki mózgowej, tarczycy, rdzenia nadnerczy, estrogeny pobudzają tor szpikowy leukopoezy.
4. Czynniki niehumoralne - produkty rozpadu krwinek białych są bodźcem dla leukopoezy na drodze sprzężenia zwrotnego np. nukleotydy i RNA z rozpadłych granulocytów pobudzają granulopoezę.
Rola krwinek białych.
- obronna (nieswoista- fagocytoza, swoista - humoralna i komórkowa )
- hemostatyczna
- w zjawiskach alergicznych
Fizjologia neutrocytów
W warunkach fizjologicznych, wypełniają swoje funkcje biologiczne dzięki odpowiedniemu wyposażeniu biochemicznemu oraz zdolności do mobilizacji, chemotaksji i fagocytozy. Zasadniczym składnikiem neutrocytów są enzymy lizosomalne obecne w swoistych ziarnistościach cytoplazmatycznych. Należą do nich: enzymy degradacji kwasów nukleinowych, enzymy proteolityczne,enzymy degradujące składniki węglowodanowe i lipidowe. W ziarnistościach lizosomalnych obecne są także enzymy utleniające, czynniki bakteriobójcze oraz substancje czynne hemostatycznie. To wielostronne wyposażenie ziarnistości lizosomalnych umożliwia wielokierunkową degradację biochemiczną sfagocytowanego materiału biologicznego, zwłaszcza drobnoustrojów. Fagocytoza i degradacja obcych substancji stanowi zasadniczą funkcję neutrocytów. Funkcja ta jest spełniana dzięki ich zdolności do mobilizacji, chemotaksji i fagocytozy.
1. Mobilizacja - wzrost liczby neutrocytów we krwi obwodowej obserwuje się u chorych
z różnymi chorobami zakaźnymi i stanami zapalnymi. Dzieje się tak ze względu na szybkie uruchamianie szpikowej puli neutrocytów w ciągu niewielu godzin od zakażenia. Kinetyka mobilizacji neutrocytów regulowana jest na zasadzie sprzężeń zwrotnych i zależy od wielkości i aktualnej leukocytozy oraz od stopnia usuwania neutrocytów z krwi.
2. Chemotaksja - neutrocyty są zdolne do reagowania kierunkową migracją do danego obiektu biologicznego, najczęściej drobnoustroju, dzięki własnościom chemotaktycznym. Zjawisko chemotaksji stanowi podstawę skutecznego zapoczątkowania i stworzenia warunków do fagocytozy. Granulocyty posiadają na swojej powierzchni receptory dla chemotaksyn, które są hormonami lokomocyjnymi, wytwarzanymi przez komórki endogenne (limfocyty T, komórki tuczne, bazofile ) i egzogenne - drobnoustroje. Neutrocyty przechodzą z miejsca zapalenia przez ściany kapilarów z krwi obwodowej. Ważniejszymi czynnikami chemotaktycznymi , które mogą odgrywać rolę w tym zjawisku są proteazy tkankowe, białko A - składnik ściany komórki gronkowca oraz fibryna gromadząca się wysięku zapalnym. Jednym z głównych czynników decydującym o pojawieniu się chemotaksji jest składnik C3 dopełniacza. Usunięcie go powoduje zahamowanie gromadzenia się neutrocytów.
3. Fagocytoza
Główną funkcją granulocytów obojętnochłonnych jest fagocytoza, która jest możliwa dzięki obecności ziarnistości w cytoplaźmie : pierwotnych - ( 20% ), które dzięki posiadanym enzymom hydrolitycznym umożliwiają hydrolizę substancji pochodzenia organicznego. Ziarnistości pierwotne związane są z tlenowym mechanizmem niszczenia drobnoustrojów, odpowiadają ziarnistościom azurofilnym, które mają właściwości lizosomalne ( zawierają kwaśne hydrolazy, mieloperoksydazy, elastazy i lizozym ). Z ziarnistościami tymi związany jest układ mieloperoksydaza - H202 - halidek ( Cl , Br, J ). System ten wytwarza substancje bakteriobójcze i cytotoksyczne.
Ziarnistości wtórne - specyficzne ( 80% ) umożliwiają przeciwbakteryjne działanie neutrofilów w warunkach beztlenowych. Ziarnistości te zawierają : laktoferrynę - białko o bardzo dużym powinowactwie do żelaza i lizozym o własnościach bakteriolitycznych.
Wyposażenie przeciwbakteryjne granulocytów:
- .system zasadowych białek wywierających działanie bakteriostatyczne.
- system mało specyficznych enzymów hydrolitycznych do degradacji substancji organicznych
- system mieloperoksydaza - nadtlenek wodoru - jon halidku, wytwarzający bakteriobójcze
i cytotoksyczne substancje ( zależny od NADPH + H ). Uwalnianie oksydazy NADPH + H
z ziarnistości granulocyta inicjuje produkcję nadtlenku wodoru, który jest substratem dla mieloperoksydazy katalizującej utlenianie jonów Cl- do bardzo aktywnych jonów podchlorynowych OCl- , które utleniają grupy -SH cząsteczek białka, dezaminują niektóre aminokwasy i tworzą z chlorem trwałe połączenia typu chloramin.
Aktywacja oksydazy NADPH jest związana z gwałtownym wzrostem pochłaniania tlenu przez neutrofile oraz z przyspieszeniem ich metabolizmu ( oddychanie wybuchowe ) i O2 jest wytwarzany w reakcji:
NADPH+ H+ + 202 --------NADP+ + 2H + + 202
O2 - jest wolnym rodnikiem, jego dwie cząsteczki reagują spontanicznie tworząc H2O2
02 i H2O2 są utleniaczami i efektywnymi czynnikami bakteriobójczymi.
Poruszanie się granulocytów w procesie fagocytozy jak i ich migracja do miejsca infekcji zachodzi dzięki mikrotubulom i mikrofilamentom. Właściwa funkcja mikrofilamentów wiąże się z oddziaływaniem aktyny, którą one zawierają oraz z miozyną i białkiem wiążącym aktyne po wewnętrznej stronie błony komórkowej. Neutrofile wydzielają również tromboksan, który kurczy naczynia oraz czynniki powodujące agregację płytek krwi. Poza tym wydzielają one leukotrieny, które zwiększają przepuszczalność naczyń i przyciągają inne granulocyty do miejsca zakażenia oraz prostaglandyny, które wywierają umiarkowane działanie przeciwzapalne.
Przebieg fagocytozy
- adherencja lub immunoadherencja
- wchłanianie z wytworzeniem wakuoli trawiennej ( fagosomu )
- trawienie ( unieczynnianie i degradacja wchłoniętej substancji w następstwie połączenia się lizosomu z fagosomem i aktywacji systemu enzymów hydrolitycznych białek zasadowych oraz układu mieloperoksydazy
Granulocyty kwasochłonne - eozynocyty
Eozynocyty przejawiają aktywność fagocytarną w stosunku do bakterii i grzybów. Aktywność fagocytarna eozynocytów jest niższa niż neutrocytów. Ziarnistości lizosomalne eozynocytów zachowują się podczas fagocytozy podobnie jak ziarnistości neutrocytów. Są one zdolne do fagocytozy kompleksów antygen -przeciwciało oraz fibryny. Złogi fibryny
w wysiękach zapalnych wykazują silne działanie eozynotaktyczne, stąd ich rola
w upłynnianiu wysięków zapalnych. Po dokonaniu fagocytozy bakterii eozynocyty rozpoczynają proces biologicznej degradacji, ich aktywność bakteriobójcza jest jednak mniejsza niż neutrocytów.
Fagocytoza eozynocyta jest mniej zależna od osoczowych substancji pośredniczących
( opsonin i dopełniacza ). Eozynocyty w ziarnistościach kwasochłonnych posiadają enzym eozynoperoksydazę oraz bialko MBP ( major basic protein ), posiadają też receptory dla IgE, C3b, C3d.
Rola eozynocytów.
1. Regulacja reakcji alergicznych.
W reakcjach tych komórki tuczne wydzielają czynniki chemotaktyczne dla eozynofilów : ECF-A i ECF-C , przyciągając granulocyty kwasochłonne do miejsca reakcji alergicznej. Podobne działanie ma histamina wydzielana przez komórki tuczne.
W miejscu reakcji alergicznej eozynofile fagocytują kompleksy antygen-przeciwciało. Fagocytoza tych kompleksów wiąże się z uwalnianiem enzymów: arylosulfatazyB i histaminazy, które rozkładają dwa główne mediatory reakcji alergicznych: SRS-A ( slow reacting substance of anaphylaxis ) i histaminę.
SRS-A jest mieszaniną 3 leukotrienów: LTC4, LTD4, LTE4, powstałych w wyniku utleniania kwasu arachidonowego. Tak więc eozynofile regulują przebieg reakcji alergicznych na zasadzie sprzężenia zwrotnego ograniczając liczbę mediatorów i fagocytując kompleksy immunologiczne.
2. Zwalczanie pasożytów jelitowych
Eozynofile wchodzą w reakcje z opłaszczonymi przez przeciwciała pasożytami a niszczenie ich odbywa się przy udziale mechanizmów oksydacyjnych. Ziarna eozynofilów zawierają eozynoperoksydazę, która jest wykorzystywana w tych procesach. W niszczeniu pasożytów przez eozynofile dużą rolę przypisuje się zasadowemu białku 1, które uwolnione w procesie degranulacji eozynofilów służy jako ligand wiążąc komórkę z pasożytem. Ponadto białko to wywiera bezpośrednio niszczący wpływ na pasożyty. Białka polikationoweuwalniane z eozynofila dezintegrują błonę pasożyta.
3. Udział w reakcjach hemostazy
Syntetyzują one plazminogen (profibrynolizynę) i transportują go do zakrzepów, gdzie uczynnia się w plazminę i rozpuszcza włóknik.
4. Udział w odpowiedzi swoistej
W procesie degradacji kompleksów antygen-przeciwciało uwalniają fragmenty struktury antygenu potrzebne jako wzorzec do syntezy odpowiednich przeciwciał.
5. Uszkodzenie tkanek - cytotoksyczne działanie mediatorów uwalnianych z aktywnego eozynofila.
Granulocyty zasadochłonne - bazocyty.
Odróżnia się dwie odmiany bazocytów :
bazocyty krwi obwodowej
bazocyty tkankowe zwane komórkami tucznymi lub mastocytami
Funkcje bazocytów są ściśle związane z obecnością w tych komórkach: histaminy, serotoniny, heparyny, bradykininy, SRS-A oraz czynników chemotaktycznych dla eozynofilów ECF-A, ECF-C, które mogą uwalniać się do otoczenia po degranulacji ziarnistości cytoplazmatycznych. Degranulacja ta zachodzi w różnych reakcjach stresowych stanach alergicznych, po ekspozycji na antygeny, na które dany osobnik jest uczulony. Uwalnianie histaminy w tych warunkach ma szczególne znaczenie wobec faktu, że znaczna część histaminy obecnej we krwi znajduje się w bazocytach oraz, że komórki te biorą żywy udział w układowych reakcjach alergicznych.
Histamina wywołuje wzrost przepuszczalności naczyń, pojawienie się obrzęku
i zaczerwienienia.
Uwolnienie heparyny powoduje zmiany w układzie krzepnięcia krwi ( zwalczanie wewnątrznaczyniowej aglutynacji krwinek oraz krzepnięcie krwi w przewlekłych stanach zapalnych ), a także przyspieszenie usuwania lipemii pokarmowej ( heparyna aktywuje lipazę lipoproteinową).
Bazocyty są głównymi komórkami krwi, które wiążą przeciwciała typu IgE. Immunoglobuliny te wytwarzane są w odpowiedzi na pewien typ antygenów zwanych alergenami. Przeciwciała IgE łączą się przez receptory z błoną bazofilów. Połączenie cząsteczek IgE
z alergenem powoduje degranulację bazofila. Istnieje dość wyraźna korelacja pomiędzy stopniem uwalniania histaminy do krwi z komórek uczulonych przeciwciałami typu IgE po kontakcie z antygenem a ciężkością klinicznie stwierdzanego odczynu alergicznego. Podczas uwalniania histaminy z bazocytów dochodzi do wewnątrzplazmatycznego zlania się ziarnistości zawierających ten czynnik w większą wakuolę, która następnie jest wydalana na zewnątrz. W ten sposób degranulacja nie powoduje uszkodzenia i śmierci bazocyta.
ROLA
-ułatwiają migrację do ogniska zapalnego innych komórek biorących udział w procesach obronnych
-uczestniczą w reakcjach alergicznych - pobudzenie do uwalniania mediatorów następuje:
drogą IgE zależną - pobudzenie receptorów o wysokim powinowactwie : FcεRI
drogą IgE niezależną (ważniejsza) - składniki dopełniacza (C3a, C5a), PAF, czynniki uwalniające histaminy - HRFs
-modulują krzepnięcie i usuwanie lipemii pokarmowej
Mastocyty (bazofile tkankowe = komórki tuczne)
odgrywają istotną rolę w reakcjach alergicznych, odpowiedzi na inwazje pasożytnicze i przebudowie tkanek.
Komórki tuczne szczególnie licznie występują w okolicy naczyń krwionośnych, zwłaszcza
w błonie śluzowej nosa, przewodu pokarmowego, w błonach surowiczych i w skórze.
MONOCYTY
Powstają w szpiku, gdzie przebywają 1-3 dni .
Monocyty przebywają we krwi obwodowej 1-2 dni, po czym pod wpływem czynnika chemotaktycznego przedostają się do tkanek stając się makrofagami tkankowymi czyli histiocytami. Makrofagi są postaciami czynnościowymi monocytów. W makrofagu dochodzi do przyrostu cytoplazmy, łącznie z organellami komórkowymi, cytoplazma zmienia się na kwasochłonną, na powierzchni tworzą się ogromne pseudopodia. Makrofag może się dzielić a także ulegać fuzji z innymi makrofagami.
Makrofagi łącznie z krążącymi we krwi monocytami tworzą system fagocytów jednojądrzastych.
Makrofagi wykazują różnice morfologiczne w zależności od miejsca pobytu: komórki Browicza - Kupffera w wątrobie, makrofagi pęcherzykowe ( komórki pyłowe ) w płucach, makrofagi wolne i osiadłe w śledzionie, węzłach chłonnych i szpiku, makrofagi opłucnowe
i otrzewnowe ( jamy surowicze ), osteoklasty w kościach, mikroglej w tkance nerwowej.
Własności monocytów i makrofagów
- zdolność zmiany kształtu i ruchu,
- zdolność rozpoznania antygenu,
- zdolności chemotaktyczne,
- po rozpoznaniu antygenu, zmiana metabolizmu spoczynkowego na czynnościowy dla pokrycia kosztów energetycznych fagocytozy lub migracji.
W cytoplaźmie posiadają ziarnistości azurochłonne oraz liczne lizosomy zawierające układy bakteriobójcze, enzymy hydrolityczne oraz specyficzne lipazy. Na powierzchni błony komórkowej znajdują się liczne receptory dla fragmentu Fc IgG1, IgG3, składnika dopełniacza C3b, receptory związane z interakcją limfocytów T i B.
Monocyty cechują się wybitną reaktywnością na czynniki chemotaktyczne. Poza fagocytozą są one zdolne do pinocytozy i mikropinocytozy oraz nekrofagocytozy. Pojęcie nekrofagocytozy obejmuje fagocytozę martwych fragmentów komórkowych i resztek tkankowych. Monocyty żywo reagują chemotaktycznie na materiał martwych tkanek i komórek.
Fagocytoza stanowi jeden z elementów funkcji monocytów i makrofagów, wśród których należy wymienić:
- funkcje obronne, skierowane przeciw drobnoustrojom
- "rozpracowanie" materiału antygenowego we współdziałaniu z limfocytami
- usuwanie starych lub uszkodzonych komórek z ustroju
Biorą również udział w gojeniu ulegając transformacji w fibroblasty oraz reparacji uszkodzeń tkankowych. Badania porównawcze nad reaktywnością fagocytarną monocytów i neutrocytów wskazują, że neutrocyty są komórkami szybciej i skuteczniej reagującymi w tym zakresie. Istnieją jednak określone zakażenia jak np.: przez drobnoustroje z rodzaju Listeria i mikobakterie, w których pierwszoplanową obronną rolę odgrywa mobilizacja monocytów i makrofagów. Zwrócono uwagę na rolę makrofagów w zakresie fagocytozy cząsteczek żelaza w hemosyderozach. Komórki te są zdolne także do fagocytozy wirusów i wytwarzania interferonu.
Monocyty wydzielają tzw. monokiny - cytokiny, które są mediatorami regulującymi czynność innych komórek:
· interleukina I
· aktywator limfocytów LAF ( lymphocyte activating factor ) stymulujący syntezę DNA
w tymocytach i limfocytach T
· aktywator limfocytów B, pobudzający odpowiedź humoralną
· inhibitor podziałów limfocytów T i B
· aktywator podziałów granulocytów
· czynnik wzrostu komórek śródbłonkowych
Makrofagi mają zdolność wytwarzania i wydzielania:
· substancji cytotoksycznych
· białek układu dopełniacza ( C1d, C2, C3, C4, C5, czynniki białkowe dla drogi klasycznej
i alternatywnej
· interferonu - czynnika antywirusowego, który służy różnym komórkom jako czynnik regulujący uruchomienie reakcji obronnych i homeostatycznych, chroni niezakażone komórki przed infekcją wirusową
· PAF - czynnik aktywujący płytki
· pirogenu endogennego
· apolipoproteiny E - uczestniczącej w transporcie cholesterolu i triacylogliceroli do wątroby
Wyszukiwarka
Podobne podstrony:
Fizjologiawyklad 07[1][1].05, medyczne różne, fizjologia
krew pto, Ratownicto Medyczne, Pato i Fizjologia, PATOFIZJOLOGIA
wykl hormon, medyczne różne, fizjologia
17158-hormony (2), medyczne różne, fizjologia
fizjologia wyklad - zagadnienia, medyczne różne, fizjologia
test fizjologii z odpowiedziami (1), medyczne różne, fizjologia
uklad kr±zenia, Ratownictwo Medyczne, Testy różne, Fizjologia
S stomat miesnie pobudliwosc i krew, II ROK STOMATOLOGIA SUM ZABRZE, FIZJOLOGIA, SEMINARIUM I
Test ukł.moczowego, Ratownictwo Medyczne, Testy różne, Fizjologia
uklad rozrodczy, Ratownictwo Medyczne, Testy różne, Fizjologia
uklad mie¶niowy, Ratownictwo Medyczne, Testy różne, Fizjologia
SEM Krew, II ROK STOMATOLOGIA SUM ZABRZE, FIZJOLOGIA, FIZJOLOGIA, Najlepiej opracowane pyt SEM, EXAM
Test ratownicy 2011, Ratownictwo Medyczne, Testy różne, Fizjologia
krew, II rok, fizjologia
Urazy u dzieci, medyczne różne, pediatria
Kinazy białkowe2, Ratownictwo medyczne, Patofizjologia, Fizjologia
SEM-15WF2011 - Metabolizm nukleotydow pur i pyr, Studia, I semestr II rok, Biochemia, Różne
więcej podobnych podstron