FUNKCJE PIERWIASTKÓW W UKŁADACH BIOLO-GICZNYCH
1. Podział składników nieorganicznych występujących w organizmie człowieka
Składniki nieorganiczne występujące w organizmie człowieka można podzielić, zależnie od ilości niezbędnych dla jego prawidłowego funkcjonowania, na następujące grupy:
makropierwiastki (pierwiastki główne lub składniki mineralne),
mikropierwiastki (pierwiastki śladowe).
Makropierwiastki stanowią 99,4% masy ciała, należą do nich: O, C, H, N, Ca, P, Na, K, Cl, S i Mg. Tlen, węgiel, wodór i azot dostarczane są z dietą (białka, tłuszcze, węglowodany) zwykle w wystarczających ilościach
i występują w materiale biologicznym w stężeniach większych niż 1 mg/g tkanki. Pozostałe makropierwiastki potrzebne są w diecie w ilościach większych niż 100 mg w ciągu doby.
Mikropierwiastki są niezbędne w wielu podstawowych procesach życiowych i występują w organizmie ludzkim w niewielkich stężeniach wyrażanych w μg/g lub ng/g tkanki oraz w μmol/l lub nmol/l krwi, surowicy, moczu, itp. Zapotrzebowanie na pierwiastki śladowe dostarczane z dietą jest mniejsze niż 100 mg/dobę. W zależności od biologicznego znaczenia dla organizmu można je podzielić następująco:
istotne, nazywane również niezbędnymi: żelazo, cynk, miedź, mangan, jod, molibden, kobalt, selen, chrom, fluor,
przypuszczalnie istotne: nikiel, cyna, wanad, krzem,
nieistotne: glin, bor, german, kadm, arsen, antymon, bizmut, ołów, rtęć, rubid, srebro, tytan.
Zgodnie z definicją zaproponowaną w 1981 roku przez Mertza, pierwiastek śladowy uważany jest za niezbędny dla organizmu człowieka, gdy jego niedobór, spowodowany niedostatecznym dostarczaniem z dietą, prowadzi do zaburzeń funkcjonowania organizmu; podanie go w dawce fizjologicznej zapobiega zaburzeniom lub je usuwa.
Zaliczenie pierwiastka do odpowiedniej grupy zależy od wielu czynni-
ków, w tym od wymaganej obecności w diecie, toksyczności, powiązań
z objawami chorób. Istotne pierwiastki śladowe wchodzą w skład enzymów (Cu, Zn, Mn, Se), hormonów (J), witaminy B12 (Co) oraz metaloprotein (Fe w hemoglobinie i mioglobinie, Cu w ceruloplazminie i Zn
w metalotioneinie). F może być uważany za istotny, gdyż jony F- odgrywają znaczną rolę w zapobieganiu próchnicy zębów i prawdopodobnie osteoporozy, choć nie udowodniono jednoznacznie, że jest niezbędny dla człowieka. Niektóre z pierwiastków śladowych nie odgrywają żadnej istotnej roli w procesach biochemicznych, a w organizmie człowieka znajdują się jedynie w wyniku oddziaływania środowiska. Większość nieistotnych pierwiastków śladowych można znaleźć w tkankach, gdyż ich zawartość w wodzie, powietrzu i żywności wzrasta w związku z działalnością człowieka w przemyśle i rolnictwie. Wybrane makropierwiastki
i mikropierwiastki, ich przybliżone zawartości w organizmie człowieka
i główne funkcje przedstawia tabela 1.
Tab. 1. Wybrane makro- i mikropierwiastki w organizmie człowieka
Pierwiastek |
Zawartość (g)* |
Funkcja |
||
Makropierwiastki |
||||
Wapń |
1200 |
elektrolit, aktywator enzymów |
||
Potas |
140 |
elektrolit, aktywator enzymów |
||
Sód |
95 |
równowaga gospodarki wodno-elektrolitowej |
||
Magnez |
35 |
elektrolit, aktywator enzymów |
||
Mikropierwiastki |
||||
Żelazo |
5 |
składnik metaloenzymów, aktywator enzymów |
||
Cynk |
4 |
składnik metaloenzymów, aktywator enzymów |
||
Miedź |
0,15 |
składnik metaloenzymów |
||
Jod |
0,03 |
składnik hormonu tyroidowego |
||
Mangan |
0,02 |
składnik metaloenzymów, aktywator enzymów |
||
Molibden |
0,02 |
składnik metaloenzymów |
||
Wanad |
0,02 |
udział w procesach redoks |
||
Selen |
0,015 |
udział w procesach redoks |
||
Nikiel |
0,01 |
składnik metaloenzymów |
||
Kobalt |
0,003 |
składnik witaminy B12, aktywator enzymów, |
||
* - dane dotyczą organizmu mężczyzny o masie ciała 70 kg
Wszystkie istotne pierwiastki śladowe mogą być toksyczne, jeśli dostarczane są do organizmu w ilościach znacznie przewyższających zapotrzebowanie. Ich niezbędność jest ograniczona i zależy od takich czynników jak stopień utlenienia czy ilość pierwiastka podawana z dietą. Dla pierwiastków powszechnie uważanych za toksyczne, jak np. As, Cd, Hg i Pb wymagane jest szczególnie precyzyjne odróżnienie niedoboru od stężenia prawidłowego i terapeutycznego oraz dawki toksycznej. Zależność efektu fizjologicznego, wywołanego przez dany pierwiastek, od dawki dostarczanej z dietą przedstawia rycina 1.
Ryc. 1. Zależność efektu fizjologicznego wywołanego przez pierwiastki śladowe zależnie od ich dziennej dawki. A - całkowity niedobór, B,C,D - niedobór o różnym nasileniu, E - dawka fizjologiczna, prawidłowa, F - efekt farmakologiczny, G - przewlekły nadmiar, chroniczne zatrucie, H - ostre działanie toksyczne, dawka śmiertelna.
2. Specyficzność działania pierwiastków śladowych
Działanie pierwiastków śladowych in vivo jest całkowicie specyficzne. Niedobór pierwiastka może być zlikwidowany wyłącznie przez ten sam,
a nie inny, choć pierwiastek chemicznie podobny do niego. Wysoka specyficzność in vivo wiąże się z działaniem specyficznych białek przenoszących, które rozpoznają odpowiedni pierwiastek i dostarczają do miejsca jego działania. Specyficzność pierwiastka związana jest z takimi jego właściwościami jak: wartościowość, potencjał redox, promień jonowy, liczba koordynacyjna, geometria koordynacji oraz powinowactwo do ligandu. Specyficzność działania pierwiastków śladowych jest znacznie mniejsza in vitro. Zastąpienie w warunkach in vitro pierwiastka przejściowego, właściwego dla danego enzymu, przez inny, także przejściowy, powoduje zmianę powinowactwa enzymu do substratu. Zarówno makropierwiastki jak i istotne pierwiastki śladowe zachowują subtelną równowagę między sobą, która ma często duże znaczenie fizjologiczne. Przykładem jest proces kostnienia, który wymaga odpowiedniej relacji stężeń wapnia i fosforu. Stosunek molowy Ca:P w pożywieniu dorosłego człowieka powinien wynosić 1:1. Nadmierne spożycie fosforu (w postaci fosforanów powszechnie dodawanych do żywności) przy niedostatecznym przyjmowaniu wapnia może prowadzić do niedoboru Ca w organizmie. Prawidłowy stosunek potasu do wapnia w płynie pozakomórkowym jest niezbędny dla zachowania właściwej aktywności mięśni.
Stężenie pierwiastków w ustroju regulowane jest przez homeostazę.
Metabolizm jednego pierwiastka nie pozostaje jednak bez wpływu na przemianę innych, szczególnie w stanach niedoboru lub nadmiaru jednego z nich. Interakcje te dotyczą wówczas ich wchłaniania i transportu
i mogą być pozytywne (synergiczne) lub negatywne (antagonistyczne). Przykładami są między innymi długotrwały niedobór miedzi prowadzący do anemii w wyniku obniżenia wchłaniania żelaza i wzrost jego stężenia w wątrobie, współzawodnictwo miedzi i cynku w ich wchłanianiu oraz niedobór miedzi spowodowany nadmiarem molibdenu w diecie.
3. Wchłanianie i przenoszenie pierwiastków śladowych w ustroju
Większość pierwiastków tworzy sole i inne związki słabo rozpuszczalne w wodzie, co powoduje, że nie ulegają całkowitemu wchłanianiu w prze-
wodzie pokarmowym lecz są w znacznej części wydalane z ustroju (z wyjątkiem sodu i potasu). Wchłanianie pierwiastków odbywa się z udziałem
specyficznych białek transportowych (specific carrier protein), których synteza jest czynnikiem kontrolującym ich poziom i metabolizm w ustroju (tab. 2).
Tab. 2. Związki przenoszące pierwiastki śladowe w osoczu
Pierwiastek |
Albuminy |
Globuliny |
Aminokwasy |
Co |
|
++ (Tb) |
|
Cr |
+ |
++ (Tf) |
|
Cu |
+ |
++ (Cp) |
+ |
Fe |
|
++ (Tf) |
|
Mn |
+ |
++ (Tf, α2MG) |
|
Mo |
|
+ |
|
Se |
+ |
+ |
+ |
Zn |
+ |
+ (α2MG) |
|
Tb - transkobalamina II, białko wiążące witaminę B12,
Cp - ceruloplazmina,
Tf - transferyna,
α2MG - α2-makroglobulina
Na proces wchłaniania pierwiastków w przewodzie pokarmowym wpły-wają związki chelatujące /fitany, szczawiany/, białka, tłuszcze, włóknik
w diecie oraz inne składniki mineralne. Stężenie pierwiastków w ustroju, regulowane przez procesy wchłaniania i wydalania, nie zawsze odzwierciadla dawkę dostarczoną do organizmu, wyraża raczej równowagę między ilością wchłoniętą, wykorzystaną, przechowywaną i wydalaną. Wydalanie pierwiastków odbywa się głównie przez nerki, część jest wydzielana do soków trawiennych i żółci, a następnie usuwana z kałem (tab. 3).
Objawy niedoboru składników mineralnych są rzadkie u osób, których dieta obejmuje różnorodne pożywienie. Niedobór, jeśli pojawia się, jest zwykle wynikiem złego wchłaniania, nadmiernego krwawienia (Fe), choroby nerek (Ca) lub innych. Objawy zatrucia mogą być wywołane nadmiernym spożyciem prawie wszystkich pierwiastków, pojawiają się również, gdy zawodzi kontrola wchłaniania.
Tab. 3. Drogi wydalania pierwiastków śladowych
Pierwiastek |
Żółć |
Mocz |
Sok trzustkowy |
Pot |
Martwe komórki śluzowe |
Co |
|
++ |
|
|
|
Cr |
|
++ |
|
|
|
Cu |
++ |
|
|
|
|
Fe |
|
|
|
|
+ |
Mn |
++ |
|
|
|
|
Mo |
+ |
+ |
|
|
|
Se |
+ |
+ |
|
|
|
Zn |
++ |
+ |
++ |
+ |
|
4. Funkcje jonów metali w układach biologicznych
Najważniejsze funkcje jonów metali w układach biologicznych to:
katalityczna,
strukturalna,
transportowa,
udział w przekazywaniu sygnałów hormonalnych,
udział w obronie organizmu przed wolnymi rodnikami,
udział w strukturze leków.
Funkcja katalityczna polega na bezpośrednim udziale jonów metali w reakcjach enzymatycznych w formie metaloenzymów lub aktywatorów enzymów (omówienie w pkt. 5.).
Funkcja strukturalna lub podporowa jonów metali polega na ich udziale
w utrzymywaniu trwałej struktury pewnych biocząsteczek lub ich części. Funkcję tę spełniają jony Ca2+ w strukturze kości i zębów, gdzie występują w hydroksyapatycie o wzorze sumarycznym Ca(OH)2⋅3Ca3(PO4)2. Podobną rolę spełniają jony F-, gdy zastępują jony OH- w hydroksyapatycie zgodnie z reakcją przebiegającą dwuetapowo:
F- + Ca(OH)2 . 3Ca3(PO4)2 Ca(OH)F . 3Ca3(PO4)2 + OH-
hydroksyapatyt hydroksyfluoropatyt
F- + Ca(OH)F . 3Ca3(PO4)2 CaF2 . 3Ca3(PO4)2 + OH-
fluoroapatyt
Wymiana jest możliwa ze względu na ten sam ładunek i podobną wielkość obu jonów.
Jony Ca2+ wchodzą w skład termolizyny, białka, które zawiera ponadto jony Zn2+ w miejscu aktywnym.
Funkcję transportową wykazują białka wiążące jony metali i przenoszące je w organizmie. Białka te nazywane są metaloproteinami. Wiążąc określone jony metali regulują zależne od nich procesy, niektóre z nich wykazują również aktywność enzymatyczną. Metaloproteiny wykazują różną specyficzność wobec jonów różnych metali. Do grupy tej należy albumina (wiąże i transportuje jony Ca2+, Cu2+, Zn2+), transferyna (Fe3+, Zn2+, Mn2 i Cr3+), ceruloplazmina (Cu+ i Cu2+), α2-makroglobulina (Zn2+). Szczególnym przykładem metaloproteiny jest metalotioneina (Mt), białko wiążące Zn2+, Cu2+, Cd2+, Hg2+ i inne metale ciężkie. Mt chroni więc organizm przed toksycznymi metalami.
Udział w przekazywaniu sygnałów hormonalnych zależnie od pierwiastka odbywa się w różny sposób. Jon Ca2+ jest śródkomórkowym przekaźnikiem w mechanizmie działania hormonów, np. wazopresyny i katecholamin α-adrenergicznych w regulacji przemiany glikogenu w wątrobie. Jod stanowi integralną część trijodotyroniny i tetrajodotyroniny (tyroksyny), czyli hormonów tarczycy.
Udział w obronie organizmu przed wolnymi rodnikami mają głównie pierwiastki uczestniczące w usuwaniu z tkanek silnych utleniaczy, do których należy nadtlenek wodoru H2O2 oraz wolne rodniki, takie jak anionorodnik ponadtlenkowy⋅ O2*-, rodniki nadtlenkowy ROO* i R* oraz rodnik wodorotlenowy HO*.
Enzym peroksydaza glutationowa (glutathione peroxidase, GPx) zawierająca selen, katalizuje reakcję usuwania H2O2 z erytrocytów, działa również na inne nadtlenki organiczne. Dysmutaza ponadtlenkowa (superoxide dismutase, SOD) usuwająca ponadtlenek O2*- z tkanek ogranicza toksyczność tlenu w organizmie. Enzym ten obecny jest w cytoplazmie
i składa się z dwóch podjednostek zawierających po jednym jonie Cu2+
i Zn2+ (Cu,Zn-SOD), zaś obecny w mitochondriach zawiera jon Mn2+ (Mn-SOD).
Inne funkcje jonów metali związane są z ich obecnością w lekach, np.
w leczeniu przewlekłego reumatoidalnego zapalenia stawów stosowany jest tiojabłczan złota (I):
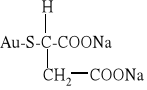
W leczeniu nowotworów stosowane są pochodne platyny (II) i (IV), np. cis-dichlorodiaminoplatyna(II) o wzorze cis-[Pt(NH3)2Cl2] (tzw. cisplatyna) oraz inne:
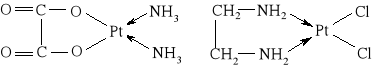
szczawianodiamoplatyna(II) dichloro(etylenodiamino)platyna(II)
Leki te działają w komórce, gdzie produkt ich hydrolizy reaguje z DNA uniemożliwiając replikację komórki.
5. Udział makro- i mikropierwiastków w reakcjach enzymatycznych
Ponad 25% wszystkich znanych enzymów zawiera mocno lub słabo związane jony metali. Wyróżnia się zatem:
metaloenzymy,
enzymy aktywowane przez jony metali.
Metaloenzymy zawierają określoną ilość jonów metali, które są silnie związane z apoenzymem (część białkowa enzymu) i pozostają w oczysz- czonej cząsteczce enzymu. Wśród metaloenzymów wyróżnia się takie,
w których jon metalu zachowuje się jak kwas Lewisa i nie zmienia stopnia utlenienia w czasie katalizowanej reakcji (głównie Zn2+, Mn2+, Ni2+, Mg2+, Ca2+ w reakcjach np. hydrolizy, dekarboksylacji, transaminacji)
oraz te, w których jon metal ulega procesom redox (np. Cu+/2+ i Fe2+/3+
w cytochromach).
Enzymy aktywowane przez jony metali nie wiążą ich tak trwale jak metaloenzymy, jednak bez jonu metalu w cząsteczce nie wykazują działania katalitycznego w reakcjach enzymatycznych.
Rozróżnienie między metaloenzymami a enzymami aktywowanymi przez jony metali opiera się więc na różnym powinowactwie enzymów do
jonów metali. Podział ten jest jednak niezbyt ścisły, gdyż znane są przykłady klasyfikacji enzymu na pograniczu obu grup. Wiele enzymów zachowuje jony metali w czasie poddawania ich zwykłym procesom oczyszczania, lecz traci je w czasie oczyszczania w obecności czynników chelatujących. Enzym traci wtedy aktywność i odzyskuje ją po dodaniu jonów metalu.
Oddziaływanie jonu metalu i enzymu jest podobne w obu grupach. Zadaniem jonów metalu jest stworzenie warunków wstępnych w apoproteinie do związania substratu.
Jon metalu (M), enzym (E) i substrat (S) tworzą kompleksy potrójne
w prostym stosunku stechiometrycznym 1:1:1 zgodnie z czterema możliwymi schematami:
kompleks z mostkiem enzymatycznym M _ E _ S
kompleks z mostkiem substratowym E _ S _ M
kompleks z mostkiem metalowym E _ M _ S
kompleks cykliczny z mostkiem metalowym
Wszystkie cztery schematy możliwe są w przypadku enzymów aktywowanych przez jony metali. Metaloenzymy nie tworzą kompleksu z mostkiem substratowym, gdyż posiadają one jony metalu połączone z apoenzymem (tzn. istnieją już w postaci E-M).
6. Mechanizm oddziaływania jonów metali na aktywność enzymów
Jony metali mogą brać udział w reakcjach enzymatycznych i zwiększać ich szybkość uczestniczyć w jednym z czterech mechanizmów:
ogólnej katalizie kwasowo-zasadowej,
katalizie kowalencyjnej,
przybliżaniu związków reagujących,
indukowaniu odkształceń enzymu lub substratu.
Jony metali (Mn+), podobnie jak protony, są kwasami według teorii Lewisa, a więc elektrofilami (czynnik elektrofilowy, E+) i dlatego mogą:
akceptować parę elektronów tworząc wiązanie σ, a także akceptować elektrony wiązania π związków organicznych,
aktywować związki nukleofilowe (czynnik nukleofilowy, N-) przyjmując elektrony i tworząc wiązanie σ lub π,
aktywować związki elektrofilowe lub same działać jako nukleofile oddając elektrony jony metali,
"maskować" związek nukleofilowy i w ten sposób zapobiegać reakcji ubocznej.
Sfera koordynacyjna jonu metalu może spowodować przybliżenie enzymu i substratu lub odkształcenie enzymu bądź substratu umożliwiając powstanie chelatu, a więc kompleksu enzym-substrat-jon metalu. Zdolność sfery koordynacyjnej metalu do działania jako trójwymiarowa
matryca i utrzymania grup reagujących w swoistej orientacji przestrzennej ma decydujące znaczenie w stereochemicznej kontroli reakcji katalizowanej enzymatycznie. Rycina 2 przedstawia kompleks adenozynotrifosforanu (ATP) z jonami Mg2+. Jon metalu, związany koordynacyjnie
z dwiema grupami fosforanowymi, zmniejsza anionowy charakter ATP, który dzięki temu może zbliżyć się do elektroujemnej cząsteczki nukleofila.
7. Pierwiastki ultraśladowe
Począwszy od lat siedemdziesiątych XX wieku sugerowano, by do listy pierwiastków śladowych dodać kilkanaście nowych. Nazywane są one pierwiastkami ultraśladowymi, gdyż ich dzienne zapotrzebowanie dla człowieka jest mniejsze niż 1 mg i zazwyczaj wyrażane w μg/dzień.
Do grupy tej zaliczanych jest obecnie 20 pierwiastków: Al, As, B, Br, Cd, Co, Cr, F, Ge, J, Li, Mn, Mo, Ni, Pb, Rb, Se, Si, Sn i V. Istotność Co, J, Mn, Mo i Se dla ludzi została jednoznacznie ustalona w oparciu o ich specyficzne funkcje biochemiczne. Dla pozostałych 15 pierwiastków jest wciąż dyskutowana. W świetle nowych badań, niektóre z nich, a zwłaszcza As, B, Cr, Ni, Si oraz V, wzbudzają zainteresowanie z uwagi na moż-
liwe korzystne działanie kliniczne lub farmakologiczne. O możliwym znaczeniu pierwiastków ultraśladowych w żywieniu człowieka można wnioskować jedynie z badań na zwierzętach. Przenoszenie na ludzi danych doświadczalnych otrzymanych dla zwierząt jest trudne, jednak uważa się, że pierwiastki istotne dla zwierząt mogą być w większości istotne także dla człowieka.
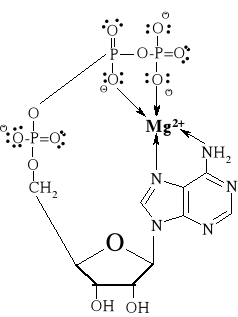
Ryc. 2. Kompleks adenozynotrifosforanu (ATP) i jonu
8. Funkcje i przemiany makropierwiastków i istotnych pierwiastków śladowych
Makropierwiastki
Wapń
Wapń jest głównym składnikiem kości i zębów, szkielet człowieka zawiera około 95-99% Ca w postaci kryształów hydroksyapatytu. Ca zawarty
w kościach ulega powolnej wymianie z płynem pozakomórkowym. Stężenia Ca w płynie pozakomórkowym i okostnowym zależne są w znacznym stopniu od regulowanej hormonalnie równowagi między procesami tworzenia i resorpcji kości.
Wchłanianie Ca zależne jest od zapotrzebowania tkanek i wymaga białek wiążących. Stężenie w osoczu regulowane jest przez witaminę D, parathormon (PTH), kalcytoninę, zmniejszane jest przez szczawiany i fitany.
Wapń występuje w surowicy krwi w trzech formach pozostających
w równowadze. Jedną z nich jest frakcja niedyfundująca, do której należy wapń związany z albuminą (około 45% Ca). Frakcja dyfundująca obejmuje połączenia jonów Ca2+ z mleczanami, wodorowęglanami, fosforanami, siarczanami, cytrynianami i innymi anionami (około 5% Ca) oraz pulę dyfundujących jonów, tzw. zjonizowanych (około 50% Ca). Fizjologicznie aktywną formą jest wapń zjonizowany. Wapń zjonizowany
i związany z białkami pozostają w równowadze, która zależy od pH krwi. Obok podstawowej roli w budowie kości i zębów, Ca jest niezbędny dla prawidłowego rytmu serca i pobudliwości nerwowej, działania hormonów oraz w procesie krzepnięcia krwi, skurczu mięśni, wydzielania enzymów trawiennych, wydzielania i działania wielu hormonów. Ca jest związany
z przenoszeniem informacji i materii przez błonę komórkową. Stężenie Ca komórkowego wynosi około 10-7 mol/l (dla porównania stężenie Ca
w płynie pozakomórkowym wynosi około 10-2 mol/l. Wewnątrzkomórkowe stężenie Ca jest utrzymywane przez Ca2+ -ATPazę obecną w błonie komórkowej.
Fosfor
Około 80% fosforu w organizmie człowieka obecne jest w połączeniu
z jonami wapnia w kośćcu i zębach w postaci hydroksyapatytu. Pozostała część fosforu obecna jest w wielu związkach organicznych jak estry fos-
foranowe, w kwasach nukleinowych, trifosforanach nukleozydów, (zwłaszcza ATP), fosfolipidach błonowych i fosforanach węglowodanów. Przestrzeń poza- i wewnątrzkomórkowa zawiera fosforany w podobnych ilościach. Stężenie fosforanów w połączeniach nieorganicznych w surowicy dzieci zawarte jest w zakresie 1,0-1,5 mmol/l, a u dorosłych 0,75-1,25 mmol/l. Wartości te zmieniają się w ciągu dnia, zwłaszcza po posiłkach. Stężenia wapnia i fosforanów w surowicy bliskie są iloczynowi rozpuszczalności fosforanu wapnia, jednak nie dochodzi do jego wytrącenia, ponieważ 45% wapnia i 10% nieorganicznych fosforanów związane jest z białkami. Pozostała część fosforanów w surowicy obecna jest w postaci buforu fosforanowego.
Fosforany biorą udział w przemianie tłuszczów i węglowodanów, wymianie energii poprzez reakcje utleniania sprzężone z fosforylacją. Fosforany nieorganiczne są substratami w reakcjach fosforylacji oksydacyjnej, metabolizmie glikogenu, syntezie nukleozydów, a także wielu innych reakcjach.
Szkielet człowieka jest głównym magazynem wapnia i fosforu, a jednocześnie dynamiczną tkanką, w której wapń i fosfor są ciągle odkładane
i uwalniane. Mineralizacja kości rozpoczyna się od etapu tworzenia
zarodków krystalizacji, po którym następuje wytrącanie fosforanu wapnia
z otaczającego organiczną matrycę płynu śródmiąższowego. Początkowo tworzy się amorficzny (bezpostaciowy) depozyt, który ma skład bruszytu (CaHPO4 ⋅ 2H2O). Minerał ten przekształca się w hydroksyapatyt, twardy, krystaliczny związek o składzie Ca10 (PO4)6 (OH)2. Inkorporacja jonów fluorkowych do kości i zębów powoduje zwiększenie proporcji postaci krystalicznej i amorficznej fosforanu wapnia, co zwiększa twadrość minerału. Fosforany wapnia są słabo rozpuszczalne w wodzie, a ich wytrącanie może wzrosnąć w wyniku zwiększenia iloczynu stężeń jonów Ca2+ i PO43- prawdopodobnie przez działanie fosfatazy alakalicznej na fosforany cukrowców i pirofosforany w macierzy kości. Alkaliczna fosfataza może regulować mineralizację kości przez hydrolizę pirofosforanów, które są inhibitorem mineralizacji in vitro. Rozpuszczalność mineralnego składnika kości wzrasta w roztworze o niskim pH. Jony wodoru niezbędne do tego procesu pochodzą z dysocjacji kwasów organicznych i H2 CO3.
Homeostaza Ca i P regulowana jest przez dietę, witaminę D i jej metabolity, PTH i kalcytoninę.
Magnez
Mg jest czwartym, po Na, K i Ca, kationem obecnym w organizmie człowieka i drugim po K w płynie wewnątrzkomórkowym. Jon Mg2+ jest niezbędny dla przebiegu wielu enzymatycznych reakcji, zwłaszcza tych,
w których uczestniczy również ATP bierze udział w reakcjach fosforylacji zależnych od ATP. Jony magnezu wiązane są również przez inne nukleotydy i uczestniczą w replikacji, transkrypcji i translacji DNA. Przestrzeń zewnatrzkomórkowa, zawierająca tylko 1 % Mg, stanowi wraz
z kośćcem łatwo wymienialną pulę, która pozostaje stabilna nawet przy znacznych zmianach stężenia Mg w surowicy. Mg jest antagonistą Ca, działa paraliżująco na układ mięśniowy.
Stężenie Mg w osoczu wynosi 0,75-1,25 mmol/l, z czego 20-25% związane jest z białkami. Podobnie jak w przypadku Ca, biologicznie aktywną frakcją jest pula zjonizowanych, wolnych jonów Mg2+.
Wchłanianie Mg przyjmowanego z dietą jest w miarę stałe i wynosi 25-65% dostarczanej dawki, odbywa się głównie w jelicie cienkim i w niewielkiej ilości w jelicie grubym. Stężenie Mg w surowicy utrzymywane jest w zakresie normy w wyniku reabsorbcji w nerkach. Zaledwie 3-5% Mg wydalane jest z moczem i zależy od stężenia w osoczu. PTH zwiększa, zaś aldosteron reabsorpcję Mg w nerkach i wzmaga jego wydalanie z moczem.
Funkcje sodu, potasu i chloru są ze sobą ściśle powiązane. Znajdują się we wszystkich płynach ustrojowych i tkankach organizmu człowieka. Sód i chlor występują głównie w płynie pozakomórkowym i osoczu krwi,
a potas w płynie wewnątrzkomórkowym. Pierwiastki te biorą udział w regulacji następujących funkcji organizmu:
gospodarki wodno-elektrolitowej,
równowagi kwasowo-zasadowej,
utrzymania ciśnienia osmotycznego,
zapewnienia prawidłowej pobudliwości nerwowo-mięśniowej (utrzymanie różnicy potencjałów między neuronami i komórkami mięśni).
Sód i potas są składnikami Na+,K+-ATPazy, ich metabolizm jest kontrolowany przez aldosteron, ulegają szybkiemu wchłanianiu, wydalanie
odbywa sie przez nerki. Pierwiastki te występują obficie w żywności
i niedobory spowodowane nieprawidłowym żywieniem nie występują.
Siarka jest składnikiem aminokwasów (cysteina, metionina), białek włosów (keratyna), a także insuliny i glutationu. Nadmiar siarki usuwany jest w moczu głównie w postaci siarczanów.
Istotne pierwiastki śladowe (mikropierwiastki)
Miedź
Miedź jest pierwiastkiem śladowym niezbędnym dla ludzi i zwierząt.
Organizm dorosłego człowieka zawiera 70-100 mg Cu. Największe stężenie występuje w wątrobie, mózgu, sercu i nerkach. Stężenie Cu w surowicy zawarte jest w przedziale 11,0-24,4 μmol/l, a ceruloplazminy (Cp), białka wiążącego ponad 90% Cu w osoczu, wynosi 200-400 mg/l. W ludzkich erytrocytach stężenie Cu wynosi 1,0-1,4 μg/ml, z czego 60% związane jest przez dysmutazę ponadtlenkową (Cu,Zn-SOD).
Wiele enzymów wymaga obecności jonów miedzi. W układach biologicznych jony miedzi występują w postaci Cu+ i Cu2+, Możliwe jest utworzenie Cu3+ w produktach pośrednich niektórych reakcji enzymatycznych oraz w układach nieorganicznych. Liczba koordynacyjna jonów miedzi wynosi 4, w niektórych produktach pośrednich może wynosić od 2 do 6. Zdolność oddawania i przyjmowania elektronów sprawia, że miedź bierze udział głównie w reakcjach typu redoks i wchodzi w skład oksydoreduktaz. Ważniejsze enzymy zawierające jony miedzi i ich funkcje przed-stawia tabela 4.
Tabela 4. Ważniejsze enzymy wiążące jony miedzi i ich funkcje.
Enzym |
Funkcje |
Oksydaza cytochromowa c Dysmutaza ponadtlenkowa
Ceruloplazmina
Tyrozynaza Oksydaza lizylowa
β-Oksydaza dopaminowa Oksydazy aminowe |
Transport elektronów w mitochondriach Usuwanie (dysmutacja) anionorodników ponadtlenkowych Transport Cu w osoczu, aktywność ferroksydazowa - utlenianie Fe2+ do Fe3+ Synteza melaniny Oksydacyjna deaminacja lizyny podczas tworzenia wiazań krzyżowych w kolagenie i elastynie Synteza noradrenaliny i adrenaliny Deaminacja amin pierwszorzędowych |
W organizmie ssaków jony miedzi są wchłaniane w żołądku i jelicie cienkim, w 40-70% puli dostarczonej w diecie. Tworzenie kompleksów jonów miedzi z L-aminkwasami i peptydami oraz kwas askorbinowy ułatwiają wchłanianie tego pierwiastka. Jony miedzi są transportowane do wątroby, skąd w połączeniu z białkami, głównie Cp, wydzielane są do krwi. W surowicy krwi w transporcie Cu uczestniczy Cp, albumina i aminokwasy. Metalotioneina (Mt) posiada duże powinowactwo do jonów miedzi, wiążąc je powoduje wydalanie z during the sloughing of cells. Wysokie spożycie cynku indukuje syntezę Mt w komórkach mucosal
i powoduje zmniejszenie wchłaniania miedzi. Miedź wydalana jest głównie do żółci, w znacznie mniejszym stopniu z moczem i potem. Toksyczne stężenia miedzi w organizmie człowieka występują rzadko, jedynie
w przypadku spożycia nadmiaru soli miedzi oraz w chorobach wątroby wiążących się z zaburzeniami przepływu żółci.
Ceruloplazmina jest α2 -globuliną, syntetyzowana jest w wątrobie w postaci apoproteiny i po związaniu 6-7 jonów miedzi wydzielana do osocza w postaci holobiałka. Aktywność ferroksydazowa Cp wiąże się z utlenianiem jonów Fe2+ do Fe3+ i przebiega zgodnie z reakcją przedstawioną
na ryc. 3.
Cp-Cu2+ + Fe2+ → Cp-Cu2+-Fe+ → Cp-Cu+-Fe3+ → Cp-Cu+ + Fe3+
k4 k5
Cp-Cu+ → Cp-Cu+* + O2 + 4H+ → Cp-Cu2+ + 2H2O
Ryc. 3. Reakcje utleniania Fe(II) do Fe(III) z udziałem ceruloplazminy.
Dzięki tej właściwości Cp, jony żelazawe nie biorą udziału w reakcji Fentona generującej wolne rodniki (Fe2+ + H2O2 → Fe3+ + HO⋅ + OH-),
a jony Fe3+ wiązane są przez transferynę i ferrytynę. Nadtlenek wodoru nie jest wolny rodnikiem, lecz jako utleniacz w obecności jonów Fe2+ generuje bardzo reaktywny rodnik wodorotlenowy.
Jony Cu+ wnikają do komórek głównie dzięki receptorom Cp znajdującym się w błonie plazmatycznej, a także połączone z albuminą i w kompleksie z histydyną. W komórkach jony miedzi wiązane są przez liczne białka, w tym SOD, oksydazę cytochromową i inne enzymy. W wiązaniu
jonów miedzi w komórkach najważniejszą rolę odgrywa glutation (GSH),
tripeptyd redukujący jony Cu2+ i kompleksujący jony Cu+. W hepatocytach 60 % miedzi związane jest z GSH i kompleks ten wykorzystywany jest do syntezy Mt, Cp i SOD. Jony miedzi transportowane są z komórek przez Cu-ATPazy.
Cu-ATPaza należy do grupy rozpowszechnionych enzymów określanych jako ATPazy typu P, które są integralnymi białkami błonowymi odpowiedzialnymi za aktywny transport jonów takich jak H, Na, K, Ca i innych, przez błonę plazmatyczną i błony organelli wewnątrzkomórkowych, wbrew gradientowi ich stężeń.
Cu,Zn-SOD przekształca anionorodniki ponadtlenkowe w nadtlenek wodoru i tlen cząsteczkowy w bardzo szybkiej reakcji dysmutacji:
O2• − + O2• − + 2H+ → H2O2 + O2
Wszystkie poznane SOD posiadają w cząsteczce przynajmniej jeden jon metalu z grup pierwiastków przejściowych (miedź, cynk, żelazo, mangan). U organizmów eukariotycznych występują trzy główne izoenzymy: komórkowa i pozakomórkowa Cu,Zn-SOD oraz mitochon- drialna Mn-SOD.
Mechanizm reakcji dysproporcjonowania O2• − katalizowanej przez SOD odbywa się zgodnie z proponowanym zapisem:
E-Me n + + O2• − → E-Me (n -1) + + O2
2H+
E-Me (n -1) + + O2• − → E-Men+ (O22−) → E-Me n + + H2O2
W pierwszym etapie w wyniku redukcji jonu Cu2+ do Cu+ przez anionorodnik ponadtlenkowy uwolniona zostaje cząsteczka O2. W następnym etapie utlenienie Cu+ do Cu2+ przez drugi O2• − powoduje uwolnienie cząsteczki H2O2. Tym samym jony miedzi po redukcji w pierwszym etapie ulegają utlenieniu w drugim, a Cp może katalizować dysmutację kolejnych rodników O2• − .
Zaburzenia metabolizmu miedzi pojawiają się między innymi w:
chorobie Wilsona,
zespole Menkesa.
Choroba Wilsona (zwyrodnienie wątrobowo-soczewkowe) jest wrodzonym stanem, który charakteryzuje sie różnymi klinicznymi objawami,
w tym głównie zaburzeniami w wydalaniu Cu z wątroby do żółci, zmniejszonym wiązaniem Cu przez Cp. Wśród parametrów biochemicznych w chorobie Wilsona stwierdza się niskie stężenie miedzi w surowicy oraz wysokie w wątrobie i moczu. Przyczyną tych zaburzeń jest defekt genetyczny w kodowaniu genu ATP-azy transportującej jony miedzi. Zwiększa się frakcja miedzi nie związana z Cp, tworzą się depozyty Cu w różnych tkankach, między innymi w błonie Descemeta w rogówce (pierścienie Kaysera-Fleischera), w wątrobie, mózgu, nerkach, mięśniach, kościach i stawach. Czynniki kompleksujące, takie jak D-penicylamina
i trietylenotetramina, usuwają nadmiar Cu, powodując utworzenie rozpuszczalnych w wodzie chelatów jonów miedzi i wydzielenie ich z moczem. W chorobie Wilsona podawane są również zwiększone dawki związków cynku (octan cynku), które zmniejszają wchłanianie Cu.
Zespół Menkesa (choroba kręconych włosów) jest rzadkim dziedzicznym zaburzeniem, w którym dzieci płci męskiej mają niskie stężenia Cu w su-rowicy i większości tkanek, oprócz nerek i jelita, gdzie stężenie Cu jest bardzo wysokie. Stężenie Cp w osoczu jest znacznie zmniejszone. Włosy chorych z zespołem Menkesa mają charakterystyczny kolor i teksturę,
są splątane i matowe, mają kolor szarawy lub kości słoniowej i są łamliwe. Pojawienie się osłabienia i depigmentacji włosów oraz defekty w budowie ściany naczyniowej wyjaśnia się utratą aktywności enzymów miedziozależnych. Molekularny defekt w syndromie Menkesa, podobnie jak w chorobie Wilsona, związany jest z ATPazą typu P, której gen zlokalizowany jest na chromosomie X.
Cynk
Jest pierwiastkiem śladowym niezbędnym dla organizmu człowieka.
Odgrywa ważną rolę w aktywności ponad 100 enzymów, należących do
wszystkich klas. Tabela 5 przedstawia niektóre enzymy zawierające jony Zn2+ ważne dla metabolizmu ssaków.
Tabela 5. Niektóre enzymy i bialka zawierające jony Zn2+ ważne dla metabolizmu ssaków
Enzym |
Funkcje |
Anhydraza węglanowa Fosfataza alkaliczna
Karboksypeptydaza A
Cu,Zn-SOD Dehydrogenaza alkoholowa Dehydrogenaza mleczanowa Dehydrogenaza glutaminianowa Kolagenoza, elastaza Fruktozo-1,6-bisfosfataza
Metalotioneina
α2-Makroglobulina |
katalizuje odwracalną reakcję uwodnienia CO2 usuwa resztę fosforanową z organicznych związków fosforanowych hydroliza C-końcowego wiazania peptydowego usuwanie anionorodnika ponadtlenkowego utlenianie etanolu do aldehydu octowego redukcja pirogronianu do mleczanu
synteza L-glutaminianu z α-ketoglutaranu, NH4+ proteoliza elastyny i różnych typów kolagenu udział w glukogenogenezie, defosforylowanie fruktozo-1,6-bisfosforanu do fruktozo-6-fosfo-ranu wiąże jony metali chroniąc komórki przed metalami toksycznymi, bierze udział w gospodarce metalami niezbędnymi dla organizmu wiąże ok. 30% Zn w osoczu, inhibitor proteaz |
W enzymach tych jon cynku pełni rolę regulacyjną lub wymagany jest dla zachowania ich struktury. Jon Zn2+ nie bierze udziału w reakcjach redoks, gdyż jego stan utlenienia nie ulega łatwo zmianom.
Stężenie Zn we krwi wynosi około 8,8 mg/l, z czego 80-90% znajduje się w erytrocytach, głównie w anhydrazie węglanowej (ryc. 5.).
Stężenie Zn w osoczu zmienia się z wiekiem, zależy od płci, pory dnia,
położenia geograficznego, czasu, jaki upłynął od ostatniego posiłku.
Obniżenie stężenie Zn obserwuje się w stresie, infekcji i małej podaży białka z dietą. Zakres stężeń Zn w osoczu to 7,6-22,9 μmol/l, z czego około 60% związane jest z albuminą (frakcja wymienialna), 30-40%
z α2-makroglobuliną (frakcja trudno wymienialna), a niewielka ilość
z transferyną oraz aminokwasami, zwłaszcza z cysteiną i histydyną.
Zn i Cu współzawodniczą o miejsca wiążące w albuminie wpływając na swe wchłanianie, które odbywa się w dwunastnicy i jelicie cienkim.
|
|
Ryc. 5. Rozmieszczenie cynku we krwi i erytrocytach
Fityniany zawarte w pożywieniu hamują wchłanianie. Gromadzenie
i przemiany odbywają się w trzustce, wątrobie, nerkach, śledzionie, kościach. W wątrobie Zn pozostaje związany z Mt obok innych pierwiastków. Objawy wywołane niedoborem Zn to zaburzenia wzrostu i odporności immunologicznej, gorsze gojenie się ran.
Metalotioneina (Mt) jest niskocząsteczkowym białkiem (6-7 kDa), składa się z 61 lub 62 aminokwasów, w tym 20 to reszty cysteiny. Grupy -SH odpowiadają za wiązanie jonów różnych metali, głównie Zn, Cd, Cu, Pb,
Hg, Ag. Metalotioneiny pochodzące z różnych narządów wiążą różne
ilości jonów metali. Stężenie tego białka zależy od stopnia narażenia na metale ciężkie i jest większe przy dłuższej ekspozycji. Mt chroni przed metalami toksycznymi i jednocześnie bierze udział w regulacji stężeń jonów metali niezbędnych dla organizmu. Syntezę Mt indukują jony wiązane przez to białko, na przykład wolne jony cynku stymulują ekspresję
genu dla Mt i wzrost stężenia Mt.
Żelazo
Żelazo obecne jest we wszystkich komórkach organizmu, jest składnikiem enzymów utleniających (cytochromy, katalaza) i metaloprotein (hemoglobina, mioglobina). Cytochromy, oksydaza cytochromowa, katalaza, peroksydazy biorą udział w transporcie elektronów i procesach utleniania dzięki obecności układu redoks: Fe2+/3+. Hemoglobina i mioglobina zawierają Fe(II) związany w hemie, ich główna rola to wiązanie
i przenoszenie tlenu we krwi i mięśniach.
Żelazo związane jest ponadto z białkami biorącymi udział w jego transporcie i przechowywaniu. Należą do nich:
transferyna (Tf), białko transportujące Fe3+ w osoczu; jedna cząsteczka Tf ma 2-3 miejsca wiążące jony żelaza. Związane Fe3+ z Tf znacznie zmniejsza toksyczność jonów żelaza i kieruje je do odpowiednich miejsc w organizmie. Na powierzchni różnych komórek występują receptory dla Tf, sterujące internalizacją Tf na drodze endocytozy;
ferrytyna jest białkiem gromadzącm jony Fe3+, skąd jest ono pobierane w razie potrzeby. Występuje w wątrobie, śledzionie, szpiku kostnym, osoczu. Cząsteczka ferrytyny zbudowana jest z 24 podjednostek biakwych, które otaczają około 3-4 tysiąca jonów Fe3+. Hemosyderyna zawiera również jony Fe3+ i jest produktem częściowej degradacji ferrytyny. Występuje w niektórych schorzeniach, schorzeniach jej obecność wskazuje na nadmierna gromadzenie żelaza.
Wchłanianie Fe zachodzi głównie w żołądku i dwunastnicy. Jony Fe2+ pochodzące z hemu są wchłaniane bezpośrednio, natomiast wchłaniane Fe3+ dostarczanego w diecie zależy od wielu czynników i wzrasta
w obecności kwasu askorbinowego, hamowane jest przez taninę i fitynia-
ny. Wchłanianie Fe jest regulowane przez zapotrzebowanie, jedynie 10% Fe z diety jest wykorzystane przez organizm. W organizmie odbywa sie ciągła wymiana Fe między osoczem, szpikiem, krwinkami czerwonymi
i pulą zapasową. Niedokrwistość spowodowana niedoborem żelaza
w diecie jest głównym zaburzeniem tego pierwiastka. Wynika z przyjmowania diet ubogoenergetycznych i obecności w diecie składników hamujących jego wchłanianie.
Jod
Jod jest pierwiastkiem śladowym o dużych wahaniach zawartości w diecie, zależnych od wody, gleby i sposobu jej uprawy, przemysłu. Prawidłowe stężenie jodu w wodzie pitnej waha się w granicach 0-4 μg/l, powinno wynosić 10 μg/l.
Jod jest niezbędny do syntezy hormonów gruczołu tarczowego, do których należą 3,5,3'-trijodotyronina (T3) i 3,5,3',5'-tetrajodotyronina (tyroksyna, T4) i ich prekursory. Gromadzi się w tarczycy jako tyreoglobulina. Jod wydalany jest w moczu, jego niedobór w diecie i niedostateczna ilość wolnej T3 i T4 powodują niedoczynność tarczycy i powstanie wola prostego. Nadczynność tarczycy jest spowodowana nadmiernym wytwarzaniem hormonów tarczycy (choroba Gravesa-Basedowa).
Mangan
Mangan aktywuje wiele enzymów, m.in. fosfatazę alkaliczną, arginazę, glikozylotransferazę, karboksypeptydazę A i dysmutazę ponadtlenkową (Mn-SOD). Bierze udział w syntezie glikoprotein i proteoglikanów. Niedobór Mn jest związany między innymi z obniżeniem wydzielania insuliny przez trzustkę, wzrostem produkcji amylazy, uszkodzeniami tkanki chrzęstnej. W osoczu Mn związany jest z α-globuliną, wewnątrzkomórkowo w mitochondriach w Mn-SOD. Gromadzi się w nerkach i wątrobie, wydalany jest z żółcią.
Molibden
Molibden zaliczany jest do pierwiastków niezbędnych, jednak nie stwierdzono jednoznacznie skutków jego niedoboru u człowieka. Występuje
w enzymach: oksydazie ksantynowej, aldehydowej i siarczynowej. Występuje głównie w wątrobie i nerkach w bardzo małych stężeniach.
Kobalt
Główna rola kobaltu w organizmie człowieka związana jest z obecnością w kobalaminie (witamina B12), niezbędnej w syntezie prawidłowych krwinek czerwonych; enzymy wymagające witaminy B12 to mutaza metylomalonyloCoA w katabolizmie L-waliny, oksydoreduktaza metylotetrahydrofolianu i in. Największe stężenie Co występuje w wątrobie, nerkach i kościach, wchłaniany jest w jelicie i wydalany z moczem.
Selen
W organizmie selen obecny jest w postaci selenometioniny i selenocysteiny oraz w nieorganicznej formie jako selenin (SeO32-) i selenian (SeO42-). Selenocysteina jest formą biologicznie aktywną i regulowaną. Se jest składnikiem peroksydazy glutationowej (GPx), enzymu katalizującego utlenianie zredukowanego glutationu. W postaci selenocysteiny stanowi jego centrum katalityczne. Związki Se i witamina E są antyoksydantami
i biorą udział w podobnych procesach biochemicznych, tj. zmniejszenia stężenia nadtlenków w tkankach. Witamina E zapobiega powstawaniu hydroksynadtlenków kwasów tłuszczowych, a Se i aminokwasy zawierające siarkę (prekursory glutationu) biorą udział w rozkładzie tych nadtlenków chroniąc błonę lipidową przed uszkodzeniem (synergistyczne działanie przeciwutleniające Se i wit. E). W bardzo małych ilościach
(3 ppm, gdy 1 ppm to jedna część na milion) selen poprawia wzrost zwierząt, przy spożyciu 5-15 ppm w diecie jest toksyczny.
Obecność selenu stwierdzono we wszystkich komórkach organizmu, najwięcej w wątrobie, nerkach i trzustce. Selen wchłaniany jest w dwunastnicy (76-100% przyjętej dawki), wydalany z kałem i moczem.
Badania epidemiologiczne wykazały zależność między niedoborem Se
a występowaniem nowotworów i chorobami układu sercowo-naczy-niowego na podłożu miażdżycowym. Związek ten wymaga jednak dalszych badań.
Schorzenia spowodowane deficytem Se w diecie to choroba Keshan (endemiczna kardiomiopatia) oraz choroba Kashin-Beck (zapalenie kostno-stawowe). Oba schorzenia występują w pewnych rejonach Chin, gdzie spożycie Se wynosi poniżej 20µg/24h, uznanego za dolną granicę spożycia. Zapotrzebowanie dzienne na Se wynosi 70 µg dla mężczyzn i 60-75 µg dla kobiet. Dobowe spożycie Se jest w niektórych miejscach świata znacznie wyższe od zapotrzebowania i wynosi w pewnych rejonach Ka-
nady 150-220 µg, Wenezueli 325 µg i Japonii 500 µg, nie powodując objawów toksycznych.
Chrom
Chrom należy do niezbędnych pierwiastków śladowych, głównie ze względu na związek z metabolizmem glukozy. Jony Cr3+ obok insuliny mogą zwiększać wykorzystanie glukozy i uważane są za czynnik tolerancji glukozy (GFT, glucose tolerance factor). Czynnik ten zawiera połączenie jonów Cr3+, kwasu nikotynowego i glutaminowego oraz glicyny
i cysteiny. Uważa się, że GFT ułatwia reakcję insuliny z jej receptorami tkankowymi. Sugerowany jest udział Cr3+ w metabolizmie lipoprotein osocza. Stwierdzono, że u chorych z miażdżycą tętnic, u których stężenie Cr w surowicy było znacznie mniejsze w porównaniu z kontrolą, podawanie doustne związków Cr3+ zmniejsza stężenie cholesterolu i triacylogliceroli w osoczu.
Cr występuje w organizmie w bardzo małych ilościach, wchłaniany jest
w jelicie cienkim, pojawia się w mitochondriach, cytozolu i mikrosomach, wydalany jest z moczem. Związki Cr6+ są bardziej toksyczne niż Cr3+, narażenie na chromiany(VI) może zwiększyć ryzyko raka płuc.
Fluor
Fluor jest niezbędny dla organizmu człowieka ze względu na udział
w strukturze hydroksyapatytu. Powstałe fluoroapatyty zwiększają twar-dość zębów i kości. Fluor obecny w śladowych ilościach chroni przed próchnicą i zapobiega osteoporozie. Nadmierne wchłanianie fluoru
u dzieci powoduje marmurkowatość i odbarwienie emalii zębów (fluoroza), zmiany w kościach i wzrost ich gęstości.
Głównym źródłem jonów F- jest woda pitna i żywność. Gromadzenie fluorków w tkankach miękkich jest bardzo małe, wchłanianie rozpuszczalnych w wodzie związków (np. NaF) jest bardzo szybkie i wydajne. F wydalany jest w moczu, w dużych dawkach jest toksyczny.
Pytania
Przedstaw podział pierwiastków śladowych występujących w organizmie człowieka i podaj przykłady.
Jakie funkcje spełniają jony metali w układach biologicznych?
Podaj związki przenoszące jony metali w płynach ustrojowych.
Podaj drogi wydalania organizmu człowieka istotnych pierwiastków śladowych.
Jakie pierwiastki i dlaczego zaliczane są do grupy ultraśladowych?
Dlaczego jony metali mogą zachowywać się jak czynniki elektrofilowe lub nukleofilowe w reakcjach enzymatycznych?
Przedstaw metaloenzymy i enzymy aktywowane przez jony metali.
Przedstaw funkcje jonów miedzi w organizmie człowieka.
Omów znaczenie jonów cynku dla organizmu człowieka.
Jaką rolę spełnia selen w organizmie?
Przedstaw znaczenie fluoru i jodu dla człowieka.
Literatura
Murray R.K. D.K.Granner, P.A.Mayes, V.W.Rodwell, Biochemia Harpera, PZWL, Warszawa, 1994
Otton F.A. G.Wilkinson, Chemia nieorganiczna, PWN Warszawa 1995
Kolditz L. Chemia nieorganiczna, PWN Warszawa 1994
Chappuis Ph. Les oligoéléments en médecine et biologie, TEC*DOC-Lavoisier, Paris, 1991
2
Sulfanilamid
![]()
Wyszukiwarka
Podobne podstrony:
Transport przez błony biologiczne, Studia, I rok, Wykłady z biofizyki
chemia ściąga, Budownictwo Studia, Rok 1, chemia
Plan cwiczen ze Struktury i Funkcji Organizmu 2010, Biologia 2010, Rok I, Semestr I, SiFO Zwierząt
PYTANIA Z KARTKÓWEK Z CHEMII, medycyna UMed Łódź, 1 rok, chemia medyczna
Ćwiczenie 9a, Studia, I rok, Chemia ogólna i nieorganiczna
Chemia medyczna, Ratownictwo Medyczne UMED - I rok, chemia medyczna
Ćwiczenie 5a, Studia, I rok, Chemia ogólna i nieorganiczna
Biotechnologia I rok, Studia, I rok, Chemia fizyczna
skrypt biotechnologia med[1], UMED wojlek I rok, CHEMIA MEDYCZNA, Chemia medyczna
4. Eliminacje, studia, I rok, chemia, organiczna
chemia kartkowkii+ wejsciowka.By nesti.xoxo, 1 rok, chemia medyczna
Cwiczenie 5[1], UMED wojlek I rok, CHEMIA MEDYCZNA, Chemia medyczna
Sprawozdanie ćw. 11 Marty, Studia, I rok, Chemia fizyczna
CHEMIA spr 2 gotowe, Budownictwo Studia, Rok 1, chemia
kolo nr 2 pyt, UMED wojlek I rok, CHEMIA MEDYCZNA, Chemia medyczna
11. Tiole i sulfidy, studia, I rok, chemia, organiczna
więcej podobnych podstron