|
Akademia Górniczo-Hutnicza w Krakowie Wydział Górnictwa i Geoinżynierii |
|
Rok akademicki: 2015/2016 |
Przedmiot: Technologie oczyszczania wody i ścieków.
|
Rok studiów: II |
Data wykonania 28.10.2015 |
Temat: Bilans jonowy wody.
|
Prowadzący: dr Anna Hołda |
Data oddania 12.11.2015 |
Student: Daria Bidzińska |
Ocena: |
Cel ćwiczenia
Celem ćwiczenia trzeciego było oznaczenie bilansu jonowego elektrolitów, czyli zawartości jonów: Ca2+, Mg2+, Cl- oraz zasadowości całkowitej wody.
Wstęp teoretyczny
Bilans jonowy wody - porównanie sumy kationów z sumą anionów wszystkich elektrolitów znajdujących się w wodzie. Metodę tę stosuję się do sprawdzenia poprawności przeprowadzonej analizy chemicznej wody naturalnej. Opiera się na oznaczeniu najpopularniejszych w wodzie jonów m.in.: Na+, K+, Mn2+, Ca2+, Mg2+, Cl-, zasadowość całkowita itd.
Zasadowość całkowita - występuje dla pH> 4,6 i określa zawartość w wodzie jonów węglanowych CO32- oraz wodorowęglanowych HCO3-.
Jony wapniowe Ca+ - stanowią podstawowy budulec kości i zębów. Niedobór skutkuje osteoporozą, nadmierną potliwością, nerwowością, wymiotami oraz skurczami. Odpowiada za przesył impulsów nerwowych i skurcze mięśni. Reguluje pracę serca.
Jony magnezowe Mg+ - budulec kości oraz komórek (zwłaszcza mięśni). Wspomaga pracę systemu nerwowego i uczestniczy w budowie wielu enzymów. Niedobór magnezu powoduje rozdrażnienie, nerwowość oraz skurcze.
Jony chlorkowe Cl- - utrzymują prawidłowe ciśnienie osmotyczne w komórkach. Biorą udział w procesie trawienia jako składniki soku żołądkowego.
Jony siarczanowe SO42- - siarka jest składnikiem wielu enzymów, dodatkowo wpływa na poprawne funkcjonowanie komórek.
Spis literatury i stron internetowych:
Technologia wody i ścieków - Ćwiczenia laboratoryjne, część 1 - Agnieszka Gala, Anna Hołda, Ewa Kisielowska, Anna Młynarczykowska, Stanisława Sanak-Rydlewska - Wydawnictwo AGH
Rozporządzenie Ministra Zdrowia z dnia 29 marca 2007 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi.
wgg.pwr.wroc.pl - Prace Naukowe Instytutu Górnictwa Politechniki Wrocławskiej
Wykonanie ćwiczenia
Oznaczanie zawartości jonów Ca2+ (Metodą miareczkowania kompleksometrycznego)
Do kolby stożkowej odmierzono 50cm3 próbki wody, do której dodano 6 cm3 2M roztworu NaOH oraz 1cm3 chlorowodorku hydroksylaminy i siarczku sodu. Próbkę wymieszano, dodano szczyptę mureksydu i miareczkowani 0,05M roztworem wersenianu sodu do zmiany zabarwienia z różowego na fioletowe. Po osiągnięciu punktu końcowego miareczkowania sprawdzono jego prawidłowość poprzez dodanie 1 do 2 kropli wersenianu. Zabarwienie nie uległo zmianie, więc uznano je za zakończone.
Tabela 1 - Wyniki miareczkowania na obecność jonów wapnia.
Objętość próbki |
Vp [cm3] |
50 |
Objętość titranta EDTA |
V1 [cm3] |
3,7 |
|
V2 [cm3] |
3,65 |
|
Vśr [cm3] |
3,675 |
Stężenie titranta EDTA |
CEDTA [M] |
0,05 |
Oznaczanie zasadowości całkowitej
Do kolby stożkowej odmierzono 50cm3 próbki wody, do której dodano 3 krople oranżu metylowego. Woda odbarwiła się na kolor żółty. Rozpoczęto miareczkowanie 0,1M HCl aż do zmiany zabarwienia na pomarańczowy.
Tabela 2 - Wyniki miareczkowania do oceny zasadowości całkowitej.
Objętość próbki |
Vp [cm3] |
50 |
Objętość titranta HCl |
V1 [cm3] |
4,4 |
|
V2 [cm3] |
4,3 |
|
Vśr [cm3] |
4,35 |
Stężenie titranta HCl |
CHCl [M] |
0,1 |
Oznaczanie zawartości jonów Mg2+ (Metodą miareczkowania kompleksometrycznego)
Do kolby stożkowej odmierzono 50cm3 próbki wody, do której dodano średnią objętość HCl
z oznaczania zasadowości całkowitej, czyli 4,35cm3. Wprowadzono 5 cm3 buforu amonowego o pH 10, 1cm3 chlorowodorku hydroksylaminy i siarczku sodu oraz 0.1 mg czerni eriochromowej T. Miareczkowano roztworem EDTA o stężeniu 0.05M aż do zmiany barwy
z różowej na niebieską.
Tabela 3 - Wyniki miareczkowania na obecność jonów magnezu.
Objętość próbki |
Vp [cm3] |
50 |
Objętość titranta EDTA |
V1 [cm3] |
4,6 |
|
V2 [cm3] |
4,8 |
|
Vśr [cm3] |
4,7 |
Stężenie titranta EDTA |
CEDTA [M] |
0,05 |
Oznaczanie zawartości jonów Cl- (Metodą Mohra)
Przygotowanie wzorcowego roztworu chlorku sodu - Aby przygotować wzorcowy roztwór chlorku sodu użyto w tym celu 1,6486 g NaCl wysuszonego do stałej masy w temperaturze 413 K i rozpuszczono w kolbie miarowej o pojemności 1 dm3 w wodzie podwójnie destylowanej. 1 cm3 takiego roztworu zawiera 1 mg jonów Cl-.
Nastawienie miana roztworu AgNO3 - Odmierzyć dokładnie 10 cm3 przygotowanego roztworu chlorku sodu, dodano 1 cm3 roztworu K2CrO4 i uzupełniono wodą podwójnie destylowaną do objętości 100 cm3. Przygotowany roztwór miareczkowano roztworem AgNO3 do zmiany zabarwienia z żółtomlecznego na żółtobrunatne. Następnie wykonać podobne miareczkowanie próbki kontrolnej sporządzonej z 1 cm3 roztworu K2CrO4 rozcieńczonego do 100 cm3 wodą podwójnie destylowaną.
Oznaczanie chlorków - Całościowego oznaczania chlorków nie przeprowadzono, ponieważ dodano 1 kroplę titr anta do 100cm3 badanej próbki i roztwór odbarwił się. Niska zawartość chlorków wykazuje, iż niemożliwym jest oznaczenie ich za pomocą metody Mohra.
Tabela 4 - Wyniki miareczkowania do oznaczenia chlorków.
|
Nastawianie miana roztworu AgNO3 |
Próbka kontrolna |
|
Objętość próbki |
Vp [cm3] |
100 |
100 |
Objętość titranta AgNO3 |
V1 [cm3] |
2,95 |
0,1 |
|
V2 [cm3] |
2,95 |
0,1 |
|
Vśr [cm3] |
2,95 |
0,1 |
Stężenie titranta AgNO3 |
|
0,1 |
0,1 |
Opracowanie wyników
Obliczanie stężenia wapnia Ca2+:
![]()
a - objętość roztworu 0,05M wersenianu sodu użyta do miareczkowania próbki badanej [cm3]
V1 - objętość próbki wody użytej do badania [cm3]
2,004 - współczynnik przeliczeniowy określający ilość wapnia odpowiadającą 1cm3 0,05M wersenianu sodu [mg]
![]()
![]()
Obliczanie zasadowości całkowitej:
![]()
b - objętość 0,1M HCl użyta do miareczkowania próbki wody badanej, [cm3]
V - objętość próbki wody użytej do oznaczania, [cm3]
![]()
![]()
Obliczanie stężenia magnezu Mg2+:
![]()
b - objętość roztworu 0,05M wersenianu sodu użyta do miareczkowania próbki badanej [cm3]
a - objętość roztworu 0,05M wersenianu sodu użyta do zmiareczkowania wapnia [cm3]
k - stosunek objętości próbek użytych do oznaczania wapnia i magnezu k = V2/V1
V2 - objętość próbki wody użytej do badania [cm3]
1,215 - współczynnik przeliczeniowy określający ilość magnezu odpowiadającą 1cm3 0,05M wersenianu sodu [mg]
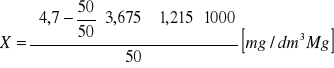
![]()
Nastawienie miana roztworu AgNO3
![]()
V1 - objętość roztworu AgNO3 zużytego do zmiareczkowania 10 cm3 roztworu NaCl [cm3],
V2 - objętość roztworu AgNO3 zużytego do zmiareczkowania próbki kontrolnej [cm3].
![]()
![]()
Obliczanie bilansu jonowego wody
Tabela 5 - Obliczanie bilansu jonowego wody.
Skład chemiczny wody |
Sposób przeliczania mg/dm3 na mval/dm3 |
Wynik [mval/ dm3] |
Kationy |
||
Wapń 147,294 mg/dm3Ca |
|
7,350 |
Magnez 24,908 mg/dm3Mg |
|
2,049 |
|
Suma kationów (ΣK) |
9,399 |
Aniony |
||
Zasadowość (wodorowęglany |
mval/l
|
8,7
|
|
Suma anionów (ΣA) |
8,7 |
Tabela 6 - Bilans jonowy wody.
Kationy [mval/dm3] |
Aniony [mval/dm3] |
||
Ca2+ Mg2 |
7,350 2,049 |
zasadowość
|
8,7 |
Suma kationów (ΣK) |
9,399 |
Suma anionów (ΣA) |
8,7 |
Obliczanie błędu względnego analizy (x)
![]()
![]()
![]()
Tabela 7 - Dopuszczalny błąd analizy.
Suma jonów w wodzie [mval/dm3] |
Dopuszczalny błąd względny analizy[±%] |
Powyżej 15 |
2 |
5÷15 |
2÷5 |
3÷5 |
5÷10 |
Podsumowanie i wnioski

Stężenia Ca2+ oraz Mg2+ - w porównaniu z zawartością jonów na etykiecie wody Cisowianki są lekko podwyższone, jednak wielkości są zbliżone. Rozbieżności wynikają z niedokładności pomiaru, na które składają się: odmierzanie objętości ręczni pipetą szklaną, wzrokowy odczyt zużytego titranta z biurety, wzrokowa ocena momentu zmiany zabawienia roztworu podczas miareczkowania. Niewielki błąd generuje kolejne, które w sumie zmieniają znacznie cały wynik.
Zasadowość - nie można określić zawartości jonów HCO3-, które znajdują się na etykiecie, ze względu na to, iż obliczono zasadowość ogółem, bez uwzględniania zawartości poszczególnych jonów węglanowych oraz wodorowęglanowych.
Stężenia Cl- - nie udało się zmierzyć, ze względu na zbyt niską ich zawartość, która jest nieodpowiednia do metody Mohra. Nastawiono jedynie miano roztworu AgNO3 i dokonano pomiaru próbki kontrolnej.
Bilans jonowy - określono dla jonów wapnia, magnezu i dla zasadowości. Wyniki i metody obliczania przedstawiono w tabeli.
Błąd względny analizy - mieści się w dopuszczalnych granicach zgodnie z Tabelą 7.
Ćwiczenie wykonano poprawnie, otrzymane wyniki mieszczą się w granicach błędu i są zbliżone do tych podanych na etykiecie wody Cisowianki.
Wyszukiwarka
Podobne podstrony:
Bilans jonowy, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I Ś
1 - Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY
Metody Oznaczania Związków Nieorganicznych 3, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓ
Warunki zaliczenia, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Technologie oczyszczania wody i ścieków - Tematy referatów, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA
Zasadowość-kwasowość-związki-twardość, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Wzór sprawozdania, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Neutralizacja, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 5
5 - Chemiczne oczyszczenie ścieków – neutralizacja, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I
2006 06 08 Techn frezowania - zadanie, AGH, Semestr 8, Technologia wybranych elementów maszyn, cnc
toś zerowka 2012 (58 pytań), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wyk
Ścieki, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
toś zerowka 2012 (58 pytań z odp), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ściekó
TOSegzamin, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
sorpcja, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laboratorium
protokoldefosfatacja, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laboratorium
odwadnianie ver.1 - 29.04.09, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laborator
więcej podobnych podstron