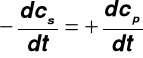CHEMIA jedna z podstawowych nauk przyrodniczych zajmująca się badaniem właściwości i przemian substancji, oraz warunków i efektów tych przemian
CHEMIA ANALITYCZNA dział chemii zajmujący się ustalaniem składu jakościowego i ilościowego substancji
CHEMIA CZYSTA - dział chemii obejmujący badania prowadzone w celach poznawczych
CHEMIA FIZYCZNA - nauka zajmująca się badaniem zależności między właściwościami fizycznymi a budową chemiczną substancji i składów a także badaniem zjawisk fizycznych związanych z przebiegiem procesów chemicznych
CHEMIA JĄDROWA -dział chemii zajmujący się zagadnieniami związanymi z jądrowymi przemianami substancji oraz z wykorzystaniem energii jądrowej
CHEMIA KWANTOWA - dział chemii tematycznej rozpatrujący i interpretujący zjawiska chemiczne w oparciu o mechanikę kantową
CHEMIA NIEORGANICZNA - dział chemii zajmujący się związkami wszystkich pierwiastków oprócz węgla ze związku węgla najprostsze należą do nieorganicznych: tlenki węgla, węglany, cyjanki węgla
CHEMIA OGÓLNA - dział chemii, którego zadaniem jest formułowanie najbardziej ogólnych praw chemii
CHEMIA ORGANICZNA - chemia związku węgla wyjątek tlenki, węglany, węgliki, cyjanki
CHEMIA STOSOWANA - dział chemii zajmujący się możliwościami zastosowania wyników badań chemii czystej do celów praktycznych, np. opracowanie metod produkcji na skale przemysłową
STEREOCHEMI - zajmuje się rozmieszczeniem przestrzennym atomów w cząsteczce.
INŻYNIERIA CHEMICZNA (PROCESOWA) - nauka o operacjach i procesach jednostkowych
S Y M B O L E , W Z O R Y
I R Ó W N A N I A C H E M I C Z N E
SYMBOLE PIRWISTKÓW CHEMICZNYCH -symbole literowe, które stanowią jedną lub dwie litery alfabetu łacińskiego pierwsza litera jest zawsze duża i jest nazwą druga jest mała i dalsza nazwa
WZORY CHEMICZNE
Jeżeli cząsteczka zawiera kilka atomów pierwiastka to ich liczbę zaznacza się w prawym dolnym rogu
WZÓR SUMARYCZNY(RYSUNKOWY I EMPIRYCZNY) wzór typu A,B(symbole pierwiastków) n, m (liczba atomów)
a) skład stechiometryczny (skład atomowy) substancji np. na podstawie analizy ilościowej. Jest to wzór „najprostrszy”CH3
b) masę cząsteczkową (a na jej podstawie tzw. wzór „cząsteczkowy”, „prawdziwy”, „rzeczywisty”, np. dla etenu C2H3
WZÓR STRUKTURALNY - określa nie tylko rodzaj i liczbę atomów każdego pierwiastka ale także sposób ich wzajemnego powiązania atomów w cząsteczce lub jonie
POSTULATY TEORII STRUKTURALNEJ (OK.1850)
POSTULAT - STWIERDZENIE NIEUDOWODNIONE
1.Atomy tworzą cząsteczki są połączone wiązaniami chemicznymi
2.Liczba wiązań chemicznych, które tworzą atom jest cecha charakterystyczną pierwiastka, i jego podstawową własnością chemiczną.
3.Pierwiastki mogą zmieniać wartościowości (liczbę atomową) w zależności od pierwiastka z którym tworzą związek chemiczny lub w zależności od warunków przeprowadzania reakcji H2S-S(II), SO2-S(IV), SO3-S(VI)
4.Mogą istnieć związki o identycznych wzorach sumarycznych lecz różnych wzorach strukturalnych (zjawisko izomerii), np.
CH2 - CH2 - OH alkohol etylowy
CH2 - O - CH2 eter dwumetylowy
M N O M E N K L A T U R A
( S Ł O W N I C T WO , N A Z E WN I C T W O )
Z W I Ą Z K Ó W N I E O R G A N I C Z N Y C H
Nazwy pierwiastków należy używać ich w polskim brzmieniu (nie należy niepotrzebnie dodawać końcówki stosowane w językach obcych np. „un” i „lum”.
Z A S AD Y Z A P I S U W Z O R Ó W,
Z W IĄ Z K Ó W N I E O R G A N I C Z N Y C H
Wzór związku rozpoczyna się od symbolu pierwiastka elektrododatniego, a następnie podaje się symbol składnika elektroujemnego (składnik elektrododatani jest to ten, który jest kationem lub atomem o elektroujemności mniejszej niż elektroujemność drugiego składnika, np. Na CL - prawidłowo, Cl Na - nieprawidłowo
JEŻELI ZWIĄZEK ZAWIERA KILKA SKŁANIKÓW elektrododatnich lub kilka składników elektroujemnych to pierwiastek w każdej z tych klas podaje się w kolejności alfabetycznej ich symboli (nie nazw), ale czyta w kolejności alfabetycznej nazw, np. KMgF2-fluorek magnezu i potasu
2.We wzorach związków składających się z trzech lub więcej pierwiastków kolejność powinna odpowiadać sposobowi powiązania atomów i jeżeli atom centralny wiąże kilka różnych atomów, to atom centralny wymienia się na początku a pozostałe atomy podaje się w kolejności alfabetycznej symboli
SbCl2F
3. PRZEDROSTKI ZWIELOKRATNIAJĄCE preferuje się stosowanie przedrostków greckich lub łacińskich (polskie są dopuszczalne)
przedrostek
krotność grec lub łac. polski
1 mono jedno
2 di dwu
3 tri trój
4 tetra czworo
5 penta pięcio
6 heksa sześcio
7 hepta siedmio
8 okta ośmio
UWAGA: Tam gdzie nie jest to niezbędne nie podaje się przedrostka mono, np. NO tlenek azotu, N2O3-tritlenek azotu (trójtlenek azotu), N3O5-pentatlenek diazotu (pięciotlenek dwuazotu)
NAZWY ZWIĄZKÓW NIEORGANICZNYCH wyraz określający nazwę składnika elektroujemnego podaje się na pierwszym miejscu, a wyraz określający nazwę składnika elektrododatniego, podaje się na drugim miejscu
-system dawny - rzeczownikowo-przymiotnikowy, np.
NaCl - chlorek sodowy
-system obecny rzeczownikowo - rzeczownikowy, np.
NaCl - chlorek sodu
NAZWA CZĘŚCI ELEKTROUJEMNEJ stanowi węgiel, to nazwa części elektroujemnej przyjmuje końcówkę „ik”, np.
SiC węglik krzemu
KOŃCÓWKA „AN” stosuje się gdy część elektroujemna składa się z różnych atomów (w której atom centralny otoczony jest innymi atomami- ligandami, np. Na2SO4 - siarczan (VI)sodu
4. NAZWA CZĘŚCI ELEKTRODODATNIEJ rzeczownik określający część elektrododatnią podawany jest w II przypadku (w dopełnieniu)
NAZWY KWASÓW
- kwasy tlenowe
nazwy kwasów tlenowych tworzy się z nazwy pierwiastka wys. W tlenku, z którego powstał kwas (z nazwy pierwiastka kwasotwórczego). Jeżeli ten pierwiastek tworzy kilka kwasów to w nazwie (bezpośrednio po nazwie, bez odstępu) podaje się wartościowość tego pierwiastka, np.
HNO2-kwas azotowy (III) (d. kwas azotowy)
HNO2-kwas azotowy (V) (d. kwas azotowy)
H2SO3-kwas siarkowy(IV)(d. kwas siarkowy)
H2SO4-kwas siarkowy(VI)(d. kwas siarkowy)
HClO- kwas chlorowy (I)(d. kwas podchlorowy)
HClO2- kwas chlorowy(III)(d. kwas chlorowy)
HClO3- kwas chlorowy(V)(d. Kwas chlorowy)
HClO4- kwas chlorowy(VII)(d. Kwas nadchlorowy)
Jeżeli tlenek kwasowy reaguje z różną liczbą cz. wody tworząc kwasy różniące się liczbą kwasową atomu wodoru (ale wszystkich kwasach utlenienia pierwiastka kwasotwórczego jest taki sam to
-kwasy, które powstały z przyłączenia najmniejszej liczby cząsteczek wody (o najmniejszej liczbie kwasów atomów wodoru) mają przedrostek „meta-„,np. P2O4 + 1 H2O = 2 HOP2
-kwasy, które powstały z przyłączenia największej liczby cząsteczek wody, mają przedrostek „orto-”, np.
P2O4 + 3 H2O = 2 H2PO4 kwas ortofosforowy (VI)
- kwasy powstałe z dwóch cząsteczek kwasu „orto-” po wydzieleniu (np. przez ogrzanie greckiego pyr-ogień) cząstek wody (lub z przyłączenia do tlenku kwasowego pośredniej ilości wody) mają przedrostek „piro-”,np. 2 H2PO4 = H2PO7 + H2O
H2P2O7 - kwas pirofosforowy (V)
To samo:
P2O5 + 1 H2O = 2 HPO kwas metafosforowy (V)
P2O5 + 2 H2O = H4P2O7 kwas pirofosforowy (V)
P2O5 + 3 H2O = 2 H3PO4 kwas ortofosforowy (V)
W tlenku, kwasie i soli jest taka sama wartościowość pierwiastka kwasotwórczego. II -II
Na ClO, Cl+1, NaClO2, Cl+3
KWASY BEZTLENOWE otrzymuje się zazwyczaj przez rozpuszczenie w wodzie wodorków niemetali, np. kwas solny (chlorodowdorowy) jest wodnym roztworem chlorowodoru HCl
Kwas siarkowy jest wodnym roztworem siarkowodoru H2S. Nazwy kwasów beztlenowych tworzy się dodając do nazwy pierwiastka stanowiącego resztę kwasową końcówkę „wodorowy”, np. HCl - kwas chlorowodorowy (solny)
H2S - kwas siarkowodorowy
HI - kwas jodowodorowy
NAZWY SOLI ogólnie obowiązują zasady podane w 4pkt.
SOLE ZAWIERAJĄCE WODÓR KWASOWY (WODOROSOLE) przed nazwą atomu dodaje się przedrostek „wodoro” (nie należy używać nazw „kwaśny”),np.
KH2PO4 - diwodoroortofosforowy(V) potasu
K3HPO4 - wodoroortofosforowy (V) dipotasu
SOLE ZAWIERAJĄCE GRUPY HYDROKSYLOWE - WODOROTLENOWE (HYDROKSYSOLE) nazwę soli poprzedza się liczebnikiem wskazującym liczbę grup hydroksylowych i przedrostkiem „hydroksy-„ (liczebnik „mono” pomija się), np. AlOHCl2 - hydroksychlorek glinu
Al.(OH)2Cl - dihydroksychlorek glinu
NAZWY SOLI PODWÓJNYCH I POTRÓJNYCH (SOLI ZAWIERAJĄCYCH KILKA RÓŻNYCH
KATIONÓW LUB ANIONÓW
-kolejność jonów we wzorze podaje się w kolejności alfabetycznej symboli chemicznych pierwiastków
-nazwy jonów podaje się w kolejności alfabetycznej nazw
-nazwy kationów oddziela się od siebie spójnikiem „i”
-nazwy anionów podaje się bez łącznika, np.
MgNH4PO4 - fosforan (V) amonu i magnezu
KNaCO2 - węglan potasu i sodu
TEORIA ATOMISTYCZNA
Postulaty współczesnej teorii atomistycznej
Każdy pierwiastek chemiczny jest zbiorem małych cząsteczek zwanych atomami. Wszystkie atomy danego pierwiastka mają identyczne właściwości .
BUDOWA ATOMU atom (gr. ”atomowa” - niepodzielny) - jest to najmniejsza cz. pierwiastka, która ma wszystkie cechy charakterystyczne. Atom składa się z dodatniego naładowanego jądra atomowego, znajdujące się w środku geometrycznym atomu i pozajądrowego układu ujemnie naładowanych elektronów.
JĄDRO ATOMOWE protony i neutrony tzw. nukleony (łac. nukleus - jądro) prawie cała masa atomu skupiona jest w jądrze (gęstość masy jądra atomowego wynosi około p = 10-14 g/cm3 = 1000 mln ton / cm2
PROTON cząstka elementarna trwała, dodatni łańcuch elementarny 1,6022 · 10-18C; masa w przybliżeniu równa jednostce mas atomowych (dodatnie 1,0073u)
NEUTRON cząstka elementarnie obojętna, masa w przybliżeniu równa jednostce mas atomowych (dokładnie 1,0078) neutrony swobodne są nietrwałe (czas połowicznego zaniku - rozpadu wodoru 15,5s)
ELEKTRON (NEGATON) cząstka trwała, ujemny ładunek
LICZBA ATOMOWA (Z) liczba protonów w jądrze atomowym danego pierwiastka (numer Porządkowy w układzie okresowym)
LICZBA MASOWA (A) liczba nukleonów (protonów i neutronów) w jądrze atomowym danego pierwiastka np. 812C, gdzie A = 12, Z = 6
PIERWIASTEK CHEMICZNY zbiór atomów o identycznej liczbie atomowej
IZOTOPY odmiany tego samego pierwiastka złożone z atomów o identycznych liczbach atomowych, a różnych liczbach masowych (izotopy zajmują to samo miejsce w układzie okresowym), gr. „izos” - ten sam „topos” - miejsce
Pierwiastek może składać się z jednego lub kilku IZOTOPÓW (20 pierwiastków nie ma izotopów, np. Be, F, Na, Al., P, Sc, Mn, Co, Au)
NUKLID - rodzaj atomów o określonym jądrze atomowym (o tej samej liczbie protonów i neutronów w jądrze), tzn. każdy izotop jest oddzielnym nuklidem.
JEDNOSTKA MASY ATOMOWEJ (dokładnej: międzynarodowa węglowa jednostka masy atomowej) (4-unit) - 1/12 masy atomu węgla (dokładnej izotopu węgla 12C), np. masa atomowa wodoru (pierwiastka najlżejszego) - 1,0079u masa atomowa kurczatowa (pierwiastka najcięższego) - 261u
1u = 1,66 · 10 -27 kg
MASA ATOMOWA masa tomu (dokładniej: masa atomu obliczona ze średniego składu izotopowego danego pierwiastka) wyrażona w jednostkach mas atomowych (u).
MASA CZĄSTECZKOWA - masa cząsteczki wyrażona w jednostce mas atomowych [ u ]; jest ona sumą mas atomowych atomów wchodzących w skład cząsteczki, np. masa atomowa tlenu O:16u
Masa atomu tlenu: O: 16 · 1,66·10-27 kg = 2,65· 10-26 kg
Masa cz. tlenu: O2: 2·16u = 32 u
Masa cząsteczki tlenu: O2: 32·1,66·10-27kg = 5,3·10-26
Proton p 1,0073 +1 Z
Neutron n 1,0087 0 A - Z
Elektron e 1/1836 -1 Z
MODEL PLANETARNY (ERNEST RUTHERFORD, pocz. XXw.) - elektrony z duża prędkością krążą wokół jądra po orbitach kolorowych lub eliptycznych (podobnie jak Ziemia I inne planety wokół Słońca). Siła przyciągania elektrostatycznego elektronu przez jądro pełni funkcję siły dośrodkowej
PRAWA ELEKTRODYNAMIKI MAXWELLA - jeżeli wokół dodatniego naładowanego jądra krąży ujemnie naładowany elektron, to musi on bez przerwy emitować falę elektromagnetyczną (np. w postaci światła). Elektron traci wtedy energię i szybkość, a długość wysyłanej fali musi stale rosnąć. W konsekwencji elektron musi poruszać się po torze spiralnym, aby w końcu spaść na jądro.
MODEL PRALENTARNY NILSONA POOHRA (1913)
Przyjęto, że prawa Maxwella nie dotyczą ruchu elektronu oraz postulaty.
1. ELEKTRON W ATOMIE MOŻE PRZEBYWAĆ w jednym z wielu możliwych stanów energetycznych (tzw. stanów stacjonarnych) w których jego energia ma ściśle określoną wartość. W stanie stacjonarnym elektron nie wypromieniowuje, ani nie pochłania energii
2. ELEKTRON MOŻE POBRAĆ kwant energii docierającej do atomu z zewnątrz i przejść do stanu stacjonarnego o wyższej energii lub może oddać kwant energii w postaci fali elektromagnetycznej i przejść do stanu energetycznego o niższej energii.
PRZESKOK ELEKTRONU Z JEDNEJ ORBITY na inną związany jest ze stratą lub zyskiem określonej porcji energii, której wartość można obliczyć z równania (bardzo ważne - wprowadzono kwantowanie energii: aktualnie do dziś) E = h · v gdzie h = 6,625 · 10 -34 Is - Plancka
v - częstotliwość absorbowanego lub emitowanego promieniowania
STAN STACJONARNY (orbita stacjonarna) - ściśle okr. „dozwolone” orbity w kształcie kręgów, po których może poruszać się elektron
STAN PODSTAWOWY - stan elektronu, w którym energia ma wartość najmniejszą z możliwych (z zwykłych warunkach ciśnienia i temperatury elektron jest w stanie podstawowym.)
STAN WZBUDZONY - wszystkie inne stany, niż podstawowy
MECHANIKA KWANTOWA (początek lat 20 XXw.)
1. DUALIZM KORPUSKULARNO-FELOWY elektron (1924r. Ludwig de Broqlie) - podobnie jak dla światła pewne zjawiska daje się opisać za pomocą modelu falowego, a inne za pomocą modelu korpuskularnego (z tego wynika, że ruch elektronu nie może być opisywany równaniami ruchu ciał makroskopowych, np. równaniami Newtona F = ma)
2.POJĘCIE „ELEKTRONU I „TORU ELEKTRONU” - pojęcie klasyczne zostaje zastąpione „chmurą ładunku elektrycznego” i „prawdopodobieństwem znalezienia elektronu w danym obszarze przestrzeni wokół jądrowej”
3.ORBITALE ( ATOMOWE, CZĄSTECZKOWE) - równania falowe (równania Schrödingera) charakteryzujące stan energetyczny pojedynczego elektronu znajdującego się w atomie lub cząsteczce (terminem „orbitalu” nazywany jest niekiedy także obszar dużego prawdopodobieństwa znalezienia elektronu).
4.ZASADA NIEOZNACZONEJ HEISNBERGA (Werner Carl Heisenberg, 1907 - 1976;1932 Nagroda Nobla) - dla układu opisywanego prawami mechaniki kwantowej niemożliwe jest równoczesne i dokładne określenie pewnych par wielkości fizycznych układu, np. prędkości i położenia elektronu (wg praw mechaniki klasycznej jest to możliwe); im dokładniej okr. Prędkość elektronu, tym mniej dokładnie okr. Się jego położenie i odwrotnie.
LICZBY KWANTOWE są to liczby wymierne kwantujące („porcjujące”) te wielkości, które mogą przyjmować dozwolone (ale nie dowolne) wartości; w mechanice kwantowej kwantowanych jest pięć wielkości w teorii Bohra - tylko energia np. jeżeli dysponujemy wagą odważnikową i odważnikami jednokilogramowymi, to możemy odważać „dowolną” ilość piasku, ale „dowolne” są tylko porcje, które są krotnością 1 kg
UWAGA: Wszystkie rozważania w mechanice kwantowej dotyczą elektronu w atomie wodoru, czyli jednego elektronu; przyjmując jednak, że wszystkie stany dopuszczalne dla tego jednego elektronu są dopuszczalne dla wszystkich innych elektronów, teorię rozszerza się następnie na elektrony innych atomów.
GŁÓWNE LICZBY KWANTOWE [ n ] Główna liczba kwantowa kwantuje energię elektronu w atomie wodowu
DOPUSZCZALNA WARTOŚĆ GŁÓNEJ LICZBY KWANTOWEJ [ n ] n = 1, 2, 3 ... ∞
Gdzie n - liczba naturalna
POWŁOKA ELEKTRONOWA zbiór stanów kwantowych o tej samej wartości głównej liczby kwantowej
LICZBA STANÓW KWANTOWYCH O TEJ SAMEJ WARTOŚCI GŁÓWNEJ LICZBY KWANTOWEJ (maksymalna liczba elektronów w danej powłoce 2n2
SYMBOLE POWŁOK ELEKTRONOWYCH I MAKSYMALNA LICZBA STANÓW KWANTOWYCH (ELEKTRONÓW)
1)powłoka 1 czyli K (n = 1 ) - 2 · 12 = 2 stany kwantowe
2)powłoka 2 czyli L ( n = 2 ) - 2 · 22 = 8 stanów kwantowych
3)powłoka czyli 3 M ( n = 3 ) - 2 · 32 = 18 stanów kwantowych
4)powłoka 4, 5, 6, czyli N, O, P ... (kolejne litery alfabetu = 2n2 stanów kwantowych
POBOCZNA (ORBITALNA) LICZBA KWANTOWA (l) poboczna (orbitalna) liczba kwantowa kwantuje orbitalny moment pędu elektronu (M pędu = m · u · r, gdzie m - masa; u - prędkość; r - promień )
UWAGA: energię elektronów w innych atomach niż wodór określają: główna i poboczna liczba kwantowa
DOPUSZCZALNE WARTOŚCI POBOCZNEJ LICZBY KWANTOWEJ ( l ): l = 0, 1, 2, 3 ... (n - 1),czyli l = 0 + ( n -1 )
Gdzie n - główna liczba kwantowa
Np. w powłoce K = ( n = 1) l = 0
L = ( n = 2 ) l = 0 lub l = 1
M = ( n = 3 ) l = 0 lub l = 1 lub l = 2
POWŁOKA ELEKTRONOWA zbiór stanów kwantowych opisujących tę samą wartość głównej liczby kwantowej (n ) i tą samą wartość pobocznej liczby kwantowej (l) (ale zawsze n ≠ l )
SYMBOLE POWŁOK ELEKTRONOWYCH
1)podpowłoka 1, czyli s( l = 0)
2)podpowłoka 2, czyli p( l = 1)
3)podpowłoka 3, czyli d( l = 2)
4)podpowłoka 4, czyli f(l = 3)
5)podpowłoka 5, 6, 7 czyli g(l = 4), h(l = 5), i( l = 6 ) itd. (kolejne liczby alfabetu)
LICZBA PODPOWŁOK W DANEJ POWŁOCE : ( n ), np. w powłoce K(n = 1) jest jedna podpowłoka (s) w powłoce L(n = 2) są dwie powłoki (s, p)
MAGNETYCZNA LICZBA KWANTOWA (m) magnetyczna liczba kwantowa kwantuje orientację przestrzenną orbitalnego momentu pędu elektronu. Moment pędu jest wektorem. Wektor można rzutować na wybrany kierunek w przestrzeni
Kwantowanie orientacji przestrzennej wektora momentu pędu polega na znalezieniu jest rzutu na kierunek zewnętrznego pola magnetycznego (przyłożonego z zewnątrz pola)
DOPUSZCZALNE WARTOŚCI MAGNETYCZNEJ LICZBY KWANTOWEJ ( m ); m = -1; - (l-1); ... ; -1; 0; +1; ... (l-1); l, czyli m = -l ÷ + l, gdzie l - poboczna liczba kwantowa
Liczba dopuszczalnych wartości magnetycznej liczby kwantowej ( m ) : 2l + 1
UWAGA: ponieważ m = f (l) i l = f (n) to m = f (n)
Np. 1); = 0 (podpowłoka s), to m = 0
2)l = 1 ( podpowłoka p ), to m = -1 0 ; +1 (2 l + 1 = 3 wartości)
3)l = 2 (podpowłoka d), to m= -2; -1; 0; +1; +2 (2l+1=5wartości)
POZIOM ORBITALNY zbiór stanów kwantowych opisujących tę samą wartością głównej liczby kwantowej (n) tą samą wartością magnetycznej liczby kwantowej (m)
SPINOWA LICZBA KWANTOWA (s) kwantuje wewnętrzny moment pędu elektronu. Elektron, oprócz ruchu wokół jądra atomowego, wykonuje jednocześnie pewien ruch wewnętrzny, który nie ma mikroskopowego odpowiednika w mechanice klasycznej. Odpowiadający ruchowi wewn. moment pędu nazwano spinem (ang. Spin - wirować). Konsekwencją ruchu wewnętrznego elektronu są jego właściwości magnetyczne; elektron jest dipolem magnetycznym i zachowuje się jak magnez.
DOPUSZCZALNA WARTOŚĆ SPINOWEJ LICZBY KWANTOWEJ (s) s = ½ wszystkie elektrony mają tę samą wartość s = ½ spinowej liczby kwantowej i w opisie stanów kwantowych można tę liczbę pominąć.
MAGNETYCZNA SPINOWA LICZBA KWANTOWA (m) określa orientację przestrzenną wektora spinu. Dopuszczalne wartości magnetycznej spinowej liczby kwantowej (ms) ms= - ½;+ ½ każdy poziom orbitalny to dwa stany kwantowe (opisane tymi samymi liczbami n, l, m) różnią się tylko magnetyczną spinową liczbą kwantową ms;
Podpowłoka poziom orbitalny ms = + ½
Powłoka podpowłoka poziom orbitalny
Podpowłoka poziom orbitalny ms = - ½
ATOMY WIELOKRONOWE wszystkie stany kwantowe dopuszczalne dla elektronu atomu wodoru są dopuszczalne dla elektronów atomów wieloktronowych z tym, że każdy elektron danego atomu musi znajdować się w innym stanie kwantowym który jest charakteryzowany pięcioma liczbami kwantowymi (w praktyce czterema, gdyż spinowa liczba kwantowa jest stała dla wszystkich stanów kwantowych).
ZAKAZ PAULIEGO w atomie nie mogą istnieć elektrony opisane tymi samymi wartościami wszystkich liczb kwantowych
KWANTOMECHANICZNY OPIS ROZMIESZCZENIA ELEKTRONÓW W ATOMIE
1)okr. liczby elektronów w każdej powłoce
2)rozmieszczenie elektronów w każdej podpowłoce
3)rozmieszczenie elektronów w poziomach orbitalnych
ad1. OKREŚLENIE LICZBY ELEKTRONÓW W POWŁOKACH stosuje się umowny zapis składający się z literowego symbolu powłok zajętych częściowo lub całkowicie przez elektrony indeksu prawego górnego
np. dla atomu chloru 17Cl : K2 L8 M7
ad.2ROZMIESZCZENIE ELEKTRONÓW W KAŻDEJ PODPOWŁOCE. Do zapisu liczby elektronów w podpowłokach (do zapisu tzw. konfiguracji elektronowej) wykorzystuje się główną liczbę kwantową (wartość głównej liczby kwantowej = numer powłoki) i poboczną liczbę kwantową (symbol literowy podpowłoki), np. dla atomu chloru 17Cl
liczba elektronów w podpowłoce
1s2 2s2 3p6 3s2 3p6
główna liczba kwantowa symbol podpowłoki
od.3.ROZMIESZZENIE ELEKTRONÓW W POZIOMACH ORBITALNYCH przedstawia się w postaci prostokątów („klatek”), w których elektrony symbolizuje się strzałkami sklarowanymi charakteryzują elektrony różniące się wartością magnetycznej spinowej liczby kwantowej tzn. + ½ lub - ½
dla atomu chloru 17Cl
1s2 2s2 2p6 3s2 3p6
Elektrony sparowane (o skompresowanych spinach) dwa elektrony obsadzające ten sam poziom orbitalny różniące się tylko wartością liczby ms
REGUŁA HUMDA
1.W danej podpowłoce powinna być możliwie duża liczba elektronów niesparowanych
2.Niesparowane elektrony, znajdują poziomy orbitalne danej podpowłoki, mają identyczną orientację spinu
3.Pary elektronowe tworzą się dopiero po zajęciu wszystkich poziomów orbitalnych danej podpowłoki przez elektrony niesparowane, np. dla C8
1s2 2s2 2p2
dla 7N dla 8O
1s2 2s2 2p3 1s2 2s2 2p4
dla 9F dla 10Ne
1s2 2s2 2p5 1s2 2s2 2p6
ATOM umownie można wydzielić rdzeń atomowy (jądro atomowe i część elektronów) i elektrony walencyjne
ELEKTRONY WALENCYJNE elektrony o największej energii biorącej udział w procesach chemicznych i decydujące o właściwościach pierwiastka
BLOKI ELEKTRYCZNE - dodatkowy podział układu okresowego pierwiastków związany z lokalizacją tzw. elektronów walencyjnych
1.Pierwiastki bloku energetycznego s
-do bloku energetycznego s należą: pierwiastki grup 1i2(IA,IIA)
-nazwa konfiguracji elektronowej ns
-elektrony walencyjne znajdują się - podpowłoka s powłoki n (1 lub 2 elektrony)
-nowo przybywające elektrony w atomach pierwiastków bloku s znajdują podpowłokę s, należącą do powłoki o numerze równym głównej liczbie kwantowej n (równej) numerowi okresu, w którym znajduje się dany pierwiastek
2.PIERWIASTKI BLOKU ENERGETYCZNEGO P
-Do bloku energetycznego p należą pierwiastki grup 13 do 18 (IIIAdoVIIIA)
-nazwa konfiguracji elektronowej ns, np.
-elektrony walencyjne znajdują się: powłoka ostatnia czyli są to 3÷6 elektronów, z czego 2 podpowłoce s, reszta w podpowłoce p
-nowo przybywające elektrony w atomach pierwiastków bloku p znajdują podpowłokę p, należąca do powłoki o numerze równym głównej liczbie kwantowej n (równej numerowi okresu w którym znajduje się dany pierwiastek)
3. PIERWIASTKI BLOKU ENERGETYCZNEGO D:
-do bloku energetycznego d należą: pierwiastki grup3do12(gr.B)
-nazwa konfiguracji elektronowej (n-1) d, ns
-elektrony walencyjne znajdują powłokę s powłoki n
podpowłoka d powłoki (n-1)
-nowo przybywające elektrony
w atomach pierwiastków bloku d nowo przybywające elektrony znajdują podpowłokę d należącą do powłoki o numerze o jeden mniejszy od numeru okresu, w którym znajduje się dany pierwiastek
4.PIERWIASTKI BLOKU ENERGETYCZNEGO f:
-do bloku energetycznego f należą: lantanowce i aktynowce
-nazwa konfiguracji elektronowej ( n - 2 ) f , ( n - 1 ) d , ns
-elektrony walencyjne znajdują się powłoka s powłoki n
podpowłoka d powłoki ( n - 1 )
podpowłoka f powłoki ( n - 2 )
-nowo przybywające elektrony
W atomach pierwiastków bloku f nowo przybywające elektrony znajdują podpowłokę f , należącą do powłoki o numerze o dwa mniejsze od numeru w którym znajduje się dany pierwiastek
Przykłady zastosowań i uwagi
Kolejność pisana konfiguracji stanów podstawowych
podpowłoka |
l.elektronów |
Konf. elektronow |
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p |
1 (H i He) 2 (Li i Be) 6 (Bo + Ne) 2 (Na I Mg) 6 (Al. + Ar) 2 (K i Ca) 10(Sc + Zn) 6 (Ca + Kr) 2 (Rb i Sr) 10 (Y + Cd) 6 (In + Xe) 2 (Cs i Ba) 14 (Ce + Lu) 10 (Ca + Hg) 2 (Ti + Pb) |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 |
Np. Ge: 1s22s22p43s24s33d104p3
UWAGI:
-podane wyżej reguły obsadzania poziomów energetycznych dotyczą stanu podstawowego atomu. Jeżeli atom pochodnie określona ilość energii, to może nastąpić przeniesienie jednego lub kilku elektronów na wyższe poziomy energetyczne (do tzw. stanu wzbudzonego).
-spośród stanów wzbudzonych najważniejsze są stany walencyjne (warunkujące tworzenie wiązań).
-walencyjnie wzbudzone atomy powstają w wyniku rozłączenia pary elektronowej z poziomu orbitalnego o największej energii i wzbudzenie elektronu walencyjnego do najbliższego stanu energetycznego, np. elektrony walencyjne C:
-stan podstawowy (konfiguracja elektronów walencyjnych
2s22p2 =>wartościowość II)
2s2 2p6
-stan wzbudzony (konfiguracja elektronów walencyjnych
2s22p4 => wartościowość III)
2s2 2p4
-stan wzbudzony (konfiguracja elektronów walencyjnych
3s2 3p4
ELEKTRONY WALENCYJNE
-stan podstawowy(konfiguracja elektronów walencyjnych
3s23p4 => wartościowość II)
3s2 3p4
-stan wzbudzony (konfiguracja elektronów walencyjnych
3s2 3p3 3d1
-stan wzbudzony (konfiguracja elektronów walencyjnych
3s13p33d2 = > wartościowość VI)
3s1 3p3 3d2
ELEKTRONY W CZĄSTECZKACH
1.łączenie się atomów w cząsteczki (tworzenie wiązań chemicznych) - konsekwencja dążenia układów do obniżenia swej energii
UWAGI:
1.Powstawaniu wiązania chemicznego tworzymy
-zmiana rozkładu gęstości ładunku elektronowego
-obniżenie energii układu
2.Minimum energii nie posiadają dwa atomy, które nie tworzą cząsteczki ( np. dwa atomy He)
ENERGIA WIĄZANIA różnica sumy energii atomów izolowanych ( w dużym oddaleniu od siebie) oraz energii cząsteczki (równowagowej odległości jąder)
Uwaga: energia oddziaływania na siebie atomów izolowanych jest równa zero
ENERGIA WIĄZANIA
-dla procesu egzotermicznego (egzoenergetycznego) znak „ - ” (wydzielenie ciepła)
-dla procesu endotermicznego (endoenergetycznego) znak „ + ” (pobieranie ciepła)
uwaga: tworzenie każdego wiązania jest procesem egzotermicznym (Δ E < 0), np. H + H = H2 - 436 (kJ / mol H2)
DROBINA (CZ.CHEMICZNA, INDYWIDUM MOLEKULARNE) - strukturalny składnik materii utworzony z jąder i elektronów (np. atom, cząsteczka, jon)
DROBINY
-jednojądrowe (atomy oraz jony proste, np. Fe, Na+, S2)
-wielojądrowe (cząsteczki oraz jony złożone S2-4, NH4+
PRZEWIDYWANIE BUDOWY PRZESTRZENNEJ DROBIN współczesna wiedza pozwala na przewidywanie budowy drobin wielojądrowych składających się z pierwiastków grup głównych (jedną z najprostszych - metoda Vsepr)
METODA Vsepr (Vallance Shall Elektron Pair Repulsion - oddziaływanie par elektronowych powłok walencyjnych)
ZAŁOŻENIE MODELU UPROSZCZONEGO
1.drobina zbudowana jest z rdzeni atomowych i elektronów walencyjnych
2.do elektronów walencyjnych zalicza się elektrony walencyjne wszystkich atomów (łącznie z nadmiarowymi anionów i ich brakiem w kationach), np. O2: Lel.wal.= 2 · 6 = 12
SO2: : Lel.wal.= 1 · 6 + 2 · 6 = 18
CO3-2: Lel.wal. = 1 · 4 + 3 · 6 + 1 · 2 = 24
NH4+: Lel.wal = 1 · 5 + 4 · 1 - 1 · 1 = 8
3.eozpatrujemy drobinę wielojądrową spełniające warunki
-można z niej wyodrębnić atom centralny;
-atom centralny jest połączony z atomami, a nie z grupami atomów (np. OH) istota uproszczona wersji metody Vsepr (atomy lub grupy połączone z atomem centralnym = ligandy)
4.O geometrii drobin (o wzajemnym połączeniu jąder atom. wchodzących w skład drobin) decyduje tzw. liczba przestrzenna
Lp = Lwpe + L δ
Lwpe - liczba wolnych par elektronowych atomu centralnego
L δ - liczba wiązań o łączących atom centralny z ligandami
PODSTAWOWE ZASADY METODY VSEPR
1.O geometrii drobin decyduje liczba przestrzenna Lp.
2.parom elektronowych, decydującym o geometrii drobin odpowiadają określone obszary orbitalne, a ich orientacja przestrzenna jest maksymalnie symetryczna
3.Poszczególne pary elektronowe odpychają się jednak z różną siłą: najsilniej odpychają się wolne pary elektronowe, słabiej odpychają się wolne pary elektronowe i para wiązanie δ, najsilniej odpychają się dwie pary δ
4.Atomy - ligandy mają oktet elektronowy (wyjątek stanowi wodór, który ma dublet elektronowy)
PODSUMOWANIE
1.ATOM CENTRALNY - LIGANDY
a)Drobiny zawierające atom centralny i ligandy w postaci atomowej H - N - H H - C - H
H O
b)Drobiny zawierające atom centralny i ligandy o postaci grup
H - O - S - O - H H2N - C - NH2
O O
c)Drobiny w których nie można wyodrębnić atomu centralnego
H2C - CH2 H2C = CH2 HC ≡ CH
ELEKTRONY WALENCYJNE DROBIN
ORIENTACJA PRZESTRZENNA OBSZARÓW ORBITALNYCH (Z ZAŁOŻENIEM PEŁNEJ SYMETRII ORIENTACJI)
-liczba przestrzenna Lp = 2 (symetria liniowa - digonalna)
-liczba przestrzenna Lp = 3 (symetria trójkątna - trygonalna)
-linia przestrzenna Lp = 4 (symetria czworościenna-tetradyczna)
PRZYKŁADY OKREŚLANIA BUDOWY PRZESTRZENNEJ DROBIN
a) BaF2
1.Określenie konfiguracji elektronowej pierwiastków tworzących związek (podkreślany elektron walencyjne ostatniej powłoki
4Be: 1s22s2; 9F: 1s22s22p5
2.Ustalenie atomu centralnego F - Be - F
3.Narysowanie elektronów walencyjnych (w różnych sposób zaznaczyć elektrony walencyjne atomu centralnego i ligandów)
F δ Be δ F
4.Obliczenie liczby przestrzennej
Lp = Lwpe + L δ = 0 + 2 = 2
5.Narysowanie struktury (budowy przestrzennej) F - Be - F
b)BF3
1.5B: 1s22s22p1 9F: 1s22s22p5
2. F - B - F
F
3. F δ B δ F
4. Lp = Lwpe + L δ = 0 + 3 = 3 F
5.
c)PbCl2
1. 82Pb: 1s22s22p64s23d104p65s24d105p66s24f145d106p2
2. 17Cl : 1s22s22p43s23p5
3. Cl - Pb - Cl
4. Lp = Lwpe + L δ = 1 + 2 = 3
5.
d). CH4
1. 6C
UWAGI:
-z przykładu f wynika właściwość, z powodu której woda naz. jest „rozpuszczalnikiem polarnym”
-ogólna zasada: „rozpuszczalniki polarne” są dobrymi rozpuszczalnikami dla związków jonowych (np. H2O dobrze rozpuszcza NaCl)
UKŁĄD OKRESOWY PIERWISTKÓW
PROWO OKRESOWOŚCI
1.1969r. Dymitr Mendelejew - właściwości chemiczne i fizyczne pierwiastków funkcję okresową masy atomowej (wyjątek: orgon - potas, kobalt - nikiel, tellur - jod)
2.1913r Henry Moseley - właściwości chemiczne i fizyczne pierwiastków funkcję okresową liczby atomowej
FORMA KRÓTKA - UKŁAD DYMITRA MENDELEJEWA
Grupy - pionowe grupy dzielące się na główne A i poboczne B (tzw. podgrupy) ozn. są liczbami rzymskimi
-grup głównych jest B grup pobocznych jest B
-nazwa każdej grupy głównej (A) i każdej grupy pobocznej (B) (wspólna nazwa pierwiastków tych grup) wywodzi się od nazwy pierwszego pierwiastka w grupie
-stosuje się nazwy części grup - od pierwszego pierwiastka danej części, np. chlorowce (tzw. chlor, brom, jod, astat)
FORMA DŁUGA - UKŁAD ALFERDA WERNERA
-pierwiastki grup pobocznych stanowią „przejście” między pierwiastkami grup głównych => pierwiastki „przejściowe” (bez miedziowców, ale z lantanowcami i aktynowcami)
-grupy główne: IA, IIA => 1,2 ; IIIA ... VIIIA => 13, ... 18
-poboczne: IB, IIB => 11, 12 ; IIIB, VIII => 3, ... 7
VIIIB - B(żelazowce), 9 (kobalkotce), 10 (nikielowce)
PRAWIDŁOWOŚCI W UKŁADZIE OKRESOWYM
1.WŁAŚCIWOŚCI
-maksymalna wartościowość pierwiastków grup głównych jest równa numerowi grup (wyjątkiem jest tlen, fluor, helowce)
-wartościowość pierwiastków grup głównych IA + IVA w związkach z wodorem i metalami jest równa numerowi grup
-wartościowość pierwiastków grup głównych VA + VIIA w związkach z wodorem i metalami jest równa VIII minus numer grupy
Nr.gr. głównej |
I |
II |
III |
IV |
V |
VI |
VII |
Wartościowość max |
I |
II |
III |
IV |
V |
VI |
VII |
Wartościowość w związkach z wodorem i metalami |
I |
II |
III |
IV |
III |
II |
I |
-maksymalna wartościowość pierwiastków grup pobocznych jest zwykle zgodna z numerem grup (wyjątek grupa IB maksymalna wartościowość bywa tam wyższa, np. CuO, Au2O3)
AKTYWNOŚĆ CHEMICZNA - dla pierwiastków metalicznych rośnie ze wzrostem liczby atomowej
-dla pierwiastków niemetalicznych maleje ze zwrotem liczby atomowej
-w każdym okresie aktywność zmienia się od bardzo dużej (np. lit) poprzez małą, do bardzo dużej (np. fluor)
-każdy okres kończy się helowcami (pierw. nieaktywnymi)
-na początku każdego okresu są metale, na końcu niemetale - widać to na przykładzie właściwości tlenków pierwiastków III okresu
Wzory tlenków |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O7 |
SO7 |
Cl2O7 |
Produkty reakcji tlenków z wodą |
NaOH |
|
|
|
|
|
|
Wzór charakteru kwasowego
Wzór charakteru zasadowego
SYSTEMATYKA ZWIĄZKÓW NIEORGANCIZNYCH
PODZIĄŁ ZWIĄZKÓW NIEORGANICZNYCH
Tlenki, wodorki, wodorotlenki, kwasy, sole, związki niemetali innych niż tlen, np.( PCl, CS, SF)
TLENKI są to związki pierwiastków z tlenem: wzór ogólny EnOm gdzie E - dowolny pierwiastek n,m - współczynnik
OTRZYMYWANIE
1.bzpośrednia reakcja pierwiastka z tlenem, np. S + O2 = SO2
2.utlenianie tlenków, np. 2SO2 + O2 = 2SO3
3.reakcjatlenków, np. CO2 + C = 2 CO
4.reakcje termicznych soli lub wodorotlenków, np.
CaCO3 = CaO + CO2 lub Cu(OH)2 => Cuo + H2o
5.spalanie związków organicznych, np. CH4 +2O2 = CO2 + 2H2O
6.rozkład kwasów tlenkowych, np. H2SO3 = CO2 + H2O
7.reakcje soli stałych kwasów tlenowych z kwasami mocnymi, np. Na2CO3 +HCl = NaCl + CO2 + H2O
właściwości fizyczne tlenki metali są zwykle ciałami stałymi o dużej gęstości i wysokiej temperaturze topnienia (500÷3000°C) tlenki litowców i berylowców rozpuszczają się w wodzie, tlenki pozostałych metali nie rozpuszczają się w wodzie. Tlenki niemetali są zwykle gazami (CO, CO2, SO2, SO3, NO, NO2)
WŁAŚCIWOŚCI CHEMICZNE tlenki dzieli się ze względu na zachowanie względem kwasów, zasad i wody:
1.tlenki zasadowe, czyli reagujące z kwasami, są to tlenki metali, a produktem reakcji są sole, np. Na2O + 2HCl = 2NaCl + H2O, (są także niezasadowe tlenki metali, np. CrCO2, Mn2O7). Tlenki metali grup IA, IIA zwane też bezwodnikami zasadowymi reagują z wodą dając wodorotlenki o charakterze zasadowym, np. Na2O + H2O = 2NaOH. Zasadowe tlenki pozostałych metali na ogół nie reagują z wodą (np. CrO, MnO) TLENKI ZASADOWE NIE REAGUJĄ Z ZASADAMI
2. Tlenki kwasowe czyli reagujące z żasadmi są to zwykle tlenki niemetali a tkaże tlenki metali na wyższym stopniu utlenienia np. Cro3 Mn2O7
tlenki kwasowe w reakcjach z zasadami i tlenkami zasadowymi tworzą sole np2NaOH+SO3=Na2SO4+H2O CaO+CO2=CaCO3
tlenki kwasowe zwane są bezwodnikami kwasowymi gdyż w reakcjach z wodą tworzą kwasy tlenowe np. SO3+H2O=H2SO4
niektóre tlenki kwasowe nie regują z wodą np. SiO2
TLENKI KWASOWE NIE REAGUJĄ Z KWASAMI
3 Tlenki amfoteryczne czyli tlenki reagujące zarówno z kwasami jak i z zasadami
Produktem reakcji z kwasami i zasadami jest sól
ZnO+H2SO4=ZnSO4+H2O
Cynk stał się kationem w soli
ZnO+2NaOH=Na2ZnO2+H2O
Cynk stał się częścią anionu cynkowanego ZNO2 2-
Tlenki amfoteryczne na ogół nie rozpuszczająsię w wodzie
4 Tlenki obojętne czyli nie reagujące z kwasami i zasadami. Do tej grupy należą m.in. CO NO. Tlenki te nie reagują z wodą a mogą mogą rozpuszczać się w wodzie jedynie fizycznie nie są to bezrodniki kwasów i zasad
Podział tlenków
(tlenki metali i niemetali)
Tlenki metali Tenki niemetali
Na2O CaO MnO CrO3 Al2O3 SO3 CO2 SiO2 As2O3
Kwasowe
SO3 CO2 CrO3
Amfoteryczne
Al2O3 As2O3
WODORKI
Są to związki pierwiastków z wodorem
HnE lub Ehn
E-dowolny pierwiastek n- wspóczynnki
HnE- niemetale
Ehn - metale
Otrzymywanie
Większość wodorotlenków otrzymuje się w bezpośredniej reakcji pierwiastków z wodorem
H2+Cl2=2HCl
3H2+N2=2NH3-niegodne z zasadą
Ca+H2=CaH2
Właściwości fizyczne
Wodorotlenki metali są ciałami stałymi wodorotlenki niemetali są przeważnie gazami
Właściwiści chemiczne
Wodorotlenki metali gwałtownie reaguja z wodą tworząc zasady wydzielając przy tym wodór
CaH2+H2)=Ca(OH)2+2H2
Wodorotlenki niemetali
1 wodorotlenki tlenowców i fluorowców rozpuszczają się w wodzie a ich wodne roztwory nazywają się kwasami beztlenowymi np.
wodny roztwór fluorowodoru HF kwas fluorowodorowy
wodny roztwów chlorowodoru HCl kwas chlorowodorowy (kwas solny)
2 Amoniak
jedyny wodorotlenek który reagując z wodą tworzy związek zasadowy
NH3+H2O=NH4OH
3 pozostałe wodorki nie reagują z wodą
WODOROTLENKI
Są to związki o wzorze ogólnym
M(OH)m
M-metal OH gr. Wodorotlenowa-hydroksylowa
Otrzymywanie
Wodorotlenki litowców i berylowców otrzymuje się dwiema metodami
w reakcji tlenku z wodą
Li2O+H2O=2LiOH
w reakcji metalu z wodą
2Na+2H20=2NaOH+H2
2 Inne metale i ich tlenki w większości przypadków nie reaguje z wodą. Wodorotlenki otrzymuje się wtedy z połączenia rozpuszczonej soli danego metalu i silnie zasadowego wodorotlenku CuSO4+2NaOH=Cu(OH)2+Na2SO4
Właściwiści fizyczne
Wodorotlenki są na ogół ciałami stałymi Wodorotlenki litowców i berylowców rozpuszczają się w wodzie wyjątek Be(OH)2 i Mg(OH)2 Wodorotlenki o silnych właściwościach zasadowych przede wszystkim NaOH i KOH nazywane są alkaliami a ich wodne roztowory ługami.Ługi popdują bolesne trudno gojenie się skóry
Właściwości chemiczne
Wszystkie wodorotlenki reagują z kwasami a niektóre także z zasadami
1 Wodorotlenki zasadowe czyli reagujące z kwasami a niereagujące z zasadami
Są to wodorotlenki metali gr, 1A i 2A wyjatej Be(OH)2 - amfoteryczny i kilka innych metali
2 Wodorotlenki amfoteryczne czyli reagujące z kwasami i zasadami są to np.
Zn(OH)2+H2SO4-ZnSO4+2H2O
Cynk stał się kationem w soli
Zn(OH)2+2NaOH-Na2ZnO2+2H2O
Cynk stał się częśćią anionu cynkowego Zn2 2-
Większość wodorotlenków amfoterycznych jest nierozpuszczalna w wodzie
KWASY
Są to związki o wzorze ogólnym
HnR
R- reszta kwasowa prosta Cl- S2- złożona SO4 2-
Otrzymywanie
Kwasy tlenowe moża uzyskać rozuszczając w wodzie odpowiedni bezwodnik kwasowy (tlenek kwasowy)
SO3+H2O=H2SO4
P2O5+3H2O=2H3PO4
Jeżeli bezwodnik kwasowy nie reaguje z wodą np. SiO2 to kwas może otrzymać
Np. Na2SiO3+2HCl=H2SiO3 + 2NaCl
Kwasy beztlenowe otrzymuje się rozpuszczając w wodzie odpowiednie wodniki
Właściwości chemiczne
1 podstawową cechą jest zdolność do reaogowania z zasadami z utorzeniem soli
np. NaOH+HCl=NaCl+H2o
2 Większość kwasów reaguje niemal ze wszystkimi metalami
metal+kwas=sól+wodór
Zn +2HCl=ZnCl+H2
3Kwasy reagują z większością tlenków metali z wytworzeniem soli
CuO+H2SO4=CuSO4+H2O
SOLE
Są to związki o wzorze ogólnym
MnRm lub Mn(HkRm) lub [M(OH)k]nRm
M-metal R-reszta kwasowa
Otrzymywanie
Reakcja kwasów z zasadami
Zasada+kwas=sól +woda
NaOH+HCl=NaCl+H2O
reakcja tlenku zasadowego z kwasem
tlenek zasadowy + kwas=sól+ woda
Fe + H2SO4=FeSO4+H2O
rekcja zasady z tlenkiem kwasowym
zasada + t.kwasowy = sól + woda
2NaOH + CO2=Na2CO3 + H2O
reakcja t. Zasadowego z t. Kwasowym
t. zasadowy + t. kwasowy = sól
CaO +CO2= CaCO3
reakcja kwasu z niektórymi metalami
metal +kwas = sól + wodór
Zn +H2SO4=ZnSO4+H2
reakcja niektórych metali z niektórymi niemetalami
metal + niemetal = sól
reakcja soli z kwasem
sól + kwas = sól + kwas
CaCO3+ H2SO4= CaSO4 +H2CO3
(H2O +CO2)
PODZIAŁ SOLI
SOLE
SOLE WODOROSOLE HYDROKSYSOLE
OBOJĘTNE
Sole obojętne
MnRm
Al.2(SO4)3
Wodorosole (sole kwaśne)
Mn(HkR)m
NaHSO4 Na2HPO4
Wodorosole są to sole wywodzące się z kwasów wielowodorowych w których nie wszystkie kwasowe atomy wodoru zostały zastąpione metalem
Kwasy jednowodorowe nie tworzą wodorosoli
Hydroksysole (sole wodorotlenkowe) sole zasadowe
[M(OH)k]nRm
np. Ca(OH)Cl [Al(OH)2]2SO4]
Hydroksysolami nazywamy sole wywodzące się z zasad dwu lub więcej wodorotlenowych w których nie wszystkie grupy wodorotlenkowe -hydroksylowe zostały zastąpione resztami kwasowymi
Zasady jednowodorotlenowe nie twodzą hydroksysoli
ELEKTOUJEMNOŚĆ PIERWIASTKÓW
Reakcje chemiczne - tworzenie wiązń chemicznych- polegają na oddawaniu przyjmowaniu lub uwspólnieniuelektronów poprzez atomy reagujących ze sobą pierwiastków
Regóła oktetu w procesie tworzenia wiązań chemicznych atom oddaje pobiera lud uwspólnia taką liczbe elektonów aby w zewnętrznej powłoce uzyskać 8 elektronów walencyjnych - wyjatek H dąży do 2 elektronów
-teoria LEWISA i KOSSELA-gdy pierwiastki łączą się w związki chemiczne ich atomy dążą do uzyskania konfiguracji walencyjnej walencyjnej najbizszego w układzie helowca
Regóła dubletu - liczba wiązań kowalencyjnych które może utrzymać atom jest równa liczbie niesparowanych elektronów walencyjnych -wiązanie powstaje wtedy gdy dwa elektrony pochodzące od dwóch róznychcatomów pierwiastka utworzą dublet czyli pare o przeciwnie sparowanych spinach
Elektroujemność jest to zdolność atomów do wiązania własnychi obcych elektronów
Pierwiastki których atomy słabo wiążą elektrony walencyjne i w równwnich chemicznych łatwo je oddają przekształcając się w jony dodatnie mają małą elektroujemność-dużą elektrododatność i chrakter metaliczny
Pierwiastki których atomy mocno wiążą własne elektrony walencyjne i w reakcjach chemicznych wykazują tendencje do przyłączania obcych elektronów tworząć jony ujemne mają dużą elektroujemność i chrakter niemetaliczny
Skal elektroujemniści Linusa Paulinga-elektroujemności Paulinga są zawartymi w przedziale od 0,7 (Cs) do 0,4 (F)
WIĄZANIA CHEMICZNE
Tworzenie wiązań chemicznych jest skutkiem dążenia układów do mineralizacji energii
Podstawowe rodzaje wiązań chemicznych
jonowe
kowalencyjne
kowalencyjne polarne
metaliczne
koordynacyjne
wodorowe
W. jonowe
Powstają między atomami pierwiastków skrajnie rózniących się elektroujemnością
Polega ono na przejściu jednego lub kilku elektronów walencynych z atomu pierwiastka elektrododatniego do atomów pierwiastka elektroujemnego
W praktyce przyjmuje się że wiązanie ma charakter jonowy gdy różnica elektroujemności atomów w skali Pauliego wynosi nie mniej niż 1,7 Do związków jonowych należą tlenki litowcówi berylowców bez berylu sole wodorotlenki tlenki metali
Właściwiści związków jonowych
w związkach o wiązaniach jonowych siły między atomami cząstek sąsiednich są znacznie -są siły elektrostatyczne i dlatego w zwykłych warunkach związki te są krystalicznymi całami stałymi , twardymi o względnie wysokich tem. topnienia , wrzenia
w zdecydowanej większości związki jonowe dobrze rozpuszczją się w rozpuszczalnikach polarnych np. w wodzie
stałe związki jonowe nie przewodzą prądu elektrycznego w stanie ciekłym - (stopione lub w roztworach wodnych) przewodzą prąd gdyż jony uwolnione z sieci krystalicznej uzyskują zdolność poruszania się
reakcje z udziałem związków jonowych przebiegają z bardzo dużą szybkością
WIĄZANIAKOWALENCYJNE POLARNE
SPOLARYZOWANE
Wiązania spolaryzowane są pośrednimi między jonowymi a kowalencyjnymi. Powstają gdy łączą się atomy pierwiastków rózniących się elektroujemnością ale nie tak bardzo aby utworzyć wiązanie jonowe.
Cechą charakterystyczną wiązania jest przesunięcie pary elektronowej wiążącej atomy w kierunku pierwiastka bardziej elektroujemnego np. HCl para jest silniej przyciągana przez atomy chloru niż przez atomy wodoru
Przesunięcie ładunku zaznacza się za pomoca strzałi
W cząstkach tych można wyróżnić biegun dodatni i ujemny(są to cząstki dipolowe -dwubiegunowe) Miarą przesunięcia ładunku jest moment dipolarny
e- bezwzględna wartość ładunku elektrycznego zawartego w jednym z biegunów
l- odległość biegunów
Jednostka momentu dipolowego
Cm kulombometr dawna jednostka debaj D 1D=3,33 10 Cm
Przykładowe wartości momentu dipolowego
Właściwości związków w wiązanich spolaryzowanych zależą od ilościowego udziału wiązania jonowego w danym wiązaniu
WIĄZANIA METALICZNE
Powstanie wązan metalicznych polega na przekształceniu atomu jednego lub kilku metali w zbiór kationów i swobodnie poruszających się między nimi elektronów. Wiązania te istnieją tylko w stanie stałym lub ciekłym. W stanie stałym węzły sieci krystalicznej metalu lub stopu są obsadzone przez kationy mogące wykonywać tylko ruchy oscylacyjne wokół węzłów a zdelokalizowane elektrony poruszają się swobodnie w obrębie całego kryształu
Właściwiści metali i ich stopów
Metale i cih stopy (jeżeli są wypolerowane i oczyszczone) mają chrakterystyczny połysk metaliczny.
Skutkiem oscylacji rdzeni atomowych , tworzących węzły sieci krystalicznej jest dobre przewodnictwo cieplne metali
Skutkiem swobodnego ruchu elektronów jest dobre przewodnictwo elektryczne (mała rezystancja) metali
Ponieważ ze wzrostem temp wzrasta ampituda drgań kationów tworzących sieć krystaliczną , ze wzrostem temp rośnie także rezystancja metali (ze wzrostem temp elektronom trudniej jest przedzierac się między węzłami)
Specyficzną właściwością metali jest termo i fotoemisja. Zjawisko polega na wybijaniu z sieci krystalicznej elektronów przez energię dostarczoną z zewnątrz w postaci ciepła lub światła
WIĄZANIA KOORDYNACYJNE
Donorowo-akceptorowe , semipolarne
Polega na utorzeniu wiązania pary elektronów dostarczonej przez jeden atom(donor dawca) drugi atom (akceptor biorca) uzupełnia własną powłokę walencyjną elektronami donora
Warunkiem utworzenia wiązania jest zderzenie drobiny dysponującej wolną parą elektronów walencyjnych nie zaangażowanej w innych wiązanich z drobiną dysponującą luką elektronową w powłoce walencyjnej. Cechą specyficzną wiązania jest to że po jego powsaniu wszystkie elektrony walencyjne akceptora stają się rowno cenne
-powsanie kationu amonowego
reakcja amoniaku z trifluorkiem boru BF3
WIĄZANIA WODOROWE
MOSTEK WODOROWY
Waiązanie wodorowe jest słabym wiązaniem między atomem wodoru związanym chemicznie z atomem silnie elektroujemnym a atomem o dużej elektroujemności. Dysponujemy wolną parą elektronów np. atom azotu tlenu chloru
Atom wodoru -proton- może być związany równocześnie z dwoma atomami jeśli mają one małe wymiary i dużą elektroujemność. Substancje w których występują wiązania wodorowe wykazują anomalie wysoką temp topnienia i wrzenia oraz duże ciepło parowania. Dzięki wiązaniu wodorowemu mogą powstać np. dimery wody(H2O)2
ZWIĄZKI KOMPLEKSOWE
Niektóre związki chemiczne zdolne są do samodzielnego istnienia mogą reagować ze sobą. Produktem tych reakcji są nowe związki o całkowicie odmiennych własnościach. Tworzące się w ten sposób połączenia nazywane są związkami kompleksowymi-koordynacyjnymi
W Związkach kompleksowych wyróżnia się atom -jon- centlalny którym jest zwykle metal tzw centrum koordynacji. Centrum koordynacji otoczone jest zespołem cząstek - ligandami. Ligandami są cząsteczki lub jony zawierające wolne pary elektronów np. NH3 Cl -
Liczbę ligandów połączonych z centrum koordynacji nazywa się liczbą koordynacyjną. Związki kompleksowe mogą być kationami anionami lub być elektrycznie obojętne (w zależności od ładunku centrum i ligandów)
STRUKTURA CIAŁ STAŁYCH
Cechą charakterystyczną ciał stałych jest przestrzenne uporządkowanie elementów strukturalnych (cechy tej nie posiadają ciecze i gazy). Jeżeli uporządkowanie ma charakter regularny, to substancję zaliczamy do ciał krystalicznych; jeżeli uporządkowanie jest nieregularne, to substancję zaliczamy do ciał bezpostaciowych (amorficznych).
Ciała krystaliczne - w stanie stałym mają uporządkowaną, prawidłową budowę wewnętrzną. W zależności od warunków krystalizacji mogą być monokryształami lub ciałami polikrystalicznymi.
Monokryształy - pojedynczy kryształ bardzo zbliżony do kryształu doskonałego, nie zawierający zrostów, pęknięć i wrostów.
Ciała polikrystaliczne - ciała składające się z licznych, drobnych kryształów (najczęściej wielkości mikroskopowej); większość spotykanych w przyrodzie i otrzymywanych sztucznie ciał stałych jest ciałami polikrystalicznymi.
Właściwości ciał krystalicznych i bezpostaciowych:
ciała krystaliczne topią się w określonej temperaturze, charakterystycznej dla danej substancji (np. woda w 0oC); ciała bezpostaciowe przechodzą ze stanu stałego do stanu ciekłego stopniowo miękną, przechodzą przez stan plastyczny (np. szkło);
ciała krystaliczne są anizotropowe (pewne właściwości fizyczne zależą od kierunku) - anizotropowa może być wytrzymałość mechaniczna, współczynnik załamania światła, współczynnik sprężystości postaciowej, współczynnik rozszerzalności liniowej, przewodność cieplna i elektryczna, stała dielektryczna;
ciała bezpostaciowe są izotropowe - wymienione właściwości mają identyczne we wszystkich kierunkach;
cechą specyficzną kryształów jest symetria; wyróżnia się płaszczyzny symetrii, osie symetrii i środki symetrii.
REAKCJE CHEMICZNE
KLASYFIKACJA REAKCJI CHEMII NIEORGANICZNEJ
1. Reakcja syntezy - polega tworzeniu nowej substancji z dwóch lub więcej substancji
A + B |
gdzie: A i B - substraty; C - produkt
np. N2 + 3H2 ![]()
2NH3
CaO + CO2 ![]()
CaCO3
2. Reakcja analizy (rozkładu) - polega na rozkładzie substancji złożonej na dwie lub więcej substancje proste
AB |
gdzie: AB - substrat; A i B - produkty
np. CaCO3 ![]()
Ca + CO2
NaCl ![]()
![]()
![]()
+ ![]()
3. Reakcja wymiany - polega na przekształceniu dwóch lub więcej substancji w nowe o innym ugrupowaniu atomów lub jonów
3a. Reakcja wymiany pojedynczej (prostej)
3b. Reakcja wymiany podwójnej
AB + CD |
np. BaCl2 + H2SO4 ![]()
BaSO4 + 2HCl
Wszystkie wymienione typy reakcji mogą przebiegać:
ze zmianą stopnia utlenienia reagentów - są to tzw. reakcje utlenienia i redukcji (reakcje redoks)
np. 2 ![]()
bez zmiany stopnia utlenienia reagentów
np. CaO + CO2 ![]()
CaCO3
KINETYKA I STATYKA
REAKCJI CHEMICZNYCH
Kinetyka chemiczna - dział chemii fizycznej zajmujący się badaniem szybkości reakcji chemicznych i wpływu na nie różnych czynników (np. stężenia reagentów, temperatury katalizatorów) oraz wyjaśnieniem ich mechanizmów, czyli sposobów przemiany substratów w produkty reakcji
Statyka chemiczna - dział chemii fizycznej zajmujący się badaniem właściwości układów, w których zakończył się przebieg reakcji chemicznej i został osiągnięty stan równowagi chemicznej
SZYBKOŚĆ REAKCJI CHEMICZNEJ
Szybkością reakcji chemicznej nazywany jest ubytek liczby moli substratów lub przyrost liczby moli produktów w jednostce czasu
w jednostce objętości układu reakcyjnego
v = |
A A + BC
A + BC |
np. Sn + 2HCl ![]()
SnCl2 + H2
Dla reakcji chemicznej przebiegającej wg równania
nA + mB ![]()
produkty
szybkość reakcji chemicznej można zapisać także
v = k |
gdzie: k - stała szybkości reakcji chemicznej; cA i [A] oraz cB i
[B] - stężenia molowe substratu A i B; n, m - współczynniki stechiometryczne
Szybkość reakcji chemicznej zależy od częstości tzw. zderzeń efektywnych, które mogą nastąpić wtedy, gdy cząstki chemiczne mają odpowiednio dużą energię, tzw. energię aktywacji.
Na szybkość reakcji chemicznej wpływa:
Stężenie - ze wzrostem stężenia substratów rośnie całkowita liczba zderzeń, a w tym także zderzeń efektywnych (wzrost stężenia powoduje wzrost szybkość reakcji)
2. Temperatura - ze wzrostem temperatury rośnie średnia energia kinetyczna cząsteczek i liczba zderzeń efektywnych (wzrost temperatury powoduje wzrost szybkości reakcji chemicznej)
Reguła van't Hoffa - Zwiększenie temperatury układu reakcyjnego o 10K powoduje zwykle 2÷3 krotny wzrost szybkości reakcji
3. Obecność katalizatora.
Katalizator jest to substancja, która wpływa na zmianę szybkości reakcji chemicznej, pozostając po reakcji w niezmienionej postaci.
Katalizator, który zwiększa szybkość reakcji nazywa się katalizatorem dodatnim (lub katalizatorem), a katalizator zmniejszający szybkość reakcji - katalizatorem ujemnym (lub inhibitorem)
Autokataliza - kataliza, w której katalizatorem dla danej reakcji jest jeden z substratów lub produktów reakcji
Katalizator biochemiczny (biokatalizator) - związek chemiczny występujący w małych ilościach w organizmach żywych, katalizujący reakcje chemiczne
(enzymy, hormony i witaminy)
PRAWO DZIAŁANIA MAS
(Guldberg, Waage - 1867 r.)
Reakcje chemiczne są procesami odwracalnymi. Często reakcje prowadzi się w warunkach powodujących praktyczną ich nieodwracalność (np. usuwając produkty ze środowiska reakcji).
Rozpatrzmy reakcję
A + B ![]()
C + D (1)
o szybkości
v1 = k1 [A] [B] (2)
W momencie powstania pierwszych cząsteczek C i D zaczyna przebiegać reakcja przeciwna
C + D ![]()
A + B (3)
o szybkości
v2 = k2 [C] [D] (4)
Po pewnym czasie ustala się stan równowagi dynamicznej i szybkości obydwu reakcji zrównują się
A + B ![]()
C + D (5)
Wtedy też
v1 = v2
czyli
k1 [A] [B] = k2 [C] [D] (6)
a stąd
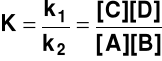
(7)
gdzie K - stała równowagi reakcji chemicznej.
Zależność (7) nazywa się „prawem działania mas” lub „prawem równowagi chemicznej” - w stanie równowagi stosunek iloczynu stężeń produktów do iloczynu stężeń substratów jest wielkością stałą, charakterystyczną dla danej reakcji w danej temperaturze
Dla reakcji
aA + bB + ![]()
cC + dD + (8)
stała równowagi ma postać
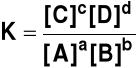
(9)
REGUŁA PRZEKORY
(REGUŁA LE CHATELIERA, 1887 r.)
Każdy układ w stanie równowagi, poddany działaniu zewnętrznemu naruszającemu ten stan równowagi ulega takim zmianom, które zmniejszają to działanie.
Podstawowe działania zewnętrzne:
Stężenie reagentów
dodatek substratu lub usunięcie produktu powoduje przesunięcie równowagi w prawo (w kierunku wzrostu stężenia produktów)
dodatek produktu lub usunięcie substratu powoduje przesunięcie równowagi w lewo (w kierunku wzrostu stężenia substratów)
Zmiany stężenia nie powodują zmiany stałej równowagi |
Ciśnienie (odpowiednik stężenia dla reakcji przebiegających w stanie gazowym)
wzrost ciśnienia przesuwa równowagę w prawo, gdy objętość substratów jest większa od objętości produktów
wzrost ciśnienia przesuwa równowagę w lewo, gdy objętość substratów jest mniejsza od objętości produktów
ciśnienie nie wpływa na równowagę procesu, gdy objętość substratów jest równa objętości produktów
Zmiany ciśnienia nie powodują zmiany stałej równowagi |
Temperatura
a) podwyższenie temperatury układu, w którym przebiega reakcja endotermiczna, powoduje przesunięcie równowagi w prawo
b) podwyższenie temperatury układu, w którym przebiega reakcja egzotermiczna, powoduje przesunięcie równowagi w lewo
Stała równowagi: ze wzrostem temperatury wzrasta dla reakcji endotermicznych i maleje dla reakcji egzotermicznych |
Katalizator
Nie wpływa na równowagę i stałą równowagi; wpływa na czas osiągnięcia równowagi
DYSOCJACJA ELEKTROLITYCZNA (JONOWA)
Dysocjacja elektrolityczna - rozpad cząsteczek na jony jako wynik oddziaływania między substancją rozpuszczoną a rozpuszczalnikiem
Elektrolity substancje, które po rozpuszczeniu w wodzie lub innym rozpuszczalniku polarnym rozpadają się na jony (Arrhenius, 1887).
Elektrolitami są związki o wiązaniach jonowych i kowalencyjnych spolaryzowanych (kwasy, wodorotlenki. sole, i wodorki kwasowe)
Nieelektrolitami są prawie wszystkie związki organiczne
(wyjątek kwasy karboksylowe)
Stała dysocjacji. Dla elektrolitu typu AB, dysocjującego na jeden kation A+ i jeden anion ![]()
AB ![]()
![]()
stała (równowagi reakcji) dysocjacji ma postać
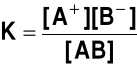
gdzie: [A+], [![]()
] - stężenie jonów; [AB] - stężenie cząsteczek niezdysocjowanych
Stała równowagi nie zależy od stężenia roztworu, zależy od temperatury (p. stała równowagi reakcji chemicznej)
W przypadku substancji dysocjujących wielostopniowo (np. kwasu fosforowego), kolejnym stopniom dysocjacji odpowiadają różne stałe dysocjacji (kolejne stopnie dysocjacji mają coraz to mniejsze stałe)
Stopień dysocjacji (służy do określania mocy elektrolitu). Jest to stosunek liczby cząsteczek zdysocjowanych Nz (stężenia cząsteczek zdysocjowanych Cz) do liczby cząsteczek wprowadzonych do roztworu Nw (całkowitego stężenia elektrolitu Cw)
= 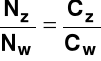
Stopień dysocjacji zależy od:
rodzaju elektrolitu i rozpuszczalnika;
stężenia roztworu (wzrasta w miarę rozcieńczania roztworu);
temperatury (zwykle rośnie ze wzrostem temperatury);
obecności innych substancji w roztworze
Moc elektrolitów określa się za pomocą stałej dysocjacji lub stopnia dysocjacji (α > 0,3 - elektrolit mocny; 0,05<α<0,3 - elektrolit średniej mocy; α<0,05 - elektrolit słaby)
HYDROLIZA SOLI
Hydroliza - rozkład substancji chemicznych organicznych
i nieorganicznych pod wpływem wody, przy czym produkty rozkładu składają się z elementów budowy substancji ulegającej hydrolizie
i wody
Hydroliza zasadowa (produkt hydrolizy ma odczyn zasadowy)
Sole słabych kwasów i mocnych zasad w wodzie ulegają całkowitej dysocjacji
np. CH3COONa |
CH3CO |
+ Na+ |
26
Wyszukiwarka
Podobne podstrony:
pwsz kalisz Budownictwo-WYKLAD!!, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, V Budowni
pwsz kalisz Biologia i ekologia - wykład, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Biologia
pwsz kalisz Dobra! Kanalizacja-wyklady!!!, inżynieria ochrony środowiska kalisz
Podsta~1-wykłady, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Ekonomia
pwsz kalisz Biologia i ekologia - wykład-całość, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Bi
ściagi wykłady tosik, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś
pwsz kalisz sciaga z chemi cz2-o2, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Chemia rok 1
pwsz kalisz sciaga chemia-O1, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Chemia rok 1
Przedsiebi, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś pwsz kalis
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz kalisz rozporzadz, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, VI odzysk ciepla ob
W-14, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, Meteorologia materialy
W-10, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, Meteorologia materialy
OCHRONA POWIETRZA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, IV ochrona powietrza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
pwsz kalisz Metody oznaczania mikroorganizmów w powietrzu, inżynieria ochrony środowiska kalisz, a p
Wentylatory 2003, inżynieria ochrony środowiska kalisz, z mix inżynieria środowiska moje z ioś pwsz
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
więcej podobnych podstron