Kinetyka reakcji hydrolizy estru w obecności mocnego kwasu.
Katalizatorami nazywamy substancje przyśpieszające reakcje chemiczne , pozostające w niezmienionej ilości po zakończeniu reakcji. Charakterystyczne jest przy tym , że bardzo małe ilości substancji katalitycznej , w porównaniu z ilościami substratów , mogą mieć bardzo silny wpływ na szybkość reakcji.
W roztworach szczególnie jest rozpowszechniona kataliza kwasowo - zasadowa . Dzieje się tak dlatego , że przyłączenie lub oderwanie protonu od cząsteczki zmienia w istotny sposób jej reaktywność. Z drugiej strony równowagi protolitycznej , zwłaszcza w roztworze wodnym , są bardzo pospolite.
W przypadku hydrolizy estrów katalizowanej kwasami , pierwszym etapem reakcji jest przyłączenie protonu do tlenu karbonylowego. Powstający kation , w którym ładunek dodatni w wyniku przemieszczenia gęstości elektronowej jest w znacznym stopniu zlokalizowany na atomie węgla ( jon karboniowy ) , znacznie łatwiej przyłącza cząsteczkę wody. Kation taki jest nietrwały , a odszczepienie grupy metoksylowej jest znacznie łatwiejsze. Reakcję katalizowaną przez kwas można przedstawić:
S +AH ![]()
SH+ + A- ![]()
P + AH (*)
Gdzie : S- substrat P - produkt
Sposób zapisu reakcji wykazuje równocześnie , że kwas katalizuje także reakcje odwrotną , co jest ogólną cechą katalizatorów .Działanie katalityczne kwasu , zależy od łatwości odszczepiania od niego protonu tzn. od stałej równowagi dysocjacji AH![]()
A- + H+ , a nie od rodzaju kwasu.
Rozważmy teraz dokładniej stosunki kinetyczne poszczególnych etapów reakcji (*). Jeżeli stała szybkości k3 jest znacznie większa od k2 , to niemal wszystkie cząsteczki SH+ przekształcają się zaraz po utworzeniu w P. Pierwszy etap reakcji (najpowolniejszy) , decyduje o kinetyce całej reakcji:
![]()
Stała szybkości reakcji ![]()
jest w tym przypadku proporcjonalna do stężenia kwasu.
Jeżeli jednak szybkość rozpadu kompleksu SH+ (k2) jest dużo większa od szybkości powstawania produktu (k3) to w pierwszym etapie reakcji ustala się równowaga , a o szybkości decyduje drugi etap reakcji :
![]()
Stężenie [SH+] związku przejściowego określone jest wzorem :
![]()
przy czym K jest stosunkiem stałych równowagi reakcji (a) i (b):
a) S + AH ![]()
SH+ + A- (b) AH![]()
A- + H+
Ostatecznie szybkość reakcji możemy zapisać :
![]()
W tym przypadku stała szybkości katalitycznej jest proporcjonalna do stężenia jonów wodorowych.
Hydroliza estrów należy do typowych reakcji katalizowanych kwasami. Zadanie polega na wyznaczeniu stałej szybkości reakcji hydrolizy przy różnych stężeniach kwasu, a więc jonów wodorowych . Jeżeli badać rozcieńczony roztwór wodny , wówczas reakcja zachowuje się jak 1rzędu , wobec drugiego reagentu tzn. wody .Szybkość reakcji opisuje więc równanie :
![]()
, czyli k = ![]()
(1 rzędowa)
gdzie k , zgodnie z równaniem ![]()
powinno być liniową funkcją stężenia kwasu .
Opracowanie wyników:
x - różnica między czasem t = 0 , a kolejnym ti .
a - różnica końcowego i pierwszego wyniku miareczkowania dająca stężenie początkowe estru
Tabela 1 . Wyniki pomiarów szybkości zmydlania estru w obecności 0,5 M HCl ;dokładne stężenie HCl po rozcieńczeniu wynosi 0,47M
![]()
Czas t[s] |
VNaOH[cm3] |
x[cm3] |
a-x [cm3] |
|
k*10-4[s-1] |
900 |
3,0 |
0,4 |
0,8 |
0,4055 |
4,5056 |
1800 |
3,2 |
0,6 |
0,6 |
0,6932 |
3,8511 |
2700 |
3,4 |
0,8 |
0,4 |
1,0986 |
4,0689 |
3600 |
3,5 |
0,9 |
0,3 |
1,3863 |
3,8508 |
4500 |
3,5 |
0,9 |
0,3 |
1,3863 |
3,0807 |
5400 |
3,8 |
1,2 |
0 |
|
|
Czas t = 0 2,6 a = 1,2
Tabela 2. Wyniki pomiarów szybkości zmydlania estru w obecności 1M HCl ;dokładne stężenie HCl po rozcieńczeniu wynosi 0,939
![]()
Czas t[s] |
VNaOH[cm3] |
x[cm3] |
a-x [cm3] |
|
k*10-4[s-1] |
900 |
5,9 |
1,4 |
0,9 |
0,9383 |
10,4256 (odrzucam) |
1800 |
6,1 |
1,6 |
0,7 |
1,1896 |
6,6089 |
2700 |
6,3 |
1,8 |
0,5 |
1,5261 |
5,6522 |
3600 |
6,4 |
1,9 |
0,4 |
1,7492 |
4,8589 |
4500 |
6,6 |
2,1 |
0,2 |
2,4435 |
5,4300 |
5400 |
6,8 |
2,3 |
0 |
|
|
Czas t = 0 4,5 a = 2,3
Tabela 3. Wyniki pomiarów szybkości zmydlania estru w obecności 15 M HCl ;dokładne stężenie HCl po rozcieńczeniu wynosi 1,393
![]()
Czas t[s] |
VNaOH[cm3] |
x[cm3] |
a-x [cm3] |
|
k*10-4[s-1] |
900 |
5,0 |
0,8 |
1,4 |
0,4520 |
5,0222 |
1800 |
5,4 |
1,2 |
1,0 |
0,7885 |
4,3806 |
2700 |
5,7 |
1,5 |
0,7 |
1,1451 |
4,2411 |
3600 |
5,9 |
1,7 |
0,5 |
1,4816 |
4,1156 |
4500 |
6,2 |
2,0 |
0,2 |
2,3979 |
5,3287 |
5400 |
6,4 |
2,2 |
0 |
|
|
Czas t = 0 4,2 a = 2,2
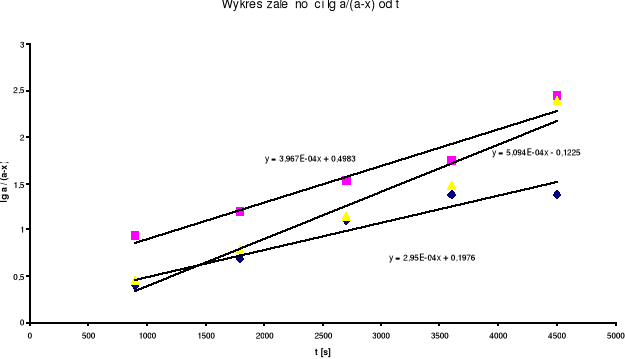
y = a x + b czyli ![]()
= kt z tego wynika , że k = a
Dla każdej prostej wyznaczam k z nachylenia prostej :
dla 0,5 M HCl y = 2,95*10-4 x +0,1976
dla 1 M HCl y = 3,967*10-4 x +0,4983
dla 1,5 M HCl y = 5,094*10-4 x -0,1225
dla 0,5 M HCl k = 2,95*10-4
dla 1 M HCl k = 3,967*10-4
dla 1,5 M HCl k = 5,094*10-4
Obliczenie błędów:
Dla pomiarów szybkości zmydlania estru w obecności 0,5 M HCl.
obliczam średni błąd kwadratowy wartości średniej ze wzoru :
Sx = 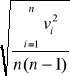
k*10-4 [s-1] |
Odchylenie ν |
Kwadrat odchylenia ν2 |
|
4,5056 |
0,6342 |
0,40221 |
|
3,8511 |
-0,0203 |
0,000412 |
|
4,0689 |
0,1975 |
0,039006 |
|
3,8508 |
-0,0206 |
0,000424 |
|
3,0807 |
-0,7907 |
0,625206 |
Sx = 0,1033 |
kśr.= 3,8714![]()
0,1033 *10-4 [s-1]
Dla pomiarów szybkości zmydlania estru w obecności 1 M HCl.
k*10-4 [s-1] |
Odchylenie ν |
Kwadrat odchylenia ν2 |
|
6,6089 |
0,9714 |
0,943618 |
|
5,6522 |
0,0147 |
0,000216 |
|
4,8589 |
-0,7786 |
0,606218 |
|
5,4300 |
-0,2075 |
0,043056 |
Sx = 0,1822 |
kśr.= 5,6375![]()
0,1033 *10-4 [s-1]
Dla pomiarów szybkości zmydlania estru w obecności 1,5 M HCl.
k*10-4 [s-1] |
Odchylenie ν |
Kwadrat odchylenia ν2 |
|
5,0222 |
0,4045 |
0,16362 |
|
4,3806 |
-0,2371 |
0,056216 |
|
4,2411 |
-0,3766 |
0,141828 |
|
4,1156 |
-0,5021 |
0,252104 |
|
5,3287 |
0,711 |
0,505521 |
Sx = 0,1058 |
kśr.= 4,6177![]()
0,1058 *10-4 [s-1]
Wnioski :
Z uzyskanych wyników widać , że rzeczywiście stała szybkości hydrolizy może być przedstawiona jako liniowa funkcja stężenia kwasy . Łatwo można wykazać , że stopień dysocjacji powstającego kwasu octowego jest bardzo mały. Można sądzić , że wartość stałej szybkości w nieobecności silnego kwasu jest bardzo mała. Analiza wyników na wykresie wyraźnie pokazuje , że zależności ![]()
nie przechodzą dokładnie przez początek układu współrzędnych .
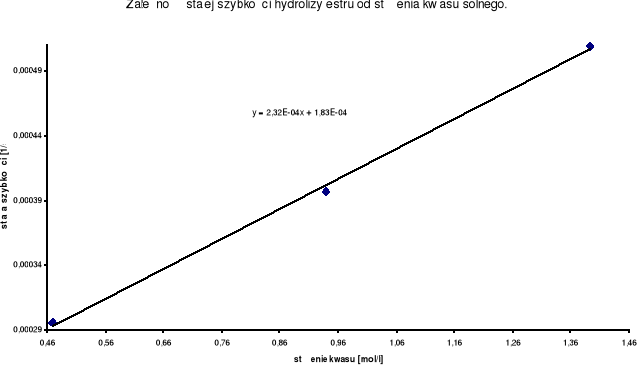
Zależność stałej szybkości hydrolizy estru od stężenia kwasu solnego jest prostoliniowa .Jest to charakterystyczne dla reakcji pierwszorzędowej . Wyznaczyłem równanie prostej , wynosi ono :
y = 2,32 * 10-4 x + 1,83 * 10-4
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Dyspersja współczynnika załamania światła, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl i HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Jonity1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Izoterma adsorpcji 1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Grupy symetrii, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entalpia parowania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron