4.03.2013r.
Laboratorium z Chemii i Technologii Wody
Część analityczna
Prowadzący: mgr Aneta Antczak-Chrobot
Przemysław Woiński
Oznaczenie twardości ogólnej metodą wersenianową
Sprawdzenie miana roztworu wersenianu dwusodowego
10 ml 0,02 M roztworu chlorku wapniowego
90 ml wody destylowanej
ok. 0,05 g czerni eriochromowej
Powstałą po wymieszaniu powyższych substancji mieszaninę, miareczkowałem roztworem wersenianu dwusodowego do uzyskania niebieskiej barwy.
Miano k obliczam ze wzoru:
![]()
gdzie: V - objętość użytego 0,02 M roztworu chlorku wapniowego
V1 - objętość zużytego wersenianu dwusodowego
k = 10 / 12,1 = 0,83
Próba właściwa z dodatkiem 1 ml chlorowodorku hydroksyloaminy i 1 ml siarczku sodowego:
50 ml badanej próbki wody wodociągowej
1 ml roztworu buforowego
ok. 0,05 g czerni eriochromowej
Powstałą po wymieszaniu powyższych substancji mieszaninę, miareczkowałem roztworem wersenianu dwusodowego do uzyskania niebieskiej barwy.
Twardość ogólną twog obliczam ze wzoru:
![]()
gdzie: V - objętość badanej próbki
V1 - objętość zużytego wersenianu dwusodowego
k - miano użytego wersenianu dwusodowego
0,04 - liczba milivali wapnia odpowiadająca 1 ml 0,02 M roztworu wersenianu dwusodowego
twog = (5,3 * 0,83 * 0,04 * 1000) / 50 = 3,52 mval/l
Próba właściwa bez dodatku chlorowodorku hydroksyloaminy i siarczku sodowego:
Sposób wykonania jest analogiczny do poprzedniej próby.
twog = (5,4 * 0,83 * 0,04 * 1000) / 50 = 3,59 mval/l
Wnioski:
Dodatek chlorowodorku hydroksyloaminy i siarczku sodowego stosuje się do wyeliminowania wpływu niektórych jonów na skuteczność oznaczenia, lecz różnica wyników obu prób jest tak nieznaczna, iż możliwe jest, że obecność tych substancji w przebadanej próbie była śladowa, lub też niewykrywalna, a różnice w wynikach spowodowane były błędem pomiaru.
Stopień twardości badanej przeze mnie próbki wody mówi nam, że była to woda miękka.
Oznaczenie chemicznego zapotrzebowania tlenu (ChZT) metodą nadmanganianową
Ustalenie miana roztworu roboczego KMnO4 0,0125 mol/l
100 ml wody destylowanej
10 ml kwasu siarkowego
10 ml roboczego roztworu nadmanganianu potasowego
10 ml roztworu szczawianu sodowego
Mieszaniną trzech pierwszych substancji umieściłem na 30 minut we wrzącej łaźni wodnej. Po tym czasie do roztworu dodałem 10 ml roztworu szczawianu sodowego, a następnie roztwór miareczkowałem do uzyskania różowego zabarwienia. Po uzyskaniu pożądanej barwy ponownie dodałem do roztworu taką samą ilość roztworu szczawianu sodowego i znowu zmiareczkowałem roztwór.
Oznaczenie dla próby właściwej
Oznaczenie wykonałem jak w poprzednim punkcie z tym, że zamiast wody destylowanej do oznaczenia użyłem 100 ml badanej wody wodociągowej.
ChZT obliczam wg wzoru:
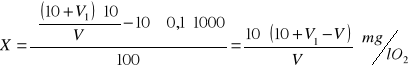
gdzie: V - objętość roztworu roboczego nadmanganianu potasowego zużyta na miareczkowanie 10 ml roztworu szczawianu sodowego
V1 - objętość roztworu roboczego nadmanganianu potasowego zużyta na miareczkowanie próbki wody wodociągowej
100 - objętość próbki wody użytej do oznaczenia
0,1 - liczba mg tlenu, odpowiadająca 1 ml roztworu nadmanganianu potasowego o stężeniu 0,0125 mol / l
X = [10 * (10 + 2,4 - 10,3)] / 10,3 = 2,04 mg / l O2
Wnioski:
Badana przeze mnie próbka wody należy do I klasy czystości wód o czym świadczy wartość X poniżej 10 mg / l O2.
Oznaczenie zawartości chlorków
Ustalenie miana roztworu AgNO3
10 ml NaCl
90 ml wody destylowanej
1 ml K2CrO4
Podane substancje wymieszałem i miareczkowałem roztworem AgNO3 do uzyskania pomarańczowej barwy.
Miano k roztworu AgNO3 obliczam ze wzoru:
![]()
gdzie: 10 - ilość mg Cl- zawarta w 10 ml roztworu NaCl
v - objętość roztworu AgNO3
k = 10 / 10,8 = 0,93 mg Cl- / ml
2) Oznaczenie dla próby właściwej
100 ml badanej wody
1 ml 10 % K2CrO4
Podane substancje wymieszałem i miareczkowałem roztworem AgNO3.
Zawartość chlorków obliczam ze wzoru:
![]()
gdzie: V1 - objętość zużytego roztworu azotanu srebra
V2 - objętość badanej próbki wody
k - miano roztworu azotanu srebra
CCl- = (0,93 * 1,4 * 1000) / 100 = 13,02 mg Cl- / l
Wnioski:
Badana przeze mnie próbka wody należy do I klasy czystości wód o czym świadczy wartość CCl- poniżej 250 mg Cl- / l.
Oznaczenie zawartości związków fosforu metodą molibdenianową z chlorkiem cynawym jako reduktorem
1) Przygotowanie krzywej wzorcowej:
0; 0,5; 1; 2; 3; 4; 5 ml roztworu roboczego
ok. 100 ml wody destylowanej
2 ml roztworu molibdenianu amonowego
0,2 ml roztworu chlorku cynawego
Do 7 kolbek dodałem koleino odpowiednie ilości roztworu roboczego i uzupełniłem wodą destylowaną do (łącznie) 100 ml. Następnie do każdej z nich dodałem pozostałe dwa odczynniki i wymieszałem. Po 10 minutach zmierzyłem dla nich wartości absorbancji przy długości fali równej 690 nm.
tab.1 Wartości absorbancji dla próbek wzorcowych
numer próbki |
A690 |
0 |
0 |
1 |
0,005 |
2 |
0,007 |
3 |
0,009 |
4 |
0,030 |
5 |
0,077 |
6 |
0,081 |
wyk.1 Wykres zależności absorbancji od stężenia ortofosforanów w próbce.
2) Wykonanie oznaczenia dla próby właściwej:
100 ml badanej wody
2 ml roztworu molibdenianu amonowego
0,2 ml roztworu chlorku cynawego
Powyższe substancje wymieszałem w dwóch powtórzeniach, a po 10 minutach od wymieszania zmierzyłem ich absorbancję λ = 690 nm.
tab. 2 Wartości absorbancji dla próbek właściwych.
numer próby |
A690 |
W 1 |
0,006 |
W 2 |
0,007 |
Wśr |
0,0065 |
Z równania krzywej wzorcowej obliczam zawartość rozpuszczonych w próbce ortofosforanów w przeliczeniu na PO4:
![]()
Obliczam zawartość rozpuszczonych w próbce ortofosforanów w przeliczeniu na PO4 korzystając ze wzoru:
![]()
gdzie: V - objętość badanej próbki
X = 0,0040 * 1000 / 100 = 0,04 mg / l
Wnioski:
Badana przeze mnie próbka wody należy do I klasy czystości wód o czym świadczy wartość X poniżej 0,2 mg / l.
Oznaczenie przewodności elektrolitycznej właściwej metodą konduktometryczną
Przewodność właściwą wody χ obliczam ze wzoru:
![]()
gdzie: χ1 - zmierzona przewodność na konduktometrze
k - stała konduktometryczna
χ = 0,49 * 415 = 203,35 μS / cm
Oznaczenie jonów wodorowęglanowych [
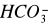
] metodą miareczkowania roztworem HCl
100 ml badanej próby
5 kropel oranżu metylowego
Zmieszane odczynniki miareczkowałem roztworem HCl do zmiany zabarwienia na jasnopomarańczowe.
Zawartość jonów wodorowęglanowych obliczam ze wzoru:
![]()
gdzie: v - objętość zużytego roztworu HCl
k - miano roztworu HCl
V - objętość przebadanej wody
HCO3- =(3,2 * 6,1 * 1000) / 100 = 195,2 mg / l
Badanie ph, kwasowości i zasadowości
1) Wartość pH oznaczyłem za pomocą pH-metru - pH 7.
2) Zasadowość:
100 ml badanej wody
3-5 kropel fenoloftaleiny
Po wymieszaniu składników, całość miareczkowałem 0,1 M HCl do odbarwienia roztworu.
2-3 krople oranżu metylowego
Po dodaniu oranżu kontynuowałem miareczkowanie do momentu zmiany zabarwienia
Na zmiareczkowanie badanej próby zużyłem 3,6 ml HCl.
3) Kwasowość:
100 ml badanej wody
3-5 kropel fenoloftaleiny
Po wymieszaniu składników, całość miareczkowałem roztworem NaOH do uzyskania lekko różowego zabarwienia.
2-3 krople oranżu metylowego
Po dodaniu oranżu kontynuowałem miareczkowanie do momentu zmiany zabarwienia na żółto-pomarańczowe.
Na zmiareczkowanie badanej próby zużyłem 2,4 ml NaOH.
Wyszukiwarka
Podobne podstrony:
Technologie informacyjne, Studia PŁ, Ochrona Środowiska, Informatyka, zagadnienia na egzamin
TECHNOLOGIA I ANALIZA ŻYWNOŚCI, Studia PŁ, Ochrona Środowiska, TiAŻ
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabEnzymy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
KLASYFIKACJA GLEB, Studia PŁ, Ochrona Środowiska, Gleboznawstwo
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
kawa, Studia PŁ, Ochrona Środowiska, Informatyka, prezentacja KAWA
Toksykologia zaliczenie, Studia PŁ, Ochrona Środowiska, Toksykologia
więcej podobnych podstron