Ćwiczenie III
Badanie aktywności promotora yy i jego represji przez produkty genów yefM oraz kompleksu białek yefM-yoeB, poprzez oznaczanie aktywności β-galaktozydazy w fuzji transkrypcyjnej
β-galaktozydaza jest enzymem biorącym udział w katabolizmie laktozy. Białko to jest kodowane przez gen lacZ znajdujący się w operonie laktozowym. Aktywność tego enzymu można badać, stosując sztuczny substrat, O-nitrofenylo- β-galaktozyd (ONPG). β-galaktozydaza katalizuje rozkład ONPG, a jednym z produktów reakcji jest nitrofenol mający żółte zabarwienie. Intensywność tego zabarwienia mierzy się spekrtrofotometrycznie.
Gen lacZ jest jednym z najczęściej stosowanych genów reporterowych służących do określania wydajności ekspresji innych genów lub badania aktywności różnych promotorów. W tym celu konstruuje się fuzje genowe lub operonowe (transkrypcyjne), w których gen lacZ jest przyłączony do innego genu przy zachowaniu zgodności ramki odczytu lub też znajduje się pod kontrolą badanego promotora. Aktywność β-galaktozydazy w komórce jest wprost proporcjonalna do ilości tego enzymu, a ilość ta jest wprost proporcjonalna do ilości i aktywności translacyjnej odpowiednich transkryptów RNA. Mierząc aktywność β-galaktozydazy w szczepach bakteryjnych zawierających odpowiednie fuzje można wnioskować o wydajności ekspresji badanego genu lub aktywności badanego promotora. Doświadczenia te należy oczywiście wykonywać w szczepach zawierających mutację w genie lacZ, tak by jedynie aktywne cząsteczki β-galaktozydazy mogły powstać tylko w oparciu o odpowiednią fuzję genową lub operonową. Fuzje te mogą być ulokowane na chromosomie bakteryjnym (fuzje jednokopijne) lub na plazmidzie (fuzje wielokopijne).
Aktywność β-galaktozydazy mierzy się po lizie komórek i oznacza w tzw. jednostkach Millera.
Materiały:
szczepy E. coli: MG1655/pRS415/pBAD33/
MG1655/pRSyy/pBAD33/
MG1655/pRSyy/pBAD33YefM/
MG1655/pRSyy/pBAD33YoeB/
MG1655/pRSyy/pBAD33YefMYoeB/
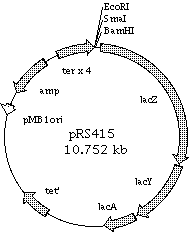
plazmid pRSyy jest pochodną plazmidu pRS415 i zawiera fuzję promotora yy z genem reporterowym lacZ; niesie oporność na ampicylinę.
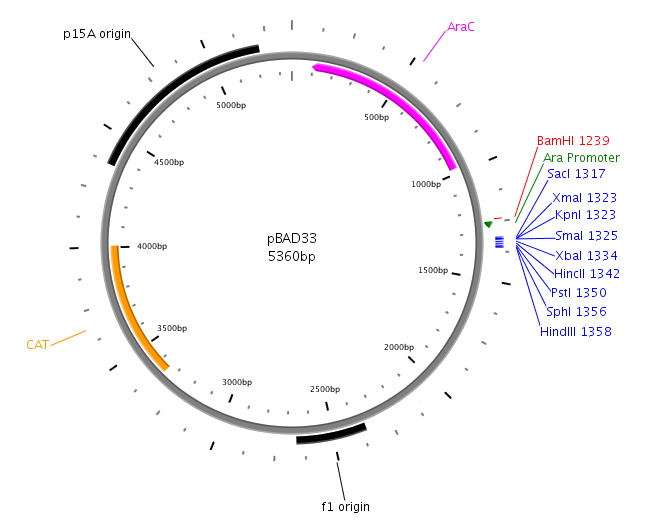
plazmidy pBAD33YefM, pBADYoeB oraz pBAD33YefMYoeB są pochodnymi plazmidu pBAD33 i niosą geny antytoksyny i kompleksu toksyna:antytoksyna pod kontrolą indukowalnego L-arabinozą promotora para; niosą oporność na chloramfenikol.
pożywka LB
roztwory antybiotyków: ampicyliny, chloramfenikolu
20% roztwór L-arabinozy
chloroform
bufor Z (bufor fosforanowy z KCl, MgSO4, SDS i β-merkaptoetanolem)
substrat reakcji - roztwór ONPG (roztwór 0.4% O-nitrofenylo- β-galaktozydu w buforze fosforanowym)
roztwór stopujący - 1M Na2CO3
Wykonanie:
Odmłodzić hodowle nocne (przygotowane przez prowadzącego) w 10 ml LB z antybiotykami (1:50) do OD600=0.2 a następnie dodać L-arabinozę do stężenia 0.2% i inkubować z wytrząsaniem przez 1 godzinę
Próby pobrać po 1 godzinie od momentu dodania roztworu L-arabinozy i zmierzyć i zapisać wartość OD600
Do dwóch probówek zawierających 100 μl chloroformu i 1,5 ml buforu Z dodać po 100 μl z pobranej próbki hodowli
Zawartość każdej z tych probówek wymieszać przez worteksowanie przez 15 sekund
Inkubować na stole przez 10 minut
Do każdej próbki dodać 400 μl roztworu ONPG i włączyć stoper
Inkubować na stole do momentu pojawienia się żółtej barwy roztworu
Dodać 1 ml 1M Na2CO3 i wyłączyć stoper. Zanotować dokładny czas, jaki upłynął od momentu dodania ONPG
Po skończeniu eksperymentu zmierzyć wartość OD420 wszystkich prób
Obliczyć aktywność β-galaktozydazy wg wzoru:
aktywność β-gal = VT x (OD420/OD600 x Δt x Vs) x 1000
gdzie:
VT = objętość próbki (w ml)
Δt = czas (w min.) od momentu dodania ONPG do momentu dodania Na2CO3
VS = objętość hodowli bakteryjnej w próbce = 0,1ml
Zagadnienia do samodzielnego przygotowania:
Teoria operonu na przykładzie operonu laktozowego, regulacja aktywności tego operonu
Fuzje genowe i operonowe: sposoby konstrukcji i zastosowanie w badaniu ekspresji genów
Geny reporterowe, przykłady, charakterystyka, wykorzystanie
Gen lacZ: charakterystyka produktu tego genu, oznaczanie aktywności β-galaktozydazy; podłoża, na których można testować aktywność β-galaktozydazy
Literatura:
Gajewski W. „Genetyka ogólna i molekularna”
Węgleński P. „Genetyka molekularna”
Kotełko K., Sedlaczek L., Lachowicz T.M. „Biologia bakterii”
Kunicki-Goldfinger W.J.H. „Życie bakterii”
Kur J. „Podstawy inżynierii genetycznej: teoria, ćwiczenia, testy”
Mapa plazmidu pRS415
Promotor pyy został wklonowany pomiędzy miejsca restrykcyjne EcoRI i BamHI, tak aby kontrolować ekspresję genu lacZ.
Plazmid posiada origin replikacji pMB1 i oporność na ampicylinę (amp).
Mapa plazmidu BAD33
Plazmid ten zawiera:
Gen oporności na chloramfenikol - cat
Origin replikacji - p15a
Promotor para indukowany L-arabinozą
Polilinker
Geny yefM i yefMyoeB zostały wklonowane między miejsca restrykcyjne PstI i HindIII
Wyszukiwarka
Podobne podstrony:
PCR trawienie elktroforeza, Ochrona Środowiska UG, semestr V, Biologia molekularna
mini prepy, Ochrona Środowiska UG, semestr V, Biologia molekularna
SDS, Ochrona Środowiska UG, semestr V, Biologia molekularna
PCR, Ochrona Środowiska UG, semestr V, Biologia molekularna
Uzupełnianka, ochrona środowiska UJ, V semestr, biologia roślin
Wykłady Biologia sanitarna, STUDIA (Ochrona Środowiska), IV semestr, Biologia sanitarna
BIOLOGIA SANITARNA- ściąga, STUDIA (Ochrona Środowiska), IV semestr, Biologia sanitarna
NICIENIE - ROBAKI OBŁE PRZEWOU POKARMOWEGO, STUDIA (Ochrona Środowiska), IV semestr, Biologia sanita
epiderma, ochrona środowiska UJ, V semestr, biologia roślin
korzeń, ochrona środowiska UJ, V semestr, biologia roślin
po polsku, Ochrona Środowiska UG, semestr V, Toksykologia
Ochrona środowiska, UG, 5. semestr, EGZAMINY 2013, OPIŚ, do egzaminu, notatki MW
Uzupełnianka, ochrona środowiska UJ, V semestr, biologia roślin
Postacie wody w glebie, Studia, UTP Ochrona środowiska, I rok, Semestr II, Geologia
ochrona srodowiska 1, INNE KIERUNKI, biologia
Budowa wnętrza Ziemi, Studia, UTP Ochrona środowiska, I rok, Semestr II, Geologia
biologia molekularnaa, Studia, V rok, V rok, IX semestr, Biologia molekularna
sciaga egz cw2, Studia, UTP Ochrona środowiska, I rok, Semestr II, Ekologia
więcej podobnych podstron