Ćwiczenie I
Izolacja DNA plazmidowego metodą lizy alkalicznej.
Izolacja DNA plazmidowego za pomocą zestawu firmy A&A Biotechnology.
Transformacja DNA plazmidowego.
Izolacja DNA plazmidowego - wstęp.
Metody izolacji DNA różnią się między sobą zależnie od rodzaju DNA (jednoniciowy, dwuniciowy, chromosomowy, plazmidowy, fagowy) oraz od rodzaju komórek, z których DNA jest izolowany (roślinne, zwierzęce, bakteryjne). Izolacja wszystkich rodzajów DNA obejmuje dwa podstawowe etapy: lizę komórek i oczyszczanie DNA. Oczyszczanie można przeprowadzić na dwa sposoby - poprzez degradację lub usunięcie z ekstraktu komórkowego wszystkich składników innych niż DNA, bądź poprzez selektywne usuwanie z ekstraktu DNA (np. z wykorzystaniem techniki chromatografii jonowymiennej).
Istnieje kilkanaście metod oczyszczania plazmidowego DNA. Wszystkie złożone są z podobnych etapów:
hodowli komórek bakteryjnych (i ewentualnej amplifikacji plazmidu)
lizy hodowli bakteryjnej
oczyszczenia plazmidowego DNA (kluczowym momentem jest tu oddzielenie DNA plazmidowego od chromosomalnego)
Do izolacji DNA plazmidowego z komórek bakteryjnych, najczęściej wykorzystuje się hodowle płynne uzupełnione odpowiednim antybiotykiem.
W pierwszej kolejności zachodzi wstępna liza komórek bakteryjnych, denaturacja białek oraz DNA. Komórki zawieszane są w roztworze zawierającym w swoim składzie EDTA oraz RNazęA, enzym degradujący RNA. EDTA jest związkiem, który chelatuje jony dwuwartościowe np. Ca2+ i Mg2+, co obniża stabilność ściany komórkowej (jony wapnia są potrzebne do zachowania stabilności warstwy lipopolisacharydowej) oraz hamuje działanie DNaz (enzymy degradujące DNA, które do aktywności potrzebują jonów Mg2+). Następnym etapem jest liza komórek bakteryjnych zachodząca pod wpływem takich czynników jak detergenty (dodecylosiarczan sodu - SDS, sarkozyl, Triton X-100), które niszczą błonę komórkową, rozpuszczalniki organiczne (fenol, chloroform), które powodują denaturację białek, roztwory alkaliczne lub wysoką temperaturę. Często stosuje się też lizozym - enzym trawiący mureinę ściany komórkowej bakterii (nie działa w pH < 8.0).
Większość metod stosowanych do oczyszczania plazmidowego DNA wykorzystuje fakt jego występowania w formie superzwiniętej (CCC- ang. covalently closed circular). Najbardziej popularnymi metodami jest liza alkaliczna i liza termiczna.
W metodzie lizy alkalicznej bufor o wysokim pH (12.0- 12.5) zawierający NaOH powoduje całkowitą denaturację chromosomalnego DNA, natomiast plazmidowy DNA zostaje zdenaturowany jedynie na niewielkich odcinakach. Fragmenty chromosomalnego DNA po neutralizacji pH i w obecności wysokiego stężenia soli (np. octanu amonu) tworzą nierozpuszczalną sieć, dzięki czemu można usunąć je przez wirowanie, natomiast DNA plazmidowe ulega renaturacji i pozostaje w supernatancie. W przypadku lizy termicznej, czynnikiem denaturującym jest wysoka temperatura, w której DNA chromosomalny i plazmidowy zachowują się podobnie jak w wysokim pH.
Następny etap polega na oddzieleniu DNA od białek. Zwykle stosuje się do tego celu roztwór fenolu lub jego mieszaninę z chloroformem. Białka można też usunąć poprzez trawienie protezami (zwykle proteinazą K). Z odbiałczonych próbek DNA ulega precypitacji (wytrąceniu) alkoholem etylowym lub izopropanolem, w obecności octanu potasowego, sodowego lub amonowego, następnie pozostałości soli usuwa się poprzez przemycie osadu 70% etanolem.
Szczepy i plazmidy:
szczep MG1655 (E. coli) z plazmidem pBAD33yefMyoeB niosącym gen oporności na chloramfenikol (cat), ori p15A oraz geny chromosomalnego systemu toksyna-antytoksyna, yefM i yoeB.
1. Protokół izolacji DNA plazmidowego metodą lizy alkalicznej.
Odczynniki do lizy alkalicznej:
bufor I (25mM Tris-HCl pH 8.0, 50 mM glukoza, 10mM EDTA, RNazaA 100 ug/ml)
bufor II (9 części 0,2M NaOH i 1 część 10% SDS)
bufor III (60 ml 5M octanu potasu + 11,5ml lodowatego kwasu octowego + 28,5ml wody)
fenol- chloroform (1:1)
70% i 96% etanol
woda jałowa
Liza alkaliczna - wykonanie:
Hodowlę nocną bakterii (3 ml) wirować (12000 rpm, 1min) ( 2x1.5 ml).
Odrzucić supernatant, osad zawiesić w 100 µl buforu I i inkubować w temperaturze pokojowej przez 5 min.
Dodać 200 µl buforu II i całość delikatnie wymieszać przez kilkukrotne odwracanie probówki, a następnie inkubować w lodzie przez 10 min.
Dodać 150 µl buforu III, wymieszać przez odwracanie probówki, po czym pozostawić w lodzie na kolejne 10 min.
Zebrać supernatant do nowej probówki i dodać 400 µl mieszaniny fenol-chloroform, wymieszać przez kilkukrotne odwracanie probówki.
Wirować (12000 rpm, 5 min), zebrać górną fazę do nowej probówki.
Dodać 0,8 ml 96% etanolu, inkubować w temperaturze -80°C 15 min.
Wirować (12000 rpm, 20 min), supernatant odrzucić.
Do osadu dodać 1 ml 70% etanolu i wirować (12000 rpm, 10 min).
Supernatant usunąć a osad wysuszyć pod próżnią przez 2-3 min.
Na koniec osad zawiesić w 20 µl wody. Oczyszczone plazmidowe DNA, znajdujące się w probówce może być przechowywane krótkoterminowo w lodówce lub długoterminowo w temp.-20°C do czasu dalszych analiz.
2. Protokół izolacji DNA plazmidowego za pomocą zestawu firmy A&A Biotechnology jest załączony do materiałów ćwiczeniowych (Plasmid Mini_Pl).
3. Transformacja komórek bakteryjnych DNA plazmidowym.
Technika transformacji bakterii DNA plazmidowym pozwala na wprowadzenie plazmidów do komórek bakteryjnych. Tylko niektóre bakterie mają naturalną zdolność pobierania obcego DNA ze środowiska (głównie bakterie Gram-dodatnie, np. Bacillus subtilis). Komórki Escherichia coli przed pobraniem DNA z otoczenia muszą być wprowadzone w stan tzw. kompetencji. Do najpopularniejszych związków chemicznych stosowanych do przygotowania komórek kompetentnych należą sole metali dwuwartościowych, takich jak: wapń, rubid, magnez, a także DMSO. Wszystkie wyżej wymienione związki wywołują zmiany w strukturze i przepuszczalności ścian komórki bakteryjnej, co umożliwia im pobranie DNA z roztworu, lecz powoduje również, że stają się one bardzo wrażliwe i dlatego należy postępować z nimi ostrożnie podczas całej procedury transformacji. W trakcie tych ćwiczeń będziemy używać komórek kompetentnych przygotowanych metodą chlorkową, w której komórki zawieszone zostały w zimnym 100mM roztworze CaCl2. Po dodaniu roztworu DNA, cząsteczki kwasu nukleinowego adsorbują się na powierzchni komórek. Szybkie podwyższenie temperatury (do 430C na około 1,5 min) powoduje zmiany w powłokach komórkowych bakterii pozwalające na wniknięcie cząsteczek DNA do wnętrza komórek. W przypadku transformacji bakterii plazmidami niosącymi oporność na antybiotyki, przed wysianiem mieszaniny transformacyjnej na płytki selekcyjne konieczna jest inkubacja hodowli (przez około 1 godz.) w pożywce bez antybiotyku. Pozwala to na ekspresję fenotypową danego genu oporności na antybiotyk.
Technikę transformacji stosuje się rutynowo w inżynierii genetycznej podczas klonowania różnych genów lub fragmentów obcego DNA do wektorów plazmidowych, które się następnie wprowadza do komórek bakteryjnych.
Instrukcja praktyczna:
Do 100 ul przygotowanych metodą chlorkową komórek kompetentnych szczepu E. coli MG1655 dodać 2 ul DNA plazmidowego otrzymanego metodą lizy alkalicznej podczas ćwiczenia I. Równocześnie przygotować próbkę kontrolną komórek kompetentnych i traktować tak samo, jak próbkę pierwszą z wyjątkiem dodania DNA.
Inkubować próbki w lodzie przez 20-60 min.
Szybko przenieść próbki na 90 sec. do 430C.
Następnie probówki przenieść znów na 5 min. do lodu
Po tym czasie dodać 1 ml pożywki LB i hodować w 370C przez 1 godz.
Na wcześniej przygotowane płytki LA z chloramfenikolem wysiewać po 150 ul hodowli.
Inkubować przez noc w cieplarce ustawionej na 370C.
Na kolejnych ćwiczeniach zinterpretować wynik doświadczenia.
Zagadnienia do opracowania:
Budowa i cechy plazmidu oraz zastosowanie w inżynierii genetycznej.
Pojęcia: wektory ekspresyjne, wielokrotne miejsca klonowania (MCS), ori replikacji, marker selekcyjny.
Metody izolacji DNA z różnych organizmów.
Metody wprowadzania komórek bakteryjnych w stan kompetencji.
Metody wprowadzania DNA do komórek.
Literatura:
Turner P.C., Mclennan A.G., „Krótkie wykłady- biologia molekularna”
Sęktas M., „Zastosowanie inżynierii genetycznej w biotechnologii”
Sambrock J., Russell D.W., „Molecular cloning”
Włodarczyk M.(2002), Co to jest plasmid? Kosmos 51:231-240
Kłyszejko-Stefanowicz L., „Ćwiczenia z biochemii”
Mapy plazmidów pBAD33 i pBAD33yefMyoeB:
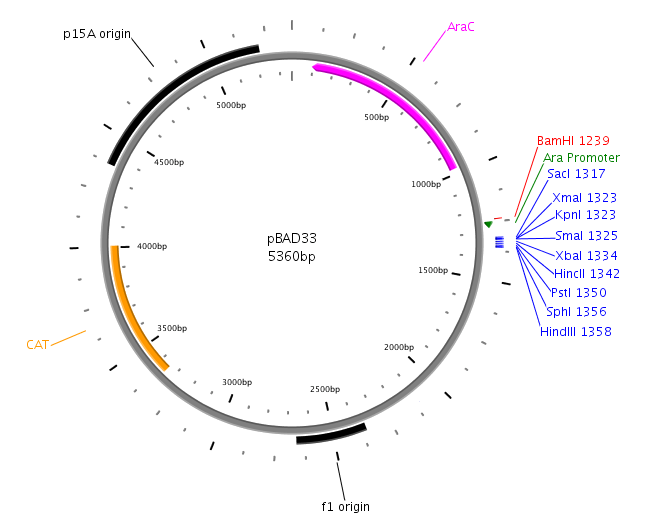
Plazmid pBAD33yefMyoeB powstał poprzez wklonowanie fragmentu DNA o długości około 600 pz zawierającego geny yefM i yoeB w miejsca SacI i HindIII wektora pBAD33.
pBAD33yefMyoeB
Wyszukiwarka