WYZNACZANIE REFRAKCJI MOLOWEJ CIECZY ORGANICZNEJ
Na granicy dwóch ośrodków izotropowych 1 i 2, w których światło rozchodzi się z różnymi prędkościami v1 i v2, promień świetlny wchodząc z ośrodka 1 do ośrodka 2 zmienia kierunek swego biegu. Część promieni ulega odbiciu, a część przechodzi przez ośrodek 2 tworząc tzw. wiązkę załamaną.
Jeżeli ośrodek 1 jest optycznie rzadszy od ośrodka 2, wówczas kąt załamania β jest mniejszy od kąta padania α oraz v1 > v2. Gdy zaś ośrodek 1 jest optycznie gęstszy od ośrodka 2, promień załamuje się od prostopadłej i wówczas α < β oraz v1 < v2.
W obu przypadkach promień padający, promień załamany i prostopadła do powierzchni granicznej leżą w jednej płaszczyźnie, przy czym oba promienie tworzą takie kąty α i β z prostopadłą, że :
![]()
![]()
![]()
lub n1sinα = n2sinβ
Związek ten wyraża prawo załamania. Stałą wartość stosunku sinusów kąta padania i kąta załamania, równą stosunkowi prędkości rozchodzenia się światła w ośrodkach 1 i 2, nazywamy współczynnikiem załamania ośrodka 2 względem ośrodka 1 i oznaczymy przez n2,1.
Dla próżni współczynnik załamania n0 = 1 ⇒ sinα = n*sinβ , n nazywamy bezwzględnym współczynnikiem załamania.
Kąt α, dla którego kąt załamania jest kątem prostym (β = 90°), nazywamy kątem granicznym (α = αgr). Dla kątów padania większych od kąta granicznego zachodzi tzw. całkowite odbicie. Wszystkie promienie świetlne wracają wówczas do ośrodka gęstszego, odbijając się od powierzchni odgraniczającej ten ośrodek od ośrodka rzadszego.
Refrakcja właściwa: ![]()
![]()
![]()
,
Refrakcja molowa: ![]()
![]()
gdzie : n - współczynnik załamania światła,
M - masa molowa badanej substancji [g/mol],
d - gęstość badanej substancji [g/cm3].
Refrakcja molowa jest dla związków o wiązaniach kowalencyjnych wielkością addytywną, tak że można ją wyrazić w postaci sumy refrakcji atomowych, odpowiadających poszczególnym atomom w cząsteczce. Refrakcja molowa zależy również od struktury cząsteczki, dlatego też przy dodawaniu do siebie refrakcji atomowych poszczególnych wolnych atomów, należy uwzględniać przy tym typ wiązania. W przypadku związków o wiązaniach jonowych, refrakcja nie jest addytywna. Związane jest to z tym, że w związkach jonowych jony polaryzują się wzajemnie, w wyniku czego tzw. refrakcje jonowe ulegają znacznym zmianom. Addytywność refrakcji jonowych wykazują jedynie bardzo rozcieńczone roztwory elektrolitów, w których wzajemna polaryzacja jonów nie jest możliwa. Refrakcję molową można zatem wyznaczyć drogą ekstrapolacji do rozcieńczenia nieskończenie dużego.
II Część doświadczalna.
1. Celem ćwiczenia jest wyznaczenie wzorów strukturalnych badanych substancji,
na podstawie wartości refrakcji właściwych oraz molowych.
Refrakcje badanych związków oblicza, program komputerowy LORENTZ, w oparciu
o podane wzory sumaryczne, gęstość, masy molowe oraz wyznaczone doświadczalnie
współczynniki załamania światła. Uzyskane wyniki obliczeń, porównuje się następnie z
wartościami literaturowymi. Dodatkowo wyznaczamy skład ilościowy mieszaniny
badanych substancji na podstawie pomiaru jej współczynnika załamania światła.
2. Aparatura:
refraktometr Abbego
lampa żarowa
naczyńka wagowe
pipety
aceton
substancja 1 o wzorze sumarycznym C7H8
M= 92,14 [g/mol] d= 0,8670 [g/cm3]
substancja 2 o wzorze sumarycznym C4H10O
M = 74,12 [g/mol] d= 0,8098 [g/cm3]
mieszanina substancji 1 i 2 w stosunku 1:3
3. Warunki pomiarów:
ciśnienie zewnętrzne ok. 997 hPa
temperatura na zewnątrz ok. -12 0C
temperatura w pomieszczeniu 230 C
III Wyniki pomiarów i obliczeń
1. Wyniki obliczeń programu LORENTZ przedstawia wydruk programu.
2. Obliczenie refrakcji właściwej oraz molowej dla substancji o wzorze sumarycznym C7H8.
a). Obliczenie średniej wartości współczynnika załamania światła:
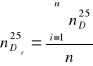
![]()
b). Obliczanie refrakcji właściwej:
![]()
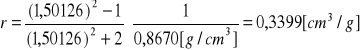
c). Obliczenie refrakcji molowej:
![]()
![]()
3. Obliczenie refrakcji właściwej i molowej dla substancji o wzorze sumarycznymC4H10O.
a). Obliczenie średniej wartości współczynnika załamania światła:
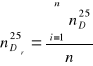
![]()
b). Obliczanie refrakcji właściwej:
![]()
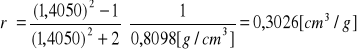
c). Obliczenie refrakcji molowej:
![]()
![]()
4. Badanie struktury otrzymanych substancji.
Na podstawie podanych przez prowadzącego ćwiczenia wzorów sumarycznych i gęstości
badanych substancji obliczono refrakcje molowe różnych wariantów struktury,
i porównano je z podanymi przez komputer prawdziwymi wartościami Mr
Wybrane wartości refrakcji atomowych oraz refrakcji wiązań chemicznych, potrzebne
do wykonania tej części ćwiczenia odczytano z tablicy II-13 „Refrakcje atomowe oraz
refrakcje wiązań chemicznych”. (4)
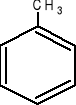
- toluen C7H8
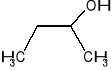
butan-2-ol (sec-butanol) C4H10O
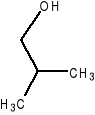
- butan-1-ol C4H10O
![]()
- izobutanol C4H10O
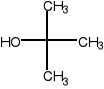
- alkohol tert-butylowy C4H10O
- eter dietylowy C4H10O
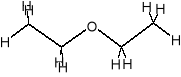
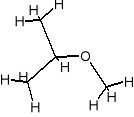
- eter metylowo-propylowy C4H10O
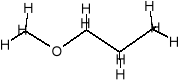
- eter metylowo-propylowy
Z przeprowadzonej analizy wynika, że analizowaną substancją nr 1 jest toluen
a substancję nr 2 stanowi butan-1-ol (wnioski wyciągnięto na podstawie analizy gęstości oraz współczynnika załamania światła). Brak współczynników załamania światła dla większości struktur spowodowany jest tym, że w literaturze podane są ich wartości w innej niż rozpatrywana temperatura (250C).
5. Obliczanie ułamków molowych poszczególnych substancji w mieszaninie (zakładając
poprawność wniosków z punktu 4):
- stosunek objętościowy badanych substancji w mieszaninie 1:3
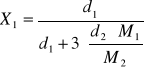
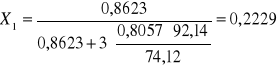
IV Spostrzeżenia i wnioski:
1. Analiza refrakcji molowych proponowanych struktur badanych związków.
Analizując wartości refakcji molowej dla poszczególnych struktur badanych związków
stwierdza się, że dla substancji o wzorze sumarycznym C4H10O proponowane alkohole
oraz etery posiadają wartości refrakcji molowej nieznacznie różniące się między sobą
(![]()
) powoduje to, że nie możliwe jest zaklasyfikowanie badanego związku do
jednej z tych grup oraz wyodrębnienie z tej grupy odpowiedniego związku
(oznacza to, że refrakcja molowa nie możne być przyjęta za kryterium wyboru).
Ponieważ niemożliwa jest identyfikacja substancji za pomocą refrakcji
molowych, jako kryterium wyboru przyjęto gęstość oraz współczynnik załamania
światła.
2. Identyfikacja pierwszej substancji.
Porównując niżej podane wartości:
a) gęstość
- ![]()
podana przez prowadzącego
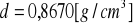
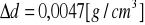
b) współczynnik załamania światła
- ![]()
wyznaczony doświadczalnie
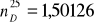
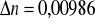
stwierdza się, że identyfikowaną substancją jest toluen.
3. Identyfikacja drugiej substancji.
Porównując niżej podane wartości:
a) gęstość
- ![]()
podana przez prowadzącego
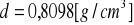
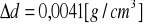
b) współczynnik załamania światła
- ![]()
wyznaczony doświadczalnie
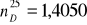
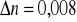
stwierdza się, że identyfikowaną substancją jest butan-1-ol.
4. Analiza obliczonych przez program LORENTZ wartości refrakcji molowych (obliczonych na
podstawie wyznaczonych współczynników załamania światła) z wartościami teoretycznymi
obliczonymi na podstawie tabeli „Refrakcje atomowe oraz refrakcje wiązań chemicznych”. (4)
a) Dla toluenu
- ![]()
wartość podana przez program
- ![]()
wartość teoretyczna
- ![]()
b) Dla butan-1-olu
- ![]()
wartość podana przez program
- ![]()
wartość teoretyczna
- ![]()
Refrakcje molową wyznaczono poprawnie, niewielkie różnice między wartością rzeczywistą a teoretyczną spowodowane mogą być czynnikami przedstawionymi w punkcie analiza błędów.
5. Analiza mieszaniny badanych substancji.
ułamek molowy toluenu obliczony programem LORENTZ
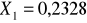
teoretyczny ułamek molowy toluenu w mieszaninie
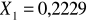
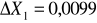
Podobnie jak i w przypadku refrakcji niewielkie różnice pomiędzy wartością rzeczywistą
a teoretyczną spowodowane mogą być czynnikami przedstawionymi w punkcie analiza błędów.
V Analiza błędów
Przeprowadzona analiza pozwala na stwierdzenie, że ćwiczenie wykonano porwanie.
Różnice między wartościami rzeczywistymi (otrzymanymi) a teoretycznymi mogą wpływać
następujące czynniki:
- Zanieczyszczenia próbek.
Ponieważ nie wiadomo jaką czystość miały otrzymane próbki zakłada się,
że należało przeprowadzić doświadczenie z analitycznie czystymi substancjami.
- Wpływ temperatury.
Refraktometr Abbego na którym wykonywano pomiar nie był podłączony do termostatu, w
wyniku czego stwierdza się brak stałości temperatury (250C) powodujący, że
początkowo odczytywano wartość współczynnika załamania światła dla temperatury
panującej w laboratorium, a następnie w wyniku promieniowania ciepła lampy
(tj. żarówki wolframowo-żarowej) temperatura wzrastała powodując zmiany w odczycie
współczynnika załamania światła (porównując „n” dla różnych temperatur dla tego samego
związku wraz ze wzrostem temp. „n” maleje) szczególnie widoczne jest to dla
współczynnika załamania światła dla mieszaniny badanych substancji przy czym należy
uwzględnić w tym przypadku stopień wymieszania.
- niedokładność odczytu.
Niedokładność odczytu wartości współczynnika załamania światła wynikająca
a) Ze złego oświetlenia pryzmatów.
b) Trudności podczas ustawienia ostrej granicy cienia w punkcie skrzyżowania widocznym w lunecie. c) Błąd odczytu.
W oparciu o wykonaną metodę nie można wyznaczyć z 100% dokładnością wzorów strukturalnych badanych związków. Wzory strukturalne substancji chemicznych można wyznaczyć innymi metodami z większą dokładnością, np. spektroskopia w świetle nadfioletu i widzialnym, spektroskopia w podczerwieni, spektroskopia rezonansu jądrowego czy analiza jakościowa w chemii organicznej.
VI Literatura:
(1) - Brodlićka „Podstawy chemii fizycznej”, PWN, Warszawa 1970
(2) - „Tablice fizyczno-chemiczne” Witold Mizerski
Wydawnictwo Adamantan W-wa 1997 str. 198-199
(3) - „Tablice fizyczno-chemiczne” Witold Mizerski
Wydawnictwo Adamantan W-wa 1997 str. 97
(4)- „Ćwiczenia z chemii fizyczne z programami do obliczeń na EMC” Z. S. Hippe, A. Kerste. M.
Mazur PWN W-wa 1987 str. 173 tablica II-13
![]()
Wartości literaturowe (t=250C)
d= 0,8623 [g/cm3] (2) ![]()
(3)
![]()
Wartości literaturowe (t=250C)
d= 0,8036 [g/cm3] (2)
![]()
Wartości literaturowe (t=250C)
d= 0,8057 [g/cm3] (2) ![]()
(3)
![]()
Wartości literaturowe (t=250C)
d= 0,798 [g/cm3] (2)
![]()
Wartości literaturowe (t=250C)
d= 0,7812 [g/cm3] (2)
![]()
Wartości literaturowe (t=250C)
d= 0,7078 [g/cm3] (2) ![]()
(3)
![]()
Wartości literaturowe (t=250C)
d= 0,7013 [g/cm3] (2)
![]()
Wartości literaturowe (t=250C)
d= 0,7035 [g/cm3] (2)
Gdzie:
d1, d1- gęstości literaturowe zanalizowanych substancji
M- masa molowa
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
8.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
izomeria optyczna, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
10.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
6.1 nowe, Technologia chemiczna, Chemia fizyczna, laboratorium
8.4 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
SEM ogniwa2, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
adsorpcja, Technologia chemiczna, Chemia fizyczna, laboratorium
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
więcej podobnych podstron