OKREŚLANIE RZĘDU REAKCJI, STAŁEJ SZYBKOŚCI ORAZ ENERGII AKTYWACJI TERMICZNEJ
Szybkość reakcji - miarą szybkości reakcji jest zmniejszenie ilości jednego z reagentów następujące w określonym okresie czasu. Gdy objętość układu reakcyjnego jest stała, to zmiana ilości reagenta odpowiada zmianie jego stężenia. Dla układów ciekłych szybkość reakcji to szybkość zmiany stężenia molowego reagenta. Szybkość reakcji wyraża się w jednostkach czasu i jest wielkością dodatnią.
A + B → C + D A + 2B → produkty
![]()
![]()
Mechanizm reakcji - polega na spotkaniu się cząsteczek substratów, przegrupowaniu atomów i elektronów w chwili zderzenia oraz oddaleniu się od siebie utworzonych cząsteczek produktów .Reakcje zachodzą etapami, stąd też zakłada się istnienie produktów przejściowych, utworzonych przez substraty w pierwszym etapie reakcji, a następnie ulegających przekształceniu w dalszych etapach w produkty ostateczne.
Szybkość pojedynczego etapu reakcji jest proporcjonalna do iloczynu stężeń cząstek uczestniczących jako reagenty w danym etapie. Powyższa zasada nie może być stosowana w przypadku reakcji złożonych. Jeśli etap początkowy przebiega powoli w stosunku do kolejnych etapów, to jest on etapem decydującym o szybkości reakcji i szybkość reakcji sumarycznej równa jest szybkości etapu początkowego.
Reakcja I rzędu to reakcja, której szybkość w danej temperaturze zależy jedynie od pierwszej potęgi stężenia pojedynczego reagenta: ![]()
Reakcja II rzędu jej szybkość jest proporcjonalna do kwadratu stężenia jednego z reagentów lub do iloczynu stężeń dwóch reagentów: ![]()
lub ![]()
Reakcja III rzędu - szybkość = k[A]3 lub k[A]2[B] lub k[A][B][C]
Równania kinetyczne i stałe szybkości reakcji wyznacza się na podstawie danych kinetycznych dla określonych temperatur. Na podstawie przeprowadzanych doświadczeń dotyczących kinetyki można stwierdzić, że wartość występującej w równaniach kinetycznych funkcji stężeniowej nie ulega zmianie, zaś wartość stałej szybkości wzrasta wraz ze wzrostem temperatury.
Odwrotność stałej szybkości określa czas , w którym następuje dostrzegalny przebieg reakcji przy jednostkowych stężeniach reagentów.
WYKONANIE ĆWICZENIA
Do czystej i suchej kolby o pojemności 250 cm3 wlewamy wlano 150 cm3 octanu etylu, a następnie dodajemy 150 cm3 NaOH i intensywnie mieszamy. Po upływie kolejno 3, 6, 12, 24, 48 i 96 minut pobieramy pipetą 20 cm3 mieszaniny i wlewamy do kolbki stożkowej zawierającej 10 cm3 kwasu solnego. Roztwór HCl miał na celu zahamowanie dalszego przebiegu reakcji. Każdą próbkę miareczkujemy kolejno roztworem NaOH wobec błękitu bromotymolowego. Ostatni pomiar wykonujemy po upływie 24 h, po tym czasie ustala się stan równowagi.
ZESTAWIENIE WYNIKÓW
Wyniki pomiarów zestawiamy w tabeli poniżej.
Nr pomiaru |
Czas t [s] |
Objętość 0.1 M. NaOH użytego do miareczkowania [cm3] |
x - liczba moli estru (w 1 dm3), który uległ przemianie w czasie t |
a - x [mol/dm3] |
b - x [mol/dm3] |
1 2 3 4 5 6 7 8 |
194 375 745 1440 2880 5760 11520 po 24 h |
4,4 5,9 7,1 8,0 8,5 8,6 8,8 8,9 |
0,0220 0,0295 0,0355 0,0400 0,0425 0,0430 0,0440 0,0445 |
0,0280 0,0205 0,0145 0,0100 0,0075 0,0070 0,0060 0,0055 |
0,0280 0,0205 0,0145 0,0100 0,0075 0,0070 0,0060 0,0055 |
gdzie: a - początkowe stężenie NaOH [mol/dm3] - (0,05 M)
b - początkowe stężenie estru [mol/dm3] - (0,05 M.)
WNIOSKI
Obserwując zmiany stężeń reagujących substratów w jednostce czasu, stwierdza się, że w miarę wzrostu przereagowania tych substratów szybkość reakcji maleje.
Wartości stałych szybkości k reakcji obliczone zostały przez program komputerowy z dokładnością 33,9 %, która informuje nas o tym, ile one odbiegają od siebie. Rząd reakcji wskazany przez komputer wynosi 2, co nie znajduje odzwierciedlenia na wykresie zależności odwrotności stężenia od czasu - krzywa dla czasów 3, 6, 12 i 24 min. biegnie niemal prostoliniowo, po czasie 48 min. odchyla się w prawo. Odchylenia punktów od prostej są spowodowane:
nieprzestrzeganiem czasu, po którym należało zatrzymać reakcję,
błędami w odczytaniu objętości titranta podczas miareczkowania,
wahaniami temperatury w pomieszczeniu.
Układ osiąga stan równowagi praktycznie po czasie 192 min (gdyż różnic objętości jest niewielka w stosunku do obj. zużytej po czasie 24 h, w granicy błędu biurety).
III. Wnioski i spostrzeżenia (poprawione):
Na podstawie przeprowadzonego doświadczenia , mającego na celu wyznaczenie rzędu i stałej szybkości reakcji hydrolizy octanu etylu (![]()
), wysunięto następujące spostrzeżenia oraz wnioski:
Zmiana stężeń reagujących substratów zmienia się w jednostce czasu. Wraz ze wzrostem przereagowania szybkość reakcji maleje.
Podana analizie reakcja wg źródeł literaturowych(*) jest reakcją odwracalną II rzędu, zaś wg naszych doświadczeń przyjmuje wartości różne od 2 w zależności od założonego poziomu tolerancji, np.:
![]()
30%![]()
n=2,5
40%![]()
n=2,0
Przeprowadzona reakcja, jest reakcją odwracalną rzędu II przy założeniu tolerancji 40%.
W oparciu o wynik obliczeń programu UNIRATE-S oraz przekształcając wyrażenie na stałą szybkości reakcji drugorzędowej odwracalnej wykonano wykresy zależności 1/lnC=f(t):
![]()
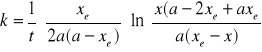
![]()
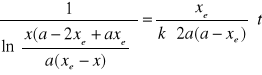
Przyjmując uproszczenie zapisu:
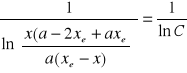
Analiza wykresu zależności 1/lnC=f(t) ( wykres nr 2,3,4).
Wykres zależności 1/lnC=f(t) dla wyżej wymienionej reakcji teoretycznie powinien być
prostoliniowy (wykres nr 2). W naszym przypadku nawet przy dużej tolerancji, odbiega od
linii prostej. Prostoliniowość obserwuje się od drugiego do czwartego pomiaru (dla czasu :
6, 12, 24 min), następnie występuje załamanie linii (spadek szybkości reakcji) przy
czasie 24 min, dla pozostałych pomiarów ponownie otrzymano linię prostą, jednak już pod
pewnym nachyleniem w stosunku do pierwszego odcinka.
Aproksymacja wykresu do linii prostej (wykres nr 3) wskazuje na duży rozrzut pomiarów
szczególnie pomiaru pierwszego oraz czwartego dlatego punkty te odrzucono (wykres nr 4).
Na podstawie współczynnika kierunkowego otrzymanej prostej wyznaczono stałą szybkości reakcji(wykres nr 4):
![]()
stała szybkości reakcji obliczona przez program UNIRATE-S przy stosunkowo dużej tolerancji (40%)
![]()
Obliczona z wykresu wartość k różni się od wartości średniej k obliczonej przez komputer
![]()
Analiza błędów:
Otrzymane wyniki świadczą o tym, że podczas doświadczenia popełniono szereg błędów na rozmiar, których mogą składać się:
niedokładności związane z odmierzaniem objętości reagentów (niedokładność pipety)
błąd paralaksy biurety, tzn. odczytana wartość nie odpowiada rzeczywistej
zmiany temperatury, szybkość reakcji zależy od temperatury (rośnie wraz z jej wzrostem)
błąd związany z czasem, nie jest możliwe równoczesne pobranie 20 ml reagującej mieszaniny i umieszczenie jej w kolbce zawierającej hamujący dalszy przebieg reakcji roztwór kw. solnego. Czas więc nie jest określony precyzyjnie
błąd miareczkowania polegający na tym, że punkt końcowy miareczkowania (punkt zmiany barwy wskaźnika z pomarańczowej na błękitną) nie pokrywa się z punktem równoważnikowym miareczkowania, ta wizualna metoda określania PK wiąże się więc z indywidualnym postrzeganiem zbliżonych barw
zaokrąglenia w obliczeniach
IV. Literatura:
[1],[2],[3],[4], [5] Gordon M. Barrow „Chemia fizyczna” PWN Warszawa 1971 (tłumaczenie z języka angielskiego)
(*) „Poradnik fizykochemiczny” WNT Warszawa 1974 rozdział B strona 328
(*) Lucjan Lubczyk „Chemia fizyczna dla przyrodników” PWN Warszawa 1977 strona 506
Porównanie otrzymanych wyników:
Ponieważ wykonano doświadczenie dwukrotnie a nie znaleziono wartości literaturowej stałej szybkości porównano otrzymane wyniki badanej reakcji.
Analiza otrzymanych wyników:
L.p. |
Czas t [min] |
x - liczba moli estru (w 1 dm3), który uległ przemianie w czasie t [mol/dm3] (1) |
x - liczba moli estru (w 1 dm3), który uległ przemianie w czasie t [mol/dm3] (2) |
Różnica pomiędzy liczbą moli estru ulegającego przemianie w doświadczeniu (1) (2) Δx [mol/dm3] |
1 |
3 |
0,023 |
0,018 |
0,005 |
2 |
6 |
0,0295 |
0,028 |
0,0015 |
3 |
12 |
0,0355 |
0,033 |
0,0025 |
4 |
24 |
0,0405 |
0,038 |
0,0025 |
5 |
48 |
0,0437 |
0,040 |
0,0037 |
6 |
96 |
0,0445 |
0,043 |
0,0015 |
7 |
192 |
0,0455 |
0,048 |
-0,0025 |
Gdzie:
- wyniki pomiarów Grzegorza Ziaji
- wyniki pomiarów Marcina Szpaka
![]()
Analizując liczbę moli przereagowanego estru w obydwu pomiarach, łatwo zauważyć , że dla pomiaru (1) większa liczba moli ulega hydrolizie w stosunku do pomiaru (2) przy tych samych wartościach czasu.
Przyczyną takiego stanu mogą być błędy wymienione wcześniej w punkcie „Analiza błędów” oraz:
różne stężenie wziętych do doświadczenia reagentów (pomiary wykonano w odstępie
siedemnastu dni).
różnica w ciśnieniu Δp=25hPa
dokładność w wykonaniu doświadczenia
wahania temperatury w laboratorium
Analiza wartości k otrzymanych przez program UNIRATE-S:
Wartość k dla pomiaru (1) kśr=4,41302 [mol/min*dm3]
przy tolerancji (sprawdzania stałości k) 30%
- Wartość k dla pomiaru (1) kśr=3,11524 [mol/min*dm3]
przy tolerancji (sprawdzania stałości k) 40%
Różnica między otrzymanymi wartościami k wynosi 1,29778, przy czym mniejsza tolerancja dla pomiaru (1) (30% w stosunku do pomiaru (2) 40%) świadczy o większej dokładności wykonania doświadczenia ( wartość k dla (1) będzie bardziej zbliżona do wartości literaturowej).
Analiza wykresu zależności 1/lnC=f(t) (wykres nr 6)
Analiza wykresu potwierdza większą dokładność pomiaru (1) wykres zależności 1/lnC=f(t)
jest bardziej zbliżony do linii prostej w stosunku do pomiaru (2).
Graficznie przedstawia różnice wynikające z różnej liczby moli estru ulegającego hydrolizie w
obu pomiarach ( krzywa zależności 1/lnC=f(t) dla pomiaru (1) przyjmuje znacznie większe
wartości).
Wnioski:
Wyniku porównania pomiaru (1) oraz (2) stwierdza się że przy zbliżonych warunkach
doświadczenia ( temperatura, stężenia reagentów, metoda wykonania) dokładniej wykonano pomiar (1) (potwierdzeniem tego jest wartość k , tolerancja oraz wykres zależności 1/lnC=f(t) (wykres nr 5)).
Otrzymane wartości k są obarczone stosunkowo dużym błędem o czym sugeruje wartość tolerancji z jaką obliczone są przez program UNIRATE-S wartości kśr.
Błąd spowodowany może być niedokładnością wykonania doświadczenia, a także metodą w
sposób której dokonano pomiarów a szczególnie etap:
zahamowania reakcji hydrolizy poprzez zobojętnienie roztworem HCl przy jednoczesnym
pomiarze czasu
należy także wziąć pod uwagę wahania temperatury czyli brak stałości temperatury pomiarów
Metodę tą należało by więc usprawnić i unowocześnić, lub wykonać większą liczbę pomiarów w przeprowadzonym doświadczeniu. Brak danych literaturowych k powoduje, że analiza otrzymanych wartości k jest niepełna.
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
8.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
izomeria optyczna, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
10.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
8.4 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
SEM ogniwa2, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
5, Technologia chemiczna, Chemia fizyczna, laboratorium
adsorpcja, Technologia chemiczna, Chemia fizyczna, laboratorium
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
więcej podobnych podstron