NAPIĘCIE POWIERZCHNIOWE
Cel ćwiczenia
Wyznaczenie izotermy napięcia powierzchniowego wodnych roztworów alkoholu n-butylowego σ = f ( c ).
Na podstawie wyznaczonej izotermy napięcia powierzchniowego oraz równania Gibbsa obliczenie i porównanie izoterm adsorpcji tego alkoholu na powierzchni granicznej roztwór wodny alkoholu - powietrze oraz na powierzchni węgla aktywnego.
Sprawdzenie stosowalności równań Freundlicha i Langmuira do opisu obydwu procesów adsorpcji alkoholu n-butylowego i wyznaczenie stałych współczynników tych równań.
Wprowadzenie
Adsorpcja na granicy faz roztwór ciekły - gaz jest wynikiem ustalania się równowagi pomiędzy dwoma przeciwstawnymi procesami. Z jednej strony układ dąży do osiągnięcia stanu o minimum energii (również energii powierzchniowej zależnej od wielkości powierzchni), a więc do takiego przegrupowania cząsteczek roztworu by osiągnąć najmniejszą powierzchnię rozdziału faz w stosunku do objętości tej fazy, z drugiej strony proces dyfuzji przeciwdziała gromadzeniu się jednego rodzaju cząsteczek w jednym miejscu, w tym przypadku na powierzchni roztworu.
Jeżeli przyciągające siły wzajemnego oddziaływania cząsteczek rozpuszczalnika są większe niż siły działające pomiędzy cząsteczkami rozpuszczalnika i cząsteczkami substancji rozpuszczonej, to cząsteczki substancji rozpuszczonej zostaną wyparte z głębi cieczy na jej powierzchnię (adsorpcja dodatnia), a ich obecność na powierzchni spowoduje obniżenie napięcia powierzchniowego roztworu.
Natomiast jeżeli przyciąganie cząsteczek substancji rozpuszczonej przez cząsteczki rozpuszczalnika jest większe niż siły działające pomiędzy cząsteczkami rozpuszczalnika, to cząsteczki rozpuszczalnika dążą do otoczenia obcych cząsteczek ze wszystkich stron, cząsteczki substancji rozpuszczonej zostaną wciągnięte w głąb fazy ciekłej i warstwa powierzchniowa ubożeje w substancję rozpuszczoną (adsorpcja ujemna), czemu towarzyszy wzrost napięcia powierzchniowego roztworu.
Jeżeli cząsteczki rozpuszczalnika działają takimi samymi siłami wzajemnie na siebie jak i na cząsteczki substancji rozpuszczonej, to napięcie powierzchniowe roztworu jest takie samo jak czystego rozpuszczalnika i nie występują żadne różnice składu warstwy powierzchniowej roztworu w stosunku do pozostałej objętości cieczy.
Substancje, które obniżają napięcie powierzchniowe nazywamy substancjami powierzchniowo czynnymi, a te, które podwyższają napięcie powierzchniowe lub nie zmieniają go - substancjami powierzchniowo nieczynnymi.
W wodnych roztworach mocnych elektrolitów siły elektrostatycznego przyciągania dipoli wodnych przez jony są większe niż siły działające pomiędzy samymi dipolami wody, wskutek tego dochodzi do pewnego zmniejszenia stężenia jonów w warstwie powierzchniowej roztworu i do nieznacznego wzrostu napięcia powierzchniowego tego roztworu w porównaniu do czystej wody.
Na przykład napięcie powierzchniowe wody w temperaturze 180C wynosi 72,4⋅10-3 N/m, natomiast 14% roztworu NaCl w tej samej temperaturze wynosi 76,9⋅10-3 ⋅N/m.
Znacznie ważniejszy jest przypadek zagęszczania się obcych cząsteczek w warstwie powierzchniowej roztworu. Zwłaszcza niektóre związki organiczne o niesymetrycznej, polarnej budowie cząsteczek, np. alkohole, kwasy tłuszczowe, wykazują zdolność silnego zagęszczania się na powierzchni ich wodnych roztworów i znacznego obniżania napięcia powierzchniowego.
Stwierdzono, że cząsteczki substancji powierzchniowo czynnych nie gromadzą się na powierzchni cieczy bezładnie, lecz w sposób ściśle uporządkowany. Zgodnie z regułą iż „podobny w podobnym się rozpuszcza” np. cząsteczki jednokarboksylowych kwasów alifatycznych typu R-COOH oraz alkoholi typu R-OH, (gdzie R oznacza rodnik organiczny np. łańcuch alifatyczny CH3-CH2-(CH2)n--), ustawiają się na powierzchni wody równolegle do siebie zwrócone hydrofilową grupą karboksylową -COOH lub hydroksylową -OH ku wodzie, a hydrofobową grupą węglowodorową ku atmosferze.
Adsorpcja substancji organicznych z roztworów zależy w bardzo dużym stopniu od ich natury. Podstawniki w adsorbowanych cząsteczkach silnie wpływają na wielkość adsorpcji. W szeregu homologicznym substancji powierzchniowo czynnych adsorpcja wzrasta w miarę wzrostu długości łańcucha organicznego jednakową liczbę razy na każdą grupę - CH2 -.
Substancje powierzchniowo czynne, do których między innymi należą mydła (sole sodowe lub potasowe wyższych kwasów tłuszczowych) mają duże zastosowanie jako środki obniżające napięcie powierzchniowe, a więc jako środki myjące i piorące.
Przyczyną zmian napięcia powierzchniowego roztworów jest adsorpcja substancji powierzchniowo czynnych na granicy rozdziału faz. Gibbs wyprowadził równanie ujmujące ilościowo zależność pomiędzy wielkością adsorpcji a napięciem powierzchniowym roztworu. Równanie to ma szczególnie duże znaczenie dla badań adsorpcji na powierzchniach granicznych układów ciecz - gaz, ciecz - ciecz, ciecz - ciało stałe, gdzie można dokładnie zmierzyć napięcie powierzchniowe.
Równanie to ma postać:
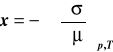
(1)
gdzie: x - wielkość adsorpcji (ilość substancji zaadsorbowanej przez jednostkę powierzchni adsorbenta w g lub w molach na m2), σ - napięcie powierzchniowe, μ - potencjał chemiczny adsorbującej się substancji.
W przypadku, gdy stężenia c (lub ciśnienia p) adsorbującej się substancji są małe:
![]()
i wtedy
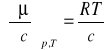
a równanie (1) można przedstawić w następującej postaci :
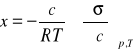
(2)
gdzie: c - oznacza równowagowe stężenie substancji rozpuszczonej w roztworze lub znajdującej się w fazie gazowej, a więc w środowisku, z którego zachodzi adsorpcja.
Jak wynika z równania (2) dodatni znak pochodnej 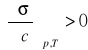
, co oznacza ujemną adsorpcję substancji powierzchniowo nieczynnej, natomiast gdy pochodna ma wartość ujemną 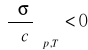
, adsorpcja jest dodatnia a substancja powierzchniowo czynna.
Równanie (2) pozwala na wyznaczenie izotermy adsorpcji danej substancji x = f(c) gdy znana jest izoterma napięcia powierzchniowego jej roztworu σ = f(c).
Na rys.1. podano dla przykładu schemat wyznaczania izoterm adsorpcji i napięcia powierzchniowego roztworu.
Metodyka pomiaru i opis aparatury
Jedną z metod wyznaczania napięcia powierzchniowego roztworu jest metoda pęcherzykowa. Pomiar polega na wyznaczeniu ciśnienia potrzebnego do wypchnięcia pęcherzyka powietrza z kapilary zanurzonej w warstwie powierzchniowej badanego roztworu.
Przyrząd służący do tego celu, skonstruowany po raz pierwszy przez Rebindera jest przedstawiony na rysunku 2.
W naczynku 1 znajduje się badana ciecz, w powierzchniowej warstwie cieczy zanurzona jest kapilara 2, tak aby tylko dotykała powierzchni cieczy, lekko ją podnosząc. Kapilara połączona jest za pomocą rurek z układem naczynek 3 i 4 (służącym do wytworzenia ciśnienia potrzebnego do wypchnięcia pęcherzyka powietrza z kapilary poprzez warstwę powierzchniową cieczy) oraz z manometrem pochyłym 5.
Pomiędzy ciśnieniem p, odczytanym na manometrze w momencie przeskakiwania pęcherzyka powietrza poprzez powierzchniową warstwę roztworu, a wielkością napięcia powierzchniowego roztworu na obwodzie kapilary o promieniu r, istnieje zależność:
![]()
(3)
gdzie: p (ciśnienie hydrostatyczne) = h·d·g, d - gęstość cieczy w manometrze, a więc
![]()
(4)
Ponieważ wyznaczenie bardzo małego promienia kapilary z wystarczającą precyzją jest trudne, a błąd oznaczenia rzutuje na błąd wyznaczanego napięcia powierzchniowego badanego roztworu, zamiast stosowania tej bezpośredniej metody można posłużyć się metodą pośrednią, pozwalającą na wyeliminowanie pomiaru promienia kapilary.
Dla dwóch cieczy o napięciach powierzchniowych σ1 i σ2 przy wyznaczaniu ciśnienia p1 i p2 z zastosowaniem tej samej kapilary otrzymamy:
![]()
i ![]()
Dzieląc te równania stronami otrzymamy:
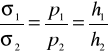
(5)
gdzie: h1 i h2 - wysokości słupów cieczy w rurce manometrycznej,
a stąd
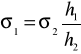
(6)
Sposób przeprowadzania pomiarów napięcia powierzchniowego
Po sprawdzeniu czystości i drożności kapilary, do naczynka 1 należy wlać wodę destylowaną i za pomocą kranu 9 ustalić jej poziom tak, by kapilara lekko dotykała powierzchni wody. Następnie po kolejnym zamknięciu kranów 8, 7 i 6 należy do naczynka 3 wlać wodę. Otwierając ostrożnie kran 7 należy ustawić szybkość wypływu kropli wody do naczynka 4 na około jedną kroplę na sekundę. Ciśnienie rośnie jednakowo równocześnie w naczynku 4, w kapilarze i w manometrze 5 aż do osiągnięcia wartości p koniecznej do wypchnięcia pęcherzyka powietrza poprzez powierzchniową wartswę cieczy w naczynku 1.
Po kilku pierwszych przeskokach pęcherzyków powietrza należy zwolnić szybkość wypływu wody z naczynka 3 do 4 i notować maksymalne położenie cieczy w rurce manometrycznej odpowiadające ciśnieniu potrzebnemu do wypchnięcia pęcherzyka powietrza.
Pomiar powtarza się 5-7 razy i oblicza wartość średnią (odchylenia poszczególnych pomiarów nie powinny przekraczać 1 - 2 mm). Następnie po usunięciu wody z naczynka 1, przemywa się je i napełnia badaną cieczą, w analogiczny sposób jak dla wody wyznacza wartości h i korzystając z wzoru (6) oblicza się napięcie powierzchniowe.
Wartości napięcia powierzchniowego wody destylowanej w różnych temperaturach podano w Tabeli 1.
Gęstość (d) alkoholu n-butylowego w temperaturze 200C wynosi 0,81 g/cm3.
Przyrządy i odczynniki:
aparat Rebindera, 0.05M i 0.5M alkohol n-butylowy, węgiel aktywny, szkło laboratoryjne, bibuła filtracyjna
Wykonanie ćwiczenia
Do dziewięciu kolbek miarowych na 100 ml wlewa się odpowiednie objętości (odmierzone biuretą) wodnego roztworu alkoholu n-butylowego, a następnie kolbki dopełnia się do objętości 100 ml wodą destylowaną. Rozcieńczenia należy wykonać według Tabeli 2. Stężenia tak otrzymanych roztworów powinny wynosić odpowiednio :
0,5 0,375 0,25 0,15 0,10 0,05 0,03 0,02 i 0,01M
Następnie odmierza się po 30 ml każdego roztworu do kolbek lub butelek z doszlifowanymi korkami i dodaje po 3g węgla aktywnego, wstrząsa przez 15 min i pozostawia do osiągnięcia równowagi adsorpcyjnej.
W tym czasie należy oznaczyć w aparacie Rebindera napięcie powierzchniowe pierwotnych roztworów, zaczynając od najbardziej rozcieńczonego i przechodząc kolejno do bardziej stężonych, a następnie wykreślić zależność h1 = f(c1). Po ustaleniu się równowagi adsorpcyjnej w kolbkach, węgiel odsącza się i oznacza napięcie powierzchniowe roztworów po adsorpcji na węglu aktywnym. Uzyskane wyniki należy zebrać w Tabeli 2 i celem porównania z zależnością wyznaczoną przed adsorpcją należy przedstawić zależność h2 = f(c1) na tym samym wykresie co h1 = f(c1). Na podstawie tego wykresu należy określić wartości równowagowych stężeń roztworów po adsorpcji, c2. Wszystkie pomiary powinny być wykonane w stałej temperaturze. Po zakończeniu ćwiczenia naczynko pomiarowe i kapilara powinny być kilkakrotnie przemyte wodą destylowaną i pozostawione tak, aby kapilara i połowa banieczki były zanurzone w wodzie destylowanej.
Opracowanie wyników
Celem przedstawienia izotermy napięcia powierzchniowego wodnych roztworów alkoholu n-butylowego należy po lewej stronie wykresu h1 = f(c1) nanieść skalę odpowiadającą wartościom h1, a po prawej stronie skalę dla napięcia powierzchniowego.
W oparciu o wyznaczoną izotermę napięcia powierzchniowego należy obliczyć wielkość adsorpcji na powierzchni granicznej roztwór wodny alkoholu - powietrze dla różnych stężeń roztworów i wykreślić tę izotermę adsorpcji (skala na osi y po prawej stronie wykresu) wraz z wykresem izotermy napięcia powierzchniowego (skala na osi y po lewej stronie wykresu).
Należy obliczyć i wykreślić izotermę adsorpcji alkoholu n-butylowego na węglu aktywnym.
Różnica (c1 - c2)·v równa jest ilości alkoholu zaadsorbowanego przez naważkę m węgla aktywnego z objętości roztworu. Stąd ilość alkoholu zaadsorbowana przez 1g węgla aktywnego wynosi:
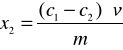
(7)
W obu przypadkach wyznaczonych izoterm adsorpcji należy sprawdzić stosowalność równań Freundlicha i Langmuira do opisu badanych procesów i w przypadku stwierdzenia ich stosowalności wyznaczyć stałe współczynniki tych równań.
Równanie Freundlicha:
![]()
(8)
W celu sprawdzenia stosowalności tego równania należy je przedstawić w postaci zlogarytmowanej:
![]()
(9)
i sporządzić wykres zależności log x = f (log c).
Równanie Langmuira:
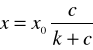
(10)
W celu sprawdzenia stosowalności tego równania można je przedstawić w postaci :
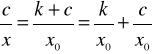
(11)
lub
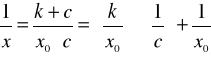
(12)
i sporządzić wykresy zależności c/x = f (c) lub 1/x = f (1/c).
Należy przeprowadzić dyskusję otrzymanych wyników i porównać obie wyznaczone izotermy. W celu porównania należy sporządzić wykresy obydwu izoterm adsorpcji alkoholu n-butylowego na powierzchni granicznej roztwór wodny alkoholu - powietrze oraz na węglu aktywnym zaznaczając na nich punktami - wyniki doświadczalne z zaznaczeniem niepewności pomiarowych oraz dwie linie obliczone w oparciu o wyznaczone współczynniki równań Freundlicha i Langmuira.
Zagadnienia do opracowania
Cechy charakterystyczne adsorpcji fizycznej i chemicznej
Izobara i izoterma adsorpcji (wyprowadzenie równania izotermy Langmuira)
Równanie adsorpcji Gibbsa
Budowa i działanie substancji powierzchniowo-czynnych
Literatura
G. Barrow, Chemia fizyczna, PWN 1966.
A. Bielański, Chemia fizyczna, PWN 1963.
A. Górski, Chemia fizyczna, PWRiL 1962.
K. Pigoń, Chemia fizyczna, PWN 1980.
Tabela 1. Napięcie powierzchniowe wody destylowanej na granicy faz woda - powietrze
Temperatura/ oC |
Napięcie powierzchniowe/ 10-3 N/m |
0 5 10 15 17 18 19 20 21 22 23 24 25 26 27 |
75,64 74,92 74,22 73,49 73,19 73,05 72,90 72,75 72,59 72,44 72,28 72,14 71,97 71,82 71,66 |
Tabela 2
Wyniki pomiarów
Nr kolbki |
Ilość alkoholu n-butylowego 0.05M 0.5M*
ml |
Ilość H2O dest.
ml |
Stężenie alkoholu n-butylowego w otrzymanym roztworze
c1/ mol/l |
Napięcie powierzchniowe roztworu przed adsorpcją
σ1/ 10-3N/m |
Obliczona ilość alkoholu zaadsorbowanego na powierzchni roztwór-powietrze
x1/ mol/m2 |
Napięcie powierzchniowe roztworu po adsorpcji na węglu aktywnym
σ2/ 10-3N/m |
Stężenie alkoholu n-butylowego w otrzymanym roztworze po adsorpcji na węglu aktywnym
c2/ mol/l |
Ilość alkoholu n-butylowego zaadsorbowana przez 1g węgla aktywnego (c1-c2) ⋅ v/m (v=30ml m-masa węgla) x2/ mol/g |
1 2 3 4 5 6 7 8 9 |
20 40 60 100 20* 30* 50* 75* 100* |
80 60 40 --- 80 70 50 25 --- |
0,01 0,02 0,03 0,05 0,10 0,15 0,25 0,375 0,50 |
|
|
|
|
|
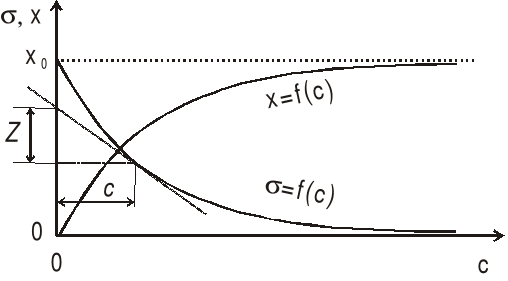
Rys. 1. Izotermy adsorpcji i napięcia powierzchniowego roztworu.
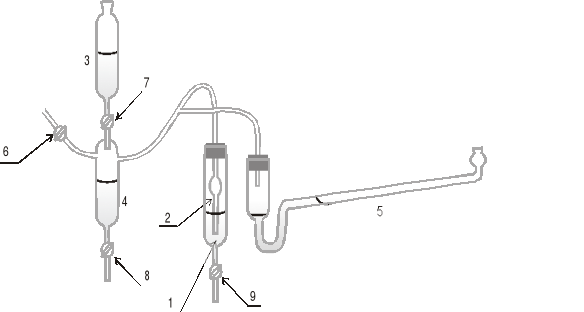
Rys.2. Schemat przyrządu Rebindera do pomiaru napięcia powierzchniowego.
LABORATORIUM Z CHEMII FIZYCZNEJ
Ćwiczenie 9
|
1
1
LABORATORIUM Z CHEMII FIZYCZNEJ
Ćwiczenie 10
|
1
9
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 4 - destylacja, Technologia INZ PWR, Semestr 3, Chemia Fizyczna, Chemia fizyczna - Laborat
Cwiczenie - F OKSYALKILENOWANIE ALKOHOLI, Technologia INZ PWR, Semestr 5, Technologia Chemiczna - su
10, Technologia INZ PWR, Semestr 1, Chemia Ogólna, Wykłady z Chemii Ogólnej
Pomiary napięć stałych, Technologia INZ PWR, Semestr 2, Elektronika i Elektrotechnika - Laboratorium
14, Technologia INZ PWR, Semestr 1, Chemia Ogólna, Wykłady z Chemii Ogólnej
Pomiar napięć stałych, Technologia INZ PWR, Semestr 2, Elektronika i Elektrotechnika - Laboratorium,
11, Technologia INZ PWR, Semestr 1, Chemia Ogólna, Wykłady z Chemii Ogólnej
9, Technologia INZ PWR, Semestr 1, Chemia Ogólna, Wykłady z Chemii Ogólnej
Cwiczenie - F OKSYALKILENOWANIE ALKOHOLI, Technologia INZ PWR, Semestr 5, Technologia Chemiczna - su
harmonogram zajęć technologia, Technologia INZ PWR, Semestr 5, Inżynieria chemiczna, Inżynieria Chem
Ćwiczenie nr 4 zapoznanie się z mostkiem Wheatstone, Technologia INZ PWR, Semestr 2, Elektronika i E
Sprawozdanie nr I, Technologia INZ PWR, Semestr 2, Elektronika i Elektrotechnika - Laboratorium, Spr
Tabela6, Technologia INZ PWR, Semestr 2, Analiza Matematyczna 2.2, Tabele
Opracowanie - materialy, Technologia INZ PWR, Semestr 1, Materiałoznastwo, Materiały - opracowania
Technologia chemiczna W3, Technologia INZ PWR, Semestr 4, Technologia Chemiczna - surowce i procesy,
więcej podobnych podstron