Przemysł azotowy.
Główne produkty przemysłu azotowego: kwas azotowy, azotany, mocznik (~90% światowej produkcji azotu znajduje zastosowanie w rolnictwie)
I synteza przemysłowa amoniaku: 1913 r w Oppau w Niemczech (Chaber- Bosch)
Reakcja syntezy amoniaku z pierwiastków (ΔH = -46 kJ/mol)
½ N2 + 3/2 H2 = NH3
Niska temperatura i wysokie ciśnienie sprzyjają przebiegowi reakcja w kierunku tworzenia amoniaku.
Ze względu na ciśnienie instalacje dzielimy na:
- niskociśnieniowe 10- 20 MPa
- średniociśnieniowe 20- 45 MPa
- wysokociśnieniowe 60- 100 MPa
Reakcje syntezy amoniaku przebiegają w obecności katalizatora.
Katalizator: Żelazo (redukcja tlenków żelaza w stosunku 1:1, 1 Fe2+ do 1 Fe3+), zawierające promotory zwiększające ich aktywność i trwałość (Al2O3, K2O, CaO). Zawartości tlenków to 3- 7. Katalizator może pracować w temp. 380- 550 ºC. Dodatek tlenku magnezu pozwala na pracę katalizatora do 600 ºC.
Katalizator jest wrażliwy na „zatrucia” (zanieczyszczenia): O2, H2O, CO, CO2
Mechanizm procesu: chemisorpcja na powierzchni katalizatora:
N2 + 2Fe = 2Fe-Nads
H2 + 2Fe = 2Fe- Hads
Nads + Hads = NHads
NHads + Hads = NH2ads
NH2ads + Hads = NH3ads
NH3ads = NH3desorp
Szybkość reakcji (równanie Temkina i Pyżewa)
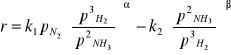
Wzrost prędkości objętościowej gazu powoduje wzrost ilości tworzącego się NH3 na jednostkę katalizatora. W praktyce stosuje się obciążenia 10000- 30000 l/h (dla 30 MPa) oraz 70000- 80000 l/h (przy 70- 100 MPa).
Przygotowanie gazu do syntezy (koszt tej operacji to ok. 70% kosztów wytwarzania amoniaku).
Wodór może pochodzić z następujących źródeł:
zgazowanie paliw stałych
zgazowanie paliw ciekłych
konwersja paliw gazowych (gaz ziemny)
elektroliza wody
Azot do syntezy pochodzi z powietrza atmosferycznego przez oddzielenie tlenu:
na drodze fizycznej (skroplenie, rektyfikacja powietrza)
na drodze chemicznej (związanie tlenu w procesie wytwarzania gazu do syntezy)
Konwersja metanu (reforming CH4):
CH4 + H2O = CO + 3H2 ΔH= 207 kJ/ mol
Reakcja odwracalna, endotermiczna- prowadzi się ją w 1100 ºC.
Katalizator: Nikiel aktywowany tlenkami Al, Mg, Cr. Ciśnienie 2- 3 MPa- redukcja wielkości aparatury.
Skład gazu po konwersji [% obj.] |
||||
Temperatura [ºC] |
CH4 |
H2O |
CO |
H2 |
700 |
5,08 |
5,08 |
22,46 |
67,39 |
800 |
1,71 |
1,71 |
24,16 |
72,44 |
900 |
0,64 |
0,64 |
24,68 |
74,04 |
Dalsze ilości wodoru i tlenku węgla powstają w wyniku egzotermicznej reakcji półspalania metanu:
2CH4 + O2 + 3,76 N2 → 2 CO + 4H2 + 3,76 N2 ΔH= - 35 kJ/ mol
Do układu wprowadzamy taką ilość azotu jaka jest niezbędna.
Musimy pozbyć się CO (konwersja CO).
Konwersja tlenku węgla:
Tlenek węgla poddajemy reakcji konwersji z parą wodną:
CO + H2O = CO2 + H2 ΔH= - 41,1 kJ/ mol
Reakcja odwracalna- równowaga przesuwa się w prawo w niskich temperaturach, ciśnienie nie ma wpływu na równowagę. W praktyce przemysłowej stosuje się nadmiar pary wodnej oraz katalizator.
Do konwersji w temp. 300- 500 ºC (normalnotemperaturowa) katalizatorami są tlenki: Fe i Cr z dodatkiem tlenu Mg i Ca. W gazach po konwersji pozostaje jeszcze 2- 3% CO.
Konwersja niskotemperaturowa pozwala na obniżenie zawartości CO poniżej 0,3% ze względu na korzystniejsze położenie stałej równowagi.
Katalizatorami w konwersji niskotemperaturowej są mieszaniny tlenków Cr i Cu. Są one jednak bardziej wrażliwe na zatrucia (związki siarki).
Oczyszczanie gazu do syntezy:
W zależności od stosowanej technologii niezbędne jest usuwanie:
Pyłów
Związków siarki
Tlenku węgla
Odsiarczanie przeprowadza się przed usuwaniem tlenku węgla (konwersja parą wodną). Stosowane są następujące metody:
odsiarczanie na węglu aktywnym
odsiarczanie za pomocą etanoloamin
odsiarczanie za pomocą tlenku cynku
Wymywanie dwutlenku węgla z gazu do syntezy.
Stosowane są procesy absorpcji fizycznej i chemicznej.
Absorbentami CO2 w absorpcji fizycznej są woda i aceton, a proces realizowany jest pod ciśnieniem. W procesie absorpcji chemicznej stosuje się absorbenty: aminoalkohole, woda amoniakalna, roztwór węglanu amonu, węglan potasu.
Rozpuszczony CO2 usuwa się przez zmianę ciśnienia lub podwyższenie temperatury (można go wykorzystać do produkcji suchego lodu, mocznika itp.)
Usuwanie końcowe tlenku węgla i resztek CO2
Tlenek węgla usuwa się przy zastosowaniu jednej z metod:
absorpcję w amoniakalnych roztworach soli miedzi (I)
przemywanie ciekłym azotem
metanizację lub prekatalizę
Metanizacja pozwala na końcowe usunięcie z gazu syntezowego CO, CO2 oraz O2:
CO + 3H2 = CH4 + H2O
CO2 + 4 H2 = CH4 + 2 H2O
O2 + 2 H2 = H2O
Węzeł syntezy amoniaku.
Cechą charakterystyczną instalacji do syntezy amoniaku jest stosowanie cyrkulacji nieprzereagowanej mieszaniny azotowo- wodorowej, która nie uległa przemianie na amoniak, wydzielenie amoniaku przez wykroplenie i stosowanie wysokich ciśnień.
Świeżą mieszaninę azotowo- wodorową do obiegu syntezy amoniaku podaje się przed skraplaczem amoniaku w celu usunięcia resztek CO2 i pary wodnej.
Stężenie gazów obojętnych (CH4, Ar) utrzymuje się na stałym poziomie przez ciągłe lub periodyczne odpuszczanie części gazów resztkowych (purge gas).
Chłodzenie gazu po reakcji do niskich temperatur może być realizowane przez odparowanie części wykroplonego amoniaku lub przez chłodzenie ciekłym amoniakiem z odrębnego obiegu chłodniczego.
Aparatura do syntezy NH3
- aparatura wysokociśnieniowa, grubościenna, odporna na korozję wodorową.
W aktualnie stosowanych konwektorach do syntezy amoniaku zapobiega się korozji wodorowej przez odpowiednią konstrukcję umożliwiającą kierowanie zimnego gazu syntezowanego pomiędzy wnętrzem konwektora i ścianą płaszcza ciśnieniowego. Dzięki czemu przy temperaturze katalizatora rzędu 550 ºC temperatura płaszcza nie przekracza 100 ºC.
Jako materiał do wykonania wnętrza aparatu stosuje się stale stopowe o zawartości 18% Cr, 8% Ni, i zawierające mniej niż 0,08% C.
Wnętrze konwertora powinno charakteryzować się:
dużą objętością katalizatora
dobrą wymianą ciepła
optymalnym rozkładem temperatur w złożu katalitycznym
szczelnością w czasie eksploatacji
Wytwórnia amoniaku, (Jakie muszą w niej być procesy jednostkowe)
odsiarczanie metanu
konwersja metanu
dopalanie metanu (półspalanie)
konwersja tlenku węgla normalnotemperaturowa
konwersja CO niskotemperaturowa
absorpcja CO2
metanizator
synteza NH3
skraplanie NH3
zwrot mieszanki gazów syntezowych
SYNTEZA MOCZNIKA
Mocznik- amidowy związek azotu, znajduje zastosowanie jako nawóz azotowy, składnik pasz, w produkcji tworzyw sztucznych, klejów, żywic, lakierów, barbituranów.
Reakcja::
2NH3 + CO2 = CO(NH2)2 + H2O
Reakcja dwustopniowa, najpierw tworzy się karbaminian amonu:
2NH3 + CO2 = NH4-O-C=O(-NH2) ΔH= - 142,1 kJ/ mol
Który przechodzi w mocznik:
NH4-O-C=O(-NH2) → CO(NH2)2 + H2O ΔH= 32,0 kJ/ mol
Reakcja przebiega w fazie ciekłej, w temperaturze 170- 220 ºC i ciśnieniu 15- 30 MPa.
Po użyciu 3-4 krotnego nadmiaru NH3 w stosunku do CO2 uzyskuje się 80% stopień przemiany.
Praktycznie zawsze stosuje się recyrkulację reagentów. Innym problemem jest korozja materiału, z którego zbudowany jest reaktor- stosowane są wykładziny z cyrkonu, tytanu i jego stopy.
!!!Do syntezy mocznika nie stosuje się katalizatorów!!!
Instalacje do syntezy mocznika:
instalacje bez zawracania amoniaku i dwutlenku węgla
instalacje z częściowym lub całkowitym zawracaniem.
4
Wykład 3
Wyszukiwarka
Podobne podstrony:
Technologia chemiczna W6, Technologia INZ PWR, Semestr 4, Technologia Chemiczna - surowce i procesy,
Cwiczenie - F OKSYALKILENOWANIE ALKOHOLI, Technologia INZ PWR, Semestr 5, Technologia Chemiczna - su
harmonogram zajęć technologia, Technologia INZ PWR, Semestr 5, Inżynieria chemiczna, Inżynieria Chem
optymal temp PFR CSTR, Technologia INZ PWR, Semestr 4, Technologia Chemiczna - surowce i nośniki, Te
Cwiczenie - F OKSYALKILENOWANIE ALKOHOLI, Technologia INZ PWR, Semestr 5, Technologia Chemiczna - su
Tabela6, Technologia INZ PWR, Semestr 2, Analiza Matematyczna 2.2, Tabele
Opracowanie - materialy, Technologia INZ PWR, Semestr 1, Materiałoznastwo, Materiały - opracowania
Zajecia 4, Technologia INZ PWR, Semestr 3, Podstawy Chemii Organicznej, Podstawy chemii organicznej
10, Technologia INZ PWR, Semestr 1, Chemia Ogólna, Wykłady z Chemii Ogólnej
Ćwiczenie nr 4 zapoznanie się z mostkiem Wheatstone, Technologia INZ PWR, Semestr 2, Elektronika i E
Zajecia 3, Technologia INZ PWR, Semestr 3, Podstawy Chemii Organicznej, Podstawy chemii organicznej
Instrukcja NMR, Technologia INZ PWR, Semestr 3, Podstawy Chemii Organicznej, Podstawy chemii organic
Sprawozdanie nr I, Technologia INZ PWR, Semestr 2, Elektronika i Elektrotechnika - Laboratorium, Spr
więcej podobnych podstron