Stężenie molowe - rozwiązania
W 250 cm3 roztworu kwasu azotowego znajduje się 25 g HNO3. Oblicz stężenie molowe tego roztworu.
Dane:
Vroztw.=250cm3=0,25dm3 (gdyż w definicji ilość moli odnosi się do 1dm3)
ms = 25 g
Szukane:
cm= ?
Rozwiązanie:
Krok I
Obliczamy masę molową HNO3, gdyż wartość ta jest niezbędna do przeliczenia masy kwasu na ilość moli i to beż względu na to, czy skorzystamy z wzoru na stężenie czy też oddzielnie masę kwasu przeliczymy na ilość moli. Mkwasu = 63 g/mol
Krok II
Korzystając z wzoru na stężenie molowe obliczamy stężenie roztworu kwasu
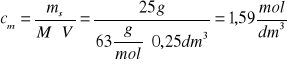
Krok III Stężenie molowe tego roztworu wynosi około 1,6 mol/dm3
Ile gramów chlorku żelaza(II) należy odważyć w celu otrzymania 0,2 dm3 roztworu o stężeniu 0,1 mol/dm3
Dane:
Vroztw.= 0,2 dm3
cm= 0,1 mol/dm3
Szukane:
ms = ?
Rozwiązanie:
Krok I
Obliczamy masę molową chlorku żelaza(II) FeCl2 M = 127 g/mol
Krok II
Wzór na stężenie molowe przekształcamy ze względu na masę substancji rozpuszczonej (ms) ms= M•V•cm
ms = 0,2dm3 •1,6 mol/dm3•127 g/mol = 40,64 g FeCl2
Krok III
Odpowiedź: Należy odważyć 40,64 g FeCl2
5,000 g stałego wodorotlenku sodu rozpuszczono w 250 g wody uzyskując roztwór o gęstości 1,02 g/cm3. Oblicz stężenie molowe tego roztworu.
Dane:
mNaOH= 5,000 g
mwody = 250 g
d = 1,02 g/cm3
Szukane:
cm =?
Rozwiązanie:
Krok I
Jako, że obliczenie dotyczy stężenia molowego z pewnością trzeba obliczyć masę molową wodorotlenku sodu MNaOH = 40 g/mol
Krok II
Konieczna jest znajomość objętości roztworu, podczas gdy w zadaniu podano masę składników oraz gęstość. Tak więc V= mr/d
V = (5 g NaOH + 250 g H2O)/ 1,02 g/cm3 =250 cm3 = 0,25 dm3
Krok III
Mamy wszystkie dane niezbędne do obliczenia stężenia molowego roztworu wodorotlenku sodu 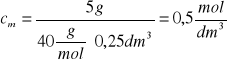
Krok IV
Odpowiedź: roztwór wodorotlenku sodu jest 0,5 molowy
1,92 mola chlorku amonu rozpuszczono w 1 kg wody. Obliczyć stężenie molowe otrzymanego roztworu o gęstości 1,028 g/cm3
Dane:
nchlorku amonu = 1,92
mwody = 1 kg
d = 1,028 g/cm3
Szukane:
cm = ?
Rozwiązanie:
Krok I
Obliczamy masę molową NH4Cl M = 53,5 g/mol
Krok II
Dla obliczenia objętości roztworu, mając daną gęstość, niezbędne jest poznanie jego masy (mr)
mr = 1000 g wody + 1,92 mol•53,3 g/mol chlorku amonu = 1102,34 g
Vr = 1102,34/1,028 = 1000 cm3 = 1 dm3
Krok III
Można zastosować podstawowy wzór, ponieważ w zadaniu podano ilość moli chlorku amonu tak więc: cm = n/V cm = 1,92 mol/dm3
Krok IV
Odpowiedź: Stężenie molowe roztworu chlorku amonu wynosi 1,92 mol/dm3
Ile gramów węglanu sodu znajduje się w 200 cm3 roztworu tej soli o stężeniu 0,5 mol/dm3
Dane:
Vr = 200 cm3 = 0,2 dm3
cm = 0,5 mol/dm3
Szukane:
ms = ?
Rozwiązanie:
Krok I
Obliczamy masę molową (M) węglanu sodu M = 106 g/mol
Krok II
Jako, że mamy wszystkie dane występujące we wzorze na stężenie molowe, wzór przekształcamy ze względu na masę substancji rozpuszczonej ms = V•M• cm =0,2dm3 •0,5 mol/dm3 • 106 g/mol = 10,6 g
Krok III
Odpowiedź: W podanej objętości roztworu znajduje się 10,6 g węglanu sodu
Ile moli kwasu siarkowego(VI) znajduje się w 150 cm3 roztworu o stężeniu 1,5 mol/dm3
Dane:
V = 150 cm3 = 0,15 dm3
cm = 1,5 mol/dm3
Szukane:
n = ?
Rozwiązanie:
Krok I
Jako, że w tym zadaniu nie mówi się o masie substancji rozpuszczonej nie jest konieczne stosowanie, a więc również obliczenie, masy molowej kwasu siarkowego. Skorzystamy z definicyjnego wzoru na stężenie molowe czyli cm= n/V. Tak więc ilość moli n = cm•V więc:
n = 1,5 mol/dm3•0,15 dm3 = 0,225 mol
Krok II
Odpowiedź: W roztworze znajduje się 0,225 mola kwasu siarkowego(VI)
W kolbie miarowej o pojemności 250 cm3 rozpuszczono 0,25 mola kwasu siarkowego i objętość dopełniono „do kreski” obliczyć stężenie molowe otrzymanego roztworu.
Dane:
V = 250 cm3 = 0,25 dm3
n = 0,25 mola
Szukane:
cm = ?
Rozwiązanie:
Krok I
Specyfiką tego prostego zadania jest przypomnienie, że roztwór o stężeniu molowym sporządza się dopełniając jego objętość do odpowiedniej wartości. W tym celu stosuje się tzw. kolby miarowe. Tak więc do obliczenia stosuje się wzór wyrażający definicją stężenia molowego cm = n/V
Cm = 0,25 mol/0,25 dm3 = 1 mol/dm3
Krok II
Odpowiedź: Roztwór kwasu siarkowego(VI) jest jednomolowy, lub inaczej ma stężenie równe 1 mol/dm3
W wodzie rozpuszczono 5,6 dm3 tlenku siarki(IV). Objętość roztworu dopełniono do 0,5 dm3. Oblicz stężenie molowe powstałego roztworu.
Dane:
Vtlenku siarki(IV) = 5,6 dm3
Vr-ru = 0,5 dm3
Szukane:
cm = ?
Rozwiązanie:
Krok I
Do roztworu wprowadzono co prawda tlenek siarki(IV), lecz powinieneś wiedzieć, że będzie on reagował z wodą dając kwas siarkowy(IV). Tak więc mówiąc ogólnie o stężeniu molowym roztworu, chodzi o stężenie kwasu siarkowego(IV).
Z równania reakcji: SO2 + H2O = H2SO3 wynika, że skoro
Z 1 mola czyli 22,4 dm3 SO2 powstaje 1 mol H2SO3
5,6 dm3 SO2 powstaje n moli H2SO3 n=0,25
Krok II
Znając objętość roztworu oraz ilość moli substancji rozpuszczonej można obliczyć stężenie molowe ze wzoru cm = n/V
cm = 0,25 mol/0,5 dm3 = 0,5 mol/dm3
Krok III
Odpowiedź: W wyniku rozpuszczenia dwutlenki siarki w wodzie otrzymano roztwór kwasu siarkowego(IV) o stężeniu 0,5 mol/dm3
Odparowano do sucha 100 cm3 roztworu chlorku sodu o stężeniu 0,1 mol/dm3. Ile gramów ważył osad po odparowaniu ?
Dane:
Vr-ru= 100 cm3 = 0,1 dm3
cm = 0,1 mol/dm3
Szukane:
ms = ?
Rozwiązanie:
Krok I
Po uważnym przeczytaniu zadania wiemy, że osad będzie stanowił chlorek sodu, czyli substancja rozpuszczona w tym roztworze. Musimy więc obliczyć masę molową (M) chlorku sodu MNaCl = 58,5 g/mol
Krok II
W zadaniu chodzi więc o obliczenie ilości substancji rozpuszczonej w 0,1 dm3 roztworu o stężeniu 0,1 mol/dm3. Tak więc:
ms = MNaCl•cm•V =58,5 g/mol•0,1mol/dm3•0,1 dm3 =0,585 g NaCl
Krok III
Po odparowaniu roztworu pozosytanie 0,585 g osadu, którym jest chlorek sodu
Jeden z roztworów HCl zawiera w 0,5 dm3 3•1023 cząsteczek chlorowodoru a drugi w takiej samej objętości zawiera 18,25 g chlorowodoru. Który z roztworów ma większe stężenie molowe ?
Dane:
Vr-ru = 0,5 dm3
nHCl = 3•1023 cząsteczek
mHCl = 18,25 g
Szukane:
Porównać stężenia molowe obydwu roztworów
Rozwiązanie:
Krok I
Należy sobie uświadomić, że skoro mamy identyczne objętości roztworów, wystarczy obliczyć, w którym z nich jest większa ilość moli chlorowodoru.
Krok II - obliczamy ilości moli
a) roztwór I 1 mol zawiera 6,02•1023
n1 moli zawiera 3 •1023 n1 = 0,5 mola
b) roztwór II 1 mol HCl ma masę 36,5 g (masa molowa HCl)
n2 moli HCl ma masę 18,25 g n2 = 0,5 mola
Krok III
Odpowiedź: Z obliczeń wynika, ze roztwory te mają identyczne stężenia molowe
11. 647 cm3 roztworu kwasu siarkowego o nieznanym stężeniu zmieszano z wodą otrzymując 1,5 kg 55% roztworu. Oblicz stężenie molowe wyjściowego roztworu kwasu.
Dane:
Vr-ru = 647 cm3
mr = 1,5 kg
cp = 55%
Szukane:
cm = ?
Rozwiązanie:
Krok I
Mając masę oraz stężenie procentowe roztworu po rozcieńczeniu policzymy masę kwasu siarkowego
1500 g roztworu stanowi 100%
ms g stanowi 55% ms =825 g
Krok II
Do obliczenia stężenia molowego niezbędna jest znajomość masy molowe (M) kwasu siarkowego M = 98 g/mol
Krok III
Skoro znamy objętość roztworu (V), masę substancji (ms) rozpuszczonej oraz masę molową kwasu (M), można obliczyć stężenie molowe cm 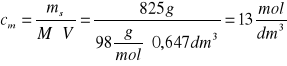
Uwaga: taka wartość stężenia molowego świadczy, że moc
ny kwas siarkowy jest bardzo słabo lotny i z tego powodu może wypierać z roztworów soli inne mocne kwasy jak np. kwas azotowy(V) czy też kwas solny.
1. W jakiej objętości roztworu o stężeniu 0,5 mol/dm3 znajduje się 2 mole substancji rozpuszczonej?
2. Oblicz masę molową substancji rozpuszczonej, wiedząc, że w 0,6 dm3 roztworu tej substancji o
stężeniu 0,2 mol/dm3, znajduje się 4,8 g tej substancji.
3. W 5,0 kg wody rozpuszczono 100 g wodorotlenku sodu. Zakładając, że objętość końcowego
roztworu wyniesie 5 dm3, oblicz jego stężenie molowe.
4. Oblicz stężenie molowe kwasu azotowego zawierającego 1,50 g czystego składnika 250 cm3
roztworu.
5. W 5,0 dm3 roztworu zasady potasowej o gęstości d = 1,15 g/cm3 znajduje się 182,5 g KOH. Oblicz
stężenie molowe i stężenie molalne tego roztworu. 6. Do 100,0 g siarczanu(VI) sodu wlano 950 cm3 wody uzyskując 1,00 dm3 roztworu. Oblicz stężenie
molowe oraz stężenie molalne tego roztworu.
7. Oblicz ile gramów NaOH zawiera 200 cm3 roztworu o stężeniu 0,245 mol·dm-3.
8. Ile gramów substancji rozpuszczonej zawiera 25 cm3 roztworu NH4NO3 o stężeniu
0,1 mol·dm-3?
9. Oblicz, w jakiej objętości roztworu NaCl o stężeniu 0,150 mol·dm-3 rozpuszczone jest 1,200 g
chlorku sodu?
10. Jaka jest masa molowa substancji, której 0,960 grama rozpuszczone jest w 200 cm3 roztworu o
stężeniu 0,120 mol·dm-3?
12
Wyszukiwarka
Podobne podstrony:
kontrola ekspresji genów, Licencjat, Semestr IV, biologia molekularna
genotypowanie gr 3 i 4, Licencjat, Semestr IV, biologia molekularna
KASPAZY, Licencjat, Semestr IV, biologia molekularna
Stezenie molowe-rozwiazania, Dla licealistów
Pedagogika Penitencjarna ZK, Studia Administracja, LICENCJAT, Semestr IV, POLITYKA KARNA I PENITENCJ
Metody Resocjalizacyjne, Studia Administracja, LICENCJAT, Semestr IV, POLITYKA KARNA I PENITENCJARNA
wykład IV biologia molekularna najwazniejsze o laminach
opracowanie skanow, Biotechnologia, Semestr III, Biologia molekularna
Ubezpieczenia T.Szumlicz l, WSFiZ - Finanse i rachunkowość (Warszawa ul. Pawia 55), Licencjat, Semes
Alkoholizm 1, Studia Administracja, LICENCJAT, Semestr IV, POLITYKA KARNA I PENITENCJARNA
Metody nauczania, Pedagogika- materiały, Studia Licencjackie, Semestr IV, Teoretyczne podstawy naucz
Notatki ostatni wykład, Licencjat, Semestr II, Biologia komórki
MAPC w leczeniu ran skóry, Licencjat, Semestr II, Biologia komórki
Motywy zabójstw, Studia Administracja, LICENCJAT, Semestr IV, POLITYKA KARNA I PENITENCJARNA
Podstawy bakteriologii 02 - konspekt, Licencjat, Semestr IV, mikrobiologia, Wykłady
Wykład Antybiotyki 02, Licencjat, Semestr IV, mikrobiologia, Wykłady
AIDS 02 - konspekt, Licencjat, Semestr IV, mikrobiologia, Wykłady
biolo molo 2, Biotechnologia, Semestr III, Biologia molekularna
więcej podobnych podstron