CO - tlenek węgla (II)
Najważniejszymi związkami chemicznymi węgla są jego połączenia z tlenem, czyli tlenek węgla (II) i tlenek węgla (IV), znany jako czad, powstaje podczas spalania węgla i jego związków przy ograniczonym dostępie tlenu:
2C + O2 → 2CO↑
Wadliwe działanie piecyków węglowych, gazowych, a także olejowych może być przyczyną niepełnego spalania użytego w nich paliwa i wydzielania trującego tlenku węgla (II). Fizjologiczne działanie tego związku polega na tym, że wiąże się on z hemoglobiną krwi, która staje się przez to niezdolna do przenoszenia tlenu. Stężenie CO w powietrzu wynoszące 0,3% objętościowych działa zabójczo na człowieka.
tlenek węgla(II) jest otrzymywany, na skalę przemysłową, w reakcji pary wodnej z rozżarzonym koksem, w wyniku czego powstaje tzw. Gaz wodny. (nosi on też nazwę „gaz syntezowy”, ponieważ stanowi surowiec do otrzymywania prostych związków organicznych.
C + H2O → CO↑+ H2↑
w laboratorium tlenek węgla(II) otrzymuje się odwadniając kwas mrówkowy (HCOOH) stężonym kwasem siarkowym (V).
CO jest gazem palnym, ponieważ węgiel ma w nim stopień utlenienia II i może go podwyższyć do IV.
CO2 - dwutlenek węgla
Produkt spalania tlenku węgla (II), czyli CO2 jest nam dobrze znany. Oto jego właściwości:
jest bezbarwnym i bezwonnym gazem, od gęstości większej od gęstości powietrza
rozpuszcza się w wodzie, tworząc słaby i nietrwały kwas węglowy
reaguje z zasadami tworząc węglany
jest niepalny i nie podtrzymuje palenia
może reagować z aktywnymi metalami, utleniając je.
tlenek węgla (IV) otrzymuje się:
w przemyśle przez rozkład termiczny węglanów, np. węglanu wapnia, w temperaturze ponad 800ºC
w laboratorium, działając mocnymi kwasami na węglany.
Tlenku węgla (IV) używa się m. in. do produkcji sody, otrzymywania napojów gazowanych, wypełniania niektórych typów gaśnic.
Zestalony CO2 nosi nazwę suchego lodu. Jest on używany w przemyśle chłodniczym, a także do uzyskiwania efektownych dymów np. podczas koncertów rockowych. (Suchy lód wrzucony do wody gwałtownie sublimuje i w strumieniach zimnego gazu kondensuje para wodna dając efektowny biały dym.) Mówiąc o korzyściach związanych z zastosowaniem CO2, nie należy zapominać również o jego szkodliwym wpływie na środowisko. Wzrost ilości tlenku węgla (IV) w atmosferze powoduje podniesienie średniej temperatury globu ziemskiego
CO2 występuje w atmosferze i hydrosferze, stanowi produkt przemiany materii (wydychany przez zwierzęta, asymilowany przez rośliny); powstaje w wyniku całkowitego spalania węgla lub rozkładu węglanów
Jak powstaje CO2 w wydychanym powietrzu?
Energia potrzebna nam, by się poruszać, pochodzi z egzotermicznych reakcji zachodzących w naszym ciele. Cały proces opiera się na cząsteczce glukozy, cukru będącego paliwem ludzkiego organizmu. Glukoza ”spala się” w mięśniach, by wydzielić energię - przypomina w tym inne paliwa, lecz proces przebiega w niskiej temperaturze. Łączy się ona z tlenem w egzotermicznej reakcji zwanej oddychaniem. Właśnie ciepło wydzielone w tej reakcji sprawia, że biegacz czuje gorąco. Ciało otrzymuje większość potrzebnej glukozy na drodze przemiany węglowodanów z pożywienia w wątrobie. Narząd ten albo wydziela glukozę bezpośrednio do krwi, albo magazynuje do czasu, kiedy jest potrzebna. Zawarty w glukozie węgiel łączy się w mięśniach z tlenem niesionym przez krew z płuc i powstaje dwutlenek węgla, który także wędruje do płuc, skąd jest wydychany.
Fotosynteza i węgiel
Węgiel krąży w ekosystemie Ziemi. Związkiem, który stanowi źródło węgla dla roślin, jest dwutlenek węgla. Rośliny pobierają go z atmosfery i w procesie fotosyntezy przetwarzają w struktury swoich komórek.
Dwutlenek węgla jest niezbędny w procesie oddychania roślin - fotosyntezy. W reakcji bierze udział po sześć cząsteczek wody i dwutlenku węgla, z których powstaje jedna cząsteczka glukozy i sześć cząsteczek tlenu.
Fotosynteza i oddychanie to dwa dopełniające się procesy - produkty uboczne jednego stanowią surowiec dla przebiegu drugiego z nich. Razem tworzą zazębiający się cykl, utrzymujący na stałym poziomie zawartość tlenu i dwutlenku węgla w atmosferze.
CO2 i efekt cieplarniany
Zawartość w atmosferze dwutlenku węgla i innych gazów odpowiedzialnych za „efekt cieplarniany” jest czynnikiem decydującym o klimacie. Gazy te są przezroczyste dla światła widzialnego, lecz absorbują podczerwień. Wskutek ich obecności energia, która normalnie zostałaby wypromieniowana z Ziemi w przestrzeń, pozostaje uwięziona w atmosferze, nadmiernie ją ocieplając. Uważa się, że Wenus jest tak gorąca właśnie w wyniku efektu cieplarnianego.
Efekt cieplarniany jest wielkim problemem naszych czasów. Każda jazda samochodem, każe zapalenie piecyka gazowego do dodanie CO2 do atmosfery. Spalając paliwa kopalne, ludzie są na dobrej drodze do wywołania nagłego ocieplenia atmosfery ziemskiej. Odpowiedź na pytanie: „Czy ocieplenie klimatu już się rozpoczęło?” - jest nadal kwestią sporną, lecz rozsądne wydaje się rozumowanie, że jeżeli nadal będziemy wypuszczać do atmosfery dwutlenek węgla i inne gazy, to w końcu ocieplenie nastąpi. Obecnie szacuje się, że w wyniku efektu cieplarnianego temperatura wzrośnie przeciętnie o kilka stopni Celsjusza, prawie o tyle, o ile wzrosła temperatura po ostatniej epoce lodowcowej. Znalezienie sposobu powstrzymania tego procesu jest dziś zadaniem priorytetowym o szczególnej wadze. Nie możemy zmienić termodynamiki atmosfery, więc podejmuje się wysiłki, aby zmniejszyć emisję CO2 i zapobiec niszczeniu lasów, które pochłaniają dwutlenek węgla, przetwarzając je w swoje tkanki.
Krzem i jego najważniejszy związek - SiO2
Pod względem rozpowszechnienia w skorupie ziemskiej, krzem zajmuje drugie miejsce po tlenie i stanowi aż 20% masy wszystkich pierwiastków. Wolny krzem otrzymuje się w wyniku redukcji tlenku SiO2, np. węglem:
SiO2 + C → Si + CO2
Krzem jest krystalicznym, szarym ciałem stałym, o metalicznym połysku. Najważniejsze zastosowanie zyskał krzem ze względu na właściwości półprzewodnikowe. Jest on podstawowym materiałem używanym w mikroelektronice, np. w produkcji komputerów.
Najbardziej rozpowszechnionym związkiem krzemu jest tlenek SiO2 nazywany krzemionką. Czysta krzemionka tworzy bogactwo form, od krystalicznego kwarcu (kryształu górskiego) po bezpostaciowy opal i agat. Jest także podstawowym składnikiem wielu skał, np. granitów i piasku.
Kryształy kwarcu cechuje bardzo ciekawa właściwość odkryta w końcu XIX w. Przez W. Roentgena. Polega ona na powstawaniu ładunków elektrycznych na powierzchniach kryształu, poddanego odkształceniu. Zjawisko to nazywamy efektem piezoelektrycznym. Przykładem jego zastosowania są zapalarki do gazu niewymagające baterii. W ostatnich latach gwałtownie rosną zastosowania metod ultradźwiękowych, np. w diagnostyce medycznej, przemyśle spożywczym. Źródłem ultradźwięków mogą być kryształy piezoelektryczne, które umieszczone w polu elektrycznym rozciągają się lub kurczą, w zależności od kierunku pola. Zmienne pole elektryczne wprawia je w drgania i w ten sposób stają się źródłem ultradźwięków.
Kwarc topi się w bardzo wysokiej temperaturze (od 1550 do 1725ºC, w zależności od odmiany), co dowodzi, że nie jest on utworzony z prostych cząsteczek SiO2, lecz ma złożoną strukturę krystaliczną. Występują w niej wiązania Si - O - Si, dzięki którym kryształ kwarcu stanowi jedną wielką cząsteczkę.
Czysta, stopiona krzemionka po ostudzeniu stanowi tzn. Szkło kwarcowe, z którego wykonuje się np. naczynia laboratoryjne. Takie szkło ma doskonałe właściwości termiczne, gdyż naczynie z niego wykonane, ogrzane do czerwoności można gwałtownie ostudzić, bez obawy jego pęknięcia.]
Ponadto kwarc przepuszcza promieniowanie ultrafioletowe, więc szkło kwarcowe stosuje się do wyrobu specjalnego typu lamp (zwanych kwarcówkami), które są używane np. w dermatologii i kosmetyce.
Tlenek krzemu (IV) reaguje z zasadami dając sole. Np. w reakcji krzemionki z zasadą sodową powstaje krzemian sodu:
SiO2 + 2NaOH → NaSiO3 + H2O
Farby w budownictwie
Farby odgrywają poważną rolę w wykańczaniu obiektów mieszkalnych i użyteczności publicznej. Służą one do malowania ścian oraz barwienia tynków.
Farby do malowania ścian sporządza się, mieszając barwny proszek zwany pigmentem z klejem i wodą. Klej spełnia funkcję lepiszcza uniemożliwiającego odpadanie i łuszczenie się pigmentu pokrywającego ścianę. Farbę nanosi się za pomocą pędzla lub natrysku. Po wyschnięciu farby pigment ścisłe przylega do powierzchni ściany. Do wytwarzania pigmentów stosowane są surowce mineralne bądź substancje z nich otrzymywane. Najtańszym białym pigmentem stosowanym w malarstwie ściennym jest kreda CaCO3. Stosunkowo drogim, ale o dużej zdolności kryjącej jest biel cynkowa ZnO. Biel cynkowa otrzymywana jest jako produkt uboczny przy produkcji cynku. Ciemnozielony pigment, zwany zielenią chromową uzyskuje się przez dokładne rozdrobnienie i roztarcie tlenku chromu (III) Cr2O3. Bardzo trwałym pigmentem o barwie błękitnej jest ultramaryna, bardzo odporna na światło. Otrzymywana jest z mieszaniny kaolinu, sody, siarki, krzemionki i węgla ogrzewanych w ciągu 20-50 dni do temperatury 700-800ºC. Jej przybliżony wzór: Na2Al2SiO24S2. Tlenek żelaza (III) Fe2O3 służy jako pigment barwy brązowej.
Tlenki i wodorotlenki żelaza, miedzi, chromu itp. Nadają zabarwienie wielu minerałom, a nawet kamieniom szlachetnym. Są one też stosowane jako barwniki do szkła i materiałów ceramicznych.
[Do barwienia szkła, używanego np. do wyrobu witraży, stosuje się tlenki metali, szczególnie żelaza, miedzi, chromu i uranu, a ponadto sole srebra, złoto, kobalt i mangan].
Co mają wspólnego tlenki ze szkłem?
Znane nam wszystkim szkło, jest mieszaniną krzemianów, którą można traktować jako stop tlenków, np. SiO2, Na2O i CaO. Poszczególne gatunki szkła różnią się zawartością i rodzajem tworzących je tlenków. Orientacyjny skład niektórych szkieł, wyrażony w procentach masowych, zamieszczono w tabeli.
rodzaj szkła |
S O2 |
N 2O |
K2O |
C O |
B O |
M O |
p o |
A 2O3 |
F 2O3 |
B2O3 |
A 2O3 |
Okienne |
71 |
16 |
- |
8 |
- |
3,3 |
- |
1,5 |
0,2 |
- |
- |
Butelkowe |
54,9-63,3 |
4,2-10,4 |
0,6-2,0 |
13,2-21,3 |
- |
- |
- |
4,7-10,1 |
1,3-4,4 |
- |
- |
Żarówkowe |
71 |
14 |
3 |
5 |
- |
3 |
3,5 |
0,3 |
0,2 |
- |
- |
Laboratoryjne, Jenajskie |
74,73 |
7,95 |
- |
1,15 |
3,37 |
- |
- |
5,40 |
- |
7,40 |
- |
Laboratoryjne, Pyrex |
80,5 |
4,4 |
0,2 |
0,4 |
- |
- |
- |
2,1 |
- |
11,9 |
0,5 |
Kryształowe |
56,2 |
0,6 |
12,1 |
- |
- |
- |
31,1 |
- |
- |
- |
- |
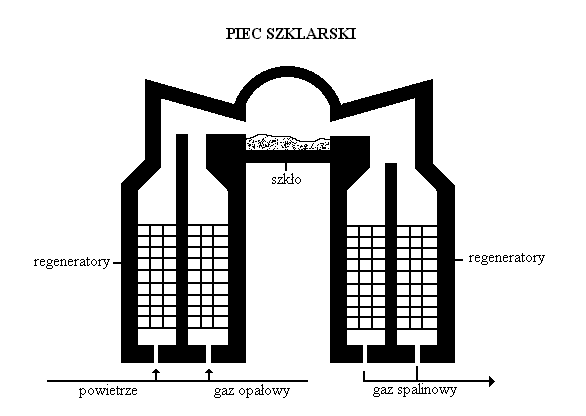
Szkło otrzymywane jest w hutach szkła. Podstawowymi surowcami do jego produkcji są: piasek kwarcytowy (szklarski), soda i wapień. Zmieloną mieszaninę surowców załadowuje się do wanny szklarskiej umieszczonej w piecu szklarskim. Piec szklarski ogrzewany jest gazami spalinowymi, powstałymi ze spalania gazu generatorowego. Powietrze oraz gaz przepuszcza się przez system nagrzanych do wysokiej temperatury kanałów. Dzięki temu unika się strat ciepła. Wychodzące z pieca gorące gazy spalinowe ogrzewają ochłodzone kanały. Jedne kanały ogrzewają napływające gazy, drugie są w tym czasie nagrzewane powstałymi spalinami.
Mieszanina składników umieszczona w wannie pieca szklarskiego ulega topnieniu, a jednocześnie zachodzą reakcje pomiędzy: sodą i krzemionką oraz wapieniem i krzemionką:
Na2CO3 + SiO2 → Na2SiO3 + CO2
CaCO3 + SiO2 → CaSiO3 + CO2
Powstała mieszanina krzemianu sodu i krzemianu wapnia z krzemionką tworzy szkło, którego zwór tlenkowy jest następujący: Na2O • CaO • 6SiO2.
Półpłynna masa szklana o znacznej lepkości wprowadzana jest na walcarkę tłoczącą szkło w postaci taśmy. Schłodzone powietrzem szkło cięte jest na tafle. Kafle szklane, przeznaczone dla budownictwa, wytłaczane są w formach za pomocą prasy.
W budownictwie stosowane jest także szkło zbrojone. Szkło takie wytwarza się z siatki stalowej, wypełniając ją masą szklaną.
Do izolacji rur centralnego ogrzewania stosowana jest wata szklana. Wytwarzanie waty szklanej zachodzi przy przetłaczaniu stopionej masy szklarskiej przez dysze z drobnymi otworami.
Tlenki azotu
Azot bardzo trudno łączy się z tlenem. Mimo to tworzy z nim wiele połączeń, w których przyjmuje stopnie utlenienia od I do V.
Tlenki azotu na niższych stopniach utlenienia są obojętne, nie reagują z wodą, kwasami, ani zasadami. Związki te na wyższych stopniach utlenienia: III, IV i V, reagują z wodą, tworząc kwasy, a z zasadami dają sole i wodę.
Tlenek azotu (I) został odkryty przez J Priestleya. Jest on bezbarwnym gazem, o słodkawym zapachu. Działa na organizm podniecająco i oszałamiająco, dlatego nadano mu nazwę gazu rozweselającego. Do niedawna N2O był używany jako środek znieczulający, podczas operacji chirurgicznych, obecnie stosuje się bezpieczniejsze od niego preparaty.
Tlenek azotu (II) jest bezbarwnym gazem, który bardzo łatwo utlenia się do brunatnego NO2.
Tlenek azotu (III) jest czerwonobrunatnym gazem, który łatwo ulega rozkładowi na tlenek azotu(II) i tlenek azotu (IV). N2O3 rozpuszcza się w wodzie, tworząc słaby i nietrwały kwas azotowy (III).
Tlenek azotu (IV) jest trującym gazem. W wysokiej temperaturze ma barwę brunatną, a podczas oziębiania staje się bezbarwny, gdyż tworzy cząsteczki N2O4.
Tlenek azotu (V) tworzy bezbarwne kryształy łatwo wiążące wodę. W reakcji z wodą tworzą kwas azotowy (V).
Zastosowanie niektórych tlenków (ogólnie)
dwutlenek azotu (I\/) NO2 - stosowany jako środek nitrujący, utleniający,
katalizator, utleniacz paliw rakietowych, itd. , jest półproduktem do wytwarzania kwasu azotowego.
tlenek chromowy Cr2O3 - jako zielona farba mineralna o dużej trwałości,
używany do barwienia na zielono szkła i glazury na porcelanie
tlenek krzemu SiO2 - drobnoziarnisty kwarc jest głównym składnikiem wielu
minerałów, m.in. opalu, chalcedonu i agatu. Dwutlenek krzemu (piasek) jest stosowany do produkcji szkła, szkła wodnego, zaprawy murarskiej, cementu, wyrobów ceramicznych, emalii, form odlewniczych i innych. Jest również surowcem do otrzymywania krzemu i jego stopów. Kwarc jest stosowany do wyrobu pryzmatów i soczewek w przyrządach optycznych. Piezoelektryczne własności kwarcu wykorzystuje się m.in. w radiotechnice.
tlenek siarki (VI) SO2 - największe ilości SO2 są zużywane do produkcji
kwasu siarkowego, poza tym znajduje zastosowanie do wybielania włókien, papieru, wełny i słomy, jako środek owadobójczy oraz jako konserwant win i soków owocowych (symbol E 220).
Tlenek wapnia CaO - [Zwany potocznie wapnem palonym jest stosowany
w budownictwie do otrzymywania zaprawy murarskiej, do produkcji cementu, a także do wyrobu szkła] stosowany do wyrobu zaprawy murarskiej, cementu, w leśnictwie jako środek owadobójczy, do wyrobu karbidu, w metalurgii jako dodatek szlakujący, w rolnictwie jako środek zmniejszający zakwaszenie gleby, w cukrownictwie (defekacja), w garbarstwie do odwłosienia skór, a także do oczyszczania gazów do zmydlania tłuszczów podczas produkcji stearyny i do wyrobu farb wapiennych.
tlenek węgla CO - służy do ogrzewania urządzeń przemysłowych
dwutlenek węgla CO2 - do produkcji suchego lodu
2Mg + O2 → 2MgO Dawniej reakcja magnezu była wykorzystywana
w lampach błyskowych, używanych przez fotografów. W wyniku tej reakcji (podczas której magnez spala się jasnym, oślepiającym płomieniem) powstaje tlenek magnezu.
Agat. Charakterystyczne dla agatów barwne wstęgi (zwane pierścieniami Lieseganga lub pierścieniami dyfuzyjnymi) powstają w wyniku rytmicznego wytrącania substancji chemicznych z roztworów przesycających skałę. Agaty używane były już w starożytności do wyrobu przedmiotów ozdobnych, m. in. gemm. Wytwarza się w nich również niektóre przyrządy laboratoryjne. Agaty występują zazwyczaj w postaci owalnych lub nieregularnych buł wśród skał wylewnych. Wydobywane są m. in. w Brazylii, Urugwaju, Ameryce Północnej; w Polsce znaczne ilości agatów występują na Dolnym Śląsku (gł. w górach Kaczawskich). Odmianą agatu jest onyks.
Agat o warstwie zewnętrznej i jądrze zbudowanym z karneolu. Najcenniejsze, krwistoczerwone odmiany karneolu pochodzą z Indii. W Polsce karneol wydobywany był w okolicach Wałbrzycha. Wykorzystywany jako kamień ozdobny. Zbliżoną do karneolu odmianą chalcedonu jest sard.
Opal biały. Opal jest substancją mineralną, zestalonym żelem krzemionkowym o zmiennej zawartości wody; zwykle bezbarwny lub biały, niekiedy różowy, żółty, czerwony (opal krwisty) lub zielony (prazopal). Tworzy skupienia naciekowe i naskorupienia. Wytrąca się z wód cieplic (np. gejzerów), powstaje także w wyniku procesów wietrzenia. Tworzy szkielety niektórych organizmów (okrzemek, promienic). Nietrwały, z biegiem czasu krystalizuje, tworząc chalcedon. Jest składnikiem niektórych skał osadowych (np. opok, gez); odmiany o efektownej grze barw (opalizacja) używane w jubilerstwie(opal szlachetny). Opale szlachetne używane były w jubilerstwie w starożytnej Grecji i Rzymie, a także na Dalekim Wschodzie. Obecnie wyrabia się z nich oczka do pierścieni i naszyjniki.
Bezbarwne kryształy kwarcu, tzw. kryształ górski. Kwarc tworzy również liczne grubo krystaliczne odmiany zabarwione: ametyst, cytryn, kwarc dymny (brunatny), morion (czarny). Zwykle bezbarwny, biały, szary lub brunatny; należy do najpospolitszych minerałów skałotwórczych. Jest ważnym składnikiem skał magmowych (np. granitów), a także metamorficznych (np. gnejsów, kwarcytów). Odporny na wietrzenie, gromadzi się w osadach: ziarna kwarcu są głównym składnikiem okruchowych skał osadowych (np. piasków i piaskowców). Kwarc skrytokrystaliczny (chalcedon), powstający w wyniku rekrystalizacji opalu, jest składnikiem gez i radiolarytów; tworzy także konkrecje (krzemienie). Żyły kwarcowe, często zawierające cenne minerały (np. złoto, rudy metali), są pospolitym produktem procesów hydrotermalnych. Kwarc jest surowcem przemysłu szklarskiego i ceramicznego; wykorzystywany także do wyrobu przyrządów optycznych, w metalurgii, w przemyśle chemicznym. Kwarc syntetyczny (tzw. Piezokwarc) używany jest do produkcji rezonatorów piezoelektrycznych. Kryształ górski używany jest od czasów starożytnych do wyrobu przedmiotów ozdobnych (np. biżuterii). W XVI - XVIII w. Powszechnie wykonywano z niego naczynia oprawne w srebro. Jako kamienie ozdobne często wykorzystywane są barwne odmiany kwarcu (np. ametyst, cytryn) i chalcedonu. Złoża kryształu górskiego eksploatowane są m. in. w Ameryce Północnej i Południowej, w Brazylii, Birmie, na Madagaskarze i na Uralu. W Polsce kwarc (także kryształ górski) wydobywany jest na Dolnym Śląsku; eksploatowane są również liczne złoża piasku kwarcowego.
O fatalnych skutkach oddziaływania CO na organizm ludzki niech świadczy tragedia, jaka rozegrała się zimą 1944 roku w okolicach Neapolu. Pociąg, nadmiernie obciążony pasażerami, wjechał do biegnącego w górę tunelu. Gdy koła zaczęły się ślizgać na oblodzonych szynach, maszynista zamiast wycofać pociąg, kazał palaczowi dorzucić węgla do kotła. Koła obracały się w prawdzie szybciej, ale parowóz nadal stał w miejscu. Przy ograniczonym dostępie tlenu, zaczęły wydzielać się wielkie ilości śmiertelnego tlenku węgla(II), który szybko rozpełzł się w wąskim tunelu. I tak w ciągu kilku minut zginęło 521 osób.
Substancje, z których powstają tkanki roślin, pobierane są zarówno z powietrza, jak i z gleby. Atomy węgla i tlenu, będące składnikami wszystkich tkanek roślin, pobierane są z powietrza w postaci CO2. Inne niezbędne pierwiastki, wśród których jest azot, fosfor, potas, siarka, wapń, magnez oraz pewna liczba pierwiastków śladowych, korzenie rośliny pobierają z gleby w postaci związków mineralnych. Roślina przetwarza te substancje nieorganiczne w związki organiczne, z których buduje swoje tkanki.
BĄBELKI
Nasycenie gazowanego napoju bąbelkami jest możliwe dlatego, że gazy pod ciśnieniem rozpuszczają się w cieczach. Dwutlenek węgla, gaz wytwarzający w wodzie bąbelki, jest wstrzykiwany do napoju pod ciśnieniem i pozostaje w stanie rozpuszczonym. Kiedy jednak otwieramy butelkę, ciśnienie spada, gaz nie może już pozostać w cieczy i w postaci bąbelków wydostaje się na zewnątrz.
W 1903 roku Ignacy Mościcki, późniejszy prezydent Rzeczypospolitej Polskiej, opracował przemysłową metodę bezpośredniej syntezy tlenku azotu (II) w łuku elektrycznym. Początkowa była ona jedynym przemysłowym sposobem otrzymywania NO. Dopiero zastosowanie katalitycznego utleniania amoniaku, wyparło metodę Mościckiego.
W 1980 roku udowodniono, że cząsteczki tlenku azotu (II) (NO) pełnią ważne funkcje w naszym organizmie. Wydawało się to dziwne, gdyż wcześniej znany był tylko negatywny wpływ tego gazu na organizm. Dzisiaj wiemy, że tlenek azotu (II) jest jednym z najważniejszych neuroprzekaźników, może regulować ciśnienie krwi poprzez rozluźnienie mięśni naczyniowych, spowalniać procesy odkładania cholesterolu na ściankach naczyń krwionośnych, a nawet hamować rozwój komórek nowotworowych.
Działanie leków nasercowych, takich jak nitrogliceryna, polega na podwyższeniu stężenia NO w organizmie, wskutek biologicznego rozpadu leku.
Fajerwerki to rozgrzane tlenki?
Pokazy sztucznych ogni mogą odbywać się dzięki łączeniu atomów w związek chemiczny. W najczęściej używanych typach fajerwerków jaskrawe, białe iskry to efekt spalania metalu magnezu, które wydziela olbrzymią ilość energii. Podczas tego procesu magnez łączy się z tlenem i powstaje tlenek magnezu, a nocne niebo rozświetlają cząsteczki ogrzane wydzieloną energią. Różne barwy ogni uzyskuje się spalając rozmaite metale.
2Mg + O2 → 2MgO
Wyszukiwarka
Podobne podstrony:
Reguly Cahna, Wydział Nauk o Żywności, chemia organiczna
Mechanizm reakcji wolnorodnikowego podstawienia WNoZ 2010, Wydział Nauk o Żywności, chemia organiczn
Treningi 1 28.02.2010, Wydział Nauk o Żywności, chemia organiczna
pytania zarządzanie, Wydział Nauk o Żywności, Zarządzanie Firmą
chemia kl pp chemia wokol nas
Fenole1, Technologia żywności UWM, CHEMIA ORGANICZNA
127d879b364443a7c898e032e415ed88, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia organ
CHEMIA ''Wpływ śkładników żywności na organizm''
octan cykloheksylu, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 4, Chemia orga
chemia 4, ^ Wydział Nauk o Ziemi UŚ Geografia ZGS, Chemia
Aminy teoria, Technologia żywności UWM, CHEMIA ORGANICZNA
acetanilid, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 4, Chemia organiczna
Chemia 1, ^ Wydział Nauk o Ziemi UŚ Geografia ZGS, Chemia
Chemia wokół nas
destylacja z para wodną sprawozdanie, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II,
AMINY, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia organiczna
Zestaw 4, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia organiczna
więcej podobnych podstron