1. I Zasada termodynamiki
W układzie odosobnionym tzn. osłoniętym osłoną adiabatyczną, ilość energii wewnętrznej układ jest stała Ed=ΔEu+Ew [J] ⇒ równ bilansu energetycznego można traktować jako I zasadę termodynamiki dot. Układu zamkniętego. Energia doprowadzona do układu wyodrębnionego osłoną adiabatyczną pozostaje częściowo w układzie a część jest wyprowadzona z układu. Interpretacja graficzna - wykr. Sankeya
Jeżeli układ działa w sposób ustalony (jego energi nie zmienia się w czasie lub zmienia się w sposób periodyczny i po skończonej liczbie cykli wraca do wart. Początkowych) to bilans energetyczny przyjmuje postać ![]()
ponieważ ![]()
to do czynnego silnika ![]()
że jest rzeczą niemożliwą skonstruowanie perpetum mobile pierwszego rodzaju (silnika pracującego bez zasilania energią z zewnątrz). ![]()
![]()
2. II Zasada termodynamiki
sformułowanie
Plancka. Jest rzeczą niemożliwą skonstr. takiego silnika (maszyny działającej periodycznie), którego działanie polegało by na podnoszeniu ciężarów i równoczesnym ochładzaniu jednego źródła ciepła. Silnik taki nosi nazwę perpetum mobile II rodzaju.
Clausjusa ciepło nie może przejść samorzutnie od ciała o temp niższej do ciała o temp wyższej. Aby spowodować taki przepływ ciepła musimy zastosować lewo bieżną maszynę cieplną i wkładać do niej energię z zewnątrz, tzn. wywoływać zmiany w innych ciałach.
Samorzutne przejście - zjawisko któremu nie towarzyszą żadne zmiany w otoczeniu (otoczenie nie oddziałuje na układ)
Schmidta - nie można całkowicie odwrócić przemiany, w której występuje tarcie. Pracę w całości można zmienić na ciepło przez tarcie, jednak z tego ciepła nie można w całości odzyskać pracy.
Ostwalda - perpetum mobile II rodzaju jest niemożliwe - DOWÓD
czyli cykl pracy silnika stąd ΔSPM II R=0 bo entropia jest wielkością stanu a stan w punkcie 1-2 jest sobie równy to Δ=0; π=ΔSPM II R+SŹR=0 - ![]()
; Q - ciepło tarcia
π > 0 sprzeczne z prawem wzrostu entropii
entropia układu zamkniętego i izolowanego nie może maleć podczas dowolnej przemiany i wzrastać przy przemianach nieodwracalnych.
3. Wielkości zastępcze dla roztworów gazowych
Oblicza się w ten sposób, że mnoży się wielkości indywidualne przez udziały i sumuje się tak obliczone iloczyny.
udziały gramowe - jeżeli jednostka danej wielkości zawiera w mianowniku kg np. R
udziały molowe (objętościowe) jeżeli jednostka danej wielkości zawiera w mianowniku kmol np. M [kg/kmol]
objętościowe - jeżeli m3 lub mm3
Stałą gazową R obliczamy ![]()
![]()
Masę drobinową M obliczamy ![]()
![]()
między udz mol zi i gram gi składnika roztworu zachodzi zależność ![]()
![]()
4. Entalpia - sposób obliczania
ciała stałe i ciecze i=u+pv, gdzie v - obj. właść., p - bezwzględne ciśnienie statyczne, u - właściwa energia wewnętrzna
gaz doskonały (funkcja tylko temp, nie zależy od ciśnienia i objętości) i=cpT+uo, gdzie cp - ciepło wł. przy stałym ciśnieniu, T - temp, uo - energia otoczenia
gaz półdoskonały (funkcja tylko temp)
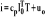
; gdzie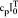
- średnie ciepło właściwe od 0 doT, T - temppara nasycona mokra i=i`+x(i``-i`), gdzie i - entalpia pary nasyc. mokrej, i` - entalpia cieczy, i`` - ilość pary suchej nasyconej, x - stopień wilgotności
para przegrzana i=i``qp, gdzie qp - ciepło przegrzania pary
para mokra nasycona i=q+r+pr, gdzie r - entalpia parowania
5. Przejmowanie
jest to wymiana ciepła pomiędzy powierzchnią ciała stałego a otaczającym ją płynem
z prawa Newtona Q=A-α(tf-tw)τ, gdzie tw - temp pow ciała stałego, tf - temp opływającego płynu, α - współczynnik, τ - czas, A - powierzchnia
α - ozn. ilość wymienionego podczas przejmowania przez jednostkę powierzchni w ciągu jednostki czasu
Przewodzenie - polega na przenoszeniu ciepła w obrębie danego ciała od jednych drobin do drugich, odbywa się tylko gdy drobiny ciała nie podlegają przesunięciom makroskopowym. Warunek spełniony podczas przepływu ciepła przez ciała stałe Prawo Fouriera![]()
, gdzie λ - wsp. przewodz. materiału, ![]()
- grzdient temp. A - pole pow
6. Sposoby przekazywania ciepła
przewodzenie ciepła - przenoszenie ciepła w obrębie danego ciała od jednych drobin do drugich lub przez dyfuzję
konwekcja - (unoszenie ciepła) ciepło płynie z cząsteczkami płynu od ściany przegrody do rdzenia strumienia lub odwrotnie
promieniowanie - ciepło przenosi się od jednego ciała do drugiego w postaci energii promienistej (za pośrednictwem fal elektromagnet)
7 Sposoby doprowadzania energii
na sposób ciepła - wtedy gdy istnieje różnica temp między ciałem a otoczeniem
na sposób pracy - wtedy gdy między układem a otoczeniem jest oddziaływanie różnego rodzaju sił
I - p1>po - praca na rzecz otoczenia + Lw>0
II - p1<po - otoczenie na rzecz układu - Ld<0
ze strumieniem ciepła - wtedy gdy np. mamy zbiornik i:
substancję doprowadzamy Md
substancję wyprowadzamy Mw
przypadki
za pomocą prądu elektrycznego
8. Praca bezwzględna
Jest to praca wykonana przez czynnik termodynamiczny wtedy gdy ciśnienie otoczenia jest równe zero. Pracę tę można obliczyć rozpatrując układ cylinder - tłok
Przy ∞ małym dx czynnik wykonuje pracę dl=kdx, gdzie k - siła, dx droga. Przy pracy bez tarcia siłę k równoważy ciśnienie działające na tłok. Stąd: k=pA, gdzie p - ciśnienie, A- przekrój, dl=p A dx ⇒ dl=p dv
p - bezwzględne ciśnienie statyczne wewn. cylindra
dv - przyrost objętości w cylindrze
Praca bezwzględna ![]()
; interpr. graficzna (założenie - znam zależność p od v)
L1-2 - zależy od drogi przemiany a nie tylko od stanu początkowego i końcowego
L1-2 - dotyczy przemian zachodzących bez strat na rzecz tarcia (wtedy dl <pdv)
Zastosowanie: w układach otwartych i zamkniętych, pseudoodwr. dl = p dv - dlt = p dv - dQf stąd dl < p dv
dlt - praca na rzecz tarcia, dQf - ciepło na rzecz tarcia
9. Sens fizyczny pracy technicznej
Pracę fizyczną rozpatrujemy wg idealnej maszyny przepływowej tzn.
nie występuje tarcie poruszających się względem siebie powierzchni
zawory nie stawiają oporu
w wewnętrznym zwrotnym położeniu tłok dotyka cylindra
Praca techniczna element. dLt = -Vdp, Lt>0 gdy dp<0
Praca skończona Lt 1-2 = ![]()
dLt>0 gdy dp<0; dLt<0 gdy dp>0
10. Obieg Diesla
Jest obiegiem porównawczym, silników o zapłonie samoczynnym i wtryskiem paliwa za pomocą sprężonego powietrza. Jest to układ otwarty.
Sprawność techniczna
![]()
; ![]()
![]()
kompresja![]()
; st. obciążeni![]()
Stąd sprawność maleje ze wzrostem obciążenia
11. Obieg Otto. Obieg porównawczy silnika z ZI
z![]()
Lo=Qd-Qw; ![]()
![]()
; ![]()
![]()
; ![]()
; ![]()
12. Stopień suchości pary nasyconej mokrej
x - jest to parametr, który stanowi zawartość pary nasyconej suchej do całkowitej ilości pary mokrej
![]()
dla cieczy w punkcie pęcherzyków x = 0
dla pary w punkcie rosy x = 1
13. Wymienniki ciepła
Zadaniem ich jest umożliwienie przenikania ciepła z 1 ośrodka do 2. Zależnie od kierunków przepływu obu czynników mówi się o przepływie współprądowym, przeciwprądowym lub poprzecznoprądowym.
współpr. - przepływ w którym kierunki przepływu obu czynników są zgodne
przeciwpr. - ... są skierowane przeciwnie
poprzecznopr. - ...są do siebie prostopadłe
Wartość różnicy temp określana jest równaniem ![]()
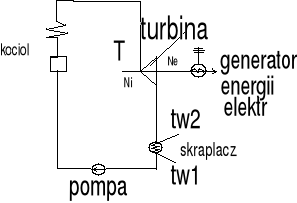
Wnioski: Przy współprądzie temp końcowa płynu ogrzewanego jest niższa od końcowej temp płynu ogrzewającego. Przy przeciwprądzie końcowa temp płynu ogrzewanego może być znacznie wyższa i w pewnych przypadkach może zbliżyć się do temp początkowej płynu ogrzewającego. Przykład: Kocioł parowy, skraplacz, podgrzewacz,
14. Co to jest entalpia
To wielkość termodynamiczna określająca stan termodynamiczny układu i równa jest sumie energii wewnętrznej U układu oraz iloczynowi jego objętości i ciśnienia. Zmiana entalpii przy stałym ciśnieniu jest miarą ilości ciepła wymienionego przez układ z otoczeniem. I - entalpia, U - energia wewnętrzna, p - ciśnienie statyczne bezwzgl., V - objętość całkowita ciała. I = U + p V. Entalpia jest funkcją tych samych parametrów stanu co energia wewnętrzna.
15. Co to jest strumień czynnika termodynamicz.?
Obliczamy za pomocą średniej prędkości przepływu. Jeżeli na przykład przewodem rurowym o przekroju F [m2] płynie strumień z szybkością ω [m/s] to wzór na strumień objętości wygląda ![]()
Strumień substancji ![]()
[kg/s] oblicza się mnożąc objętość przez gęstość substancji ![]()
gdy ![]()
= idem to jest to warunek ciągłości strugi.
16. Gaz doskonały i półdoskonały
gaz doskonały - gaz którego drobiny nie przyciągają się wzajemnie, są nieskończenie małe i sztywne (wewnątrz drobin nie występują drgania).Spełnia on:
- prawo Awogadra - w jednakowych objętościach znajduje się ta sama ilość cząstek dowolnego gazu doskonałego, jeżeli ciśnienie i temp obu gazów są jednakowe.![]()
- równanie stanu - f(p,V,T) =0, gdy znam 2 parametry gazu to mogę obliczyć 3
- równanie stanu gazu doskonałego (Clapeyrona) pV=RT
- ciepło właściwe ![]()
; cp>cv; ![]()
; cp-cv=R
- zasada ekwipartycji - energia rozkłada się równomiernie na wszystkie możliwe ruchy cząstek
Gaz półdosk. różni się od gazu doskonałego tym że w jego drobinach występują drgania. Atomy wchodzące w skład gazów są powiązane ze sobą sprężyście
17. Co to jest strumień ciepła?
Stosunek elementarnej ilości ciepła dQ do czasu dτ trwania wymiany tej ilości ciepła ![]()
,wzór osiąga postać ![]()
przy ustalonej wymianie ciepła
18. Bilans wymiennika ciepła
Wymiennik przeponowy to urządzenie jest przekazywanie ciepła między 2 czynnikami oddzielonymi przegrodą
bilans wewnątrz ścianki kanału grzejącego
osłona na zewnątrz wymiennika
![]()
19 Co to jest entropia
Jest to funkcja stanu termodynamicznego, której zmiana równa się ilorazowi dostarczonego ciepłą i temperatury ![]()
; S - entropia całkowita
![]()
; s - entropia właściwa w odniesieniu do 1kg czynnika; dla źródła ΔS = - ![]()
źródło oddaje energię więc przyrost entropii jest ujemny. Entropia mówi nam o kierunku przemian zachodzących w przyrodzie.
20. Prawo wzrostu entropii
Jeżeli układ jest jak na rys. i założenie: do tłok + cylinder możemy doprowadzić ciepło Q ze źródła ciepłą, przy czym Q = idem. Do cylindra mogę doprowadzić substancję o ilości dm i entropii właściwej s.
Wyróżniamy dwa przypadki:
I przemiana odwracalna
Tcz = Tźr ; b) brak tarcia dQt = 0
przyrost entropii układu odosobnionego Δs = π, natomiast elementarny przyrost ozn. dπ = ds.u+dsot
![]()
- przyrost entropii układu
![]()
- przyrost entropii otoczenia
![]()
![]()
Wniosek: W układzie odosobnionym sumą przyrostów entropii wszystkich ciał uczestniczących w zjawisku odwracalnym jest = 0. Warunek ten jest spełniony nawet w najmniejszej części zjawiska.
II przemiana nieodwracalna tzn. tźr≠tcz
21. Co to jest spalanie niezupełne i niecałkowite
niecałkowite - to spalanie kiedy produkty spalania zawierają stałe składniki palne. Jednym stałym składnikiem jest C.
niezupełne - gdy w produktach spalania występują palne gazy (CO, H2, CH4). Jeżeli do paliwa doprowadzi się za mało powietrza bądź nie wystąpi jego dokładne wymieszanie to spalanie nie będzie zupełne i w spalinach pojawią się produkty niezupełnego spalania. Najbardziej istotne znaczenie ma CO co połączone jest ze znaczną stratą.
22. Rodzaje konwekcji
Konwekcja - przenoszenie energii przez przepływ drobin i mieszanie się strugi o różnej temp. Występuje tylko w cieczach i gazach.
a) konwekcja wymuszona - występuje gdy prędkość przepływu strugi płynu może wynikać z działania sił zewnętrznych (działanie pompy). Wymiana ciepła przy konwekcji wymuszonej zależy od rodzaju ruchu:
laminarny Re<Rekr =2300
burzliwy Re >10000
Rkr<Re<104 (ruch przejściowy, ob. inne zależ)
b) Konwekcja swobodna - występuje wtedy gdy ruch płynu powstaje samoczynnie na skutek działania sił wyporu. K. s. najczęściej nakłada się na konw. wymuszoną, bo siły wyporu powstają zawsze zawsze gdy gęstość ciężaru płynu jest inna w warstwie przyściennej niż w rdzeniu strugi
23. Termiczne równanie czynnika termodynamicznego
Pośród termicznych parametrów stanu czynnika tylko dwa mogą zmieniać się niezależnie, natomiast trzeci jest określony przez pozostałe. Zależność F(p, T, V) nazywamy termicznym równaniem stanu które obowiązuje zawsze w przyrodzie, podaje się je jako wzór, zależność między parametrami lub podaje w postaci tablic.
24. Opisać efekty energetyczne obiegu silnika cieplnego, ziębiarki, pompy grzejnej
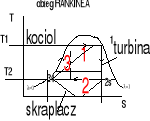
Silnik - pobiera ciepło Qd ze źródła ciepła o temp T1, wykonuje dodatnią pracę i oddaje ciepło Qw do źródła o temp T2<T1. Sprawność techniczna silnika jest to stosunek pracy wykonanej przez silnik do ciepła pochłoniętego przez czynnik obiegowy. Lob.=Qd-Qw
![]()
; ![]()
Pompa grzejna - pobiera ciepło Qd z otoczenia, pobiera pracę napędową, oddaje ciepło Qw do źródła o temp wyższej od temp otoczenia. Sprawność to stosunek ciepła Qw oddawanego do ogrzewanej przestrzeni do pracy napędowej. Lob.=Qw-Qd
![]()
; ![]()
Ziębiarka - pobiera ciepło Qd ze źródła o temp niższej od temp otoczenia, pobiera pracę Lob. i oddaje ciepło Qw do źródła o temp wyższej od temp otoczenia. Sprawność to stosunek ciepła Qd pobranego do pracypobranej
25,Co to jest skojarzona gospodarka cieplna.
Do ogrzewania pomieszczeń wystarczy czynnik termodyn o temp 800C , w wielu zaś procesach przemysłowych potrzebny jest czynnik o temp 150-2000C , taki czynnik a nawet o temp znacznie wyższej można uzyskać w kotłach parowych. Stosowanie jednak takiego czynnika do ogrzewania pomieszczeń powoduje znaczne dodatkowe straty energii Unikniemy tego dzięki temu że parę o wysokich parametrach skieruje się do turbiny przeciwprężnej w której pary wylotowe mają parametry dogodne do celów ogrzewczych i jest wykorzystana do pracy. W ten sposób realizujemy tzw skojarzoną gospodarkę cieplną. Która polega na równoczesnym wykorzystaniu pracy (energii elektrycznej) i ciepła grzejnego doprowadzonego do mieszkań Zakład pracujący w tn sposób nazywa się elektrociepłownią.
26.Jak oblicza się oszczędność energii uzyskanej w skojarzonej gospodarce cieplnej.
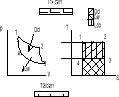
Sprawność termiczna elektrowni ηt el jest to stosunek wytworzonej mocy elektrycznej do enertgi chemicznej spalonego paliwa ηt el=Nel/(p Wd) Max straty energi występują w kotle parowym 50%-60% spalonego paliwa.
27 obieg Braytona.
28. Wady i zalety siłowni turbogazowych.
ZALETY:
możliwość dobrania najdogodniejszego czynnika chłodzącego
można zmniejszyć rozmiary agregatu poprzez zastosowanie podwyższonych ciśnień
umożliwia regulację mocy silniki przez zmianę gęstości czynnika obiegowego
ma górną moc graniczną agregatu > niż w przypadku układu otwartego
mogą pracować bez używania wody
WADY
konieczność stosowania 2 wymienników ciepła , zwłaszcza nagrzewnicy narażonej na wysokie temp
konieczność stosowania sprężarek duże części energii (aby uzyskać 10 MW musza mieć turbinę 40 Mw gdyż 30 MW na sprężarkę.
29 Zasada zachowania energii
Energia nie może zniknąć nie może powstać z niczego , lecz może przejść z jednej postaci w drugą i ilość jej nie może ulec zmianie w układzie zamkniętym i izolowanym układ jest niezmienny niezależnie od zmian zachodzących w układzie.ΣE=0
30.Co to jest energia wewnętrzna
Energia wewnętrzna U jest to całkowia energia odniesiona do układu osi współrzędnych mających początek w środku masy ukł i umieszczonych tak że energia ruchu obrotowego =0. Z enrgi układu Eu można wyróznić energię potencjalną Ep + energię kinetyczna Ek + energię wewnętrzną U
Eu=Ek+Ep+U
Głównymi składnikami U są:
Jest to parametr stanu gdyż zależy od stanu czynnika. Zawiera w sobie różne rodzaje energii chem, sprężystą itd.
Energia wewn właściwa u=U/m (intensywny parametr)
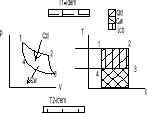
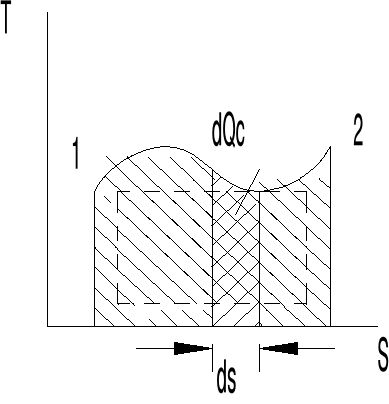
31.Przedstawić całkowite ciepło pochłonięte przez czynnik termodynamiczny w ukł T-S
![]()
Całkowite ciepło które zostało pochłonięte przez czynnik można obliczyć za pomocą wzoru
Qc1-2=![]()
Jnterpretacja graficzna : ciepło pochłonięte w czasie przemiany odpowiada pole zawarte nad linią przemianową 1-2 i osią
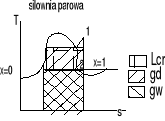
32 Siłownia parowa
To przede wszystkim turbiny parowe Tłokowe silniki
W których (para jest sprężona do niskiego ciśnienia w dyszy i uzyskuje Ek Strumień pary o dużej prędkości skierowany do kanałów łopadkowych wirnika i przepływa powodując obrót wirnika i wykonuje pracę)
Silnik parowy pracuje w układzie zamkniętym z innymi urządzeniami tworząc tzw siłownie. W siłowni nie można zrealizować obiegu Carnota.
3-4 tzw sprężenie wody z ciśnienia za skraplacza do ciśnienia w kotle
Ciecz podgrzewana izobarycznie w kotle do temp wrzenia powstają pęcherzyki pary i dalsze podgrzewanie do odparowania cieczy. Proces odparowania to proces izobaryczno izotermiczny do stanu pary nasyconej suchej w turbinie w punkcie 1 Następnie para przepływa do turbiny i rozpręża się w niej izentropowo do punktu 2 Następnie rozprężona para trafia do skraplacza w którym przepływająca woda powoduje skroplenie pary w przemianie izobarycznej 2s-34.
Jm wyższa temp dolotu i niższa temp wylotu to sprawność rośnie
Obieg pary przegrzanej kondensacyjnie
ηtCR=lCR/gd
Zpary nasyconej suchej w przegrzewacza pary i izobary temp rośnie w/g właściwości konstrukcyjnych elementu.
ηtCR= lepsze :- rośnie temp i ciśnienie
odtwarzanie obiegu Carnota
stopniowanie turbiny
rozsunięcie T
obniżenie ciśnienia końcowego rozpręzania zależność od wody chłodzącej skraplak tw1)
33. Obieg Carnota obieg o max sprawności
1-2 izotermiczna ekspansja następuje pobór ciepła
2-3 izentropowa ekspansja
3-4 kompresja izotermiczna następuje oddanie ciepła
4-1 kompresja izentropowa
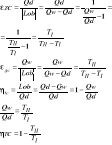
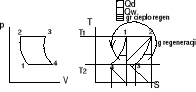
34. Uogólniony obieg Carnota
Dotyczy siłowni parowych - zamiast przemian izentropowych zastosowano dwie dowolne przemiany
Równoległe do siebie. Regeneracja ciepła polega na przekazaniu ciepła między dwoma strumieniami ciepła tego samego czynnika
ηte=1-(qk/gc)
35 Co to jest bilans energetyczny
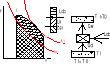
Wypływa z zasady zachowania energii Ed=ΔEu+Ew[J] dla strumienia wszędzie jest kropka i[J/s].Energia częściowo doprowadzona do układu Ed jest częściowo zużyta na zmianę energii układu ΔEu oraz częściowo jest wyprowadzona. Ew.Zas zach energii wynika z obserwacji zjawisk zachodzących w przyrodzie i doświadczeń
Energia nie może zniknąć nie może powstać z niczego , lecz może przejść z jednej postaci w drugą i ilość jej nie może ulec zmianie w układzie zamkniętym i izolowanym układ jest niezmienny niezależnie od zmian zachodzących w układzie.ΣE=0
36 Wyjaśnij dlaczego praca i ciepło nie mogą być traktowane za postaci energii
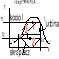
Praca i ciepło nie są postaciami energii mimo Ze ich ilość mierzy się tymi samymi metodami jednostkami co ilość energii. Energia jest bowiem własnością materii jest funkcją stanu układu. Praca i ciepło przestają istnieć w chwili zakończenia zjawiska- wykonania pracy czy przepływu ciepła. Pozostaje po nich tylko skutek tych zjawisk.
37 Jak określa się skład chem paliw
Skład chem paliw stałych określa się za pom udziałów gramowych oznaczonych małymi literami:c,h,s
Paliwo składa się z substancji palnej i balastu (w paliwach stałych i ciekłych - popiół i wilgoć a w gazowych CO2 oraz para)
a) paliwa gazowe -za pomocą udziałów molowych (objętościowych)poszcególnych składników.Udział molowy składnika w suchym gazie palnym oznacza się wprost jego symbolem chem sumą tych udziałów jest 1
Przy spalaniu paliw gazowych za jednostkę ilości substancji przyjmuje się 1 kmol suchego gazu palnego
b) stałe i ciekłe paliwa - udziały gramowe oznaczając małymi literami alfabetu. Jednostką ilości paliwa stałego lub cieklego jest 1kg paliwa wilgotnego. Ilość substancji poszczególnych składników w jednostce substancji paliwa wyrażają wzory
n`c+s=c/12+s/32 kmol(c+s)/kgpal
Skład paliwa ciekłego i stałego jest sumą udziałów gramowych = 1.Określamy 1 min zapotrzebowania na tlen O
Nmin=c/12+h/4+s/32-0/32 [(kmolO2)/(kgpal)]
2 Min powietrza nlpow=nsmin/0.21 [kmol pow/kgpal]
zawsze dajemy więcej nlpow
λ=rzeczywista ilość pow(n`l)/teoretyczna ilość pow(n`lmin)
Wartość opałowa Wd[J/kg]ilość ciepła doprowadzona z komory spalin po zupełnym i całkowitym spaleniu jednostki paliwa jeżeli spalenie odbyło się pod stałym ciśnieniem spaliny zaś zostały ochłodzone do temp początkowej substratów przy czym para wodna zawarta w spalinach nie uległa skropleniu.
Ciepło spalania[Wg]- ilość ciepła doprowadzona z komory spalin po zupełnym i całkowitym spaleniu jednostki paliwa jeżeli spalenie odbyło się pod stałym ciśnieniem spaliny zaś zostały ochłodzone do temp początkowej substratów przy czym para wodna zawarta w spalinach uległa skropleniu.
Wd=Wg-m``H2O*rH2O r- ciepło skraplania pary
38. Jaką przemianę nazywamy obiegiem termod.
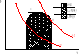
Obieg termodynamiczny jest to przemiana w której stan końcowy czynnika jest identyczny z początkowym. Wykresem (obrazem obiegu) jest krzywa zamknięta . W każdym wykresie możemy określić 4 charakterystyczne punkty
dwa punkty zwrotne I II i dzielą one krzywą na linię ekspansji i kompresji
dwa punkty adiabatyczne i i dzielą one krzywe na części podczas której czynnik pochłania ciepło i część podczas której oddaje ciepło.
Ciepło dostarczane pobrane przez czynnik z zewnątrz w czasie obiegu ozn Qd, zaś oddawane Qw sa one > 0.
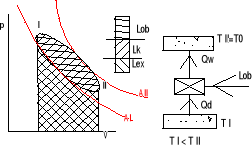
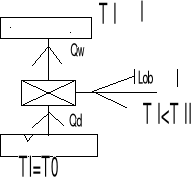
39. Co to jest obieg prawo i lewo bieżny
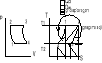
obieg prawobieżny - jest obiegiem silnika
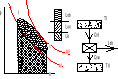
Qd > Qw
Założenie T I > T II
Silnik pobiera ciepło Qd ze źródła o temp wyższej , wykonuje pracę i oddaje ciepło Qw do (otoczenia ) o temp niższej Sprawność termiczna silnika
![]()
obieg lewobieżny - jest to obieg ziębiarki lub pompy grzejnej
sprawność termiczna ogólnie
lewobnieżny
Qw > Qd
ηt=efekt użyteczny urządzenia/Qd
Chłodnica pobiera ciepło Qd o temp niższej niż temp otoczenia T II otrzymuje pracę /Lob/ i oddaje ciepło Qw do źródła o temperaturze wyższej(otoczeniu)
Lob=Qw-Qd
Sprawność ziębiatrki![]()
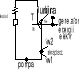
Spraw termiczna![]()
Pompa grzejna pobiera ciepło z otoczenia Qd otrzymuje pracę i dostarcza ciepło Qw do żródeł o temperaturze wyższej od temp otoczenia
Obiegi odwracalne składają się tylko z przemian odwracalnych . Równanie bilansu (czy obieg jest czy nie jest odwracalny ) ma postać Qd-Qw=Lob
40. Definicje Clausiusa, Plancka, Smitcha, Ostwalda, Entropia
Patrz punkt drugi
41. Prawa dla gazu doskonałego
Boylea Mariottea
Jeżeli w τ=idem to p*V=idem
GayLussaca- Charlesa
Jeżeli p= idem to objętość właściwa to objętość właściwa V=V0(1+Tα);V/T=idem
V0-obj.wł gazu w temp 00C
α-termiczny wsp rozszerzalności objętości gazu odniesiony do obj V0 jest ustalony eksperymentalnie (1/273,15) *(1/K)
Założymy że t=idem
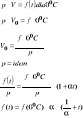
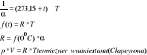
p-stałe ciśnienie bezwzgl [N/m2]
V- objętość właściwa [m3/kg]
R-indywidualna stała gazowa [Nm/kgK]
T-temp benzyny
Awogadra liczba drobin zawartych w jednakowej objętości różnych gazów doskonałych w tych samych warunkach termicznych (temp i ciśnienie gazów jest takie same)
(MR) jedn indywidualnej stałej gazowej 8314 [J/kmolK]
R=(MR)/M
M1*R1= M2*R2= M*R
P*V=R*T⇒p(MV)=MR*T
P*V=m*R*T⇒p*V=n(MR)*T
MV;(MR)≡(B)nie zależy od rodzaju gazu
n,m- masy
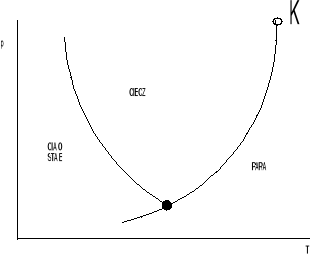
42. Co to jest punkt krytyczny i potrójny
Jest to punkt równowagi trzech faz (stałej, ciekłej, gazowej)substancji.
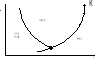
Podczas przejścia cieczy ze stanu ciekłego w parowy.Zakładając że mamy zamknięte naczynie (cylindr tłok)z cieczą dostarczając temperaturę przy p=idem ciecz uzyskuje coraz wyższą temperaturę aż do momentu osiągnięcia tzw zmiany stanu skupienia polegającym na powstaniu fazy gazowej w całej objętości cieczy w postaci pęcherzyków parowych (wrzenie)- zależy dla określonej cieczy wyłącznie od ciśnienia. Jeżeli dalej będziemy dostarczać ciepło to temp będzie się utrzymywać na stałej wartości, natomiast będzie coraz więcej pary, gdy ciecz całkowicie odparuje to nastąpi wzrost temp pary.Faza gazowa mająca kontakt z wrzącą cieczą (temp wrzenia) to tak zwana para nasycona-para nasycona i ciecz są w tak zwanym w stanie równowagi trwałej i dla danej cieczy jest funkcją ciśnienia.Stąd mamy krzywą nasycenia Zależność ciśnienia nasycenia p od temp nasycenia.
43. Przemiany (gazów doskonałych i pół doskonałych)
a) izotermiczny- jest przemianą, w której stała jest temperatura czynnika
*![]()
- praca bezwzględna
mając funkcję p od V p1v1=p2v2![]()
p=p1v1/v ponieważ p1v1 jest stałe ![]()
robimy podst. V2/V1=p1/p2 ![]()
* ![]()
Lt1-2=L1-2 ciepło Q1-2=L1-2=Lt1-2 jeżeli dv>0 rozprężanie L1-2>0 ; Q1-2>0 jeżeli dv<0 sprężanie L1-2<0 ; Q1-2<0
b)izochoryczny V=idem
p=idem ; v=idem
* L1-2=0 * lt1-2=V(p1p2) chcąc sprężyć trzeba doprowadzić pracę z wewnątrz która jest ujemna
Ciepło Q1-2=V2-V1=m(u2-u1)=mcv(T2-T1)
c) izobaryczna p=idem
* Lt1-2=0
* L1-2=p(v2-v1)
*Q1-2=I2-I1=m(i2-i1)=mcp(T2-T1)
d) adiabatyczna odwracalna - dQ=0 bez wymiany ciepła z otoczeniem jest przemianą izentropową
*
jeżeli dQ=0![]()
ds=0 bo ds=dq/τ
![]()
równ. różniczk. adiab. odwrac.
χ=cp/cv ; χ=dv/v+dp/p=0![]()
χlnv+lnp=0 ;ln(pvχ)=0
χ-wykładn. adiabaty
* L1-2=cv(T1-T2) ; * Lt1-2=χL1-2
e) Politropa- przemiana w której ciepło właściwe jest równe c=dq/dτ=idem ; z- wykładnik politropy
44. Co to jest równowaga termodynamiczna?
Jest to taki stan, który ustala się samorzutnie w układzie odizolowanym od oddziaływań sił zewnętrznych i pozostaje niezmienny w czasie czyli gdy parametry stanu tego układu nie ulegają zmianie w czasie. Spełnione są trzy warunki równowagi:
a) równowaga termiczna
b) równowaga chemiczna
c)równowaga mechaniczna
45.Ciepło właściwe politropy
![]()
natomiast z Capeyrona i równ. χ otrzymujemy ![]()
Ciepło właściwe politrpy może mieć wartość zarówno dodatnią jak i ujemną Przy 1<z<χ to C<0
Sens fizyczny C<0; mimo doprowadzono ciepła temp. czynnika obniża się lub mimo odprowadzonego ciepła temp. czynnika podwyższa się. Przemiany gdy C<0 często zachodzą w praktyce np. przy sprężaniu czynnika w sprężarce, przy rozprężaniu adiabatycznym odwracalnym
46. Co to jest ciepło właściwe i od czego zależy?
Całkowite ciepło przejęte przez ciało o masie m podczas podgrzewania od T1 do T2 jest równe ciepłu dostarczonemu z zewnątrz i ciepłu tarcia (ciepło wewnątrz ciał) Qc 1-2 =Q1-2+Qf przy czym
![]()
przekształcając wg. ![]()
![]()
![]()
Średnie ciepło właściwe ![]()
jest to ilość ciepła jaką należy dostarczyć jednej jednostce ilości substancji, aby zmienić temperaturę o 1K w całym rozpatrywanym okresie temp. Zależy od:
rodzaju ciała
temperatury t1 t2
warunków ogrzewania ciał
Stosunek Cp/Cv=χ Jeżeli mam ciało masie m i podgrzewam od t do Δt+t to nastąpi przyrost ciepła ΔQc ![]()
![]()
![]()
-rośnie wraz ze wzrostem t i jest wysokością prostokąta o szerokości (t2-t1). F pole figury nieregularnej równe polu prostokąta o wysokości. Wielkości ciepła właściwego C i szerokości t2-t1. Pole figury F=(t2-t1)*c
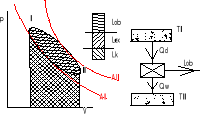
47. Wpływ zaworu dławiącego na pracę ziembiarki
Ziembiarka z zaworem dławiącym- schemat
Zawór dławiący- jest urządzeniem stosowanym w ziębiarce umożliwiającym spadek ciśnienia od wartości panującej w skraplaczu do wartości panującej w parowniku (skroplona ciecz zostaje zdławiona do odpowiedniego ciśnienia). Przemiana dławienia odbywa się przy stałej 3-4 entalpi, ponadto obieg z zaworem dławiącym jest nie odwracalny ze względu na nie odwracalność przemiany dławienia. Ponadto również występują straty energetyczne (nie odbiera się pracy sprężarki oraz zmniejsza się wartość wydajności chłodniczej g0.
Obieg suchy- Δ od Carnotta ![]()
sprężanie zachodzi e obszarze pary przegrzanej dzięki (osuszaniu między parownikiem a sprężarką ![]()
para sucha nasycona)
(osuszacz odbiera krople cieczy od pary suchej nasyconej)
48. Co to jest dławienie?
Jest to przemiana w której czynnik termodynamiczny ekspanduje dv (wzrasta) i rozpręża się dp (maleje), nie wykorzystując przy tym pracy. Przemiana ta ma miejsce gdy czynnik natrafia na przegrodę w postaci zmieniającego się przekroju, zmiany kierunku przepływu, zmianę prędkości.

49. Co to jest równanie przemiany?
Jest to zależność pomiędzy parametrem stanu. Dla każdej przemiany można podać 3 równania.
Przemiany mogą być odwracalne lub nieodwracalne
Przemiany mogą być zamknięte lub otwarte
Otwarta przebiega przy zmiennej ilości substancji
50. Podać równowagę stanu gazu doskonałego i półdoskonałego?
pV= RT- równanie stanu gazów doskonałych
pV= mRT ; p [N/m2] ; V [m3/kg] ; R [Nm/kgK] ; T [K]
51. Zerowa zasada termodynamiki
Jeżeli dwa ciała 1 i 2 są w stanie równowagi termicznej z 3 są one także w równowadze między sobą.
52. Zdefiniować i podać zast. i sposób oblicze. straty wylot i napełnienia sprężarki?
Strata wylotowa- temp. spalin wypływających do otoczenia jest większa niż temp. otoczenia. Ciepło unoszone do otoczenia przez spaliny qw.
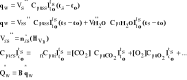
![]()
- ilość spalonego paliwa
Równanie Pecleta.
![]()
k- współczynnik przenikania ciepła [ W / m2 K ]
1.I zasada termod. I
2.II zasada termod. I
3.Wielkości zast. dla roztworów gazowych. I
4.Entalpia- obliczanie. I
5.Przejmowanie. I
6.Sposób przekazania ciepła. II
7.Sposoby doprowadzania ciepła II
8.Praca bezwzględna. II
9.Sens fizyczny pracy tech. II
10.Obieg Diesla. II
11.Obieg Otto. III
12.Stopień suchości pary nasyconej mokrej. III
13.Wymienniki ciepła. III
14.Entalpia co to jest ? III
15.Strumień czynnika termodyn. III
16.Gaz doskonały i pół doskonały. III
17.Strumień ciepła co to jest ? III
18.Bilans wymiennika ciepła. IV
19.Entropia co to jest ? IV
20.Prawo wzrostu entropii. IV
21.Spalanie niezupełne i niecałkowite IV
22.Rodzaje konwekcji. IV
23.Termiczne rów. czynnika termodyn. IV
24.Efekty energetyczne obiegu silnika cieplnego, ziębiarki, pompy grzejnej. IV
25.Skojarzona gospodarka cieplna co to jest ? V
26.Obliczanie oszczędności energii uzyskiwanej w skojarzeniu gosp. cieplnej. V
27.Obieg Braytona. V
28.Siłownia turbogazowa wady i zalety. V
29.Zasada zachowania energii. V
30.Energia wewnętrzna co to jest? V
31.Całkowite ciepło pochłonięte przez czynnik termodyn. W układzie T-s. V
32.Siłownia parowa. V
33.Obieg Carnota obieg o max sprawności. VI
34.Uogólniony obieg Carnota. VI
35.Bilans energetyczny co to jest ? VI
36.Dlaczego praca i ciepło nie mogą być traktowane za postać energii. VI
37.Jak określa się skład chemiczny paliw. VI
38.Jaką przemianą nazywamy obieg. termodyn. VII
39.Obieg prawo i lewo bieżny. VII
40.Definicja Clausiusa, Plancka, Smitha, Ostwalda, Entropia. I
41.Prawo dla gazu doskonałego. VII
42.Punkt krytyczny i potrójny co to jest ? VIII
43.Przemiany gazów dosk. i pół doskonałych. VIII
44.Równowaga termodynamiczna co to jest ? IX
45.Ciepło właściwe politropy. IX
46.Ciepło właściwe i od czego zależy. IX
47.Zaworu dławiącego na pracę ziembiarki. IX
48.Dławienie co to jest ? X
49.Równaie przemiany co to jest ? X
50.Podać równowaga stanu gazu doskonałego i półdoskonałego. X
51.Zerowa zasada termodynamiki. X
52.Strata wylotu i napełnianie sprężarki. X
Ew = Lw
Ed = Ew
Md>Mw
Md<Mw
Md=Mw
md>mw
md<mw
md=mw
dx - odległość przesunięcia tłoka
Jeżeli:
dv>0 to dl>0
dv<0 to dl<0
Lt=Ln+L1-2+Lw+L1-2+p1v1-p2v2
Ln - praca napełniania
L1-2 - praca przemiany zamknietej
Lw - praca wytłaczania
zał. p1>p2
w.z.p. - przemiana napełniania
z.z.p. - ilość czynnika = const
1-2 sprężanie izentro.
2-3spalanie p=cons
3-4 rozpr. izentropo.
4-1 wydech izochora,
1-2 sprężanie izentro.
2-3 izochora (spal. wyb.)
3-4 rozpr. izentropo.
4-1 wydech (izochoryczne oddaw. ciepła)
mp - ilość pary suchej
ilość całkowita pary mokrej
i nosi nazwę średniej logarytmicznej, gdyż zawiera logarytm różnicy temp na końcu i początku wymiennika
N1-2 - ilość cząstek gazu
M1-2 - masy cząsteczkowe
m1-2 - masa gazu
Oznaczenie:
czynnik grzejący z indeksem 1
czynnik ogrzewany z indeksem 2
czynnik wprowadzany „prim”
czynnik wyprowadzany „bis”
stąd można obliczyć Qo
1 gw
2 Lob=LCR
3 gd
straty wydajności chłodniczej lt=ls-lr
s- sprężanie
r- rozprężanie
Parownik (skropiony czynnik odparowuje pobierając ciepło osiąga stan określony punktem 1)
dv=0, dp=0
Ev=m(i+w2/2)
i1+w12/2=i2+w22/2
w<40 m/s2 przyjmujemy Ek strugi i1=i2
a)t1 różne od t2
b) t1=t2=t3
c)t1=t3
Wyszukiwarka
Podobne podstrony:
I zasada Termodynamiki
2 Bilans energii Pierwsza zasada termodynamiki
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
zasada termodynamiki Nernsta (twierdzenie Nernsta)
16Pierwsza zasada termodynamiki
II Zasada Termodynamiki
02 Zerowa zasada termodynamikiid 3864 ppt
2 2 pierwsza zasada termodynamiki
13. II zasada termodynamiki
2 4 druga zasada termodynamiki
2 7 II zasada termodynamiki i sprawnosc cyklu?rnota
zasada termodynamiki druga
II ZASADA TERMODYNAMIKI ENTROPIA 2
TERMODYNAMIKA , 0 zasada termody: dwa cjała A i B są w ruwnowadze termicznej jeśli każde z nich jest
13 II zasada termodynamikiid 14454
więcej podobnych podstron