Do 30 cm3 0,2 molowego wodnego roztworu amoniaku wlano 720 cm3 roztrworu kwasu solnego o pH=2. Oblicz pH tak sporządzonego roztworu. Stała dysocjacji NH3 Kb=1,75*10-5
nz=cz*vz=0,24mol/dm3*30cm3=7,2mM NH3 HCl= alfa=1
HCl pH=2 [H+]=Ck=10-2=0,01 mol/dm3
nk=ck*vk=0,01 mol/dm3*720 cm3 =7,2mM HCl
cs=ns/vr=0,0072mol/0,75 dm3=0,0096 mol/dm3
Kb=[NH4+]*[OH-]/[NH3]
Kb=Cs* Kw/[H+]2
[H+]=(Cs* Kw/ Kb)pierwiastek
[H+]=0,0096*10-14/1,75*10-5 =2,34*10-6
pH=-log(2,34*10-6)=5,63
NH3+HCl= NH4Cl
NH4++ Cl-+HOH>< NH3*H2O+Cl-+H+
Do 500 cm3 0,124 molowego wodnego roztrworu kw octowego wsypano 1 g krystalicznego NaOH. Zakładając że objętość nie uległa zmianie oblicz jego pH. Stała dysocjacji CH3COOH Ka=1,8*10-5
nk=ck*vk=0,124 mol/dm3*500 cm3 =62mM CH3COOH
40g NaOH- 1000mM
1g NaOH- 25mM
CH3COOH+NaOH=CH3COONa+H2O
62mM 25mM Produkty reakcji
25mM 25mM Przereagowało
Powstało 25mM
37mM Pozostało
Ck=n/v=0,037mol/0,5 dm3=0,074 mol/dm3
Cs=n/v=0,025mol/0,5 dm3=0,05 mol/dm3
CH3COOH+H2O<>CH3COO-+H3O+
Ka=[CH3COO-]*[H+]/[CH3COOH]
[H+]= (Ck/ Cs)* Ka
[H+]=(0,074 mol/dm3 /0,05 mol/dm3)* 1,8*10-5
[H+]=2,664*10-5
pH=-log(2,664*10-5)=4,57
Przedstaw wg protonowej teorii kw równania reakcji które zachodzą podczas
A)przygotowania roztworu buforu amonowego
NH3aq +NH4Cl NH3+H2O<>NH4++Cl-
NH4Cl> NH4++Cl-
NH4 protonodawca NH3 protonobiorca
B)Po dodaniu do niego mocnego kwasu
(MK)H3O++ NH3-><NH4++ H2O(SK)
C)Po dodaniu do niego mocnej zasady
(MZ)OH-+ NH4+> H2O+NH30(SZ)
20 cm3 roztrworu kw octowego o pH 2,85 miareczkowano 0,050 molowy roztworem NaOH.Oblicz objętość użytej w tym miareczkowaniu zasady. Stała dysocjacji CH3COOH Ka=1,8*10-5
nk=ck*vk=0,124 mol/dm3*500 cm3 =62mM CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
pH=2,85
[H+]=10-pH=0,001413mol/dm3
CK=[H+]2/ Ka=(0,001413mol/dm3)2/1,8*10-5=0,111 mol/dm3
Vz=ck*vk/ck=0,111 mol/dm3*20 cm3/0,05mol/dm3=44,4 cm3 NaOH
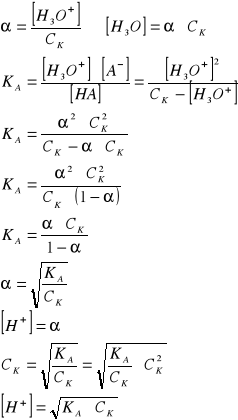
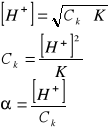
Dla słabego kwasu HA
HA + H2O = H3O+ + A−
[H3O+] =[A−] = C cz zdys.
CK=[H3O+] + [HA]
[HA] = CK − [H3O+]
Wyszukiwarka
Podobne podstrony:
NaOH, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
Ile procent wapnia zawierała próbka, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
Cu, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
Na zmiareczkowanie 20 cm3 roztworu KOH zużyto 24, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieo
Zgodnie z teorią Brönsteda kation NH4, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
HCl, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
kwasy HnA, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
ćw52 97-2003, Towaroznawstwo SGGW, Rok I, Semestr I, fizyka, Fizyka, Fizyka, Sprawozdania
newword cw 3, Towaroznawstwo SGGW, Rok I, Semestr I, informatyka, asdasdsd, informa
cwiczenie 6 Dobek, Towaroznawstwo SGGW, Rok I, Semestr I, informatyka, asdasdsd, informa, do wyslani
word cw 4, Towaroznawstwo SGGW, Rok I, Semestr I, informatyka, asdasdsd, informa
Cwiczenie 40 (6), Towaroznawstwo SGGW, Rok I, Semestr I, fizyka
cwiczenie 5 Dobek, Towaroznawstwo SGGW, Rok I, Semestr I, informatyka, asdasdsd, informa, do wyslani
cwiczenie 5, Towaroznawstwo SGGW, Rok I, Semestr I, informatyka, asdasdsd, informa
cw 64, Towaroznawstwo SGGW, Rok I, Semestr I, fizyka, Fizyka, Fizyka, Sprawozdania
więcej podobnych podstron