ĆWICZENIE 9
WYZNACZANIE CIEPŁA PAROWANIA HEKSANU Z POMIARU ZALEŻNOŚCI PRĘŻNOŚCI PARY OD TEMPERATURY.
Przygotowały:
Alicja Kudła
Katarzyna Cieślik
WSTĘP
W układzie dwufazowym ciecz - para cząsteczki w warstwie powierzchniowej lustra cieczy obdarzone wystarczającą energią mogą opuścić ciecz przechodząc w fazę gazową. Intensywność tego procesu wzrasta ze wzrostem temperatury. W miarę wzrostu stężenia cząsteczek w fazie gazowej obserwuje się proces odwrotny tj. przechodzenie pewnej liczby cząsteczek w fazę ciekłą. Jest to proces skraplania .W miarę upływu czasu szybkość parowania maleje , a szybkość skraplania rośnie. Gdy szybkości obydwu procesów zrówna się ustali się stan równowagi dynamicznej. Równowagę tą charakteryzuje właściwa dla danej cieczy prężność pary nasyconej w danej temperaturze. Prężność pary nasyconej nie zależy od ilości substancji znajdującej się w poszczególnych fazach ani też od zajmowanych przez nią objętości Jest ona głównie funkcją temperatury i stanowi miarę stężenia substancji w fazie gazowej. Przy ponownych podgrzaniu układu zamkniętego rośnie temp. I zostaje zachwiana równowaga. Wzrasta energia cząsteczek , rośnie szybkość parowania , maleje szybkość skraplania , wzrasta prężność pary nad roztworem. Ponownie ustala się stan równowagi na innym poziomie temperatury. Każdej temperaturze T odpowiada właściwa dla niej prężność pary nasyconej p.
Proces parowania wymaga dostarczenia do układu pewnej ilości energii na sposób ciepła , która w odniesieniu do 1 mola danej cieczy nosi nazwę molowego ciepła parowania ΔH i jest zużywana na zwiększenie energii cząsteczek opuszczających ciecz ( wewnętrzne ciepło parowania Li ) oraz na pracę A rozszerzenia układu od objętości molowej cieczy do objętości molowej pary przeciw ciśnieniu zewnętrznemu p :
A = p ( V(g) - V(c) ) (1)
Molowe ciepło parowania jest sumą obydwu tych udziałów :
L = Li + p ( V(g) - V© ) (2)
Relacje między ciśnieniem równowagowym i temperaturą wyraża równanie Clausiussa - Clapeyrona :
![]()
(3)
Po rozdzieleniu zmiennych i scałkowaniu równanie to ma postać :
![]()
(4)
gdzie : ΔH jest molowym ciepłem parowania cieczy.
OPRACOWANIE WYNIKÓW
Wyniki pomiarów zestawiono w tabeli
T [C] |
T [K] |
1 / T =xi |
h1 [mmHg] |
h2 [mmHg] |
h [mmHg] |
p=patm - h |
ln p=yi |
xiyi |
xi2 |
20,9 |
294,05 |
0,0034 |
706 |
67 |
639 |
119 |
4,78 |
0,016 |
|
23,6 |
296,75 |
0,00337 |
696 |
77 |
619 |
139 |
4,93 |
0,017 |
|
27,4 |
300,55 |
0,00332 |
685 |
91 |
594 |
164 |
5,1 |
0,017 |
|
31,2 |
304,35 |
0,00329 |
673 |
109 |
564 |
194 |
5,27 |
0,017 |
|
34,9 |
308,05 |
0,00325 |
657 |
125 |
532 |
226 |
5,42 |
0,018 |
|
39 |
312,15 |
0,00320 |
639 |
147 |
492 |
266 |
5,58 |
0,018 |
|
SUMA |
|
0,01983 |
|
|
|
|
31,08 |
0,103 |
|
Ciśnienie atmosferyczne w laboratorium wynosiło 758mmHg.
Wykres ln p = f(1/T) przedstawia się następująco :
Ze względu na stosunkowo wąski zakres temperatur zależność jest liniowa:
ln p = a(1/T) + b (5)
gdzie : ![]()
(6)
Współczynnik a można otrzymać przy pomocy jednej z opcji w programie Microsoft Excel, gdzie wyznaczony jest automatycznie i z dużą dokładnością .
Współczynnik a odczytany z wykresu wynosi -4036. Znając go możemy obliczyć molowe ciepło parowania heksanu ze wzoru (6) :
ΔHpar. = -8,314 · (-4036) = 33555,304 J/mol =33,56 kJ/mol
Współczynnik a możemy również obliczyć na podstawie zależności :
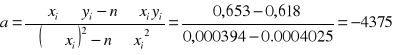
ΔHpar. = -8,314 · (-4375) = 12471 J/mol =36,37 kJ/mol
Współczynnik a wyznaczony za pomocą metody najmniejszych kwadratów jest mało wiarygodny w stosunku do współczynnika obliczonego komputerowo, tak więc proponuje się odrzucenie tego wyniku.
Wartość molowego ciepła parowania heksanu odczytana z „Poradnika fizykochemicznego” wynosi 28,85 kJ/mol.
Odchylenie procentowe dla wartości molowego ciepła heksanu policzonego przy pomocy graficznie wyznaczonego wskaźnika a wynosi:
![]()
Odchylenie standardowe dla wartości molowego ciepła heksanu policzonego przy pomocy wskaźnika a wyznaczonego poprzez metodę najmniejszych kwadratów wynosi:
![]()
Wyszukiwarka
Podobne podstrony:
Wyznaczanie ciepła parowania wody na podstawie zależności temperatury wrzenia od ciśnienia
OI11 Wyznaczanie ciepla parowania i ciepla topnienia
II11 Wyznaczanie ciepla parowania i ciepla topnienia
, chemia fizyczna, wyznaczanie ciepła parowania cieczy z pomiarów prężności pary metodą izoteniskopo
Wyznaczanie ciepła parowania wody i topnienia dla lodu, Fizyka
6i8 Badanie podstawowych przemian termodynamicznych Wyznaczanie wielkości kappa Wyznaczanie ciepła p
WYZNACZANIE CIEPŁA PAROWANIA WODY ORAZ CIEPŁA TOPNIENIA LODU
fizyka, Ciepło topnienia lodu 2 (inne spr.), Temat ćwiczenia nr 32:Wyznaczanie ciepła topnienia lodu
Wyznaczanie ciepła topnienia lodu, cwicze~1, ˙ Cel ˙wiczenia:
Ciepło topnienia i parowania - Sprawozdanie, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratori
Mech- Wyznaczanie ciepła topnienia lodu(1), Sprawozdania - Fizyka
Wyznaczanie ciepła rozpuszczania trudno rozpuszczalnych wodorotlenków
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
wyznaczanie Ciepła właściwego ciał stałych - 1
Ćwiczenie$ Wyznaczanie ładunku właściwego elektronu
więcej podobnych podstron