Adrian Standowicz 27.05.2009
I TM, Aa
Ćwiczenie 2: Wyznaczanie ciepła parowania i topnienia

WSTĘP:
1.1.
Ciepło:
W fizyce jest to jeden z dwóch sposobów, obok pracy, przekazywania energii układowi
termodynamicznemu. Polega na przekazywaniu energii chaotycznego ruchu cząstek (atomów, cząsteczek, jonów) w zderzeniach cząstek tworzących te układy. Oznacza formę zmian energii, nie zaś jedną z form energii.
Dla odróżnienia ciepła jako zjawiska fizycznego od ciepła jako wielkości fizycznej używa się określenia wymiana cieplna lub cieplny przepływ energii na określenie procesu, a ilość ciepła na wielkość fizyczną określającą zmianę energii wywołaną tym zjawiskiem.
Ciepło właściwe:
Jest to wielkość charakteryzująca każdą substancję pod względem energetycznym. Jest to energia podnosząca temperaturę ciała o jednostkowej masie o jednostkę temperatury. Ciepło właściwe (c) wprowadza się jako współczynnik proporcjonalności w prawie fizycznym mówiącym, że:
Zmiana energii wewnętrznej (ΔE) ciała jest proporcjonalna do masy ciała (m) i zmiany temperatury (Δt):
![]()
Prawo to jest prawem doświadczalnym i spełnione jest z pewnym przybliżeniem oraz pod warunkiem, że ciało nie zmienia stanu skupienia lub fazy. C. właściwe podaje się w ![]()
.
Ciepło topnienia:
Jest to ilość energii, którą trzeba dostarczyć ciału o masie 1 kg, aby je stopić bez zmiany temperatury. Jednostka ciepła topnienia: J / kg. Ciepło topnienia wyraża się wzorem:
![]()
Ciepło krzepnięcia jest równe ciepłu topnienia.
Ciepło parowania:
Jest to ilość energii, którą trzeba dostarczyć cieczy o masie 1 kg, aby wyparowała bez zmiany temperatury. Jednostka ciepła parowania: J / kg. Ciepło topnienia wyraża się wzorem:
![]()
Ciepło parowania jest równe ciepłu skraplania.
Bilans cieplny:
Jest to porównanie zysków i strat ciepła. W izolowanym układzie ciał, w którym nie zachodzi wymiana ciepła z otoczeniem, ilość energii cieplnej oddawanej (ΔEo) przez ciało cieplejsze jest równa ilości energii cieplnej pobieranej (ΔEp) przez ciało chłodniejsze tego układu:
![]()
albo inaczej: ![]()
Kalorymetr :
Kalorymetr cieczowy składa się z naczynia metalowego, do którego wlewa się odważoną ilość wody. W przykrywce wewnętrznego naczynia są dwa otwory: z jednego wystaje mieszadło umożliwiające wyrównanie temperatur ciał w kalorymetrze, do drugiego można włożyć termometr w celu pomiaru temperatury znajdującej się w nim cieczy.
Aby zmniejszyć wymianę ciepła z otoczeniem, występującą zawsze gdy istnieje różnica temperatur pomiędzy kalorymetrem a otoczeniem, izolujemy kalorymetr stawiając go na nie przewodzących ciepła nóżkach. Zewnętrzna powierzchnia kalorymetru jest posrebrzona i wypolerowana ma to na celu zmniejszenie szybkości stygnięcia kalorymetru. Kalorymetr dodatkowo umieszczony jest w osłonie cieplnej, zmniejszającej szybkość ostygania. Osłona jest to naczynie o podwójnych ściankach, wypełnione wodą o temperaturze otoczenia. Od góry kalorymetr zakrywa pokrywka. Uwięzione w ten sposób w kalorymetrze powietrze dodatkowo pełni rolę izolatora.
Kalorymetr to przyrząd do sprawdzania i pomiaru właściwości cieplnych, takich jak równanie bilansu cieplnego, wyznaczania ciepła właściwego i ciepła topnienia np. lodu.
TABELE POMIAROWE:
Tabela I - ciepło parowania:
mw+k [kg] |
Mw+k' [kg] |
mp [kg] |
t [s] |
U [V] |
I [A] |
R [J/kg] |
R [cal/g] |
1,2459 |
1,045 |
0,2009 |
600 |
210 |
3,2 |
2006970 |
479,36 |
Tabela II - ciepło topnienia:
mk [kg] |
mk+w [kg] |
mk+w+l [kg] |
mw [kg] |
ml [kg] |
T4 [˚C] |
T1 [˚C ] |
T3 [˚C ] |
L [J/kg] |
L [cal/g] |
0,1255 |
0,3315 |
0,3475 |
0,206 |
0,016 |
51,3 |
-20,1 |
41,7 |
368495 |
88,01 |
OBLICZENIA:
Dla ciepła parowania:
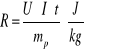
![]()
~
Dla ciepła topnienia:
Dane tablicowe:
- cw - 4190 [J / kgK]
- cl - 2100 [J / kgK]
- ck - 897 [J / kgK]
Założenia:
- T5 = T4
- kalorymetr aluminiowy
- Q1 - ciepło pobrane przez lód w trakcie jego ogrzewania
- Q2 - ciepło pobrane przez lód w trakcie jego topnienia
- Q3 - ciepło pobrane przez wodę powstałą z lodu w trakcie jej ogrzewania
- Q4 - ciepło oddane przez wodę
- Q5 - ciepło oddane przez kalorymetr
![]()
![]()
![]()
![]()
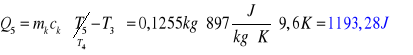
Równanie bilansu: ![]()
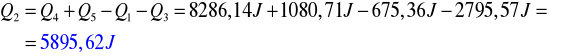
![]()
RACHUNEK BŁĘDU (dla ciepła parowania):
WNIOSKI:
Ćwiczenie to pozwoliło nam na zbadanie procesów termodynamicznych zachodzących podczas zmian stanu skupienia H2O (lód (c.stałe) woda (ciecz) para (gaz)) i zaobserwowanie różnic między ilością energii potrzebną do zainicjowania tychże przemian. Doświadczenie to dało nam wgląd w zasadę działania kalorymetru i pozwoliło na, oczywiście nie pozbawione błędów pomiarowych, określenie ciepła topnienia i parowania. Porównując z wartościami tablicowymi otrzymaliśmy najpierw wartości zaniżone, a następnie nieco zawyżone. Może się to wiązać z następującymi faktami:
- zbyt długie podgrzewanie wody
- powolne wykonanie ćwiczenia, a co za tym idzie utrata ciepła przez wodę na skutek jego
wymiany z otoczeniem.
- fakt, że grzałka wcale nie miała idealnej, 100% sprawności, przez co jej moc nie mogła być
dokładnie równa ![]()
.
- niepożądana wymiana cieplna między nagrzanym kalorymetrem, a otoczeniem.
itp.
,gdzie: - ct - ciepło topnienia
- ![]()
- ilość dostarczonej energii pod wpływem której
określona masa substancji stopnieje
- m - masa
,gdzie: - cp - ciepło parowania
- ![]()
- ilość dostarczonej energii pod wpływem której
określona masa substancji wyparuje
- m - masa
SPRAWOZDANIE
![]()
Wyszukiwarka
Podobne podstrony:
Dekrement tłumienia - Sprawozdanie - Bez obrazka, Akademia Morska, I semestr, FIZYKA, Fizyka - Labor
wahadlo torsyjne, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria
SPRAWOZDANIE, Akademia Morska, I semestr, Materiały i elementy
4. Badanie drgań własnych metodą rezonansu, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria
wahadłorewersyjne, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria, Wyznaczanie przyspiesze
Badanie zależności metalu i półprzewodnika od temperatury, Akademia Morska, I semestr, FIZYKA, Fizyk
przyśpieszenie ziemskie, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria, Wyznaczanie przys
Wyznaczanie momentu bezwładności żyroskopu1, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratori
ABCDEF, Akademia Morska, semestr 1, Fizyka
cwicz 7, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria, Wyznaczanie stosunku CpCv
Podstawowa Teoria na Laboratoria Fizyki, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria, W
wahadłorewersyjne2, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratoria, Wyznaczanie przyspiesz
Cwiczenie 53c, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SE
Cwiczenie 11i, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SE
DEFINICJE W SKRÓCIE, Akademia Morska, 1 rok, Fizyka, FIZYKA1, Fizyka, Semestr 1, Wykład
Strona tytułowa do sprawozdań, Akademia Morska, III semestr, technika cyfrowa, Technika Cyfrowa, TC
Cwiczenie 32f, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SE
Cwiczenie 0f, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SEM
SprawozdanieTyrystor ppm, Akademia Morska, semestr 5, Półprzewodnikowe przyrządy mocy - LABORATORIUM
więcej podobnych podstron