Ćwiczenie 8-1: Miareczkowanie potencjometryczne kwasu zasadą.
1. Cel ćwiczenia:
Teoretyczne i praktyczne zapoznanie się z miareczkowaniem potencjometrycznym kwasu zasadą.
Opanowanie techniki pomiaru pH roztworu oraz kalibrowania pehametru.
Wyznaczenie punktu równoważności molowej reakcji kwas-zasada (mocny kwas i mocna zasada, słaby kwas i mocna zasada).
Określenie ilości kwasów w kolbach wydanych przez prowadzącego ćwiczenia.
Wyznaczanie stałej dysocjacji Ka słabego elektrolitu (CH3COOH).
2. Wstęp teoretyczny :
Potencjometria jest jedną z metod fizykochemicznych służących do wyznaczania różnych wielkości oraz ilościowego oznaczania składników roztworu opartą na pomiarze siły elektromotorycznej ogniwa SEM lub pH roztworu.
Zasada miareczkowania potencjometrycznego polega na wyznaczeniu PRM - punktu równoważności molowej reakcji podczas miareczkowania. W przypadku miareczkowania kwasu zasadą zależy na wyznaczeniu punktu, w którym kwas zostaje całkowicie zobojętniony (liczba moli kwasu i zasady jest określona przez współczynniki stechiometryczne r. reakcji zobojętniania).
Wyznaczanie PRM polega na pomiarze SEM ogniwa zbudowanego z elektrody badanej, której potencjał zależy od stężenia badanych jonów w roztworze oraz elektrody odniesienia (porównawczej np. kalomelowej lub chlorosrebrowej).
W czasie miareczkowania kwasu roztworem zasady mierzymy pH roztworu, które jest bezpośrednio związane z siłą elektromotoryczną zbudowanego ogniwa. SEM ogniwa jest to różnica potencjałów elektrody porównawczej i elektrody badanej. Zmiany wartości siły elektromotorycznej są wynikiem zmian wartości potencjału elektrody badanej (odwracalnej względem kationów wodorowych), ponieważ potencjał elektrody porównawczej jest stały.
3. Wykonanie ćwiczenia:
Część I. Miareczkowanie mocnego kwasu roztworem mocnej zasady o znanym stężeniu.
Odczynniki i przyrządy:
Pehametr, elektroda kombinowana, mieszadło magnetyczne, biureta o pojemności 50 cm3, pipeta na 20 cm3, 2 zlewki na 250 cm3, 2 kolby miarowe na 100 cm3, roztwór NaOH o znanym stężeniu [NaOH] = 0,1003 mol/dm3.
Otrzymaną kolbę o pojemności 100cm3 z nieznaną ilością HCl (o nieznanym stężeniu) dopełniono do kreski wodą destylowaną i po dokładnym wymieszaniu odmierzono 20cm3 za pomocą pipety Mohra do zlewki na 250 cm3 .
2. Zlewkę ustawiono na podstawie mieszadła magnetycznego, a następnie umieszczono w niej mieszadełko magenetyczne oraz elektrodę kombinowaną podłączoną do pehametru. Dodatkowo do zlewki dodano wody destylowanej po to, aby elektroda była zanurzona w roztworze.
Po włączeniu mieszadła oraz pehametru odczytano i zanotowano w tabelce początkową wartość pH. Rozpoczęto miareczkowanie potencjometryczne dodając, co jakiś czas porcję 1,0 cm3 roztworu NaOH za pomocą biurety, po krótkim odczekaniu odczytując za każdym razem wartość pH na pehametrze i wpisując dane do tabeli.
W zlewce zachodzi następująca reakcja:
HCl + NaOH NaCl +H2O (1)
W miarę zbliżania się do PRM (punktu równoważności molowej) mogliśmy obserwować coraz większe skoki pH.
W celu sprządzenia dokładnego wykresu zależności pH roztworu od objętości dodawanego roztworu NaOH doświadczenie powtórzono dodając w okolicach dużego skoku pH mniejsze porcje NaOH (0,5cm3). Dane drugiego miareczkowania umieszczono w Tabeli 1.
Wyznaczono punkt równoważności molowej z wykresów:
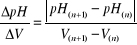
pH = f(V)∆pH/∆V = f(V) gdzie, (2)
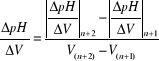
∆2 pH/∆V2 = f(V) gdzie, (3)
Na podstawie odczytanej z wykresów objętości VPRM i podanego stężenia roztworu NaOH oraz objętości roztworu kwasu solnego użytej do miareczkowania (10cm3) korzystając z równania (1) obliczono masę HCl zawartą w 100cm3 analizowanego roztworu.
Część II. Miareczkowanie słabego kwasu roztworem mocnej zasady o znanym stężeniu. Wyznaczenie stałej dysocjacji słabego kwasu.
Odczynniki i przyrządy:
Pehametr, elektroda kombinowana, mieszadło magnetyczne, biureta o pojemności 50 cm3, pipeta na 20 cm3, 2 zlewki na 250 cm3, 2 kolby miarowe na 100 cm3, roztwór NaOH o znanym stężeniu [NaOH] = 0,1003 mol/dm3.
Otrzymaną kolbę o pojemności 100cm3 z nieznaną ilością kwasu octowego (o nieznanym stężeniu) dopełniono do kreski wodą destylowaną i po dokładnym wymieszaniu odmierzono 20cm3 za pomocą pipety Mohra do zlewki.
Zlewkę ustawiono na podstawie mieszadła magnetycznego, a następnie umieszczono w niej mieszadełko magenetyczne oraz elektrodę kombinowaną podłączoną do pehametru. Dodatkowo do zlewki dodano wody destylowanej po to, aby elektroda była zanurzona w roztworze.
Po włączeniu mieszadła oraz pehametru odczytano i zanotowano w tabelce początkową wartość pH. Rozpoczęto miareczkowanie potencjometryczne dodając, co jakiś czas porcję 1,0 cm3 roztworu NaOH za pomocą biurety, po krótkim czasie odczytując za każdym razem wartość pH na pehametrze i wpisując dane do tabeli.
W zlewce zachodzi następująca reakcja:
CH3COOH + NaOH CH3COONa +H2O (4)
W celu sporządzenia dokładnego wykresu zależności pH roztworu od objętości dodawanego roztworu NaOH doświadczenie powtórzono dodając w okolicach dużego skoku pH mniejsze porcje NaOH (0,5cm3). Dane drugiego miareczkowania umieszczono w Tabeli 2.
Punkt równoważności molowej wyznaczono w sposób analogiczny do I części doświadczenia (z wykresów funkcji pH=f(V))
Na podstawie odczytanej z wykresów objętości VPRM i podanego stężenia roztworu NaOH oraz objętości roztworu kwasu octowego użytej do miareczkowania (10cm3) korzystając z równania (4) obliczono masę CH3COOH zawartą w 100cm3 analizowanego roztworu.
Na koniec obliczono stałą dysocjacji kwasu octowego. Z wykresu zależności pH=f(V) dla kwasu octowego odczytano wartość pH odpowiadającą ½ VPRM. Wartość ta jest równa pKa dla kwasu octowego. Wynika to z równania na stałą dysocjacji słabego kwasu. Korzystając z zaleności pH=-log[H+] oraz z władności logarytmów stałą dysocjacji wyznaczamy ze wzoru: Ka=10-pH.
4. Opracowanie wyników:
Część I.
TABELA 1: Zmiany pH podczas miareczkowania 100 cm3 HCl roztworem NaOH o stężeniu 0,1003 mol/ dm3 (zależność zmian pH od objętości dodawanego NaOH).
Numer pomiaru n |
V NaOH (cm3) |
pH roztworu |
I pochodna |
II pochodna |
1 |
0,0 |
3,13 |
|
|
2 |
1,0 |
3,19 |
0,06 |
|
3 |
2,0 |
3,24 |
0,05 |
-0,01 |
4 |
3,0 |
3,28 |
0,04 |
-0,01 |
5 |
4,0 |
3,35 |
0,07 |
0,03 |
6 |
5,0 |
3,44 |
0,09 |
0,02 |
7 |
6,0 |
3,56 |
0,12 |
0,03 |
8 |
7,0 |
3,81 |
0,25 |
0,13 |
9 |
7,5 |
4,18 |
0,74 |
0,98 |
10 |
8,0 |
6,3 |
4,24 |
7,00 |
11 |
8,5 |
8,64 |
4,68 |
0,88 |
12 |
9,0 |
9,22 |
1,16 |
-7,04 |
13 |
9,5 |
9,46 |
0,48 |
-1,36 |
14 |
10,0 |
9,6 |
0,28 |
-0,40 |
15 |
11,0 |
9,78 |
0,18 |
-0,10 |
16 |
12,0 |
9,9 |
0,12 |
-0,06 |
17 |
13,0 |
10,01 |
0,11 |
-0,01 |
18 |
14,0 |
10,08 |
0,07 |
-0,04 |
19 |
15,0 |
10,14 |
0,06 |
-0,01 |
20 |
16,0 |
10,19 |
0,05 |
-0,01 |
21 |
17,0 |
10,24 |
0,05 |
0,00 |
22 |
18,0 |
10,27 |
0,03 |
-0,02 |
Część II.
TABELA 2: Zmiany pH podczas miareczkowania 100 cm3 CH3COOH roztworem NaOH o stężeniu 0,1003 mol/ dm3 (zależność zmian pH od objętości dodawanego NaOH).
Numer pomiaru n |
V NaOH (cm3) |
pH roztworu |
I pochodna |
II pochodna |
1 |
0,0 |
3,74 |
|
|
2 |
1,0 |
3,98 |
0,24 |
|
3 |
2,0 |
4,28 |
0,3 |
0,06 |
4 |
3,0 |
4,52 |
0,24 |
-0,06 |
5 |
4,0 |
4,79 |
0,27 |
0,03 |
6 |
4,5 |
4,99 |
0,4 |
0,26 |
7 |
5,0 |
5,18 |
0,38 |
-0,04 |
8 |
5,5 |
5,78 |
1,2 |
1,64 |
9 |
6,0 |
6,43 |
1,3 |
0,20 |
10 |
6,5 |
8,88 |
4,9 |
7,20 |
11 |
7,0 |
9,25 |
0,74 |
-8,32 |
12 |
7,5 |
9,43 |
0,36 |
-0,76 |
13 |
8,0 |
9,59 |
0,32 |
-0,08 |
14 |
8,5 |
9,70 |
0,22 |
-0,20 |
15 |
9,0 |
9,78 |
0,16 |
-0,12 |
16 |
10,0 |
9,91 |
0,13 |
-0,03 |
17 |
11,0 |
10,02 |
0,11 |
-0,02 |
18 |
12,0 |
10,10 |
0,08 |
-0,03 |
19 |
13,0 |
10,16 |
0,06 |
-0,02 |
20 |
14,0 |
10,21 |
0,05 |
-0,01 |
21 |
15,0 |
10,26 |
0,05 |
0,00 |
22 |
16,0 |
10,30 |
0,04 |
-0,01 |
23 |
17,0 |
10,34 |
0,04 |
0,00 |
Obliczenie liczby moli kwasów zawartych w 100 cm3 roztworów:
CZĘŚĆ I:
VPRM= 8,5 cm3
[NaOH] = 0,1003 mol/dm3
V pipety= 20 cm3
HCl + NaOH NaCl +H2O
C=n/v
n=C/v= 0,0085*0,1003 = 8,53*10^-4 [mola NaOH] - liczba moli zasady potrzebna do zobojętnienia kwasu= liczbie moli zobojętnionego kwasu (reagują w stosunku 1:1)
20 cm3 8,53*10^-4
100 cm3 X
X=4,265* 10^-3 mola HCl
M=36,5 g/mol
n=m/M
m=n*M
m=4,265* 10^-3 mola *36,5 g/mol= 0,156g - liczba gramów HCl w 100 cm3 badanego roztworu
CZĘŚĆ II:
VPRM = 6,25 cm3
[NaOH] = 0,1003 mol/dm3
V pipety= 20 cm3
CH3COOH + NaOH CH3COONa +H2O
n=C/v= 0,00625*0,1003= 6,269*10^-4 mola NaOH zużytego na zobojętnienie kwasu= liczbie moli zobojętnionego kwasu (reagują w stosunku 1:1)
20 cm3 6,269*10^-4
100 cm3 X
X=3,135*10^-3 mola CH3COOH
M=60 g/mol
n=m/M
m=n*M
m=3,135* 10^-3 mola *60 g/mol= 0,188 g - liczba gramów CH3COOH w 100 cm3 badanego roztworu
Wyznaczenie stałej dysocjacji dla kwasu octowego, której wartość wyznaczona doświadczalnie wynosi:
VPRM = 6,25 cm3
½ VPRM= 3,125 cm3 i to na wykrysie pH=f(V) odpowiada pH=4,25
pH= pK=4,25
Ka=[H+]
[H+]= 10^-pH= 10^-4,25= 5,623*10^-5= Ka
W tablicach dla kwasu octowego pKa=4,8 (z poradnika fizykochemicznego)
5. Wnioski:
Podczas miareczkowania mocnego kwasu roztworem mocnej zasady o znanym stężeniu początkowo pH zmienia się nieznacznie i dopiero w pobliżu PRM następuje gwałtowny skok tej wartości (duży skok w okolicy pH obojętnego).
Przy miareczkowaniu słabego kwasu roztworem mocnej zasady o znanym stężeniu można zaobserwować także nieznaczne zmiany pH, lecz w okolicy pH=8 następuje skok.
Nasz wynik doświadczenia jest zbliżony do teoretycznego.
Błędy, nieścisłości mogą być spowodowane niedokładnością pomiaru, niedoskonałością przyrządów, a także zbytnim pośpiechem.
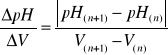
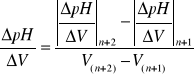
Wyszukiwarka
Podobne podstrony:
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
10-1-gr-11-A, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Numer i tytuł ćwiczenia, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
ch fizyczna 13, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fi
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
2015 pytania tren do wykł VI, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna,
pyt tren wykł III 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
6-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, sprawoz
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
Fizyczna 43, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
(10-1), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, spra
moje ChF 54, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
sprawozdanie-4-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizy
więcej podobnych podstron