Ćwiczenie 6-1 :Wyznaczanie stałej szybkości reakcji pierwszego rzędu. Wyznaczanie stałej szybkości reakcji inwersji sacharozy metodą polarymetryczną.
1. Cel ćwiczenia:
Wyznaczenie stałej szybkości reakcji inwersji sacharozy.
Zapoznanie się z metodami pomiaru szybkości reakcji pierwszego rzędu (metoda polarymetryczna z wykorzystaniem polarymetru).
2. Wstęp teoretyczny:
Szybkością reakcji chemicznej nazywamy stosunek zmiany stężenia substratu (ubytek) lub (przyrost) produktu do czasu, w którym ta zmiana nastąpiła, co możemy zapisać następująco:
![]()
Gdzie, cA - stężenie substratu A w chwili t
CX - stężenie produktu X w chwili t
Reakcją pierwszego rzędu określamy reakcje, których szybkość wyznaczona eksperymentalnie jest proporcjonalna do pierwszej potęgi stężenia składnika reagującego. Równanie kinetyczne dla reakcji I rzędu można zapisać wzorem:
![]()
gdzie, k jest stałą szybkości reakcji równą szybkości reakcji, gdy stężenie substratu jest jednostkowe (wartość charakterystyczna dla danej reakcji w danej temperaturze).
Po scałkowaniu równania i rozwiązaniu względem k otrzymujemy:
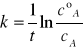
Gdzie, cºA - oznacza stężenie początkowe substratu
cA - oznacza stężenia substratu po czasie t
SACHAROZA jest optycznie czynna i skręca płaszczyznę światła spolaryzowanego w prawo. Dwucukier ten ulega w roztworze wodnym hydrolizie wg następującego równania:
C12H22O11 + H2O C6H12O6 + C6H12O6
Sacharoza glukoza + fruktoza
Jej produkty natomiast skręcają płaszczyznę światła spolaryzowanego w lewo, stąd też w trakcie reakcji możemy obserwować zmianę kąta skręcenia światła w polarymetrze (z wartości dodatnich na ujemne - czyli inwersję kąta skręcania). Szybkość reakcji hydrolizy sacharozy zależy od jej początkowego stężenia oraz stężenia jonów wodorowych niezbędnych do zapoczątkowania reakcji (konieczność użycia kwasu, który jest katalizatorem reakcji).
Mierząc kąt skręcenia płaszczyzny światła spolaryzowanego przepuszczonego przez reagującą mieszaninę umieszczoną w rurce polarymetrycznej możemy śledzić szybkość reakcji hydrolizy sacharozy (kąt skręcenia światła spolaryzowanego jest liniową funkcją stężenia substratu). Jeżeli przyjmiemy że:
α0 - kąt skręcenia płaszczyzny przed zapoczątkowaniem reakcji
α∞ - kąt skręcenia po zakończeniu reakcji
αt - kąt skręcenia w chwili t od zapoczątkowania reakcji,
to c°A = u(α0 - α∞)
cA = u (αt - α∞)
po podstawieniu do wzoru na stałą szybkości reakcji dla reakcji pierwszego rzędu otrzymujemy wzór, dzięki któremu obliczymy stałą szybkości reakcji inwersji sacharozy:
![]()
(1)
3. Wykonanie ćwiczenia:
Na układ doświadczalny składają się: polarymetr, kolba Erlenmayera na 100cm3, kwas solny 2mol∙dm-3; waga analityczna, sacharoza, pipety o objętości 25cm3, stoper.
Przygotowanie roztworu sacharozy - do 60cm3 wody destylowanej umieszczonej w erlenmajerce wsypano 40g odważonej sacharozy (roztwór 40%) i dokładnie wymieszano!
Próbka kontrolna - do 25cm3 40% roztworu sacharozy umieszczonego w czystej kolbie wprowadzono za pomocą pipety 25cm3 wody destylowanej, dokładnie wmieszano i wypełniono otrzymanym roztworem rurkę polarymetryczną. Zmierzono początkową wartość kąta skręcenia (α0)
Roztwór właściwy - 25cm3 roztworu sacharozy umieszczono za pomocą pipety w czystej kolbie stożkowej. Następnie za pomocą czystej pipety odmierzono taka samą objętość kwasu solnego i wprowadzono do kolby z roztworem. W tym momencie włączono stoper, który mierzył dokładny czas trwania reakcji.
Otrzymany roztwór wprowadzono do rurki polarymetrycznej, którą uprzednio opróżniono i oczyszczono. Rurkę umieszczono w polarymetrze. Odczytując na stoperze czas reakcji mierzono wartość kąta skręcenia płaszczyzny światła spolaryzowanego, co 5minut, a następnie 2 pomiary co 10 minut. Wyniki zestawiono w TABELI 1.
Obliczono wartości stałej szybkości reakcji ze wzoru (1) dla każdego pomiaru.
Sporządzono wykres zależności
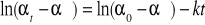
, a następnie wyznaczono stałą szybkości k, której wartość równa jest tangensowi kąta nachylenia otrzymanej prostej.
4. Obliczenia oraz opracowanie wyników:
Obliczanie masy substancji i wody w celu sporządzenia roztworu 40% 0 masie 100g.
Cp= ms / mr *100%
ms=Cp* mr / 100%= 40%*100g/100%=40g
mw=100g - 40g= 60g
Kąt skręcenia światła spolaryzowanego po zakończeniu reakcji obliczamy ze wzoru ![]()
. (2)
T=220C
![]()
.
TABELA 1. Zestawienie wyników:
Czas trwania reakcji [min] |
α0 |
αt |
α∞ |
(α0 - α∞) |
(αt - α∞) |
Stała szybkości reakcji k |
5 |
14.9 |
13.9 |
-4.917 |
19.817 |
18.817 |
10.3559*10-3 min-1 |
10 |
14.9 |
13.1 |
-4.917 |
19.817 |
18.017 |
9.5224*10-3 min-1 |
15 |
14.9 |
12.3 |
-4.917 |
19.817 |
17.217 |
9.3762*10-3 min-1 |
20 |
14.9 |
11 |
-4.917 |
19.817 |
15.917 |
10.9576*10-3 min-1 |
25 |
14.9 |
10.2 |
-4.917 |
19.817 |
15.117 |
10,8288*10-3 min-1 |
30 |
14.9 |
9.4 |
-4.917 |
19.817 |
14.317 |
10.8364*10-3 min-1 |
35 |
14.9 |
8.6 |
-4.917 |
19.817 |
13.517 |
10.9312*10-3 min-1 |
40 |
14.9 |
7.9 |
-4.917 |
19.817 |
12.817 |
10.8942*10-3 min-1 |
45 |
14.9 |
6.9 |
-4.917 |
19.817 |
12.017 |
11.1160*10-3 min-1 |
55 |
14.9 |
5.9 |
-4.917 |
19.817 |
10.817 |
11.0077*10-3 min-1 |
65 |
14.9 |
4.9 |
-4.917 |
19.817 |
9.817 |
10.8065*10-3 min-1 |
k średnie |
10,6030*10-3 min-1 |
W celu wyliczenia stałej szybkość reakcji korzystamy ze wzoru (1) ze strony drugiej.
Obliczenie k po 5 minutach trwania reakcji:
![]()
1/5 ln (19,817/18,817)= 10.3559*10-3 min-1
STAŁA SZYBKOŚCI k WYZNACZONA METODĄ GRAFICZNĄ:
Do sporządzenia wykresu ln(αt - α∞) od czasu t korzystamy z TABELI 1 i tworzymy pomocniczą TABELĘ 2:
TABELA 2.
Czas trwania reakcji [min] |
(αt - α∞) |
ln(αt - α∞) |
5 |
18.817 |
2,9348 |
10 |
18.017 |
2,8913 |
15 |
17.217 |
2,8459 |
20 |
15.917 |
2,7674 |
25 |
15.117 |
2,7158 |
30 |
14.317 |
2,6614 |
35 |
13.517 |
2,6039 |
40 |
12.817 |
2,5508 |
45 |
12.017 |
2,4863 |
55 |
10.817 |
2,3811 |
65 |
9.817 |
2,2841 |
Równanie funkcji:
y= -0,0115x + 3,0064
k= -tgα= -a , gdzie a= - 0,0115 [-],
więc k= 0,0115 min-1
Wnioski:
Cel ćwiczenia został osiągnięty.
Metodą polarymetryczną wyznaczyłyśmy potrzebne α0, natomiast α∞ wyliczyłyśmy korzystając ze wzoru (2) ze strony 3.
W miarę postępu hydrolizy sacharozy zmniejsza się kąt skręcenia (po 5 minutach z wartości 13,9 do wartości 4,9 po 65 minutach trwania reakcji).
Szybkość reakcji zależy od stężenia sacharozy i stężenia kationów wodorowych, które katalizują tę reakcję.
Reakcja inwersji sacharozy można uznać za reakcję pseudopierwszorzędową dlatego że, stężenie kationów wodorowych nie ulega zmianie, a stężenie sacharozy praktycznie się nie zmienia.
Porównując k wyznaczone metodą graficzną k= 0,0115 z średnią stałą szybkości reakcji k= 10,6030*10-3= 0,0106030 możemy uznać, że doświadczenie wykonałyśmy poprawnie. Wszelkie różnice mogą być skutkiem błędów pomiarowych, niedoskonałości oka ludzkiego, przyrządów, braku doświadczenia w obsłudze polarymetru, niedokładnym oczyszczeniem elementów, przez które przechodziły promienie świetlne.
1
![]()
![]()
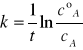
![]()
![]()
Wyszukiwarka
Podobne podstrony:
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
10-1-gr-11-A, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Numer i tytuł ćwiczenia, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
ch fizyczna 13, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fi
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
2015 pytania tren do wykł VI, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna,
pyt tren wykł III 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
8-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, sprawoz
Fizyczna 43, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
(10-1), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, spra
moje ChF 54, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
sprawozdanie-4-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizy
więcej podobnych podstron