|
INSTYTUT INŻYNIERII ŚRODOWISKA UNIWERSYTET ZIELONOGÓRSKI
|
|
|
CHEMIA FIZYCZNA LABORATORIUM
|
|
III ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE GRUPA 36 C
|
25.04.2003 TYDZIEŃ 4 |
|
KINETYKA CHEMICZNA. WYZNACZANIE STAŁEJ SZYBKOŚCI I RZĘDU REAKCJI.
TEMAT V
AUTORZY OPRACOWANIA:
TOMASZ GACEK ARKADIUSZ KARPACZ ERNEST STECKIEWICZ MAREK ŻEBROWSKI
|
||
CZĘŚĆ TEORETYCZNA
Szybkość reakcji definiujemy za pomocą pochodnych stężenia substratu lub produktu względem czasu
![]()
gdzie c - stężenie substratu, x - stężenie produktu.
Znak minus przed pierwszą pochodną oznacza, że stężenie substratu maleje w czasie.
Szybkość reakcji jest funkcją stężenia poszczególnych reagentów A, B, C ... i jeżeli reakcja jest jednokierunkowa
![]()
...
to współczynniki potęgowe a, b, c są charakterystyczne dla danej reakcji i określają rząd reakcji względem danych reagentów.
Suma współczynników potęgowych określa rząd reakcji. Nie można go mylić ze współczynnikami stechiometrycznymi reakcji i tzw. cząsteczkowością reakcji. Cząsteczkowość określa liczbę cząsteczek uczestniczących w elementarnej przemianie chemicznej.
O kinetyce procesu decydują najpowolniejsze etapy, ale niekoniecznie tylko jeden z nich, dlatego też równanie kinetyczne może przyjmować bardzo złożoną postać ze współczynnikami potęgowymi różniącymi się zasadniczo od współczynników stechiometrycznych.
Ponieważ liczba cząsteczek biorących udział w elementarnej przemianie jest z reguły mała (dwie cząsteczki, rzadziej jedna lub trzy), to też i rzędy reakcji osiągają małe wartości. Analizę ogranicza się zwykle do reakcji o rzędowości mniejszej niż 3. Rząd może być ułamkowy, jak również zerowy.
Rozważając przykład, kiedy w reakcji bierze udział tylko jeden substrat, równania kinetyczne dla reakcji rzędu pierwszego, drugiego i trzeciego mają wtedy postać
![]()
![]()
![]()
Scałkowanie tych równań prowadzi do użytecznych w praktyce równań kinetycznych.
Dla reakcji I rzędu:
![]()
gdzie c0 jest stężeniem początkowym. To samo równanie w formie wykładniczej ma postać
![]()
Charakterystyczna jest liniowa zależność lg c od czasu. Taką graficzną prezentację kinetyki reakcji I rzędu stosuje się często w praktyce:
![]()
Równanie to pozwala w prosty sposób sprawdzić, czy dana reakcja jest pierwszego rzędu, pozwala wyznaczyć stałą szybkości k1 z nachylenia lg c = f(t).
Z równania możemy znaleźć wyrażenie na tzw. czas połówkowy reakcji, tj. czas po upływie którego stężenie substratu spada do połowy wartości stężenia początkowego c0. Jeżeli więc wstawimy do równania c= ½ c0, to czas połówkowy t1/2 wyniesie
![]()
Wynika stąd, że czas połówkowy zupełnie nie zależy od stężenia początkowego c0. Dla danej reakcji połowa substratu przereagowuje zawsze w tym samym czasie.
Dla reakcji II rzędu, całkowanie równania prowadzi do wyniku:
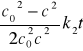
W tym przypadku odwrotność stężenia jest liniową funkcją czasu
![]()
,
natomiast czas połówkowy takiej reakcji II rzędu zależy od c0, zgodnie z wyrażeniem
![]()
.
Dla reakcji III rzędu, całkowanie równania (3) prowadzi do równania kinetycznego:
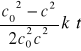
z którego wynika, że od czasu zależy liniowo odwrotność kwadratu stężenia substratu, a czas połówkowy określa wyrażenie
![]()
Jeżeli porównamy czasy połówkowe dla reakcji poszczególnych rzędów, to dochodzimy do wniosku, że są one związane z rzędem reakcji n ogólnym wzorem
![]()
Dla reakcji zerowego rzędu czas połówkowy będzie proporcjonalny do stężenia początkowego.
Równania na szybkość reakcji dla poszczególnych rzędów w ogólnym przypadku lepiej zapisać w następujący sposób:
I rząd:
![]()
II rząd:
![]()
III rząd:
![]()
gdzie a, b, c oznaczają stężenie początkowe substratów, a x - przyrost stężenia produktu.
Całkowanie powyższych równań prowadzi do ogólnie stosowanych wzorów:
I rząd:
![]()
II rząd:
![]()
III rząd:
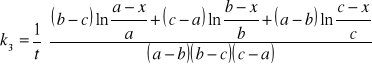
W przypadku równania n-tego rzędu, dla takich samych stężeń substratów, tzn. gdy
![]()
całkowanie prowadzi do wyrażenia:
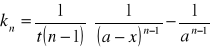
Rząd reakcji wyznacza się następująco:
Metoda graficzna. Polega na wykorzystaniu scałkowanych postaci równań kinetycznych i graficznej prezentacji wyników pomiarów. Dla reakcji I rzędu spełniona jest liniowa zależność między lg c a czasem, dla reakcji II rzędu między odwrotnością stężenia a czasem, dla reakcji III rzędu między odwrotnością kwadratu stężenia a czasem. Spełnienie jednej z podanych relacji wskazuje na właściwie dobrany rząd.
Metoda różniczkowa van't Hoffa. Polega na pomiarze szybkości reakcji dla t=0, przy różnych stężeniach początkowych. Nie jest rzeczą łatwą uchwycić zmiany stężeń w chwili początkowej, zwłaszcza, gdy reakcja jest dość szybka. Trzeba wtedy ekstrapolować nachylenie stycznej do krzywej przebiegu reakcji do czasu zerowego.
x
t
Po wyznaczeniu szybkości reakcji dla dwu różnych stężeń początkowych a1 i a2 otrzymujemy
![]()
i ![]()
Po zlogarytmowaniu i przekształceniu dochodzimy do wyrażenia
![]()
Metoda całkowa. W metodzie tej wykorzystuje się pomiar czasu, w ciągu którego przereagowuje określony ułamek substratu. Oznaczamy przez r ułamek nieprzereagowanego substratu:
![]()
Podstawiając wartości ![]()
i ![]()
do równania (6) otrzymujemy:
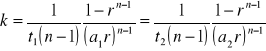
Po przekształceniu i uproszczeniu dochodzimy do relacji
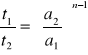
skąd wynika
![]()
W równaniu tym można w szczególności wykorzystać pomiar czasu połówkowego.
W przypadku gdy w reakcji bierze udział szereg reagentów, wówczas konieczne okazuje się stosowanie metody izolacyjnej Ostwalda. W metodzie tej stosujemy duży nadmiar wszystkich składników w stosunku do jednego. Szybkość reakcji jest wtedy zależna od stężenia tylko tego jednego składnika. Rząd reakcji tego właśnie składnika możemy wyznaczyć jedną z trzech ww metod. Metoda ta jest powszechnie stosowana do badań mechanizmu reakcji złożonych.
CZĘŚĆ OBLICZENIOWA
Metodyka
Zadanie polegało na wyznaczeniu rzędu reakcji utleniania jonów Fe2+ jonami ClO3- środowisku kwaśnym, zachodzącej według sumarycznego równania:
![]()
Stwierdzono, że etapem decydującym o kinetyce jest reakcja:
![]()
Stosowano metodę polegającą na określeniu czasu, w ciągu którego przereagowuje zadany ułamek substratów.
Przebieg reakcji śledzono przez fotometryczny pomiar stężenia jonów Fe3+ pod postacią kompleksu rodankowego. Pomiar prowadzono dla dwóch serii roztworów o różnym stężeniu początkowym , przy czym stężenia reagentów były takie same.
Materiały
Aparatura:
spektrofotometr Spekol; ultratermostat U-10; szkło laboratoryjne.
Odczynniki:
roztwór soli żelazowej Fe2+ o stężeniu 0,002 mol/dm3 i 0,004 mol/dm3 ;
roztwór chloranu ClO3- o stężeniu 0,002 mol/dm3 i 0,004 mol/dm3 ;
25%-owy roztwór rodanku amonowego; 0,1m HCl
Wykonanie ćwiczenia
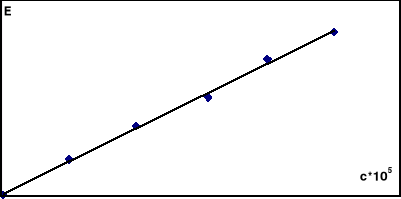
Sporządzono roztwory reagentów w 0,1n HCl i umieszczono je w termostacie nastawionym na ustaloną z góry temperaturę 25°C. Bezpośrednio przed rozpoczęciem pomiarów mieszano w stosunku 1:1 roztwory jonów Fe2+ i ClO3- o stężeniach 0,002 mol/dm3. Z naczynia reakcyjnego pobrano do kolbki 2 cm3 mieszaniny, rozcieńczono 18 cm3 0,1 n HCl i dodano 2cm3 rodanku. Czas odczytu określono w momencie rozcieńczenia. Dalsze pomiary wykonano przy tej samej długości fali w 10-cio minutowych odstępach. Podobnie postępowano z roztworem sporządzonym z mieszaniny Fe2+ i ClO3- o stężeniach 0,004 mol/dm3. W międzyczasie sporządzić krzywą cechowania stężenia jonów Fe3+dla długości fali λ=480nm na podstawie pomiaru ekstynkcji kompleksu rodankowego. Krzywą cechowania przedstawiono na wykresie.
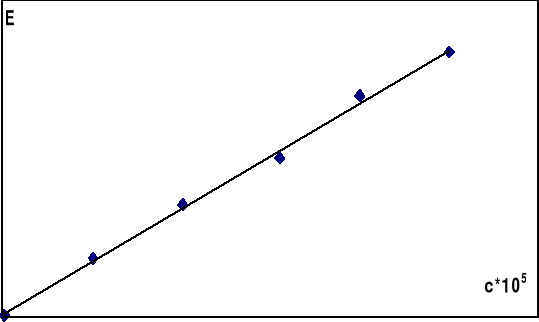
Wykres 1: Krzywa cechowania E(c) dla jonów Fe3+ przy λ=480nm
Przedstawienie wyników pomiarów
Wyniki odczytów ekstynkcji pobieranych próbek w miarę postępu reakcji i znalezionych z krzywej cechowania stężeń x jonów Fe3+ przedstawiono odpowiednio w tabelach nr 1 i 2. Tabele te zawierają także wartości stężenia substratu c oraz liczby postępu reakcji x′, która jest stosunkiem x do stężenia początkowego substratu co.
Wyniki pomiaru szybkości utleniania jonów Fe2+ przy stężeniu początkowym co=0,002mol/dm3.
t[s]
|
0 |
600 |
1200 |
1800 |
3000 |
E
|
0,109 |
0,121 |
0,129 |
0,132 |
0,144 |
x • 105
|
35,33 |
39,21 |
41,81 |
42,78 |
46,67 |
c • 104
|
16,47 |
16,08 |
15,82 |
15,72 |
15,33 |
(1/c) • 10-4
|
0,0607 |
0,0622 |
0,0632 |
0,0636 |
0,0652 |
x′
|
0,177 |
0,196 |
0,209 |
0,214 |
0,233 |
(*) Wartości znalezione /metodą najmniejszych kwadratów/ na podstawie zmierzonych ekstynkcji były mnożone przez 11, aby uwzględnić efekt rozcieńczenia, przy czym :
c = co- x
x′ = x/co
Wyniki pomiaru szybkości utleniania jonów Fe2+ przy stężeniu początkowym co=0,004mol/dm3
t[s]
|
0 |
600 |
1200 |
1800 |
3000 |
E
|
0,162 |
0,187 |
0,211 |
0,243 |
0,261 |
x • 105
|
52,51 |
60,61 |
68,39 |
78,76 |
84,59 |
c • 104
|
34,75 |
33,94 |
33,16 |
32,12 |
31,54 |
(1/c) • 10-4
|
0,0288 |
0,0295 |
0,0302 |
0,0311 |
0,0317 |
x′
|
0,131 |
0,152 |
0,171 |
0,197 |
0,211 |
Na podstawie uzyskanych wyników sporządzono wykres zależności 1/c od
czasu, w myśl równania reakcji II rzędu (dla równych ilości substratów):
![]()
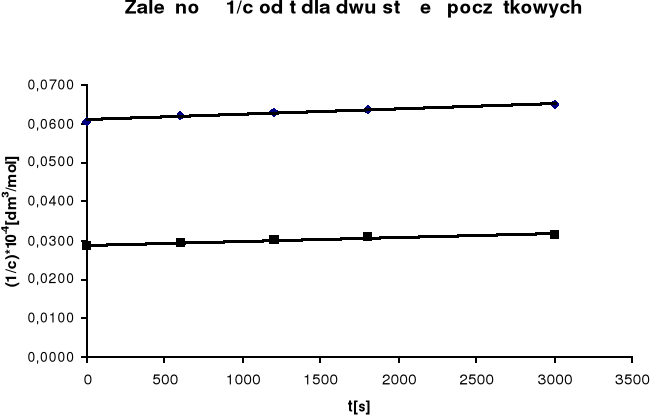
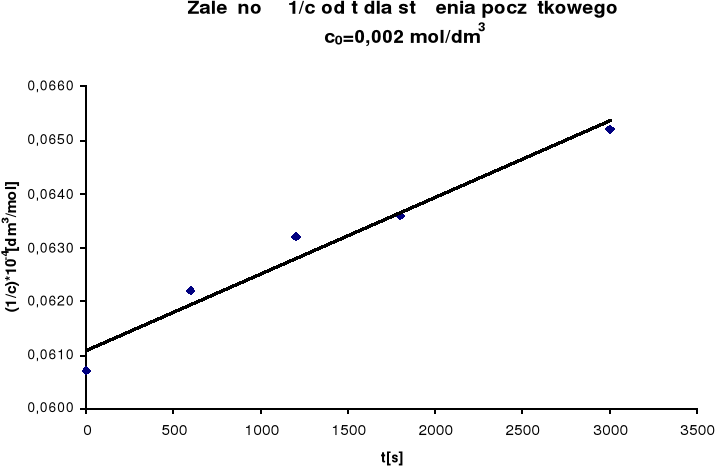
Z nachylenia prostej obliczono stałą szybkości reakcji k:
![]()
więc:
k = 0,021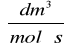
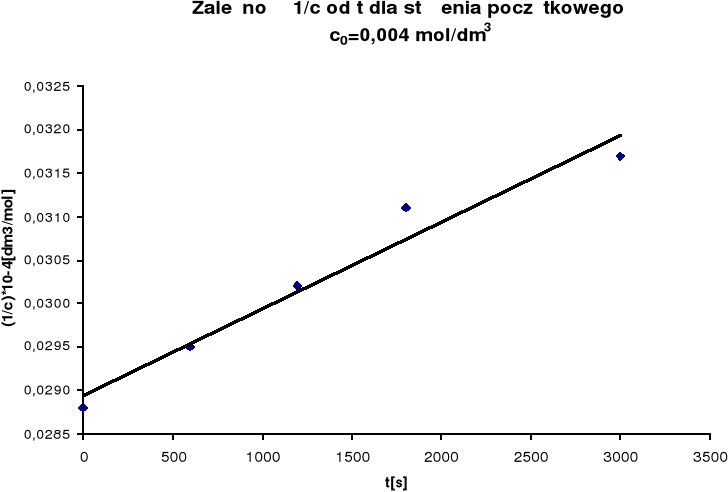
Z nachylenia prostej obliczono stałą szybkości reakcji k:
![]()
więc:
k = 0,01 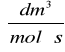
Do określenia rzędu reakcji zastosowano metodę całkową. W tym celu sporządzono wykresy zależności liczby postępu reakcji od czasu. Przebiegi x′=f(t) dla obu stężeń początkowych przedstawia na wykresie :
Z wykresu odczytujemy wartości t1 i t2 dla dowolnej wartości liczby postępu reakcji i wstawiamy do poniższego równania
![]()
gdzie a1 i a2 - stężenie początkowe substratu
Stężenia początkowe substratów: a1 = 0,004 mol/dm3 , a2 = 0,002 mol/dm3
![]()
= 2,26
WNIOSKI:
Celem ćwiczenia było wyznaczenie rzędu reakcji utleniania jonów Fe2+ jonami ClO3- w środowisku kwaśnym. Analizując przeprowadzone badanie możemy stwierdzić, iż wraz z upływem czasu stężenie jonów żelaza rosło, oraz wraz z upływem czasu rósł także postęp reakcji. Analizując wykres przedstawiający zależności x` od t dla dwu stężeń początkowych obliczono rząd reakcji, który wyniósł n=2,26.
LITERATURA
Pigoń K., Ruziewicz Z., „Chemia fizyczna”, PWN Warszawa
Sobczyk I., Kisza A., Gatner K., Kroll A., „Eksperymentalna chemia fizyczna”, PWN Warszawa
8
Wyszukiwarka
Podobne podstrony:
Kinetyka Chemiczna
4) Kinetyka chemiczna
10 Kinetyka chemicznaid 10897 ppt
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
10 wykad Statyka kinetyka chemiczna[F 2006]
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
Kinetyka chemiczna
kinetyka chemiczna id 235068 Nieznany
10 Kinetyka chemiczna i kataliza
KINETYKA CHEMICZNA, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
ELEMENTY KINETYKI CHEMICZNEJ, NAUKA, WIEDZA
3 1 Elementy kinetyka chemicznej reakcji prostych
Kinetyka chemiczna
Sprawozdanie - Kinetyka chemiczna. Wyznaczenie stałej szybkości, Studia, Chemia
3.kinetyka chemiczna, Politechnika Rzeszowska Budownictwo, IBD, Chemia
Kinetyka chemiczna, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
więcej podobnych podstron