
KINETYKA
KINETYKA
CHEMICZNA
CHEMICZNA
KINETYKA
KINETYKA
CHEMICZNA
CHEMICZNA

v - szybkość reakcji
C
A
, C
B
, C
C
- stężenia reagentów w danej chwili
k - współczynnik proporcjonalności zwany
współczynnikiem szybkości reakcji
lub
stałą szybkości reakcji
A + B C
dt
dc
dt
dc
dt
dc
v
C
B
A
Kinetyka chemiczna
Kinetyka chemiczna
-
-
nauka zajmująca
się
przebiegiem reakcji
chemicznych w
czasie
v = k
v = k
C
C
A
A
C
C
B
B
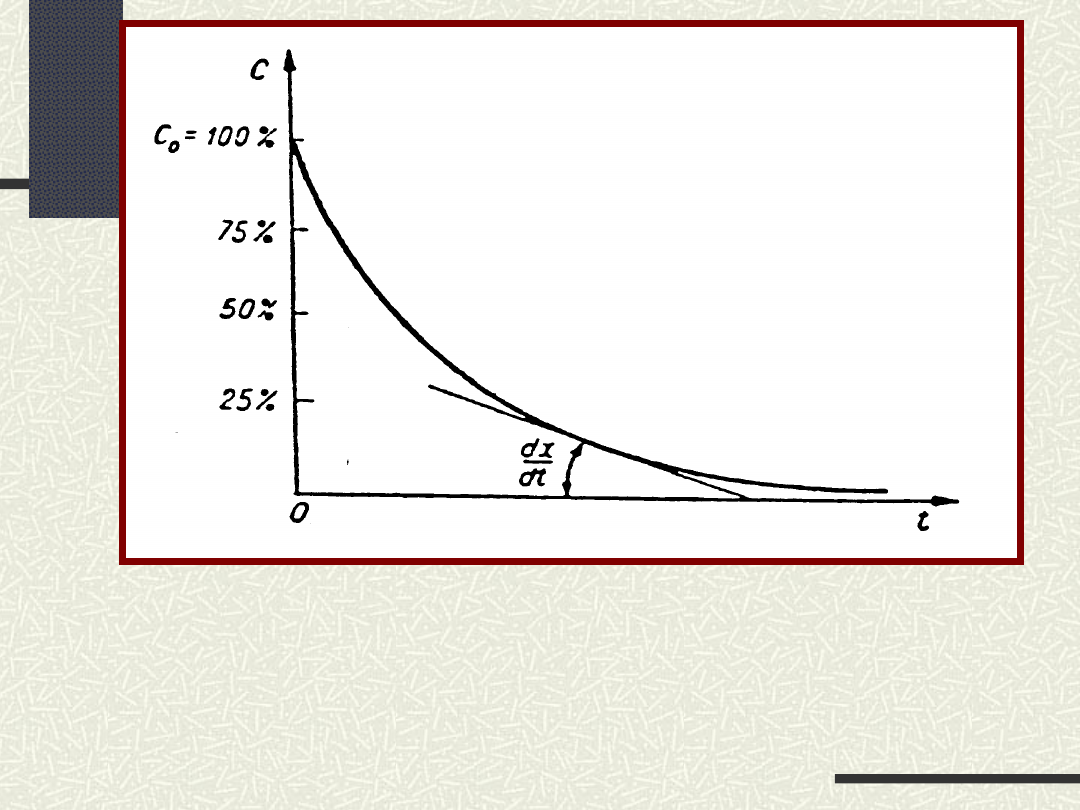
Zmiana st
Zmiana st
ęż
ęż
enia jednego z substratów w
enia jednego z substratów w
zale
zale
ż
ż
no
no
ś
ś
ci od czasu przebiegu reakcji
ci od czasu przebiegu reakcji
[
dx/dt oznacza pochodną stężenia względem czasu,
czyli prędkość reakcji w danej chwili
]

k -
nie zależy od stężenia reagentów
k -
od:
– rodzaju reakcji
– temperatury reakcji
– katalizatorów użytych do
przeprowadzenia reakcji
v = k
v = k
C
C
A
A
C
C
B
B

Dla reakcji:
2 A + B C
A + A + B C
v = k C
A
C
A
C
B
= k C
A
2
C
B
Dla reakcji:
aA + bB + cC produkty
v = k (C
A
)
a
(C
B
)
b
(C
C
)
c
......

Stężenie
Stężenie
substratów
substratów
oraz
oraz
produktów
produktów
reakcji
reakcji
jako funkcja czasu dla
jako funkcja czasu dla
odwracalnej
odwracalnej
reakcji
reakcji
chemicznej
chemicznej
C
A
, C
B
C
C
t
Stężenie, C
Czas, t
Przebieg reakcji odwracalnej
w zależności od czasu
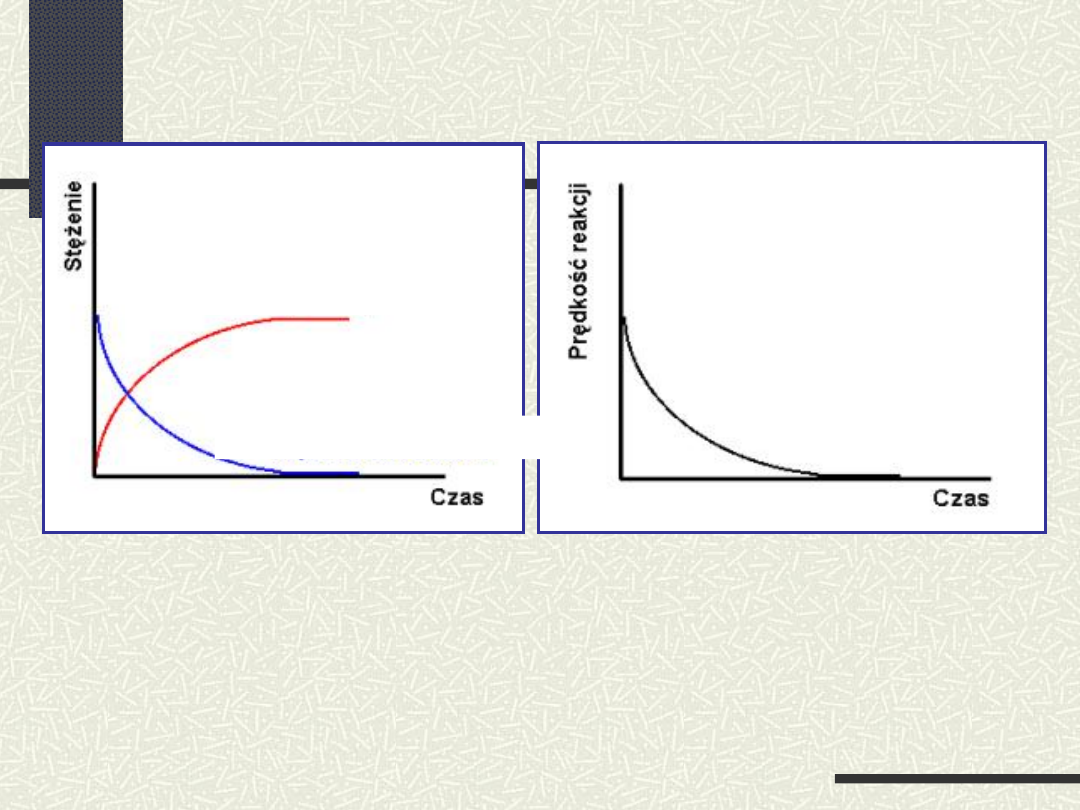
Stężenie substratów
i
produktów
oraz
szybkość (prędkość) reakcji jako funkcja
czasu
dla
nieodwracalnej
reakcji chemicznej
Stężenie produktów
Stężenie substratów

- liczba cząsteczek biorących udział w
elementarnym etapie
reakcji
chemicznej
Rozróżniamy reakcje:
– jednocząsteczkowe,
– dwucząsteczkowe,
– trójcząsteczkowe, itd.
szybkość reakcji zależy od etapu wolniejszego
- I,
reakcja trzycząsteczkowa
CZĄSTECZKOWOŚĆ
REAKCJI CHEMICZNYCH
(I) 2NO+H
2
N
2
+2H
2
O
2
(II) H
2
O
2
+H
2
H
2
O
2NO+2H
2
N
2
+2H
2
O
Reakcje jednocząsteczkowe
-
reakcje
samorzutnego rozkładu lub
przemiany
jednego rodzaju
cząsteczek
A produkty
v = k C
A
Br
Br
2
2
2 Br
2 Br
v = k
v = k
.
.
C
C
Br
Br
2
2
N
2
O
4
2NO
2
N
2
O
5
2NO
2
+1/2O
2
Pb(C
2
H
5
)
4
Pb+2C
4
H
10
N
2
O
NO+1/2N
2
C
2
H
5
Br
C
2
H
4
+HBr
Reakcje
Reakcje
jednocząsteczkow
jednocząsteczkow
e
e
E
E
A
A
kJ/mol
kJ/mol
58
103
154
222
230

H
H
2
2
+ Cl
+ Cl
2
2
2HCl
2HCl
2HI
2HI
H
H
2
2
+ I
+ I
2
2
v = k
v = k
C
C
H
H
C
C
Cl
Cl
v = k
v = k
.
.
C
C
2
2
HI
HI
2
2
2
2
Reakcje dwucząsteczkowe
- w
utworzeniu najmniejszej ilości produktu
biorą
udział dwie cząsteczki różne lub jednakowe
A + B produkty
lub
A +A
produkty

W reakcjach trójcząsteczkowych
reagują ze sobą trzy cząstki
H
H
2
2
SO
SO
3
3
+ I
+ I
2
2
+ H
+ H
2
2
O
O
H
H
2
2
SO
SO
4
4
+ 2HI
+ 2HI
v = k
v = k
C
C
H
H
SO
SO
C
C
I
I
C
C
H
H
O
O
lub
lub
2NO + O
2NO + O
2
2
2NO
2NO
2
2
v = k
v = k
C
C
2
2
NO
NO
C
C
O
O
3
3
2
2
2
2
2
2
2
2
suma wykładników potęg
a+b
w równaniu v=k[A]
a
[B]
b
Reakcje pierwszego rzędu
-
reakcje, których
szybkość zmienia
się tak, jak gdyby były one
reakcjami
jednocząsteczkowymi
np
.
N
2
O
4
2NO
2
Rzędowość reakcji

szybko
szybko
ść
ść
reakcji chemicznych zmienia si
reakcji chemicznych zmienia si
ę
ę
bezustannie w miar
bezustannie w miar
ę
ę
ich przebiegu
ich przebiegu
szybko
szybko
ść
ść
w danym momencie oznacza
w danym momencie oznacza
niesko
niesko
ń
ń
czenie ma
czenie ma
łą
łą
zmian
zmian
ę
ę
st
st
ęż
ęż
enia dc w
enia dc w
niesko
niesko
ń
ń
czenie krótkim czasie dt
czenie krótkim czasie dt
dc
dc
v = ----
v = ----
dt
dt
0
0
c
1
1
0,69
t
lnc /
ln2
k
2
k
k
=
=
=
0
c
1
t
ln
k
c
=
dla c=c
o
/2
...
D
C
B
A
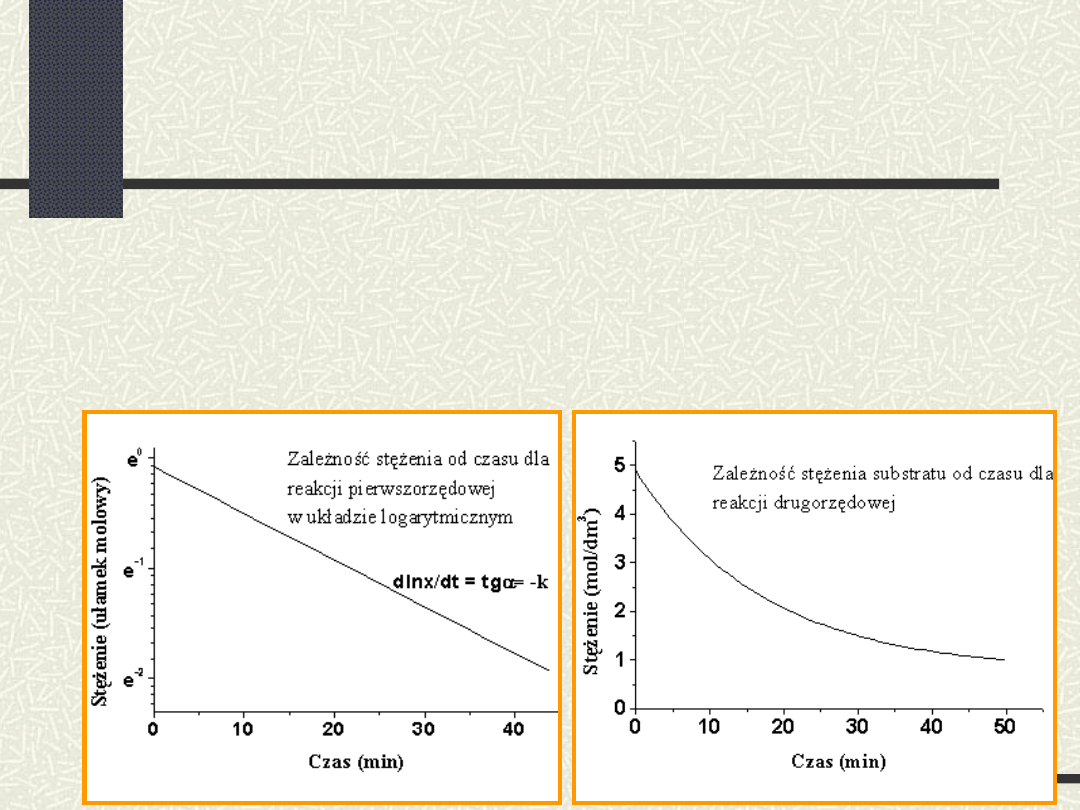
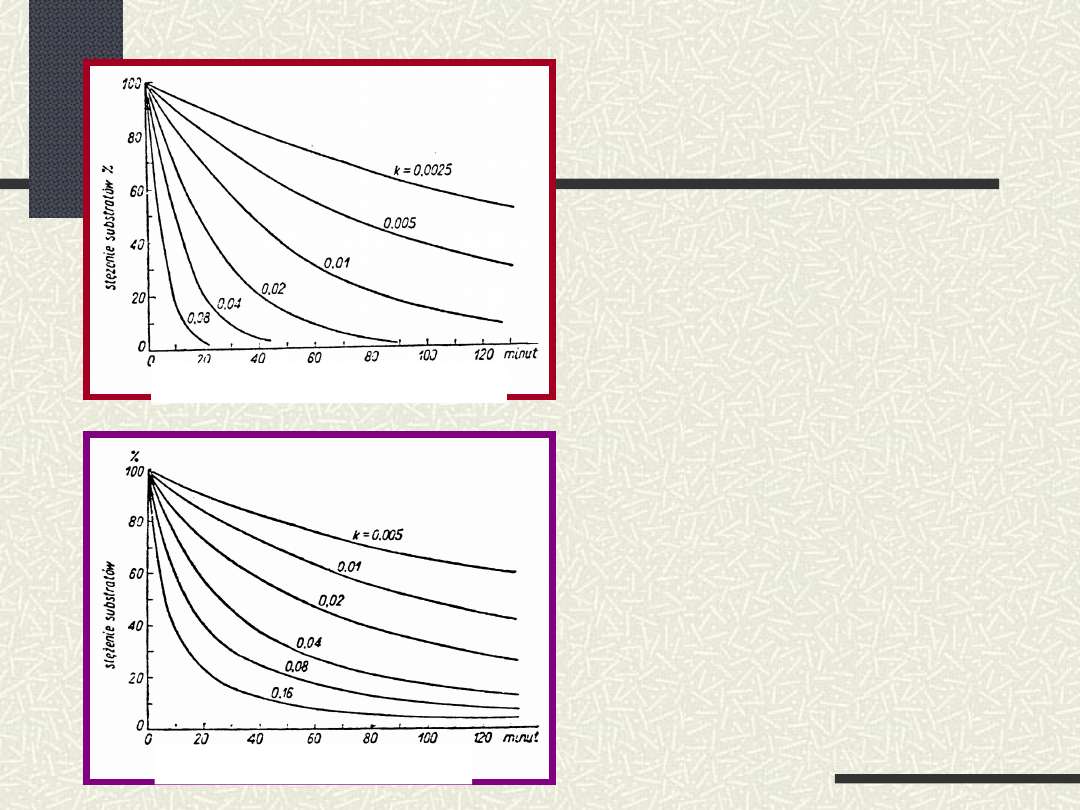
Dla reakcji pierwszego rzędu nieodwracalnej
(A produkty)
Wykres przebiegu
Wykres przebiegu
reakcji pierwszego
reakcji pierwszego
rz
rz
ę
ę
du
du
Wykres
Wykres
przebiegu
przebiegu
reakcji drugiego
reakcji drugiego
rz
rz
ę
ę
du w zale
du w zale
ż
ż
no
no
ś
ś
ci
ci
od warto
od warto
ś
ś
ci sta
ci sta
ł
ł
ej
ej
szybko
szybko
ś
ś
ci reakcji
ci reakcji
reakcje pierwszorzędowe
reakcje drugorzędowe

Dla nieodwracalnej reakcji drugiego rz
Dla nieodwracalnej reakcji drugiego rz
ę
ę
du
du
t =
1
k
2
c
0
1
0
c
=
1
0
k c
dla c=c
o
/2
C
C
B
B
v
v
=
=
=
=
k
k
C
C
A
A
-dc
-dc
dt
dt
...
E
D
C
B
A
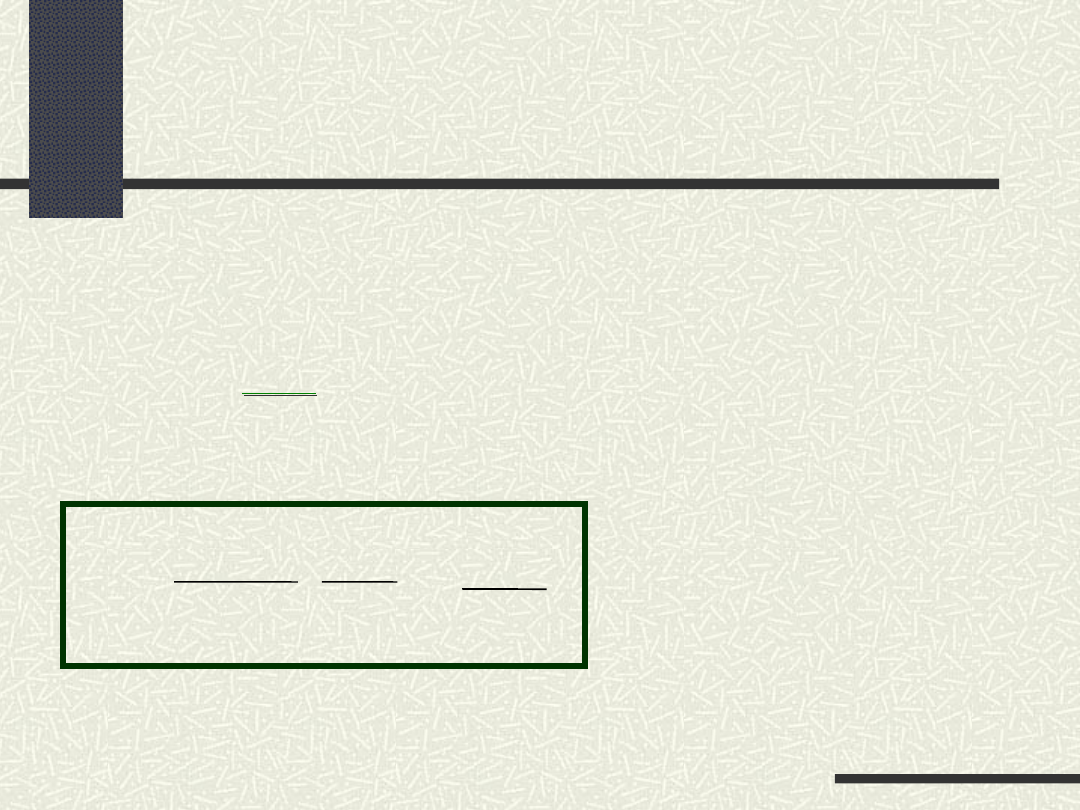
Dla reakcji
Dla reakcji
wielocz
wielocz
ą
ą
steczkowej
steczkowej
nieodwracalnej
nieodwracalnej
typu
typu
r
r
-
-
l
l
i
i
c
c
z
z
b
b
a
a
c
c
z
z
ą
ą
s
s
t
t
e
e
c
c
z
z
e
e
k
k
s
s
u
u
b
b
s
s
t
t
r
r
a
a
t
t
ó
ó
w
w
(
(
l
l
+
+
m
m
+
+
n
n
)
)
-dc
-dc
dt
dt
v
v
=
=
=
k
k
.
.
c
c
a
a
A
A
.
.
c
c
b
b
B
B
.
.
c
c
c
c
C
C
k =
k =
1
1
1
1
1
1
1
1
t
t
r
r
c
c
r
r
(
(
)
)
1
1
1
1
c
c
o
o
r
r
aA bB cC ....
produkty
+
+
+ �

CZYNNIKI WPŁYWAJĄCE NA
SZYBKOŚĆ REAKCJI
CHEMICZNYCH
— charakter substancji reagujących
— temperatura
— charakter środowiska
— katalizatory
— ciśnienie
(gdy reakcja przebiega w fazie gazowej)
— promieniowanie elektromagnetyczne
(gdy
reakcja
jest
fotochemiczna)
— rozwinięcie powierzchni
(gdy reakcja ma
przebieg
powierzchniowy)

wpływ rozpuszczalnika na wiązania w
reagujących cząsteczkach
wpływ katalityczny rozpuszczalnika
•
w jednorodnym środowisku (ciekłym
lub
gazowym) reakcje przebiegają szybko
•
w środowisku stałym procesy
chemiczne
zachodzą bardzo wolno
Wpływ charakteru środowiska

Wpływ charakteru
substancji
reagujących
szybko
szybko
przebiegaj
przebiegaj
ą
ą
reakcje zachodz
reakcje zachodz
ą
ą
ce
ce
pomi
pomi
ę
ę
dzy kationami i anionami
dzy kationami i anionami
[mała energia
[mała energia
aktywacji]
aktywacji]
wolniej
przebiegają
reakcje
między
wolniej
przebiegają
reakcje
między
cząsteczkami
cząsteczkami
o wiązaniach atomowych
o wiązaniach atomowych
— cząsteczki dipolowe przyciągają się silniej niż cząsteczki
niebiegunowe
— stosunkowo szybko zachodzą reakcje jeśli wiązania w
obrębie
reagujących ze sobą cząsteczek nie są rozrywane
— reakcje przebiegają wolno w przypadku niszczenia wiązań w
cząsteczkach reagujących i tworzenia nowych wiązań w
cząsteczkach
produktu

w reakcjach, w których bior
w reakcjach, w których bior
ą
ą
udzia
udzia
ł
ł
cia
cia
ł
ł
a
a
sta
sta
ł
ł
e
e
szybko
szybko
ść
ść
reakcji zale
reakcji zale
ż
ż
y od
y od
stopnia
stopnia
rozwinięcia
rozwinięcia
pow
pow
ierzchni
ierzchni
ciała stałego
ciała stałego
mieszanie cieczy przy
mieszanie cieczy przy
s
s
piesza reakcj
piesza reakcj
ę -
ę -
ruch
ruch
cieczowy wywo
cieczowy wywo
ł
ł
uje szybsz
uje szybsz
ą
ą
dyfuzj
dyfuzj
ę
ę
Wpływ charakteru
substancji
reagujących

Wpływ temperatury
Wpływ wzrostu temperatury na szybkość reakcji
jest określony przez tzw. współczynnik
temperaturowy
2 < < 4
=
k
t
k
t+10
k
k
t
t
–
–
stała szybkości reakcji w temperaturze t
k
k
t+10
t+10
–
–
stała szybkości reakcji w temperaturze
t+10
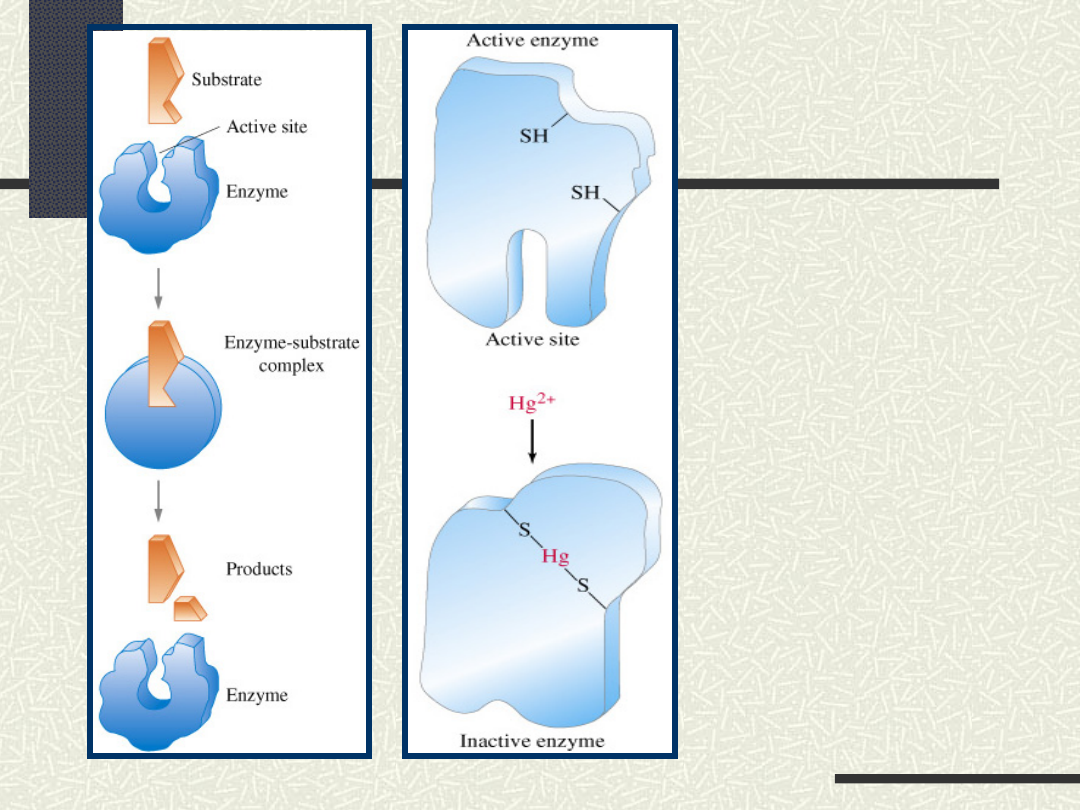
Mechaniz
m
działania
enzymu
Mechanizm deaktywacji
enzymu
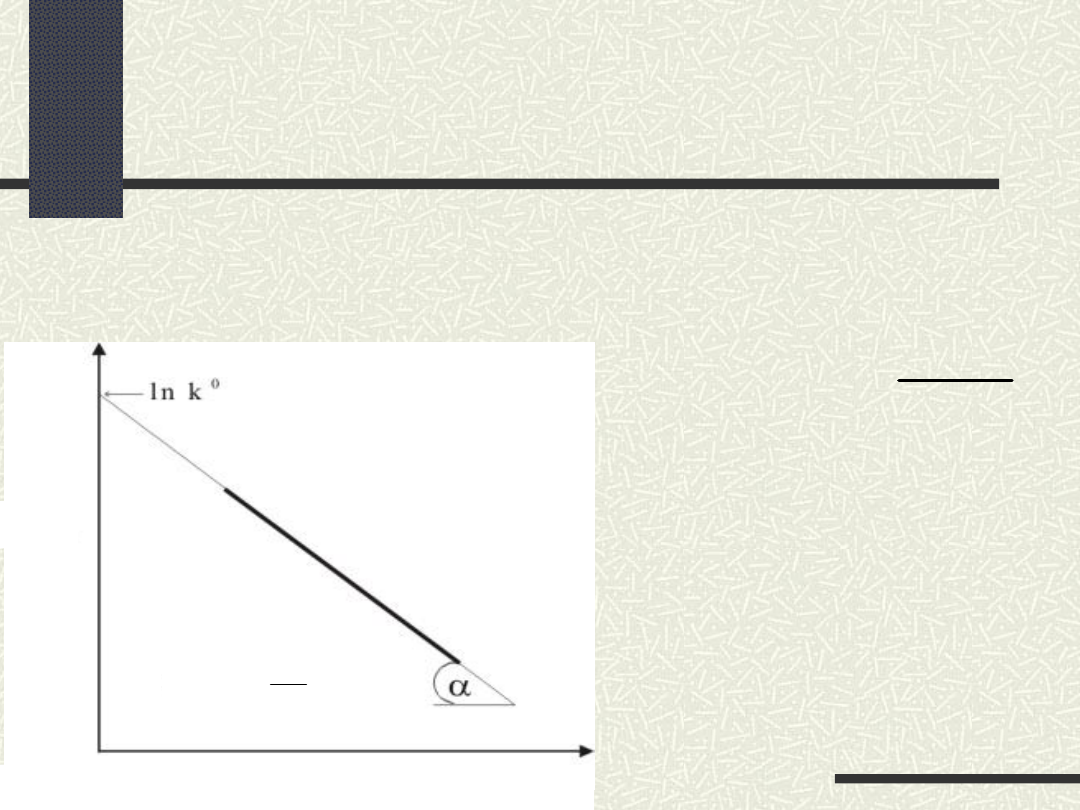
wg Arrheniusa (1889r.):
C i A
dwie stałe charakterystyczne
dla poszczególnych reakcji
R
stała gazowa (pv=RT)
T
temperatura (K)
Wpływ temperatury na
szybkość reakcji chemicznej
R
A
tg
1/T
ln k
RT
A
C
k
ln

w
reakcji
biorą
udział
tylko
te
cząsteczki,
które posiadają szybkość ruchu większą
niż średnia szybkość
cząsteczek
A
-
molowa energia
aktywacji
(energia
potrzebna wzbudzenia 1 mola
substancji)
im wyższa wartość A, tym reakcja
zachodzi
trudniej i wolniej
wg Arrheniusa (1889r.):
liczba aktywnych cz
liczba aktywnych cz
ą
ą
steczek w
steczek w
uk
uk
ł
ł
adzie
reaguj
adzie
reaguj
ą
ą
cym
jest
cym
jest
okre
okre
ś
ś
lona
lona
:
:
N
a
=
RT
A
0
e
N
=
N
0
e
-
A
/
R
T
N liczba cząsteczek aktywnych
N
o
liczba ogólna cząsteczek
e podstawa logarytmu naturalnego (e=2,72)
A energia aktywacji w kal/mol
R stała gazowa ( R= 2 kal/mol)
T temperatura w skali bezwzględnej
równaniem BOLTZMANNA:
równaniem BOLTZMANNA:

Wed
Wed
ł
ł
ug teorii aktywacji,
ug teorii aktywacji,
cz
cz
ą
ą
steczki aktywne
steczki aktywne
są to
są to
:
:
cząsteczki o większej energii
kinetycznej ruchu
cząsteczki, w których elektrony
znajdują się na wyższych poziomach
energetycznych
cząsteczki odkształcone o
nienormalnych odległościach
międzyatomowych
cząsteczki o wzmożonych drganiach
atomów

Aktywacj
Aktywacj
ę
ę
mo
mo
ż
ż
na osi
na osi
ą
ą
gn
gn
ąć
ąć
poprzez
poprzez
:
:
wzrost temperatury
pochłonięcie energii kwantów
świetlnych
naświetlenie radiochemiczne
tj. przez
zderzenie
z cząstkami , neutronami lub
elektronami
zastosowanie katalizatorów - na skutek
adsorpcji cząsteczek na powierzchni
katalizatora i ich odkształcenia

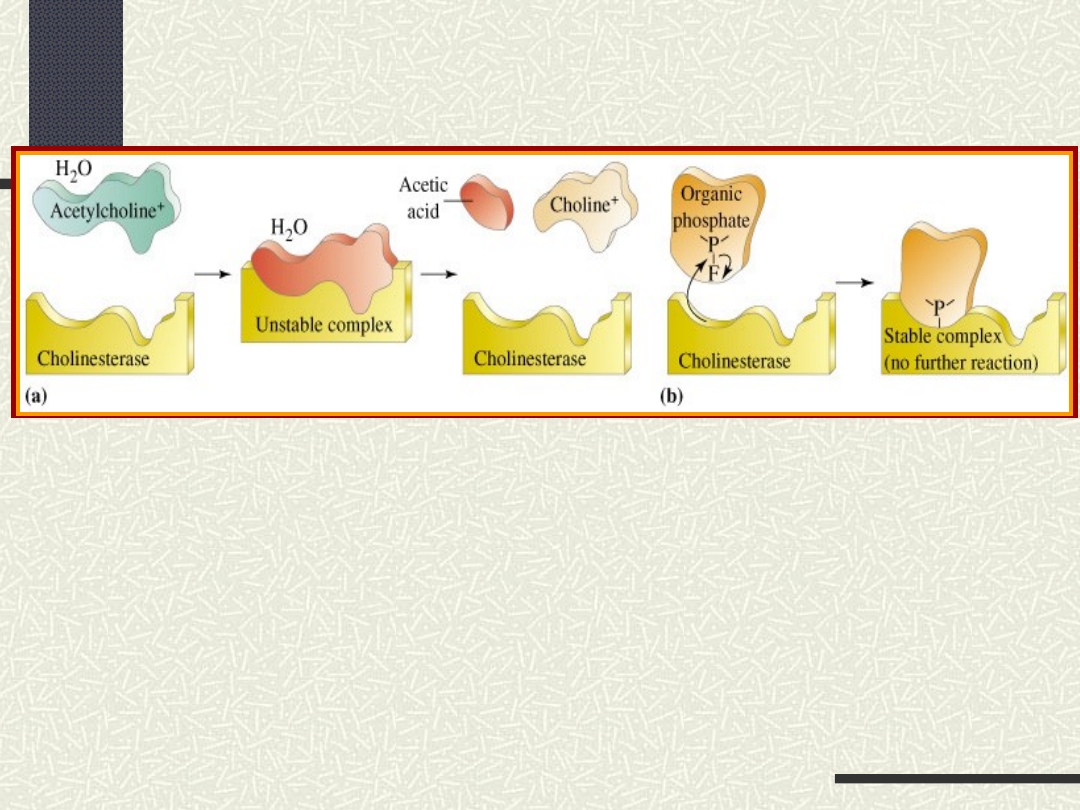
Wpływ katalizatorów
Katalizatory
—
substancje
przyspieszające
lub
opóźniające
reakcję, które po ukończeniu reakcji same
pozostają niezmienione
Katalizatory dodatnie -
aktywatory
Katalizatory ujemne - inhibitory
Kataliza — zjawisko przyspieszania lub opóźniania
reakcji
pod wpływem katalizatora

KATALIZATORY nie zużywają się w
reakcji, mogą jednak zmieniać swą
postać
- katalizatory zmieniają stałą szybkości reakcji
- małe ilości katalizatorów powodują
przemianę
dużych ilości substancji
- nie istnieją katalizatory uniwersalne
- działanie katalityczne powoduje obniżenie
energii
aktywacji reakcji
2
MnO
3
O
3
KCl
2
KClO
2
2
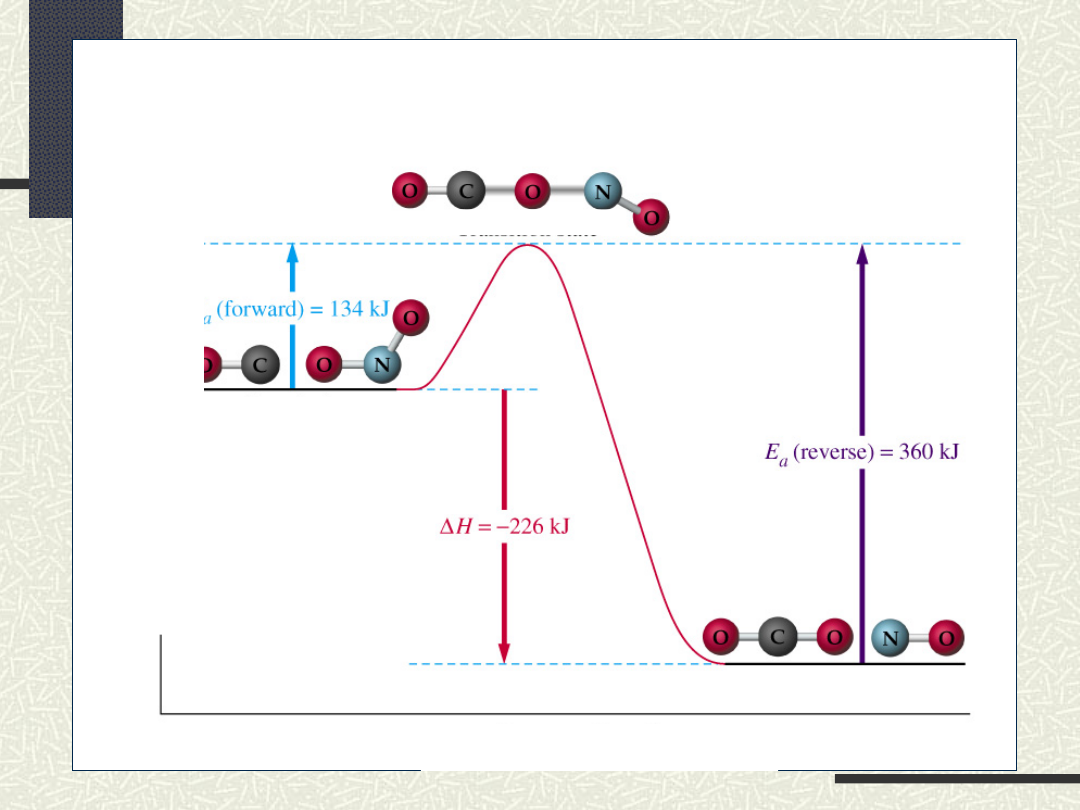
E
n
e
rg
ia
p
o
te
n
c
ja
ln
a
,
k
J
Stan przejściowy
Substraty
Postęp reakcji
Produkty
CO + NO
CO + NO
2
2
CO
CO
2
2
+ NO
+ NO
H+HBrHH+B
r
H = -67 kJ
reakcja
egzotermiczna
E
n
e
rg
ia
Postęp reakcji
Substrat
y
Produkty
Katalizowan
a reakcja
Niekatalizow
ana reakcja
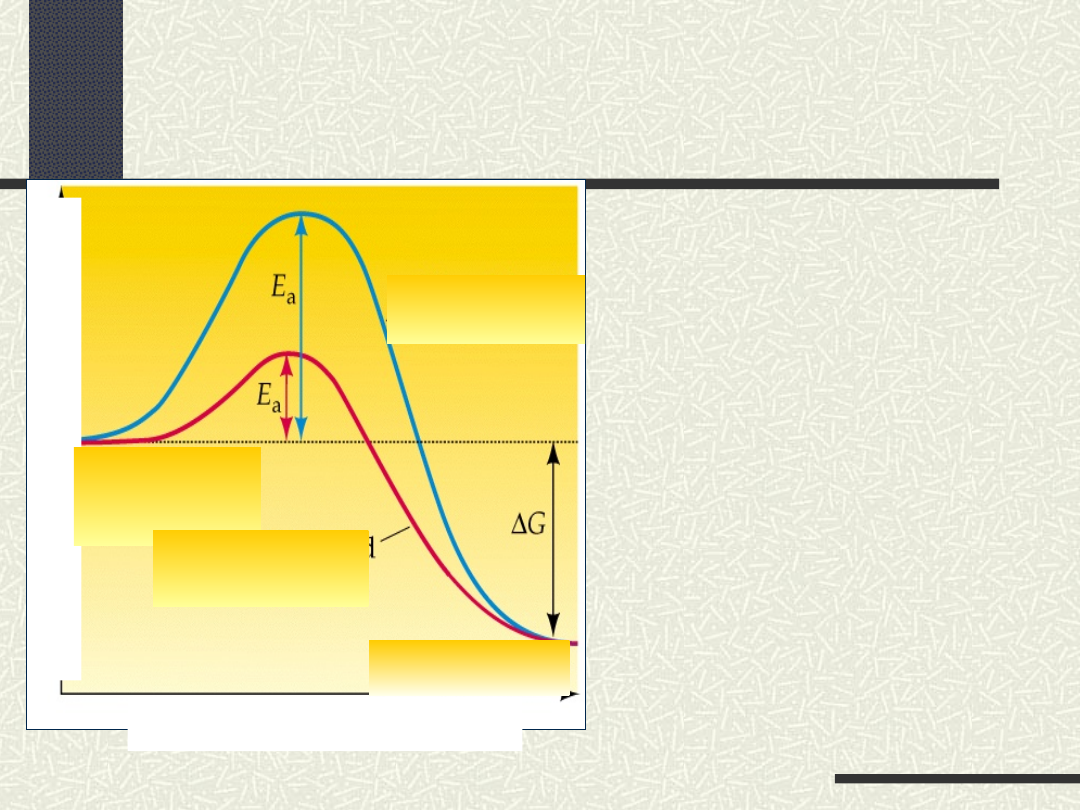
Wpływ katalizatora na energię
aktywacji
Zmiany energii podczas reakcji
Zmiany energii podczas reakcji
zachodzącej bez udziału katalizatora (a)
zachodzącej bez udziału katalizatora (a)
i w obecności katalizatora (b)
i w obecności katalizatora (b)
a
b
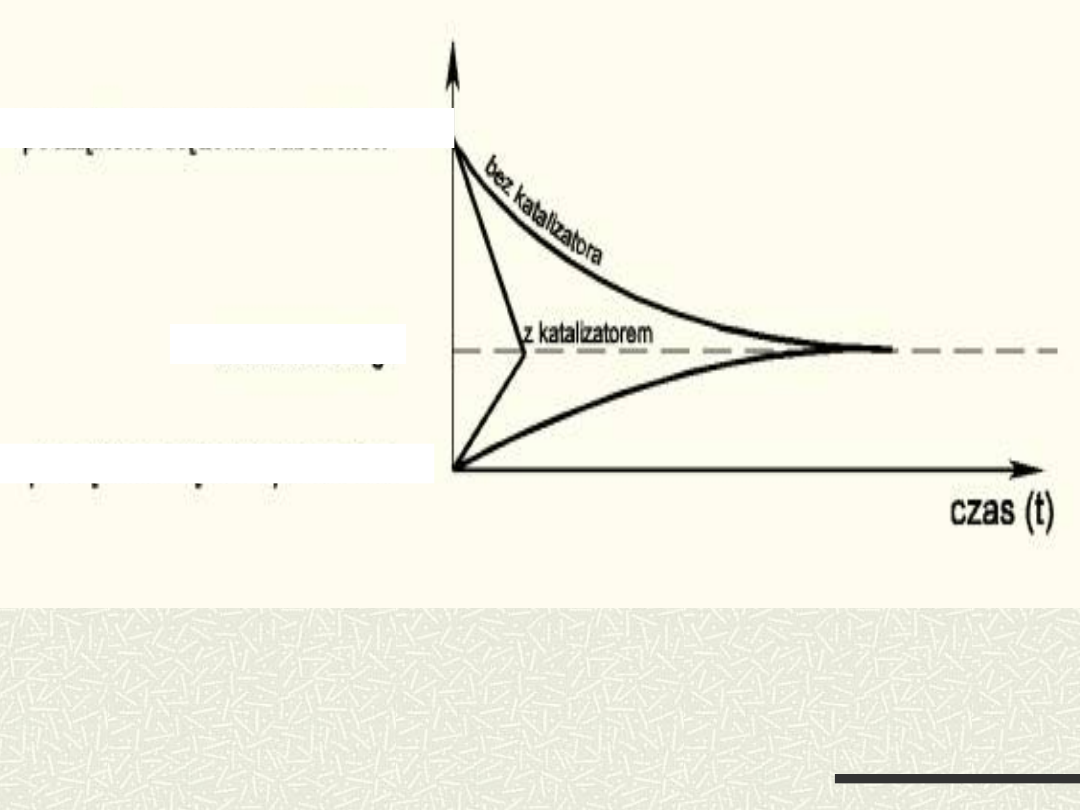
Wpływ katalizatora na zmianę stężeń substratów
i produktów reakcji oraz na położenie stanu
równowagi reakcji
początkowe stężenie substratów
początkowe stężenie produktów
stan równowagi
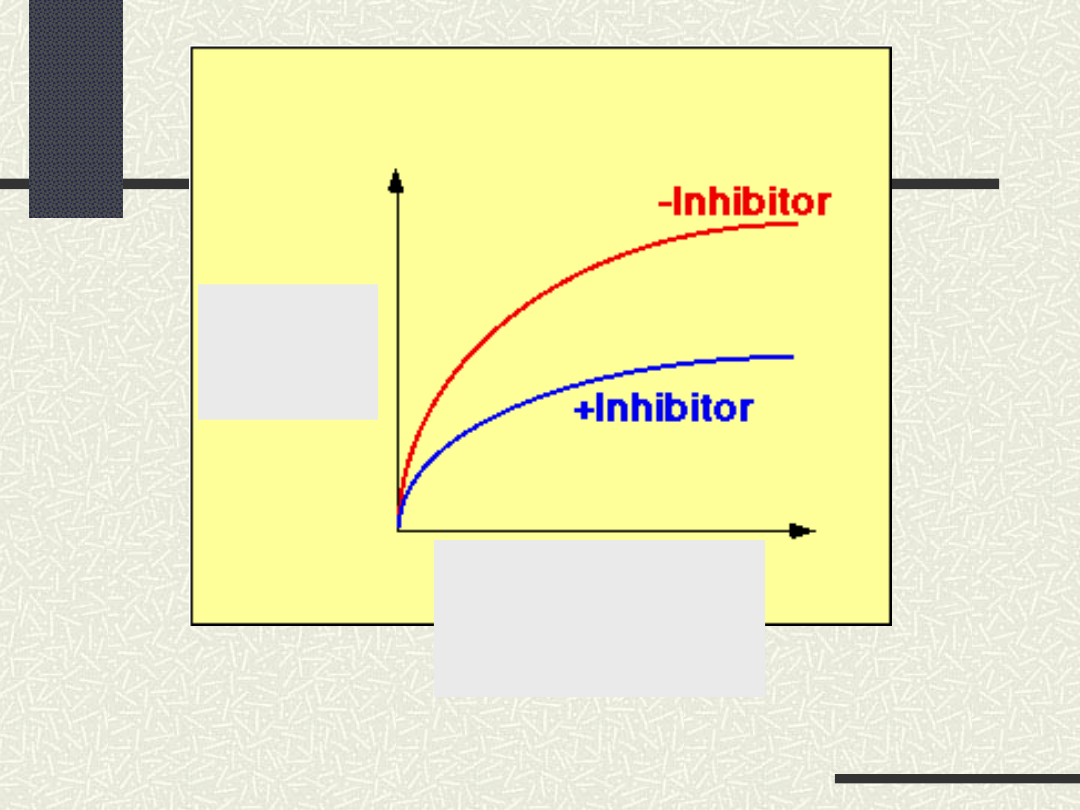
Wpływ inhibitora na przebieg reakcji
Wpływ inhibitora na przebieg reakcji
prędkoś
ć
reakcji
stężenie
produktu
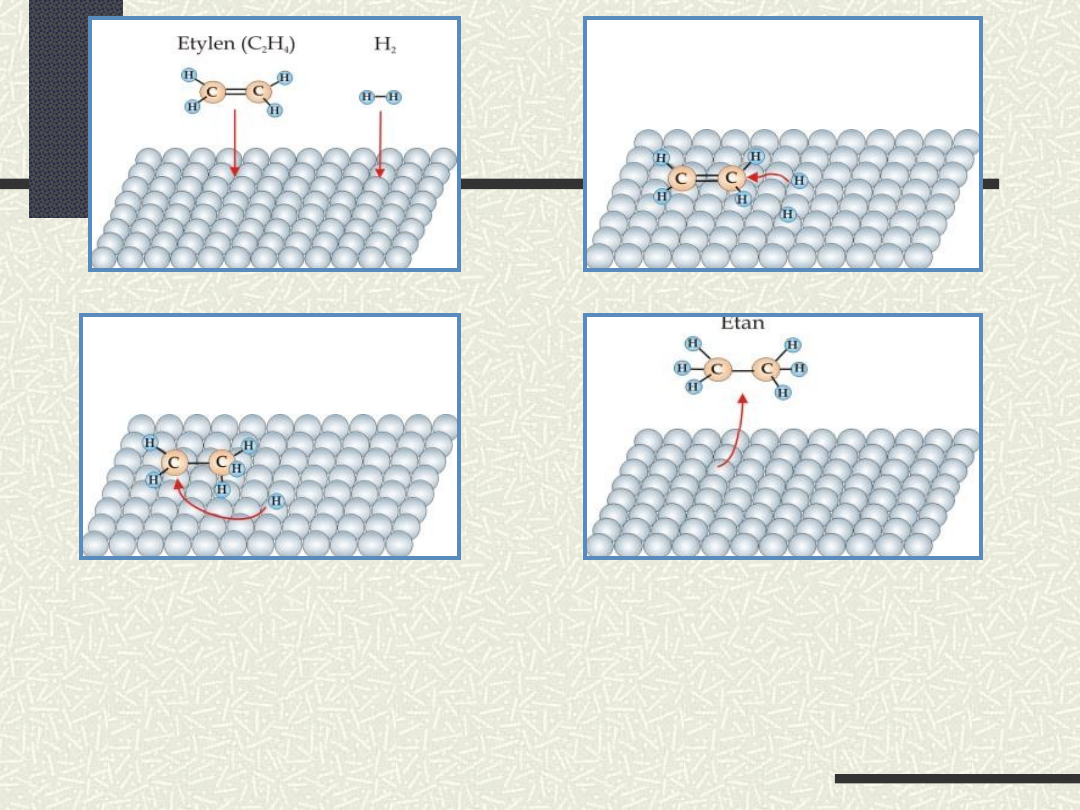
Schemat reakcji zachodzącej na
Schemat reakcji zachodzącej na
powierzchni
powierzchni
katalizatora
katalizatora
C
2
H
4
+ H
2
C
2
H
6
Teoria zderzeń aktywnych
w zderzeniu następuje przegrupowanie atomów i
elektronów,
co
powoduje
przemianę
wiązań
chemicznych
i
powstanie
nowych
substancji
chemicznych
podczas reakcji substancji A z substancją B,
cząstki A
muszą zderzać się z cząstkami B
gdyby każde zderzenie prowadziło do
reakcji,
przebiegałaby ona momentalnie
nadmiar energii, ponad średni poziom potrzebny w
zderzeniu do zajścia reakcji chemicznej, nazywa się
energią aktywacji
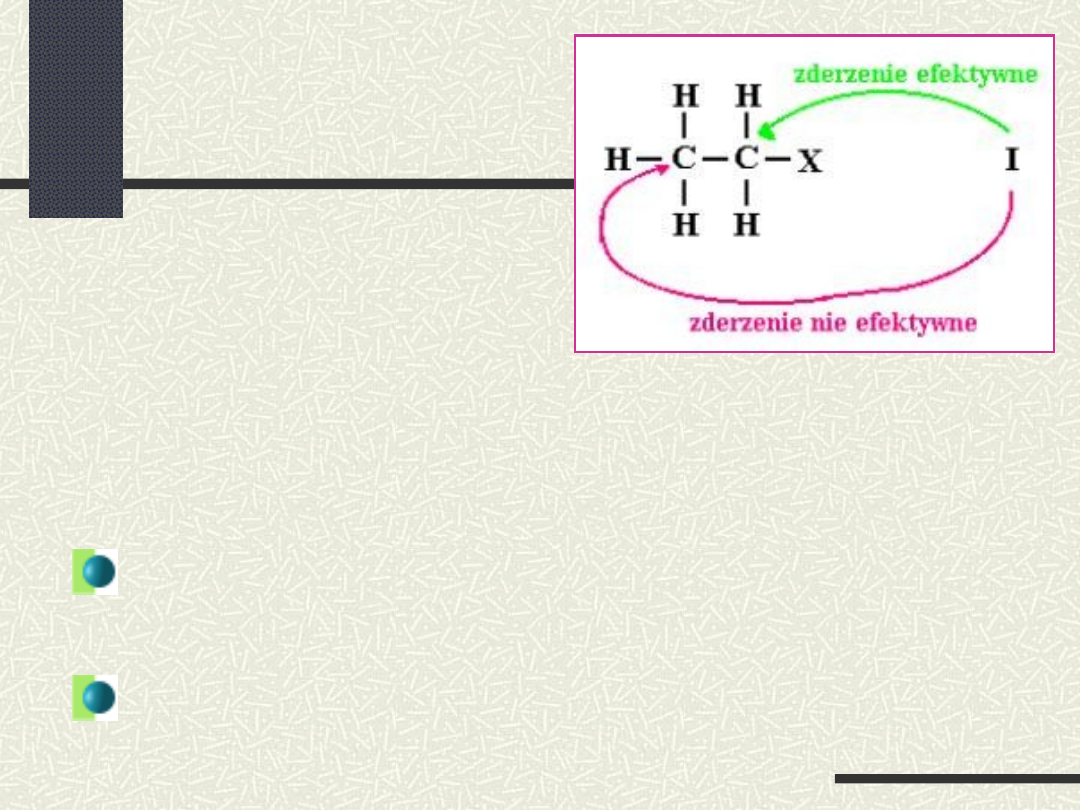
Zgodnie z teorią zderzeń szybkość
każdego etapu reakcji jest wprost
proporcjonalna do:
liczby zderzeń w jednostce czasu cząstek
biorących udział w danym etapie
stosunku zderzeń efektywnych do
całkowitej liczby zderzeń

Reakcje łańcuchowe
Reakcje łańcuchowe
—
reakcje złożone z
szeregu
rozwijających się
procesów
powiązanych
ze sobą
Cl
HCl
H
Cl
H
HCl
Cl
H
Cl
Cl
Cl
Cl
Cl
HCl
2
Cl
H
2
2
2
2
h
2
2


Statyka chemiczna - zajmuje się tzw.
stanami
równowagi
A + B C + D
stan równowagi
stan równowagi
nie jest stanem
nie jest stanem
spoczynku,
spoczynku,
lecz
lecz
stanem zrównowa
stanem zrównowa
ż
ż
onej
onej
aktywno
aktywno
ś
ś
ci
ci
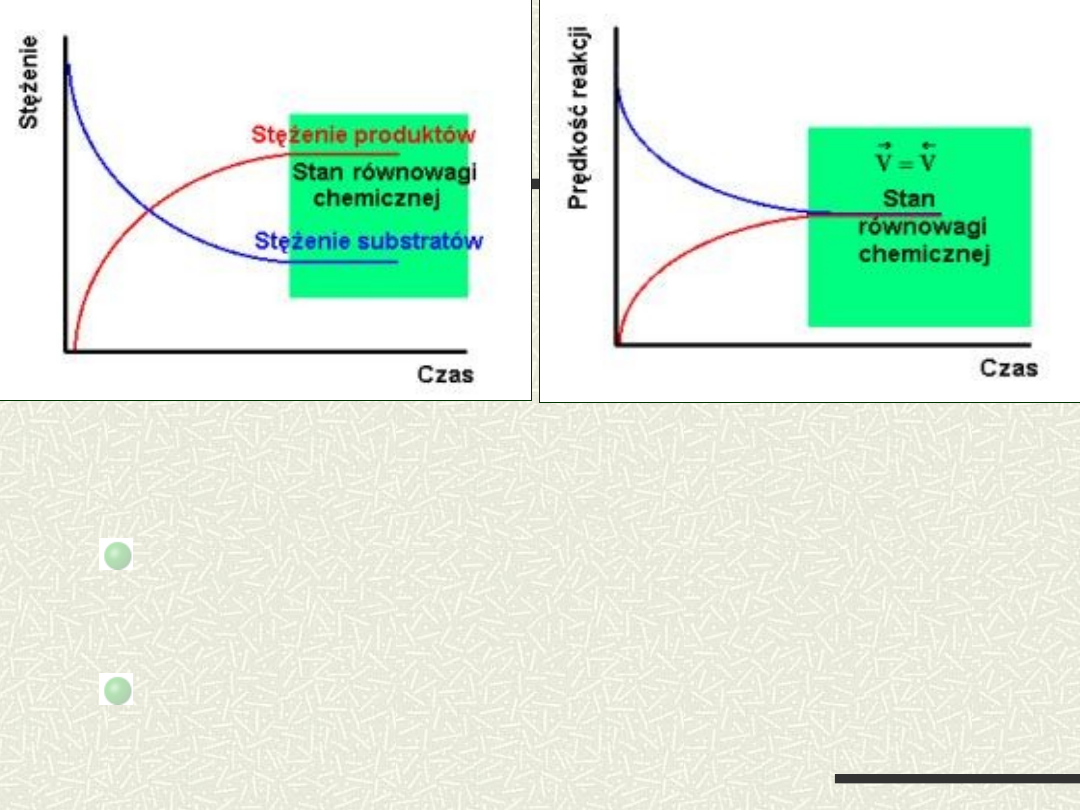
stężenia składników reakcji nie ulegają w
czasie żadnym zmianom
szybkości reakcji przebiegających w obu
kierunkach są jednakowe
Charakterystyka stanu równowagi
Charakterystyka stanu równowagi

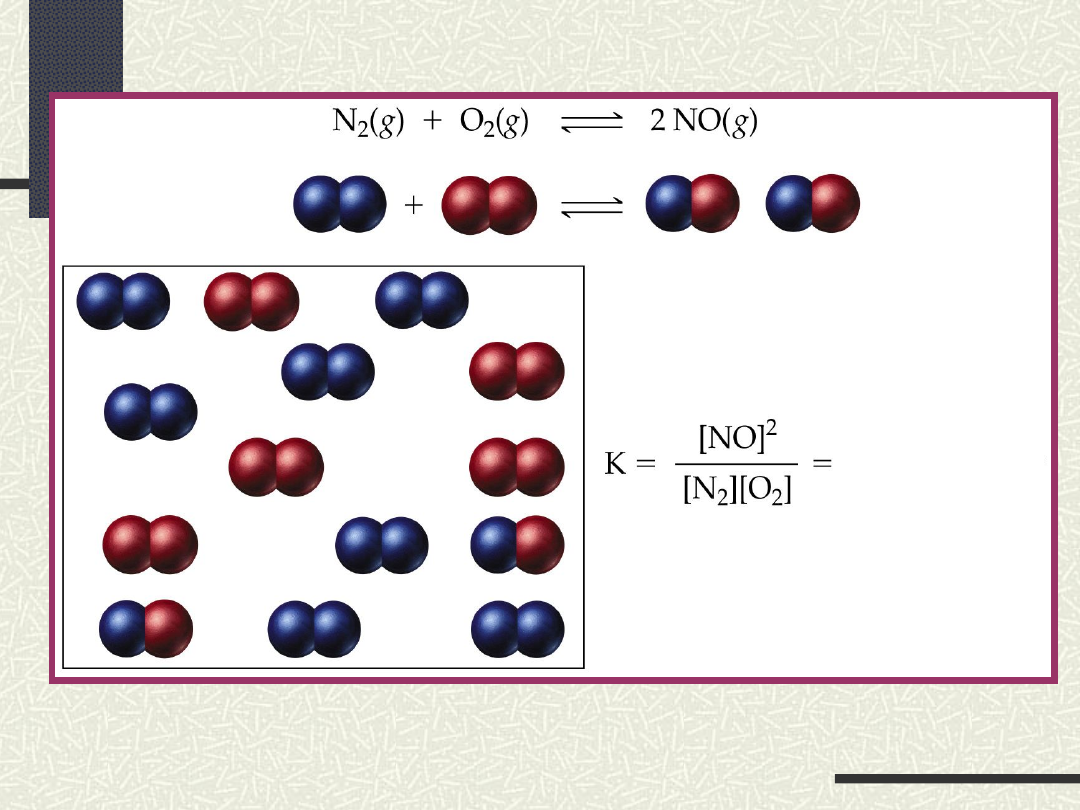
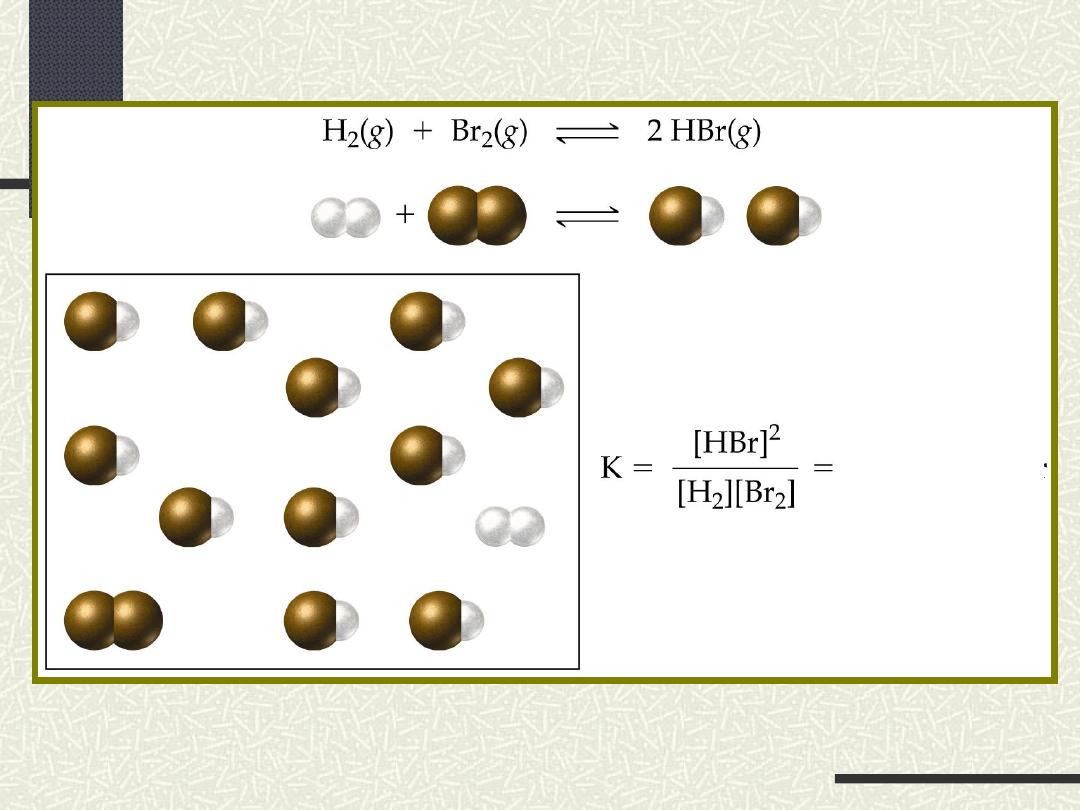
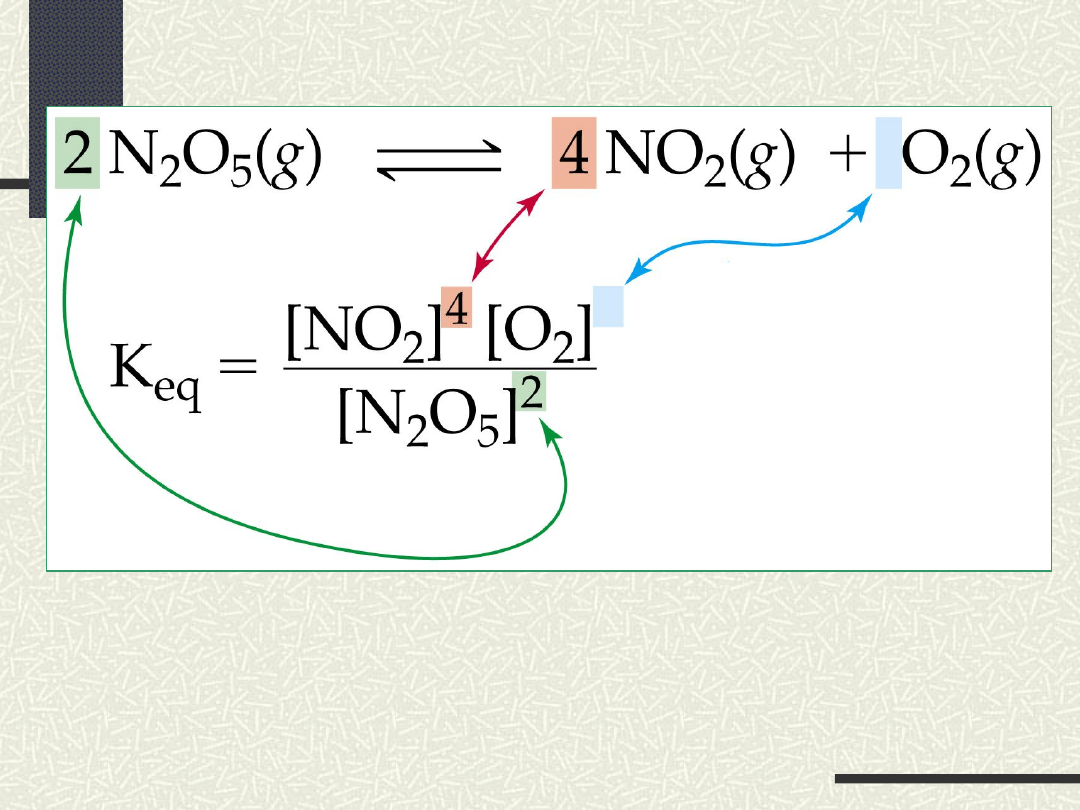
PRAWO
RÓWNOWAGI CHEMICZNEJ
nA + mB pC + qD
v
1
= k
1
.
C
a
n
.
C
B
m
v
2
= k
2
.
C
C
p
.
C
D
q
w stanie równowagi v
1
=v
2
k
1
.
C
A
n
.
C
B
m
=k
2
.
C
C
p
.
C
D
q
C
C
p
.
C
D
q
C
A
n
.
C
B
m
k
1
k
2
=
=
K
mała
wartość
duża
wartość

dla reakcji zachodzącej między
gazami:
nA + mB rC + qD
m
B
n
A
q
D
r
C
p
p
p
p
p
K
m
B
n
A
q
D
r
C
c
c
c
c
c
K
stosuje się stałą ciśnieniową
zamiast stałej stężeniowej

C (ciało stałe) + H
2
O CO + H
2
dla układów niejednorodnych:
dla układów niejednorodnych:
O
H
H
CO
2
2
c
c
c
K

Jeżeli układ będący w stanie równowagi
poddamy działaniu zewnętrznemu, tj. zmianie
stężenia reagentów, zmianie ciśnienia lub
zmianie temperatury, to w układzie tym
przesuwa się równowaga chemiczna w kierunku
kompensacji tych zmian
REGUŁA PRZEKORY
REGUŁA PRZEKORY
LE CHATELIER
LE CHATELIER
’A,
’A,
ZASADA
ZASADA
PRZECIWDZIAŁANIA
PRZECIWDZIAŁANIA
(1887
(1887
R.)
R.)
:
:

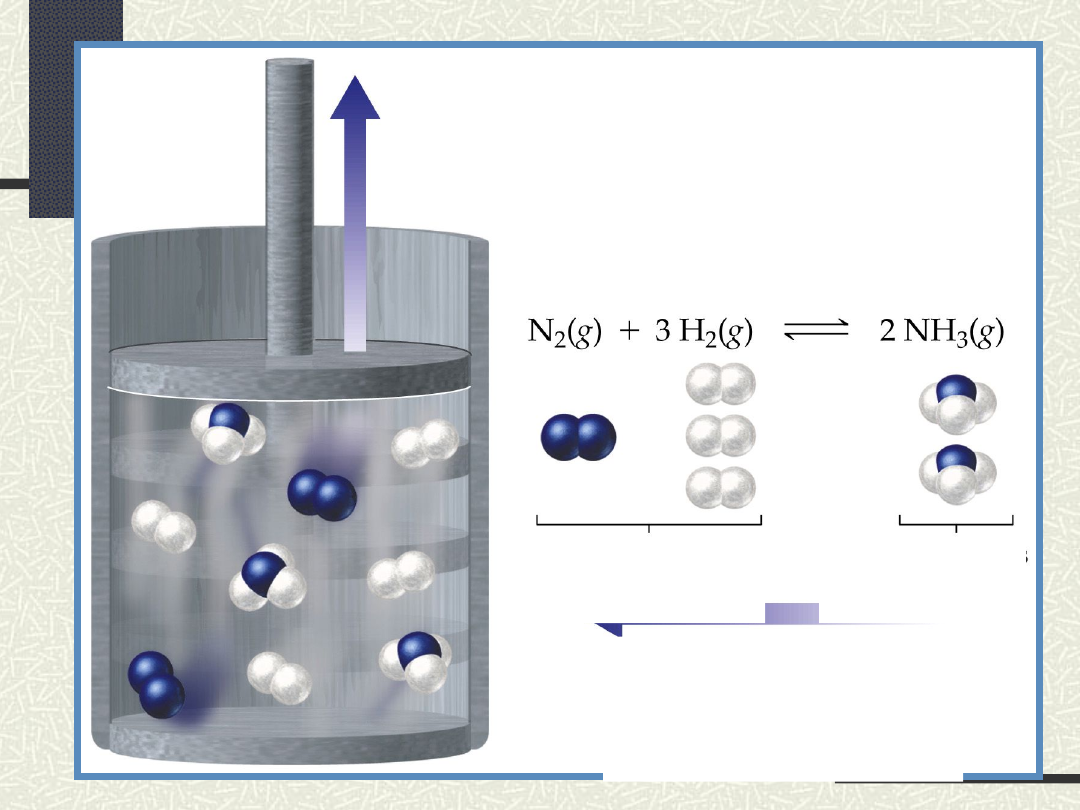
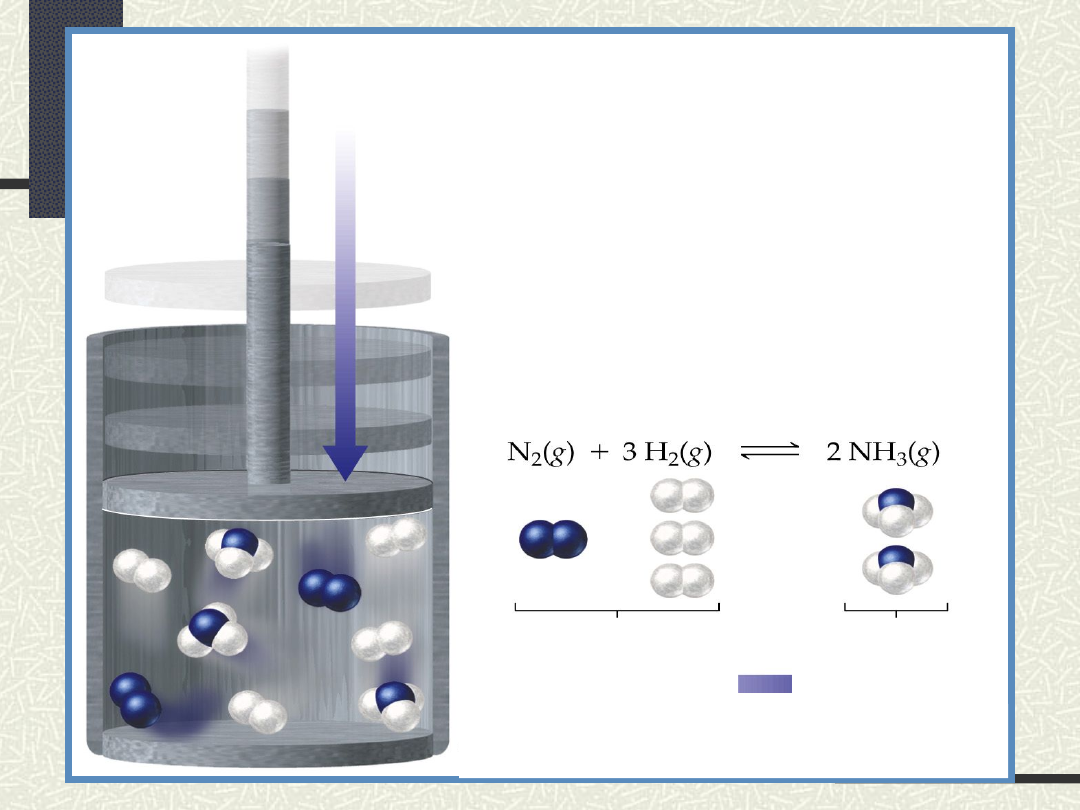
Zmiana ciśnienia wywiera wpływ na
kierunek reakcji jedynie wtedy, gdy
liczba moli produktów reakcji jest
różna od liczby substratów np.:
N
2
+O
2
2NO
N
2
+3H
2
2NH
3
N
2
O
4
2NO
2
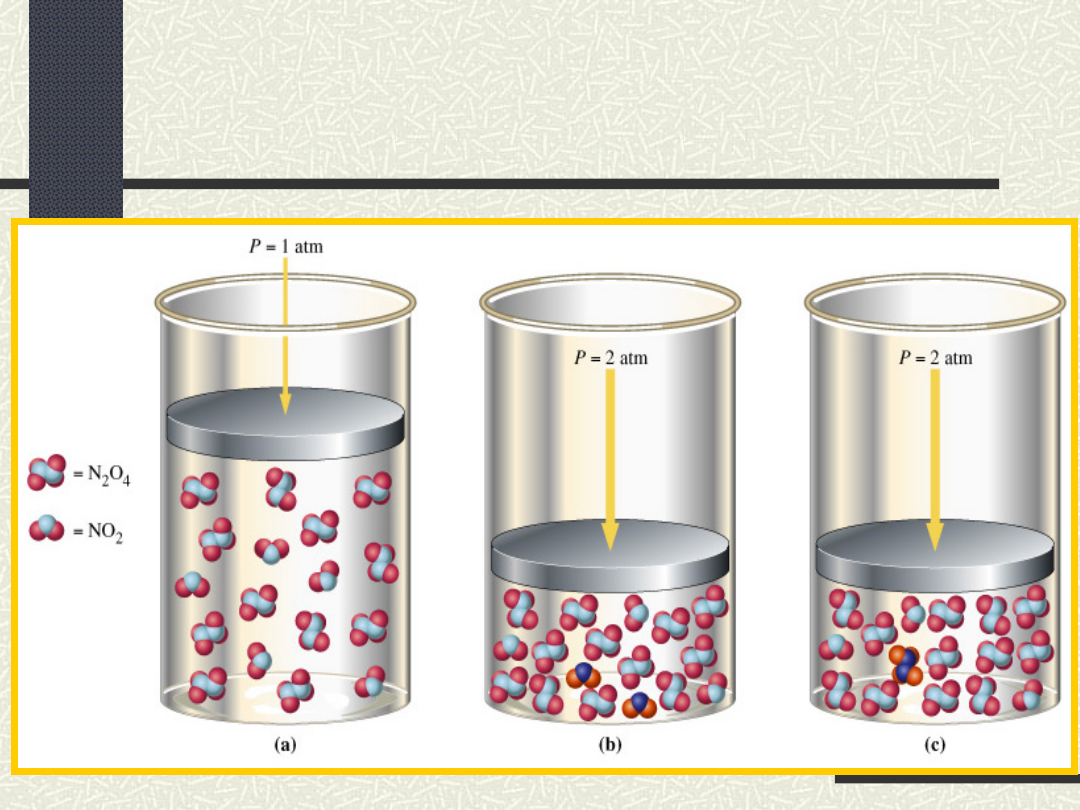
N
2
O
4
2NO
2
4 mole
gazów
2 mole
gazów
Obniżenie ciśnienia
Przesunięcie
położenia stanu
równowagi w
lewo
Zwiększenie
ciśnienia
4 mole
gazów
2 mole
gazów
Przesunięcie położenia stanu
równowagi w lewo
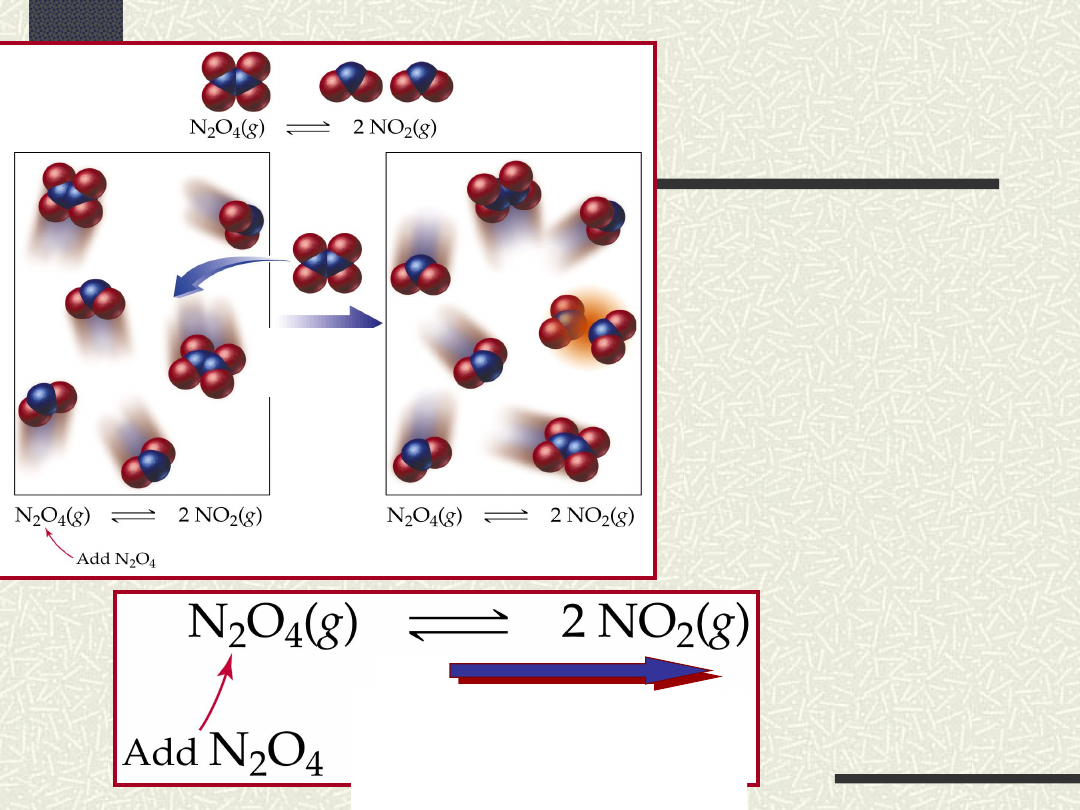
Wpływ
Wpływ
zmiany
zmiany
stężenia
stężenia
na stan
na stan
równowagi
równowagi
przesunięcie
położenia stanu
równowagi w prawo
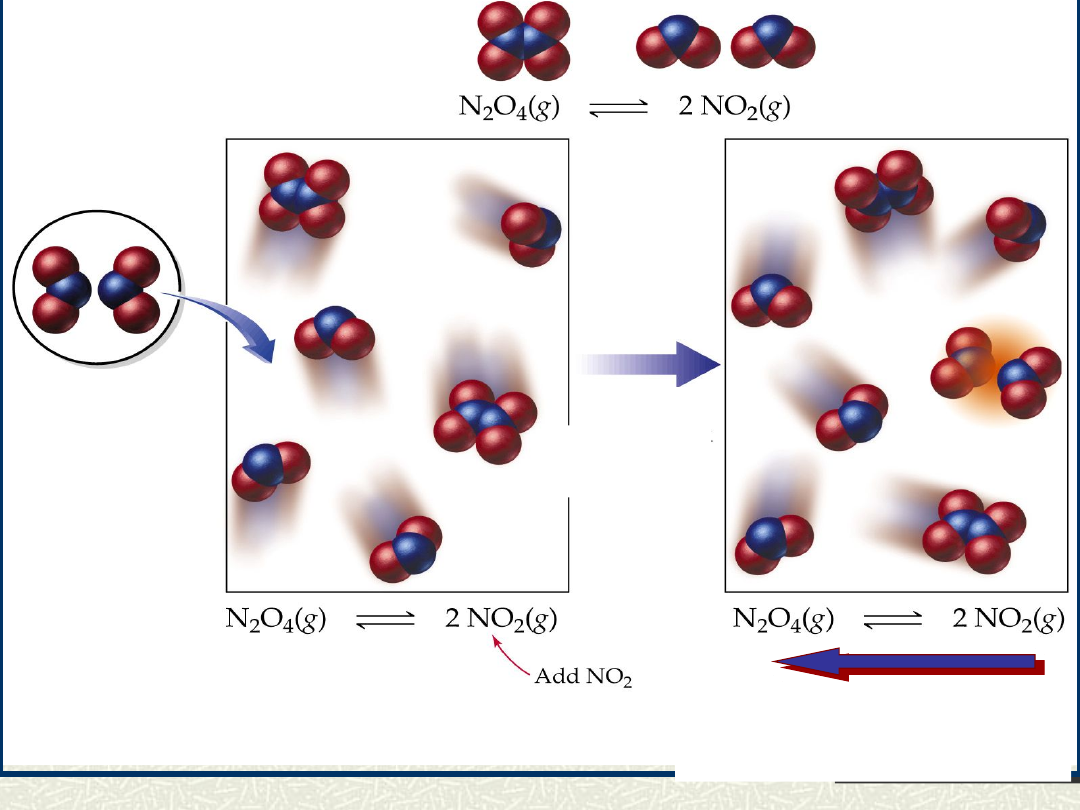
przesunięcie
położenia stanu
równowagi w lewo

A – stała charakterystyczna dla danej
reakcji
Q – ciepło reakcji
R – stała gazowa
T – temperatura
Wpływ temperatury
na stan równowagi
RT
Q
A
K
ln
Wpływ temperatury na stan równowagi
REAKCJE EGZOTERMICZNE
nA + mB rC + qD +
Q
nA + mB rC + qD +
Q
v
1
= k
1
.
C
a
n
.
C
B
m
v
2
= k
2
.
C
C
p
.
C
D
q
nA + mB rC + qD + Q
nA + mB rC + qD + Q
podwyższenie
temperatury
nA + mB rC + qD + Q
nA + mB rC + qD + Q
obniżenie
temperatury
C
C
C
C
p
p
.
.
C
C
D
D
q
q
C
C
A
A
n
n
.
.
C
C
B
B
m
m
K =
K =

Wpływ temperatury na stan równowagi
REAKCJE ENDOTERMICZNE
nA + mB rC + qD +
Q
nA + mB rC + qD +
Q
v
1
= k
1
.
C
a
n
.
C
B
m
v
2
= k
2
.
C
C
p
.
C
D
q
nA + mB rC + qD - Q
nA + mB rC + qD - Q
podwyższenie
temperatury
nA + mB rC + qD - Q
nA + mB rC + qD - Q
obniżenie
temperatury
C
C
C
C
p
p
.
.
C
C
D
D
q
q
C
C
A
A
n
n
.
.
C
C
B
B
m
m
K =
K =


Utlenianie
utrata elektronów przez związek
ulegający utlenieniu
2Zn + O
2
2ZnO
2Mg + O
2
2 MgO
Zn + S ZnS
Redukc
ja
pobieranie elektronów przez związek
ulegający
redukcji
utleniacz
elektrobiorca
reduktor
elektronodawca
PROCESY OKSYDACYJNO - REDUKCYJNE
Procesowi utleniania towarzyszy zawsze
proces redukcji i odwrotnie
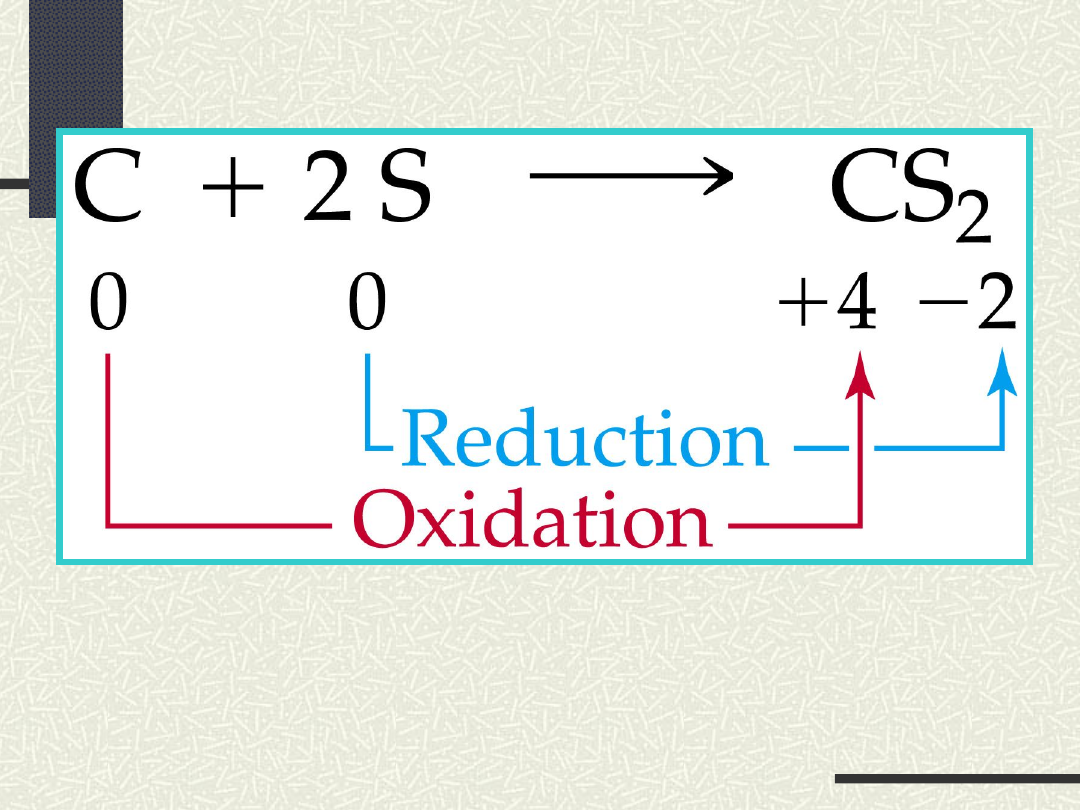
Schemat reakcji redoks
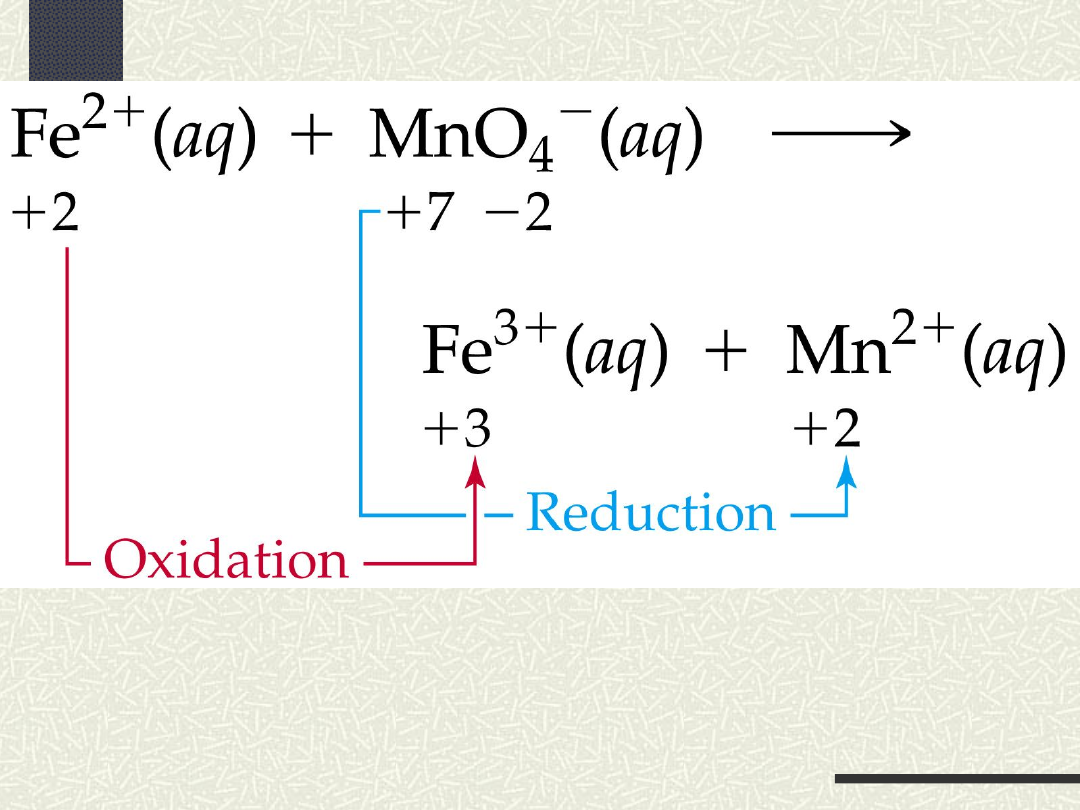
Schemat reakcji redoks

Stopień utlenienia
- liczba
dodatnich lub ujemnych ładunków
elementarnych, jakie
przypisalibyśmy atomom
pierwiastka, gdyby cząsteczka w
skład której wchodzi miała tylko
wiązania jonowe.
Utlenianie - proces, w którym stopień
utlenienia wzrasta
Utleniacz - substancja, w której stopień
utlenienia maleje
Redukcja - proces, w którym stopień utlenienia
maleje
Reduktor - substancja, której stopień utlenienia
rośnie
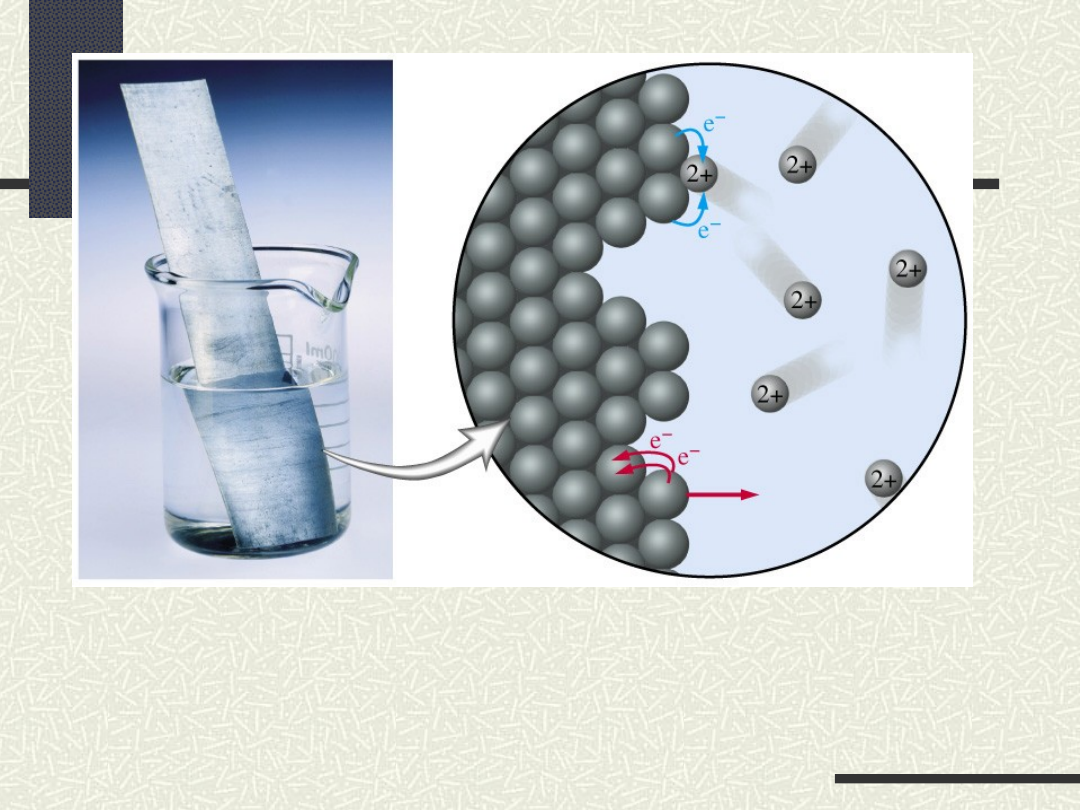
Schemat procesu utleniania i
redukcji

Najczęściej stosowanymi
utleniaczami są:
1. anoda podczas elektrolizy
2. chlorowce
3. chlorany
4. związki manganu na +VI i +VII stopniu
utlenienia
5. związki chromu na +VI stopniu utlenienia
6. stężony kwas siarkowy VI
7. kwas azotowy V i jego sole
8. ozon, tlen, nadtlenek wodoru, nadtlenki
metali
9. jony metali szlachetnych
10. łatwo redukujące się tlenki

1. Katoda podczas elektrolizy
2. Wodór
3. Węgiel i tlenek węgla II
4. KI, HBr, HCl
5. Sole cyny II i żelaza II
6. Siarkowodór, kwas siarkowy IV i jego
bezwodnik
Najczęściej stosowanymi reduktorami są:

Właściwości redoks innych
substancji:
1. Gazy szlachetne - chemicznie nieaktywne
2. Jony metaloidów o bardzo wysokim stopniu
utlenienia - utleniacze
3. Jony dodatnie metali i metaloidów o
pośrednim stopniu utlenienia - w zależności
od reagenta - utleniacze lub reduktory
2Fe Cl
2
+ Cl
2
2 FeCl
3
FeO + CO Fe + CO
2

Właściwości redoks innych substancji:
4. Atomy metaloidów - w zależności od
reagenta - utleniacze lub reduktory
Fe + S FeS
S + O
2
SO
2
5. Atomy metali - typowe reduktory
6. Ujemne jony metaloidów - reduktory
2 HI + S H
2
S + I
2
7. Atomy wodoru - reduktory
CuO + H
2
Cu + H
2
O

Metal aktywniejszy redukuje metal mniej
aktywny
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
Wyszukiwarka
Podobne podstrony:
9 wykad Ukady dyspersyjne [F] 2006
15 wykad ukad okresowy[F]2006
23 wykad 13 gr[1] borowce[F]2006
9 wykad Ukady dyspersyjne [F] 2006
6 wykad WiĄzania chemiczne[F]
9 wykad Ukady dyspersyjne [F] 10 2008
10 Kinetyka chemicznaid 10897 ppt
10 Kinetyka chemiczna i kataliza
12 wykad roztwory buforowe [F]2006
25 wykad 15 gr azotowce 01 2006[F]
6 wykad WiĄzania chemiczne[F]
więcej podobnych podstron