
Beata Ostrowska
Twoja matura Chemia
3
Spis treci
:VWS .................................................................................................................................................6
I.
Budowa atomu i promieniotwórcz
Rü
Poziom
podstawowy .............................................................................................................. 15
Poziom
rozszerzony ............................................................................................................... 18
II.
=PLDQ\ZáDFLZRFLSLHUZLDVWNyZQDWOHXNáadu okresowego
Poziom
podstawowy .............................................................................................................. 24
Poziom
rozszerzony ............................................................................................................... 26
III.
:L]DQLDFKHPLF]QH
Poziom
podstawowy .............................................................................................................. 29
Poziom
rozszerzony ............................................................................................................... 31
IV
5HDNFMHFKHPLF]QHL]MDZLVNDIL]\F]QHZáDFLZRFLVXEVWDQFMLchemicznych
Poziom
podstawowy .............................................................................................................. 35
Poziom
rozszerzony ............................................................................................................... 41
V.
6]\ENRüUHDNFMLFKHPLF]QHM5HDNFMHNDWDOLW\F]QH
Poziom
podstawowy .............................................................................................................. 46
Poziom
rozszerzony ............................................................................................................... 50
VI. Równowaga chemiczna
Poziom
rozszerzony ............................................................................................................... 54
VII.
5R]SXV]F]DOQRü5RG]DMHUR]WZRUyZ
Poziom
podstawowy .............................................................................................................. 58
Poziom
rozszerzony ............................................................................................................... 60
VIII.
2EOLF]HQLD]Z\NRU]\VWDQLHPSRMFLDPRO
Poziom
podstawowy .............................................................................................................. 68
Poziom
rozszerzony ............................................................................................................... 70
IX.
6W*HQLHSURFHQWRZHLVW*HQLHPRORZHUR]WZRUX
Poziom
podstawowy .............................................................................................................. 73
Poziom
rozszerzony ............................................................................................................... 75
X.
Dysocjacja jonowa. Reakcje w roztworach elektrolitów
Poziom
podstawowy .............................................................................................................. 78
Poziom
rozszerzony ............................................................................................................... 82

Twoja matura Chemia
Beata Ostrowska
4
XI.
Tlenki, kwasy, zasady i sole
Poziom
podstawowy ............................................................................................................ 93
Poziom
rozszerzony............................................................................................................. 97
XII. Reakcje
redoks
Poziom
podstawowy .......................................................................................................... 101
Poziom
rozszerzony........................................................................................................... 104
XIII. Elektrochemia (ogniwa, elektroliza, korozja)
Poziom
rozszerzony........................................................................................................... 107
XIV. Us
WDODQLHZ]RUyZ]ZL]NyZchemicznych
Poziom
podstawowy .......................................................................................................... 113
Poziom
rozszerzony........................................................................................................... 116
XV.
:JORZRGRU\LLFKMHGQRIXQNF\MQHSRFKRGQH
Poziom
podstawowy .......................................................................................................... 121
Poziom
rozszerzony........................................................................................................... 129
XVI.
:LHORIXQNF\MQHSRFKRGQHZJORZRGRUyZ
Poziom
podstawowy .......................................................................................................... 134
Poziom
rozszerzony........................................................................................................... 138
XVII.
&KHPLDLMHMZSá\ZQDNV]WDáWRZDQLHURGRZLVNDRUD]MHJRRFKURQ
Poziom
podstawowy .......................................................................................................... 142
Poziom
rozszerzony........................................................................................................... 145
XVIII.
&KHPLDGRZLDGF]DOQD
Poziom
podstawowy .......................................................................................................... 146
Poziom
rozszerzony........................................................................................................... 148
XIX.
&KHPLDZ*\FLXcodziennym
Poziom
podstawowy .......................................................................................................... 151
Poziom
rozszerzony........................................................................................................... 153
XX.
Zadania z fragmentem tekstu popularnonaukowego
Poziom
podstawowy .......................................................................................................... 160
Poziom
rozszerzony........................................................................................................... 162
2GSRZLHG]LGR]DGD .................................................................................................................... 165
Tablice ........................................................................................................................................... 217

Beata Ostrowska
Twoja matura Chemia
5

Twoja matura Chemia
Beata Ostrowska
6
Wstêp
!
" # $a-
% * $
% * z co
najmniej jednego przedmiotu do wyboru (biologia, chemia, fizyka i astronomia, geografia, historia, wiedza
o
# # %! &
z
* ' ( )g-
zaminacyjne.
) # ! ** o-
wym lub rozsze
! + !
) , ! "
obejmuj
# # # (Arkusz I).
) # -
1)
, arkusza egzami-
nacyjnego jak na poziomie podstawowym (Arkusz I),
2)
c
, #
# # o-
# # #
i rozszerzonego (Arkusz II).
" * * # ! Wtedy musi jednak zda-
! +
## $ ' ( )i-
nacyjna). Pozytywny wynik egzaminu to uzyskanie co najmniej 30% punktów za poprawne odpowiedzi do
z poziomu podstawowego.
& ./ – chemia” jest przeznaczony przede wszystkim dla uczniów,
# !
W prezentowanym
# #
uczniom i na
#! &
Podstawy programowej # zawartych
w
! 0 # Podstawy programo-
wej z chemii dla szkól ponadgimnazjalnych
.
' # de wszystkim zadania rachunko-
! + * # d-
gimnazjalnych do zdawania egzaminów na akademie medyczne. Brakuje natomiast propozycji prezentuj
1
# !-
!
analizy danych fizykochemicznych przedstawionych w postaci tabel i wykresów,
!
!
konstrukcji wykresów,
!
analizy tekstów popularnonaukowych,
!
# * !
& !

Beata Ostrowska
Twoja matura Chemia
7
Podstawa programowa z chemii dla szkó³ ponadgimnazjalnych
²²
poziom podstawowy
Cele edukacyjne
1.
0 ## ## !
2.
2 # w * !
3.
3
do
#!
1.
( #!
2.
z przeprowadzonych eksperymentów
i
.
3.
+ #!
4.
& *# ( !
5.
( # # o-
wiska naturalnego.
1.
+ ! 4! & .
2.
0* * i ich
.
3.
0* # ## #!
4.
# ! 4 #! e-
akcje syntezy, analizy i wymiany.
5.
Mol. Molowa interpretacja p
##! ' !
6.
5 ##!
7.
Reakcje endo- i egzoenergetyczne.
8.
Proste reakcje utleniania-
# * !
9.
! 5 * * – st*
i molowe.
10.
Dysocjacja elektrolityczna. Reakcje w roztworach wodnych elektrolitów –
i
!
11.
+ # !
12.
+ – !
13.
' !
14.
6 # – !
15.
7* # – o-
wanie
# * !
16.
8# * # ! & o-
# ## * # !
1.
3 ## #
na ich przebieg.
2.
2 # * .
3.
2 *# ( !
literatury popularnonaukowej i Internetu.
Twoja matura Chemia
Beata Ostrowska
8
4.
2 ostych reakcji chemicznych oraz opisywania efektów energe-
tycznych im to
#.
5.
& #.
6.
2 # ##.
7.
0 *# ## # a-
nia.
Podstawa programowa z chemii dla szkó³ ponadgimnazjalnych
²²
poziom rozszerzony
Cele edukacyjne
1.
& # !
2.
+ realizacji prac eksperymentalnych oraz interpretacji
otrzymanych wyników.
3.
+ # u-
ralnego.
1.
+ *#
(ó!
2.
+* # !
3.
0
# !
4.
Przygotowanie uczniów do projektowania bada
# a-
wie zdobytej wiedzy chemicznej i z dziedzin pokrewnych.
1.
+ – elementy mechaniki kwantowej w ! 4o-
topy. Promienio
sztuczna.
2.
U
! 0* t-
ków i
# * ! " !
3.
+ ! 0* 1
## # !
4.
#! 5 ! !
5.
Mol. Molowa interpretacja przemian chemicznych. Równanie Clapeyrona. Warunki normalne
i standardowe.
6.
5 ##! !
7.
Reakcje endo- i egzoenergetyczne. Katalizatory i
#!
8.
Reakcje utleniania-redukcji. Ogniwa galwaniczne i ich zastosowania.
9.
SEM ogniwa. Elektroliza roztworów wodnych elektrolitów i soli stopionych.
10.
Prawa elektrolizy. Korozja elektrochemiczna i metody jej zapobiegania.
11.
! ! & * ! 2 !
12.
5 #! / sole – nazewnic-
!
13.
8# *# !
0 grupach i okresach.
Beata Ostrowska
Twoja matura Chemia
9
14.
) ! 5 ! & ' 9
(! roztworach wodnych elektrolitów –
i hydrolizy. Amfote
!
15.
+ aromatyczne – nazewnictwo i ! 5 #o-
logiczny. Izomeria konstytucyjna i geometryczna.
16.
+ przyrodzie. Przeróbka ropy naftowej.
17.
6 # ! "# # r-
boksylowe i ich pochodne – budowa, nazewnictwo, otrzymywanie i
!
18.
+ # ! " *o-
* e – #
w
* !
19.
0 ! 8#!
20.
Polimeryzacyjne tworzywa sztuczne – budowa i zastosowanie.
21.
( ciwego wykorzystywania substancji chemicznych.
1.
0 # zjawisk chemicznych.
2.
2 *# # #e-
#! 3 w i * # sposobie reagowania pierwiast-
ków w ob
*# ##!
3.
2 * y-
mi i chemicznymi.
4.
2 *# a-
chunkowych, teoretycznych i praktycznych:
1)
#
2)
#
3)
# #
4)
wykorzystywanie
# ( !
5.
2 # ## planowania ekspery-
mentów dla ich weryfikacji.
6.
5 s # podanych in-
formacji.
7.
2 *# ( celu rozszerzenia posiadanej wiedzy.
Standardy wymagañ egzaminacyjnych
5 a egzaminu maturalnego z chemii b-
szary:
I.
+i i rozumienie.
II.
Korzystanie z informacji.
III.
Tworzenie informacji.
+ # * &d-
! & !
Podpunkty o
-
•
# *
•
rodzaje informacji do wykorzystania,
Twoja matura Chemia
Beata Ostrowska
10
•
typy i rodzaje informacji do tworzenia.
Schemat ten dotyczy poziomu podstawowego i rozszerzonego.
& * # #
* ) Narodowej i Sportu z dnia 10 kwietnia 2003 r. z
ro
#
i egzaminów.
I. Wiadomoci i ich rozumienie
0 zjawiska:
POZIOM PODSTAWOWY
POZIOM ROZSZERZONY
1)
! " " zjawiska chemiczne,
"# !# !$ !
zwi
%
a)
$ ! opami i "!
b)
! !znymi,
c)
molem substancji chemicznej,
d)
pierwiastkami i
! hemicznymi,
e)
typami reakcji chemicznych,
f)
roztworami wodnymi i
*!
g)
! $
i
h)
reakcjami utleniania i redukcji,
i)
#! ich pochodnymi,
1)
jak na poziomie podstawowym oraz:
a)
$ ! ja! !chaniki
"! "!
b)
$ !z
c)
! !
d)
! !
zacho
! roztworach wodnych,
e)
ogniwami galwanicznymi i el
f)
szeregiem homologicznym,
g)
! #anicznych,
2)
" * "tków
i
! ania:
a)
chemiczne metali i niemetali
(sodu, potasu, magnezu, wapnia, glinu, c
*a-
za, miedzi, wodoru, tlenu, azotu, chloru, bromu, w
&
gla, krzemu, fosforu, siarki),
b)
w
chemiczne tlenków wymie-
nionych w podpunkcie a) metali i niemetali, wodor-
ków niemetali (tlenu, azotu, chloru, bromu, siarki),
* zasad, kwasów i #o-
rów i ich pochodnych,
c)
zastosowania poznanych substancji chemicznych
i
#* " ! o-
rzystaniem,
2)
jak na poziomie podstawowym oraz:
a)
chemiczne metali (chromu,
manganu, srebra),
b)
chemiczne tlenków wymie-
nionych w podpunkcie a) metali, wodorków, wodoro-
tlenków, kwasów i soli,
# ich po-
chodnych,
3)
" procesy chemicz-
ne:
a)
zapisuje równania reakcji chemicznych w formie
cz
steczkowej i jonowej,
b)
" eakcji
chemicznych,
c)
opisuje efekty energetyczne przemian,
d)
" "$#
chemicznych.
3)
jak na poziomie podstawowym.

Beata Ostrowska
Twoja matura Chemia
11
II. Korzystanie z informacji
0 rzystuje i przetwarza informacje:
POZIOM PODSTAWOWY
POZIOM ROZSZERZONY
1)
odczytuje i analizuje informacje przedstawione
w formie:
a)
tekstu o tematyce chemicznej,
b)
tablic chemicznych, tabeli, wykresu, schematu, ry-
sunku,
1)
jak na poziomie podstawowym,
2)
" $ ! " alizy
tablic chemicznych, tabeli, wykresu, schematu, ry-
sunku i tekstu,
2)
jak na poziomie podstawowym,
3)
selekcjonuje, porównuje informacje,
3)
jak na poziomie podstawowym,
4)
" ! # " asad:
a)
konstruuje schematy, rysunki, tabele, wykresy,
b)
! " " $ "e-
sów,
4)
jak na poziomie podstawowym,
5)
wykonuje obliczenia chemiczne:
a)
! " ! $ !owej,
b)
stechiometryczne,
c)
*! "! *!
molowym roztworu.
5)
jak na poziomie podstawowym oraz:
a)
"! przemianami promieniotwór-
czymi,
b)
z zastosowaniem warunków standardowych
i warunków normalnych,
c)
" "! *
d)
'( # az z zastosowaniem praw
elektrolizy,
e)
# stopniem dyso-
"! ) "*
f)
$ !
g)
! #! "emian.
III. Tworzenie informacji
Zda
interpretuje informacje:
POZIOM PODSTAWOWY
POZIOM ROZSZERZONY
1)
* "-skutkowe
w
% "$ * o
" * ! $ $
a
iami oraz przemian chemicznych,
1)
jak na poziomie podstawowym,
2)
planuje typowe eksperymenty i przewiduje obserwa-
cje,
2)
planuje eksperymenty i przewiduje obserwacje,
3)
" ! ! + 3)
" ! !
i uzasadnia opinie.

Twoja matura Chemia
Beata Ostrowska
12
Wskazówki dla rozwi¹zuj¹cych testy maturalne z chemii
0 * 1
! & , a w drugich od(
onuje wyboru poprawnej odpowiedzi.
3 # - - !
Zadanie-rozprawka (IV 1 r)
0 w-
## ( ##! & ( w-
! '( # #
w tzw. kluczu odpowiedzi
! /
z polecenia.
Zadanie krótkiej odpowiedzi (III 1 r)
0 # e-
matycznego lub kilku zda
! 6 * * (!
0 $4 %
+ # ( #! Zada-
nie m
! ** e # r-
czym,
## lub # #
chemicznych substancji.
3 # - typu
prawda-
! 0
wykonana oraz od
# # #!
Zadanie wielokrotnego wyboru (IV 17 p)
0 wskazania jednej pop #!
Zadanie na dobieranie (XVI 7 r, XVII 3 p)
Zadanie
# ## ! 0aniem
# tak , logi
wyra
* ##!
Zadanie typu prawda-
$:; , %
6 ! +
jest prawdziwe,
! 0 * prawdo odg o-
wiedzi (50%) zadania te s
rzad # #
chemii.
& # (
! + ! 81
* a-
! 7 a odpowiedzi? Oto kilka
wskazówek:
'
+ ko ! + a-
# ( # #e-
!
'
& #-
ócony.
0 -
Na
+
+ OH
í
+ H
+
+ Cl
í
→
Na
+
+ Cl
í
+ H
2
O
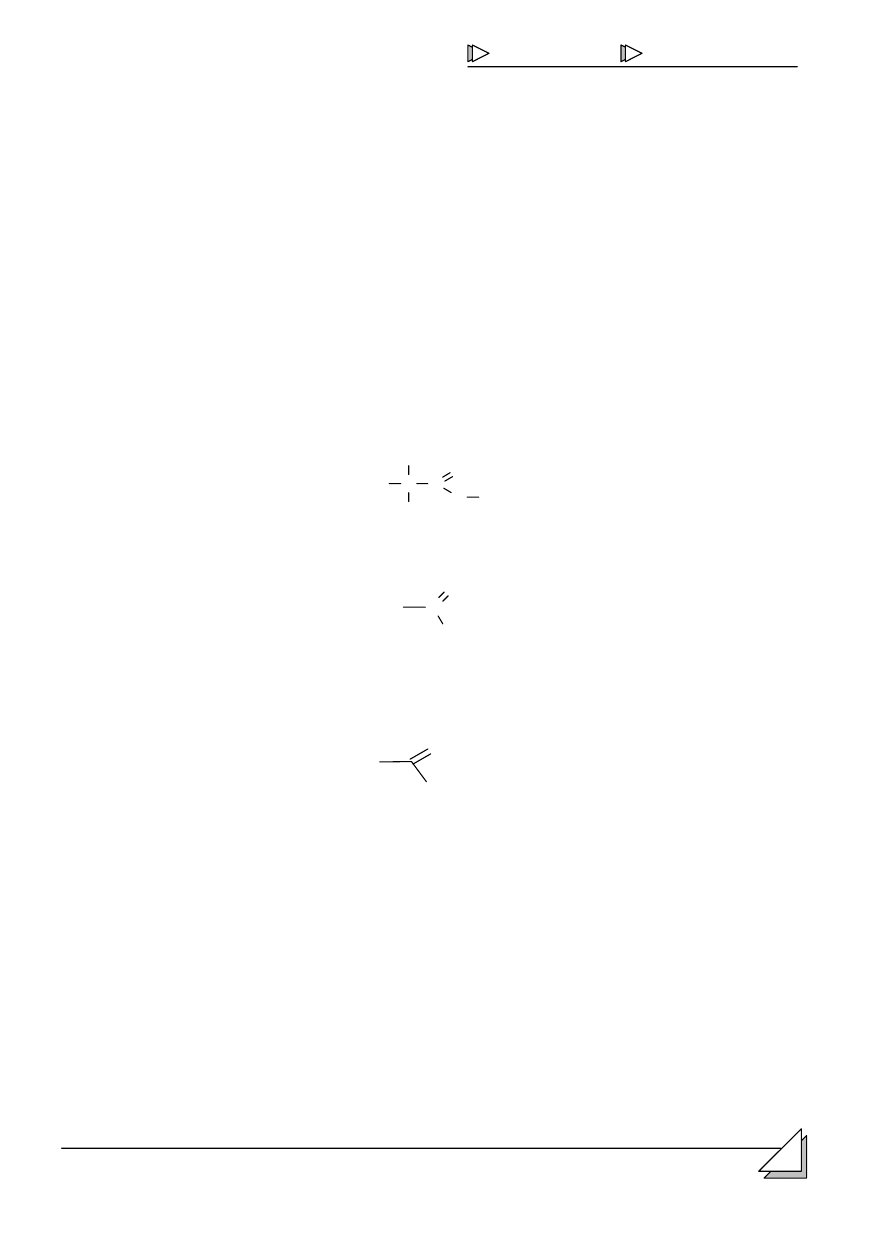
Beata Ostrowska
Twoja matura Chemia
13
−
HCl
0 -
H
+
+ OH
í
→
H
2
O
0 -
NaOH + HCl
→
NaCl + H
2
O
'
Ni
# * ! 5#
skrócona forma zapisu przemiany chemicznej.
Schemat reakcji chlorowania metanu:
&O
&+
&+
Kí
&O
→
Równanie rekcji chlorowania metanu:
+&O
&O
&+
&O
&+
Kí
+
→
+
'
+ # # #
#- !
Wzór strukturalny (kreskowy) kwasu etanowego:
C
H
H
H
C
O
O H
+ lny kwasu etanowego:
C
O
H
O
C
H
3
Wzór skrócony:
CH
3
COOH
Wzór szkieletowy kwasu etanowego:
O
O
H
'
< # - y-
czajowa czy systematyczna, np.
nazwa zwyczajowa – kwas octowy,
nazwa systematyczna – kwas etanowy.
'
+ # ## 8
wyniku.
'
+ # #!
* * „Twoja matura – chemia” pozwoli uczniom jak najlepiej
*# ,
a
dopiecznymi.
Autorka

Twoja matura Chemia
Beata Ostrowska
14
Beata Ostrowska
Twoja matura Chemia
15
I. Budowa atomu i promieniotwórczoæ Poziom podstawowy
I.
Budowa atomu i promieniotwórczoæ
Poziom podstawowy
1.
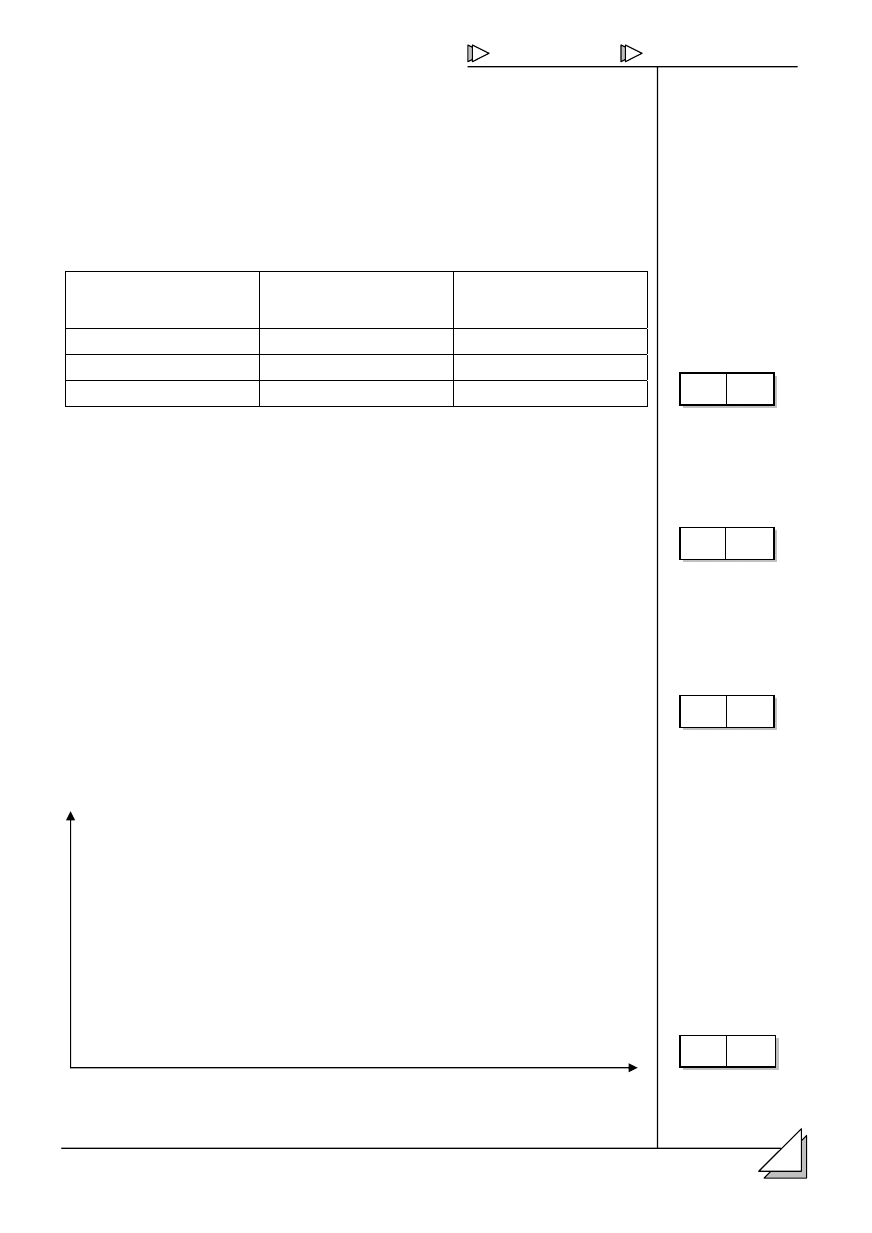
2 podan # oraz #
ików atomu.
1D]ZD F]VWNL
elementarnej
Masa [u]
àDGXQHN HOHPHQWDUQ\
proton
0
–1
2.
' # # romieniotwór-
czych.
0J
→
.....
+
e
0
1
−
&U
→
.....
+
e
0
1
3X
→
.....
+
α
3.
+
Pb
210
82
- ¯ ,
¯ ,
α
,
α
! 6 = 8 izotop o =
Skorzystaj z odpowiednich tablic chemicznych.
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
4.
7 * # N
o
= 20·10
6
od okresu
pó
trwania dla
τ
= 5 jednostek czasu. Omów jego przebieg.
Charaktery
adowe
atomu.
0-3 p.
0-2 p.
0-4 p.
podstawie znanej
*
e-
mian promieniotwór-
czych.
naturalnej przemiany
0-3 p.
Twoja matura Chemia
Beata Ostrowska
16
I. Budowa atomu i promieniotwórczoæ Poziom podstawowy
5.
6 =
8
→
7K
→
3D
→
$F
→
)U
→
5D
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
6.
Zapisz informacj
# ,
X
A
Z
.
a)
> #
b)
atom tlenu, w którym liczba protonów i neutronów jest jednakowa
c)
ato
a)
_____________________________________________________________
b)
_____________________________________________________________
c)
_____________________________________________________________
7.
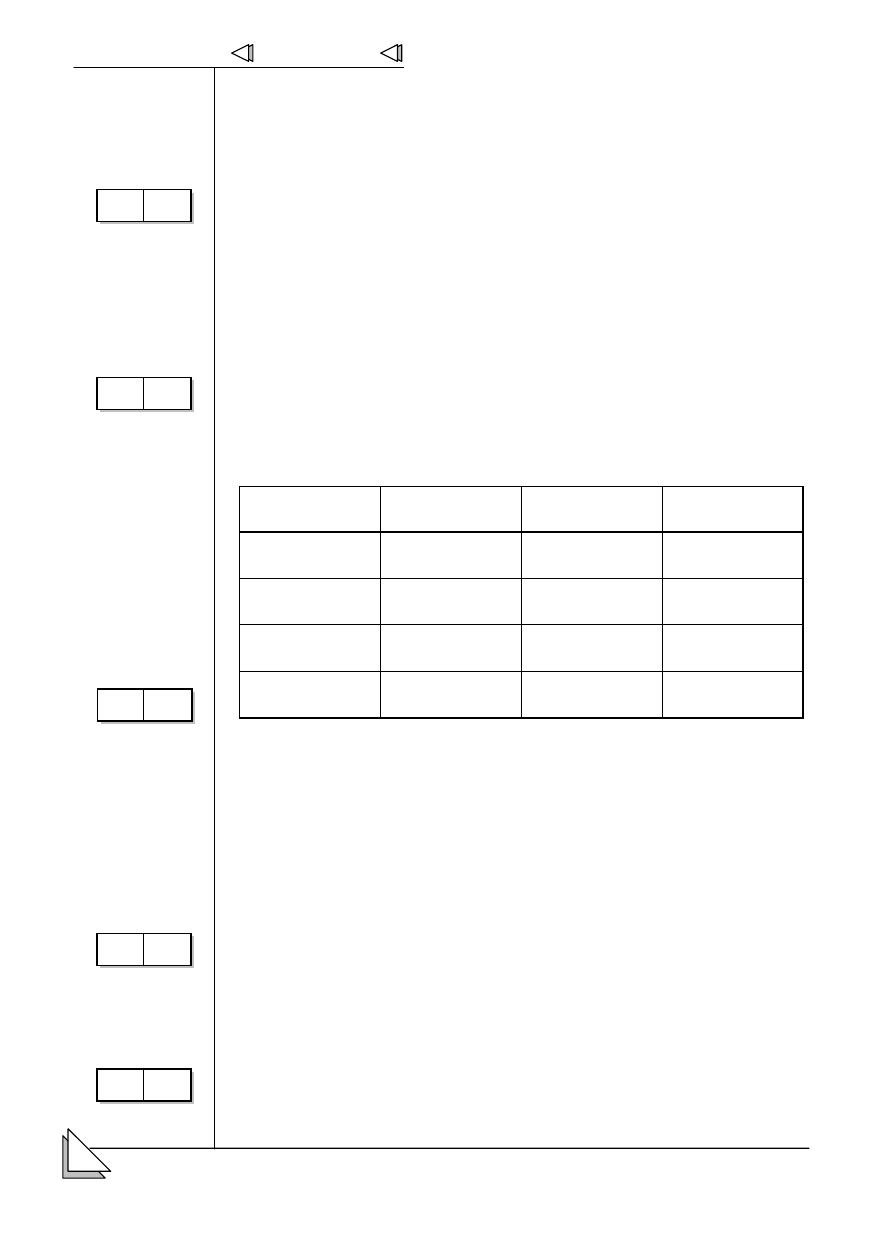
7 # e-
mentarnych.
Symbol drobiny
Liczba protonów
Liczba
elektronów
Liczba neutronów
19 18 20
17 18 20
41 36 52
27 27 32
8.
& d-
# $,?% # # Z = 10, 14, 16, 19.
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
' # # !
Z = 10 _____________
Z = 14 _____________
Z = 16 _____________
Z = 19 _____________
0-2 p.
Z
symbol
atomo
i
.
atomów i jonów na
podstawie podanej
elementarnych.
przemiany
promieniotwórczej na
substratu i produktu.
0-4 p.
elektronowe
pierwiastków
o podanych liczbach
atomowych.
0-4 p.
elektronów
walencyjnych na
podstawie konfiguracji.
0-4 p.
0-3 p.

Beata Ostrowska
Twoja matura Chemia
17
I. Budowa atomu i promieniotwórczoæ Poziom podstawowy
9.
& # # * rubidu
z
# $(@*?%.
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
10.
7 e-
nu, wapnia, bromu, sodu.
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
11.
& :
1s
2
2s
2
2p
5
.
Na jakich stop-
niach utlenienia mo
* # #micznych?
a) tylko +II
b) tylko +V
c) +II, +V i +VII
d) tylko –I
12.
Pierwiastek o konfiguracji elektronowej [Ne]3s
2
3p
4
* # chemicz-
# -
a) tylko –II
b) –II, +IV, +VI
c) od +II do +VI
d) tylko +IV
pierwiastka na
helowca.
0-1 p.
utlenienia pierwiastka
na podstawie
konfiguracji.
utlenienia pierwiastka
na podstawie podanej
konfiguracji
elektronowej.
0-4 p.
0-4 p.
0-1 p.
utlenienia pierwiastka
na podstawie podanej
konfiguracji
elektronowej.

Twoja matura Chemia
Beata Ostrowska
&
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
Budowa atomu i promieniotwórczoæ
Poziom rozszerzony
1.
7
2
z
&
cz
stek
α
oraz równanie jego rozpadu na
1
.
_______________________________________________________________________
2.
Astat
At
211
85
otrzymano przez bombardowanie
%L
α
. Napisz równa-
*
ementarne.
___________________________________________________________________
3.
J
jakiego izptopu * * *
w wyniku tej prze
*
3
oraz neutron?
___________________________________________________________________
4.
+ er
/L
protone
in-
nego lekkiego pierwiastka i neutron (w przeliczeniu na jeden atom litu). Jakie to j
1
dra? Napisz równanie przemiany promieniotwórczej.
___________________________________________________________________
5.
+
&O
neutrona
! J
jakie
? Napisz równanie przemiany promieniotwórczej.
___________________________________________________________________
6.
+
1
# iony proton. J
jakiego izotopu
= 7 !
___________________________________________________________________
7.
&
8
%D
i
.U
.
6 * = 7
promieniotwórczej.
___________________________________________________________________
8.
Technet
%.
: e-
ronami
'
! + ! 6 -
dowi? Napisz równanie przemiany promieniotwórczej.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
0-2 p.
0-1 p.
0-1 p.
0-1 p.
0-1 p.
0-1 p.
0-1 p.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
przemian
promieniotwórczych.
0-1 p.
przemian
promieniotwórczych.
0-1 p.
przemian
promieniotwórczych.

Beata Ostrowska
Twoja matura Chemia
'
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
9.
' izotopu radonu-222 wynosi 4 dni. Oblicz, ile radonu
znaj
,A # ,A !
10.
' izotopu uranu-238 wynosi
τ
U
= 4,5·10
9
! 2
! 6 a-
dów radu, którego
τ
Ra
= 1,6·10
3
lat?
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
11.
(
8
jest
3E
! 4
¯ i
α
zostanie wypromieniowanych w czasie tego rozpadu?
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
12.
' # e-
# !
Odp.
promieniotwórczej na
podstawie czasu
0-2 p.
0-2 p.
!
dane fizykochemiczne
i na tej podstawie
0-2 p.
przemiany
promieniotwórczej na
substratu i produktu.
Odp.
promieniotwórczego na
podstawie podanego
0-2 p.
Twoja matura Chemia
Beata Ostrowska
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
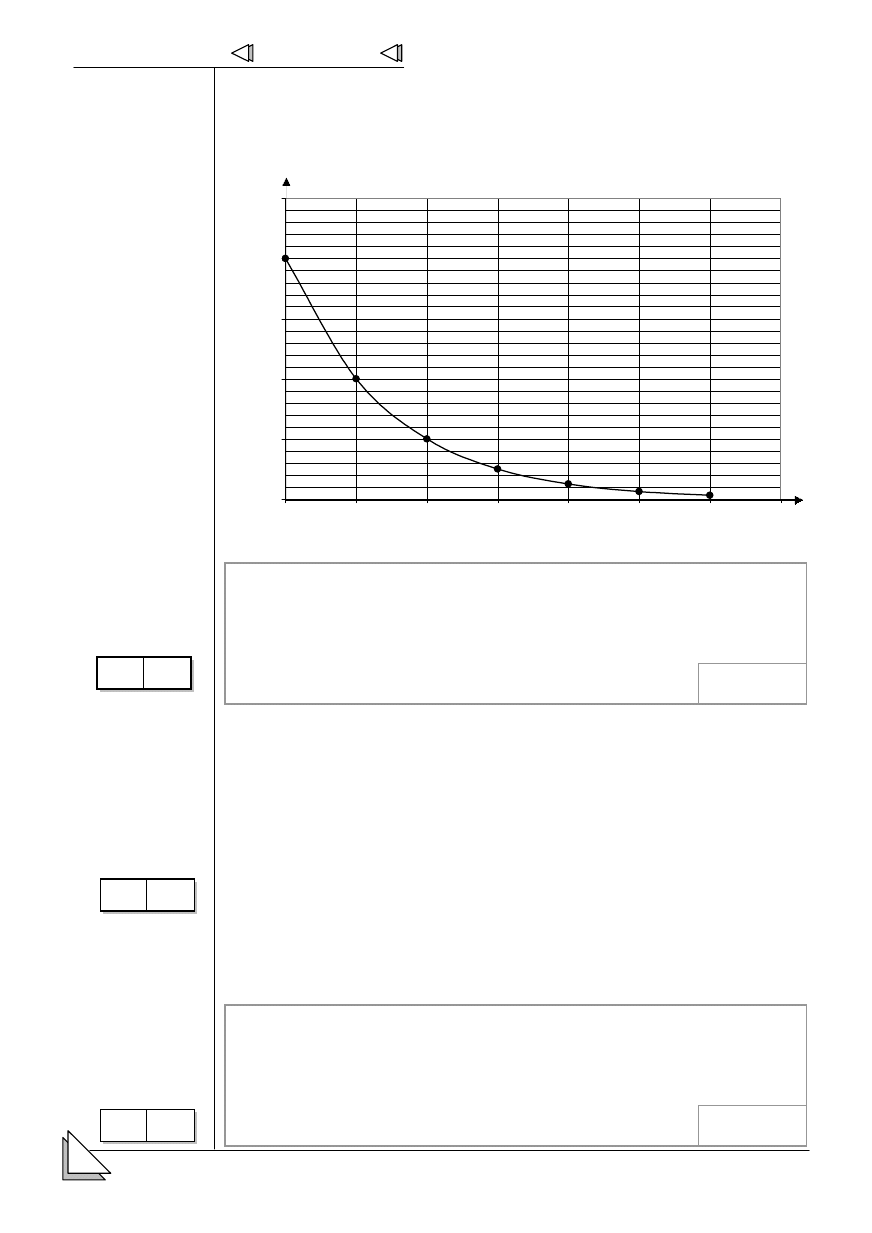
13.
+ * der atomu pierwiastka promieniotwórczego
! '
zaniku,
dni.
2
1
0,5
0,25
0,0313
0,0625
0,125
0
0,5
1
1,5
2
2,5
0
100
200
300
400
500
600
700
14.
Wiek wykopal
## * ! !
' *
14
C wynosi
5730 lat. Oszacuj wiek znaleziska,
*
* ,B *
promieniowania znaleziska archeologicznego.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
15.
' #
o liczbach masowych: 24 (78,6%), 25 (10,11%), 26 (11,29%). Odszukaj ten pier-
!
Odp.
Odp.
0-2 p.
0-2 p.
procentowego
izotopowego.
promieniotwórczego na
podstawie wykresu
*
promieniotwórczego.
0-3 p
.
W
enia
z wykorzystaniem
owicznego
zaniku izotopu.
Beata Ostrowska
Twoja matura Chemia
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
16.
& #
izotopów, z których jeden ma 44 neutrony, a drugi 46. Masa atomowa pierwiastka
wynosi 79,90 u. Liczba atomowa tego pierwiastka wynosi 35.
17.
& C> ,stanowi-
# # B , a drugi 50. Masa
atomowa pierwiastka wynosi 85,47 u.
18.
' izotopy:
206
Pb,
207
Pb,
208
Pb. Ostatni z izo-
CD ! ' a-
# o * * > !
19.
7 * napisz
elektronów walencyjnych.
Okres Grupa
Konfiguracja
elektronów
walencyjnych
3 16
5 3
6 2
5 18
Odp.
Odp.
Odp.
0-2 p.
0-2 p.
0-2 p.
izotopowy pierwiastka
masy at
elektronowe
pierwiastków
*
pierwiastka
0-4 p.
izotopowy pierwiastka
izotopowy pierwiastka
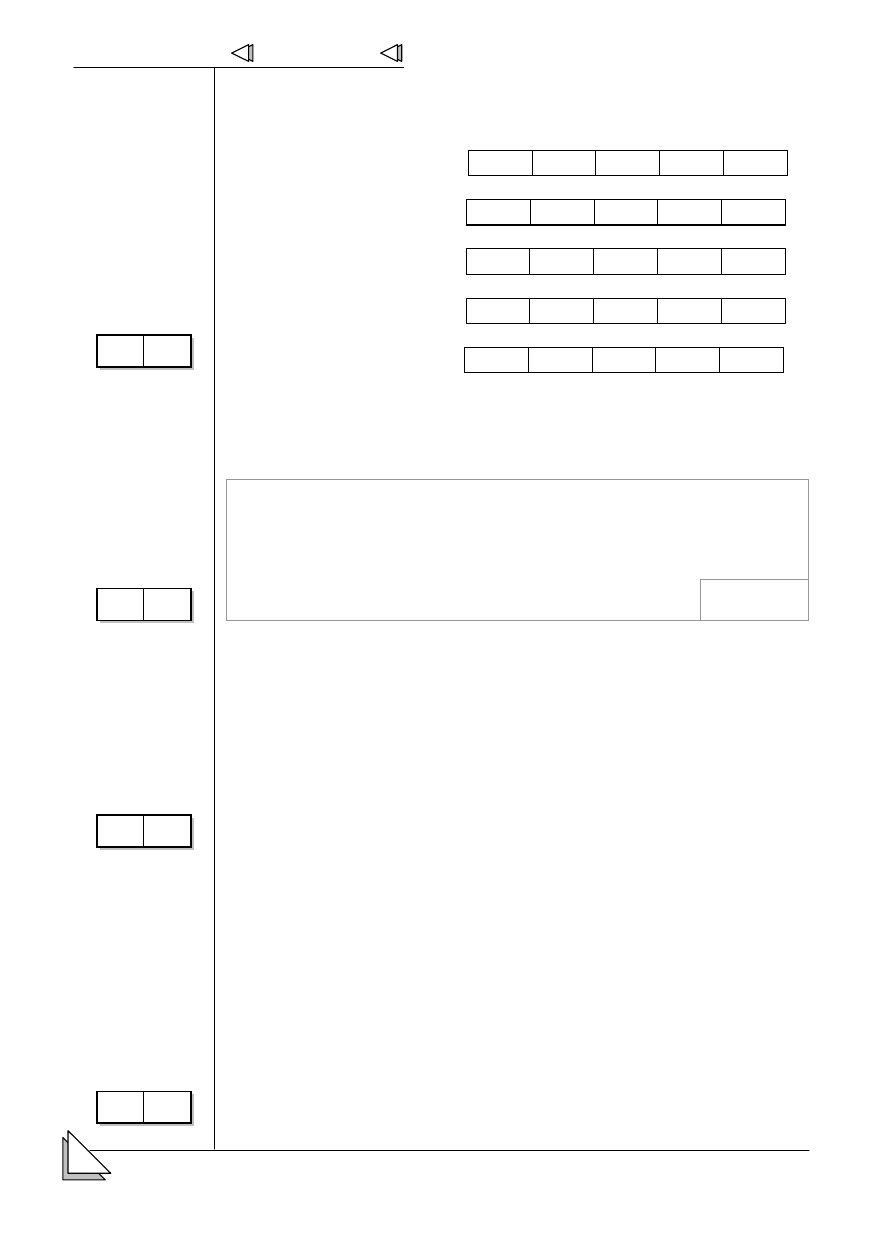
Twoja matura Chemia
Beata Ostrowska
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
20.
+* # a-
nia poziomów orbitalnych.
a)
3d
↑↓
↑↓
↑
b)
3d
↓
↓
↓
↓
↑
c)
3d
↑
↑
↑
↑
↑
d)
3d
↑↑
↑↑
↑↑
↑↑
↑↑
e)
3d
↑
↓
↑
↓
↑
21.
Il
*#
= 8 *
=
22.
Na podstawie konfiguracji atomów azotu
z
# 78
3
&8
3
i PCl
5
.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
23.
Na podstawie kon
, w jaki sposób jony:
a) Cu
2+
,
b) Fe
2+
i Fe
3+
,
c) Ti
2+
i Ti
4+
.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
podstawie istnienia
stanów wzbudzonych.
tworzenia
podstawie konfiguracji
elektronowych
pierwiastków.
0-1 p.
Odp.
pierwiastków
w okresie na
podstawie liczb
kwantowych.
0-2 p.
"
ania
onowych.
0-2 p.
0-3 p.

Beata Ostrowska
Twoja matura Chemia
!
I. Budowa atomu i promieniotwórczoæ Poziom rozszerzony
24.
( # * =
a)
4
Be 1s
2
2s
1
2p
1
b)
12
Mg 1s
2
2s
2
2p
6
3s
2
c)
5
B 1s
2
2s
1
2p
2
4 # =
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
25.
Przedstaw graficznie opis walencyjnych poziomów orbitalnych w atomach:
a) magnezu,
b) galu,
c) krzemu.
0-3 p.
"
elektronów
walencyjnych
pierwiastków w stanie
podstawowym
z
orbitalu.
# *
pierwiastka w stanie
podstawowym
i wzbudzonym.
0-2 p.
Wyszukiwarka
Podobne podstrony:
210 Chemiaid 29182 Nieznany (2)
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia
Chemia R cje chemiczne
Chemia materiałów V
Wykład 9 CHEMIA ORGANICZNA
więcej podobnych podstron