
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
MINISTERSTWO EDUKACJI
NARODOWEJ
Łucja Rozwadowska
Analizowanie fizykochemicznych procesów spalania oraz
właściwości środków gaśniczych
315[02].Z3.07
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
1
Recenzenci:
dr inż. Jarosław Chodorowski
mgr inż. Tomasz Wiśniewski
Opracowanie redakcyjne:
mgr inż. Łucja Rozwadowska
Konsultacja:
dr Justyna Bluszcz
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 315[02].Z3.07
,,Analizowanie fizykochemicznych procesów spalania oraz właściwości środków
gaśniczych”, zawartego w modułowym programie nauczania dla zawodu technik pożarnictwa.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
2
SPIS TREŚCI
1.
Wprowadzenie
4
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1. Podstawy termodynamiki
7
4.1.1.
Materiał nauczania
7
4.1.2.
Pytania sprawdzające
10
4.1.3.
Ćwiczenia
11
4.1.4.
Sprawdzian postępów
12
4.2. Reakcja spalania jako proces fizykochemiczny
13
4.2.1.
Materiał nauczania
13
4.2.2.
Pytania sprawdzające
15
4.2.3.
Ćwiczenia
15
4.2.4.
Sprawdzian postępów
17
4.3. Zagrożenia stwarzane przez substancje chemiczne oraz właściwości
fizykochemiczne produktów spalania
18
4.3.1.
Materiał nauczania
18
4.3.2.
Pytania sprawdzające
19
4.3.3.
Ćwiczenia
20
4.3.4.
Sprawdzian postępów
20
4.4. Budowa płomienia. Pożar i procesy wymiany ciepła
21
4.4.1.
Materiał nauczania
21
4.4.2.
Pytania sprawdzające
22
4.4.3.
Ćwiczenia
23
4.4.4.
Sprawdzian postępów
23
4.5. Proces spalania ciał stałych, cieczy oraz gazów
24
4.5.1.
Materiał nauczania
24
4.5.2.
Pytania sprawdzające
25
4.5.3.
Ćwiczenia
25
4.5.4.
Sprawdzian postępów
27
4.6. Zjawisko samozapalenia oraz zagrożenia stwarzane przez pożary metali
28
4.6.1.
Materiał nauczania
28
4.6.2.
Pytania sprawdzające
29
4.6.3.
Ćwiczenia
29
4.6.4.
Sprawdzian postępów
30
4.7. Właściwości wody, mechanizm gaśniczy oraz zakres stosowania
31
4.7.1.
Materiał nauczania
31
4.7.2.
Pytania sprawdzające
33
4.7.3.
Ćwiczenia
33
4.7.4.
Sprawdzian postępów
34
4.8. Rodzaje środków pianotwórczych, właściwości pian, mechanizm gaśniczy oraz
zakres stosowania
35
4.8.1.
Materiał nauczania
35
4.8.2.
Pytania sprawdzające
36
4.8.3.
Ćwiczenia
36
4.8.4.
Sprawdzian postępów
38

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
3
4.9. Rodzaje proszków oraz gazów gaśniczych, ich właściwości, mechanizm gaśniczy
oraz zakres stosowania
39
4.9.1.
Materiał nauczania
39
4.9.2.
Pytania sprawdzające
40
4.9.3.
Ćwiczenia
41
4.9.4.
Sprawdzian postępów
42
4.10. Właściwości neutralizatorów, sorbentów i dyspergentów
43
4.10.1.
Materiał nauczania
43
4.10.2.
Pytania sprawdzające
44
4.10.3.
Ćwiczenia
45
4.10.4.
Sprawdzian postępów
46
5.
Sprawdzian osiągnięć
47
6.
Literatura
52

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
4
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu zagadnień z zakresu fizykochemii
spalania, termodynamiki oraz środków gaśniczych. W poradniku znajdziesz:
–
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
abyś bez problemów mógł korzystać z poradnika,
–
cele kształcenia – wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
–
materiał nauczania – wiadomości teoretyczne niezbędne do opanowania treści jednostki
modułowej,
–
zestaw pytań, abyś mógł sprawdzić, czy już opanowałeś określone treści,
–
ćwiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
–
sprawdzian postępów,
–
sprawdzian osiągnięć w formie przykładowego zestawu zadań testowych. Zaliczenie
testu potwierdzi opanowanie przez Ciebie materiału całej jednostki modułowej,
–
literaturę.
Materiał nauczania podzielony jest na rozdziały, które zawierają podrozdziały. Podczas
realizacji poszczególnych rozdziałów wskazanym jest zwrócenie uwagi na następujące
elementy:
−
materiał nauczania, który powinieneś w miarę możliwości przeanalizować samodzielnie,
szczególnie ważna jest bowiem umiejętność czytania tekstu ze zrozumieniem,
−
pytania sprawdzające, które mają pokazać, na ile opanowałeś materiał teoretyczny
i czy możesz przystąpić do wykonania ćwiczeń,
−
ćwiczenia, które odgrywają dominującą rolę w kształtowaniu umiejętności oraz
opanowaniu materiału. Podczas wykonywania ćwiczeń powinieneś czerpać z wiedzy
teoretycznej, utrwalać ją, jak również zdobywać nowe umiejętności. Zaproponowane
zostały różne ćwiczenia i nauczyciel sam zdecyduje, które zostaną zrealizowane
w szkole,
−
sprawdzian postępów, który stanowi podsumowanie rozdziału, a Twoim zadaniem jest
udzielenie odpowiedzi na pytania w nim zawarte. Powinieneś samodzielnie czytając
zamieszczone w nim stwierdzenia potwierdzić lub zaprzeczyć o opanowaniu określonego
zakresu materiału. Jeżeli wystąpią zaprzeczenia, nauczyciel powinien do tych zagadnień
wrócić, sprawdzając czy braki w opanowaniu materiału są wynikiem niezrozumienia
przez Ciebie tego zagadnienia, czy niewłaściwej postawy w trakcie nauczania.
Podczas wykonywania ćwiczeń laboratoryjnych czy też poligonowych musisz
przestrzegać zasady bezpieczeństwa i higieny pracy, jak również zapoznać się
z regulaminami pracowni czy stanowisk.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
– stosować jednostki układu SI,
– przeliczać jednostki,
– posługiwać się podstawowymi pojęciami z zakresu matematyki, fizyki i chemii,
– korzystać z praw i pojęć chemicznych,
– korzystać z różnych źródeł informacji,
– obsługiwać komputer,
– współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
scharakteryzować rodzaje energii,
−
scharakteryzować gaz doskonały i jego mieszaniny,
−
określić właściwości gazu doskonałego i jego mieszaniny,
−
przedstawić w sposób analityczny równanie stanu gazu doskonałego,
−
wyjaśnić prawo Avogadra,
−
wyjaśnić różnice między przemianami: izotermiczna, izobaryczna, izochoryczna,
adiabatyczna, politropowa,
−
scharakteryzować gaz rzeczywisty,
−
przedstawić równanie gazu rzeczywistego,
−
wyjaśnić pierwszą, drugą i trzecią zasadę termodynamiki,
−
scharakteryzować obiegi termodynamiczne oraz sprawność silnika termodynamicznego,
−
wykazać różnicę między przemianą odwracalną i nieodwracalną,
−
scharakteryzować właściwości fizyczne i chemiczne substancji,
−
wyjaśnić pojęcia utleniania i aktywności chemicznej,
−
wyjaśnić pojęcie temperatury zapłonu, ciepła spalania i wartości opałowej,
−
scharakteryzować zagrożenia wywołane przez substancje chemiczne,
−
wyjaśnić pojęcie toksyczności,
−
scharakteryzować produkty spalania i ich właściwości fizykochemiczne,
−
wyjaśnić budowę płomienia,
−
scharakteryzować proces wymiany ciepła,
−
określić różnice między przewodzeniem, promieniowaniem, konwekcją, przenikaniem,
−
obliczyć ilość ciepła przekazywanego podczas wymiany,
−
scharakteryzować zjawisko samonagrzewania i samozapalenia,
−
scharakteryzować zagrożenia wywołane przez pożary metali lekkich, ciekłych i metali
alkalicznych,
−
określić właściwości fizykochemiczne wody,
−
wyjaśnić działanie gaśnicze wody,
−
określić zalety i wady wody jako środka gaśniczego,
−
scharakteryzować sposoby podnoszenia skuteczności gaśniczej wody,
−
scharakteryzować właściwości pian gaśniczych,
−
obliczyć ilość wytworzonej piany gaśniczej,
−
wyjaśnić mechanizm działania gaśniczego piany,
−
scharakteryzować rodzaje środków pianotwórczych,
−
scharakteryzować właściwości fizykochemiczne proszków gaśniczych,
−
wyjaśnić mechanizm działania gaśniczego proszków,
−
dopasować odpowiedni rodzaj proszku gaśniczego do danej grupy pożaru,
−
wymienić gazy gaśnicze,
−
scharakteryzować właściwości fizykochemiczne gazów gaśniczych,
−
wyjaśnić mechanizmy działania gaśniczego gazów gaśniczych,
−
scharakteryzować zakres stosowania gazów gaśniczych,
−
określić właściwości neutralizatorów, sorbentów i dyspergentów,
−
scharakteryzować i wyznaczać parametry pożarowo-wybuchowe gazów, par cieczy
palnych oraz pyłów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
7
4. MATERIAŁ NAUCZANIA
4.1. Podstawy termodynamiki
4.1.1. Materiał nauczania
Termodynamika jest to dział fizyki, obejmujący badanie zjawisk cieplnych
zachodzących w układach makroskopowych.
Układ fizyczny jest to wyodrębniony z otaczającego świata obiekt lub zbiór obiektów,
którego własności lub zjawiska w nim zachodzące, są przedmiotem badań. Układ fizyczny
nazywa się izolowanym lub odosobnionym, gdy nie występuje oddziaływanie między
otoczeniem a układem (nie ma wymiany ani energii, ani masy). Układ otwarty jest wtedy gdy
układ wymienia z otoczeniem masę i energię, natomiast zamknięty, gdy wymienia
z otoczeniem tylko energię.
Aby określić stan termodynamiczny układu, należy podać wartości wszystkich
parametrów (wielkości) charakteryzujących właściwości makroskopowe tego układu.
Równanie stanu opisuje związek między parametrami opisującymi układ fizyczny
w stanie równowagi termodynamicznej. Najprostszym równaniem jest równanie Clapeyrona:
nRT
pV
=
gdzie:
p – ciśnienie gazu [Pa],
V – objętość gazu [m
3
],
T – temperatura [K],
n – liczba moli [mol],
R – stała gazowa R=8,31 [J/molK].
Równanie Clapeyrona stosuje się do gazu doskonałego.
Gaz doskonały jest to hipotetyczny model gazu, w którym brak oddziaływań
międzycząsteczkowych z wyjątkiem odpychania w momencie doskonale sprężystych zderzeń
cząsteczek znajdujących się w ciągłym uchu, a ponadto objętość cząsteczek jest znikoma
w stosunku do objętości gazu.
Gaz rzeczywisty to gaz, który nie zachowuje się ściśle zgodnie z prawami ustalonymi
dla gazu doskonałego. W praktyce są to wszystkie gazy istniejące w realnym świecie. Gaz
rzeczywisty opisuje równanie Van der Waalsa, rozszerzające równanie gazu doskonałego
o zjawisko skroplenia i zjawiska krytyczne.
(
)
RT
b
V
V
a
p
=
−
+
2
gdzie:
a i b – stałe.
Entalpia jedna z funkcji stanu termodynamicznego równa:
pV
U
H
+
=
gdzie:
U – energia wewnętrzna.
Entropia jedna z funkcji stanu termodynamicznego. W dowolnym odwracalnym
procesie termodynamicznym zachodzącym w stałej temperaturze T zmiana entropii równa się
ilorazowi dostarczonej ilości ciepła
∆Q i temperatury T:
T
Q
S
∆
=
∆
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
8
W dowolnym nieodwracalnym procesie entropia wzrasta. W temperaturze zera
bezwzględnego entropia dowolnego układu w równowadze jest równa zeru.
Prawo Avogadra mówi, że w tych samych warunkach fizycznych tj. w takiej samej
temperaturze i pod takim samym ciśnieniem, w równych objętościach różnych gazów
znajduje się taka sama liczba cząsteczek. Między licznością materii, a liczbą Avogadra
występuje następująca zależność:
A
N
N
n
=
gdzie:
N – liczba cząstek (atomów, cząsteczek, jonów i wszelkich innych indywiduów chemicznych)
N
A
– stała Avogadra równa 6,022 × 10
23
[mol
-1
].
Gazy ulegać mogą następującym przemianom termodynamicznym:
−
przemianie izotermicznej (przy stałej temperaturze, T=const),
−
przemianie izobarycznej (przy stałym ciśnieniu, p=const),
−
przemianie izochorycznej (przy stałej objętości, V=const),
−
przemianie adiabatycznej (przy braku wymiany ciepła z otoczeniem, Q=0),
−
przemianie politropowej (pV
n
= const, gdzie n - wykładnik politropy).
Przemianę izotermiczną opisuje prawo Boyle’a-Mariotte’a, zgodnie z którym przy stałej
temperaturze, ciśnienie zmienia się odwrotnie proporcjonalnie do zmiany objętości:
const
pV
=
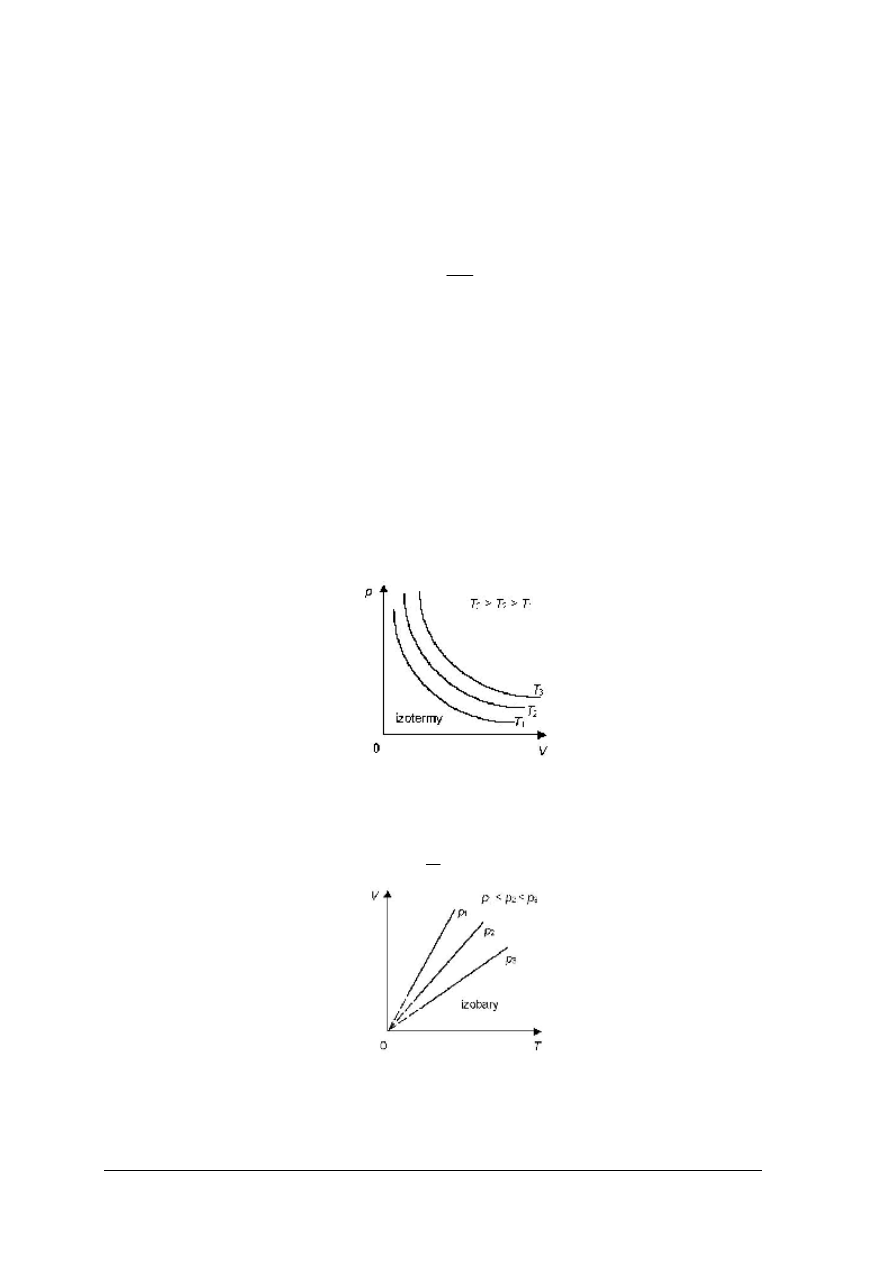
Rys. 1. Zależność ciśnienia od objętości dla przemiany izotermicznej
Przemianę izobaryczną opisuje prawo gazów Gay-Lussac’a, zgodnie z którym przy stałym
ciśnieniu, objętość gazu jest wprost proporcjonalna do jego temperatury bezwzględnej:
const
T
V
=
Rys. 2. Zależność objętości od czasu dla przemiany izobarycznej
Przemianę izochoryczną opisuje prawo Gay-Lussac’a-Charles’a, zgodnie, z którym
w stałej objętości ciśnienie gazu jest wprost proporcjonalne do jego temperatury bezwzględnej:
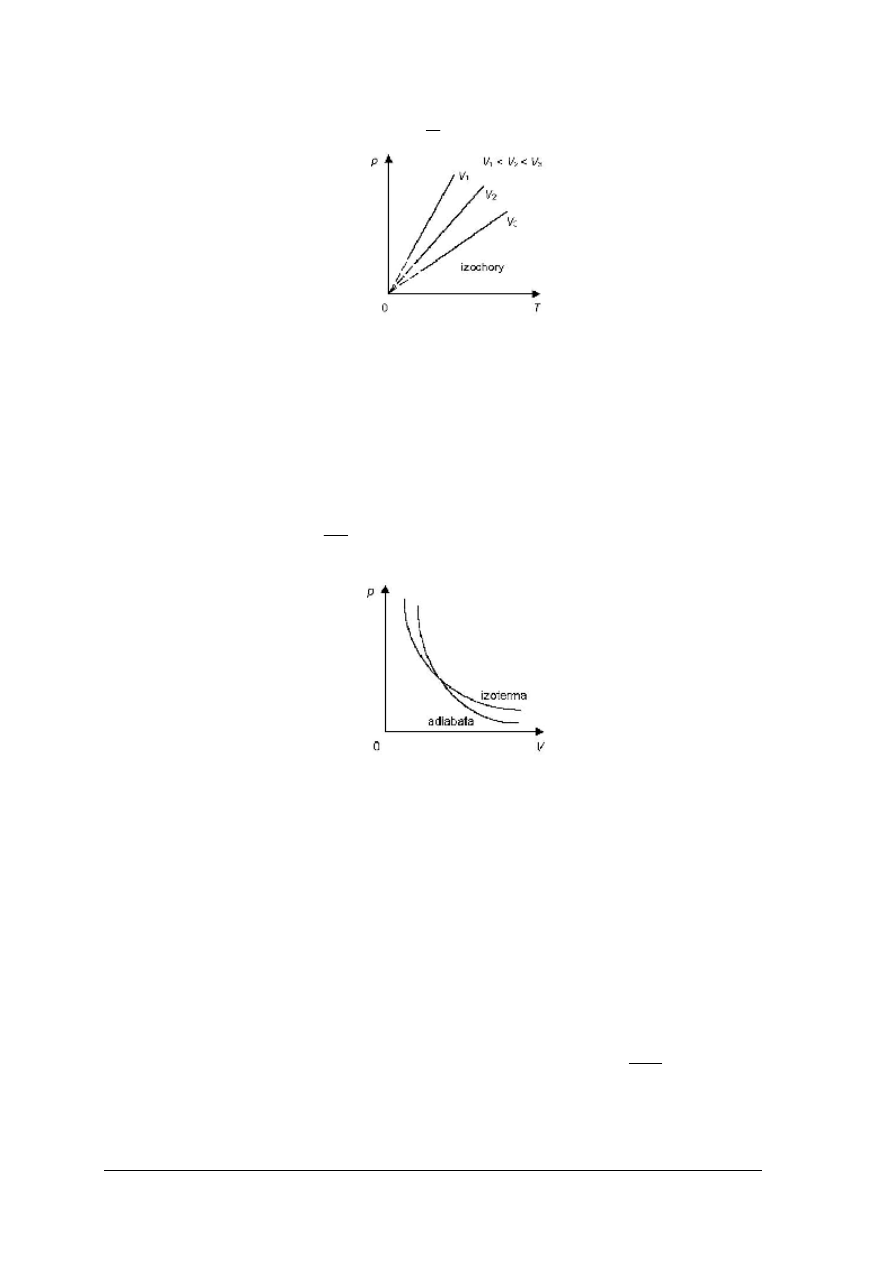
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
9
const
T
p
=
Rys. 3. Zależność ciśnienia od czasu dla przemiany izochorycznej
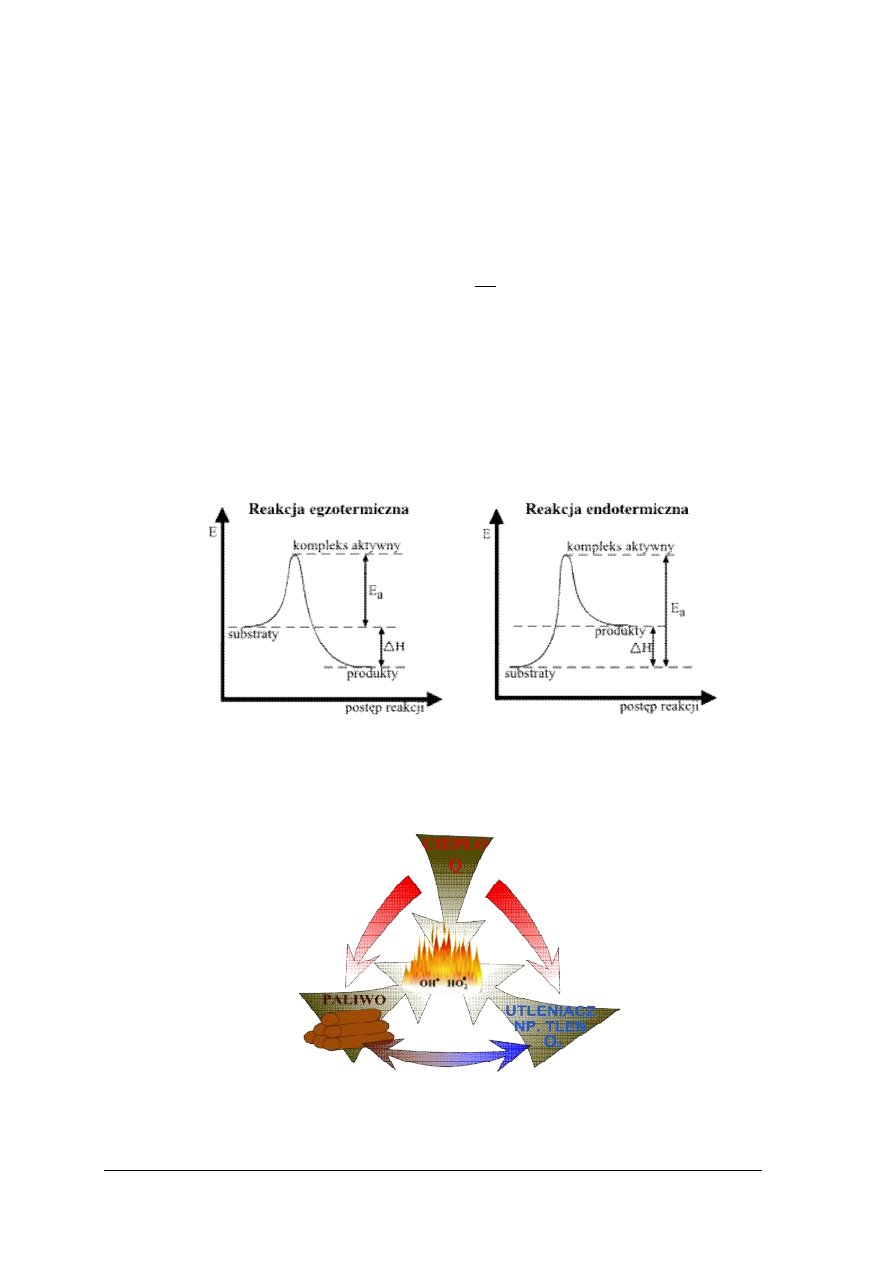
Przemianę adiabatyczną opisuje prawo Poisson’a. Przemianą adiabatyczną nazywamy
przemianę zachodzącą bez wymiany energii układu w postaci ciepła lub promieniowania
z otoczeniem (dQ=0), podczas której całość energii zamieniana jest w jego pracę. Przemiana ta
związana jest głównie ze zjawiskiem rozprężania i sprężania gazów.
const
pV
=
κ
gdzie:
κ – wykładnik adiabaty, równy stosunkowi ciepła właściwego przy stałym ciśnieniu C
p
i przy stałej objętości C
v
,
v
p
C
C
=
κ
.
Rys. 4. Zależność ciśnienia od objętości dla przemiany adiabatycznej
Przemiana politropowa jest odwracalną przemianą termodynamiczną gazu, dla której
związek między ciśnieniem p i objętością V jest określony równaniem:
const
pV
n
=
gdzie:
n – wykładnik politropy, stały dla danego procesu politropowego, ale przyjmujący dla
różnych procesów politropowych różne wartości, od minus do plus nieskończoności.
Szczególnymi przypadkami przemiany politropowej są:
−
proces izochoryczny (n = ±∞),
−
proces izobaryczny (n = 0),
−
proces izotermiczny (n = 1),
−
proces adiabatyczny (n = κ).
Energia mechaniczna jest to suma energii kinetycznej
=
2
2
mv
E
k
i potencjalnej
[
]
mgh
E
p
=
; gdzie m – masa ciała [kg], v – prędkość ciała [m/s], g – przyspieszenie ziemskie
[m/s
2
], h – wysokość ponad poziom odniesienia, na którym energia jest równa zero [m].

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
10
Energia wewnętrzna (U) jest funkcją stanu termodynamicznego równa całkowitej
energii danego układu.
Suma energii kinetycznej, potencjalnej i wewnętrznej określana jest jako energia
całkowita układu (E
u
):
U
E
E
E
p
k
u
+
+
=
W termodynamice wyróżnić można jej trzy podstawowe zasady:
I zasada termodynamiki jest szczególnym przypadkiem zasady zachowania energii,
czyli energia w żadnym procesie nie może pojawić się „znikąd”. Wiąże trzy pojęcia: energię
wewnętrzną będąca funkcją stanu ciała, układu oraz pracę i ciepło, które są formami
przekazywania energii. Określa, że zmiana energii wewnętrznej ciała lub układu równa jest
przekazanej energii w wyniku wykonanej pracy (nad ciałem, układem lub przez ciało, układ)
i przepływu ciepła. Praca i ciepło mogą być większe bądź mniejsze od zera, gdy:
−
Q > 0 – ciepło jest dostarczane do ciała, układu,
−
Q < 0 – ciało, układ oddaje ciepło,
−
W > 0 – do ciała, układu dostarczona jest energia w wyniku pracy,
−
W < 0 – ciało, układ wykonuje pracę kosztem energii wewnętrznej.
II zasada termodynamiki mówi, że nie istnieje proces, w którym ciepło przechodziłoby
samorzutnie od ciał chłodniejszych do ciał bardziej ogrzanych.
III zasada termodynamiki mówi, iż w ustalonej objętości lub pod stałym ciśnieniem
entropia układu dąży do zera, gdy temperatura dąży do zera bezwzględnego.
Obiegi termodynamiczne to przemiany, w których stan końcowy czynnika jest
identyczny z początkowym. Obrazem obiegu w układzie p,V jest krzywa zamknięta.
Sprawność silnika termodynamicznego jest to stosunek pracy wykonanej przez silnik
do ciepła pochłoniętego przez czynnik obiegowy:
Q
W
=
η
Przemiana nieodwracalna jest to proces, w którym po osiągnięciu stanu końcowego
niemożliwe jest powrócenie do stanu początkowego. Wszystkie procesy samorzutne są
procesami nieodwracalnymi, m.in.: samorzutne reakcje chemiczne, dyfuzja, przewodzenie
ciepła oraz rozprężanie gazów.
Przemiana odwracalna jest to proces, którego kierunek można odwrócić poprzez
nieskończenie małą zmianę wartości jednej lub więcej zmiennych stanu termodynamicznego
Procesy odwracalne zachodzą bez wzrostu entropii.
Właściwości fizyczne substancji to m.in.: stan skupienia, barwa, kruchość, ciągliwość,
plastyczność, sprężystość, gęstość, przewodnictwo cieplne i elektryczne, temperatura
topnienia i wrzenia, rozpuszczalność.
Właściwości chemiczne substancji to m.in.: odczyn (kwaśny, zasadowy, obojętny),
palność, smak, zapach, potencjał oksydacyjno – redukcyjny, ładunek (dodatni, ujemny),
aktywność chemiczna, oddziaływanie na środowisko naturalne, typ (związek kowalencyjny,
jonowy, mieszany, koordynacyjny).
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jaką zależność opisuje równanie Clapeyrona?
2. O czym mówi prawo Avogadra?
3. Czym różnią się przemiany izotermiczna, izobaryczna i izochoryczna?
4. Czym różni się przemiana odwracalna od nieodwracalnej?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
11
4.1.3. Ćwiczenia
Ćwiczenie 1
Oblicz, ile atomów znajduje się w 5 g węgla, tlenu cząsteczkowego, azotu
cząsteczkowego, tlenku węgla i dwutlenku węgla i porównaj wyniki.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać za pomocą zależności matematycznej prawo Avogadra,
2) przekształcić zależność w celu wyliczenia liczby atomów,
3) odnaleźć w układzie okresowym pierwiastków szukane substancje i określić ich masy
molowe,
4) obliczyć jaką liczbę moli stanowią poszczególne substancje,
5) obliczyć szukaną liczbę atomów,
6) zapisać i porównać wyniki.
Wyposażenie stanowiska pracy:
−
układ okresowy pierwiastków,
−
zeszyt i przybory do pisania,
−
kalkulator.
Ćwiczenie 2
Narysuj
i
porównaj
przemiany:
izotermiczną,
izobaryczną
i
izochoryczną
w następujących układach współrzędnych: p(T), p(V), V(T).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać zależności opisujące ww przemiany,
2) narysować przebieg zależności p(T), p(V), V(T) dla poszczególnych przemian,
3) porównać otrzymane wykresy.
Wyposażenie stanowiska pracy:
−
zeszyt i przybory do pisania.
Ćwiczenie 3
Znajdź w literaturze i internecie po 5 przykładów przemian odwracalnych
i nieodwracalnych, które związane są z tematyką pożarniczą. Zebrane wyniki przedstaw na
forum grupy.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) wyszukać przemiany związane w tematyką pożarniczą,
2) przyporządkować te przemiany do odpowiedniej grupy,
3) przedstawić swoje wyniki na forum klasy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
12
Wyposażenie stanowiska pracy:
−
literatura dodatkowa,
−
komputer z dostępem do internetu,
−
zeszyt i przybory do pisania.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować prawo Avogadra?
2) zdefiniować przemianę odwracalną i nieodwracalną?
3) wymienić po 5 właściwości fizycznych i chemicznych substancji?
4) rozróżnić przemiany izotermiczną i adiabatyczną?
5) wyjaśnić różnicę między gazem doskonałym, a rzeczywistym?
6) określić sprawność silnika termodynamicznego?
7) podać przykłady przemian odwracalnych i nieodwracalnych?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
13
4.2. Reakcja spalania jako proces fizykochemiczny
4.2.1. Materiał nauczania
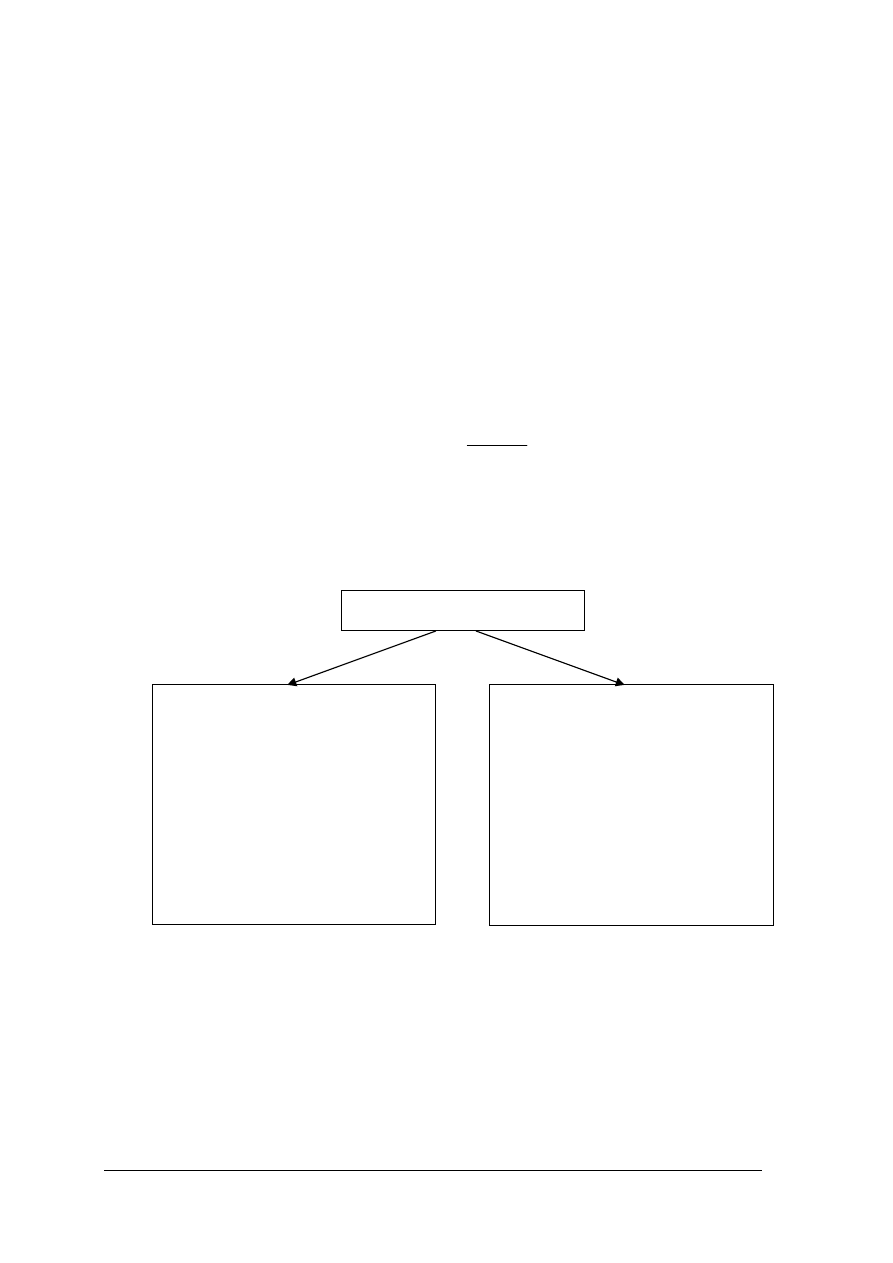
Utlenianie jest to reakcja egzotermiczna, która przebiega w każdej temperaturze z różną
szybkością i prowadzi do zwiększenia wartościowości pierwiastka chemicznego.
Równanie Arrheniusa opisuje zależność szybkości reakcji od temperatury:
RT
E
a
Ae
k
−
=
gdzie:
k – stała szybkości reakcji,
A – stała dla danej reakcji, zwana też czynnikiem przedwykładniczym [s
-1
],
e – podstawa logarytmu naturalnego (inaczej liczba Eulera, liczba Nepera), e
≈
2,718,
E
a
– energia aktywacji [J/mol],
R – stała gazowa, R=8,31 [J/molK],
T – temperatura [K].
Energia aktywacji to energia niezbędna do zapoczątkowania reakcji chemicznej.
Rys. 5. Energia aktywacji w reakcji egzotermicznej i endotermicznej [26]
Spalanie jest to jest to złożony fizykochemiczny proces wzajemnego oddziaływania
materiału palnego i utleniacza (najczęściej powietrza) charakteryzujący się wydzielaniem
ciepła i światła (reakcja egzotermiczna) oraz wolnych rodników, warunkujących zachowanie
ciągłości tego procesu.
Rys. 6. Czworościan spalania [opracowanie własne]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
14
Ze względu na szybkość procesu spalania wyróżniamy spalanie:
−
dyfuzyjne – szybkość zależy od dyfuzji powietrza do środowiska pożarowego, występuje
podczas pożaru,
−
kinetyczne – szybkość zależy od szybkości przebiegu reakcji chemicznej, występuje
podczas wybuchu.
Ciepło spalania jest to ilość ciepła, która wydziela się podczas całkowitego spalania
jednostki masy lub objętości danej substancji, przy założeniu, że woda po spaleniu występuje
w stanie ciekłym [MJ/kg lub MJ/m
3
].
Wartość opałowa jest to ilość ciepła, która wydziela się podczas całkowitego spalania
jednostki masy lub objętości danej substancji, przy założeniu że woda po spaleniu występuje
w stanie pary [MJ/kg lub MJ/m
3
].
Temperatura krytyczna jest to temperatura, powyżej której dana substancja może
znajdować się tylko w stanie gazowym.
Gęstość względem powietrza jest to stosunek gęstości substancji w fazie lotnej do
gęstości powietrza.
powietrza
subst
pow
wzg
ρ
ρ
ρ
.
.
.
=
gdzie:
ρ
powietrza
= 1,29 kg/m
3
Źródło ciepła jest to dowolny impuls cieplny (bodziec energetyczny) mający niezbędny
zapas energii cieplnej do zapoczątkowania reakcji spalania.
Zapłon polega na zapaleniu mieszaniny palnej punktowym bodźcem energetycznym
tylko w bardzo ograniczonej przestrzeni, wokół której powstaje czoło płomienia
przemieszczające się następnie już samoczynnie na całą pozostałość mieszaniny.
Temperatura zapłonu charakteryzuje tylko ciecze palne, jest to najniższa temperatura
cieczy, w której nad powierzchnią istnieje mieszanina zdolna do zapłonu od zewnętrznego
punktowego bodźca energetycznego, a powstały płomień rozprzestrzenia się na całą
powierzchnię.
punktowe (PBE)
−
bodźce, które mają taki zasób
energii cieplnej, że świecą tzn.
ich temperatura minimalna
musi być ok. 450-480
0
C,
−
oddziałują na materiał palny na
małą powierzchnię
(punktowo),
−
inicjację reakcji spalania
nazywamy zapłonem.
ciągłe (CBE)
−
bodźce, które mają taki zapas
energii cieplnej, że ich
temperatura nie przekracza
4500C,
−
oddziałują na materiał palny za
pomocą promieniowania
cieplnego i przewodnictwa,
−
inicjację reakcji spalania
nazywamy samozapłonem.
Źródła ciepła

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
15
Samozapłon polega na równomiernym ogrzaniu materiału palnego do takiej temperatury,
w której zapali się on samorzutnie w całej masie bez udziału tzw. punktowego bodźca
energetycznego.
Temperatura samozapłonu jest to najniższa temperatura materiału palnego, w której
samorzutnie pojawia się płomień w wyniku promieniowania energetycznego, czyli ciągłego
bodźca energetycznego.
Samozapalenie jest to proces zachodzący w wyniku złożonych procesów biologicznych,
chemicznych i fizycznych, prowadzący do samonagrzewania się substancji aż do pojawienia
się płomienia bez udziału zewnętrznego bodźca energetycznego.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak definiuje się ciepło spalania i wartość opałową?
2. Jaki jest wzór na gęstość względem powietrza?
3. Jak definiuje się zapłon i temperaturę zapłonu?
4. Jak definiuje się samozapłon i temperaturę samozapłonu?
4.2.3. Ćwiczenia
Ćwiczenie 1
Odszukaj i porównaj wartość ciepła spalania i wartości opałowej dla 3 różnych
substancji. Wskaż, która wartość dla tej samej substancji jest wyższa i wyjaśnij dlaczego.
Uzasadnienie odpowiedzi zapisz w zeszycie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać fragment materiału nauczania z poradnika dla ucznia dotyczący ciepła
spalania i wartości opałowej i poszerzyć wiadomości z literatury uzupełniającej,
2) odszukać wartości ciepła spalania i wartości opałowej dla wybranych substancji,
3) uwzględnić ciepło wydzielane podczas spalania oraz ciepło użyte na przemianę fazową
wody,
4) wskazać, która wielkość jest wyższa i zapisać w zeszycie uzasadnienie odpowiedzi,
5) przedstawić wyniki na forum grupy.
Wyposażenie stanowiska pracy:
−
literatura uzupełniająca,
−
tabele ciepła spalania i wartości opałowych,
−
karty charakterystyk substancji niebezpiecznych,
−
komputer z dostępem do internetu,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Oblicz gęstość względem powietrza dla metanu, propanu, amoniaku, chloru, par alkoholu
etylowego, metylowego i porównaj otrzymane wyniki. Wyjaśnij i uzasadnij na forum grupy
jak będą zachowywały się te substancje po uwolnieniu do powietrza atmosferycznego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
16
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać równanie określające gęstość względem powietrza,
2) odnaleźć gęstość metanu, propanu, amoniaku w kartach charakterystyk substancji,
3) obliczyć gęstość par alkoholu etylowego przy użyciu równania gazu doskonałego,
4) obliczyć gęstości względem powietrza dla poszczególnych substancji,
5) porównać wyniki.
Wyposażenie stanowiska pracy:
−
karty charakterystyk substancji niebezpiecznych lub baza danych o substancjach
niebezpiecznych,
−
zeszyt i przybory do pisania,
−
kalkulator.
Ćwiczenie 3
Wyznacz temperatury zapłonu wybranych cieczy metodą Pensky’ego-Martens’a zgodnie
z normą PN-EN ISO 2719:2007. Oznaczanie temperatury zapłonu. Metoda zamkniętego tygla
Pensky’ego-Martens’a.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki cieczy,
4) wykonać pomiary dla poszczególnych cieczy,
5) uwzględnić błąd wyniku zależny od ciśnienia atmosferycznego,
6) wykonać opracowanie i analizę wyników.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne z półautomatycznym aparatem do oznaczania temperatury
zapłonu w tyglu zamkniętym metodą Pensky-Martens’a,
−
próbki cieczy,
−
zlewka, menzurka,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania,
−
barometr.
Ćwiczenie 4
Wyznacz temperatury samozapłonu wybranych cieczy metodą dynamiczną zgodnie
z normą PN-C-04006:1964. Przetwory naftowe - Pomiar temperatury samozapłonu metodą
dynamiczną.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
17
3) przygotować wskazane przez prowadzącego próbki cieczy,
4) wykonać pomiary dla poszczególnych cieczy,
5) wykonać opracowanie i analizę wyników.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko do oznaczania temperatury samozapłonu metodą dynamiczną,
−
próbki cieczy,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
Ćwiczenie 5
Wyznacz ciepła spalania wybranych paliw stałych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki ciał stałych,
4) wykonać pomiary dla poszczególnych próbek,
5) wykonać opracowanie i analizę wyników.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne z kalorymetrem,
−
waga laboratoryjna,
−
próbki ciał stałych,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić pojęcia utleniania i energii aktywacji?
2) określić czynniki konieczne do zaistnienia procesu spalania?
3) obliczyć gęstość względem powietrza?
4) rozróżnić zapłon, samozapłon i samozapalenie?
5) rozróżnić ciepło spalania i wartość opałową?
6) wymienić różnice między punktowym i ciągłym bodźcem
energetycznym?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
18
4.3. Zagrożenia
stwarzane
przez
substancje
chemiczne
oraz właściwości fizykochemiczne produktów spalania
4.3.1. Materiał nauczania
Substancja niebezpieczna to jedna lub więcej substancji albo mieszaniny substancji,
które ze względu na swoje właściwości chemiczne, biologiczne lub promieniotwórcze mogą,
w razie nieprawidłowego obchodzenia się z nimi, spowodować zagrożenie życia lub zdrowia
ludzi lub środowiska. Substancją niebezpieczną może być surowiec, produkt, półprodukt,
odpad, a także substancja powstała w wyniku awarii.
Zagrożenie chemiczne to potencjalne niebezpieczeństwo zatrucia, pożaru lub wybuchu,
jakie stwarzają z powodu swych właściwości fizykochemicznych i toksycznych substancje
chemiczne stosowane w wysokich stężeniach, ciśnieniach i temperaturach.
Rys. 7. Zagrożenia stwarzane przez substancje chemiczne [3]
Toksyczność jest to właściwość szkodliwego działania na organizmy substancji
chemicznych, zwanych truciznami jest związana nie tylko z rodzajem trucizny i jej
właściwościami fizykochemicznymi, ale również z jej ilością, drogą przenikania, przemianom
jakim ulega w organizmie oraz wrażliwością organizmu. Miarą toksyczności jest dawka
i stężenie. Najczęściej ich zawartość i toksyczność zapisywana jest w poniższych
jednostkach:
−
mg/m
3
−
mg/kg masy ciała
−
% objętościowych
−
ppm (part per milion) – jedna milionowa
−
ppb (part per bilion) – jedna miliardowa
Substancje niebezpieczne mogą przedostawać się do organizmu ludzkiego przez układ
oddechowy, skórę lub układ pokarmowy. Zagrożenie substancjami chemicznymi w tym także
produktami rozkładu termicznego zależy m. in.: od: ilości i stężenia substancji, czasu
narażenia, indywidualnej odporności fizycznej i psychicznej, stanu obciążenia organizmu
(np.: dużego wysiłku), itp.
Substancjami niebezpiecznymi najczęściej spotykanymi w codziennej pracy strażaka są
produkty rozkładu termicznego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
19
Produkty spalania są to związki i pierwiastki chemiczne, które powstają w wyniku
reakcji spalania. Wyróżnia się produkty spalania niecałkowitego i całkowitego.
Produktami niecałkowitego spalania są produkty powstałe podczas spalania
przebiegającego przy ograniczonym dopływie utleniacza, np.: węgiel, tlenek węgla, trójtlenek
fosforu. Niecałkowita reakcja spalania metanu do węgla i tlenku węgla:
2
2
2
2
4
76
,
3
2
76
,
3
N
O
H
C
N
O
CH
+
+
→
+
+
2
2
2
2
4
76
,
3
5
,
1
2
76
,
3
5
,
1
5
,
1
N
O
H
CO
N
O
CH
⋅
+
+
→
⋅
+
+
Produktami całkowitego spalania są produkty nie mające zdolności do dalszego
utleniania, w warunkach których były otrzymane, np.: dwutlenek węgla, woda, dwutlenek
siarki, pięciotlenek fosforu. Całkowita reakcja spalania metanu do dwutlenku węgla.
2
2
2
2
2
4
76
,
3
2
2
76
,
3
2
2
N
O
H
CO
N
O
CH
⋅
+
+
→
⋅
+
+
Dym jest to mieszanina drobnych cząstek stałych, ciekłych, par cieczy i gazów
powstałych w wyniku rozkładu termicznego i/lub spalania substancji.
Do najczęściej spotykanych produktów rozkładu termicznego należą: tlenek węgla, dwutlenek
węgla, woda, cyjanowodór, chlorowodór.
Tlenek węgla (CO) zwany powszechnie czadem, to główny, trujący gaz występujący
podczas pożaru, odpowiadający za największą liczbę zgonów. Stanowi bardzo poważne
zagrożenie, gdyż jest palny, wybuchowy, bezwonny, bezbarwny, bez smaku. Wykazuje do
300 razy większe powinowactwo do hemoglobiny niż tlen, tworząc karboksyhemoglobinę, co
skutkuje niedotlenieniem organizmu i w konsekwencji śmiercią. Już niewielkie stężenie
objętościowe CO może spowodować śmierć w ciągu kilku minut, a omdlenie i utratę
świadomości nawet w kilkadziesiąt sekund.
Dwutlenek węgla (CO
2
) to niepalny lecz toksyczny gaz, którego stężenie około 10% obj.
może powodować ból i zawroty głowy. Najbardziej widocznym i odczuwalnym efektem
przebywania w atmosferze CO
2
jest zwiększenie częstości i głębokości oddechu (8-10 razy
szybciej niż normalnie). Przy dalszym narażeniu stopniowo zmniejsza się wentylacja
organizmu i w konsekwencji dochodzi do uduszenia.
Cyjanowodór (HCN) to bezbarwny gaz lub ciecz o charakterystycznym zapachu
gorzkich migdałów. Substancja bardzo toksyczna, działająca silnie drażniąco na błony
śluzowe i skórę. Proces zatrucia u ludzi przebiega w trzech fazach, charakteryzujących się
następującymi objawami: duszności i podniecenie, zawroty i drgawki oraz porażenie i śmierć.
Narażenie HCN w stężeniu większym niż 300 mg/m³ przez minutę może prowadzić do
śmierci człowieka.
Chlorowodór (HCl) powstaje w wyniku rozkładu termicznego i spalania związków
organicznych zawierających chlor, np. polichlorku winylu. Jest to niepalny gaz, o duszącym
zapachu, działający żrąco na skórę i błony śluzowe, dymiący na powietrzu. Jego roztwór
wodny nosi nazwę kwasu solnego.
Spośród innych toksycznych produktów spalania znajdujących się w dymie wymienić
należy: akroleinę, tlenki azotu, amoniak, dwutlenek siarki, formaldehyd, siarkowodór,
fluorowodór i inne.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Dlaczego w wyniku reakcji spalania powstają produkty niecałkowitego spalania?
2. Jakie podstawowe produkty powstają podczas reakcji spalania?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
20
4.3.3. Ćwiczenia
Ćwiczenie 1
Określ skład gazowych produktów spalania różnych substancji przy użyciu analizatora
spalin.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki materiałów palnych,
4) wykonać pomiary stężeń podstawowych gazowych produktów spalania dla
poszczególnych próbek,
5) opracować wyniki i wykonać analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
miernik pozwalający badać stężenia podstawowych gazowych produktów spalania
w temperaturze do 1000
0
C (np.: tlenek i dwutlenek węgla, dwutlenek siarki, tlenki azotu,
cyjanowodór, chlorowodór),
−
stanowisko laboratoryjne z wentylacją wymuszoną,
−
materiały palne,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) opisać zagrożenia stwarzane przez substancje chemiczne?
2) zdefiniować substancję niebezpieczną?
3) napisać przykładowe reakcje spalania całkowitego i niecałkowitego?
4) scharakteryzować podstawowe produkty spalania?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
21
4.4. Budowa płomienia. Pożar i procesy wymiany ciepła
4.4.1. Materiał nauczania
Płomień jest to widzialna objętość gazowa, w której przebiegają procesy rozkładu
termicznego oraz spalania. Wyróżnia się płomień laminarny i turbulencyjny. Najczęściej
spotykanym laminarnym płomieniem dyfuzyjnym jest płomień świecy. Dyfuzyjny oznacza,
że szybkość procesu spalania, zależy od dyfuzji powietrza do paliwa.
Laminarny płomień dyfuzyjny składa się z 2 podstawowych części:
−
wewnętrznej – zwanej strefą palnej fazy lotnej, w której nie zachodzi spalanie. W tej
strefie następuje przygotowanie materiału palnego do reakcji spalania polegające jego
rozkładzie termicznym; temperatura tej strefy zależy od ciepła spalania paliwa i jest dużo
niższa niż temperatura w strefie zewnętrznej,
−
zewnętrznej – zwanej strefą spalania, w której zachodzi spalanie, tzn. łączenie się
produktów dysocjacji termicznej z powietrzem w wyniku czego powstają produkty
spalania; strefa o najwyższej temperaturze, decydująca o wartości temperatury płomienia
(nie mylić z temperaturą pożaru, która jest średnia temperaturą gazów pożarowych).
Rys. 8. Budowa płomienia dyfuzyjnego [opracowanie własne]
Dyfuzyjny płomień turbulencyjny tworzy się w czasie pożaru, gdy szybkość przepływu
fazy lotnej(najczęściej powietrza) do strefy spalania jest powyżej krytycznej wartości liczby
Reynolds’a.
Pożar jest to spalanie dyfuzyjne zachodzące przy turbulentnym przepływie fazy lotnej,
w układzie heterogenicznym. Składniki (paliwo i powietrze) nie są wstępnie zmieszane przed
zapoczątkowaniem reakcji spalania. Wyróżnia się 5 grup pożarów. Ich przykłady zestawiono
w tabeli 1.
Tabela 1. Grupy pożarów
Grupa pożarów
Określenie rodzaju pożarów
A
Pożary ciał stałych pochodzenia organicznego, podczas spalania
których występuje zjawisko tlenia się (drewno, papier, węgiel ...).
B
Pożary cieczy palnych i ciał stałych topiących się podczas palenia
(benzyna, nafta, rozpuszczalniki, alkohole ...).
C
Pożary gazów (metan, gaz ziemny, acetylen...).
D
Pożary metali (sód, potas, magnez ...).
F
Pożary tłuszczów i olejów w urządzeniach kuchennych.
Wymiana ciepła jest to ruch ciepła w danej przestrzeni zachodzący na skutek istnienia
różnicy temperatur. Istnieją trzy podstawowe mechanizmy transportu ciepła w środowisku
pożarowym: przewodzenie, konwekcja (unoszenie), promieniowanie (radiacja).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
22
Zgodnie ze standardem American Society for Testing and Materials (ASTM 119E/92)
opisującym w postaci graficznej, przebieg wzrostu temperatury pożaru w funkcji czasu
trwania pożaru, w pożarze wyróżnić możemy jego 3 podstawowe fazy (rys. 9):
I faza – faza wzrostu bądź rozwoju pożaru, zwana również fazą przedrozgorzeniową.
Średnia temperatura pożaru w tej fazie jest stosunkowo niska, natomiast strefa spalania
zlokalizowana jest w sąsiedztwie miejsca inicjacji pożaru.
II faza – pożaru w pełni rozwiniętego, zwana również fazą porozgorzeniową. W tej
fazie wszystkie materiały palne ulegają spalaniu, płomienie wypełniają całe
pomieszczenie, a temperatura osiąga maksymalną wartość.
III faza – okres wygasania (stygnięcia, regresji) pożaru, rozpoczęcie tej fazy
charakteryzuje się spadek temperatury pożaru do 80 % wartości maksymalnej.
Rys. 9. Przebieg temperatury pożaru w funkcji czasu trwania pożaru [25]
Dynamika rozwoju pożarów zależy przede wszystkim od:
−
rodzaju materiałów palnych zgromadzonych w pomieszczeniu,
−
ilości tych materiałów,
−
powierzchni jaką zajmują,
−
od wymiarów samego pomieszczenia,
−
od wielkości i usytuowania otworów wentylacyjnych,
−
od ilości powietrza w pomieszczeniu lub do niego docierającego.
Rozgorzenie (flashover) jest to moment przejścia pomiędzy dwoma fazami rozwoju
pożaru (fazą wzrostu pożaru, a fazą pożaru rozwiniętego), charakteryzujący się jednoczesnym
wypełnieniem całego pomieszczenia płomieniami. Przyjętym kryterium zaistnienia
rozgorzenia jest temperatura warstwy gazów pożarowych równa 600
0
C oraz gęstość
generowanego strumienia promieniowania cieplnego docierająca do poziomu podłogi rzędu
20 kW/m
2
.
Wsteczny ciąg płomieni (backdraft) zwany też ognistym podmuchem – jest to wybuch,
który powstaje przy zmianie spalania niecałkowitego występującego w atmosferze ubogiej
w tlen (duża ilość materiału palnego gotowego do reakcji spalania, przy małej ilości
powietrza skutkującego małą objętością płomienia lub jego brakiem) w natychmiastowe
spalanie wybuchowe mieszaniny palnej spowodowane natychmiastowym dostarczeniem
dużej ilości „świeżego” powietrza do pomieszczenia.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie części można wyróżnić w budowie płomienia?
2. Jak zmienia się temperatura pożaru podczas jego trwania?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
23
4.4.3. Ćwiczenia
Ćwiczenie 1
Wyznacz wartości temperatur osiągane przez różne materiały palne w procesie spalania.
Dokonaj pomiarów temperatury w różnych częściach płomienia.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki materiałów palnych,
4) wykonać pomiary temperatury części wewnętrznej i zewnętrznej płomienia dla różnych
próbek materiałów stałych, oraz temperaturę generowanych produktów spalania lub
produktów rozkładu termicznego,
5) wykonać pomiary temperatury części wewnętrznej i zewnętrznej płomienia dla różnych
próbek substancji ciekłych, oraz temperaturę generowanych produktów spalania lub
produktów rozkładu termicznego,
6) wykonać pomiary temperatury części wewnętrznej i zewnętrznej płomienia dla gazu, oraz
temperaturę generowanych produktów spalania lub produktów rozkładu termicznego,
7) opracować wyniki i wykonać analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne do badania temperatury w procesach spalania,
−
pirometr,
−
termopary,
−
materiały palne stałe, ciekłe i gazowe,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić budowę płomienia?
2) określić różnicę między płomieniem laminarnym a turbulencyjnym?
3) zdefiniować pożar?
4) omówić wymianę ciepła podczas pożaru?
5) rozróżnić zjawisko rozgorzenia i wstecznego ciągu płomieni?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
24
4.5. Proces spalania ciał stałych, cieczy oraz gazów
4.5.1. Materiał nauczania
Spalanie ciał stałych można zobrazować według następującego schematu:
Rys. 10. Proces spalania ciał stałych [8]
Analizując powyższy schemat, można jednoznacznie stwierdzić, iż aby nastąpił proces
spalania w pierwszej kolejności musi nastąpić rozkład termiczny materiału stałego. Bardzo
ważnym elementem jest strumień energii zwróconej, warunkujący ciągłość reakcji spalania.
Oprócz ciał stałych w postaci litej w profilaktyce pożarowej spotykamy się także
z materiałami w postaci pyłów.
W przypadku oceny zagrożenia pożarowego ciał stałych w postaci zwartej najczęściej
używa się wartości temperatury zapłonu oraz samozapłonu, natomiast w przypadku pyłów
używa się: temperatury tlenia warstwy pyłu i minimalnej temperatury zapłonu warstwy pyłu.
Temperatura tlenia warstwy pyłu zgodnie z PN-C-1200-12:1994 jest to najniższa
temperatura gorącej poziomej powierzchni, na której pył osiadły swobodnie w warstwie
grubości 10 mm ulega zatleniu w określonym czasie.
Minimalna temperatura zapłonu warstwy pyłu zgodnie z PN-50281-2-1:2002 jest to
najniższa temperatura gorącej powierzchni, w której dochodzi do zapłonu, znajdującej się na tej
powierzchni warstwy pyłu o grubości 5 mm.
Spalanie cieczy w powietrzu zachodzi w fazie lotnej, gdy nad powierzchnią palnej
cieczy, występuje stężenie jej par, co najmniej równe stężeniu odpowiadającemu dolnej
granicy zapalności (wybuchowości) DGW a ciecz posiada temperaturę, co najmniej równą jej
temperaturze zapłonu.
Spalanie gazów nie wymaga wcześniejszych przemian jak rozkład termiczny w ciałach
stałych czy parowanie w cieczach, gdyż gaz występuje w fazie (gazowej) gotowej do reakcji
z utleniaczem. Dlatego też, pomiędzy poszczególnymi ciałami występują duże różnice
w energii niezbędnej do zapoczątkowaniu ich reakcji spalania tzw. minimalnej energii
zapłonu (MEZ). Dla ciał stałych wartość niezbędnej energii jest największa a dla gazów
najmniejsza.
spalanie
bezpłomieniowe
+ powietrze
Zapalenie
mieszaniny
gazowej
Materiał
palny
Rozkład
termiczny
produkty
spalania
gazy niepalne
produkty ciekłe
zwęglona
pozostałość
powietrze
Energia cieplna zwrócona
z płomienia do materiału
gazy palne
spalanie
płomieniowe
-Q
1
proces endotermiczny
+Q
2
proces
egzotermiczny
+

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
25
Zarówno gazy, pary cieczy jak i ciała stałe (w postaci pyłów) są zdolne do spalania
wybuchowego. Zachodzić ono może tylko w określonym zakresie stężeń pomiędzy:
−
dolną granicą wybuchowości (zapalności) – DGW – minimalne stężenie, przy którym już
może nastąpić wybuch,
−
górną granicą wybuchowości (zapalności) – GGW – maksymalne stężenie, przy którym
jeszcze może nastąpić wybuch.
Do oceny siły wybuchu używa się zwykle następujących wielkości:
−
P
max
– maksymalne ciśnienie wybuchu [bar],
−
(dP/dt)
max
– maksymalna szybkość wzrostu ciśnienia [bar/s],
−
t – czas trwania wybuchu [s],
−
t
ind
– czas indukcji, okres czasu pomiędzy zapaleniem a początkiem wybuchu [s].
Siła wybuchu zależy od: ilości i składu mieszaniny, ciepła spalania, współczynnika zmiany
objętości (objętości przed i po wybuchu), typu otoczenia, gdzie następuje wybuch.
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to są pyły?
2. Jakie zagrożenie stwarzają pyły?
3. Jakie parametry opisują zagrożenia stwarzane przez pyły?
4. W jakim zakresie stężeń substancje ulegają spalaniu kinetycznemu?
4.5.3. Ćwiczenia
Ćwiczenie 1
Wykonaj analizę sitową oraz określ wilgotności badanych pyłów.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki pyłów,
4) przeprowadzić analizę granulometryczną (oznaczenie składu ziarnowego) substancji
ziarnistych, przy użyciu wytrząsarki,
5) określić zawartość wilgoci za pomocą wagosuszarki,
6) opracować wyniki i wykonać analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne,
−
wytrząsarka,
−
wagosuszarka,
−
waga laboratoryjna,
−
pyły przemysłowe, spożywcze, metali i tworzyw sztucznych,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
26
Ćwiczenie 2
Wyznacz minimalną temperaturę zapłonu warstwy badanych pyłów zgodnie
z normą PN-EN 50281-2-1:2002 Urządzenia elektryczne do stosowania w obecności pyłów
palnych – Część 2-1: Metody badania - Metody oznaczania minimalnej temperatury zapłonu
pyłu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego próbki pyłów (takie same jak w ćwiczeniu 1),
4) wykonać pomiary minimalnej temperatury zapłonu dla przygotowanych próbek,
5) opracować wyniki i wykonać analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne zgodne z normą PN-EN 50281-2-1:2002,
−
zestaw komputerowy z oprogramowaniem do rejestracji temperatury płyty grzewczej
i warstwy badanego pyłu,
−
pirometr,
−
waga laboratoryjna,
−
stoper,
−
pyły przemysłowe, spożywcze, metali i tworzyw sztucznych (takie jak w ćwiczeniu 1),
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
Ćwiczenie 3
Wytwórz mieszaninę wybuchową gazów, par cieczy oraz pyłów. Dokonaj obserwacji
efektów wybuchu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wskazane przez prowadzącego materiały palne,
4) wykonać próby tworzenia mieszanin wybuchowych dla przygotowanych substancji
palnych i obserwować ewentualne efekty wybuchów,
5) opracować wyniki.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
komora badawcza z możliwością tworzenia mieszanin wybuchowych pyłów, gazów lub
par cieczy z powietrzem, wyposażona w urządzenia pomiarowe służące do pomiaru
stężeń gazów lub par cieczy lub odważenia badanych próbek pyłów,
−
butle z gazami palnymi,
−
waga laboratoryjna,
−
pyły przemysłowe, spożywcze, metali i tworzyw sztucznych,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
27
−
ciecze palne,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
4.5.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić różnicę miedzy spalaniem dyfuzyjnym a kinetycznym?
2) określić etapy spalania ciał stałych?
3) zdefiniować minimalną temperaturę zapłonu warstwy pyłu?
4) omówić granice wybuchowości?
5) podać czynniki wpływające na siłę wybuchu?
6) wymienić parametry opisujące zagrożenie wybuchowe?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
28
4.6. Zjawisko samozapalenia oraz zagrożenia stwarzane przez
pożary metali
4.6.1. Materiał nauczania
Samozapalenie jak wspomniano w rozdziale 4.2.1. to proces polegający na
doprowadzeniu do samorzutnego samonagrzewania się substancji aż do pojawienia się
płomienia. Samozapalenie się ciała nie jest charakteryzowane przez podanie jego temperatury
samozapalenia, gdyż wyznaczenie jednej wartości temperatury samozapalenia dla danego
materiału nawet w określonym stanie skupienia jest niemożliwe.
Reakcja egzotermiczna warunkująca samozapalenie powstaje samorzutnie w samym
materiale lub mieszaninie materiałów (samonagrzewanie materiałów) bez udziału źródeł
ciepła dostarczanych z zewnątrz, w wyniku procesów biologicznych (rozmnażanie,
oddychanie komórek), zjawisk fizycznych (adsorpcji) lub reakcji chemicznych (utleniania,
polimeryzacji).
Przykładami związków samozapalających się pod wpływem powietrza są:
−
pierwiastki w stanie zwartym: fosfor (biały), rubit, cez, węgiel (sadza), siarka koloidalna
(bardzo rozdrobniona),
−
związki chemiczne: węgliki (K
2
C
2
, Na
2
C
2
, Li
2
C
2
), P
2
H
4
(fosfina), PH
3
, arsenowodór
AsH
3
, siarczki żelaza.
Związki samozapalające się pod wpływem wody (wilgoci) to m.in.:
−
metale lekkie,
−
wodorki NaH + H
2
O → NaOH + H
2
,
−
węgliki CaC
2
+ H
2
O → C
2
H
2
+ CaO,
−
fosforki Ca
3
P
2
+ 6H
2
O → 3Ca(OH)
2
+ 2PH
3
,
−
siarczki NaS + H
2
O (wilgoć) → NaOH + S (koloidalna),
−
krzemki MgSi
2
+ H
2
O → Mg(OH)
2
+ SiH
4
(silnie palny),
Bardzo dobre właściwości samozapalające wykazują oleje roślinne oraz tran, których
podatność do samonagrzewania określa się liczbą jodową.
Liczba jodowa jest to ilość jodu w gramach, którą może pochłonąć 100g oleju. Im
wyższa wartość jodowa, tym większa zdolność do samozapalenia.
Metale lekkie to metale, których gęstość jest mniejsza od 5000 kg/m
3
. Należą do nich
metale alkaliczne (I grupy układu okresowego), metale ziem alkalicznych (II grupy) oraz
skand, tytan, itr oraz glin.
Metale ciężkie to metale, których gęstość jest większa od 5000 kg/m
3
, są to m.in.: miedź,
kadm, nikiel, ołów, rtęć.
Pożary metali stanowią szczególne zagrożenie, ze względu na gwałtowny charakter
reakcji spalania, podczas której osiągane są bardzo wysokie temperatury spalania rzędu
2000-3000
0
C.
Z punktu widzenia ochrony przeciwpożarowej metale lekkie dzieli się na te,
które w warunkach normalnych reagują z wodą (lit, sód, potas, rubid, cez, wapń, bar,
stront) oraz te, które tylko dopiero podczas spalania reagują z wodą (aluminium, magnez,
tytan).
Gaszenie pożarów metali jest utrudnione z powodu wysokiej temperatury spalania
oraz ograniczonej liczby środków gaśniczych, które można zastosować. Woda oraz
wszystkie środki gaśnicze na bazie wody są nieskuteczne, a co więcej niebezpieczne.
Wynika to z reakcji metalu z wodą, w wyniku, której wytwarza się wodór:
2
2
H
NaOH
O
H
Na
+
→
+

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
29
Skutecznym środkiem gaśniczym do gaszenia metali są specjalne proszki gaśnicze
przeznaczone do grupy pożarów D, w przypadku ich braku można zastosować proszek
ABC lub suchy piasek.
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to jest samozapalenie?
2. W wyniku jakich procesów dochodzi do samonagrzewania substancji?
3. Co powstaje w wyniku reakcji metalu z wodą?
4.6.3. Ćwiczenia
Ćwiczenie 1
Doprowadź do samozapalenia gliceryny.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować glicerynę oraz nadmanganian potasu,
4) rozdrobnić kryształki nadmanganianu potasu w moździerzu,
5) usypać stożek z nadmanganianu na ognioodpornej płytce,
6) wlać 3 krople gliceryny na stożek,
7) obserwować przebieg reakcji.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne,
−
gliceryna oraz nadmanganian potasu,
−
moździerz,
−
ognioodporna płytka,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Dokonaj obserwacji przebiegu reakcji metalu z wodą. Wyjaśnij przebieg tej reakcji na
forum grupy.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować naczynie z wodą,
4) ukroić niewielki kawałek sodu,
5) za pomocą szczypiec, np.: łopatkowych wrzucić sód do wody,
6) obserwować przebieg reakcji,
7) wyjaśnić na forum grupy przebieg tej reakcji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
30
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne,
−
naczynie w wodą,
−
sód,
−
nóż,
−
szczypce,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
4.6.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić przebieg samonagrzewania i w efekcie samozapalenia
substancji?
2) określić temperaturę samozapalenia?
3) podać kilka substancji ulegających samozapaleniu?
4) rozróżnić metale lekkie i ciężkie?
5) wyjaśnić zakaz stosowania wody do gaszenia pożarów metali?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
31
4.7. Właściwości wody, mechanizm gaśniczy oraz zakres
stosowania
4.7.1. Materiał nauczania
Woda jest najczęściej stosowanym środkiem gaśniczym, ze względu na jej
dostępność, szerokie zastosowanie i właściwości gaśnicze.
Posiada jednak także wady. Najczęstsze problemy ze stosowaniem wody do celów
gaśniczych wynikają z:
−
sytuacji, w których woda jest nieskuteczna,
−
sytuacji, w których woda może stanowić zagrożenie, np.: elektroenergetyczne (dobrze
przewodzi prąd); pożary metali lub obecność konstrukcji metalowych nagrzanych do
wysokich temperatur; obecność substancji reagujących z wodą z wydzieleniem gazów
palnych i/lub toksycznych; obecność substancji reagujących w wodą egzotermicznie.
Najważniejsze właściwości wody mające wpływ na skuteczność gaśniczą to:
zalety:
wady:
−
wysokie ciepło właściwe
słaba zwilżalność
−
wysokie ciepło parowania
mała przyczepność do powierzchni
Własności gaśnicze związane są z:
−
działaniem chłodzącym – obniżanie temperatury palących się materiałów oraz strefy
spalania, wskutek odbioru ciepła,
−
działaniem rozrzedzającym strefę spalania – rozcieńczanie strefy spalania wytwarzającą
się na skutek odparowywania wody parą wodną – z 1dm
3
odparowanej wody powstaje
ponad 1700 dm
3
pary.
Podawanie wody w taki sposób, aby jak największa jej ilość uległa odparowaniu
przyczynia się do szybkiego ugaszenia pożaru, stąd wynika różnica w stosowaniu prądów
zwartych, rozproszonych i mgłowych.
Ciepło właściwe wody wynosi 4,19 kJ/kgK, co oznacza, że aby ogrzać 1 kg wody
(1 dm
3
) o 1K (1
0
C) należy dostarczyć 4,19 kJ.
Ciepło parowania wody wynosi 2257 kJ/kg, co oznacza, że 1kg wody (1 dm
3
)
odparowując, czyli przechodząc w wyniku ogrzewania (np.: przez pożar) ze stanu ciekłego
w gazowy jest w stanie odebrać z otoczenia 2257 kJ ciepła.
Ciepło ogrzewania wody (q
ogrz
) wyraża się wzorem:
)
(
o
k
p
o
w
ogrz
T
T
c
w
w
G
q
−
⋅
⋅
⋅
⋅
=
[kW]
Ciepło odparowania wody (q
odp
) wyraża się wzorem:
H
w
w
G
q
o
w
odp
∆
⋅
⋅
⋅
=
[kW]
gdzie:
G – szybkość masowa podawania wody [kg/s],
ΔH – ciepło parowania [kJ/kg],
c
p
– ciepło właściwe [kJ/kgK],
w
w
– stopień wykorzystania wody,
w
o
– stopień odparowania wody,
T
k
– temperatura końcowa [K],
T
0
– temperatura początkowa [K].
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
32
Środki dodawane do wody w celu podniesienia skuteczności gaśniczej to:
−
środki zwilżające – ich dodatki w ilości 0,1 – l % znacznie zwiększają szybkość wnikania
wody w hydrofobowe materiały porowate,
−
środki zagęszczające – mające na celu zwiększenie przyczepności wody do gaszonych
materiałów,
−
inne środki: zmniejszające szybkość parowania, obniżające temperaturę krzepnięcia.
Czynniki określające jakość i przydatność środków zwilżających to zdolność obniżania
napięcia powierzchniowego, kąt zwilżania i zdolność emulgowania.
Napięcie powierzchniowe (σ) definiowane jest jako praca, którą trzeba wykonać, by
utworzyć jednostkową powierzchnię cieczy:
S
W
=
σ
=
=
m
N
m
J
2
σ
gdzie:
W – praca potrzebna do utworzenia powierzchni S [J],
S – pole powierzchni [m
2
].
Zwilżalność jest to zdolność do pokrywania ciała stałego przez ciecz, jej miarą jest
kąt zwilżania.
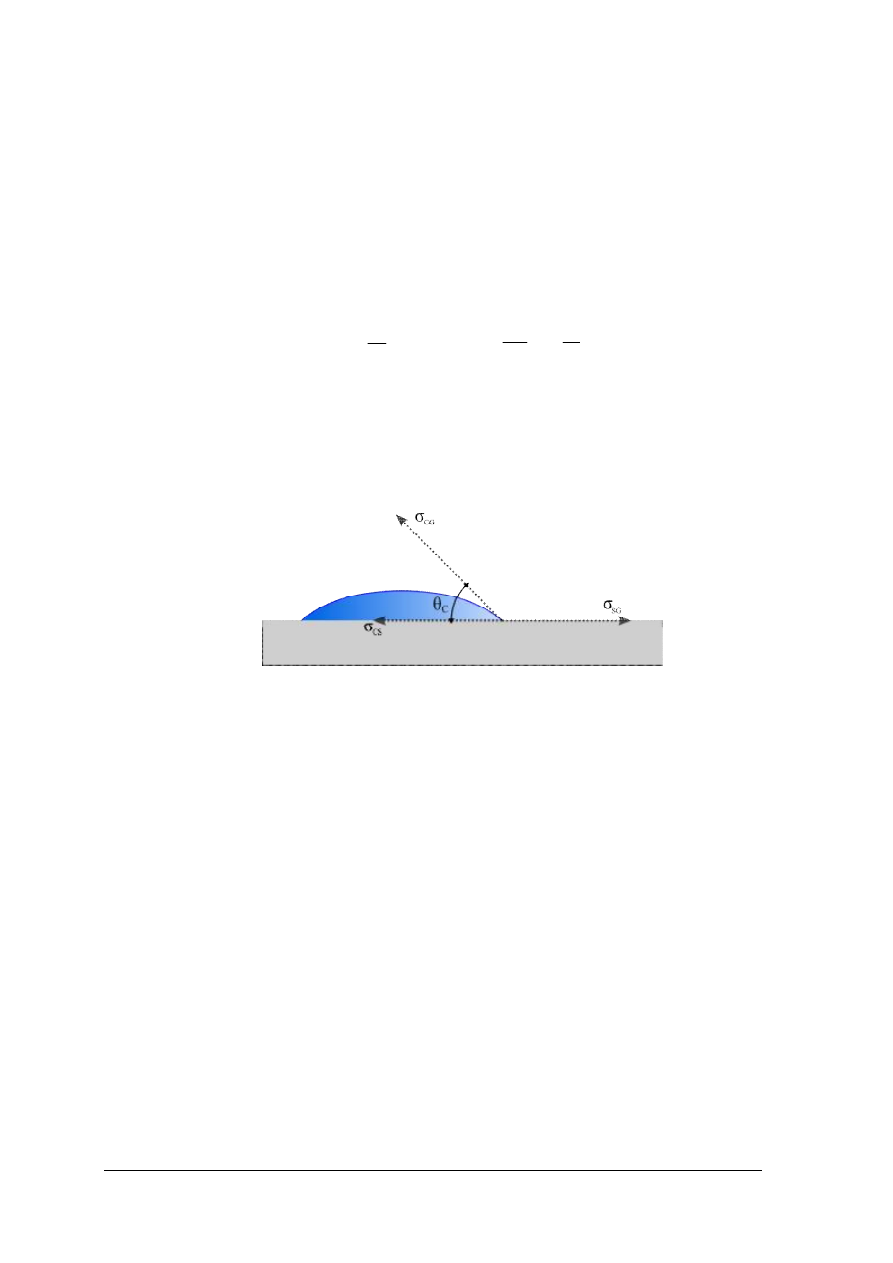
Kąt zwilżania (kąt graniczny) – jest to kąt, jaki tworzy z powierzchnią ciała stałego
ciecz znajdująca się w stanie równowagi z ciałem stałym i fazą gazową.
Rys. 11. Styk ciała stałego, cieczy i gazu [27]
W stanie równowagi wypadkowa sił napięcia powierzchniowego musi być równa 0, tzn.
C
CG
CS
SG
θ
σ
σ
σ
cos
⋅
+
=
Jeżeli θ
C
= 0 – ciecz nie tworzy kropli, lecz rozlewa się w postaci błonki na powierzchni
ciała stałego, mówi się wtedy o zwilżaniu zupełnym.
Jeżeli θ
C
є (0
0
, 90
0
) – oznacza to, że ciecz dobrze zwilża ciało stałe.
Jeżeli θ
C
є (90
0
, 180
0
) – oznacza to, że ciecz źle zwilża ciało stałe.
Obniżanie napięcia powierzchniowego oraz zwiększanie zwilżalności wody osiąga się
za pomocą związków powierzchniowo-czynnych.
Związki powierzchniowo czynne ZPC (surfaktanty) to substancje chemiczne
wykazujące tendencję do gromadzenia się na powierzchni i obniżania napięcia
powierzchniowego cieczy. Składają się z grupy hydrofilowej (naładowana grupa,
zapewniającej rozpuszczalność w wodzie) oraz grupy hydrofobowej (tworzy warstwy
adsorpcyjne, co jest właśnie przyczyną obniżania napięcia powierzchniowego).
Emulgowanie to proces prowadzący do wytworzenia emulsji, czyli układu dwóch faz
ciekłych, nie mieszających się ze sobą, z których jedna – faza rozproszona – zawieszona
jest w drugiej fazie, w postaci kropelek, o średnicy od 0,1 do 1 μm. Zjawisko to znajduje
zastosowanie przy gaszeniu pożarów cieczy hydrofobowych wodą, ze względu na
rozwarstwianie się obu cieczy.
Środki zagęszczające mają na celu podniesienie skuteczności gaśniczej wody przez
zwiększenie przyczepności wody do gaszonych materiałów. Woda zagęszczona,
tzw. lepka, przylega dłużej do powierzchni odchylonych nawet znacznie od poziomu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
33
Ponadto po odparowaniu wody zagęszczacze tworzą szczelną warstwę odcinającą
powietrze. Dla celów pożarniczych średnia lepkość wodnych roztworów mieści się
w zakresie od kilku do 150cP (P-puaz = g/cm·s).
4.7.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Na czym polega działanie chłodzące wody i od czego zależy skuteczność gaśnicza wody?
2. Co to jest zwilżalność i w jaki sposób się ją wyraża?
4.7.3. Ćwiczenia
Ćwiczenie 1
Oblicz, jaki strumień ciepła może odebrać strumień wody o temperaturze początkowej
15
0
C podawany z szybkością 400 dm
3
/min, jeżeli 40% wody nie dociera do strefy pożaru,
pozostała część wody w 50% odparowuje, a w 50% ogrzewa się do temperatury końcowej
70
0
C.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) wypisać dane,
2) zapisać zależności na ciepło ogrzewania i odparowania wody,
3) obliczyć strumień ciepła.
Wyposażenie stanowiska pracy:
−
zeszyt i przybory do pisania,
−
kalkulator.
Ćwiczenie 2
Wykonaj badanie zdolności zwilżających środków powierzchniowo-czynnych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować krążki z materiału i badane ciecze o różnych stężeniach zgodnie z instrukcją,
4) wykonać pomiary,
5) opracować wyniku i wykonać analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do wykonania ćwiczenia,
−
stanowisko laboratoryjne z układem pomiarowym zgodnym z PN-EN 1772:2001,
−
tkanina bawełniana,
−
płyn do naczyń, środki pianotwórcze,
−
stoper,
−
naczynia miarowe,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
34
4.7.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić wpływ środków zwilżających na gaśnicze właściwości
wody?
2) określić strumień ciepła odbierany przez wodę?
3) wyjaśnić co to jest napięcie powierzchniowe?
4) wymienić sytuacje, w których nie wolno stosować wody?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
35
4.8. Rodzaje środków pianotwórczych, właściwości pian,
mechanizm gaśniczy oraz zakres stosowania
4.8.1. Materiał nauczania
Piana gaśnicza to środek gaśniczy, który otrzymuje się w wyniku energicznego
zmieszania wodnego roztworu środka pianotwórczego z powietrzem lub gazem obojętnym.
woda + koncentrat środka pianotwórczego
→
roztwór środka pianotwórczego
W pożarnictwie wykorzystuje się roztwory o różnym stężeniu, najczęściej od 1 do 6%
środka pianotwórczego. Koncentrat pianotwórczy to mieszanina wielu substancji
chemicznych (stałych lub ciekłych), nadających odpowiednie własności pianotwórcze,
obniżających temperaturę krzepnięcia, zwiększających trwałość pian i ich odporność
termiczną.
Rodzaje środków pianotwórczych:
−
proteinowe (P),
−
fluoroproteinowe (FP),
−
syntetyczne (S),
−
fluorosyntetyczne tworzące film wodny (AFFF,A3F),
−
fluoroproteinowe tworzące film wodny (FFFP),
−
alkoholoodporne (AR),
−
klasy A.
Właściwości pian gaśniczych określają podstawowe parametry: liczba spienienia,
dyspersyjność, trwałość i płynność.
Liczba spienienia (L
s
) – jest to stosunek objętości piany do objętości roztworu, z którego
ta piana została wytworzona.
r
p
s
V
V
L
=
gdzie:
V
p
– objętość piany [m
3
],
V
r
– objętość roztworu [m
3
].
Piany pod względem liczby spienienia dzieli się na pianę: ciężką (L
s
<20), średnią
(20<L
s
<200) oraz lekką(L
s
>200).
Dyspersyjność D
p
jest parametrem określającym stopień rozdrobnienia pęcherzyków
piany.
pp
p
d
D
1
=
=
mm
D
p
1
gdzie:
d
pp
– średnica pęcherzyka piany [mm].
Trwałość piany – jest to jej zdolność do zachowania swoich właściwości, jakie uzyskała
w momencie wytworzenia. Piana jest układem niestabilnym, dlatego też parametr ten ma
istotne znaczenie podczas działań w ochronie przeciwpożarowej.
Trwałość piany określana jest na podstawie szybkości wypływu z niej wodnego roztworu
środka pianotwórczego (zjawisko synerezy). Miarą trwałości piany jest czas, w którym
wypłynie 25% lub 50% objętości roztworu, z którego piana została wytworzona
(odpowiednio oznaczane jako W
1/4
i W
1/2
).
Płynność piany jest to zdolność do rozpływania się po powierzchniach ciał stałych lub
cieczy. Szybkie rozpływanie się piany gaśniczej jest cechą pożądaną. Im szybciej rozpływa się
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
36
piana po powierzchni palącego się materiału, tym krótszy jest kontakt jej z płomieniami,
mniejsze niszczenie piany spowodowane wysoką temperaturą i szybsze gaszenie pożaru.
Porównanie własności różnych pian zestawiono w tabeli nr 2.
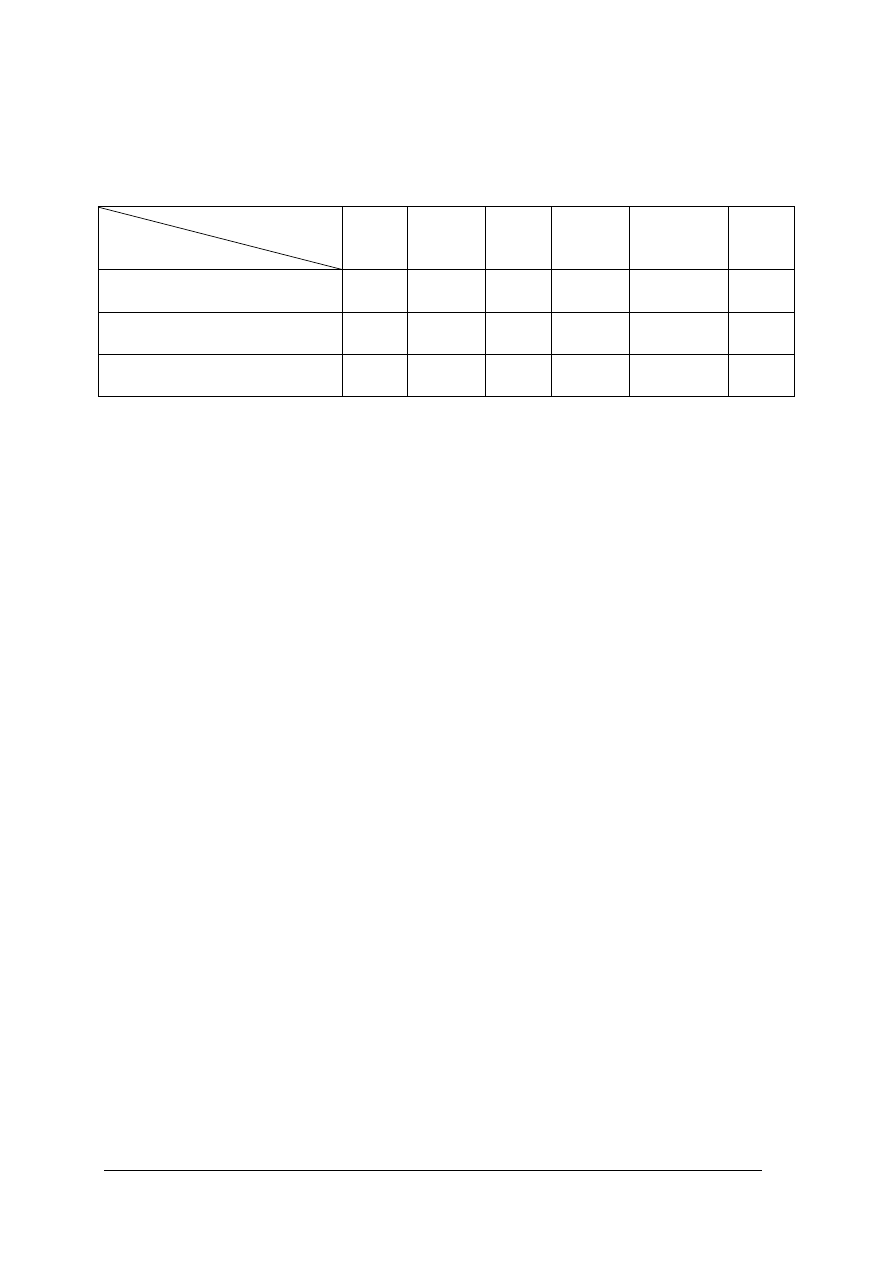
Tabela 2. Własności pian otrzymanych z różnych środków pianotwórczych [6]
Środek pianotwórczy
Własność
P
FP
FFFP
AFFF
AR-AFFF
S
Szybkość rozpływania
niska
średnia
dobra
bardzo
dobra
dobra
dobra
Odporność na nawrót palenia
bardzo
dobra
bardzo
dobra
dobra
dobra
bardzo
dobra
niska
Odporność na niszczące
działanie paliw
niska
dobra
dobra
dobra
bardzo
dobra
niska
Mechanizm gaśniczy pian polega na:
−
oddzieleniu strefy spalania od otaczającego powietrza,
−
chłodzeniu strefy spalania i paliwa wyciekającym z piany roztworem,
−
izolowaniu termicznym (ochrona przed nagrzewaniem),
−
wypieraniu powietrza (przy wypełnianiu lub zalewaniu pianą pomieszczeń)
−
ograniczaniu parowania cieczy lub wydzielania się gazów z materiału stałego.
Piany stosowane są przede wszystkim do zwalczania pożarów grupy B, rzadziej
stosowane są w przypadku pożarów grupy A. Zaleca się stosowanie pian do gaszenia pożarów
środków transportu, gdzie zagrożenia związane z pożarami klasy A i B występują wspólnie.
Z powodzeniem można piany także stosować do gaszenia pożarów lasów i traw czy
nieużytków i upraw rolnych (piana ciężka i średnia). Pianę średnią i lekką można także
stosować do wypełniania zagrożonych przestrzeni (zamkniętych), natomiast pianą ciężką
i średnią można zabezpieczać rozlewiska paliw, substancji niebezpiecznych i inne zagrożone
pożarem obszary (także otwarte). Piany lekkiej nie należy stosować na otwartych
przestrzeniach, gdyż jest bardzo wrażliwa na warunki atmosferyczne, szczególnie wiatr.
Ograniczenia w stosowaniu piany są podobne jak w przypadku wody, ze względu na
fakt, że stanowi ona bazę dla tego środka gaśniczego.
4.8.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to jest piana gaśnicza i w jaki sposób powstaje?
2. Co to jest liczba spienienia?
3. W jaki sposób określa się trwałość pian?
4. Co to jest napięcie powierzchniowe?
4.8.3. Ćwiczenia
Ćwiczenie 1
Wytwórz pianę gaśniczą, oblicz jej liczbę spienienia i zbadaj jej właściwości.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
37
2) przygotować stanowisko do pracy zgodne z PN-EN 1568-1:2002,
3) przygotować roztwór badanego środka pianotwórczego,
4) wytworzyć pianę za pomocą znormalizowanej prądownicy laboratoryjnej,
5) obliczyć liczbę spienienia,
6) zapisywać odpowiednie wielkości zgodnie z instrukcją,
7) opracować wyniki i wykonać wykres synerezy.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne zgodne z PN-EN 1568-1:2002,
−
środki pianotwórcze,
−
naczynia miarowe,
−
stoper,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Określ
lepkość,
napięcie
powierzchniowe,
temperaturę
krzepnięcia
środków
pianotwórczych oraz ich roztworów.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowiska do pracy,
3) przygotować wyznaczone przez prowadzącego środki pianotwórcze i ich roztwory,
4) dokonać pomiaru lepkości, napięcia powierzchniowego oraz temperatury krzepnięcia
poszczególnych próbek,
5) zapisać wyniki i wykonać ich analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne do badania lepkości zgodne z PN-EN 1568-1:2002
(wiskozymetr Höpplera),
−
stanowisko
laboratoryjne
do
pomiaru
napięcia
powierzchniowego
metodą
stalagmometryczną zgodne z PN-EN 1568-1:2002,
−
stanowisko
laboratoryjne
do
badania
temperatury
krzepnięcia
zgodne
z PN-EN 1568-1:2002,
−
środki pianotwórcze,
−
naczynia miarowe,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
38
4.8.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić sposób otrzymywania pian gaśniczych?
2) wymienić rodzaje środków pianotwórczych?
3) podać klasyfikację pian ze względu na liczbę spienienia?
4) omówić mechanizmy gaśnicze piany?
5) wyjaśnić przyczynę nietrwałości piany?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
39
4.9. Rodzaje proszków oraz gazów gaśniczych, ich właściwości,
mechanizm gaśniczy oraz zakres stosowania
4.9.1. Materiał nauczania
Proszki gaśnicze – to mieszaniny ciał stałych złożonych z jednego lub więcej
składników posiadających właściwości gaśnicze (stanowiących bazę proszków) oraz
dodatków, których celem jest nadanie sproszkowanej bazie odpowiednich właściwości
techniczno-użytkowych, takich jak: płynność, odporność na zbrylanie, higroskopijność, itp.
Mechanizmy gaśnicze proszków opierają się na:
−
działaniu inhibicyjnym – zasadnicze działanie proszków przeznaczonych do gaszenia
pożarów gazów, cieczy palnych i ciał stałych, które w warunkach pożaru topią się,
−
działaniu izolującym – w przypadku proszków przeznaczonych do gaszenia metali i ciał
stałych.
Proszki klasyfikuje się w zależności od grup pożarów, do których są przeznaczone:
−
proszki BC – do gaszenia pożarów płomieniowych, podstawowymi składnikami tych
proszków są wodorowęglany metali alkalicznych (KHCO
3
, NaHCO
3
), węglany (Na
2
CO
3
,
CaCO
3
) oraz siarczany (K
2
SO
4
),
−
proszki ABC (uniwersalne) – do gaszenia pożarów płomieniowych, bezpłomieniowych
oraz ewentualnie płonących metali, głównymi składnikami są ortofosforany amonowe
(NH
4
H
2
PO
4
, (NH
4
)
2
HPO
4
), niekiedy z dodatkiem siarczanów i wodorosiarczanów
amonowych ((NH
4
)
2
SO
4
, NH
4
HSO
4
),
−
proszki D (specjalne) – do gaszenia pożarów metali, zawierające głównie chlorki sodu
i potasu (NaCl, KCl), czteroboran sodu (Na
2
B
4
O
7
∙10H
2
O), grafit, mikrogranulki
węglowe, wysokotopliwe żywice.
Parametry fizyczne proszków można podzielić na:
−
produkcyjne jak na przykład: skład ziarnowy i związana z tym gęstość nasypowa
i powierzchnia właściwa czy gęstość właściwa zależna od składu chemicznego proszku,
−
użytkowe m. in.: własności hydrofobowe, sypkość, odporność na składowanie
w warunkach wahającej się wilgotności i temperatury, odporność na wstrząsy, z czym
związane jest zmniejszenie objętości (tzw. zagęszczalność), możliwość współdziałania
z pianą, przewodnictwo elektryczne proszku i obłoku proszkowego, skuteczność
gaśnicza.
Gęstość nasypowa – jest to stosunek masy proszku do jego objętości, jaką zajmuje
w warstwie po swobodnym przesypywaniu.
Powierzchnia właściwa – to stosunek powierzchni cząstki do jej masy lub objętości.
Zagęszczalność – jest to procentowy ubytek objętości warstwy proszku po określonym
czasie wibrowania.
Sypkość (płynność) proszku – to zdolność do przemieszczania się pod wpływem
działania siły ciężkości.
Skuteczność gaśnicza proszku w dużej mierze zależy od składu, ale również od stopnia
rozdrobnienia, szczególnie dla proszków działających inhibicyjnie. Im proszek bardziej
rozdrobniony (ale tylko do pewnego stopnia), tym jego efektywność gaśnicza jest wyższa.
Zakres stosowania proszku gaśniczego uzależniony jest od mechanizmu gaśniczego,
a tym samym od jego rodzaju. Proszek jest skuteczny w stosunku do tych grup pożarów, które
określone są już w oznaczeniu rodzaju proszku. Ważną zaletą tego środka gaśniczego jest
możliwość stosowania go w kontakcie z urządzeniami elektrycznymi najczęściej o napięciu
do 1000V jednak z odpowiedniej odległości.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
40
Gazy gaśnicze – to gazy i pary służące do gaszenia pożarów lub zastosowań
profilaktycznych w celu zabezpieczenia przed powstaniem pożaru lub wybuchu. Gazy
gaśnicze stosowane są zarówno do gaszenia różnych materiałów, linii technologicznych
jak i urządzeń przemysłowych. W profilaktyce do zabezpieczania przed powstaniem
pożaru lub wybuchu stosowane są w pomieszczeniach, magazynach, zbiornikach,
przewodach, mieszalnikach, itp. W przypadku gazów gaśniczych wymagane jest
uzyskanie jednego z dwóch zakładanych wartości stężenia.
Stężenie gaszące – najniższe stężenie gazu w powietrzu powodujące zgaśnięcie
płomienia dyfuzyjnego paliwa.
Stężenie inertujące – najniższe stężenie gazu gaśniczego w powietrzu, przy którym
dany gaz lub pary cieczy nie zapalają się przy dowolnym stężeniu w określonych
warunkach.
W zależności od mechanizmu działania gaśniczego gazów wyróżniamy dwie grupy:
gazy obojętne oraz halony i ich zamienniki.
Do najczęściej stosowanych gazów obojętnych zaliczamy: dwutlenek węgla, azot, argon,
mieszaniny tych gazów oraz gazy spalinowe.
Mechanizm działania gaśniczego gazów obojętnych polega na zmniejszeniu stężenia
tlenu znajdującego się w strefie spalania do wartości umożliwiającej zahamowanie procesu
spalania (do wartości około 12-15% dla większości materiałów palnych).
Halony – to organiczne związki węgla, w których atomy wodoru zostały całkowicie lub
częściowo zastąpione atomami chlorowców. Są bardzo skutecznym środkiem gaśniczym, ale
ze względu na toksyczność i negatywne oddziaływanie na warstwę ozonową zostały
wycofane. Powodem wycofania halonów i wprowadzenia ich zamienników był brom, który
był czynnikiem niszczącym warstwę ozonową.
Najpopularniejsze halony to m.in.: 1211, 1301, 2402 i 1040.
Działanie gaśnicze halonów i ich zamienników polega na chemicznym wychwytywaniu
wolnych rodników oraz katalizowaniu ich rekombinacji. Zasada tworzenia nazw halonów
oparta jest na zawartości poszczególnych pierwiastków, zgodnie z rys 12.
Rys. 12. Zasada tworzenia nazw halonów [5]
Najpopularniejsze zamienniki halonów to m.in.: FM - 200 (C
3
F
7
H), FE – 13 (CHF
3
), FE – 36
(C
3
H
2
F
6
), FE – 241 (C
2
HClF
4
), FE – 25 (C
2
HF
3
), CEA – 308 (C
3
F
8
), CEA – 410 (C
4
F
10
).
4.9.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak definiuje się powierzchnię właściwą oraz gęstość nasypową proszku?
2. Co to jest zagęszczalność i sypkość proszku?
3. Do jakich grup pożarów stosuje się wodę, pianę i proszek?
4. Jaki proszek należy stosować przy pożarach ciał stałych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
41
4.9.3. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie powierzchni właściwej, gęstości nasypowej, zagęszczalności oraz
sypkości wybranych proszków.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowiska do pracy,
3) przygotować wyznaczone przez prowadzącego proszki gaśnicze,
4) dokonać pomiaru powierzchni właściwej, gęstości nasypowej, zagęszczalności oraz
sypkości poszczególnych próbek,
5) zapisać wyniki i wykonać ich analizę.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne do oznaczania powierzchni właściwej – powierzchniomierz
Blaine`a,
−
cylinder o pojemności 250 cm
3
z korkiem,
−
wibrator o częstotliwości drgań 60-70Hz,
−
układ pomiarowy do badania sypkości proszku,
−
proszki gaśnicze,
−
naczynia miarowe,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Wykonaj badanie skuteczności gaśniczej wody, piany oraz proszku w stosunku do
różnych materiałów palnych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowiska do badania skuteczności gaśniczej (stos drewna, stos opon, mała
i duża taca z olejem napędowym),
3) rozwinąć linię główną zakończoną rozdzielaczem, jedną linię gaśniczą zakończoną
prądownicą typu Turbo-Jet oraz drugą zbudowaną z dwóch odcinków z zasysaczem
liniowym zakończoną wytwornicą pianową,
4) rozpalić kolejno poszczególne stanowiska,
5) podawać na palący się stos drewna proszek BC, następnie ABC,
6) podawać na palący się stos drewna wodę, następnie pianę gaśniczą,
7) podawać na palący się stos opon kolejno wodę, proszek BC, pianę,
8) podawać na małą tacę proszek BC,
9) podawać na dużą tacę proszek BC, następnie pianę,
10) obserwować i porównywać skuteczność gaśniczą badanych środków.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
42
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
samochód gaśniczy,
−
sprzęt i armatura wodno – pianowa (zasysacz liniowy, wytwornica pianowa, prądownica
Turbo-Jet),
−
gaśnice proszkowe ABC oraz BC,
−
materiały palne (drewno, opony, benzyna, olej opałowy),
−
tace do pożarów grupy B,
−
środki ochrony indywidualnej.
4.9.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić nieskuteczność gaśniczą wody w stosunku do opon?
2) dobrać najbardziej skuteczny środek gaśniczy w przypadku pożaru
opon?
3) podać
przyczyny
nieskuteczności
gaśnicy
proszkowej
BC
w przypadku pożaru drewna?
4) omówić skuteczność gaśniczą wody i piany w stosunku do pożarów
cieczy palnych?
5) wyjaśnić różnice między skutecznością gaśniczą proszków ABC i BC
w stosunku do pożarów ciał stałych?
6) wyjaśnić różnicę między gazami obojętnymi i halonami?
7) wyjaśnić dlaczego halony zostały wycofane i jakie środki zajęły ich
miejsce?
8) podać różnicę między stężeniem gaszącym a inertującym?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
43
4.10. Właściwości neutralizatorów, sorbentów i dyspergentów
4.10.1. Materiał nauczania
Neutralizacja – to reakcja zobojętnienia zachodząca pomiędzy kwasem a zasadą,
w wyniku, której powstaje sól i woda, a wynikiem reakcji jest powstanie roztworu
obojętnego. Neutralizator to substancja posiadająca właściwości zobojętniające.
Najbardziej popularne neutralizatory to podchloryn sodu, kwaśny węglan sodu, żel
krzemowy, tiosiarczan sodu (antychlor), wapno gaszone, siarczan sodu. Ponadto
opracowane zostały roztwory dekontaminacyjne (tabela 3), które należy stosować do
odpowiedniej klasy rozpoznanego związku zgodnie z tabelą 4.
Tabela 3. Skład roztworów dekontaminacyjnych [10]
Roztwór dekontaminacyjny
Skład roztworu
RD 1
5% Na
2
CO
3
i 5% Na
3
PO
4
RD 2
10% Ca(ClO)
2
RD 3
5% Na
3
PO
4
RD 4
1% HCl
RD 5
wodny roztwór detergentu najlepiej domowego użytku
Tabela 4. Wybór RD w zależności od rodzaju substancji niebezpiecznej [10]
L.p.
Klasa rozpoznanego związku chemicznego
Roztwór
dekontaminacyjny
1
Nieorganiczne kwasy, odpady procesu przeróbki metali
1
2
Metale ciężkie rtęć, ołów, kadm, itp.
2
3
Pestycydy, chlorowane fenole, środki chwastobójcze
2
4
Cyjanki, amoniak i inne niekwaśne i nieorganiczne
odpady
2
5
Rozpuszczalniki i związki organiczne takie jak:
trójchloroetylen, chloroform, trójchloroetan i toluen
1 lub 3
6
Dwufenyle polichlorowane i polibromowane
1 lub 3
7
Oleje natłuszczone i inne niewymienione odpady nie
skażone pestycydami
3
8
Nieorganiczne zasady (wodorotlenki) alkaliczne i żrące
odpady
4
9
Materiały radioaktywne
5
10
Materiały chorobotwórcze
1 i 2
Sorpcja jest to pochłanianie gazów, par, cieczy i ciał rozpuszczonych lub znajdujących
się w cieczy przez porowate ciało stałe. Sorbent to ciało porowate zdolne do wchłaniania
pewnej ograniczonej ilości substancji zanieczyszczającej środowisko. Adsorpcja to proces
wiązania się cząsteczek, atomów lub jonów na powierzchni lub granicy faz fizycznych.
Absorpcja to proces polegający na wnikaniu cząsteczek, atomów lub jonów do wnętrza innej
substancji.
Jednym z podziałów sorbentów, jest ich podział ze względu na pochodzenie na:
−
naturalne: organiczne (słoma zbelowana, trociny, kora drzewna, torf) i nieorganiczne:
(piasek, kruszywa),
−
syntetyczne (wełna szklana, Uni-safe, Damolin, Ekoperl).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
44
Innym podziałem sorbentów jest podział ze względu na możliwość ich stosowania na
akwenach (powierzchniach wodnych), na:
−
sorbenty pływające,
−
sorbenty niepływające.
Sorbenty przede wszystkim wykorzystywane są do:
−
zwalczania rozlewisk olejowych i substancji chemicznych,
−
ograniczania obszaru rozlewisk,
−
usuwania substancji oraz ich pozostałości.
Podczas zwalczania rozlewów olejowych z wykorzystaniem sorbentów należy:
−
ograniczyć zasięg rozlewiska,
−
zatamować wyciek substancji,
−
zebrać rozlaną substancję w sposób mechaniczny,
−
pokryć miejsce rozlewu czy rozlewiska sorbentem,
−
zebrać zużyty sorbent,
−
doczyścić pozostałą plamę,
−
oddać do utylizacji wykorzystany sorbent.
Miarą praktycznej przydatności sorbentu jest jego chłonność. Chłonność sorbentu – to
stosunek masy wchłoniętej substancji do masy luźnego sorbentu, który ją wchłonął.
Dyspergowanie to zjawisko polegające na rozpraszaniu przez środki powierzchniowo
czynne węglowodorów znajdujących się w wodzie na szereg licznych, miniaturowych
drobinek, które ulegają łatwiejszej biodegradacji. Dyspergenty – to środki powierzchniowo
czynne znajdujące zastosowanie podczas usuwania plam substancji ropopochodnych
z powierzchni wód i gruntów.
Do najbardziej popularnych dyspergentów zaliczamy: Aquaquick oraz Sintan.
Dyspergenty ze względu na swoje zastosowanie spełniać muszą podstawowe
wymagania, m. in.: niepalność, neutralność, wysokie właściwości odtłuszczające oraz szybką
biodegradowalność.
Ogólne zasady stosowania dyspergentów podczas działań opierają się na:
−
przygotowaniu roztworu,
−
pokryciu dyspergentem powstałej plamy,
−
mechanicznym wzburzeniu mieszaniny,
−
zebraniu sorbentem naniesionego dyspergentu,
−
spłukaniu powierzchni silnym prądem wody,
−
utylizacji odpadów.
4.10.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. W jaki sposób działają sorbenty?
2. Co określa nam parametr chłonność sorbentu?
3. Na czym polega działanie neutralizatorów i do czego prowadzi?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
45
4.10.3. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie chłonności różnych sorbentów. Porównaj wyniki.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować wchłaniane ciecze oraz badane sorbenty,
4) dokonać pomiarów,
5) porównać wyniki.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne ze statywem do mocowania, opuszczania i podnoszenia sitek,
−
sitka w kształcie stożków
−
ciecze ropopochodne,
−
sorbenty,
−
środki ochrony indywidualnej,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Dokonaj identyfikacji kwasów i zasad oraz wykonaj ich neutralizację.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z instrukcją wykonania ćwiczenia,
2) przygotować stanowisko do pracy,
3) przygotować kwas i zasadę oraz dobrać do tych substancji odpowiednie,
4) zbadać pH badanych cieczy i określić ich odczyn,
5) dodawać stopniowo odpowiedni neutralizator do kwasu lub zasady, ciągle kontrolując pH
roztworu,
6) obserwować przebieg reakcji zobojętniania.
Wyposażenie stanowiska pracy:
−
instrukcja do ćwiczenia,
−
stanowisko laboratoryjne z blatem z blachy kwasoodpornej,
−
pehametr,
−
indykatory pH,
−
naczynia miarowe, pipety, pompki,
−
termometr,
−
odczynniki: kwasy, zasady, neutralizatory,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
46
4.10.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić różnicę między adsorpcją i absorpcją?
2) określić chłonność sorbentu?
3) podać kilka przykładów neutralizatorów, sorbentów i dyspergentów?
4) rozróżnić mechanizm działania neutralizatorów, sorbentów
i dyspergentów?
5) omówić zasady stosowania sorbentów?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
47
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 21 zadań. Do każdego zadania dołączone są 4 możliwości odpowiedzi.
Tylko jedna jest prawidłowa.
5. Udzielaj odpowiedzi na załączonej karcie odpowiedzi, stawiając w odpowiedniej rubryce
znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową.
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Jeśli udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8. Na rozwiązanie testu masz 40 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1. Równanie gazu doskonałego ma postać
a)
nRT
pV
=
.
b)
nRV
pT
=
.
c)
nR
V
pT
=
.
d)
nR
pVT
=
.
2. Między licznością materii (n), a liczbą Avogadra (N
A
) istnieje zależność
a)
N
N
n
A
=
.
b)
A
N
N
n
=
.
c)
A
N
N
n
⋅
=
.
d)
A
N
N
n
−
=
.
3. Przemiana 1-2 przedstawiona na wykresie p(V) to przemiana
a) izotermiczna.
b) izochoryczna.
c) izobaryczna.
d) adiabatyczna.
4. Zasada, że nie istnieje proces, w którym ciepło przechodziłoby samorzutnie od ciał
chłodniejszych do ciał bardziej ogrzanych, wynika z
a) 0 zasady termodynamiki.
b) I zasady termodynamiki.
c) II zasady termodynamiki.
d) III zasady termodynamiki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
48
5. Do właściwości chemicznych należy
a) barwa.
b) kruchość.
c) plastyczność.
d) palność.
6. Równanie Arrheniusa opisuje zależność
a)
RT
E
Ae
k
a
=
.
b)
RT
E
a
Ae
k
−
=
.
c)
RT
E
a
Ae
k
=
.
d)
a
E
RT
Ae
k
=
.
7. Spalanie jest to
a) proces kontrolowany, który zachodzi w ściśle określonej objętości.
b) proces niekontrolowany, który zachodzi w ściśle określonej objętości.
c) proces kontrolowany, który nie zachodzi w ściśle określonej objętości.
d) proces niekontrolowany, który nie zachodzi w ściśle określonej objętości.
8. Wartość ciepła spalania dla takiej samej substancji
a) jest mniejsza od wartości opałowej.
b) jest większa od wartości opałowej.
c) jest równa wartości opałowej.
d) jest zależna od temperatury zapłonu.
9. Najniższa temperatura cieczy, w której nad powierzchnią istnieje mieszanina zdolna do
zapalenia od zewnętrznego punktowego bodźca energetycznego, a powstały płomień
rozprzestrzenia się na całą powierzchnię, to
a) temperatura zapalenia.
b) temperatura samozapalenia.
c) temperatura zapłonu.
d) temperatura samozapłonu.
10. Produktem niecałkowitego spalania jest
a) tlenek węgla (IV).
b) tlenek węgla (II).
c) woda.
d) tlenek fosforu (V).
11. Największe znaczenie w przypadku rozprzestrzeniania pożaru w mieszkaniu ma
a) przenikanie i promieniowanie.
b) promieniowanie i konwekcja.
c) przewodzenie i konwekcja.
d) przewodzenie i przenikanie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
49
12. Największa siła wybuchu jest wtedy, gdy
a) utleniacz i materiał palny są w stężeniu przypadającym na środek granic
wybuchowości.
b) utleniacz i materiał palny są w stężeniu stechiometrycznym.
c) utleniacz i materiał palny są w stężeniu GGW.
d) utleniacz i materiał palny są w stężeniu DGW.
13. Ciecz, która ulega zapłonowi w warunkach normalnych bez konieczności ogrzewania, to
a) 40% alkohol.
b) olej napędowy.
c) olej opałowy.
d) benzyna.
14. Liczba jodowa jest to
a) ilość jodu w gramach, którą może pochłonąć 100g oleju.
b) ilość jodu w gramach, która może pochłonąć 100g oleju.
c) ilość jodu w gramach, którą może pochłonąć 100g benzyny.
d) ilość jodu w gramach, która może pochłonąć 100g benzyny.
15. Wodę jako środek gaśniczy nie można stosować podczas gaszenia
a) mieszkań.
b) lasów.
c) drewna.
d) metali.
16. W celu zwiększenia zdolności przylegających wody do powierzchni pionowych należy
dodać
a) środek zagęszczający.
b) środek powierzchniowo czynny.
c) środek obniżający temperaturę krzepnięcia.
d) środek zmniejszający lepkość.
17. Liczba spienienia (L
s
) jest to
a) różnica między objętością piany, a objętością roztworu, z którego ta piana została
wytworzona.
b) stosunek
objętości
roztworu,
z
którego
piana
została
wytworzona,
do objętości piany.
c) stosunek objętości piany do objętości roztworu, z którego ta piana została
wytworzona.
d) różnica między objętością roztworu, z którego piana została wytworzona,
a objętością piany.
18. Piana gaśnicza to środek gaśniczy, który otrzymuje się
a) w wyniku energicznego zmieszania wodnego roztworu środka pianotwórczego
z powietrzem lub gazem obojętnym.
b) w
wyniku
energicznego
zmieszania
koncentratu
środka pianotwórczego
z powietrzem lub gazem obojętnym.
c) w
wyniku
energicznego
zmieszania
koncentratu
środka pianotwórczego
z wodą.
d) w wyniku energicznego zmieszania wodnego roztworu środka pianotwórczego
z wodą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
50
19. Do gaszenia pożaru acetonu należy użyć
a) wody z dodatkiem środka zagęszczającego.
b) piany na bazie środka proteinowego.
c) piany na bazie środka alkoholoodpornego.
d) proszku specjalnego.
20. Zamiennikiem halonów nie jest
a) C
3
F
7
H.
b) CHF
3
.
c) CO
2
.
d) C
4
F
10
.
21. Zjawisko polegające na rozpraszaniu przez środki powierzchniowo czynne
węglowodorów na szereg licznych, miniaturowych drobinek to
a) dyspergowanie.
b) sorpcja.
c) neutralizacja.
d) rozcieńczanie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
51
KARTA ODPOWIEDZI
Imię i nazwisko: ……………………………………………………………………………
Analizowanie fizykochemicznych procesów spalania oraz właściwości
środków gaśniczych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
21.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
52
6. LITERATURA
1. Bodzek D. (red.), Chemia i fizykochemia substancji toksycznych i niebezpiecznych,
Wydawnictwo ŚAM, Katowice 2003
2. Buchowski H., Podstawy termodynamiki, WNT, Warszawa 1998
3. Jasińska Ł., Grosset R., Edukacja społeczeństwa w zakresie zagrożeń chemicznych.
Materiał szkoleniowy dla szefów obrony cywilnej powiatów i gmin, KG PSP Fundacja
Edukacja i Technika Ratownictwa, Warszawa 2006
4. Kociołek K. T. (red.), Fizykochemia spalania i środki gaśnicze, KG PSP Fundacja
Edukacja i Technika Ratownictwa, Warszawa 2005
5. Mizerski A., Sobolewski M., Środki gaśnicze. Ćwiczenia laboratoryjne, SGSP, Warszawa
1997
6. Mizerski A., Sobolewski M., Król B., Zastosowanie pian do gaszenia pożarów, SGSP,
Warszawa 2002
7. Pazdro K.M., Zbiór zadań z chemii, Oficyna Edukacyjna Krzysztof Pazdro,
Warszawa 2005
8. Pofit-Szczepańska M., Wybrane zagadnienia z chemii ogólnej, fizykochemii spalania
i wybuchu oraz rozwoju pożarów, SA PSP w Krakowie, Kraków 2007
9. Pofit-Szczepańska M., Wybrane zagadnienia z fizykochemii wybuchu, SGSP,
Warszawa 1996
10. Ranecki J., Ratownictwo chemiczno-ekologiczne, SA PSP w Poznaniu, Poznań 1998
11. Szargut J., Termodynamika, PWN, Warszawa 2000
12. Szcześniak B.K. (red.), Fizykochemia spalania i wybuchów. Ćwiczenia laboratoryjne,
SGSP, Warszawa 1996
13. Wilczkowski S., Środki gaśnicze, SA PSP w Krakowie, Kraków 1999
14. Wojnarowski A., Obolewicz-Pietrusiak A., Podstawy ratownictwa chemicznego, FIREX,
Warszawa 2001
15. PN-EN ISO 2719:2007. Oznaczanie temperatury zapłonu. Metoda zamkniętego tygla
Pensky’ego-Martensa.
16. PN-C-04006:1964. Przetwory naftowe - Pomiar temperatury samozapłonu metodą
dynamiczną
17. PN-ISO 1928:2002 Paliwa stałe - Oznaczanie ciepła spalania metodą spalania w bombie
kalorymetrycznej i obliczanie wartości opałowej
18. PN-C-04062:1986 Przetwory naftowe - Oznaczanie ciepła spalania paliw ciekłych
w bombie kalorymetrycznej i obliczanie wartości opałowej
19. PN-Z-04002-13:1975 Ochrona czystości powietrza - Badania fizycznych własności pyłów
- Oznaczanie wilgotności pyłu
20. PN-Z-04097-07:1974 Ochrona czystości powietrza - Badania składu ziarnowego pyłów -
Analiza sitowa
21. PN-EN 50281-2-1:2002 Urządzenia elektryczne do stosowania w obecności pyłów
palnych - Część 2-1: Metody badania - Metody oznaczania minimalnej temperatury
zapłonu pyłu
22. PN-EN 1772:2001 Środki powierzchniowo czynne - Oznaczanie zdolności zwilżania
przez zanurzenie
23. PN-EN 1568-1:2002 Środki gaśnicze - Pianotwórcze środki gaśnicze - Część 1:
Wymagania dotyczące środków pianotwórczych do wytwarzania piany średniej służącej
do powierzchniowego gaszenia cieczy palnych nie mieszających się z wodą
24. PN-EN 615:1999/AC:2006 Ochrona przeciwpożarowa - Środki gaśnicze - Wymagania
techniczne dotyczące proszków (innych niż do gaszenia pożarów grupy D)
25. Standard ASTM 119E/92

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego"
53
26. www.mlyniec.gda.pl
27. http://pl.wikipedia.org
Czasopisma:
−
Przegląd Pożarniczy,
−
Ochrona Przeciwpożarowa,
−
W akcji,
−
Fire engineering,
−
Fire magazine.
Wyszukiwarka
Podobne podstrony:
Tablica. Niektore wlasciwosci fizykochemiczne gazĂłw, Procesy spalania
4. Ocena procesu spalania silników trakcyjnych metodą analizy spalin, Studia, Diagnostyka
Cw. 1 (gazowe) Badanie procesu spalania gazu ziemnego, PODRĘCZNIKI, POMOCE, SLAJDY, SUROWCE I PALIWA
LOGISTYKA ZAOPATRZENIA-Analiza zapasów i procesów magazynowych, ABC Magazynu
Budowa pojazdów samochodowych -Proces spalania w silniku o zapłonie samoczynnym semestr 1, Motoryzac
Budowa pojazdów samochodowych Proces spalania w silniku o zapłonie samoczynnym semestr 1 (2)
charakterystyka procesów spalania
temat 6, proces spalania a pozar [konspekt]
charakterystyka procesów spalania
18 Logistyka zaopatrzenia Analiza zapasów i procesów magazid 17872 ppt
9 Analiza logistyczna w procesach produkcji
Analiza FMEA procesu (2)
zjawiska w procesie spalania
pytania 2009-02-07, Procesy spalania
3 Analiza logistyczna w procesach zaopatrzenia
Procesy spalania notatki
więcej podobnych podstron