
0208; 22.04.2009, wykład nr 8., - Apoptoza; Paul Esz
Fizjologiczna śmierć komórki (śmierć programowana) synonim apoptoza (apoptosis, od greckiego słowa – opadania
liści, płatków kwiatu – Kerr w 1972 roku) Jest konsekwencją samobójczego programu genetycznego, uruchomianego w
odpowiedzi na złożone oddziaływanie z innymi komórkami.
Najczęściej następuje naruszenie integralności 1 z 4 systemów wewnątrzkomórkowych
–
oddychania tlenowego
–
funkcjonowania błon komórkowych
–
enzymów i białek strukturalnych
–
naprawy aparatu genetycznego
Apoptoza Caenorhabditis elegans
Dorosły osobnik jest hermafrodytą i składa się z 959 komórek somatycznych.
Liczba komórek powstających – 1090.
W wyniku apoptozy ginie 131
–
131 umiera podczas embriogenezy
–
18 podczas dorosłego życia
Geny proapoptotyczne
–
ced-3 (ICE)
–
ced-4 (Apaf-1)
Feny antyapoptotyczne → brak apoptozy
–
ced-9 (bcl-2)
Genetyczne kontrola apoptozy
–
„ced” (cell death) geny śmierci są dobrze zachowane w procesie ewolucji
–
ekspresja genów ced-3 i ced-4 odpowiada za molekularne procesy apoptozy
–
„ced-9” (u ludzi bcl-2) – ekspresja w komórkach stymulowanych do proliferacji (między innymi limfocyty
prawidłowe, komórki nowotworowe)
Różnice morfologiczne pomiędzy apoptozą, a martwicą
Apotoza
Martwica
1. dotyczy zwykle pojedynczych komórek
2. Zmniejszenie objętości komórki i pofałdowanie
błony komórkowej
3. Kondensacja chromatyny, fragmentacj jądra
4. zamknicie organelli w ciałkach apoptotycznych
5. ciągłoś błony komorkowej zachwana aż do
momentu sfagocytowania ciałek apoptotycznych
6. brak zapalenia, hamowanie reakcji zapalnej
7. fagocytoza przez sąsiednie komórki i makrofagi
1. najczęściej dotyczy grup komorek
2. zwiększenie objętości i pęcznienie komórki
3. brak kondensacji chromatyny, liza jądra
4. pęcznienie i rozpad organelli
5. perforacja błony, zawartoś komorek wydpstaje
się do przestrzeni pozakomórekowej
6. odczyn zapalny ze strony otoczenia
7. agocytoza przez fagocyty
Zmiany biochemiczne
Materiał genetyczny
Apoptoza
Martwica
aktywacja
specyficznych
endonukleaz,
fragmentacja,
utworzenie odcinków o długości 200-
300kb, 20-50 kb, 200-300 bp
aktywacja niespecyficznych nukleaz,
fragmentacja na odcinki o
przypadkowej długości
Rozdział elektroforetyczny
Obraz drabinki Dna
Obraz smugi (smear)
Aktywacja enzymów
kinaz białkowych (np. kinazy MAP) i
fosfataz, nukleaz, kaspaz, kalpain
niespecyficzna degradacja
Białka regulacyjne
Apoptoza;; białka rodziny Bel-2 (pro-
i anty- apoptotyczne), inhibitory
apoptozy (białka IAP), inhibitory
kaspaz
W niektórych przypadkach ekspresja
Bel-2

Wymagania energetyczne
Proces aktywny, zależny od ATP
Proces bierny, niezależny od ATP
Substraty
Białka enzymatyczne o strukturalne
Przypadkowe białka
Inne
Synteza poli(ADP-rybozy), synteza de
novo mRNA i białek
Brak syntezy białek
Czynniki wywołujące apoptozę
–
hormony i cytokiny
–
deficyt czynników wzrostowych i troficznych
–
czynniki cytotoksyczne
–
czynniki fizyczne
Szlaki sygnałowe apoptozy
W zależności od rodzaju komórki i czynnika indukującego proces apoptozy może przebiega, rożnymi ścieżkami
Do najlepiej poznanych należą
–
szlak związany z błoną komórkową tzw. zewnętrzny
–
szlak wewnętrzny zwany mitochondrialnym
–
szlak angażujący perforyny i granzym B, czyli pseudoreceptorowy
Apoptoza może również odbywać się z udziałem szlaku sfingomielinowo-ceramidowego oraz indukowanego stresem.
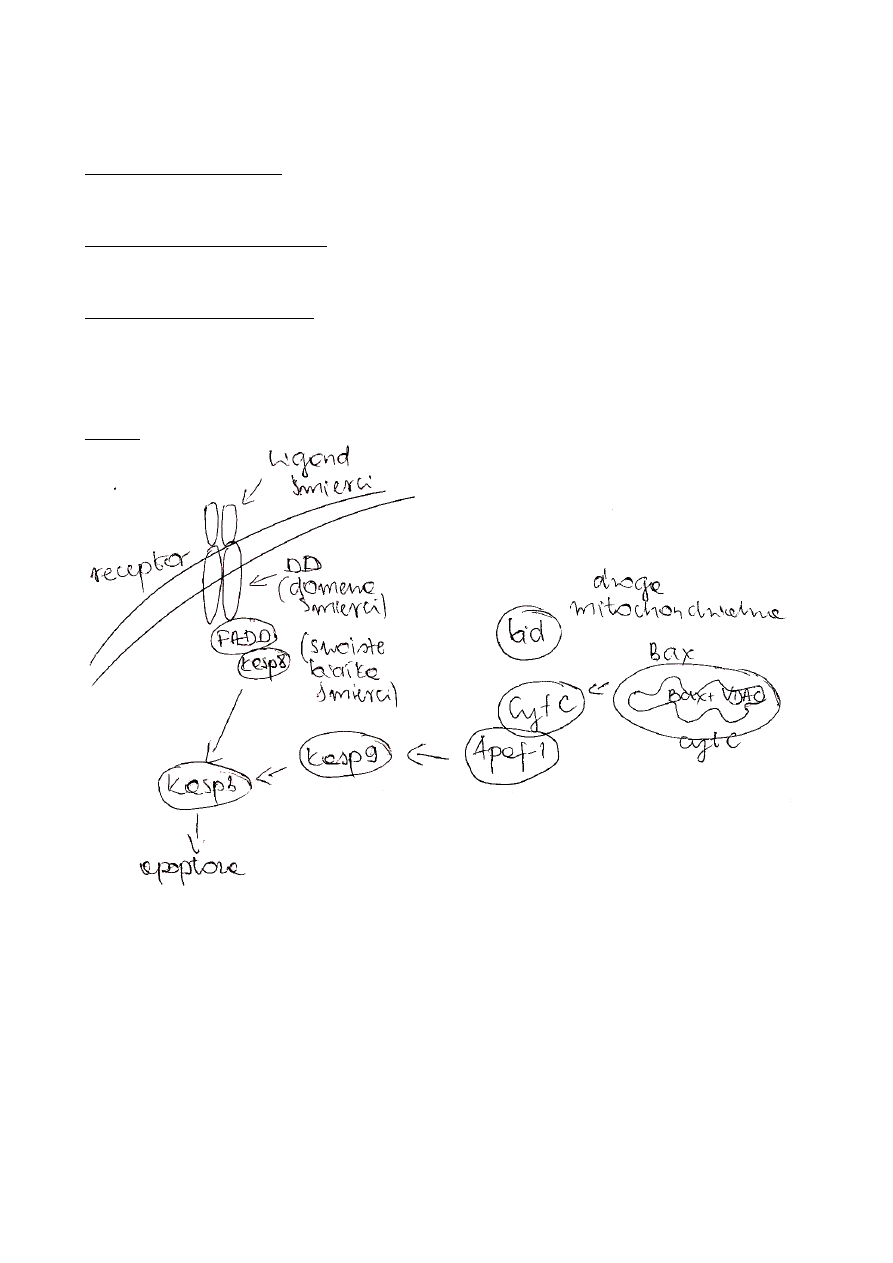
Szlak zewnętrznych
–
pobudzenie receptorów śmierci należących do nadrodziny receptorów TNF np. Fas/CD95/Apol, TRAIL-R1 i
R2/Apo2
–
receptory śmierci posiadają wewnątrzkomórkową domenę śmierci DD
–
po związaniu się odpowiedniego liganda z receptorem błonowym (TNF-alfa, FasL, TRAIL/Apo2L) dochodzi
do oligomeryzacji receptora, a następnie powstaje kompleks DISC (death inducin singnaling caomplex)
–
kompleks ten powstaje poprzez połączenie domen śmierci z białkiem adaptorowym FADD oraz z prokaspazą 8
–
następuje aktywacja prokaspazy 8 (powstaje kaspaza 8), która jest bezpośrednim aktywatorem kaspazy 3
(kaspazy wykonawczej)
Szlak wewnętrzny
inicjowany poprzez
–
zmiany potencjału mitochondrialnego
–
mutacje DNA
–
inne zaburzenia metabolizmu komórkowego
Szlak ten może łączy się ze ścieżką receptorową zewnętrzną poprzez białko Bid, które ulega proteolizie – powstaje tBid
(truncated Bid) – posta ta wpływa na uwalnianie cytochromu c – aktywacja szlaku mitochondrialnego
–
istotnym etapem jest uwolnienie cytochromu c z przestrzeni międzybłonowej poprzez specjalne kanały
–
kanały te tworzone są poprzez białka z rodziny Bel-2 (bax, bak) z bialekiem VDAC (voltage Dependent Anion
Channel)
–
przez kanały mitochondrium do cytoplazmy dostaje się cytochrom c
–
wypływ cytochromu c jest sygnałem do tworzenia kompleksu zwanego apoptosomem
–
apoptosom skalda się z cytochromu c, prokaspazy 9, bialka Apaf-1 (ATP)
–
kompleks ten potrzebny jest do autoproteolizy kaspazy 9 , która następnie aktywuje kaspazę 3
–
podczas apoptozy z mitochondrium uwalniane są także białka Smac/Diablo o Omi/HTR A2 są one
antagonistami inhibitorów apoptozy (IAP)
Szlak pseudoreceptorowy – indukowany przez cytotoksyczne limfocyty T oraz komorki NK – będzie jeszcze
potem
Właściwości kaspaz – (będzie na ćwiczeniach jeszcze)
–
są to proteazy cysteinowe, substraty ich zawierają kwas asparaginowy w pozycji P1 (proteoliza w miejscu
reszty Asp)
–
syntetyzowane są jako nieaktywne zymogeny
–
dotychczas zidentyfikowano 14 kaspaz
–
kaspozy inicjatorowe 2,8,9,10
–
kaspazy wykonawcze 3,6,7
–
kaspazy inicjatorowe posiadają „domeny śmierci” CARD i DED
–
kaspazy wykonawcze aktywują enzymy prowadzące do destrukcji komórek
Białka trawione przez kaspazy
–
większość tych białek uczestniczy w procesach molekularnych związanych z cyklem komórkowym i apoptozą
–
do proteolizy białek dochodzi przy udziale tylko kaspaz 3,6,7
Śmierć komórki niezależna od kaspaz
–
proteaza aktywowana wapniem kalpaina (kapalina), prawdopodobnie pełni autonomiczną rolę w apoptozie
–
ostatnie doniesienia wskazują na jej rolę w procesie aktywacji i unieczynnienia kaspaz 3,7,9, i ostatnio 12
Apoptoza w stanach patologicznych
Ograniczenie apoptozy prowadzi do powstania nowotworów i autoagresji komórek układu odpornościowego. Wzrost
apoptozy jest charakterystyczny dla chorób zwyrodnieniowych: choroby Alzheimera, Parkinsona, AIDS, zawału serca
czy udaru mózgu
Schemat
Wyszukiwarka
Podobne podstrony:
0108 20 04 2009, cwiczenia nr 8 , Apoptoza Paul Esz(1)
0209 29 04 2009, wykład nr 9 , Tkanka nabłonkowa Paul Esz(1)
0207 08 04 2009, wykład nr 7 , Cykl komórkowy Paul Esz(1)
0208 22[1].04.2009, II rok, II rok CM UMK, Histologia i cytofizjologia, histologia, Histologia, His
0202 04 03 2009, wykład nr 2 , Budowa i funkcje błony komórkowej oraz transport przez błony(1)
0214 13 10 2009, wykład nr 14 , Układ pokarmowy, cześć II Paul Esz(1)
0212 20 05 2009, wykład nr 12 , Krew i limfa Paul Esz(1)
0215 20 10 2009, wykład nr 15 , Układ pokarmowy, cześć III Paul Esz(1)
0216 27 10 2009, wykład nr 16 , Układ dokrewny, cześć I Paul Esz(1)
0211 13 05 2009, wykład nr 11 , Tkanka łączna oporowa Paul Esz(1)
0107 06 04 2009, cwiczenia nr 7 , Cykl komórek nowotworowych Paul Esz(1)
0109 27 04 2009, cwiczenia nr 9 , Tkanka nabłonkowa Paul Esz(1)
0213 06 10 2009, wykład nr 13 , Układ pokarmowy, cześć I Paul Esz(1)
0210 06 05 2009, wykład nr 10 , Tkanka łączna właściwa Paul Esz(1)
0205 25.03.2009, wykład nr 5.,, Jądro komórkowe
0203 11 03 2009, wykład nr 3 , Białka powierzchni komórkowej Cząsteczki adhezyjne
22 04 07 wykład matematyka
więcej podobnych podstron