
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Agnieszka Taborek
Posługiwanie się pojęciami z zakresu chemii stosowanej
311[30].Z1.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Halina Bielecka
mgr inż. Małgorzata Kapusta
Opracowanie redakcyjne:
mgr Agnieszka Taborek
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[30].Z1.01.
„Posługiwanie się pojęciami z zakresu chemii stosowanej”, zawartego w modułowym
programie nauczania dla zawodu technik technologii ceramicznej.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1. Atom i jego budowa, izotopy
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
9
4.1.3. Ćwiczenia
9
4.1.4. Sprawdzian postępów
11
4.2. Cząsteczki i ich budowa, wiązania chemiczne
12
4.2.1. Materiał nauczania
12
4.2.2. Pytania sprawdzające
15
4.2.3. Ćwiczenia
15
4.2.4. Sprawdzian postępów
16
4.3. Rodzaje reakcji chemicznych
17
4.3.1. Materiał nauczania
17
4.3.2. Pytania sprawdzające
18
4.3.3. Ćwiczenia
18
4.3.4. Sprawdzian postępów
19
4.4. Roztwory wodne soli, kwasów, zasad
20
4.4.1. Materiał nauczania
20
4.4.2. Pytania sprawdzające
21
4.4.3. Ćwiczenia
21
4.4.4. Sprawdzian postępów
22
4.5. Sposoby wyrażania stężeń
23
4.5.1. Materiał nauczania
23
4.5.2. Pytania sprawdzające
26
4.5.3. Ćwiczenia
26
4.5.4. Sprawdzian postępów
28
4.6. Obliczanie procesów chemicznych
29
4.6.1. Materiał nauczania
29
4.6.2. Pytania sprawdzające
32
4.6.3. Ćwiczenia
33
4.6.4. Sprawdzian postępów
34
4.7. Składy mieszanin i roztworów
35
4.7.1. Materiał nauczania
35
4.7.2. Pytania sprawdzające
36
4.7.3. Ćwiczenia
36
4.7.4. Sprawdzian postępów
37
5.
Sprawdzian osiągnięć
38
6.
Literatura
43

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1.
WPROWADZENIE
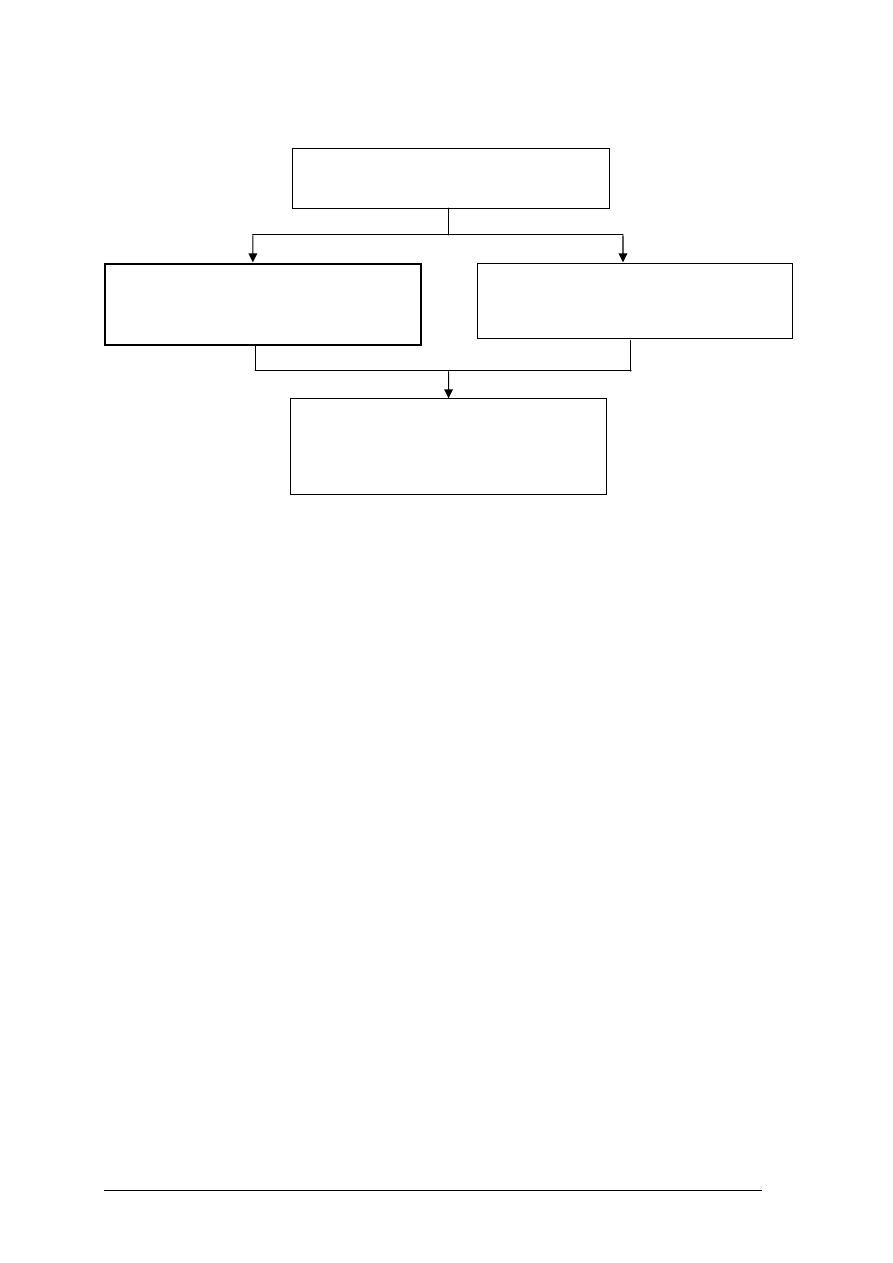
Poradnik będzie Ci pomocny w kształtowaniu umiejętności posługiwania się pojęciami
z zakresu chemii stosowanej.
W poradniku zamieszczono:
–
wymagania wstępne, czyli wykaz niezbędnych wiadomości i umiejętności, które
powinieneś mieć opanowane, abyś mógł przystąpić do realizacji programu jednostki
modułowej,
–
cele kształcenia tej jednostki modułowej,
–
materiał nauczania – zawarty w rozdziale 4, który umożliwia samodzielne przygotowanie
się do wykonania ćwiczeń i zaliczenia sprawdzianów. Obejmuje on również ćwiczenia,
które zawierają wykaz materiałów, narzędzi i sprzętu, potrzebnych do realizacji ćwiczeń.
Przed ćwiczeniami zamieszczono pytania sprawdzające wiedzę potrzebną do ich
wykonania. Po ćwiczeniach zamieszczony został sprawdzian postępów. Wykonując
sprawdzian postępów powinieneś odpowiadać na pytania tak lub nie, co oznacza, że
opanowałeś materiał albo nie,
–
sprawdzian osiągnięć, w którym zamieszczono instrukcję dla ucznia oraz zestaw zadań
testowych sprawdzających opanowanie wiedzy i umiejętności z zakresu całej jednostki;
zamieszczona została także karta odpowiedzi,
–
wykaz literatury.
Jeżeli będziesz mieć trudności ze zrozumieniem tematu lub ćwiczenia, to poproś
nauczyciela lub instruktora o wyjaśnienie i ewentualne sprawdzenie, czy dobrze wykonujesz
daną czynność.
Bezpieczeństwo i higiena pracy
W czasie pobytu w pracowni musisz przestrzegać regulaminów, przepisów
bezpieczeństwa i higieny pracy oraz instrukcji przeciwpożarowych, wynikających z rodzaju
wykonywanych prac. Przepisy te poznasz podczas trwania nauki.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
311[30].Z1
Podstawy chemii ceramicznej
311[30].Z1.01
Posługiwanie się pojęciami z zakresu
chemii stosowanej
311[30].Z1.02
Określanie właściwości krzemianów
i układów koloidalnych
311[30].Z1.03
Badanie przemian fazowych
w materiałach ceramicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
posługiwać się podstawowymi pojęciami z zakresu fizyki, chemii,
−
posługiwać się podstawowymi przelicznikami miar,
−
stosować podstawowe przepisy bezpieczeństwa i higieny pracy,
−
korzystać z różnych źródeł informacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
opisać budowę atomu,
−
opisać budowę cząsteczki,
−
scharakteryzować właściwości chemiczne wybranych pierwiastków,
−
scharakteryzować ważniejsze związki chemiczne nieorganiczne i organiczne w tym
minerały, stanowiące surowiec przemysłu ceramicznego,
−
zastosować nazewnictwo systematyczne podstawowych związków chemicznych
nieorganicznych i organicznych,
−
rozróżnić rodzaje reakcji chemicznych na podstawie zapisu równań reakcji chemicznych,
−
scharakteryzować roztwory wodne soli, kwasów i zasad,
−
obliczyć stężenia roztworów i określić skład mieszanin stosowanych w produkcji
ceramicznej,
−
obliczyć efekty energetyczne przemian fizycznych i chemicznych,
−
sporządzić roztwory i mieszaniny substancji o określonym składzie i stężeniu dla celów
laboratoryjnych,
−
zastosować przepisy bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska w trakcie ćwiczeń laboratoryjnych.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1.
Atom i jego budowa, izotopy
4.1.1. Materiał nauczania
Każdy atom składa się z tak zwanych cząstek elementarnych: protonów, neutronów
i elektronów. Centrum atomu stanowi jądro atomowe, w skład, którego wchodzą protony
i neutrony, a elektrony rozmieszczone są poza jądrem atomowym, tworząc tzw. chmurę
elektronową. W tabeli 1 przedstawione są cząstki elementarne oraz ich charakterystyka.
Tabela 1. Charakterystyka cząstek składowych atomu [opracowanie własne]
Nazwa cząstki
Symbol
Masa atomowa [u] Ładunek
Proton
p
1
+1
Neutron
n
1
0
Elektron
e
1/2000
–1
Atom, którego jądro zawiera określoną liczbę protonów i neutronów nazywamy
nuklidem.
Liczbę protonów w jądrze atomowym określa liczba atomowa (Z), a łączną liczbę
nukleonów (protonów i neutronów) – liczba masowa (A). Liczby te podawane są w tablicach
układu okresowego. Przyjęto umowę, że liczbę masową A podaje się w lewym górnym rogu,
a liczbę atomową Z w lewym dolnym rogu symbolu pierwiastka:
A
Z
E – symbol pierwiastka
A – liczba masowa = liczba nukleonów = liczba protonów i neutronów,
Z – liczba atomowa = liczba protonów = liczba ładunków dodatnich w jądrze = liczba
elektronów = numer pierwiastka w układzie okresowym.
Znając wartości tych liczb możemy łatwo obliczyć liczbę neutronów w jądrze atomowym
danego pierwiastka. Jest ona równa różnicy A–Z. Łączna liczba elektronów jest równa liczbie
protonów. Wynika to z faktu, że każdy atom jest elektrycznie obojętny, a więc dodatni
ładunek jądra atomowego musi być równoważony przez identyczną liczbę ujemnych
elektronów.
Pierwiastek jest to zbiór atomów o takiej samej liczbie protonów w jądrze. Wszystkie
atomy danego pierwiastka mają, zatem jednakową liczbę atomową, ale mogą różnić się liczbą
masową, ze względu na różną liczbę neutronów w jądrze. Takie atomy nazywamy izotopami.
Izotopy są to odmiany tego samego pierwiastka, różniące się liczbą neutronów w jądrze.
Izotopy mają takie same właściwości chemiczne, a różnią się nieznacznie właściwościami
fizycznymi. Pierwiastki cechują bardzo różne ilości izotopów. Niektóre istnieją w przyrodzie
jako tak zwane pierwiastki czyste izotopowo, czyli w postaci tylko jednego trwałego nuklidu
danego pierwiastka, np.: fluor, sód, fosfor, glin. Przeważająca większość pierwiastków ma
dwa izotopy lub więcej. Na przykład chlor ma dwa izotopy (
35
Cl i
37
Cl), tlen trzy (
16
O,
17
O,
18
O), a cyna aż dziesięć.
Wodór występujący w przyrodzie stanowi mieszaninę dwóch izotopów, które otrzymały
własne nazwy:
1
H – prot i
2
H – deuter lub wodór ciężki (oznaczany często symbolem
2
D).
Oprócz tych dwóch trwałych izotopów wodoru istnieje trzeci, wytworzony sztucznie
nietrwały wodór
3
H, zwany trytem (
3
T).
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Jeżeli pierwiastek chemiczny jest mieszaniną izotopów, to jego masa atomowa jest
ś
rednią ważoną wynikającą z procentowej zawartości poszczególnych izotopów. Masę
atomową pierwiastka występującego w przyrodzie w postaci mieszaniny izotopów oblicza się
ze wzoru:
A
1
.
p
1
+ A
2
.
p
2
+……
Masa atomowa =
–––––––––––––––––––
100 %
gdzie:
A
1
, A
2
– masy atomowe poszczególnych izotopów,
p
1
, p
2
– procentowe zawartości izotopów.
Elektrony poruszają się w przestrzeni wokółjądrowej tak, że nie można jednoznacznie
określić ich miejsca, a jedynie wskazać prawdopodobieństwo znalezienia ich w danym
miejscu. „Chmura” elektronowa, którą tworzą elektrony, rozprzestrzenia się symetrycznie
wokół jądra. Można w niej wyróżnić zbiory takich elektronów, które łączy niemal jednakowa
odległość wokół jądra. Tworzą one wspólne powłoki elektronowe, które oznacza się literami
K, L, M, itd. Maksymalna liczba elektronów w poszczególnych powłokach przedstawiona jest
w tabeli 2.
Tabela 2. Rozmieszczenie elektronów w poszczególnych powłokach [opracowanie własne]
Kolejny numer powłoki licząc od
jądra
n
Symbol powłoki
Maksymalna liczba elektronów
2n
2
1
K
2
2
L
8
3
M
18
4
N
32
Powłokowa konfiguracja elektronowa jest to rozmieszczenie elektronów w powłokach.
Zapis przedstawiający rozmieszczenie elektronów w atomach różnych pierwiastków:
1
H: K
1
,
2
He: K
2
,
3
Li: K
2
L
1
,
7
N: K
2
L
5
,
12
Mg: K
2
L
8
M
2
,
18
Ar: K
2
L
8
M
8
.
Liczba powłok elektronowych w atomie danego pierwiastka jest równa numerowi
okresu, do którego należy dany pierwiastek w układzie okresowym.
Elektrony walencyjne to elektrony biorące udział w tworzeniu wiązań chemicznych;
słabo związane z jądrem, poruszające się w zewnętrznej strefie atomu. Elektrony walencyjne
atomów pierwiastków grup głównych to elektrony zewnętrznej powłoki, a ich liczba jest
równa cyfrze stojącej na miejscu jednostek w numerze grupy układu okresowego.
Potas leży w 4 okresie i 1 grupie układu okresowego, dlatego zapełnia cztery powłoki,
a na ostatniej powłoce „walencyjnej” ma jeden elektron:
19
K: K L M N
1
. Okazuje się, że
obsadzanie nowej powłoki może zacząć się przed całkowitym zapełnieniem powłoki
poprzedniej. Pełna konfiguracja elektronowa dla potasu: K
2
L
8
M
8
N
1
.
Atomy pierwiastków grup głównych (1, 2 i 13–18) w miarę wzrostu liczb atomowych
zapełniają najbardziej zewnętrzną powłokę elektronową. Liczba elektronów na ostatniej
powłoce jest równa liczbie elektronów walencyjnych, czyli cyfrze stojącej na miejscu
jednostek w numerze grupy układu okresowego.
Atomy pierwiastków grup pobocznych (3–12) w miarę zwiększania liczby atomowej
zapełniają elektronami podzewnętrzną (drugą od końca) powłokę elektronową, a na ostatniej
zewnętrznej powłoce mają dwa, a czasem jeden elektron (np. Cu, Cr, Ag, Au, Pt).
22
Ti: K
2
L
8
M
10
N
2
24
Cr: K
2
L
8
M
9
N
1
48
Cd: K
2
L
8
M
18
N
18
O
2
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
W jaki sposób zbudowany jest atom?
2.
Z jakich cząstek elementarnych składa się jądro atomowe?
3.
Co oznacza liczba atomowa i masowa?
4.
W jaki sposób obliczamy liczbę neutronów w jądrze?
5.
Co oznacza pojęcie pierwiastek?
6.
Co to jest masa atomowa?
7.
Czym są izotopy?
8.
Co to jest powłoka elektronowa?
9.
W jaki sposób oznaczamy powłoki elektronowe?
10.
Jakim pojęciem określamy rozmieszczenie elektronów w powłokach?
11.
Co to są elektrony walencyjne?
12.
O czym mówi liczba powłok elektronowych i liczba elektronów walencyjnych
w konfiguracji elektronowej danego pierwiastka?
13.
Jakie są reguły zapisu konfiguracji elektronowej dla pierwiastków grup głównych
i pobocznych?
4.1.3. Ćwiczenia
Ćwiczenie 1
Uzupełnij tabelę:
liczba
Symbol
izotopu
atomowa
masowa
protonów
neutronów
elektronów
31
P
4
5
42
33
36
18
197
Au
64
50
69
26
56
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat atomu i jego budowy,
2)
skorzystać z układu okresowego,
3)
uzupełnić tabelę,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
–
notatnik,
–
przybory do pisania,
–
układ okresowy pierwiastków,
–
literatura z rozdziału 6 na temat atomu i jego budowy.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Ćwiczenie 2
Uzupełnij tabelę:
Symbol
pierwiastka
Liczba elektronów Numer okresu Numer grupy
Powłokowa konfiguracja
elektronowa
C
14
Mg
19
3
13
K
2
L
8
M
6
Fe
48
5
4
K
2
L
8
M
18
N
32
O
18
P
1
Cr
4
11
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat atomu i jego budowy,
2)
skorzystać z układu okresowego,
3)
uzupełnić tabelę,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
układ okresowy pierwiastków,
−
literatura z rozdziału 6 na temat atomu i jego budowy.
Ćwiczenie 3
Oblicz masę atomową magnezu, wiedząc, że zawiera on 78,6% magnezu-24 (
24
Mg),
10,1% magnezu-25 oraz 11,3% magnezu-26.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat atomu i jego budowy,
2)
obliczyć masę atomową magnezu,
3)
zapisać obliczenia w notatniku,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
literatura z rozdziału 6 dotycząca izotopów,
−
kalkulator,
−
notatnik,
−
przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
opisać budowę atomu?
2)
określić, z jakich cząstek elementarnych jest zbudowane jądro
atomowe?
3)
wyjaśnić oznaczenie liczby atomowej i masowej?
4)
obliczyć liczbę neutronów w jądrze?
5)
zdefiniować pojecie pierwiastka?
6)
wyjaśnić, co oznacza pojęcie izotop?
7)
obliczyć średnią masę atomową?
8)
wyjaśnić pojęcie powłoki elektronowej?
9)
określić, co to są elektrony walencyjne?
10)
wyjaśnić pojęcie powłoki elektronowej i sposób ich oznaczenia?
11)
opisać sposób, w jaki zapełniane są powłoki elektronowe?
12)
zdefiniować konfigurację elektronową?
13)
określić reguły zapisu konfiguracji elektronowej dla pierwiastków grup
głównych i pobocznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
4.2.
Cząsteczki i ich budowa, wiązania chemiczne
4.2.1. Materiał nauczania
Cząsteczka jest to indywiduum chemiczne zbudowane, z co najmniej z dwóch
połączonych atomów.
Najprostsze cząsteczki zbudowane są z dwóch i to jednakowych atomów. Są to
substancje pierwiastkowe: H
2
, O
2
, N
2
. Istnieją również cząsteczki złożone z większej liczby
atomów np.: O
3
, P
4
, S
8
. Cząsteczki zbudowane z atomów tego samego rodzaju nazywamy
cząsteczkami homoatomowymi, albo cząsteczkami pierwiastków.
Znacznie więcej jest jednak cząsteczek złożonych z atomów różnego rodzaju, np.: HCl,
CO
2
, H
2
SO
4
. Cząsteczki takie nazywamy heteroatomowymi, albo cząsteczkami związków
chemicznych.
Atomy łączą się w cząsteczki, czyli między atomami tworzą się wiązania chemiczne.
Istota wiązań chemicznych opiera się na regułach: dubletu i oktetu. Od chwili odkrycia gazów
szlachetnych (18 grupa układu okresowego) chemicy zwrócili uwagę na ich bierność
chemiczną. Przyczynę tej bierności upatrywano w występowaniu na powłokach walencyjnych
tych pierwiastków trwałych, korzystnych energetycznie, układów elektronów – dwóch, czyli
dubletu w wypadku helu i ośmiu, czyli oktetu w wypadku pozostałych gazów szlachetnych.
Wtedy uznano, że inne pierwiastki chemiczne też dążą do uzyskania tych korzystnych
układów elektronów i to właśnie jest przyczyną ich łączenia się w cząsteczki.
Drugim ważnym pojęciem jest elektroujemność.
Elektroujemność jest to liczbowa miara zdolności atomów do przyciągania (pobierania)
elektronów.
Już w 1932 roku Pauling podzielił pierwiastki na elektrododatnie, czyli takie, które
wykazują tendencję do oddawania elektronów i tworzenia jonów dodatnich oraz
elektroujemne, czyli wykazujące tendencję do przyjmowania elektronów i tworzenia jonów
ujemnych. Przypisał on poszczególnym pierwiastkom wartości liczbowe, które są
odzwierciedleniem właśnie tych opisanych tendencji. Najmniejszą elektroujemność w skali
Paulinga ma frans (0,7) leżący w lewym dolnym rogu układu okresowego, a największą fluor
(4,0) – w prawym górnym rogu układu okresowego. Elektroujemność jest cechą
pierwiastków, która zmienia się podobnie jak inne właściwości. Analizując wartości
elektroujemności poszczególnych pierwiastków można stwierdzić, że elektroujemność
w grupach maleje, a w okresach wykazuje tendencje wzrostowe.
Tworzenie wiązań chemicznych jest to wypadkowa różnych oddziaływań między
atomami, których efektem jest łączenie się atomów. Wiązania chemiczne polegają na
oddawaniu i przyjmowaniu lub uwspólnianiu elektronów w celu uzyskania trwałej dwu- lub
ośmioelektronowej konfiguracji na powłoce walencyjnej.
Wyróżniamy dwa podstawowe rodzaje wiązań chemicznych: wiązanie jonowe i wiązanie
kowalencyjne (atomowe).
Wiązanie jonowe tworzy się wówczas, gdy różnica elektroujemności (
∆
E) pomiędzy
łączącymi się atomami jest większa od 1,7, a gdy jest ona niewielka i nie przekracza 0,4
powstają wiązania kowalencyjne. Gdy różnica elektroujemności zawiera się w przedziale
0,4–1,7 tworzą się wówczas wiązania pośrednie między atomowymi a jonowymi. Nazywamy
je kowalencyjnymi spolaryzowanymi (atomowymi spolaryzowanymi).
Wiązanie jonowe
Atom sodu ma stosunkowo niską elektroujemność, a więc aby uzyskać stosunkowo
trwały układ ośmiu elektronów na powłoce walencyjnej chętnie pozbywa się jednego
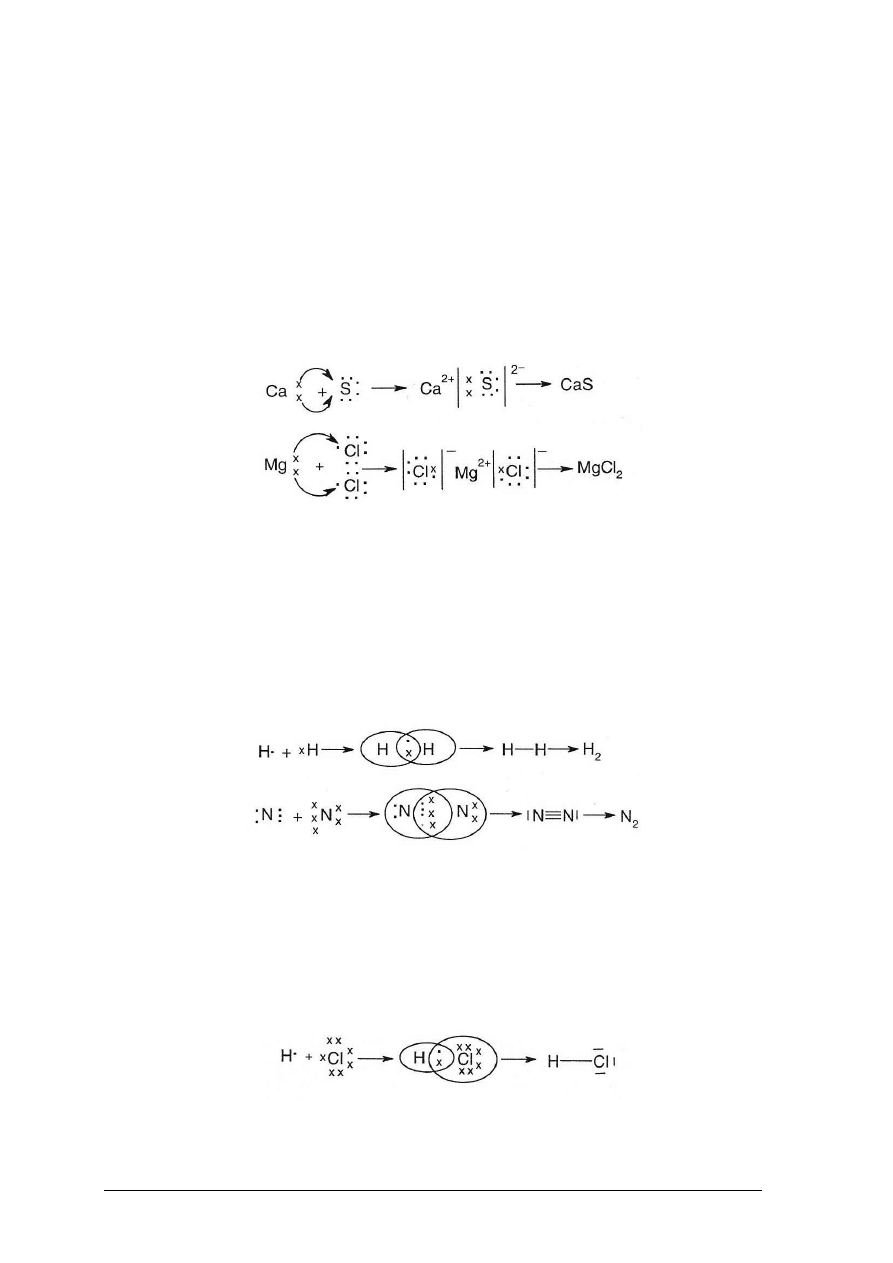
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
elektronu, wówczas staje się jonem dodatnim – kationem. Elektron oddany przez sód chętnie
przyjmie atom chloru (ma stosunkowo wysoką elektroujemność), który staje się jonem
ujemnym, czyli anionem.
11
Na: K
2
L
8
M
1
17
Cl: K
2
L
8
M
7
Na
+
: K
2
L
8
Cl
–
: K
2
L
8
M
8
W ten sposób poprzez przyciąganie się dodatnich kationów sodu i ujemnych anionów
chlorkowych powstaje chlorek sodu – związek o wiązaniu jonowym – Na
+
Cl
–
.
Wiązanie jonowe jest możliwe pomiędzy atomami pierwiastków grupy 1 i 2 oraz 16 i 17
mimo różnicy elektroujemności mniejszej od 1,7.
Związki o budowie jonowej mają wysokie temperatury topnienia i wrzenia, dobrze
rozpuszczają się w rozpuszczalnikach polarnych, a na ogół nie rozpuszczają się
w rozpuszczalnikach niepolarnych. Ponadto związki o budowie jonowej w stanie stopionym
i ich roztwory w rozpuszczalnikach polarnych przewodzą prąd elektryczny.
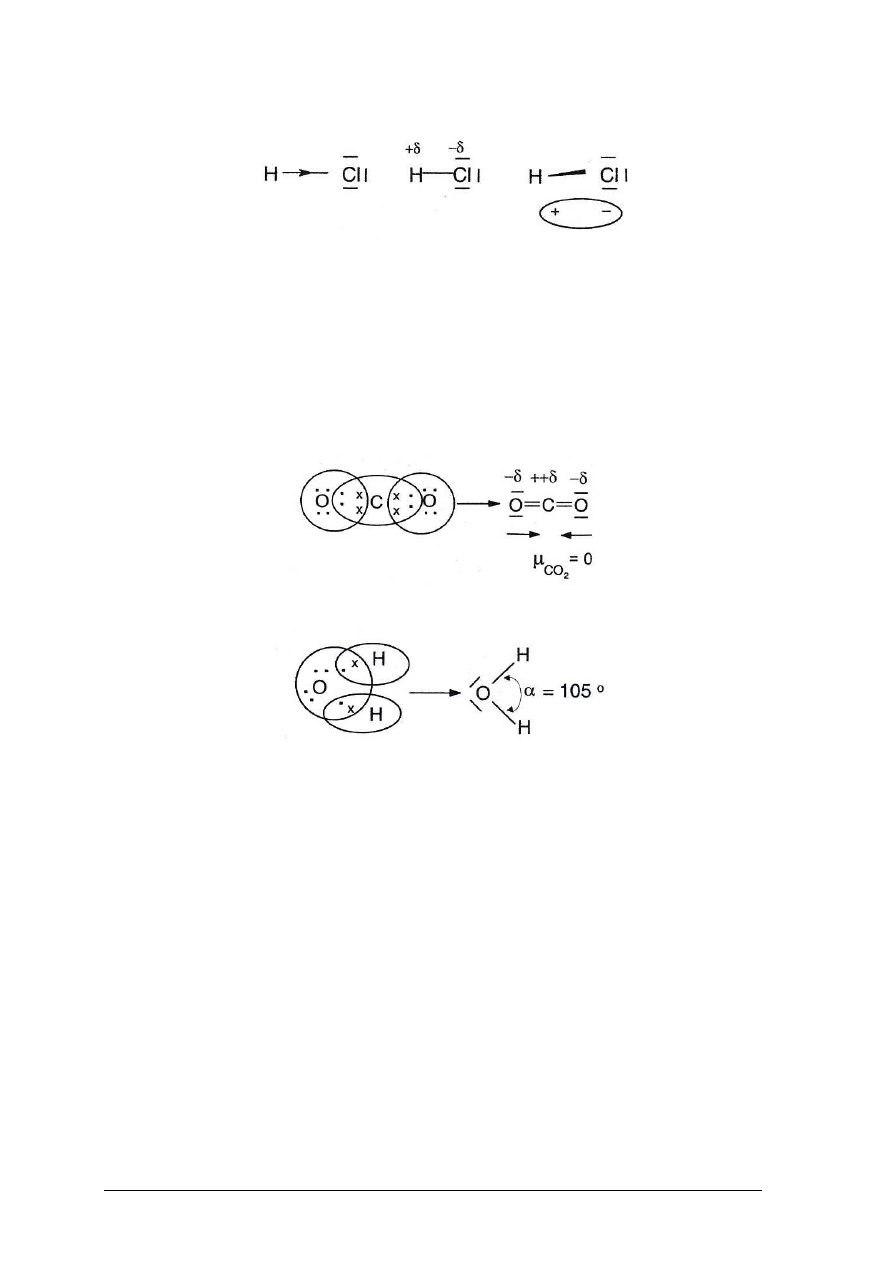
Wiązanie kowalencyjne
Wiązanie kowalencyjne polega na uwspólnianiu elektronów czyli utworzeniu wspólnych
par elektronowych przez reagujące ze sobą atomy. Ładunek jest rozmieszczony symetrycznie
wokół jąder obu atomów. W ten sposób atomy osiągają trwałą konfigurację elektronową.
Wiązanie kowalencyjne spolaryzowane
Jeżeli tworzy się wiązanie kowalencyjne między atomami różnych pierwiastków, to
powstające wspólne pary elektronowe znajdują się w polu działania jąder o różnych
ładunkach i wówczas jądro pierwiastka bardziej elektroujemnego silniej przyciąga wspólne
elektrony i rozkład ładunku jest niesymetryczny; maksimum gęstości elektronowej jest bliżej
atomu bardziej elektroujemnego i środki geometryczne ładunków dodatnich i ujemnych nie
pokrywają się:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Polaryzację wiązania zapisuje się w różny sposób:
Cząsteczka jako całość jest elektrycznie obojętna, stanowi jednak dipol – układ dwóch
ładunków o takich samych wartościach i różnych znakach, oddalonych na pewną odległość.
Miarą przesunięcia ładunku jest moment dipolowy.
Moment dipolowy stanowi wektor o kierunku zgodnym z osią dipola i umownym zwrocie od
ładunku ujemnego do dodatniego. Definiuje się go jako iloczyn bezwzględnej wartości
ładunku elektrycznego (
ρ
) zawartego w jednym biegunie oraz odległości biegunów (l):
µ
=
ρ
.
l
µ
– moment dipolowy [D]
Jednostką momentu dipolowego jest D – debaj.
Brak momentu dipolowego dowodzi symetrycznej budowy cząsteczki.
Cząsteczka wody ma moment dipolowy różny od zera, co świadczy, że nie może mieć
budowy liniowej.
Substancje kowalencyjne tworzą w stanie stałym dwa rodzaje kryształów: cząsteczkowe
i kowalencyjne. W stanie stałym jak i ciekłym nie przewodzą prądu elektrycznego. Jednym
z nielicznych wyjątków jest grafit. Czyste kryształy kowalencyjne typu grafit są izolatorami.
Substancje kowalencyjne z wiązaniem niespolaryzowanym lub słabo spolaryzowanym
rozpuszczają się w rozpuszczalnikach niepolarnych. Substancje kowalencyjne tworzące
kryształy cząsteczkowe mają stosunkowo niskie temperatury topnienia i wrzenia. Natomiast
kryształy kowalencyjne typu diamentu są bardzo trwałe – wykazują odporność na działanie
czynników mechanicznych i topią się w wysokiej temperaturze.
Na podstawie znajomości wzoru elektronowego i kształtu cząsteczek związku
chemicznego możemy w wielu przypadkach określić: polarność tego związku, trwałość,
reaktywność oraz zdolność do uczestnictwa w różnego rodzaju oddziaływaniach
międzycząsteczkowych.
Budowa i kształt cząsteczki warunkują jej właściwości fizyczne i chemiczne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Na jakich regułach opiera się istota tworzenia wiązań chemicznych?
2.
Co to jest elektroujemność?
3.
Jak zmienia się elektroujemność w grupach i okresach?
4.
Na czym polegają wiązania chemiczne?
5.
Jakie wyróżniamy rodzaje wiązań chemicznych?
6.
Co to jest wiązanie jonowe i kiedy się tworzy?
7.
Jakie właściwości wykazują substancje jonowe?
8.
Na czym polega wiązanie kowalencyjne?
9.
Kiedy tworzy się wiązanie kowalencyjne, a kiedy spolaryzowane?
10.
Co to jest dipol?
11.
Na czym polega różnica wiązania kowalencyjnego i kowalencyjnego spolaryzowanego?
12.
Jakie właściwości wykazują substancje o budowie kowalencyjnej?
13.
O jakich właściwościach decyduje budowa i kształt cząsteczki?
4.2.3. Ćwiczenia
Ćwiczenie 1
Wybierz 6 związków stosowanych w przemyśle ceramicznym. Mając do dyspozycji
zestaw do modelowania związków chemicznych zbuduj cząsteczki tych związków
chemicznych z uwzględnieniem odpowiednich wiązań chemicznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat wiązań chemicznych,
2)
wypisać związki stosowane w przemyśle ceramicznym,
3)
określić rodzaj wiązań chemicznych, jakie tworzą te cząsteczki,
4)
zbudować, za pomocą modeli, cząsteczki tych związków z uwzględnieniem
odpowiednich wiązań chemicznych,
5)
zapisać w notatniku schemat wiązań chemicznych w tych związkach,
6)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
zestaw do budowania modeli związków chemicznych,
−
układ okresowy pierwiastków,
−
tabela elektroujemności,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 na temat wiązań chemicznych.
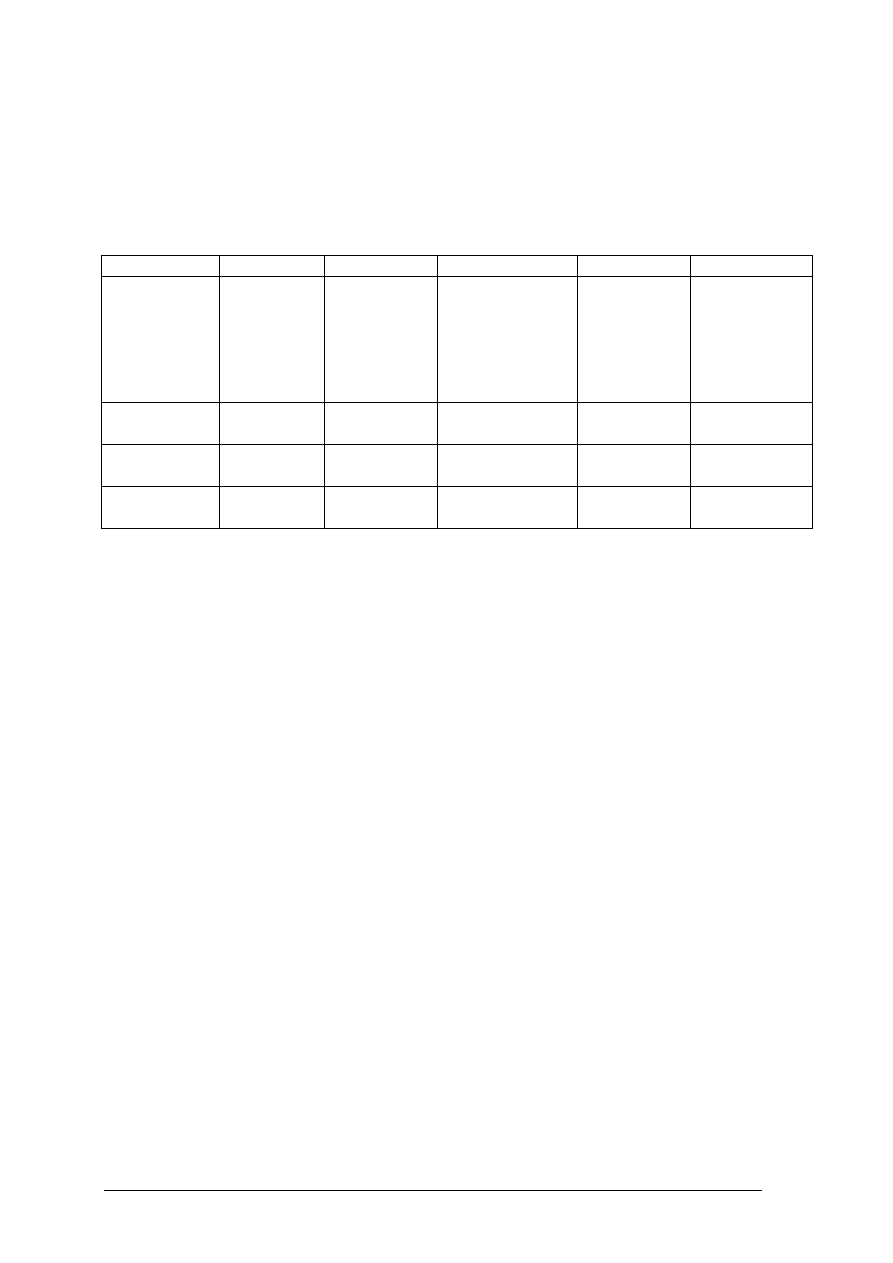
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Ćwiczenie 2
Uzupełnij tabelę wpisując:
−
do kolumny 2 jedno z następujących określeń: z jonów, z cząsteczek,
−
do kolumny 3: stosunkowo wysokie, stosunkowo niskie, zależy od rodzaju sieci
krystalicznej,
−
do kolumny 4: dobra, słaba, najczęściej dobra.
1
2
3
4
5
6
Rodzaj
wiązania
Sieć
krystaliczna
zbudowana
jest
Temperatury
topnienia
i wrzenia
Rozpuszczalność
w wodzie
Przykłady
związków
chemicznych
stosowanych
w przemyśle
ceramicznym
Zastosowanie
wymienionych
związków
Jonowe
Kowalencyjne
Kowalencyjne
spolaryzowane
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat wiązań chemicznych,
2)
uzupełnić tabelę,
3)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca cząsteczek i ich budowy oraz wiązań chemicznych.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
podać reguły na jakich opiera się istota tworzenia wiązań chemicznych?
2)
wyjaśnić, jak zmienia się elektroujemność w grupach i okresach?
3)
wyjaśnić, na czym polegają wiązania chemiczne?
4)
wyjaśnić, na czym polega wiązanie jonowe?
5)
wyjaśnić, w jaki sposób tworzy się wiązanie kowalencyjne?
6)
wyjaśnić, na czym polega różnica między wiązaniami kowalencyjnym
i kowalencyjnym spolaryzowanym?
7)
wymienić właściwości, które wynikają z budowy i kształtu cząsteczki?
8)
określić właściwości, które charakteryzują substancje jonowe?
9)
podać właściwości jakimi charakteryzują się substancje o budowie
kowalencyjnej?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
4.3.
Rodzaje reakcji chemicznych
4.3.1. Materiał nauczania
Różnorodność reakcji chemicznych zachodzących w przyrodzie oraz przeprowadzanych
w laboratoriach i przemyśle jest ogromna, dlatego dokonuje się ich klasyfikacji. Polega ona
na podziale znanych reakcji chemicznych według różnych kryteriów.
Ze względu na liczbę i rodzaj reagentów reakcje chemiczne dzielimy na trzy podstawowe
typy: syntezę, analizę, wymianę (tabela 3).
Tabela 3. Typy reakcji chemicznych [opracowanie własne]
Typ reakcji
Schemat reakcji i przykład
Synteza
substrat 1 + substrat 2 → produkt
2 Cu + O
2
→ 2 CuO
Analiza
substrat → produkt 1 + produkt 2
Cu(OH)
2
→ CuO + H
2
O
Wymiana:
−
pojedyncza
−
podwójna
substrat1 + substrat 2 → produkt 1 + produkt 2
Zn + CuSO
4
→ ZnSO
4
+ Cu
CuSO
4
+ 2 NaOH → Cu(OH)
2
+ Na
2
SO
4
Podczas reakcji chemicznej układ reagentów może wymieniać z otoczeniem energię
różnymi sposobami – na sposób ciepła, na sposób pracy lub też jednocześnie na sposób ciepła
i na sposób pracy. Ze względu na efekty energetyczne towarzyszące reakcjom chemicznym
możemy wyróżnić dwa typy:
−
reakcje egzoenergetyczne, kiedy reagenty przekazują energię do otoczenia,
−
reakcje endoenergetyczne, kiedy reagenty pobierają energię z otoczenia.
Ilość energii wymienionej na sposób ciepła między układem a otoczeniem nazywamy
efektem cieplnym (termicznym) reakcji chemicznej. Wartość efektu energetycznego reakcji
oznacza się różnymi znakami, w zależności od tego czy energia jest przekazywana do
otoczenia czy do układu:
−
znakiem ”–„ oznacza się efekt cieplny reakcji, podczas której układ przekazuje energię na
sposób ciepła, np.:
C
(s)
+ O
2(g)
→ CO
2(g)
– 394 kJ/mol C
−
znakiem „+” oznacza się efekt cieplny reakcji, podczas której układ pobiera energię
z otoczenia, np.:
CaCO
3(s)
→ CaO
(s)
+ CO
2(g)
+ 1206,6 kJ/mol CaCO
3
gdzie:
(s)
– substancja stała,
(g)
– substancja gazowa.
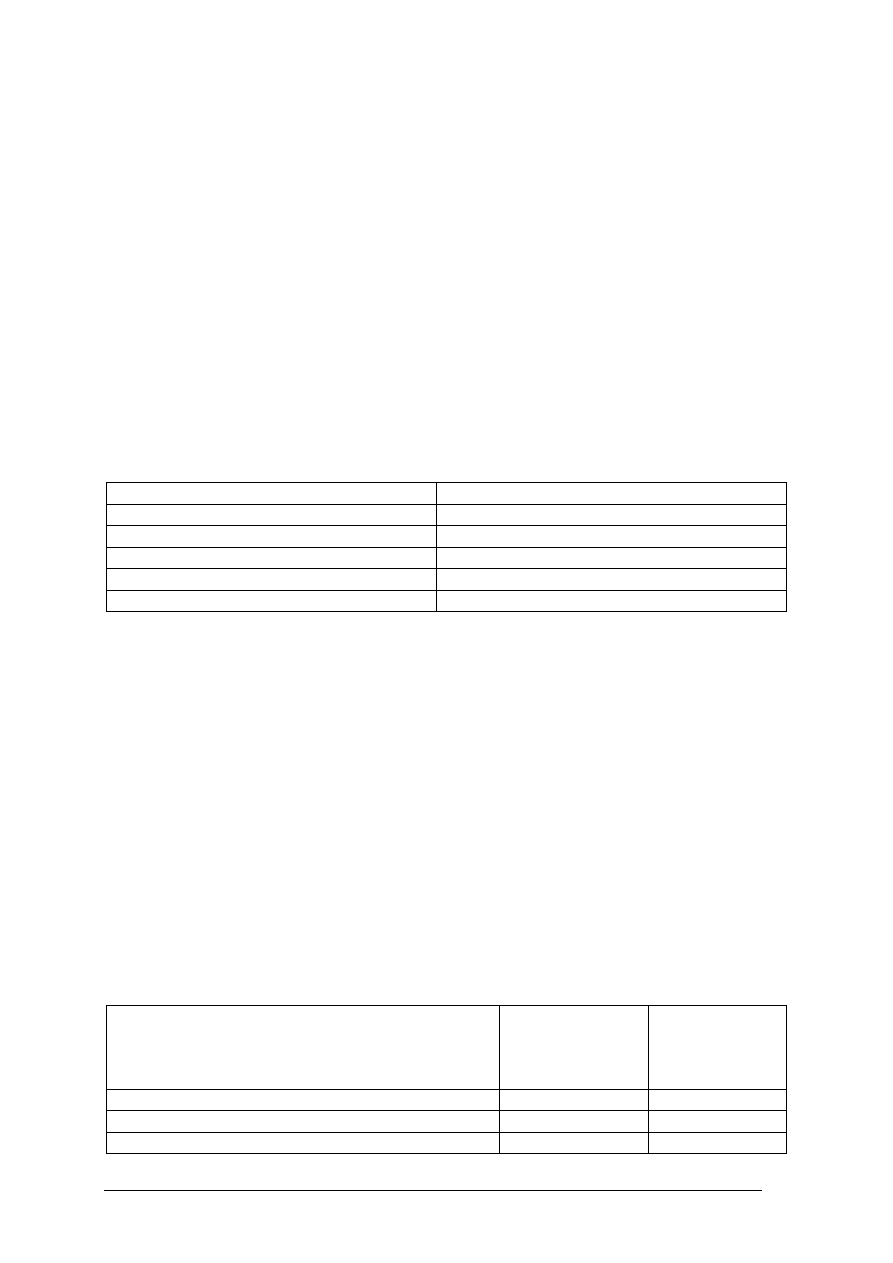
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie wyróżnia się typy reakcji chemicznych w zależności od ilości reagentów?
2.
Czym charakteryzuje się reakcja syntezy?
3.
Czym charakteryzuje się reakcja analizy?
4.
Czym charakteryzuje się reakcja wymiany?
5.
Jakie wyróżniamy typy reakcji chemicznych w zależności od efektów energetycznych
towarzyszących reakcji?
6.
Jakimi znakami opisujemy efekty energetyczne w reakcji egzoenergetycznej
i endoenergetycznej?
4.3.3. Ćwiczenia
Ćwiczenie 1
Przeanalizuj równania reakcji chemicznych i określ ich typ. Wyniki analizy zapisz
w notatniku.
Równanie reakcji
Typ reakcji
NH
4
HCO
3
→ NH
3
+ H
2
O + CO
2
2 FeO + Si → SiO
2
+ 2 Fe
SO
3
+ H
2
O → H
2
SO
4
AgNO
3
+ NaCl → AgCl + NaNO
3
Zn + 2 HCl → ZnCl
2
+ H
2
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat typów reakcji chemicznych,
2)
przeanalizować podane w ćwiczeniu równania reakcji chemicznych,
3)
określić typy reakcji dla podanych przykładów,
4)
zapisać wyniki analizy w notatniku,
5)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca typów reakcji chemicznych.
Ćwiczenie 2
Przeanalizuj równania reakcji chemicznych pod kątem ilości reagentów oraz zmiany
energii zachodzących podczas reakcji. Uzupełnij tabelę wpisując odpowiednie typy reakcji.
Równanie reakcji
Typ reakcji ze
względu na ilość
reagentów
Typ reakcji ze
względu na
efekt
energetyczny
N
2(g)
+ O
2(g)
→
2 NO
(g)
- 91,3 kJ/mol NO
N
2(g)
+ 3 H
2(g)
→ 2 NH
3(g)
+ 45,95kJ/mol NH
3
2 KClO
3(s)
→ 2 KCl
(s)
+ 3 O
2(g)
+ 45,3 kJ/mol KClO
3

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości na temat typów reakcji chemicznych,
2)
przeanalizować podane w ćwiczeniu równania reakcji chemicznych,
3)
określić typy reakcji dla podanych przykładów,
4)
zapisać wyniki analizy w notatniku,
5)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
–
notatnik,
–
przybory do pisania,
–
literatura z rozdziału 6 dotycząca typów reakcji chemicznych.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wymienić typy reakcji chemicznych w zależności od ilości reagentów?
2)
scharakteryzować reakcję syntezy?
3)
scharakteryzować reakcję analizy?
4)
scharakteryzować reakcję wymiany?
5)
podać typy reakcji chemicznych w zależności od efektów
energetycznych towarzyszących reakcji?
6)
określić
znaki
opisujące
efekty
energetyczne
w
reakcji
egzoenergetycznej i endoenergetycznej?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.4.
Roztwory wodne soli, kwasów, zasad
4.4.1. Materiał nauczania
Cząsteczki soli, kwasów i zasad w roztworze wodnym rozpadają się na jony.
Cząsteczki soli Me
m
R
n
ulegają rozpadowi na kationy metalu Me
n+
oraz aniony reszty
kwasowej R
m–
.
H
2
O
Me
m
R
n
→ Me
n+
+ R
m–
Przykłady:
H
2
O
Al
2
(SO
4
)
3
→
2 Al
3+
+ 3 SO
4
2–
H
2
O
Ca(NO
3
)
2
→ Ca
2+
+ 2 NO
3
–
Cząsteczki kwasów H
m
R ulegają rozpadowi na kationy wodorowe H
+
oraz aniony reszty
kwasowej R
m–
.
H
2
O
H
m
R → mH
+
+ R
m–
Przykłady:
H
2
O
HCl → H
+
+ Cl
–
H
2
O
H
2
SO
4
→ 2 H
+
+ SO
4
2–
Cząsteczki zasad Me(OH)
n
ulegają rozpadowi na kationy metalu Me
n+
oraz aniony
wodorotlenkowe OH
–
.
H
2
O
Me(OH)
n
→ Me
n+
+ nOH
–
Przykład:
H
2
O
Ca(OH)
2
→ Ca
2+
+ 2 OH
–
Jeżeli roztwór, zawierający swobodne jony, znajdzie się w polu elektrycznym,
wytworzonym przez przeciwnie naładowane metalowe płyty, kationy, jako jony dodatnie
zaczną wędrować w kierunku płyty ujemnej, a aniony – w kierunku dodatniej. Roztwór taki
jest więc zdolny do przewodzenia prądu elektrycznego i nazywamy go elektrolitem. Proces
prowadzący do powstawania elektrolitu, w wyniku oddziaływania wody z rozpuszczaną
w niej substancją, nazywamy dysocjacją elektrolityczną.
Substancje, które podczas rozpuszczania ulegają całkowitej (lub prawie całkowitej)
dysocjacji nazywamy mocnymi elektrolitami, gdyż w ich roztworach znajduje się dużo jonów
i mogą one łatwo przewodzić prąd elektryczny. Do mocnych elektrolitów zaliczamy:
−
prawie wszystkie sole,
−
wodorotlenki litowców i berylowców z wyjątkiem berylu i magnezu,
−
kwasy: HCl, HBr, HI, HNO
3
, H
2
SO
4
, HClO
4
.
Wodorotlenki pozostałych metali są bardzo słabo rozpuszczalne w wodzie. Ich roztwory
zawierają bardzo mało jonów, czyli nie są mocnymi elektrolitami. Wodorotlenek metalu
trudno rozpuszczalny w wodzie jest, więc słabą zasadą, a jego roztwór – słabym elektrolitem.
Do elektrolitów słabych i średniej mocy należą wszystkie pozostałe kwasy, w tym organiczne
oraz roztwór amoniaku.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak zachowują się cząsteczki soli, kwasów i zasad w roztworze wodnym?
2.
Na jakie jony rozpadają się cząsteczki soli w roztworze wodnym?
3.
Na jakie jony rozpadają się cząsteczki kwasów w roztworze wodnym?
4.
Na jakie jony rozpadają się cząsteczki zasad w roztworze wodnym?
5.
Jaki roztwór nazywamy elektrolitem?
6.
Jakie roztwory zaliczamy do mocnych elektrolitów?
7.
Jakie roztwory zaliczamy do słabych elektrolitów?
4.4.3. Ćwiczenia
Ćwiczenie 1
Zapisz równania rozpadu na jony dla następujących cząsteczek: MgCl
2
, KOH, Na
2
SO
4
,
HNO
3
, Mg(OH)
2
, H
3
PO
4
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące równań dysocjacji soli, kwasów i zasad,
2)
zapisać w notatniku równania rozpadu na jony dla cząsteczek: MgCl
2
, KOH, Na
2
SO
4
,
HNO
3
, Mg(OH)
2
, H
3
PO
4
,
3)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca dysocjacji jonowej.
Ćwiczenie 2
Nazwij poniższe związki chemiczne. Określ, czy ich roztwory są mocnymi czy słabymi
elektrolitami.
Wzór substancji
Nazwa związku chemicznego
Moc elektrolitu
NaCl
H
2
CO
3
BaSO
4
Fe(OH)
3
HNO
3
Ba(OH)
2
K
3
PO
4
CrCl
3
CsOH
H
2
S
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące mocy elektrolitów,
2)
wpisać do tabeli nazwy związków chemicznych,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
3)
określić czy roztwory tych związków są mocnymi czy słabymi elektrolitami, w razie
wątpliwości skorzystać z układu okresowego oraz tabeli rozpuszczalności soli
i wodorotlenków,
4)
zapisać wyniki analizy w notatniku,
5)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
układ okresowy,
−
tabela rozpuszczalności soli i wodorotlenków,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca elektrolitów.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić, jak zachowują się cząsteczki soli, kwasów i zasad
w roztworze wodnym?
2)
określić, na jakie jony rozpadają się cząsteczki soli w roztworze
wodnym?
3)
określić, na jakie jony rozpadają się cząsteczki kwasów w roztworze
wodnym?
4)
określić, na jakie jony rozpadają się cząsteczki zasad w roztworze
wodnym?
5)
zdefiniować roztwór określamy mianem elektrolitu?
6)
wskazać roztwory zaliczane do słabych elektrolitów?
7)
wskazać roztwory zaliczane do mocnych elektrolitów?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
4.5.
Sposoby wyrażania stężeń
4.5.1. Materiał nauczania
Wielkością charakteryzującą każdy roztwór pod względem ilości substancji w nim
rozpuszczonej jest jego stężenie. Stężeniem roztworu nazywamy zawartość substancji
rozpuszczonej w określonej ilości roztworu lub rozpuszczalnika.
Wyraża się je najczęściej jako stężenie procentowe, stężenie w mol/dm
3
oraz stężenie
w ułamkach molowych.
Stężenie procentowe roztworu Cp, wyrażone w procentach masowych oznacza liczbę
gramów substancji rozpuszczonej, zawartej w 100 gramach roztworu.
m
s
C
p
= ––– 100%
m
r
gdzie: m
s
– masa substancji,
m
r
– masa roztworu, czyli suma mas substancji i rozpuszczalnika.
m
r
= m
s
+ m
rozp.
Przykład
Jak przygotować 500 gramów 2% roztworu wodorotlenku sodu?
Dane:
Szukane:
m
r
= 500g
m
s
= ?
Cp = 2%
m
rozp.
= ?
Przekształcamy wzór na stężenie procentowe i wyliczamy masę substancji:
Cp · m
r
2% · 500 g
m
s
= ———— = ————— = 10 g
100%
100%
Następnie obliczamy ilość rozpuszczalnika:
m
rozp.
= m
r
– m
s
= 500 g – 10 g = 490 g
Przy założeniu, że gęstość wody wynosi 1 g/cm
3
, można odmierzyć 490 cm
3
wody.
Odpowiedź: Aby przygotować 500 gramów 2% roztworu wodorotlenku sodu należy
odważyć 10 gramów NaOH i rozpuścić go w 490 cm
3
wody destylowanej.
Stężenie molowe C
m
określa liczbę moli substancji rozpuszczonej, zawartej w 1 dm
3
roztworu i wyraża się w mol/dm
3
.
n
C
m
= —
V
gdzie: n – liczba moli substancji rozpuszczonej,
V – objętość roztworu.
Przykład
Jak przygotować 200 cm
3
roztworu chlorku sodu o stężeniu 0,5 mol/dm
3
?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Dane:
Szukane:
V = 200cm
3
= 0,2dm
3
n
= ?
C
m
= 0,5 mol/dm
3
m
s
= ?
Przekształcamy wzór na stężenie molowe i wyliczamy liczbę moli substancji:
n = C
m
· V = 0,5 mol/dm
3
· 0,2 dm
3
= 0,1 mol
Następnie obliczamy masę molową chlorku sodu i masę substancji:
M
NaCl
= 23 + 35,5 = 58,5 g/mol
m
= n · M, m
s
= 0,1 mol · 58,5 g/mol = 5,85 g
Odpowiedź: Aby przygotować 200 cm
3
roztworu chlorku sodu o stężeniu 0,5 mol/dm
3
,
należy odważyć 5,85 grama NaCl, rozpuścić go w wodzie i dopełnić wodą do 200 cm
3
.
Ułamek molowy jest to stosunek liczby moli składnika roztworu do sumy liczby moli
wszystkich składników roztworu.
Jeżeli w roztworze dwuskładnikowym oznaczymy przez n
1
liczbę moli substancji
rozproszonej, a przez n
2
liczbę moli rozpuszczalnika, wówczas ułamek molowy substancji
rozpuszczonej X
1
wyrażamy wzorem:
n
1
X
1
= ———
n
1
+ n
2
a ułamek molowy rozpuszczalnika X
2
wzorem:
n
2
X
2
= ———
n
1
+ n
2
Dla roztworu wieloskładnikowego, o składnikach n
1
, n
2
... n
i
ułamek molowy X
i
składnika n
i
wynosi:
n
i
X
i
= ———————
n
1
+ n
2
+ ... n
i
Przykład
Oblicz stężenie w ułamkach molowych roztworu wodnego zawierającego 12%
masowych NaOH.
Dane:
Szukane:
Cp = 12%
m
NaOH
= 12 g w 100 g roztworu
X
NaOH
= ?
m
H2O
= 88 g w 100 g roztworu
X
H2O
= ?
M
NaOH
= 40 g/mol
M
H2O
= 18 g/mol
Przeliczamy ilości gramowe składników na mole
m
NaOH
12 g
n
NaOH
= ——— = ———— = 0,30 mola
M
NaOH
40 g/mol
M
H2O
88 g
n
H2O
= ——— = ———— = 4,89 mola
M
H2O
18 g/mol

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Ułamek molowy X
NaOH
i X
H2O
wynosi odpowiednio:
n
NaOH
0,03
X
NaOH
= ————— = —————— = 0,058
n
NaOH
+ n
H2O
0,03 + 4,89
n
H2O
4,89
X
H2O
= ————— = —————— = 0,942
n
NaOH
+ n
H2O
0,03 + 4,89
Suma ułamków molowych składników roztworu wynosi:
X
NaOH
+ X
H2O
= 0,058 +0,942 = 1,000
Przeliczanie stężeń jest bardzo przydatną czynnością. Najprościej zapamiętać zależność
między stężeniem procentowym i molowym, wyliczając ją zgodnie z zamieszczonym poniżej
przykładem.
Przykład
Oblicz stężenie molowe roztworu kwasu siarkowego(VI) o gęstości 1,30 g/cm
3
i stężeniu
40 %.
Dane:
Szukane:
d = 1,30 g/cm
3
= 1300 g/dm
3
C
m
= ?
Cp = 40 %
M
H2SO4
= 98 g/mol
m
s
C
p
= — 100%
m
r
gdzie: m
s
= n· M
m
r
= V· d
stąd:
n· M
C
p
= ——— 100%
V· d
C
m
·
M
C
p
= ——— 100%
d
po przekształceniu:
C
p
·
d
C
m
= ———
M · 100%
40 %
·
1300 g/dm
3
C
m
= ———————
98 g/mol · 100%
C
m
= 4,3 mol/dm
3

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak można zdefiniować stężenie roztworu?
2.
Co określa stężenie procentowe roztworu?
3.
Co określa stężenie molowe roztworu?
4.
W jakich jednostkach wyrażamy stężenie procentowe i stężenie molowe?
5.
Ile wynosi gęstość wody?
6.
Co wyraża ułamek molowy?
7.
Jakim wzorem opiszesz zależność między stężeniem procentowym a molowym?
4.5.3. Ćwiczenia
Ćwiczenie 1
W 200 gramach wody rozpuszczono 20 gramów chlorku sodu. Oblicz stężenie
procentowe tego roztworu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące stężenia procentowego,
2)
wypisać dane i szukane z treści polecenia,
3)
obliczyć stężenie procentowe roztworu,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca stężenia procentowego.
Ćwiczenie 2
W wodzie rozpuszczono 0,2 mola wodorotlenku sodu otrzymując 500 cm
3
roztworu.
Oblicz stężenie molowe tego roztworu, wyrażając go w mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące stężenia molowego,
2)
wypisać dane i szukane z treści polecenia,
3)
zamienić objętość z cm
3
na dm
3
,
4)
obliczyć stężenie molowe roztworu,
5)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca stężenia molowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Ćwiczenie 3
Przygotuj 100 gramów roztworu chlorku sodu o stężeniu 5%.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące stężenia procentowego,
2)
obliczyć, ile chlorku sodu należy odważyć i ile wody należy odmierzyć do przygotowania
roztworu,
3)
odważyć chlorek sodu, odmierzyć wodę i przygotować roztwór,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
waga techniczna,
−
chlorek sodu, woda destylowana,
−
naczynko wagowe, zlewka, cylinder miarowy,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca stężenia procentowego.
Ćwiczenie 4
Przygotuj 200 cm
3
roztworu wodorotlenku sodu o stężeniu 0,1 mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące stężenia molowego,
2)
obliczyć, ile wodorotlenku należy odważyć do przygotowania roztworu,
3)
odważyć wodorotlenek i przygotować roztwór,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
waga techniczna,
−
wodorotlenek sodu, woda destylowana,
−
naczynko wagowe, zlewka, cylinder miarowy,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca stężenia molowego.
Ćwiczenie 5
Oblicz stężenie procentowe roztworu siarczku sodu (Na
2
S) o stężeniu 0,5 mol/dm
3
i gęstości 1,04 g/cm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące przeliczania stężeń,
2)
wypisać dane i szukane z treści polecenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
3)
obliczyć stężenie procentowe roztworu,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
notatnik,
−
przybory do pisania,
−
literatura z rozdziału 6 dotycząca przeliczania stężeń.
4.5.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
zdefiniować stężenie roztworu?
2)
wyjaśnić, co określa stężenie procentowe roztworu?
3)
wyjaśnić, co określa stężenie molowe roztworu?
4)
określić, w jakich jednostkach wyrażamy stężenie procentowe i stężenie
molowe?
5)
określić gęstość wody?
6)
zdefiniować pojęcie: ułamek molowy?
7)
określić, jakim wzorem można opisać zależność między stężeniem
procentowym a molowym?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
4.6.
Obliczanie procesów chemicznych
4.6.1. Materiał nauczania
Obliczenia, w których wykorzystuje się równania chemiczne, są najbardziej użyteczne
dla każdego, kto zamierza zrealizować przemianę chemiczną. Celem obliczeń tego typu jest
ustalenie ilości substratów, niezbędnej do otrzymania pożądanej ilości produktu.
Substancje
reagują
ze
sobą
w
ś
ciśle
określonym
stosunku
ilościowym,
charakterystycznym dla danej reakcji. Również powstające produkty pozostają w stosunku do
siebie i substratów w ściśle określonych stosunkach. Stosunki ilościowe między reagentami,
tzw. stosunki stechiometryczne reagentów, oblicza się na podstawie równania chemicznego.
Na przykład korzystając z mas molowych (lub atomowych i cząsteczkowych) reagentów,
można obliczyć masowy stosunek stechiometryczny. W tym celu należy pomnożyć
współczynniki stechiometryczne przez odpowiednie masy molowe.
Dowolne równanie reakcji możemy zinterpretować na różne sposoby.
Równanie spalania wodoru w tlenie można odczytać tak:
2 H
2
+ O
2
→
2 H
2
O
2 cząsteczki wodoru 1 cząsteczka tlenu 2 cząsteczki wody
lub tak:
2 mole wodoru 1 mol tlenu 2 mole wody
Dzięki znajomości masy molowej możemy przewidzieć, jakich mas substratów należy użyć
do reakcji, a także jaką ilość produktu otrzymamy w jej wyniku.
Posługując się masami molowymi oraz korzystając z zależności m = n
.
M, powyższe
równanie można odczytać również tak:
2 mol
.
2 g/mol 1 mol
.
32 g/mol 2 mol
.
18 g/mol
4 g wodoru 32 g tlenu 36 g wody
Na podstawie powyższych rozważań można sformułować ważne uogólnienie, zwane zasadą
stechiometrii: ilość jednego reagenta określa ilości wszystkich pozostałych.
Obliczenia stechiometryczne wynikające z równań reakcji można początkowo, to znaczy
przed nabraniem wprawy, rozwiązywać, przyjmując następujący schemat postępowania.
1.
Ułożyć równanie reakcji chemicznej.
2.
Podkreślić wzór substancji, której ilość jest podana i wzór substancji, której ilość należy
obliczyć.
3.
Wypisać wielkości dane i szukane nad wzorami odpowiednich substancji.
4.
Ustalić stosunek stechiometryczny podkreślonych substancji, podając ilości każdej
substancji w takich samych jednostkach, jak w zapisie nad wzorem.
5.
Ułożyć proporcję.
6.
Obliczyć wartość niewiadomej.
7.
Podać odpowiedź.
Przykład 1
Ile gramów siarki potrzeba do otrzymania 100 g siarczku glinu z glinu i siarki?
Układamy równanie reakcji chemicznej:
2 Al + 3 S
→
Al
2
S
3
Podkreślamy wzór substancji, której ilość jest podana i wzór substancji, której ilość należy
obliczyć oraz wypisujemy wielkości dane i szukane nad wzorami odpowiednich substancji:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
x g 100g
2 Al + 3 S
→
Al
2
S
3
Odczytujemy odpowiednio równanie, podając ilość każdej substancji w takich samych
jednostkach, jak w zapisie nad wzorem:
x g 100g
2 Al + 3 S
→
Al
2
S
3
3
.
32 g 1
.
150 g
Układamy proporcję:
96 g S
150 g Al
2
S
3
x g S
100 g Al
2
S
3
Obliczmy wartość niewiadomej:
96 g
.
100 g
x =
= 64 g S
150 g
Podajemy odpowiedź: Do otrzymania 100 g siarczku glinu potrzeba 64 g siarki.
Przykład 2
Podczas prażenia węglanu wapnia otrzymuje się tlenek wapnia i tlenek węgla (IV). Oblicz
masę tlenku wapnia powstającą w wyniku termicznego rozkładu 75 g węglanu wapnia.
75 g x g
CaCO
3
→
CaO + CO
2
100 g 56 g
100g CaCO
3
56 g CaO
75 g CaCO
3
x g CaO
75 g 56 g
x =
= 42 g CaO
100 g
Odpowiedź: w wyniku rozkładu 75 g CaCO
3
powstanie 42 g CaO.
Przykład 3
Czy 20 g tlenu wystarczy do całkowitego spalenia 5 g węgla, jeżeli produktem tej reakcji jest
dwutlenek węgla?
Analiza problemu
Reakcja przebiega według równania:
C + O
2
→
CO
2
12 g 32 g
które określa stosunek stechiometryczny węgla do tlenu, wynoszący 12 g : 32 g. Znajomość
tego stosunku pozwala na obliczenie, ile tlenu potrzeba do spalenia 5 g węgla lub też,
ile węgla można spalić za pomocą 20 g tlenu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Rozwiązanie
Metoda I
Obliczamy ile tlenu potrzeba do spalenia 5 g węgla:
wielkości dane i szukane: 5 g x g
równanie chemiczne:
C + O
2
→
CO
2
stosunek stechiometryczny: 12 g 32 g
obliczenia:
12 g C
32 g O
2
5 g C
x g O
2
5 g
.
32 g
x =
= 13,3 g O
2
12 g
Wynik ten oznacza, że do spalenia 5 g węgla potrzeba tylko 13,3 g tlenu, zatem podana
w zadaniu ilość 20 g wystarczy w zupełności. Nadmiar tlenu nie brałby udziału w reakcji.
Metoda II
Obliczamy, ile węgla można spalić za pomocą 20 g tlenu:
wielkości dane i szukane: x g 20 g
równanie chemiczne:
C + O
2
→
CO
2
stosunek stechiometryczny: 12 g 32 g
obliczenia:
12 g C
32 g O
2
x g C
20 g O
2
12 g
.
20 g
x =
= 7,5 g C
32 g
Wynik ten oznacza, że dysponując 20 g tlenu, można spalić 7,5 g węgla, czyli więcej niż
podano w zadani (5 g), a zatem tlen byłby w takim przypadku użyty w nadmiarze.
Przykład 4.
Ile gramów siarczku żelaza(II) otrzymamy, jeżeli do reakcji użyjemy 10,5 g żelaza i 7 g
siarki?
Analiza problemu
Reakcja przebiega według równania:
Fe + S
→
FeS
56 g 32 g 88 g
które określa stosunek stechiometryczny substratów Fe : S = 56 : 32. reakcja może przebiegać
tylko w takim stosunku masowym. Używając do reakcji dowolnych ilości żelaza i siarki, np.
10,5 g Fe i 7,5 g S, jak podano w zadaniu, nie mamy pewności, czy zmieszano je w stosunku
stechiometrycznym.
Rozwiązanie zadania sprowadza się do sprawdzenia, czy substraty zostały użyte
w stosunku stechiometrycznym, czy też któregoś z nich użyto w nadmiarze. Ilość
powstającego FeS obliczamy ze stosunku FeS do substratu, który nie był użyty w nadmiarze.
Rozwiązanie
Wielkości dane i szukane: 10,5 g x g z g
lub: y g 7 g z g
równanie reakcji:
Fe + S
→
FeS
stosunek stechiometryczny: 56 g 32 g 88 g

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Metoda I
Obliczamy, ile siarki (x) przereaguje z 10,5 g żelaza:
56 g Fe
32 g S
10,5 g Fe
x g S
10,5 g
.
32 g
x =
= 6 g S
56 g
Wynik oznacza, że siarka (7 g) została użyta w nadmiarze.
Metoda II
Obliczamy, ile żelaza (y) przereaguje z 7 g siarki:
56 g Fe
32 g S
y g Fe
7 g S
56 g
.
7 g
x =
= 6 g Fe
32 g
wynik oznacza, że ilość użytego żelaza (10,5 g) była taka, że mogło ono przereagować
w całości.
Każda z przedstawionych metod prowadzi do tego samego wniosku: o ilości
wytworzonego siarczku żelaza (z) decyduje żelazo, a nie siarka, zatem dalsze obliczenia
prowadzimy względem żelaza:
56 g Fe
88 g FeS
10,5 g Fe
z g FeS
10,5 g
.
88 g
x =
= 16,5 g FeS
56 g
Odpowiedź: otrzymamy 16,5 g siarczku żelaza(II).
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
W jakim celu wykorzystuje się równania chemiczne do obliczeń?
2.
Co oznacza pojęcie stosunki stechiometryczne reagentów?
3.
W jaki sposób możemy obliczyć masowy stosunek stechiometryczny reagentów?
4.
Jak brzmi zasada stechiometrii?
5.
Jaki jest schemat obliczania procesów chemicznych?
6.
W jakim stosunku stechiometrycznym (molowym) reagują substraty w reakcji:
N
2
+ 3 H
2
→
2 NH
3
?
7.
W jakim stosunku masowym reagują substraty w reakcji: Fe + S
→
FeS?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
4.6.3. Ćwiczenia
Ćwiczenie 1
Oblicz, ile gramów wodorotlenku sodu potrzeba do zobojętnienia 12 g kwasu
fosforowego(V).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
ułożyć równanie reakcji chemicznej,
2)
podkreślić wzór substancji, której ilość jest podana i wzór substancji, której ilość należy
obliczyć,
3)
wypisać wielkości dane i szukane nad wzorami odpowiednich substancji,
4)
ustalić stosunek stechiometryczny podkreślonych substancji, podając ilości każdej
substancji w takich samych jednostkach, jak w zapisie nad wzorem,
5)
ułożyć proporcję,
6)
obliczyć wartość niewiadomej,
7)
zapisać obliczenia i odpowiedź w notatniku,
8)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
kalkulator,
−
literatura dotycząca obliczeń stechiometrycznych.
Ćwiczenie 2
W celu otrzymania siarczku cynku (ZnS) zmieszano 15 g cynku z 6,4 g siarki. Określ,
którego z substratów użyto w nadmiarze. Oblicz ile gramów siarczku cynku otrzymano.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
ułożyć równanie reakcji chemicznej,
2)
wypisać wielkości dane i szukane nad wzorami odpowiednich substancji,
3)
ustalić stosunek stechiometryczny podkreślonych substancji,
4)
ułożyć proporcję,
5)
ustalić na podstawie obliczeń, który substrat przereagował w całości, a który został użyty
w nadmiarze,
6)
prowadzić dalsze obliczenia w stosunku do substratu, który przereagował w całości,
7)
ułożyć proporcję,
8)
obliczyć masę otrzymanej soli,
9)
zapisać obliczenia w notatniku,
10)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania,
−
kalkulator,
−
literatura z rozdziału 6 dotycząca obliczeń stechiometrycznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
4.6.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
podać, w jakim celu wykorzystuje się równania chemiczne
w obliczeniach?
2)
wyjaśnić pojęcie stosunki stechiometryczne reagentów?
3)
obliczyć masowy stosunek stechiometryczny reagentów?
4)
podać zasadę stechiometrii?
5)
obliczyć stosunek masowy reagentów dla danej reakcji?
6)
podać, w jakim stosunku molowym reaguje glin z tlenem, tworząc
tlenek glinu?
7)
podać schemat obliczania procesów chemicznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
4.7.
Składy mieszanin i roztworów
4.7.1. Materiał nauczania
Wagowa zawartość procentowa p
1
w
(tzw. procent wagowy) składnika 1 w mieszaninie
oraz objętościowa zawartość procentowa p
1
o
(tzw. procent objętościowy) składnika 1
w mieszaninie są definiowane wzorami:
m
1
V
1
p
1
w
= —— · 100%
p
1
o
= —— · 100%
m
m
V
m
gdzie: m – masy, V – objętości, indeks 1 dotyczy składnika 1, indeks m – mieszaniny.
Przykład 1
Mieszanina zawiera 2 mole tlenku węgla (CO) i 3 mole dwutlenku węgla (CO
2
). Oblicz
zawartość procentową tlenku węgla w procentach wagowych i objętościowych.
2 mole CO to 2 · 28 g = 56 g
3 mole CO
2
to 3 · 44 g = 132 g
masa mieszaniny m
m
= 56 g + 132g = 188 g
56 g
p
1
w
= —— · 100% = 29,8%
188 g
2 mole CO zajmują objętość 2V
0
(V
0
– objętość mola, identyczna dla wszystkich gazów,
zależna od ciśnienia i temperatury). 3 mole CO
2
zajmują objętość 3 V
0
2V
0
p
CO
o
= ————— · 100% = 40%
2V
0
+ 3 V
0
Przykład 2
W wyniku prażenia 50 gramów wapienia otrzymano 18 gramów dwutlenku węgla. Ile procent
węglanu wapnia zawierał wapień?
Wielkości dane:
x
18 g
Równanie chemiczne:
CaCO
3
→ CaO
+ CO
2
Stosunek stechiometryczny:
100 g
44 g
x 18
równanie: —— = ——
100
44
x = 40,9 g CaCO
3
zawartość procentowa węglanu wapnia w wapieniu wynosi: 40,9 g/50 g 100% = 81,8%
Przykład 3
10 gramów stopu glinu z magnezem rozpuszczono w kwasie solnym i otrzymano 10,58 dm
3
wodoru odmierzonego w warunkach normalnych. Oblicz skład procentowy stopu.
Liczbę gramów glinu zawartego w stopie oznaczamy przez x, a liczbę gramów magnezu
przez 10 – x. Objętość wodoru wydzielonego w reakcji magnezu z kwasem oznaczamy przez
y, a objętość wodoru wydzielonego w reakcji z magnezu z kwasem przez 10,58 – y.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Wielkości dane i szukane:
x [g]
y [dm
3
]
Równanie chemiczne:
2 Al + 6 HCl → 2 AlCl
3
+ 3 H
2
Stosunek stechiometryczny: 54 g
3 · 22,4 dm
3
54
x
równanie I: ———— = —
3 · 22,4 y
Wielkości dane i szukane:
(10 -x ) [g]
(10,58 – y) [dm
3
]
Równanie chemiczne:
Mg + 2 HCl → MgCl
2
+ H
2
Stosunek stechiometryczny:
24 g
22,4 dm
3
24
10 - x
równanie II: —— = ————
22,4 10,58 – y
po rozwiązaniu równań I i II otrzymamy: x = 2, y = 3. Zawartość glinu w stopie wyniesie:
2/5·100% = 40%, a zawartość magnezu: 100% - 40% = 60%.
4.7.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakimi wzorami można zdefiniować procent wagowy i procent objętościowy?
2.
Ile waży 3 mole SiO
2
?
3.
Jaką objętość zajmuje 5 moli tlenu cząsteczkowego?
4.
Jaką wartość przyjmuje x w proporcji
x
16
—— = ——?
20 5
5.
Jaką postać będzie miało równanie dla następujących danych
Wielkości dane i szukane:
x [g]
y [dm
3
]
Równanie chemiczne:
2 Al + 6 HCl → 2 AlCl
3
+ 3 H
2
Stosunek stechiometryczny: 108 g
3 · 22,4 dm
3
?
4.7.3. Ćwiczenia
Ćwiczenie 1
Oblicz procentowy skład wagowy mieszaniny zawierającej 25% objętościowych
dwutlenku siarki oraz tlen.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące mieszanin i roztworów,
2)
wypisać dane i szukane z treści polecenia,
3)
obliczyć procentowy skład wagowy mieszaniny,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Ćwiczenie 2
W wyniku ogrzewania 20 gramów zanieczyszczonej soli Bertholleta otrzymano 11,8
gramów substancji. Oblicz ile procent czystej soli Bertholleta zawierała próbka. Reakcja
rozkładu przebiega według równania:
2 KClO
3
→
2 KCl + 3O
2
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące mieszanin i roztworów,
2)
wypisać dane i szukane z treści polecenia,
3)
obliczyć zawartość procentową czystej soli,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania.
Ćwiczenie 3
5 gramów siluminu (stop glinu i krzemu) poddano działaniu kwasu solnego. Otrzymano
5,6 dm
3
wodoru (warunki normalne). Oblicz skład procentowy siluminu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować wiadomości dotyczące mieszanin i roztworów,
2)
wypisać dane i szukane z treści polecenia,
3)
obliczyć skład procentowy stopu,
4)
zaprezentować efekty pracy.
Wyposażenie stanowiska pracy:
−
notatnik,
−
przybory do pisania.
4.7.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
podać, jakimi wzorami można zdefiniować procent wagowy i procent
objętościowy?
2)
obliczyć, ile waży 5 moli Cr
2
O
3
?
3)
podać, jaką objętość zajmuje 6 moli tlenu cząsteczkowego?
4)
obliczyć wartość x w proporcji
345 x
—— = ——?
200 44

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi.
5.
Test zawiera 20 zadań wielokrotnego wyboru, z których:
−
zadania od 1 do 15 są z poziomu podstawowego,
−
zadania od 16 do 20 są z poziomu ponadpodstawowego.
6.
Za każdą poprawną odpowiedź możesz uzyskać 1 punkt.
7.
Dla każdego zadania podane są cztery możliwe odpowiedzi: a, b, c, d. Tylko jedna
odpowiedź jest poprawna; wybierz ją i zaznacz kratkę z odpowiadającą jej literą, znakiem
X.
8.
Jeżeli się pomylisz i błędnie zaznaczysz odpowiedź, otocz ją kółkiem i zaznacz ponownie
odpowiedź, którą uważasz za poprawną.
9.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
10.
Kiedy udzielenie odpowiedzi będzie sprawiało Ci trudność, wtedy odłóż rozwiązanie
zadania na później i wróć do niego, gdy zostanie Ci czas wolny.
11.
Po rozwiązaniu testu sprawdź, czy zaznaczyłeś wszystkie odpowiedzi na KARCIE
ODPOWIEDZI.
12.
Na rozwiązanie testu masz 45 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
ZESTAW ZADAŃ TESTOWYCH
1.
Równanie
N
2(g)
+ 3 H
2(g)
↔ 2 NH
3(g)
+ 45,95 kJ/mol
obrazuje reakcję
a)
syntezy, egzoenergetyczną.
b)
syntezy, endoenergetyczną.
c)
analizy, egzoenergetyczną.
d)
analizy, endoenergetyczną.
2.
Do mocnych elektrolitów zaliczamy wodne roztwory
a)
NaCl, KOH, H
2
CO
3
.
b)
NaCl, LiOH, H
2
SO
4
.
c)
AgCl, KOH, H
2
SO
4
.
d)
NaCl, CuOH, HNO
3
.
3.
W celu przygotowania 100 gramów 2% roztworu siarczanu (VI) potasu, należy odważyć
a)
2 gramy soli.
b)
5 gramów soli.
c)
50 gramów soli.
d)
0,2 grama soli.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
4.
W czasie dysocjacji elekrolitycznej cząsteczki wszystkich soli rozpadają się na
a)
kationy metalu i aniony wodorotlenkowe.
b)
kationy metalu i aniony reszty kwasowej.
c)
kationy wodoru i aniony reszty kwasowej.
d)
kationy wodoru i aniony wodorotlenkowe.
5.
Równanie opisujące rozpad na jony cząsteczki siarczanu (VI) sodu to
a)
Na
2
SO
4
→ Na
+
+ SO
4
2–
.
b)
Na
2
SO
4
→ 2Na
+
+ 2SO
4
–
.
c)
Na
2
SO
4
→ Na
2+
+ SO
4
2–
.
d)
Na
2
SO
4
→ 2Na
+
+ SO
4
2–
.
6.
Pierwiastek o symbolu
12
25
X zawiera
a)
12 protonów.
b)
12 neutronów.
c)
25 elektronów.
d)
25 neutronów.
7.
Pierwiastek o konfiguracji: K
2
L
8
M
4
ma symbol
a)
Ga.
b)
Si.
c)
C.
d)
S.
8. Pierwiastek leżący w 4 okresie i 13 grupie ma
a)
31 protonów w jądrze i 31 elektronów walencyjnych.
b)
31 protonów i 3 powłoki elektronowe.
c)
3 powłoki elektronowe i 4 elektrony walencyjne.
d)
4 powłoki elektronowe i 3 elektrony walencyjne.
9. Wiązanie kowalencyjne niespolaryzowane występuje w cząsteczce
a)
CaS.
b)
NH
3
.
c)
PH
3
.
d)
K
2
O.
10. Przy założeniu, że gęstość wody wynosi 1 g/cm
3
, zamiast ważyć 200 gramów wody,
można odmierzyć
a)
2 dm
3
wody.
b)
20 cm
3
wody.
c)
200 cm
3
wody.
d)
200 dm
3
wody.
11. Wagowy stosunek stechiometryczny siarki do tlenu w reakcji przebiegającej według
równania:
2 S + 3 O
2
→ 2 SO
3
wynosi
a)
32 : 32.
b)
64 : 32.
c)
64 : 64.
d)
64 : 96.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
12. Molowy stosunek stechiometryczny reagentów w następującym równaniu
2 Fe
2
O
3
+ 3 C → 4 Fe + 3 CO
2
wynosi
a)
2 : 3 : 4 : 6.
b)
4 : 3 : 4 : 3.
c)
2 : 3 : 4 : 3.
d)
4 : 3 : 4 : 6.
13. 3 dm
3
roztworu o stężeniu 0,2 mol/dm
3
zawiera
a)
2 mole substancji.
b)
6 moli substancji.
c)
0,2 mola substancji.
d)
0,6 mola substancji.
14. Korzystając z podanych danych, można obliczyć ilość tlenu potrzebną do spalenia 20 g
węgla
wielkości dane i szukane: 24 g x g
równanie chemiczne:
C + O
2
→
CO
2
stosunek stechiometryczny: 12 g 32 g, wynosi
a)
64 g.
b)
16g.
c)
8 g.
d)
0,75 g.
15. Masa jednego mola tlenku glinu wynosi
a)
43 g.
b)
75 g.
c)
102 g.
d)
113 g.
16. Związki o budowie jonowej
a)
tworzą kryształy kowalencyjne i cząsteczkowe.
b)
rozpuszczają się w rozpuszczalnikach niepolarnych.
c)
występują we wszystkich stanach skupienia.
d)
w stanie stałym lub roztworze przewodzą prąd elektryczny.
17. Związki o budowie kowalencyjnej spolaryzowanej to
a)
H
2
S, Na
2
S
,
CaS.
b)
CaO, CaCl
2
, HCl.
c)
KBr, MgBr
2
, MgO.
d)
HBr, H
2
O, CO
2
.
18. Pierwiastek zawierający 20 neutronów, 19 protonów i 19 elektronów ma symbol
a)
20
39
A.
b)
39
19
A.
c)
20
19
A.
d)
19
39
A.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
19. Po odparowaniu do sucha 50 gramów 5% roztworu otrzymamy
a)
2,5 gramów soli.
b)
5 grama soli.
c)
20 gramów soli.
d)
50 gramów soli.
20. Poddano reakcji 10 gramów glinu i 20 gramów siarki. W mieszaninie poreakcyjnej
znajdują się
a)
siarczek glinu i glin.
b)
siarczek glinu i siarka.
c)
siarczek glinu, siarka i glin.
d)
siarczek glinu.
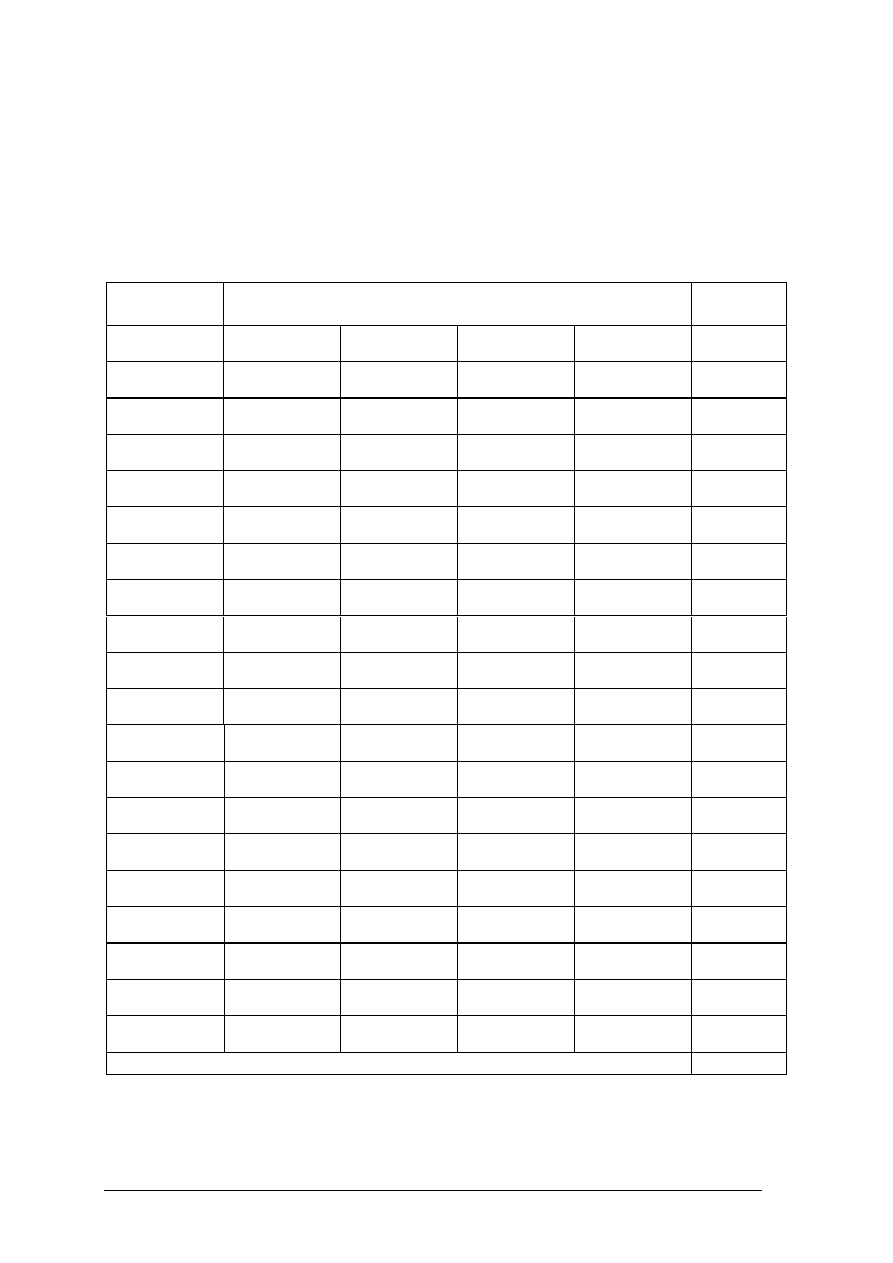
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
KARTA ODPOWIEDZI
Imię i nazwisko ................................................................................................
Posługiwanie się pojęciami z zakresu chemii stosowanej
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
6. LITERATURA
1.
Banaszkiewicz S.: Podstawy chemii. Politechnika Radomska, Radom 2003
2.
Bielański A.: Chemia ogólna i nieorganiczna. PWN, Warszawa 1998
3.
Gormaz G., Casanovas J.: Atlas mineralogii. Wiedza i śycie, Warszawa 1992
4.
Hejwowska S., Marcinkowski R.: Chemia Podręcznik zakres rozszerzony. OPERON,
Gdynia 2004
5.
Kędryna T.: Chemia ogólna z elementami biochemii. ZamKor, Kraków 2006
6.
Nadachowski F., Jonas S., Ptak W. S.: Wstęp do projektowania technologii
ceramicznych. Skrypt AGH 1999
7.
Pajdowski L.: Chemia ogólna. Wydawnictwo Naukowe PWN, Warszawa 1993
8.
Pampuch R., Haberko K., Kordek M.: Nauka o procesach ceramicznych. PWN,
Warszawa 1992
9.
Raabe J., Rusiecki A.: Pracownia technologii ceramiki. Państwowe Wydawnictwa
Szkolnictwa Zawodowego, 1972
10.
Ufnalski W.: Obliczenia fizykochemiczne. Oficyna Wydawnicza PW, Warszawa 1995
11.
Ufnalski W.: Obliczenia fizykochemiczne na Twoim PC. WNT, Warszawa 1997
Wyszukiwarka
Podobne podstrony:
05 Posługiwanie się pojęciami z zakresu termodynamiki
05 Posługiwanie się z pojęciami z zakresu ekologii
09 Posługiwanie się dokumentacją techniczną (2)
kłopotliwe, dyskryminacja, DYSKRYMINACJA: posługując się pojęciem "dyskryminacji" wrogowie
09 Posługiwanie się dokumentacją techniczną
05 Poslugiwanie sie z pojeciami Nieznany (2)
09 Posługiwanie się dokumentacją techniczną (2)
Posługiwanie się podstawowymi pojęciami z zakresu budowy rurociągów
Pojęcie mnożenia i dzielenia w klasie pierwszej wprowadza się propedeutycznie w zakresie0x
Posługiwanie się mapami stosowanymi w geodezji
03 Posługiwanie się mapami stosowanymi w geodezji
02 Posługiwanie się podstawowymi pojęciami
Posługiwanie się podstawowymi pojęciami fizykochemicznymi
02 Posługiwanie się podstawowymi pojęciami
Zdolność do odrywania się od konkretów i posługiwania się reprezentacjami symbolicznymi w zakresie p
Posługując się stosownymi przykładami wskaż najciekawsze odzwierciedlenia kultury średniowiecza w li
Marcel Mauss Sposoby posługiwania się ciałem Pojęcie sposobów posługiwania się ciatem
Pojęcie i zakres wiedzy logistyki stosowanej doc
więcej podobnych podstron