
Wykorzystanie tkanki tłuszczowej jako źródła
mezenchymalnych komórek macierzystych
Use of adipose tissue as a source of mesenchymal stem
cells
Katarzyna Jezierska-Woźniak
1
, Dorota Nosarzewska
1
, Anna Tutas
1
,
Anita Mikołajczyk
1
, Michał Okliński
1
, Marek Kajetan Jurkowski
2
1
Zakład Neurobiologii i Anatomii Człowieka, Katedra Neurologii i Neurochirurgii, Wydział Nauk Medycznych,
Uniwersytet Warmińsko-Mazurski w Olsztynie
2
Zakład Medycyny Nuklearnej i Endokrynologii Onkologicznej, Instytut Onkologii, Odział w Gliwicach
Streszczenie
Możliwościwykorzystaniakomórekmacierzystychwmedycynieregeneracyjnejiterapiigenowej
wydająsięogromne.Pozwalanatoichzdolnośćdopotencjalnienieograniczonejliczbypodzia-
łóworazdoróżnicowaniawwieleliniikomórkowych.Winżynieriitkanekpochodzeniamezo-
dermalnegoichnajlepiejpoznanymźródłemjestszpikkostny.Jednakmetodypobieraniaszpiku
kostnegoczęstowymagająrdzeniowegolubcałkowitegoznieczulenia,anajwiększąwadąjest
niewielkaliczbaotrzymanychkomórekmezenchymalnych,około1na10
5
adherentnychkomó-
rekłącznotkankowo-naczyniowegozrębu.Alternatywnymźródłemmezenchymalnychkomórek
macierzystychzrębu,opróczszpikukostnego,okostnej,tkankimięśniowejczybłonystawowej,
wydajesiętkankatłuszczowa.Podobniejakszpikkostnymapochodzeniemezodermalneiza-
wieraheterogennąpopulacjękomórekzrębu,adodatkowymjejatutemjestdostępnośćiobfitość.
Tkankatłuszczowapokrywarozległyobszarnaszegociała.Odgrywaznaczącąrolęprzechowując
energiędlapotrzeborganizmu,atakżeimmunomodulującą,poprzezwydzielanielicznychczą-
steczekzwanychadipokinami.Tkankitłuszczowezazwyczajpozyskujesiępodczasoperacjichi-
rurgicznychokolicbrzuchaplanowanychilaparoskopowychlubliposukcji.Komórkizrębuizo-
lowaneztkankitłuszczowejwykazująwielewspólnychcech,włączajączdolnośćadherencjido
plastiku,tworzenieformprzypominającychkoloniefibroblastów,dużązdolnośćproliferacjioraz
zdolnośćdoróżnicowaniawadipocyty,chondrocyty,mioblastyiosteoblasty,aprzedewszyst-
kimekspresjęwieluwspólnychantygenówpowierzchniowych.Niedawnebadaniawykazujątak-
żeichzdolnośćdotworzeniaformpochodzącychzinnychlistkówzarodkowych,naprzykładpo-
chodzącychzektodermyneuronów.Celempracyjestprzedstawieniemożliwościwykorzystania
tkankitłuszczowejjakoźródłamezenchymalnychkomórekmacierzystych,napodstawiedotych-
czasopublikowanychwynikówbadań.
Słowa kluczowe:
mezenchymalne komórki macierzyste • tkanka tłuszczowa • szpik kostny • medycyna
regeneracyjna
Summary
Enormousexpectationsareassociatedwithstemcellswithregardtocelltherapyandtissueen-
gineering.Stemcellshaveunlimitedpotentialforself-renewalanddevelopintovariouscellty-
pes.Forthemesodermaltissueengineeringsuchasourceofcellsisthebonemarrowstroma.
However,isolationofthebonemarrowrequiresgeneralorspinalanesthesiaandyieldslownumber
Received: 2010.03.16
Accepted: 2010.06.23
Published: 2010.07.27
326
Review
www.
phmd
.pl
® Postepy Hig Med Dosw (online), 2010; 64: 326-332
e-ISSN 1732-2693
- - - - -

W
stęp
Możliwościwykorzystaniakomórekmacierzystychwme-
dycynieregeneracyjnejiterapiigenowejwydająsięogrom-
ne.Pozwalanatoichzdolnośćdopotencjalnienieogra-
niczonejliczbypodziałóworazdoróżnicowaniawwiele
liniikomórkowych.Pojęciowowystępujądwagłównetypy
komórekmacierzystych–embrionalnekomórkimacierzy-
ste(embrionalstemcells–ESC)ikomórkimacierzyste
dojrzałychtkanek.ESCcharakteryzujezdolnośćdototi-
potencji(blastomerydzielącejsięzygoty),cooznacza,że
mogąsięróżnicowaćdokażdegotypukomórek,łącznie
zkomórkamitworzącymiłożysko[8]lubpluripotencji(ko-
mórkiblastocysty)–dająpoczątekkażdemutypowikomó-
rekdorosłegoorganizmu,zwyjątkiemkomórekłożyska
[32,34].Jednakmimoodwoływaniasiędoichogromnych
możliwości,praktycznewykorzystanieESCjestograniczo-
nezpowodupotencjalnychproblemówregulacjikomórko-
wych,etycznychiregulacjiprawnych.Wodróżnieniuod
nichkomórkimacierzystedojrzałychtkaneksąimmuno-
kompatybilneiniepodlegająetycznymrozważaniom[51].
Komórkiteutrzymująszerokipotencjałróżnicowania,ale
ichpotencjałrozwojowyjestbardziejograniczonyniżko-
mórekembrionalnych.Początkowouważano,żezdolność
różnicowaniajestograniczonadotkanki,zktórejpocho-
dzą(unipotencja).Ostatniebadaniajednakdowodzą,że
mogąsięróżnicowaćwkomórkiotymsamympochodze-
niuembrionalnym(multipotencja),awodpowiednichwa-
runkachwykazywaćtakżecharakterpluripotentny(ryc.1).
s
zpik
kostny
jako
źródło
mezenchymalnych
komórek
macierzystych
Winżynieriitkanekpochodzeniamezodermalnegoichnaj-
lepiejpoznanymźródłemjestszpikkostny.Ludzkiszpik
kostnypowstajezmezodermyiobejmujepopulacjehema-
topoetycznychkomórekmacierzystychorazpopulacjęko-
mórekmezenchymalnegozrębu[15,16,33,45].Mechanizmy
proliferacjiidyferencjacjihematopoetycznychkomórekma-
cierzystychsądokładniepoznane,natomiastwciążniewie-
lewiadomoozrębie.Zrąbszpikukostnego,zarównoludz-
ki,jakizwierzęcy,jestniezwykleheterogennywswoim
składzie.Zawierawieleróżnegorodzajupopulacjikomó-
rek,włączającpopulacjękomórekmacierzystych,zwaną
mezenchymalną(mesenchymalstemcells–MSC)lubpo-
pulacjąkomórekzrębu[5].
Metodypobieraniaszpikukostnegoczęstowymagająrdze-
niowegolubcałkowitegoznieczulenia,anajwiększąich
wadąjestniewielkaliczbaotrzymanychkomórekmezen-
chymalnych,około1na10
5
adherentnychkomórekłącz-
notkankowo-naczyniowegozrębu.Zpraktycznegopunk-
tuwidzenia,małaliczbakomórekpowodujekonieczność
hodowliex vivo,byosiągnąćklinicznieodpowiedniąich
liczbę.Tozkoleiwymagastosowaniaodpowiedniodo-
branychsurowic,byosiągnąćwzrostkomórek,bezutraty
ichzdolnościdoróżnicowania.Jesttoniezwykleczaso-
chłonne,drogieiznaczniepodnosiryzykokontaminacji
orazichśmierci.
Komórkizrębuizolowaneztkanekpochodzeniamezoder-
malnegowykazująwielewspólnychcech,włączajączdol-
nośćadherencjidoplastiku,tworzenieformprzypominają-
cychkoloniefibroblastów,dużązdolnośćproliferacjioraz
zdolnośćdoróżnicowaniawadipocyty,chondrocyty,mio-
blastyiosteoblasty,aprzedewszystkimekspresjęwielu
wspólnychantygenówpowierzchniowych[51].Ostatnie
badaniawykazujątakżeichzdolnośćdotworzeniaform
pochodzącychzinnychlistkówzarodkowych,naprzykład
pochodzącychzektodermyneuronów.Wydajesięwięc,że
ofmesodermalstemcells(MSCs)uponprocessing(1MSCper10
5
adherentstromalcells).Anal-
ternativesourceofautologousstemcellsseemstobe,apartfrombonemarrow:periosteum,mu-
sculartissueorsynovialmembraneandadiposetissue.Theadiposetissueisderivedfromtheem-
bryonicmesenchyme,containsalargenumberofstromalstemcellsandisrelativelyeasytoobtain
inlargequantities.Itcoversawidespreadareaofhumanbody,andcanbeclassifiedaswhiteand
brownadiposetissueintermsoflocationandfunction.Specimensoftheadiposetissueareusual-
lyobtainedfromelective,laparoscopicorliposuctionsurgeries.Stromalstemcells,isolatedfrom
thistissue,exhibitcharacteristicscommontomesodermaltissues,including:adherencetoplastic,
formationoffibroblastic-likecolonies,extensiveproliferativecapacity,abilitytodifferentiateinto
severalmesodermallineages(includingbone,cartilage,muscleandfat),andexpressionofseve-
ralcommoncellsurfaceantigens.Recentevidencesuggestthatthesecellscanalsoformnon-me-
sodermaltissues–neuron-likecells.Theaimofthispublicationistodescribetheapplicationof
theadiposetissueasasourceofmesenchymalstemcellsbasedoncurrentliteraturedata.
Key words:
mesenchymal stem cells • adipose tissue • bone marrow • regenerative medicine
Full-text PDF:
http://www.phmd.pl/fulltxt.php?ICID=915330
Word count:
2669
Tables:
—
Figures:
1
References:
51
Adres autorki:
mgr Katarzyna Jezierska-Woźniak Zakład Neurobiologii i Anatomii Człowieka Wydział Nauk Medycznych Uniwersytet
Warmińsko-Mazurski w Olsztynie, al. Warszawska 30, 10-082 Olsztyn; e-mail: katarzyna.jezierska@uwm.edu.pl
Jezierska-Woźniak K. i wsp. – Wykorzystanie tkanki tłuszczowej jako źródła…
327
- - - - -
komórkizrębumogąbyćpotencjalnieprzydatnedlame-
dycynyregeneracyjnej[39,40,50].
DotychczasowacharakterystykaMSCbyławdużejmie-
rzeograniczonadokomórekwhodowli,gdziewykorzy-
stujesięichadherencjędoplastikuizdolnośćproliferacji.
Dziejesiętak,ponieważkomórkizrębusąrzadkieidlate-
gotrudnedoizolacjiwliczbiewystarczającejdoanalizy.
Takwięcidealneźródłokomórekmacierzystychpowinno
byćzarównołatwodostępne,ograniczającedominimum
dyskomfortpacjenta,nienaruszającezdolnościkomórek
doróżnicowania,atakżenatylebogate,byniepowodo-
waćzbytnichingerencjiwkulturęhodowli[51].
c
harakterystyka
mezenchymalnych
komórek
macierzystych
tkanki
tłuszczoWej
Alternatywnymźródłemmezenchymalnychkomórekmacie-
rzystychzrębu,opróczokostnej,tkankimięśniowejczybłony
stawowej,wydajesiętkankatłuszczowa.Pokrywaonarozległy
obszarnaszegociała.Odgrywaznaczącąrolęprzechowując
energiędlapotrzeborganizmu,atakżeimmunomodulującą,
przezwydzielanielicznychcząsteczekzwanychadipokina-
mi[42].Wzależnościodjejumiejscowieniaifunkcjiwy-
różniasiężółtąibrunatnątkankętłuszczową.Żółtatkanka
tłuszczowaodpowiadagłówniezamagazynowanieenergii,
atakżewytwarzanietłuszczówiichrozkład.Brunatnatkan-
katłuszczowa,charakterystycznatylkodlassaków,odpowia-
daprzedewszystkimzawytwarzanieciepła[10].
Podobniejakszpikkostny,tkankatłuszczowamapocho-
dzeniemezodermalneizawieraheterogennąpopulację
komórekzrębu,adodatkowymjejatutemjestdostępność
iobfitość.Komórkimacierzystetkankitłuszczowejsto-
sunkowołatworozwijająsięwhodowliipowolisięsta-
rzeją(nawetdo15iwięcejpasaży)[40].Dodatkowoko-
mórkitewreakcjiprzeszczepprzeciwkogospodarzowi
(graft-versus-host–GvH)mogąwykazywaćwłaściwości
immunosupresyjne[48].
Przynajmniejdwazjawiskapotwierdzająistnienietłusz-
czowychkomórekmacierzystych.Pierwszymznichjest
wzrostliczbyadipocytówwwarunkachnadmiaruenergii,
copotwierdzaistnieniekomórekadipogennychoprócztych
ostateczniezróżnicowanych,niemającychzdolnościdopo-
działówkomórkowych[9].Drugimdowodemjestto,żepod
wpływemtiazolidinedionudochodzidopobudzeniarecep-
torówwarunkującychróżnicowanieadipocytów,wzrasta
ekspresjaichgenówmarkerowych,atakżezmniejszasię
tempoproliferacjikomórektłuszczakomięsaka(liposarco-
ma).Oznaczato,żekomórkitłuszczakomięsakapowstają
ztłuszczowychkomórekprogenitorowychimogąpodle-
gaćpóźniejszemuróżnicowaniudoczasu,ażnabiorąosta-
tecznegofenotypuadipocytów[6].
Komórkimacierzystetkankitłuszczowejsąumiejscowio-
newjejpodścielisku,gdziepanująwarunkibeztlenowe.
AktywacjaczynnikaHIF1(hipoxiainducedfactor1)(czyn-
nikindukowanyprzezhipoksję1)podwpływemwarunków
beztlenowychodgrywagłównąrolęwinhibicjipóźniejsze-
goróżnicowaniaipomagautrzymaćkomórkiwstanienie-
zróżnicowanym[26].
Źródłemtkankitłuszczowejsązazwyczajoperacjechirur-
giczneokolicybrzuchalubliposukcje.Podczasinterwen-
cjilaparoskopowychilośćpobranejtkankijestzazwyczaj
niewielka,około5g,zkoleibiopsjapozwalanapobranie
jedynie1-3gtkanki,dodatkowodosyćczęstozanieczysz-
czonejkomórkamikrwi.Częstymmiejscempobrań,zwłasz-
czapodczasoperacjiplastycznych,jestteżokolicasutkowa.
Pozwalanauzyskanienawet100gtkanki,niestetyzawie-
rającejdodatkowotkankęgruczołową.Wzwiązkuztym
ilośćuzyskanychkomórekzależywznacznymstopniuod
miejsca,zktóregotkankazostałapobrana.Wprzypadku
tkankisutkawydajnośćwynosiokoło300tys.komórekna
gramtkanki,awprzypadkutkankiokolicybrzuchanawet
700tys.zgramatkanki[14,43].
Pierwszemetodyizolacjikomórekztkankitłuszczowejopra-
cowalijużwlatach60.ubiegłegostuleciaRodbelliJones
[36,37].Homogenizowalioniszczurzytłuszcz,usuwaliko-
mórkihematopoetyczne,aotrzymanefragmentyinkubowali
wroztworzekolagenazy,poczymwirowali,bymócoddzie-
lićunoszącesiędojrzałeadipocytyodosaduSVF(stromal
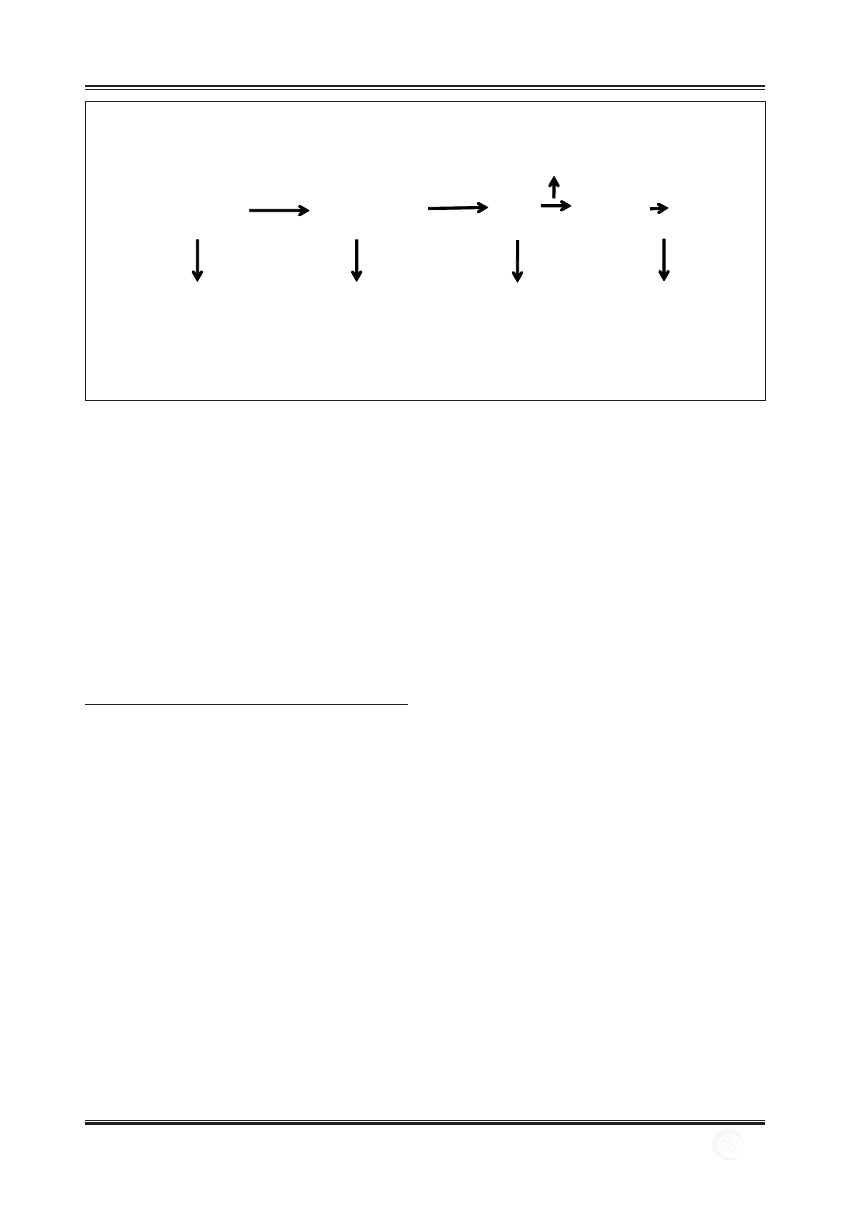
okres do blastuli
6-tygodniowy zarodek
Embrionalne
komórki macierzyste
(ES – embryonic stem cells)
(GE – embryonic germ stem cells)
Zarodkowe
komórki macierzyste
Komórki macierzyste
tkanek płodowych
Komórki macierzyste krwi pępowinowej
Dorosły
Komórki macierzyste
dojrzałych tkanek
Niemowlę
Płód
totipotentne
pluripotentne
pluripotentne
multipotentne
pluripotentne
pluripotentne
multipotentne
multipotentne
pluripotentne
Ryc. 1. Pochodzenie i charakter ludzkich komórek macierzystych
Postepy Hig Med Dosw (online), 2010; tom 64: 326-332
328
- - - - -

vascularfraction).FrakcjaSVFwykazującasiędużąhete-
rogennością,zawieraopróczkomórekmacierzystychtakże
krążącekomórkikrwi,fibroblasty,pericyty,komórkiśród-
błonka.Końcowymetapembyłowydzielenieztejfrakcji
komórekmacierzystych,wykorzystującichnaturalnązdol-
nośćadherencjidoplastiku[36,37].Procedurataulegała
zmianomwrazzrozwojemoperacjiliposukcji.Chirurdzy,
używająckaniulissących,zasysajątkankębezpośredniodo
roztworuzawierającegoanestetyki/lubepinefrynę.Pozwala
tonauzyskiwanierozdrobnionychfragmentów,których
wielkośćzależyodśrednicyużytejkaniuli.Operacjelipo-
sukcjisądobrzetolerowaneiniosąniewielkieryzykopo-
wikłań,około0,1%[20].Pobieranietkankitymsposobem
niemabezpośredniegowpływunaprzeżywalnośćkomórek
(98–100%przeżywalności).Zkoleiwykorzystanieultradź-
więkówdopobraniatkanki,zmniejszaliczbęuzyskanych
komórek,atakżeobniżaichzdolnośćdoproliferacji[32].
Bynazwaćpopulacjękomórekmacierzystychizolowaną
ztkankitłuszczowejpotrawieniukolagenaząstworzono
wielenazw.DonajczęściejużywanychnależąASCs–adi-
pose-derivedstem/stromalcells,ADAS–adiposederived
adultstem,ADSC–adiposederivedstromacells,ASC
–adiposestromacells,AdMSC–adiposemesenchymal
stemcells,lipiblasty,pericyty,pre-adipocyty,czyPLA–
processedlipoaspiratecells.Abyujednolicićnazewnictwo
InternationalFatAppliedTechnologySocietyzdecydowa-
łoprzyjąćtermin„adipose-derivedstemcells”(ASCs)za
właściwydlakomórekmacierzystychtkankitłuszczowej.
PozwalatonaodróżnienieASCsodadherentnychkomó-
rekmacierzystych/komórekprogenitorowychszpikukost-
nego,mezenchymalnychkomórekmacierzystychimultipo-
tentnychmezenchymalnychkomórekzrębu(MSCs)[17].
Bypotwierdzić,czykomórkiotrzymanepotrawieniuko-
lagenaząsąkomórkamimacierzystymi,przeprowadzasię
charakterystykęmolekularnąibiochemiczną.Komórkite
zawierająwielemarkerówantygenowychpodobnychdo
obserwowanychwpopulacjikomórekmezodermalnych.
Indukcjakomórekskutkujeekspresjąlicznych,charakte-
rystycznychdladanejliniigenówibiałek,podobnychdo
tychobserwowanychwindukowanychkomórkachMSC
itychkomórkach,którerozwijająsięwokreślonąlinię[50].
LudzkieASCmająfenotypimmunologicznypodobnydo
komórekmacierzystychszpikukostnego.Markerypo-
wierzchniowewspólnedlakomórekASCikomórekma-
cierzystychzrębuszpikuto:CD9(białkotetraspan),CD10
(neuralnaendopepsydaza),CD13(aminopeptydaza),CD29
(integryna
b1),CD49d(integrynaa4),CD44(receptor
kwasuhialuronowego),CD54(ICAM-1,cząsteczkaad-
hezjimiędzykomórkowej1),CD55(czynnikprzyspiesza-
jącyrozkład),CD59(układdopełniacza),CD71(receptor
transferyny),CD73(ekto-5-nucleotydaza),CD90(Thy-1),
CD105(endoglin),CD106(cząsteczkaadhezjikomórko-
wejnaczyń),CD144(VE-kadheryna),CD146(MUC-18),
CD166(cząsteczkaadhezjikomórekaktywowanalim-
focytami;ALCAM),
aaktynamięśnigładkich,wimen-
tyna,markeryhematopoetyczneCD14,CD31iCD45,
orazVEGFR-2(receptorczynnikawzrostunabłonkana-
czyń)ibiałkaIklasygłównegoukładuzgodnościtkanko-
wejHLA-ABC.Komórkimacierzystetkankitłuszczowej
niezawierająnatomiastmarkerówCD11b(integryna
ab),
CD18(integryna
b2),CD50(ICAM-3,cząsteczkaadhezji
międzykomórkowej3),CD56(NCAM,cząsteczkaadhezji
komóreknerwowych),CD62(selektynaE),CD104(inte-
gryna
a4),CD16(receptorFc)orazbiałkaIIklasygłów-
negoukładuzgodnościtkankowej[13,18,50].
Różniceobserwowanowekspresjidwóchmarkerów–ko-
mórkiASCbyłypozytywnedlaCD49dinegatywnedla
CD106,podczasgdywprzypadkukomórekMSCssytu-
acjaprzedstawiasięodwrotnie.EkspresjęCD106potwier-
dzonowkomórkachzrębuszpikukostnego,gdziefunk-
cjonalniejestzwiązanazhematopoezą.Braktegomarkera
wkomórkachASCjestzgodnyzichlokalizacjąwtkance
niezwiązanejzhematopoezą[50].
Mimoróżnicwmetodachizolacjiiprowadzeniahodowli,
występujedużazgodnośćprzedstawionychwynikówana-
lizowanychmarkerówcharakteryzującychomawianeko-
mórki,aniektórepojawiającesięrozbieżnościwynikają
zmożliwościzmianmarkerówwwynikupasażyiczasu
trwaniahodowli.Podwóchlubwięcejudanychpasażach
nakomórkachASC,ekspresjiulegająmarkerycharakte-
rystycznedlaadhezjiireceptorykomórkowe,enzymypo-
wierzchniowe,białkacytoszkieletuibiałkacharakterystycz-
nedlakomórekzrębu.Bezpośrednieporównaniemiędzy
immunofenotypamiludzkichASCiMSCwykazuje,żesą
onew90%jednakowe[50].
Poziomekspresjimarkerówhematopoetycznychkomórek
macierzystych(CD11,CD14,CD45iCD34)wśródkomó-
rekSVFmalejelubzanikawrazzkolejnymipasażami,co
sugeruje,żeadherencjadoplastikuidalszyrozwójpozwa-
lauzyskaćwzględniehomogennąpopulacjęwporówna-
niuzfrakcjąSVF.Poziomekspresjimarkerówcharaktery-
stycznychdlakomórekzrębu–CD13,CD29,CD44,CD73,
CD90iCD166,jestpoczątkowoniskidlakomórekSVF,
awzrastaznaczącowrazzliczbąpasaży.Markerykomó-
rekśródbłonka–CD31,CD144iVEGFR-2sąobecnena
komórkachSVFinieulegająznaczącymzmianomwcza-
siepasażowania.Natomiastwysokipoziomekspresjigli-
koproteinyCD34występujewśródkomórekSVFiASC
wczasiepoczątkowychpasaży,malejącpodczastrwania
kultury.Glikoproteinataniejestnatomiastobecnawpo-
pulacjikomórekMSC[29].
IdentyfikacjamarkerówpowierzchniowychASCstwarza
możliwośćizolacjipopulacjikomórekmacierzystychbezpo-
średniozheterogennejfrakcjiSVF.Wykorzystujesięwtym
celuzarównocytometrięprzepływową,jakiimmunoma-
gnetycznekulki,zarównodopozytywnej,jakinegatywnej
selekcji.Naprzykładkomórkiprogenitoroweśródbłonka
mogązostaćusunięteprzeznegatywnąselekcjęekspresji
markeraCD31lubcząsteczkiadhezjikomórekśródbłonka
płytekkrwi.Analogiczniepozytywnąselekcjęprzeprowa-
dzasięnaprzykładdlaglikoproteinyCD34,którejobec-
nośćwskazujenawystępowanieASC[17].
z
dolność
różnicoWania
komórek
asc
Wielebadańdowodzi,żekomórkimacierzysteotrzyma-
neztkankitłuszczowejutrzymujązdolnośćdoróżnicowa-
niawkierunkukomórektłuszczowych[17,18,50,51],kost-
nych[11,19,22,49],chrzęstnych[41,51]imięśniowych[38]
orazwykazująogromnypotencjałnaczyniotwórczy[35],
zarównowwarunkachin vitro,jakiin vivo.
Jezierska-Woźniak K. i wsp. – Wykorzystanie tkanki tłuszczowej jako źródła…
329
- - - - -

Chondrogeneza
Różnicowaniewchrząstkęwymagadużejgęstościkultury
(micromass),cozapewniakomórkomodpowiedniąkomuni-
kacjęiprzekazinformacji.Jednymzmodelitakichhodow-
lijesthodowlawmikrogrudkach(micropellets).Takiewa-
runkihodowlinaśladujązagęszczeniepierwotnejchrząstki
podczasrozwojuembrionalnego,prowadzącedowzrostu
interakcjimiędzykomórkamiiwytwarzaniamacierzymię-
dzykomórkowej[46].Kulturajednowarstwowa(monolayer)
prowadzidoutratyfenotypuchrząstkowego,coprzejawia
sięwzrostemekspresjikolagenutypuX,charakterystycz-
negodlaprzerośniętychchondrocytóworazzmniejszeniem
ekspresjicharakterystycznegodlachrząstkikolagenutypu
II.Rozwiązaniemjesthodowlatypuprzestrzennego(3D
–three-dimensional)[25].Takimodelhodowlinaśladuje
stanfizjologicznyworganizmie.Bystworzyćtakiewarunki
stosujesięwielemateriałów,stanowiącychrusztowanie–
sztucznąmacierzmiędzykomórkowądlarozwijającychsię
komórek,m.in.agarozę,alginian,żelatynę,fluoropolime-
ry,PLGA(poly(D,L-lactic-co-glycolicacid))[1,2,4,7,27].
Pożywkahodowliprzyszłychchondrocytówwzbogacona
jesttakżeoinsulinę,TGF-
b,deksametazon,czyaskorbi-
nian[41,51].Istotnadlaprawidłowegorozwojukomórek
wchondrocytyokazujesiętakżeobecnośćtlenuwhodow-
li.Wykazano,żeśrodowiskooobniżonejzawartościtlenu
odgrywaważnąrolęwregulacjiproliferacjiimetabolizmu
ASCpodczasprocesuróżnicowania.Kontrolujączawartość
tlenuwśrodowiskumożemywpływaćnaakumulacjęma-
kromolekułmacierzymiędzykomórkowej.Zarównomała
(5%),jakiduża(20%)zawartośćtlenuwhodowlimoże
zwiększaćwytwarzaniekolagenutypuII,jednak20%stę-
żenietlenupowodujetakżeistotnezwiększeniekoncen-
tracjikolagenutypuX[44].Zkoleizinnychbadańwyni-
ka,żezawartośćtlenuwśrodowiskuwpływahamującona
proceschondrogenezy,przyczym2%tlenuobniżaprze-
biegprocesudużowięcejniż21%[28].
Stwierdzenie,którekomórkiASCczyMSCsąbardziej
wydajnedootrzymywaniachrząstkiwwarunkachin vitro
ciąglepozostajesporne.DeUgarte[12]wrazzzespołem
analizowaliobiepopulacjekomórekotrzymaneodtegosa-
megopacjentaiwykazali,żekomórkitkankitłuszczowej
wykazująpodobnydokomórekMSCpotencjałwchondro-
genezie.ZkoleiwynikipracyzespołuWintera[47]niewy-
kazująistotnychróżnicwzdolnościkomórekASCiMSC
doróżnicowaniawkierunkuchrząstki.Natomiastzprac
zespołówHuanga[21]iWickhama[46]wynikamniejsza
zdolnośćkomórekASCdochondrogenezyniżkomórek
otrzymanychzeszpikukostnego.
Należyjednakpamiętać,żezdolnośćkomórekASCdoróż-
nicowaniawokreśloneliniekomórkowezmieniasięwza-
leżnościodumiejscowieniaanatomicznegotkanki,zktóre-
gozostałypobrane.Komórkiztrzewnejtkankitłuszczowej,
włóknistejbłonymaziowejitłuszczowejtkankimaziowej
dużołatwiejulegająindukcjiwróżneliniekomórkoweniż
komórkizpodskórnejtkankitłuszczowej[30].
Osteogeneza
Komórkimacierzystetkankitłuszczowejróżnicującej
wosteoblastymogłybybyćwykorzystywaneklinicznie
wprzypadkunieprawidłowegozrośnięciasiękościpo
złamaniu,brakuzrostu,czywspomagaćprzeszczeptkan-
kikostnej.Jesttomożliwewobecnościpewnychczynni-
ków.Jednymznich,wspomagającymosteogenezęwwa-
runkachin vitroiwykorzystywanymwwielubadaniach,
jestdeksametazon,chociażjegodokładnymechanizm
działanianiejestjeszczepoznany[17].Zukiwsp.zamiast
niegowykorzystali1,25-dihydroksywitaminęD3[51].
Niezbędnyjestrównieżkwasaskorbinowy,któregofunk-
cjapoleganahydroksylacjikolagenowejprolinyilizyny
orazwzrościesyntezybiałekmacierzykościniezwiąza-
nejzkolagenem,atakże
b-glicerofosforan,któregozna-
czeniejestzasadniczewprocesiewapnieniaimineraliza-
cjisubstancjizewnątrzkomórkowej.Dlategomediumdo
procesuosteogenezyjestuzupełnianepochodnymiaskor-
binianówi
b-glicerofosforanem,deksametazonemlubwi-
taminąD[17,50,51].KomórkiASCmineralizująmacierz
międzykomórkowąiwykazująwzrostekspresjiosteokal-
cynyifosfatazyzasadowej[22].Wtakichwarunkachob-
serwujesięekspresjęgenówibiałekwłaściwychdlafe-
notypuosteoblastów–fosfatazęzasadową,kolagentypu
I,osteospontynę,osteonektynę,osteokalcynę,BMP(bone
morphogeneticproteins)iinne.Takjakwprzypadkuchon-
drogenezy,stosujesięhodowletypu3D,mającezazada-
niestworzyćwarunkiprzestrzennedlaprawidłowejoste-
ogenezy[30,50].
Lipogeneza
LiniaASChodowanawpożywceadipogennej,powodu-
jeekspresjęwielumarkerówwłaściwychdlaadipocytów
iswoistychdlanichwakuoltłuszczowych.Najbardziej
istotnymśrodkiempobudzającymadipogenezę,wydaje
sięinsulinaiglikokortykosteroidy.Pierwszymzetapów
tegoprocesuin vitrojestpobudzenieprzezIGF-1(insuli-
nozależnyczynnikwzrostu1).Wzrostglikokortykoidów,
insulinyikwasówtłuszczowych,zarównowewczesnej,
jakipóźnejfazieróżnicowaniajestistotnydlategopro-
cesu[23].Otrzymanetąmetodąkomórkikliniczniewy-
korzystujesiędowypełnianiaubytkówtkanekmiękkich
pozabiegachchirurgicznych,naprzykładmastektomii[3].
Miogeneza
HodowlaASCwpożywcezawierającej5%surowicękońską
iglikokortykoidydeksametazoni/lubhydrokortyzonskut-
kujeekspresjągenówwłaściwądlamiogenezy–ASMA,
kalponiny,kaldesmonu,SM22,MHC,łańcuchaciężkiej
miozynymięśnigładkichorazfuzjąkomórekiformowa-
niemwielojądrowychmiotubuli.Wykazująonezdolność
dokurczeniasięirozkurczaniapodwpływemkarbacho-
luiatropiny[38].
Zdolność różnicowania komórek ASC w formy
niemezodermalne
Początkowosądzono,żeróżnicowaniekomórekmacierzy-
stychtkankitłuszczowej,mającejpochodzeniemezoder-
malnewkomórkitkanekoinnympochodzeniu,wydajesię
małoprawdopodobne.Jednakindukcjakomórekmacie-
rzystychuzyskanychztkankitłuszczowej,przezdodanie
dopożywkikwasuwalpronowego,butylohydroksyanizo-
lu,insulinyihydrokortyzonu,powodujezmianywmorfo-
logiikomórekwneurony.Poprawie30minutach,około
Postepy Hig Med Dosw (online), 2010; tom 64: 326-332
330
- - - - -

10%komórekprzypominafenotypowokomórkinerwowe.
Ciałakomórekstająsiębardziejkuliste,azupływemcza-
suichwypustkiwytwarzajądrugorzędowerozgałęzienia.
Po3godzinach70%komórekprzybieraopisanyfenotyp,
natomiastdalszaindukcjanieprzynosijużżadnychzna-
czącychzmian[50].Opisanymzmianomtowarzyszyrów-
nieżekspresjamarkerówcharakterystycznychdlatkanki
nerwowej,takichjaknestyna,NSE(neuronspecificenola-
se),białkoswoistedlaneuronów(NeuN),Map2,filamenty
pośrednie,tubulina
b-III,podjednostkaNR1iNR2recep-
toraglutaminianowego,markeroligodendrocytówS-100
iinne.IchobecnośćpotwierdzasięwykorzystującRT-
PCR,metodyimmunohistochemiczneczywesternblot-
ting[39,40].Ponadtokomórkimacierzystetkankitłusz-
czowejwykazujązdolnośćróżnicowaniawkardiomiocyty
ikomórkiśródbłonkanaczyń[17,23].
W
nioski
Wprzyszłościwykorzystaniekomórekmacierzystychpo-
chodzeniamezodermalnegojestwielceprawdopodobne,
jednakdalszyrozwójtejtechnologiiwymagaznalezienia
łatwodostępnegoichźródła.Wprzeciwieństwiedome-
todpobieraniaszpikukostnego,pobraniekomórekmacie-
rzystychztkankitłuszczowejjestdużoprostsze.Pozatym
wtejtkancewystępujeznaczniewięcejmezenchymalnych
komórekmacierzystychniżwszpiku.Autologicznepocho-
dzenietychkomórek,wrazzichmożliwościąróżnicowa-
niawlinieopochodzeniuzarównomezodermalnym,jak
izinnychlistkówzarodkowych,czyniąjedoskonałymma-
teriałemdorozwojuterapiikomórkowej.
p
iśmiennictWo
[1]AwadH.A.,WickhamM.Q.,LeddyH.A.,GimbleJ.M.,GuilakF.:
Chondrogenicdifferentiationofadipose-derivedadultstemcells
inagarose,alginate,andgelatinscaffolds.Biomaterials,2004;25:
3211–3222
[2]BetreH.,OngS.R.,GuilakF.,ChilkotiA.,FermorB.,SettonL.A.:
Chondrocyticdifferentiationofhumanadipose-derivedadultstem
cellsinelastin-likepolypeptide.Biomaterials,2006;27:91–99
[3]BreyE.M.,PatrickC.W.Jr.:Tissueengineeringappliedtoreconstruc-
tivesurgery.IEEEEng.Med.Biol.Mag.,2000;19:122–125
[4]BurksC.A.,BundyK.,FotuhiP.,AltE.:Characterizationof75:25
poly(l-lactide-co-
e-caprolactone)thinfilmsfortheendoluminalde-
liveryofadipose-derivedstemcellstoabdominalaorticaneurysms.
TissueEng.,2006;12:2591–2600
[5]Caplan,A.I.:Mesenchymalstemcells.J.Orthop.Res.,1991;9:641–650
[6]ChenJ.H.,EnloeB.M.,WeybrightP.,CampbellN.,DorfmanD.,
FletcherC.D.,CoryD.G,SingerS.:Biochemicalcorrelatesofthia-
zolidinedione-inducedadipocytedifferentiationbyhigh-resolution
magicanglespinningNMRspectroscopy.Magn.Reson.Med.,2002;
48:602–610
[7]Clavijo-AlvarezJ.A.,RubinJ.P.,BennettJ.,NguyenV.T.,DudasJ.,
UnderwoodC.,MarraK.G.:Anovelperfluoroelastomerseededwith
adipose-derivedstemcellsforsoft-tissuerepair.Plast.Reconstr.Surg.,
2006;118:1132–1142
[8]CogleC.R.,GuthrieS.M.,SandersR.C.,AllenW.L.,ScottE.W.,
PetersenB.E.:Anoverviewofstemcellresearchandregulatoryissu-
es.MayoClin.Proc.,2003;78:993–1003
[9]CorneliusP.,MacDougaldO.A.,LaneM.D.:Regulationofadipocy-
tedevelopment.Annu.Rev.Nutr.,1994;14:99–129
[10]CousinB.,CasteillaL.,DaniC.,MuzzinP.,RevelliJ.P.,PenicaudL.:
Adiposetissuesfromvariousanatomicalsitesarecharacterizedbydif-
ferentpatternsofgeneexpressionandregulation.Biochem.J.,1993;
292:873–876
[11]CuiL.,LiuB.,LiuG.,ZhangW.,CenL.,SunJ.,YinS.,LiuW.,Cao
Y.:Repairofcranialbonedefectswithadiposederivedstemcellsand
coralscaffoldinacaninemodel.Biomaterials2007;28:5477–5486
[12]DeUgarteD.A.,MorizonoK.,ElbarbaryA.,AlfonsoZ.,ZukP.A.,
ZhuM.,DragooJ.L.,AshjianP.,ThomasB.,BenhaimP.,ChenI.,
FraserJ.,HedrickM.H.:Comparisonofmulti-lineagecellsfromhu-
manadiposetissueandbonemarrow.CellsTissuesOrgans,2003;174:
101–109
[13]FestyF.,HoareauL.,Bes-HoutmannS.,PéquinA.M.,GonthierM.P.,
MunstunA.,HoarauJ.J.,CésariM.,RocheR.:Surfaceproteinexpres-
sionbetweenhumanadiposetissue-derivedstromalcellsandmature
adipocytes.Histochem.CellBiol.,2005;124:113–121
[14]FraserJ.K.,ZhuM.,WulurI.,AlfonsoZ.:Adipose-derivedstemcells.
MethodsMol.Biol.,2008;449:59–67
[15]FriedensteinA.J.,ChailakhyanR.K.,LatsinikN.V.,PanasyukA.F.,
Keiliss-BorokI.V.:Stromalcellsresponsiblefortransferringthemi-
croenvironmentofthehematopoietictissues.Cloningin vitroandre-
transplantationin vivo.Transplantation,1974;17:331–340
[16]FriedensteinA.J.,PetrakovaK.V.,KurolesovaA.I.,FrolovaG.P.:
Heterotopicofbonemarrow.Analysisofprecursorcellsforosteoge-
nicandhematopoietictissues.Transplantation,1968;6:230–247
[17]GimbleJ.M.,KatzA.J.,BunnellB.A.:Adipose-derivedstemcellsfor
regenerativemedicine.Circ.Res.,2007;100:1249–1260
[18]GronthosS.,FranklinD.M.,LeddyH.A.,RobeyP.G.,StormsR.W.,
GimbleJ.M.:Surfaceproteincharacterizationofhumanadiposetis-
sue-derivedstromalcells.J.Cell.Physiol.,2001;189:54–63
[19]HicokK.C.,DuLaneyT.V.,ZhouY.S.,HalvorsenY.D.,HittD.C.,
CooperL.F.,GimbleJ.M.:Humanadipose-derivedadultstemcells
produceosteoidin vivo.TissueEng.,2004;10:371–380
[20]HousmanT.S.,LawrenceN.,MellenB.G.,GeorgeM.N.,FilippoJ.S.,
CervenyK.A.,DeMarcoM.,FeldmanS.R.,FleischerA.B.:Thesafe-
tyofliposuction:resultsofanationalsurvey.Dermatol.Surg.,2002;
28:971–978
[21]HuangJ.I.,KazmiN.,DurbhakulaM.M.,HeringT.M.,YooJ.U.,
JohnstoneB.:Chondrogenicpotentialofprogenitorcellsderivedfrom
humanbonemarrowandadiposetissue:apatient-matchedcompari-
son.J.Orthop.Res.,2005;23:1383–1389
[22]ImG.I.,ShinY.W.,LeeK.B.:Doadiposetissue-derivedmesenchy-
malstemcellshavethesameosteogenicandchondrogenicpotential
asbonemarrow-derivedcells?Osteoarthr.Cartil.,2005;13:845–853
[23]JumabayM.,MatsumotoT.,YokoyamaS.,KanoK.,KusumiY.,Masuko
T.,MitsumataM.,SaitoS.,HirayamaA.,MugishimaH.,FukudaN.:
Dedifferentiatedfatcellsconverttocardiomyocytephenotypeandre-
pairinfractedcardiactissueinrats.J.Mol.Cell.Cardiol.,2009;47:
565–575
[24]LeeJ.A.,ParrettB.M.,ConejeroJ.A.,LaserJ.,ChenJ.,KogonA.J.,
NandaD.,GrantR.T.,BreitbartA.S.:Biologicalalchemy:engineering
boneandfatfromfat-derivedstemcells.Ann.Plast.Surg.,2003;50:
610–617
[25]LeongD.T.,KhorW.M.,ChewF.T.,LimT.C.,HutmacherD.W.:
Characterizationofosteogenicallyinducedadiposetissue-derivedpre-
cursorcellsin2-dimensionaland3-dimensionalenvironments.Cells
TissuesOrgans,2006;182:1–11
[26]LinQ.,LeeY.J.,YunZ.:Differentiationarrestbyhypoxia.J.Biol.
Chem.,2006;281:30678–30683
[27]MalafayaP.P.,PedroA.J.,PeterbauerA.,GabrielC.,RedlH.,Reis
R.L.:Chitosanparticlesagglomeratedscaffoldsforcartilageandoste-
ochondraltissueengineeringapproacheswithadiposetissuederived
stemcells.J.Mater.Sci.Mater.Med.,2005;16:1077–1085
[28]MalladiP.,XuY.,ChiouM.,GiacciaA.J.,LongakerM.T.:Effectof
reducedoxygentensiononchondrogenesisandosteogenesisinadi-
pose-derivedmesenchymalcells.Am.J.Physiol.CellPhysiol.,2006;
290:C1139–C1146
[29]MitchellJ.B.,McIntoshK.,ZvonicS.,GarretS.,FloydZ.E.,Kloster
A.,DiHalvorsenY.,StormsR.W.,GohB.,KilroyG.,WuX.,Gimble
J.M.:Immunophenotypeofhumanadipose-derivedcells:temporal
changesinstromal-associatedandstemcell-associatedmarkers.Stem
Cells,2006;24:376–385
Jezierska-Woźniak K. i wsp. – Wykorzystanie tkanki tłuszczowej jako źródła…
331
- - - - -

[30]MochizukiT.,MunetaT.,SakaguchiY.,NimuraA.,YokoyamaA.,
KogaH.,SekiyaI.:Higherchondrogenicpotentialoffibroussyno-
vium-andadiposesynovium-derivedcellscomparedwithsubcutane-
ousfat-derivedcells:distinguishingpropertiesofmesenchymalstem
cellsinhumans.ArthritisRheum.,2006;54:843–853
[31]OdoricoJ.S.,KaufmanD.S.,ThomsonJ.A.:Multilineagedifferen-
tiationfromhumanembryonicstemcelllines.StemCells,2001;19:
193–204
[32]Oedayrajsingh-VarmaM.J.,vanHamS.M.,KnippenbergM.,Helder
M.N.,Klein-NulendJ.,SchoutenT.E.,RittM.J.,vanMilligenF.J.:
Adiposetissue-derivedmesenchymalstemcellyieldandgrowthcha-
racteristicsareaffectedbythetissue-harvestingprocedure.Cytotherapy,
2006;8:166–177
[33]PaulS.R.,YangY.C.,DonahueR.E.,GoldringS.,WilliamsD.A.:
Stromalcell-associatedhematopoiesis:immortalizationandcharac-
terizationofaprimatebonemarrow-derivedstromalcellline.Blood,
1991;77:1723–1733
[34]PeraM.F.,ReubinoffB.,TrounsonA.:Humanembryonicstemcells.
J.CellSci.,2000;113:5–10
[35]RehmanJ.,TraktuevD.,LiJ.,Merfeld-ClaussS.,Temm-GroveC.J.,
BovenkerkJ.E.,PellC.L.,JohnstoneB.H.,ConsidineR.V.,March
K.L.:Secretionofangiogenicandantiapoptoticfactorsbyhumanadi-
posestromalcells.Circulation,2004;109:1292–1298
[36]RodbellM.:Metabolismofisolatedfatcells.1.Effectsofhormoneson
glucosemetabolismandlipolysis.J.Biol.Chem.,1964;239:375–380
[37]RodbellM.,JonesA.B.:Metabolismofisolatedfatcells.3.Thesi-
milarinhibitoryactionofphospholipaseC(Clostridiumperfringens
atoxin)andofinsulinonlipolysisstimulatedbylipolytichormones
andtheophylline.J.Biol.Chem.,1966;241:140–142
[38]RodriguezL.V.,AlfonsoZ.,ZhangR.,LeungJ.,WuB.,IgnarroL.J.:
Clonogenicmultipotentstemcellsinhumanadiposetissuedifferen-
tiateintofunctionalsmoothmusclecells.Proc.Natl.Acad.Sci.USA,
2006;103:12167–12172
[39]SaffordK.M.,HicokK.C.,SaffordS.D.,HalvorsenY.D.,Wilkison
W.O.,GimbleJ.M.,RiceH.E.:Neurogenicdifferentiationofmuri-
neandhumanadipose-derivedstromalcells.Biochem.Biophys.Res.
Commun.,2002;294:371–379
[40]SaffordK.M.,SaffordS.D.,GimbleJ.M.,ShettyA.K.,RiceH.E.:
Characterizationofneuronal/glialdifferentiationofmurineadipose-
derivedadultstromalcells.Exp.Neurol.,2004;187:319–328
[41]TappH.,HanleyE.N.Jr.,PattJ.C.,GruberH.E.:Adipose-derivedstem
cells:characterizationandcurrentapplicationinorthopaedictissuere-
pair.Exp.Biol.Med.,2009;234:1–9
[42]TrayhurnP.,WoodI.S.:Adipokines:inflammationandthepleiotro-
picroleofwhiteadiposetissue.Br.J.Nutr.,2004;92:347–355
[43]vanHarmelenV.,SkurkT.,HaunerH.:Primarycultureanddifferen-
tiationofhumanadipocyteprecursorcells.MethodsMol.Med.,2005;
107:125–135
[44]WangD.W.,FermorB.,GimbleJ.M.,AwadH.A.,GuilakF.:Influence
ofoxygenontheproliferationandmetabolismofadiposederivedadult
stemcells.J.Cell.Physiol.,2005;204:184–191
[45]WertsE.D.,DeGowinR.L.,KnappS.K.,GibsonD.P.:Characterization
ofmarrowstromal(fibroblastoid)cellsandtheirassociationwithery-
thropoiesis.Exp.Hematol.,1980;8,423–433
[46]WickhamM.Q.,EricksonG.R.,GimbleJ.M.,VailT.P.,GuilakF.:
Multipotentstromalcellsderivedfromtheinfrapatellarfatpadofthe
knee.Clin.Orthop.Relat.Res.,2003;412:196–212
[47]WinterA.,BreitS.,ParschD.,BenzK.,SteckE.,HaunerH.,Weber
R.M.,EwerbeckV.,RichterW.:Cartilage-likegeneexpressionindif-
ferentiatedhumanstemcellspheroids:acomparisonofbonemarrow-
derivedandadiposetissue-derivedstromalcells.ArthritisRheum.,
2003;48:418–429
[48]YanezR.,LamanaM.L.,Garcia-CastroJ.,ColmeneroI.,RamírezM.,
BuerenJ.A.:Adiposetissue-derivedmesenchymalstemcellshavein
vivoimmunosuppressivepropertiesapplicableforthecontrolofthe
graft-versus-hostdisease.StemCells,2006;24:2582–2591
[49]YoonE.,DharS.,ChunD.E.,GharibjanianN.A.,EvansG.R.:In vivo
osteogenicpotentialofhumanadipose-derivedstemcells/polylacti-
de-co-glycolicacidconstructforboneregenerationinaratcritical-si-
zedcalvarialdefectmodel.TissueEng.,2007;13:619–627
[50]ZukP.A.,ZhuM.,AshjianP.,DeUgarteD.A.,HuangJ.I.,MizunoH.,
AlfonsoZ.C.,FraserJ.K.,BenhaimP.,HedrickM.H.:Humanadipo-
setissueisasourceofmultipotentstemcells.Mol.Biol.Cell,2002;
13:4279–4295
[51]ZukP.A.,ZhuM.,MizunoH.,HuangJ.,FutrellJ.W.,KatzA.J.,
BenhaimP.,LorenzH.P.,HedrickM.H.:Multilineagecellsfromhu-
manadiposetissue:implicationsforcell-basedtherapies.TissueEng.,
2001;7:211–228
Autorzydeklarująbrakpotencjalnychkonfliktówinteresów.
Postepy Hig Med Dosw (online), 2010; tom 64: 326-332
332
- - - - -
Wyszukiwarka
Podobne podstrony:
03 Wykorzystanie produktów spożywczych jako źródła
03 Wykorzystanie produktów spożywczych jako źródła
03 Wykorzystanie produktów spożywczych jako źródła
03 Wykorzystanie produktów spożywczych jako źródła 2
wykorzystanie produktów spożywczych jako źródła składników pokarmowych ściąga białka
wykorzystanie produktów spożywczych jako źródła składników pokarmowych pytania na sprawdzian z białe
Wykorzystanie produktów spoŜywczych jako źródła składników pokarmowych
01 Wykorzystanie żywności jako źródła składników
01 Wykorzystanie żywności jako źródła składników
EISLER, Jerzy Refleksje nad wykorzystywaniem relacji jako źródła w badaniu historii PRL (Rozmowy z
konstytucja i ustawy jako źródła prawa polskiego, Pomoce naukowe, studia, prawo
pyt, ZM 10. Omowic zrodla informacji wykorzystywane w badaniach marketingowych, Omówić źródła inform
Prelekcja 5 Hydrosfera i litosfera jako źródła czynników patogennych dla człowieka
Instrukcja wykorzystania telefonu Nokia jako modem
Prelekcja 5 Hydrosfera i litosfera jako źródła czynników patogennych dla człowieka
Biblia i mitologia jako źródła kultury europejskiej
UMOWA MIĘDZYNARODOWA JAKO ŹRÓDŁA PRAWA ADMINISTRACYJNEGO, Nauka, Administracja
Biblia i mitologia jako źródła kultury europejskiej (2)
TRENING NA REDUKCJĘ TKANKI TŁUSZCZOWEJ
więcej podobnych podstron