1
WIĄZANIE KOORDYNACYJNE
Wiązanie kowalencyjne może powstać również
w wyniku nałożenia się orbitali zawierających
parę elektronową jednego atomu z
PUSTYM
ORBITALEM
atomu drugiego.
Wówczas
wszystkie
elektrony
wiązania
pochodzą od jednego atomu (tzw.
donor
); drugi
atom (tzw.
akceptor
) uzupełnia własną powłokę
walencyjną elektronami donora.
Tego rodzaju wiązanie nazywa się
KOORDYNACYJNYM, DONOROWO-
AKCEPTOROWYM LUB SEMIPOLARNYM
A
+
D
**
A
**
D
lub
A
D
Kierunek strzałki jest skierowany do atomu, który akceptuje parę elektronową
AKCEPTOR DONOR
ZWIĄZEK
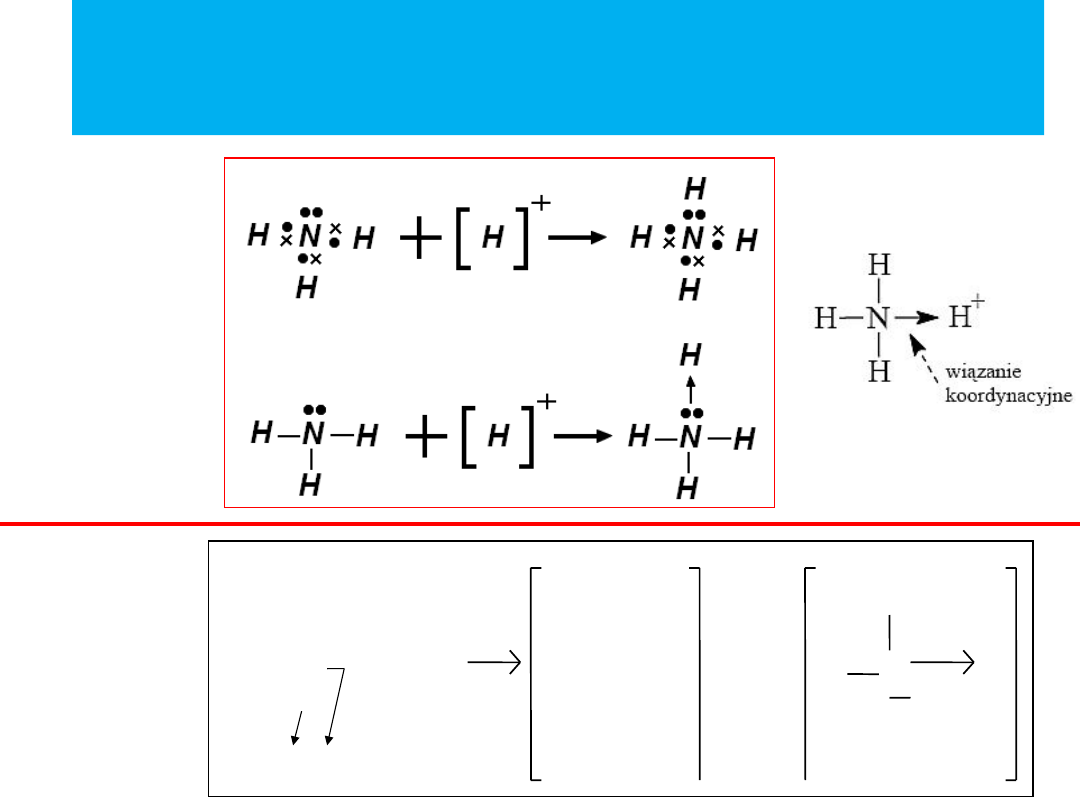
O
o
*
*
o
o
H
o
H
wolne pary
elektronowe
+
H
+
proton
wodoru
O
o
*
*
o
o
H
o
o
H
H
+
O
H
H
H
+
lub
DONOR
AKCEPTOR
o o
H
2
O
o
3
+
H O
[
]
H O
3
+
jon hydroniowy
+
jon amonowy:
NH
4
+
Wiązanie koordynacyjne -
przykłady
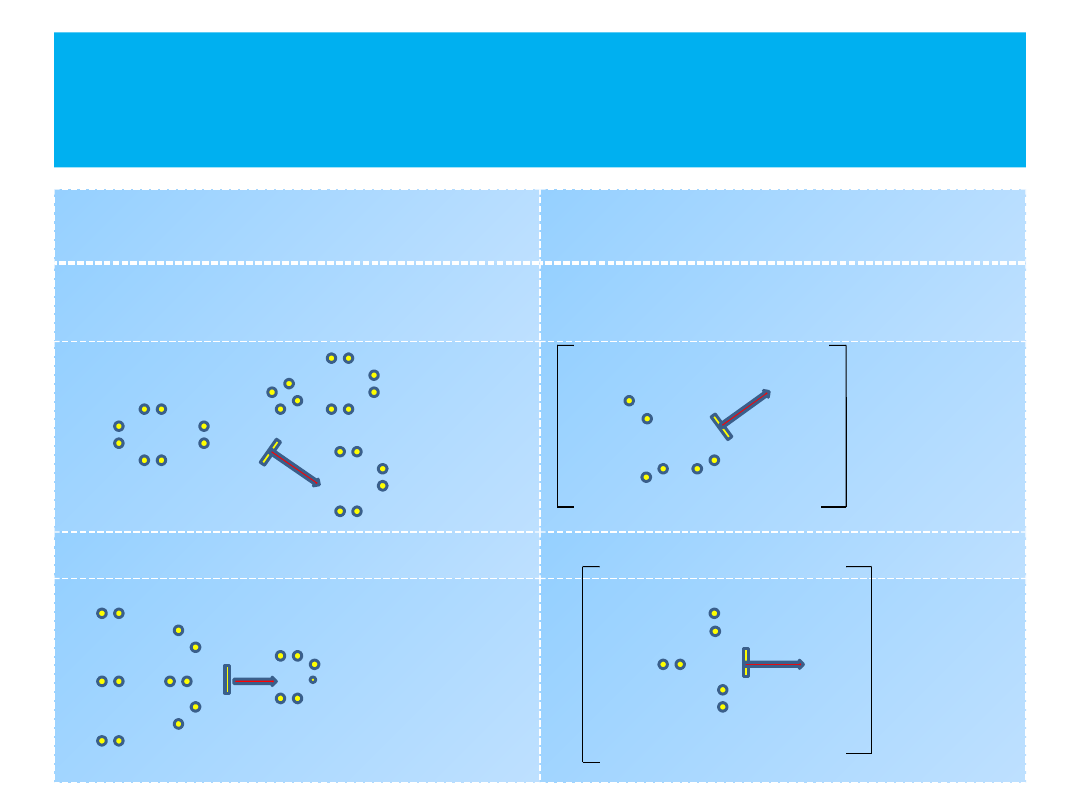
Wiązanie koordynacyjne -
przykłady
DONOR
(dawca) pary
elektronowej –
kolor czerwony
AKCEPTOR
(biorca) pary
elektronowej –
kolor zielony
HNO
3
- Kwas azotowy(V)
H
3
O
+
- kation hydroniowy
(oksoniowy)
O
H
O
N
O
H
H
+
O
H
H
3
PO
4
– kwas ortofosfowy(V)
NH
4
+
- kation amonowy
H O
H O
P
O
H O
H
H
N
H
+
H
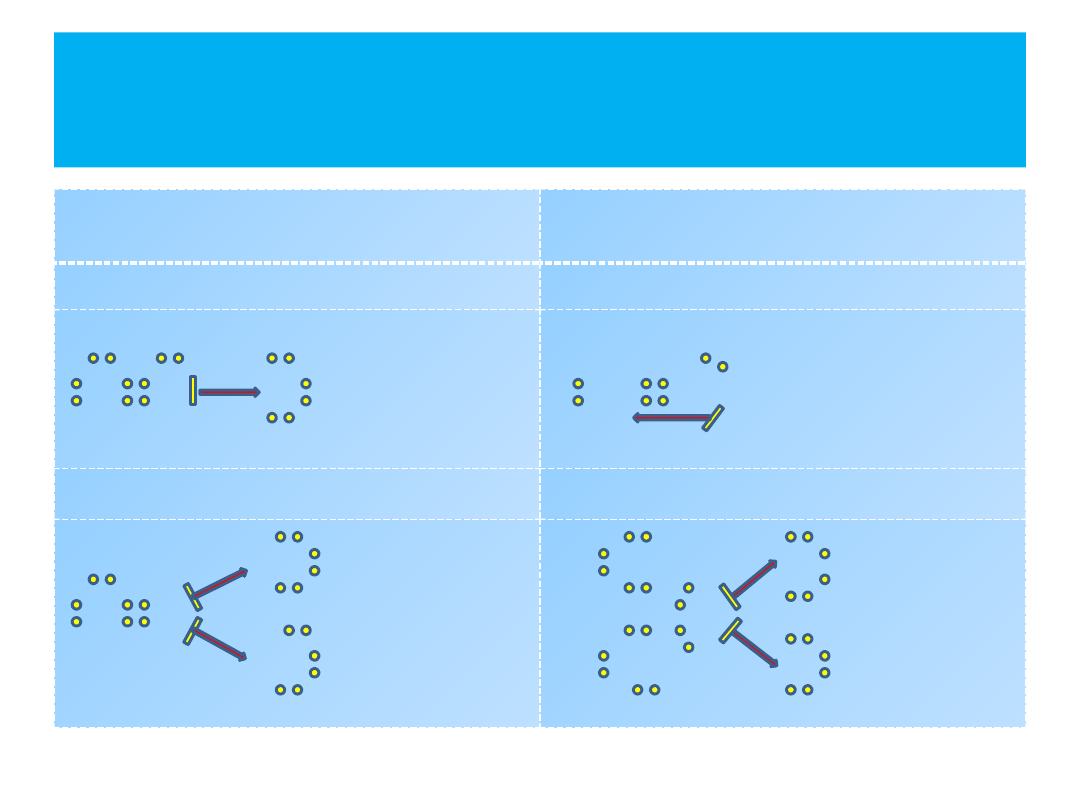
Wiązanie koordynacyjne -
przykłady
DONOR
(dawca) pary
elektronowej –
kolor czerwony
AKCEPTOR
(biorca) pary
elektronowej –
kolor zielony
SO
2
– tlenek siarki(IV)
CO – tlenek węgla(II)
O
S
O
C
O
SO
3
– tlenek siarki(VI)
Kwas siarkowy(VI)
O
O
S
O
H
O
O
S
H
O
O
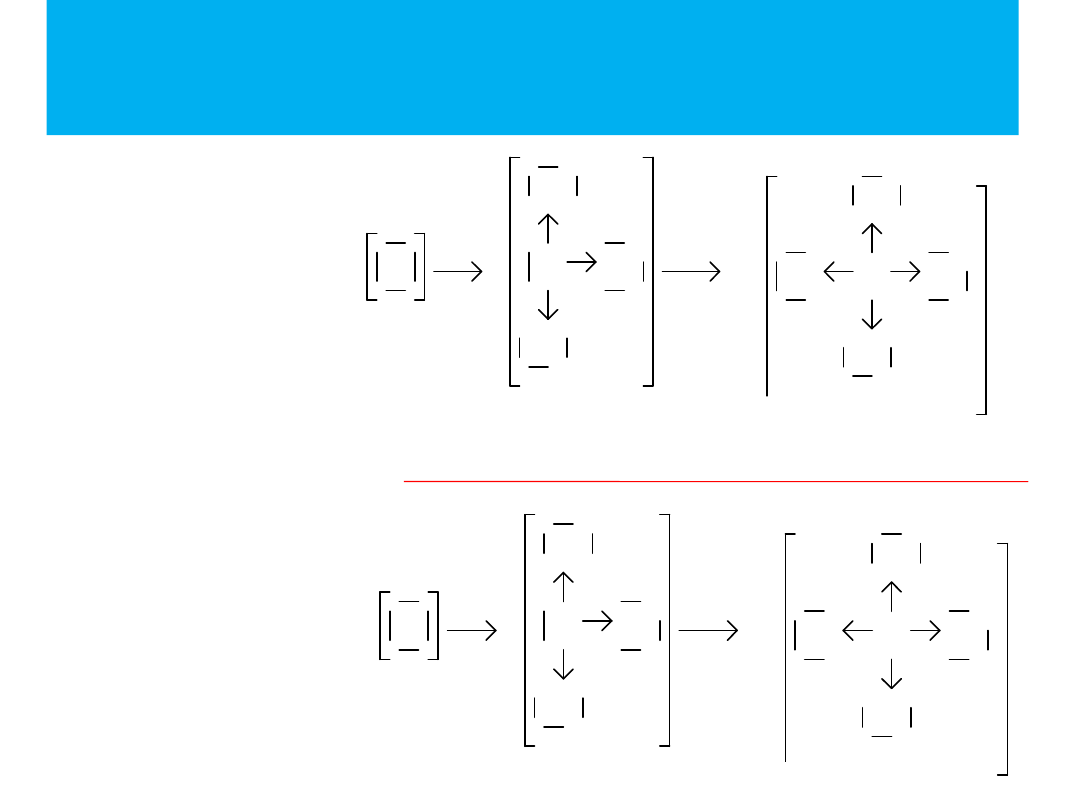
Związek
między
jonami prostymi a
jonami
kwasów
tlenowych
można
wytłumaczyć
istnieniem
wiązań
koordynacyjnych
między
siarką
i
tlenem
oraz
fosforem i tlenem:
O
P O
P
3-
O
O
P O
O
3-
O
3-
[PO
3
]
3-
[PO
4
]
3-
[PO
3
]
3-
[PO
4
]
3-
O
S O
S
2-
O
O
S O
O
2-
O
2-
[SO
3
]
2-
[SO
4
]
2-
[SO
4
]
2-
[SO
3
]
2-
Wiązanie koordynacyjne -
przykłady
6
DONOREM
w wiązaniach koordynacyjnych jest
zwykle niemetal w formie cząsteczki lub jonu -
LIGANDY
Np.
-
-
-
2
3
CN
,
OH
,
Cl
O,
H
,
NH
AKCEPTORAMI
mogą być cząsteczki obojętne
(BF
3
) lub jony.
Np.:
itp.
Zn
,
Al
,
Cu
,
Ag
H
2
3
2
+
,
Wiązanie koordynacyjne występuje w tzw.
ZWIĄZKACH KOMPLEKSOWYCH.
Wówczas
jon
metalu
będący
akceptorem
elektronów
przyjmuje
zwykle
kilka
par
elektronów.
Liczba par elektronowych przyjętych przez
akceptor nazywa się LICZBĄ KOORDYNACYJNĄ
akceptora.
Wynosi ona zwykle: 2, 4, 6, 8.
Olbrzymia większość związków kompleksowych
zawiera w centrum atom lub jon metalu
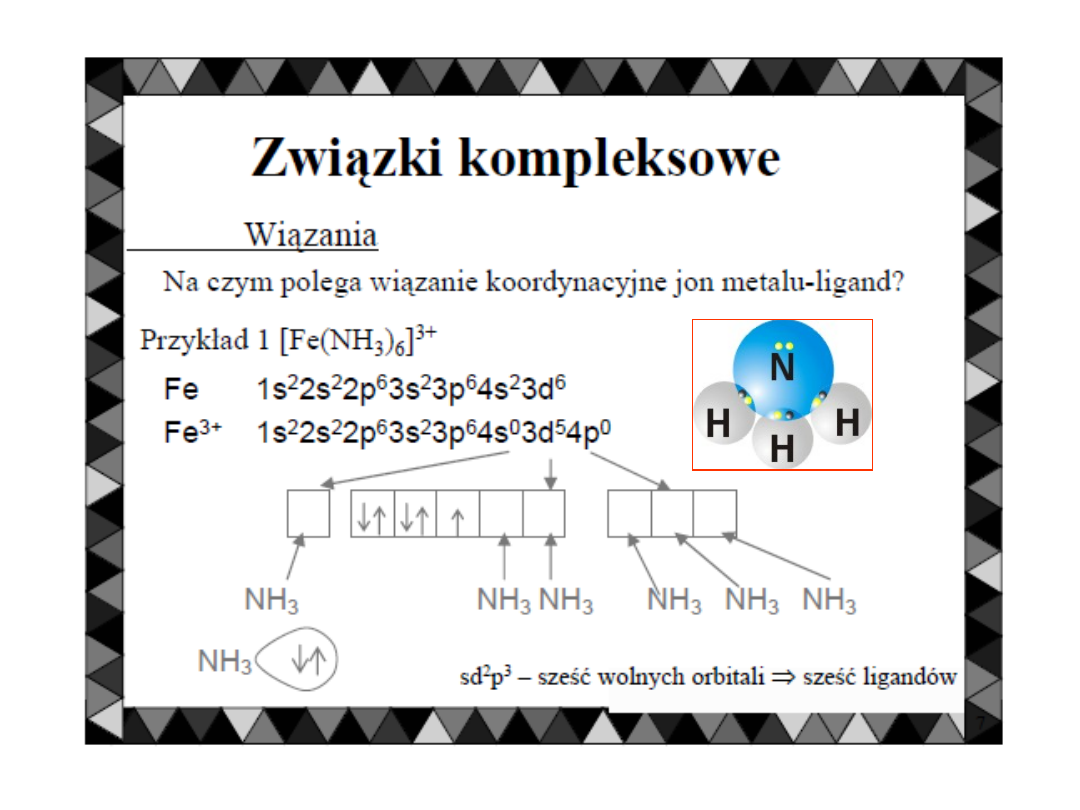
7
8
[Cu(NH
3
)
4
]
2+
Cu
NH
3
NH
3
NH
3
H
3
N
2+
[Co(NH
3
)
6
]
3+
Co
NH
3
NH
3
NH
3
NH
3
H
3
N
H
3
N
3+
[Cu(NH
3
)
4
]
2+
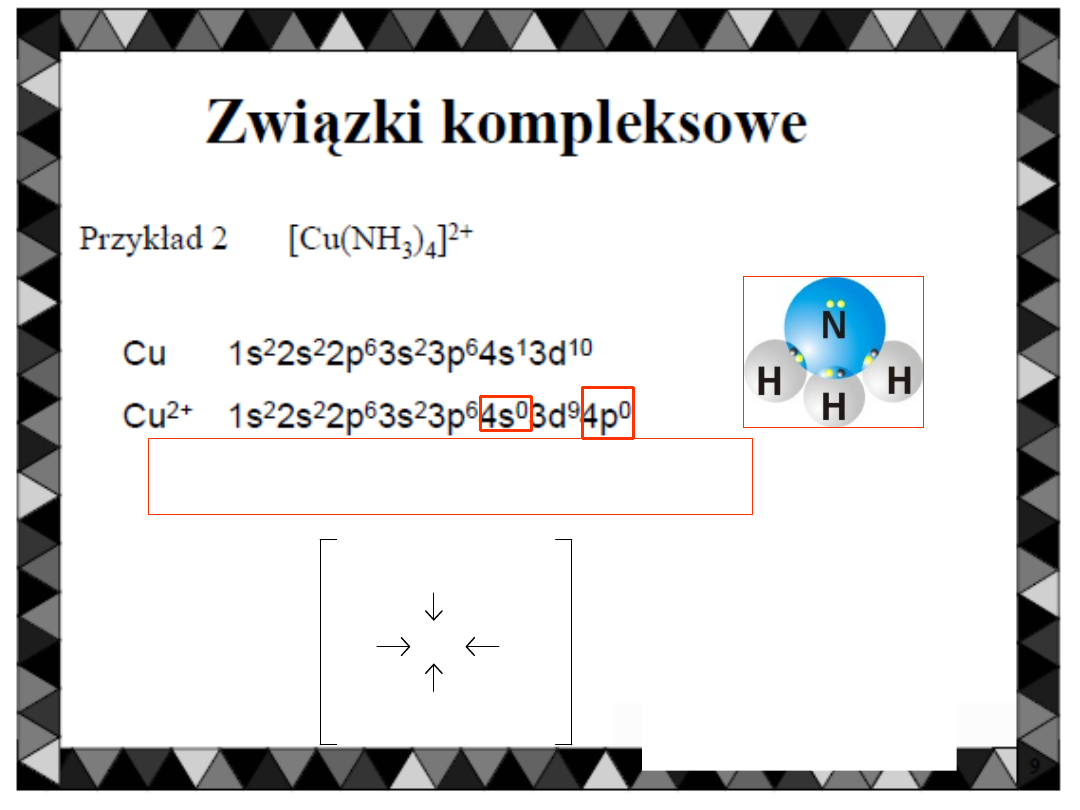
sp
3
= cztery wolne orbitale Cztery
ligandy
1x
3x
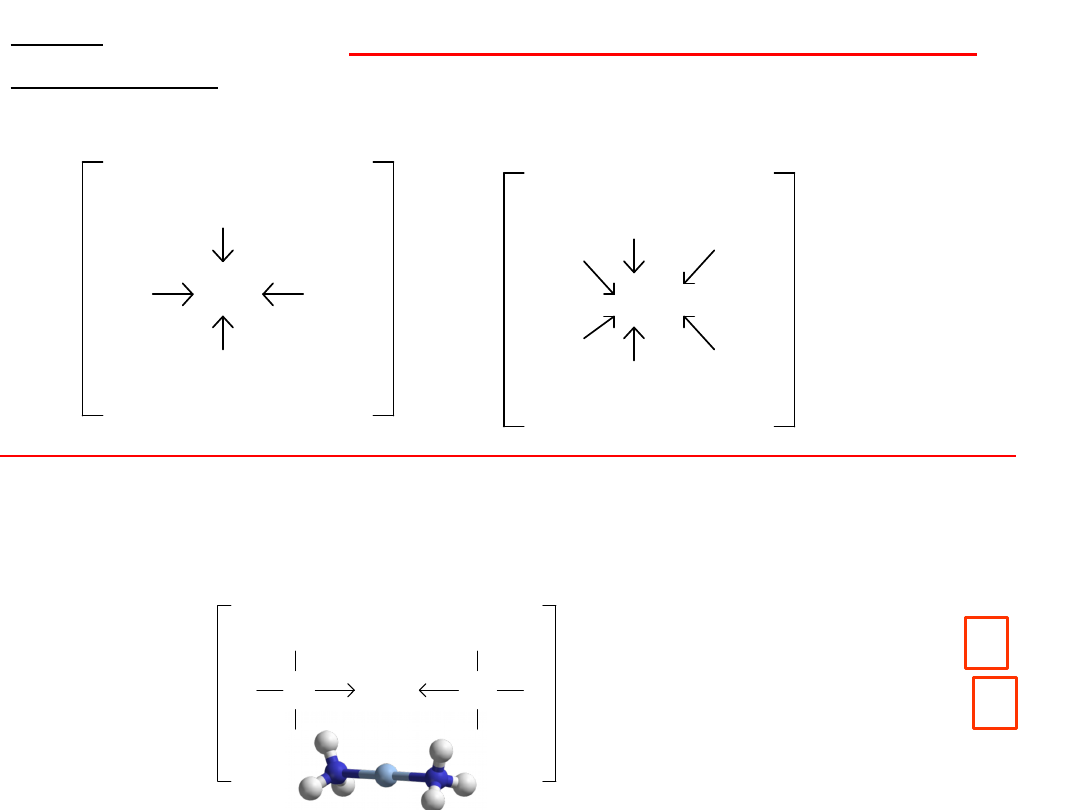
9
ZWIĄZKI KOMPLEKSOWE
[Cu(NH
3
)
4
]
2+
Cu
NH
3
NH
3
NH
3
H
3
N
2+
[Co(NH
3
)
6
]
3+
Co
NH
3
NH
3
NH
3
NH
3
H
3
N
H
3
N
3+
Inne
przykłady:
9
Struktur
a kationu
diamo-
srebrowe
go
AgN
N
H
H
H
H
H
H
+
Np.
AgCl + 2 NH
3
® [Ag(NH
3
)
2
]Cl
[Ag(NH
3
)
2
]Cl
Û
[Ag(NH
3
)
2
]
+
+ Cl-
jon kompleksowy
Chlorek diamosrebrowy –
Związek kompleksowy
47
Ag - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
1
4d
10
47
Ag
+
- 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
0
4d
10
2. Tworzenie wiązania kowalencyjnego polega na
uwspólnieniu wszystkich lub części elektronów
walencyjnych przez dwa atomy, przy czym wspólne
elektrony mogą pochodzić od obu atomów
(
wiązanie kowalencyjne
) lub od jednego atomu
(
wiązanie koordynacyjne
).
PODSUMOWANIE
1.
Wiązania kowalencyjne tworzą się między
atomami
o
identycznej
elektroujemności
(
kowalencyjne
niespolaryzowane
)
lub
między
atomami o niewielkiej różnicy elektroujemności
(
kowalencyjne spolaryzowane
).
Związki jonowe
Związki kowalencyjne
• Wiązanie silne;
• Izolatory, przewodzą prąd
elektryczny w stanie
stopionym;
• Rozpuszczają się w wodzie,
ale nie w rozpuszczalnikach
niepolarnych;
• Wiązanie bezkierunkowe;
• Ładunek skupiony w
centrum jonów.
• Wiązanie silne;
• Półprzewodniki lub izolatory
we wszystkich stanach
skupienia;
• Rozpuszczają się w
rozpuszczalnikach
niepolarnych, ale nie w
wodzie;
• Wiązanie kierunkowe;
• Ładunek pomiędzy atomami
tworzącymi wiązanie.
11
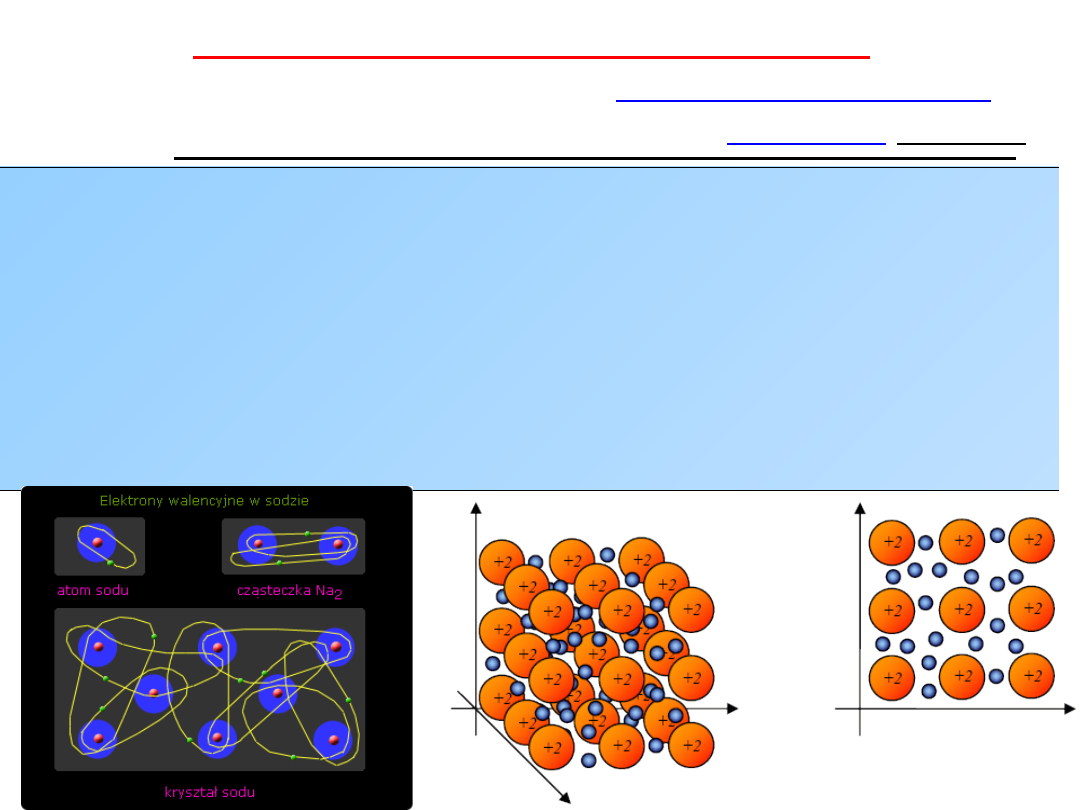
WIĄZANIE METALICZNE
występujących bezpośrednio między
• Wiązania metaliczne
występują w
kryształach
metali
i
kryształach
stopów metali
• Wiązanie powstaje
pomiędzy kationami metali
tworzącymi sieć
krystaliczną i
ich elektronami walencyjnymi
,
elektrony nie są
związane
z konkretnym kationem metalu w sieci –
elektrony
zdelokalizowane
• Elektrony zdelokalizowane
poruszają się swobodnie
pomiędzy
kationami metali tworzących si
eć, tworzą one tzw. gaz elektronowy
równoważący sumaryczny ładunek dodatni na kationach,
WIĄZANIE METALICZNE
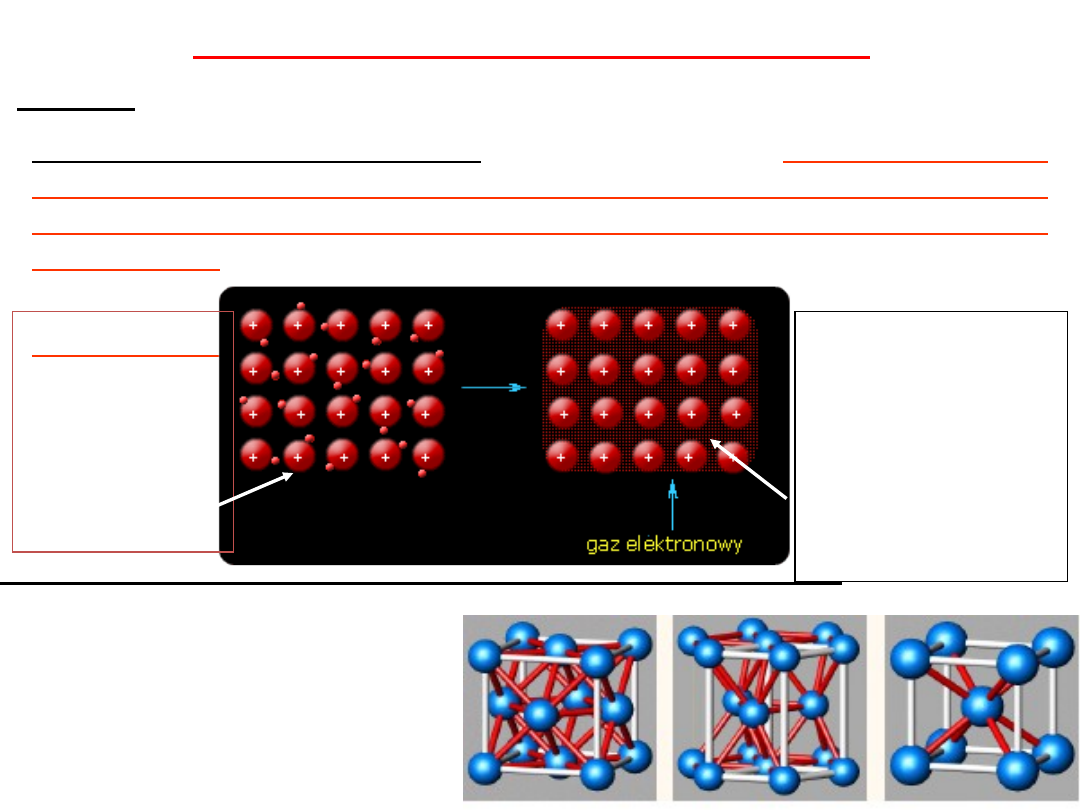
WIĄZANIE METALICZNE - polega na:
przekształceniu
atomów tego samego metalu lub atomów różnych metali w
zbiór kationów i swobodnie poruszających się między nimi
elektronów
.
Elektrony
tworzące
wiązanie
noszą
nazwę
gazu
elektronowego
Przenikanie
przestrzeni
między-jonowej i przez
oddziaływanie
elektrostatyczne
"wciąga"
w
siebie
dodatnie jony, gęsto je
przez to upakowując
.
Istota
Atomy metali -
niski potencjał
jonizacyjny.
W izolowanych
atomach-ściśle
określone
powłoki wokół
jądra.
W sieci
krystalicznej
każdy elektron
walencyjny
znajduje się pod
wpływem
oddziaływania
kilku jąder.
Tworzą kryształy

13
1. Duże przewodnictwo elektryczne i cieplne - można
uzasadnić
ruchliwością elektronów należących
do gazu elektronowego
,
2. Połysk metaliczny wynika stąd, że pod wpływem
światła widzialnego,
elektrony
znajdujące się na
powierzchni kryształu
wykonują drgania o
częstotliwości
promieniowania
padającego
.
Promienie odbite mają taką samą częstotliwość jak
promienie
padające,
co
postrzegamy
jako
charakterystyczny połysk metalu,
Właściwości metali
wiążą się z istniejącym wiązaniem metalicznym:
3. Plastyczność - ciągliwość, kowalność metali,
tłumaczy się brakiem w krysztale kierunków
uprzywilejowanych, a więc można przesuwać
płaszczyzny sieciowe i powodować pęknięcia metali.
1. Wiązanie metaliczne może istnieć w stanie stałym lub
ciekłym
2. Wiązanie jest bezkierunkowe,
3. Im więcej elektronów uczestniczy w tworzeniu wiązania,
tym jest ono silniejsze,
4. Zazwyczaj niezbyt silne wiązanie, ale są metale o silnym
wiązaniu: np. wolfram;
Właściwości wiązania metalicznego
14
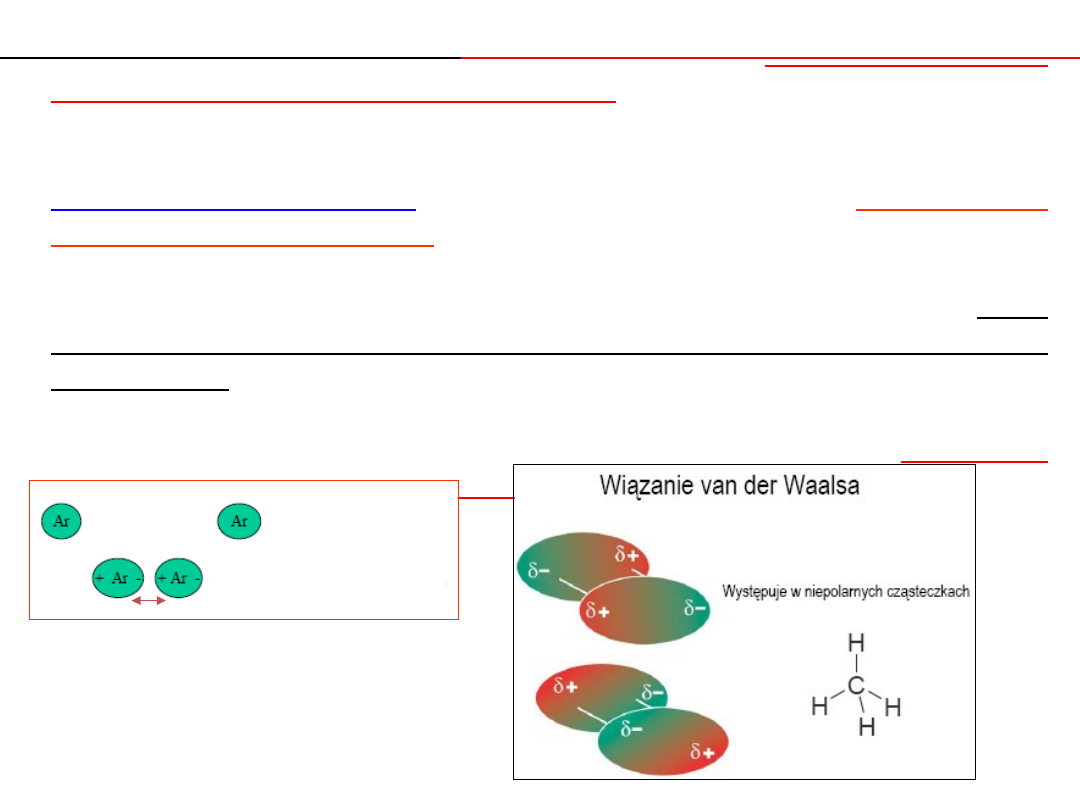
ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE
• Wiązanie wodorowe,
• Wiązanie siłami van der
Waalsa.
siły wynikające z wędrówki elektronów i ewentualnej
ich
wymiany
między
sąsiadującymi
atomami
(
międzyatomowe
:
jonowe,
kowalencyjne,
metaliczne),
siły, których występowanie nie jest związane z
wymianą elektronów:
Siły działające między atomami zbliżonymi do siebie
na odpowiednie odległości można podzielić w
ogólności na:
Wymienione rodzaje wiązań
różnią się wydatnie
energią
:
― wiązania międzyatomowe (I rzędu) - silniejsze, o
wyższej energii (250-1000 kJ/mol),
― natomiast wiązania międzycząsteczkowe (II rzędu)
- słabsze, a ich energia waha się w granicach 4-40
kJ/mol.
wiązania międzycząsteczkowe
Łączenie się między sobą obojętnych cząsteczek
tłumaczy się występowaniem między nimi
sił
przyciągania i odpychania
, które noszą nazwę
oddziaływań międzycząsteczkowych
.
WIĄZANIE WODOROWE - PROTONOWE
Jądro wodoru, czyli proton, należący do jednej
cząsteczki może oddziaływać silnie na elektrony
drugiej cząsteczki, przyciągając je do siebie.
Wiązanie jest
kierunkowe i spolaryzowane
.
Przykładem jest fluorowodór w kwasie fluoro-wodorowym
(HF)
2
:
Jądro wodoru łączy się z parą elektronową fluoru tworząc
dwucząsteczkowe połączenie.
Struktura
pierścieni
owa
H
F
F
H
wiązanie wodorowe
wiązanie kowalencyjne
silnie spolaryzowane
9
F – 1s
2
2s
2
2p
5
Atom wodoru połączony wiązaniem kowalencyjnym z
fluorem oddziaływuje dodatkowo z wolną parą elektronową
atomu
fluoru
sąsiedniej
cząsteczki
tworząc
międzycząsteczkowe wiązanie wodorowe.
Wiązanie
wodorowe
w
fluorowodorze
gazowym (HF)
6
:
•• •• •• ••
•• ••
H••F
••
H••F
••
H••F
••
H••F
••
H••F
••
H••F
••
•• •• •• ••
•• ••
• •
-
wiązanie wodorowe
• •
-
wiązanie
kowalencyjne
Struktu
ra
liniowa
16
•Substancje, w których występuje
wiązanie
wodorowe
charakteryzują się wysokimi temp.
wrzenia i topnienia.
•Zmniejszenie
gęstości
przy
zamarzaniu
Ten typ wiązania wpływa, między innymi na wartość
temp. wrzenia, temperatury topnienia oraz
rozpuszczalności:
* O
* H
O
**
*
*
*
*
**
H
H
O
**
*
*
*
*
**
H
H
O
**
*
*
*
*
**
H
H
itd.
O
**
*
*
*
*
**
H
H
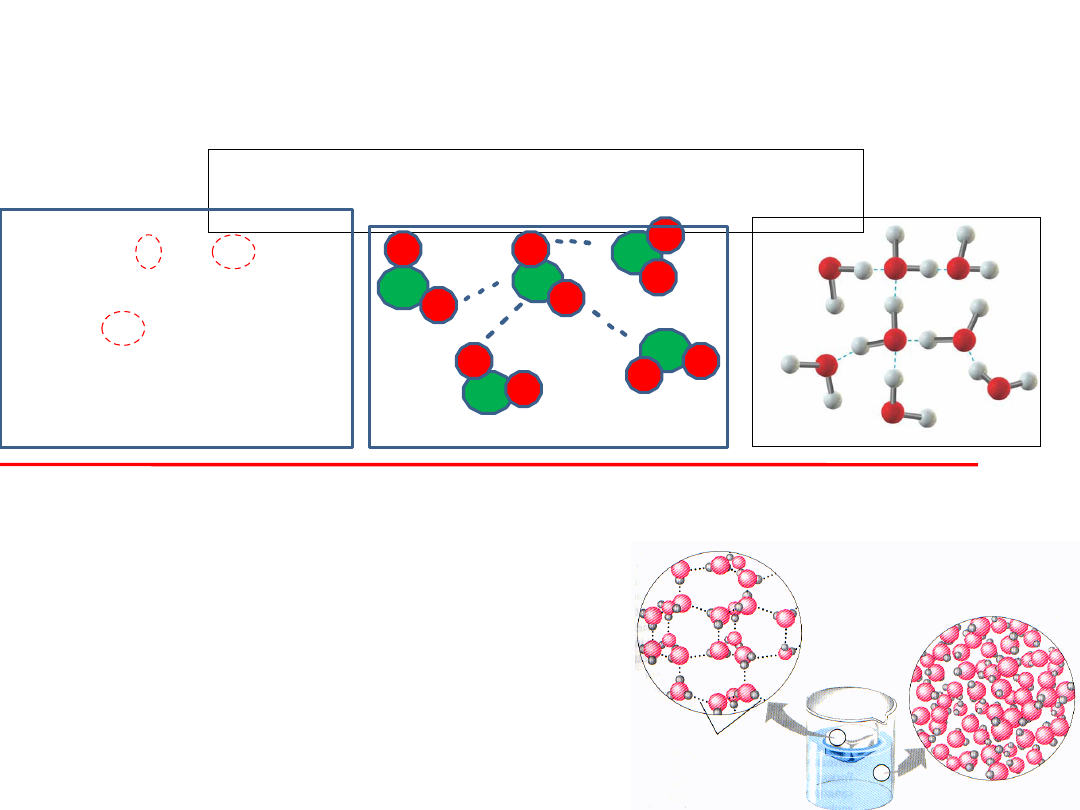
Wiązanie wodorowe występuje też między
cząsteczkami
WODY
,
Tworzą się tzw. ASOCJATY składające się z 6-8
cząsteczek wody.
ASOCJACJA - łączenie się cząsteczek
w grupy.
O
O
O
O
O
H
H
H
H
H
H
H
H
H
H

Właściwości wiązania
wodorowego
17
Wiązanie
wodorowe
występuje
w
cząsteczkach związków, w których atom
WODORU połączony jest z atomem
pierwiastka o dużej
elektroujemności
.
Występuje
między
cząsteczkami
związków chemicznych.
Jest
dużo
słabsze
od
wiązań
kowalencyjnych i jonowych
(energia
wiązania wodorowego to ok. 1/10
energii wiązania kowalencyjnego).
Zmienia własności związków.
18
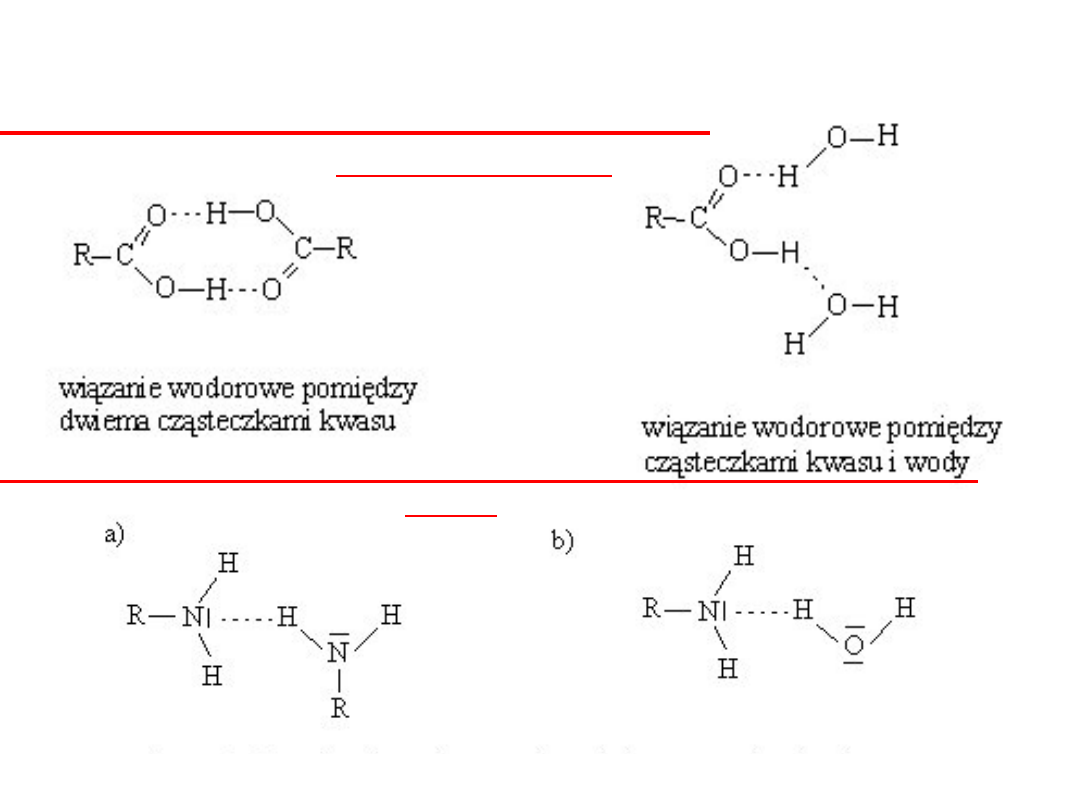
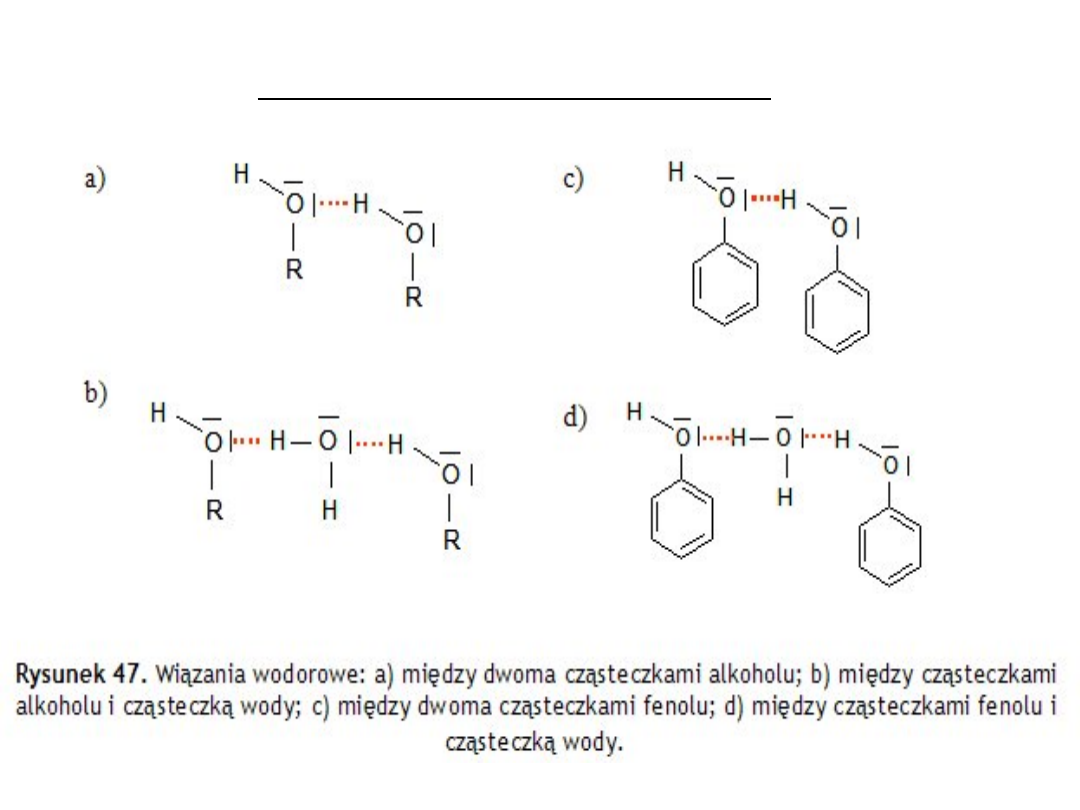
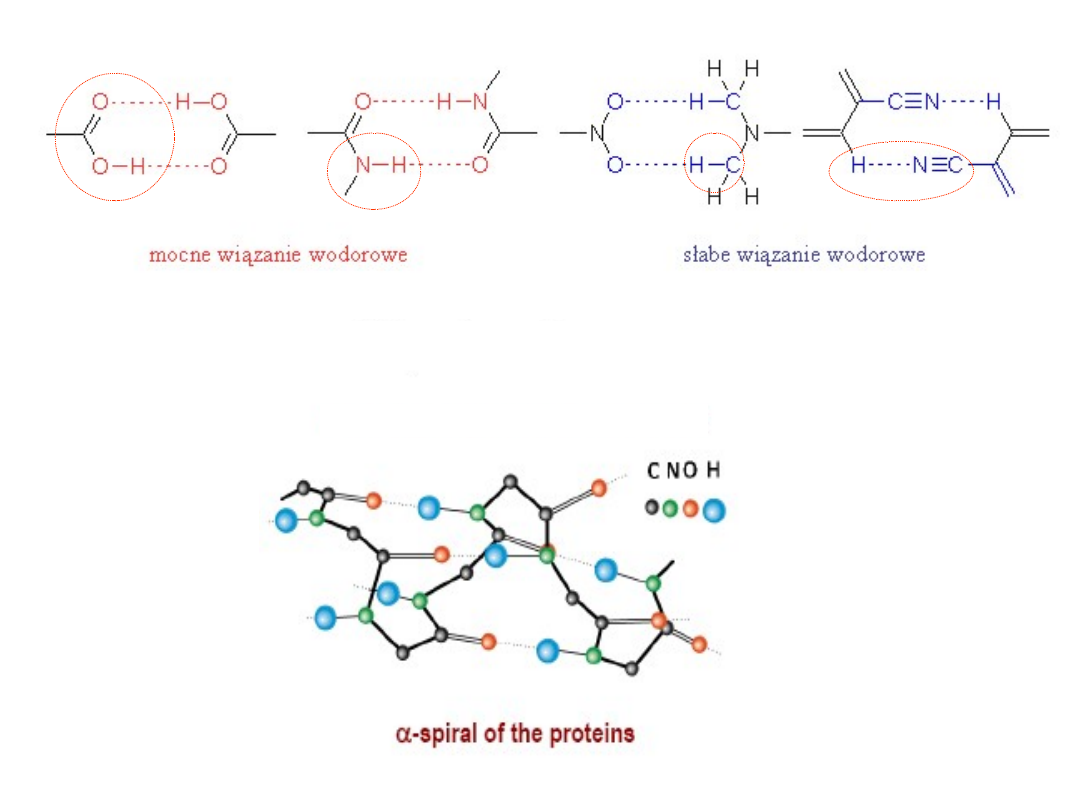
Wiązania wodorowe (mostki wodorowe) powstają również w
związkach organicznych (kwasy organiczne, aminy, alkohole,
fenole,), w których występuje grupa wodorotlenowa -OH.
między cząsteczkami aminy i
wody
kwasy organiczne
aminy
Pomiędzy cząsteczkami
aminy
19
Wiązania wodorowe w
alkoholach
20
W biologicznych
związkach
wielkocząsteczkowych:
Grupa karboksylowa
Grupa
aminowa
Grupa nitrowa

21
Siły van der Waalsa –
termin został
zasugerowany przez holenderskiego fizyka, od
jego nazwiska, i oznacza tworzenie wiązań
między cząsteczkami.
Wiązania van der Waalsa
Są to siły pomiędzy dipolami stałymi albo
indukowanymi.
Stąd wyróżnia się, co najmniej trzy rodzaje
oddziaływań międzycząsteczkowych:
1.dipol trwały -
dipol trwały
2.dipol trwały -
dipol
indukowany
3.dipol
indukowany -
dipol
indukowany
Wiązania van der Waalsa
są słabe
22
1.Oddziaływanie w układzie:
dipol
trwały
-
dipol
trwały
,
tzw.
oddziaływanie dipolowe.
(-
)
(
+)
Ładunki te oddziałują ze sobą tak jak
jony - ale oddziaływanie to jest słabsze,
gdyż w grę wchodzą
cząstkowe ładunki
elektryczne
,
a
także
przyciąganiu
pomiędzy ładunkami różnoimiennymi
towarzyszy też
odpychanie pomiędzy
ładunkami jednoimiennymi
.
Wzajemne przyciąganie się dipoli uwalnia energię nazywaną
energią orientacji
.
Dotyczy ono związków polarnych (dipoli), których
cząsteczki posiadają trwałe momenty dipolowe. Tzn.
w jednych miejscach posiadają nadmiar ładunku
ujemnego, a w innych jego niedomiar.
Polega na wzajemnym przyciąganiu, się różnoimiennych
biegunów sąsiadujących z sobą cząsteczek.
Cząsteczki dipoli ustawiają
się (orientują) w stosunku do
siebie
przeciwnymi
biegunami „+„ i „-”.
23
dipol
indukowan
y
Energię uwolnioną wskutek oddziaływania miedzy dipolem trwałym a
dipolem indukowanym nazywa się
energią indukcji
.
2.Oddziaływanie w układzie:
dipol trwały - dipol
indukowany
.
Oddziaływania tego typu występują między
cząsteczkami
obdarzonymi
trwałym
momentem
dipolowym
wytwarzającym
pole
elektryczne
a
cząsteczkami niepolarnymi
, które łatwo ulegają
polaryzacji pod wpływem takiego pola.
Wewnątrz cząsteczki niepolarnej następuje przesuniecie
się ładunków elektrycznych (polaryzacja) z jednoczesnym
wytworzeniem wzbudzonego (indukowanego) momentu
dipolowego.
Czyli w cząsteczkach, które nie posiadają trwałego
momentu dipolowego, dochodzi do oddziaływań na
siebie podobnie jak w przypadku dwóch trwałych
dipoli, tyle że znacznie słabiej.
Dipol
trwały
Cząsteczka
niepolarna
+
-
+
+
-
+
-
3.Oddziaływanie w układzie:
dipol indukowany - dipol indukowany
Ten rodzaj oddziaływań określa się jako
siły dyspersyjne
(typowe wiązanie van der Waalsa)
.
•Przyjmuje się, że w cząsteczkach bez trwałego momentu
dipolowego
występują
zawsze
fluktuacje
ich
, powodujące powstawanie
chwilowych
momentów dipolowych
.
•Cząsteczka posiadająca chwilowy moment dipolowy może go
wywołać w cząsteczce sąsiadującej, wskutek czego obie
cząsteczki mogą się nawzajem chwilowo przyciągać lub
odpychać.
•Źródłem sił dyspersyjnych jest właśnie wzajemne przyciąganie
się
dipoli
chwilowych
,
nazywanych
także
dipolami
szybkozmiennymi lub fluktuującymi
.
Siły dyspersyjne działają jedynie
wtedy, gdy
cząsteczki znajdują
się bardzo blisko siebie
, tak że
prawie się stykają.
przyciągan
ie
pomiędzy
chwilowym
i dipolami
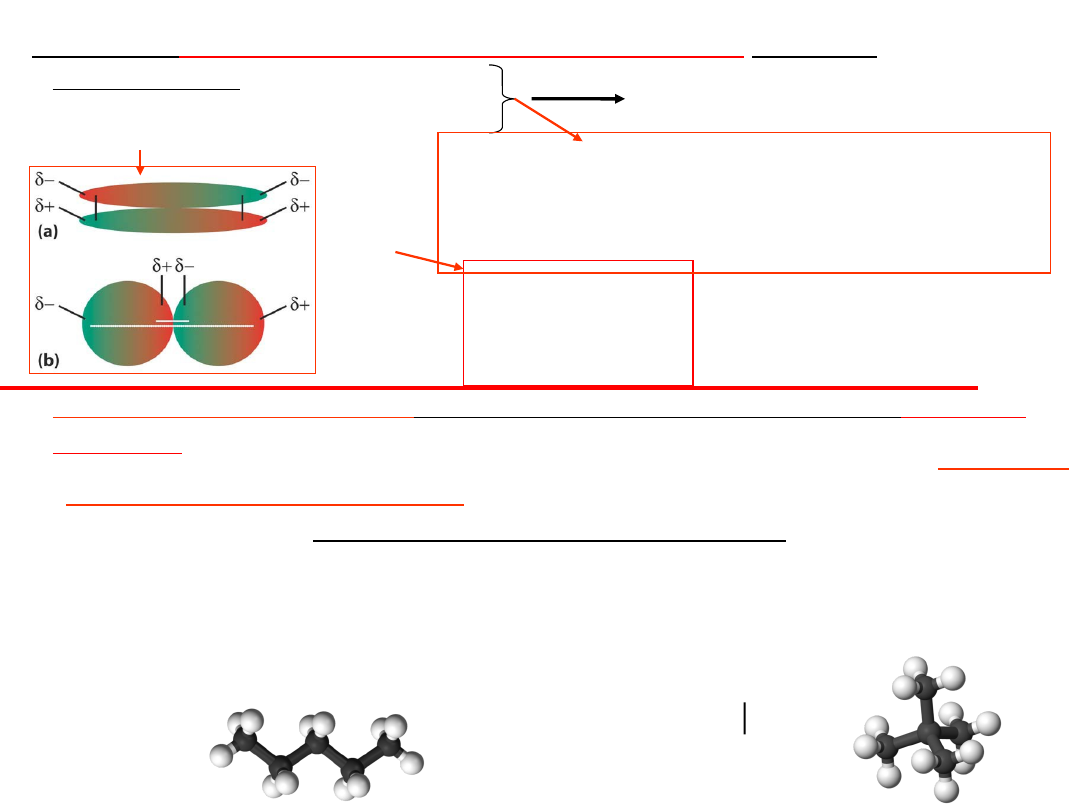
25
Wiązanie
dipol indukowany - dipol indukowany
jest tym
silniejsze im:
• Więcej jest elektronów w cząsteczce
• Im większa jest cząsteczka
• Kształt cząsteczki
Np. w smarach albo w
tworzywach
sztucznych.
bo cząsteczki
mogą ściślej
przylegać do
siebie
czemu odpowiadają większe fluktuacje
ładunków
cząstkowych
uwarunkowane
oscylowaniem elektronów między różnymi
położeniami
Silniejsze
Słabsze
• Substancje o dużej masie cząsteczkowej mają
wysokie
temperatury
wrzenia,
a
substancje
o
małej
masie
cząsteczkowej - niskie temperatury wrzenia.
• Różnice w temp. wrzenia związków organicznych
różniących się strukturą
. Np. cząsteczka o wzorze C
5
H
12
,
izomer o strukturze liniowej ma wyższą temperaturę wrzenia niż
forma rozgałęziona. Różnicę tłumaczy się oddziaływaniem sił
van der Waalsa, które są większe przy strukturze liniowej,
Własności cząsteczek
, w których występują wiązania
van der
Waalsa:
CH
3
—CH
2
— CH
2
— CH
2
— CH
3
n-pentan
CH
3
—CH
2
— CH— CH
CH
3
izo-pentan
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Wiązania chemiczne (II)
03 Wiazania chemiczne II rzedui Nieznany (2)
Wiązania chemiczne (II)
Część II wiązania chemiczne zadania(1)
Wyklad 4 Wiazania chemiczne w cialach stalych
6 wykad WiĄzania chemiczne[F]
Wykład 1, budowa atomu, wiązania chemiczne
Finanse pubiczne II cz 2
2 Atom i cząstka Wiązania chemiczne klucz
2 Atom i cząstka Wiązania chemiczne
NANOC W Nano Wyklad 05 Synteza Metodami Chemicznymi II (1)
Mathcad Projekt wytrzymałość II cz 3
7 układ okresowy pierwiastków, wiązania chemiczne
Budowa atomu i wiązania chemiczne test odpowiedzi
Odpowiedzi cwiczymy czytanie kl II cz II
dr hab RG I II II cz swoboda przeplywu pracownikow
RECEPTY Z MAŚCI dla semestru II? CZ III
więcej podobnych podstron