
Modyfikacja
potranslacyjna białek

Potranslacyjne modyfikacje białek
•
Nieodwracalne modyfikacje warunkujące
natywną, funkcjonalną strukturę białka (np.
przyłączenie hemu do łańcuchów białkowych
hemoglobiny, hydroksylacja proliny i lizyny
prokolagenu)
•
Odwracalne modyfikacje regulujące aktywność
czy funkcję białka (np. fosforylacja, acetylacja)
•
Nieodwracalne modyfikacje warunkujące
degradację białka (poliubikwityacja)
Znanych jest kilkadziesiąt różnych
potranslacyjnych modyfikacji białek
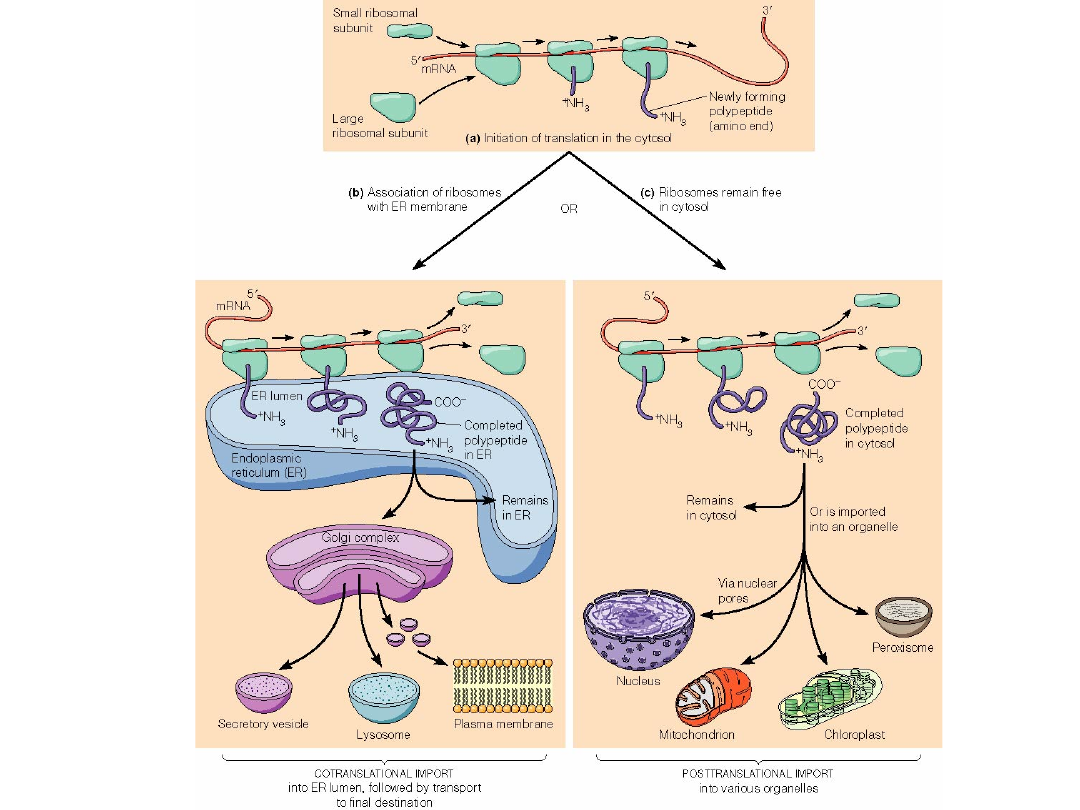
DROGI BIAŁEK
Białka cytoplazmatyczne
Białka jądrowe
Białka mitochondrialne
Białka plastydów
Białka peroksysomów
uwalniane do
cytoplazmy;
transport
przechodzą
przez ER;
transport
Białka wydzielnicze
Białka błony komórkowej
Białka ER
Białka aparatu Golgiego
Białka lizosomów
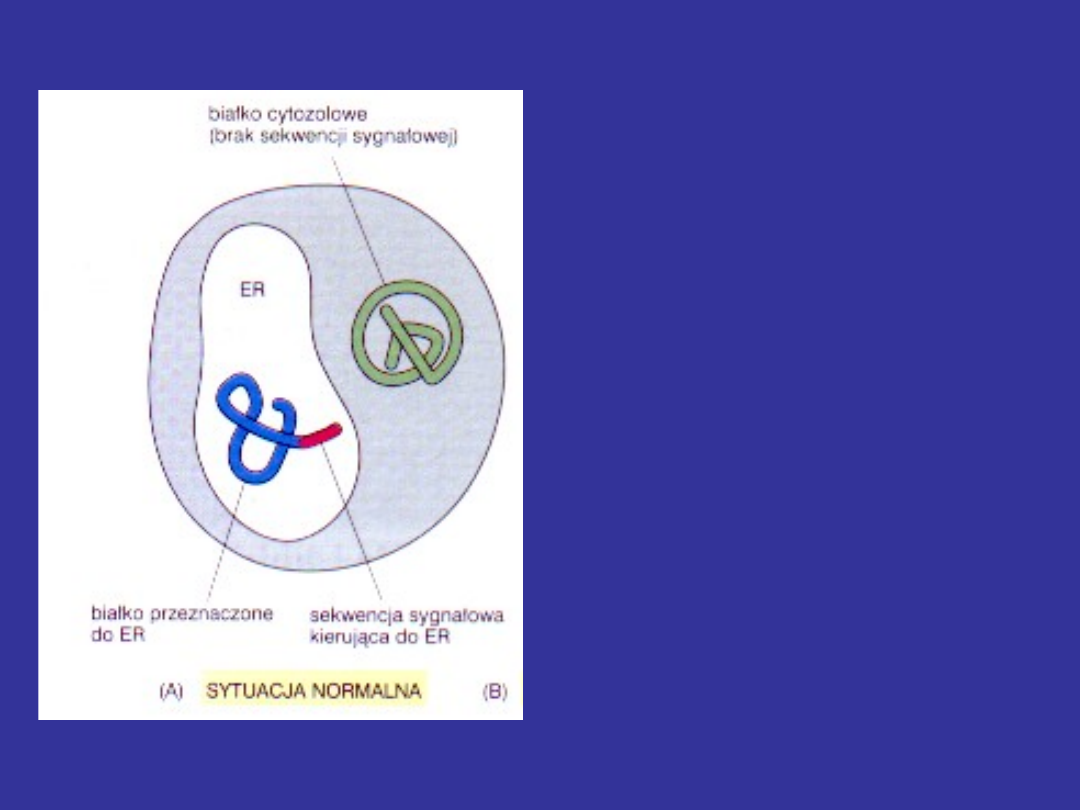
Sekwencje
sygnałowe
(sortujące)
są
konieczne
do
skierowania białka
do
określonej
organelli.
Białka,
które
takiego
sygnału nie mają
pozostają
w
cytozolu.
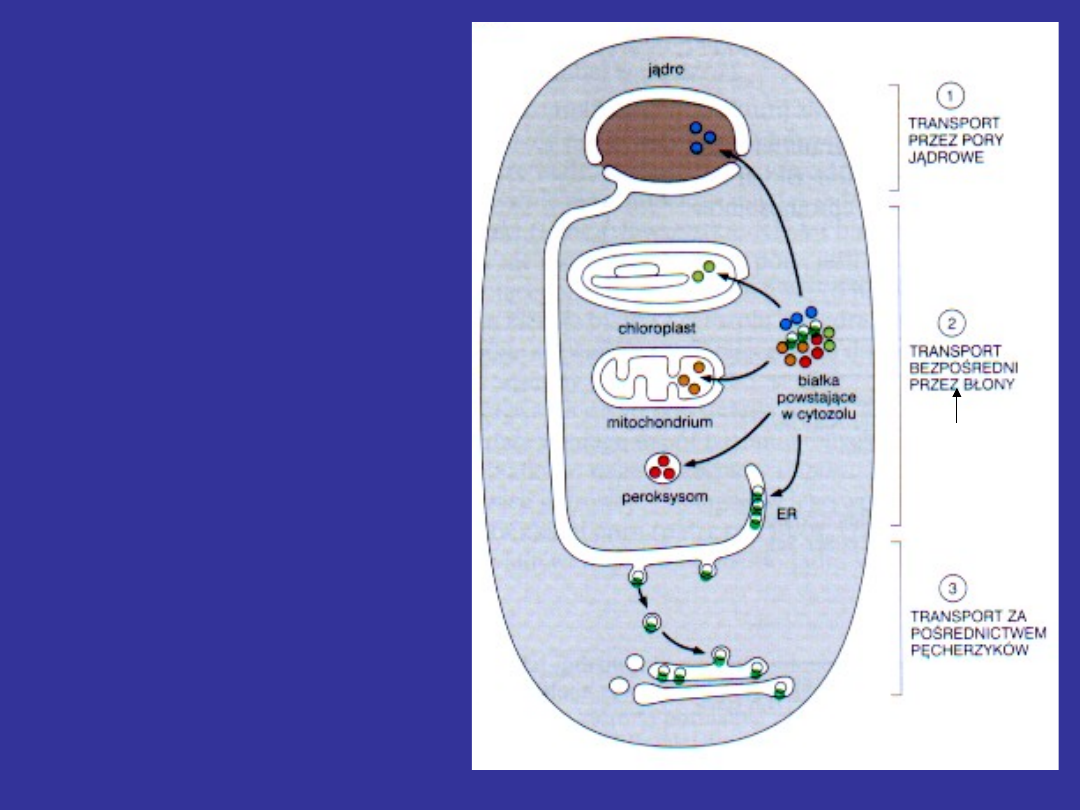
Powstające w cytozolu
białka, są doprowadzane
do właściwej dla nich
organelli przez sygnały
sortujące.
Sygnał
sortujący
(sekwencja
sygnałowa)
to
ciągły
odcinek
sekwencji aminokwasów
(zazwyczaj hydrofobowy)
o długości 15-60 AA.
Sekwencja
sygnałowa
po spełnieniu swej funkcji
jest często usuwana z
dojrzałego białka.
translokazy
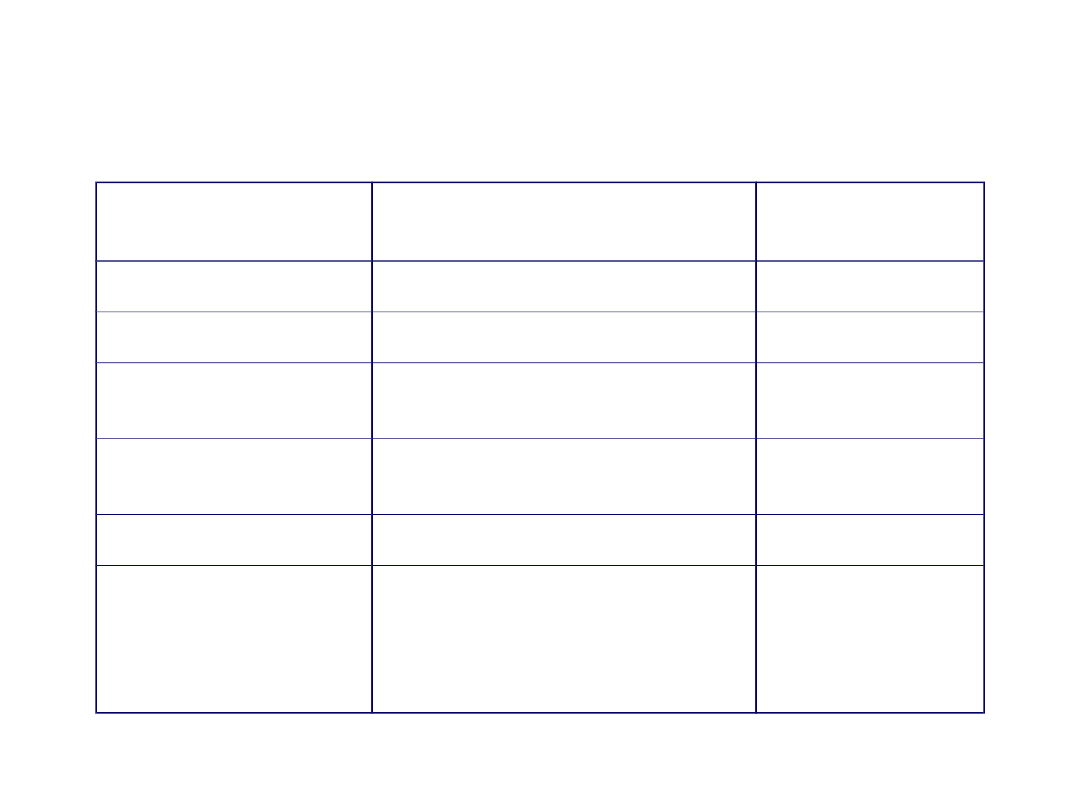
ADRES
SEKWENCJA
GDZIE W
ŁAŃCUCHU
do ER (i dalej)
peptyd sygnałowy
N-koniec
białka siateczki
KDEL
(Lys-Asp-Glu-Leu)
C-koniec
do jądra
sekw. aa zasadowych np.
KKKRK
wewnątrz
łańcucha
do mitochondriów
sekw. aa hydrofobowych i
zasadowych
N-koniec
do peroksysomów
SKL
(Ser-Lys-Leu)
blisko C-końca
do
lizosomów
mannozo-6-P
(przyłączona do
specyficznej domeny w
obrębie polipeptydu
utworzona
przez kilka
sekwencji w
łańcuchu
Adresy białek
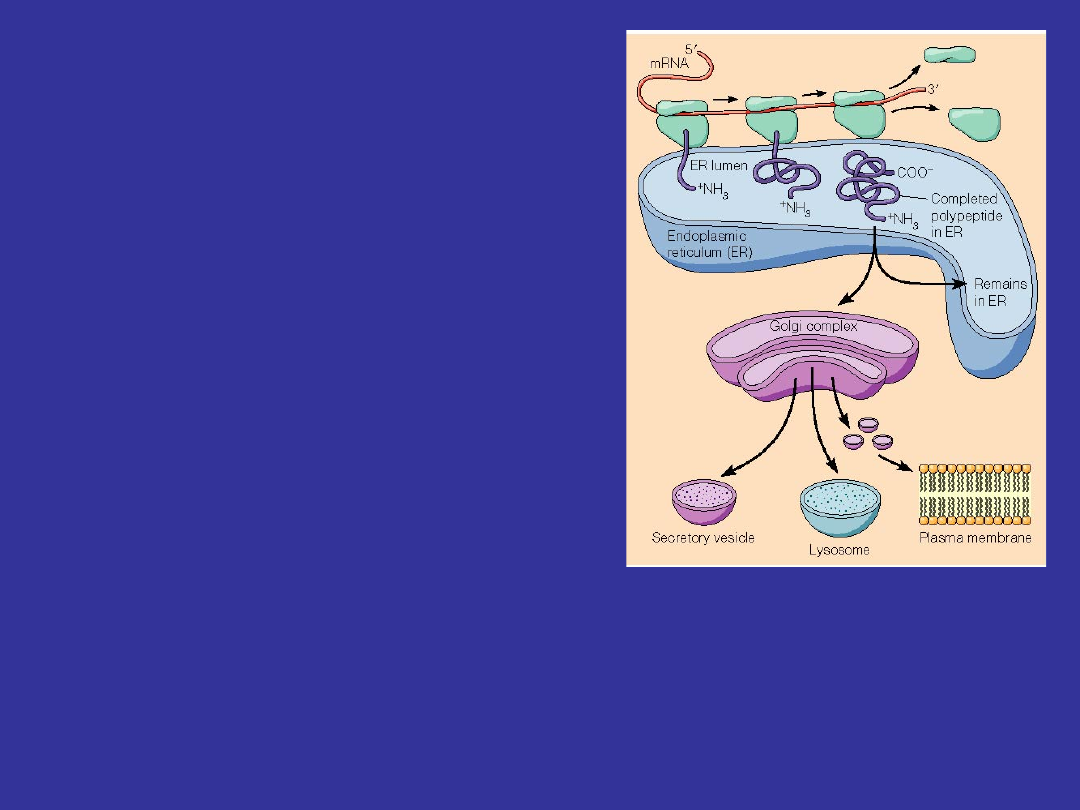
Na rybosomach osadzających
się
na
błonach
RER
zachodzi synteza:
Białek
sekrecyjnych
(eksportowych) przeznaczonych
do wydzielenia poza komórkę.
Hydrolaz lizosomowych.
Białek integralnych wchodzących
w skład błony komórkowej oraz
innych błon cytoplazmatycznych.
To czy białko będzie produkowane na wolnych rybosomach
czy na rybosomach związanych z siateczką zależy od
początkowego (N-końcowego) odcinka zsyntetyzowanego
łańcucha polipeptydowego – od tego czy ma on cechy
peptydu sygnałowego.
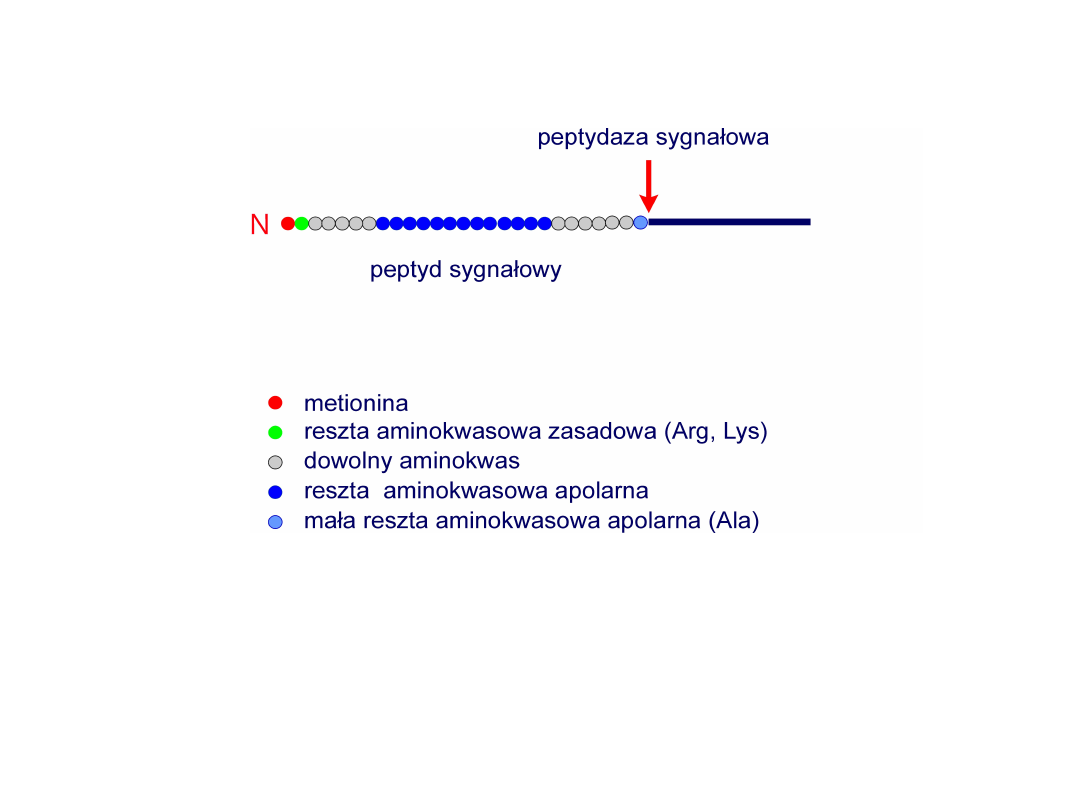
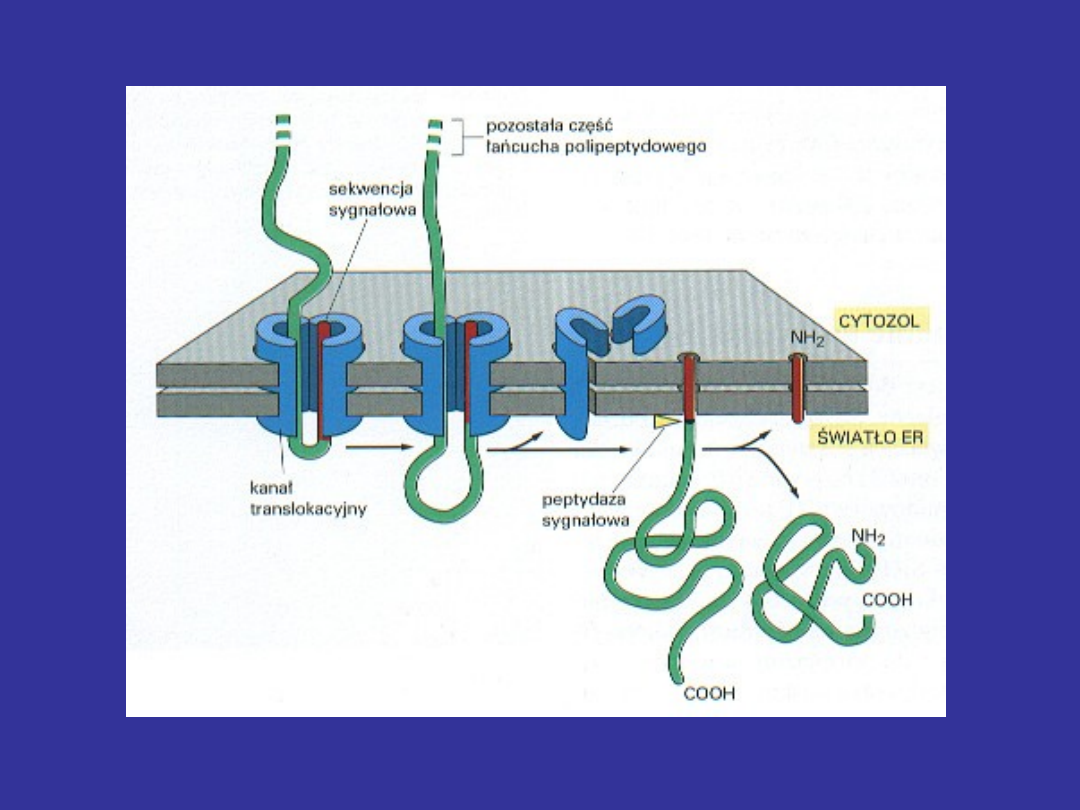
Peptyd sygnałowy
•
Peptydy sygnałowe odpowiadają za oddziaływanie rybosomów
syntetyzujących dane białko z ER.
•
Peptyd sygnałowy wprowadza białko do światła ER; tam ulega
odcięciu przez specjalny enzym:
peptydazę sygnałową
.
•
Obecnie znanych jest kilka tysięcy peptydów sygnałowych różnych
białek
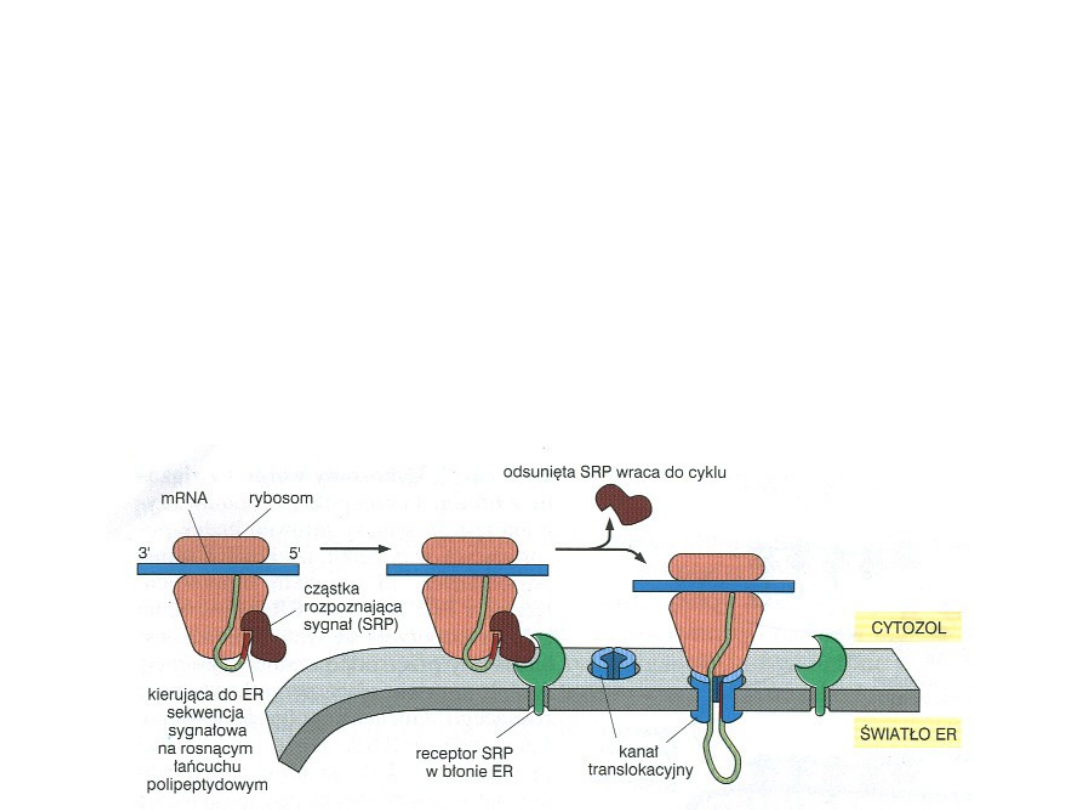
W jaki sposób peptyd sygnałowy odnajduje
ER?
To wzajemne rozpoznanie zachodzi dzięki parze białek. Są
to:
SRP
(signal recognition particle) – cząstka rozpoznająca
sygnał; białko cytoplazmatyczne
Receptor SRP
– białko występujące w błonie ER
SRP - rybonukleoproteina - kompleks o masie 325 kDa
(300 nukleotydów RNA i 6 różnych łańcuchów
polipeptydowych).
SRP rozpoznaje peptyd sygnałowy + rybosom.
Asn – X –
Ser
Asn – X - Thr
Transport jądrowo -
cytoplazmatyczny
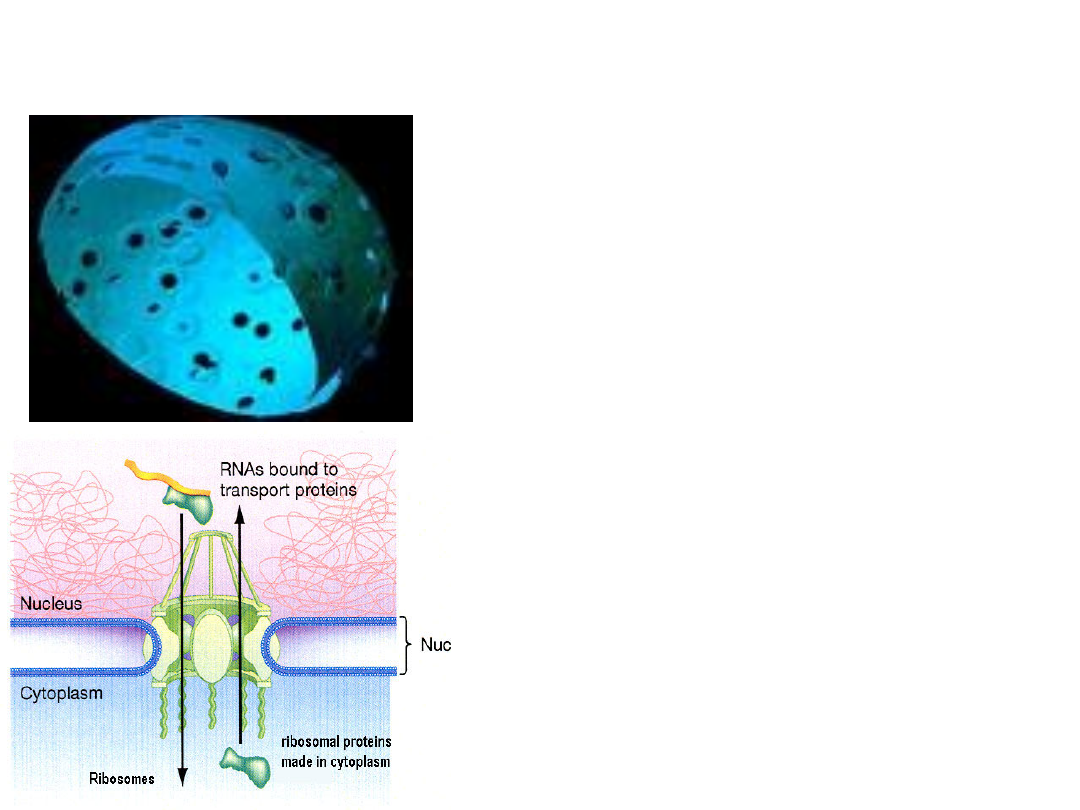
• W
przeciętnej
komórce
otoczka jądrowa zawiera 3-
5 tys. porów.
• Są one hydrofilową drogą
przez
którą
przechodzą
substancje
w
obu
kierunkach.
• Do jądra są wybiórczo
kierowane takie białka, jak
histony, polimerazy DNA
i
RNA,
białka
rybosomów.
• Do cytoplazmy : gotowe
rybosomy, mRNA, tRNA .
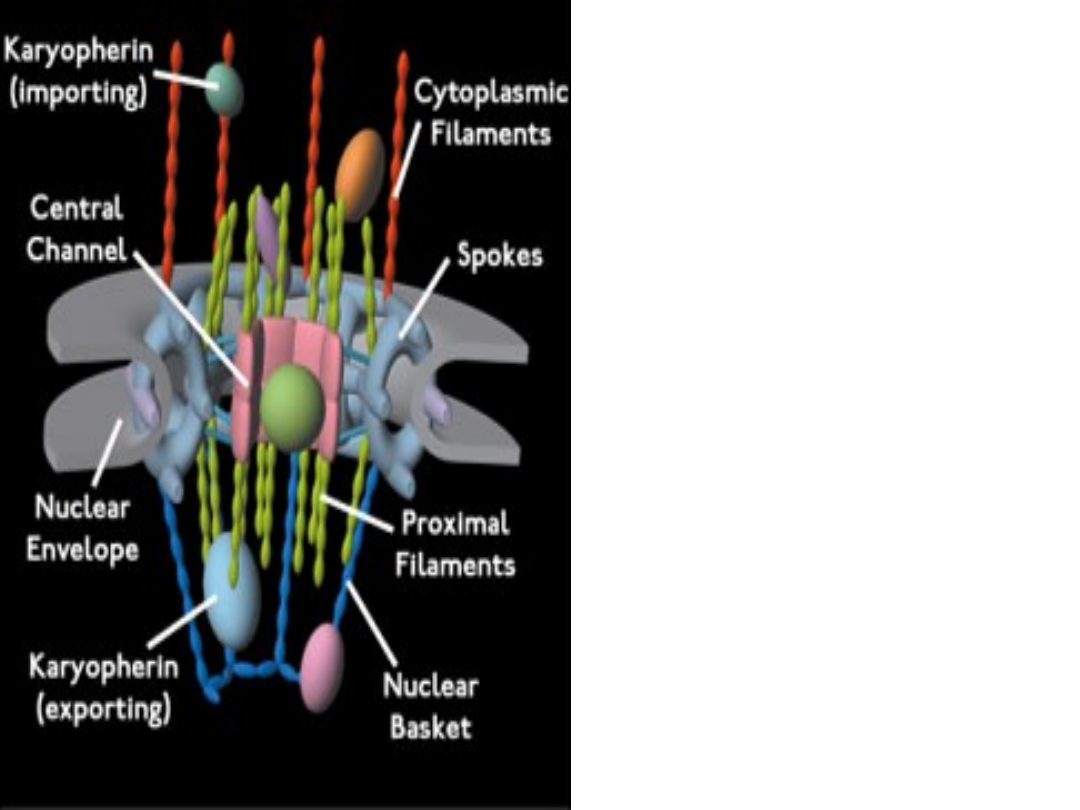
• Por jądrowy ma średnicę ok.
50
nm,
ale
swobodny
przepływ cząsteczek jest
możliwy
dla
makrocząsteczek o średnicy
do 9 nm.
• Dla
makrocząsteczek
większych bariera ta jest
nie do przebycia, chyba, że
posiadają swoiste sekwencje
sygnałowe, a transport ten
wymaga nakładu energii –
hydroliza ATP
Pory
jądrowe
transportują białka w
ich
całkowicie
sfałdowanej
konformacji

Potranslacyjna obróbka
białka
• fałdowanie łańcucha polipeptydowego
• oligomeryzację w podjednostki
białkowe
• glikolizację
• modyfikacja chemiczna

Fałdowanie białek czyli przyjmowanie prawidłowej
struktury III-rzędowej zachodzi równolegle z
niektórymi potranslacyjnymi modyfikacjami białek.
W latach 60. i 70. – uznawano hipotezę Christiana
Anfinsena mówiącą, że białka samoistnie ulegają
fałdowaniu przyjmując optymalną energetycznie
strukturę, wyznaczoną przez sekwencję
aminokwasową polipeptydu.
Prace nad rybonukleazą – Nagroda Nobla z chemii
(1/3) 1972.
W latach 80. – odkryto i zaczęto poznawać rolę
białek opiekuńczych (ang. chaperones).

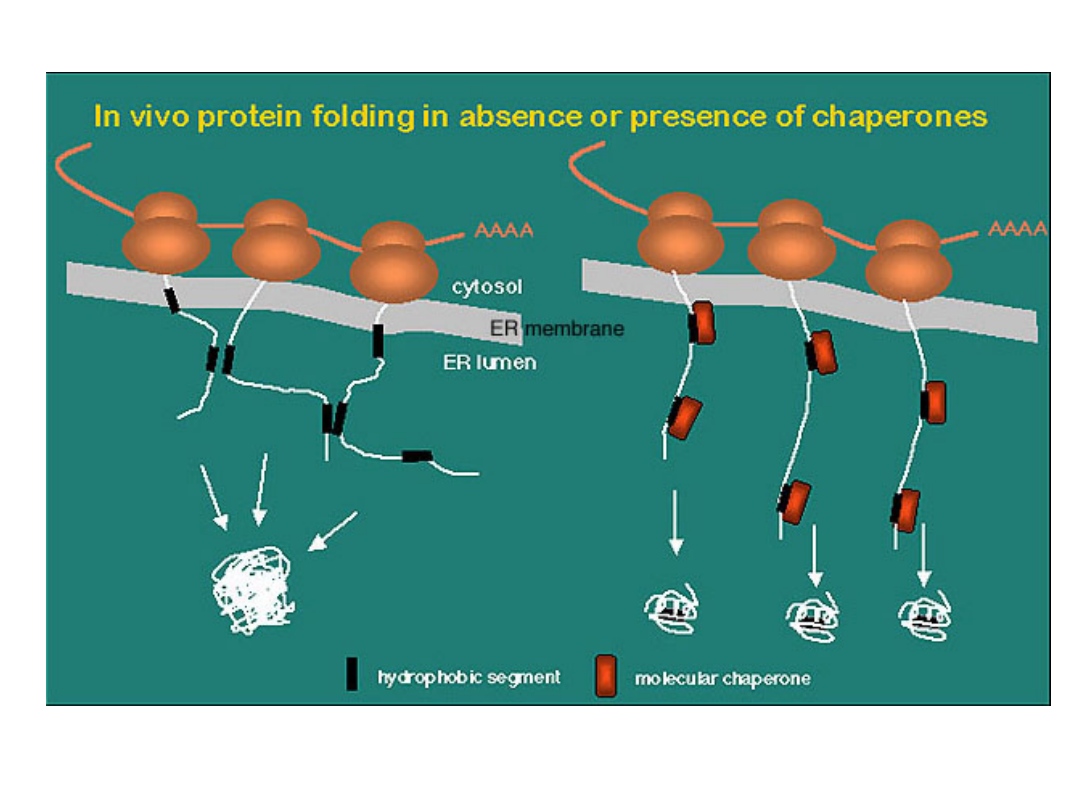
Prawidowe zwijanie białek jest wspomagane przez
białka opiekuńcze
•wiele białek opiekuńczych należy do białek szoku cieplnego
(heat shock proteins).
• Hsp zostały poznane jako te, których ekspresja znacząco
wzrasta przy wzroście temperatury.
• Nie wszystkie białka opiekuńcze są syntetyzowane w
zwiększonej ilości w sytuacjach stresowych np. Hsp70 jest,
Hsc70 – nie jest.
Białka opiekuńcze rozpoznają nieprawidłowo sfałdowane
białka - rozpoznają wyeksponowane fragmenty hydrofobowe.
W białakach prawidłowo sfałdowanych fragmenty
hydrofobowe znajdują się „wewnątrz” cząsteczki białka.

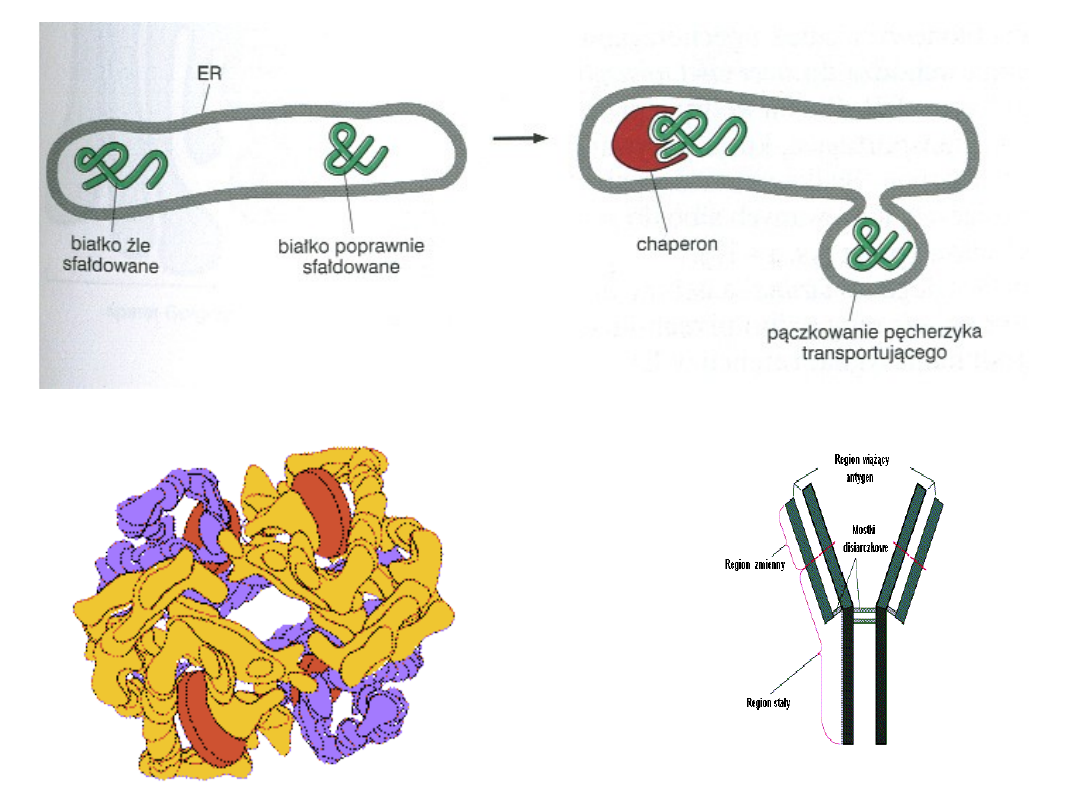
B ia łk a o p ie k u ń c z e H s p 6 0 - C h a p e r o n in y
G r o E L
G r o E S
Zbudowane z dwóch pierścieni. Każdy pierścień składa się z
7 takich samych lub bardzo podobnych białek – razem
tworzących „beczkę”

BIAŁKA OPIEKUŃCZE
• Każde powstające białko, czy w cytoplazmie
podstawowej czy w powiązaniu z siateczką
śródplazmatyczną,
wymaga
odpowiedniego
sfałdowania łańcucha polipeptydowego tak, by
utworzyła się charakterystyczna struktura drugo-;
trzecio-; czwartorzędowa przestrzenna struktura
umożliwiająca prawidłowe funkcjonowanie białka.
• Większość białek samoczynnie przybiera ją w
warunkach fizjologicznych, ale 10% przybiera
konformację przestrzenną inną od pożądanej, co z
reguły prowadzi do braku aktywności. Prawidłowe
ułożenie łańcucha polipeptydowego zapewnione
jest przez oddziaływanie z białkami opiekuńczymi
(chaperonami)

• Białka
opiekuńcze
są
ATP-azami
charakteryzującymi się wysokim powinowactwem
do
hydrofobowych
odcinków
łańcuchów
polipeptydowych.
• Występują zarówno na obszarze cytoplazmy
podstawowej, jak i w jądrze komórkowym oraz w
świetle organelli błoniastych.
• Należą do dwóch głównych rodzin określonych
jako: hsp60 i hsp70. Nazwa hsp oznacza białko
szoku cieplnego (heat shock protein).

Potranslacyjna obróbka
białka
• fałdowanie łańcucha polipeptydowego
• oligomeryzację w podjednostki białkowe
• glikolizację
• modyfikacja chemiczna

GLIKOZYLACJA
Dwie grupy związków powstających w wyniku
przyłączania reszt cukrowych do białek:
GLIKOPROTEINY
PROTEOGLIKANY
•
łańcuchy cukrowe przyłączone
poprzez wiązanie O-glikozydowe
•
łańcuchy cukrowe przyłączone
poprzez wiązanie N-glikozydowe
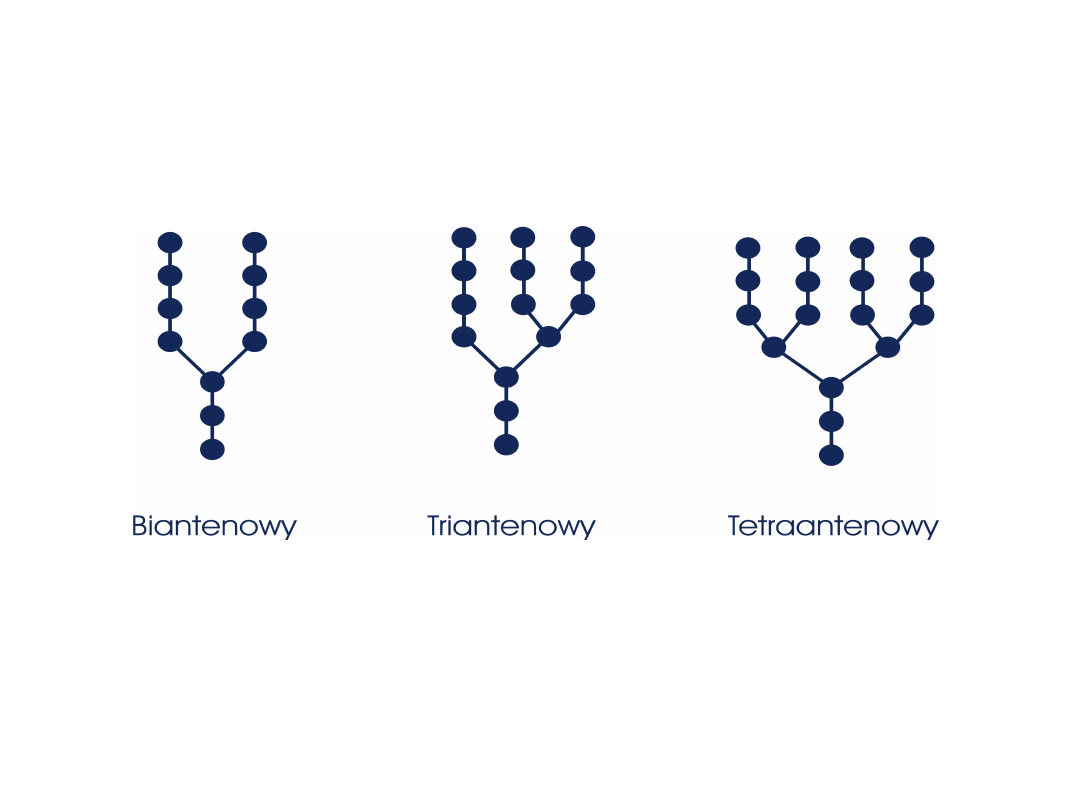
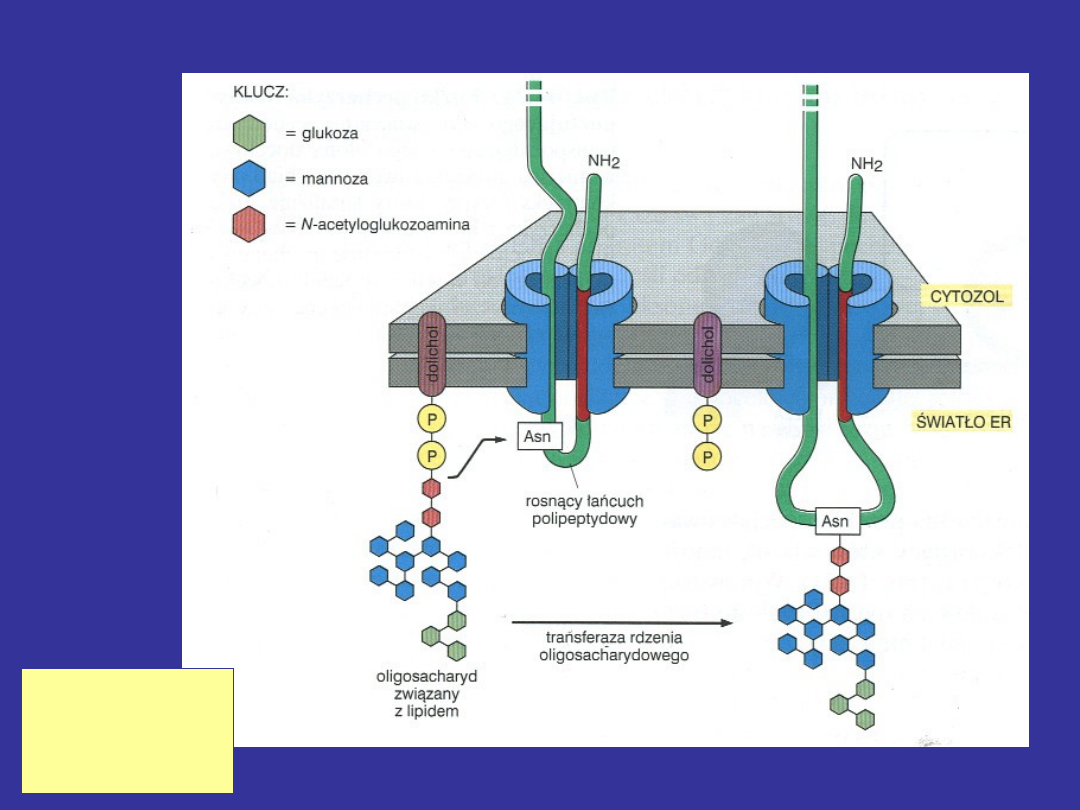
Typy łańcuchów cukrowych występujących w N-
glikoproteinach
Połączenie z białkiem – przez resztę
Asn
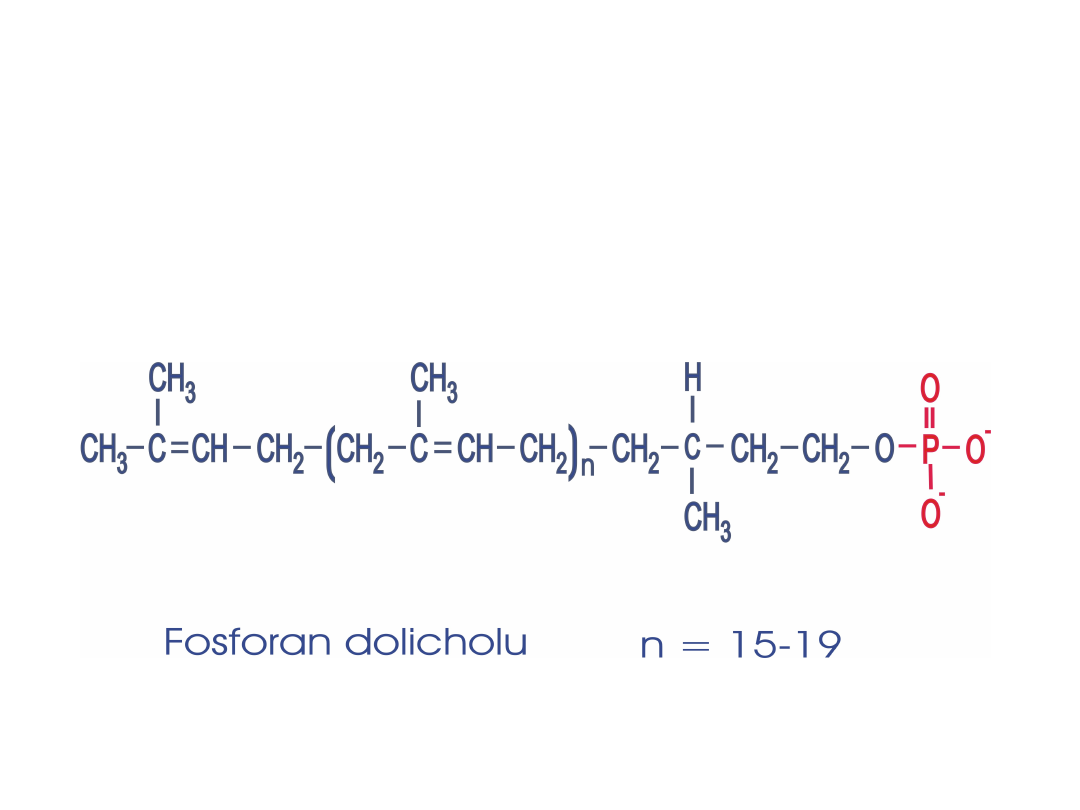
Fosforan dolicholu jest akceptorem reszt cukrowych a
następnie donorem struktury oligosacharydowej w syntezie
N-glikoprotein
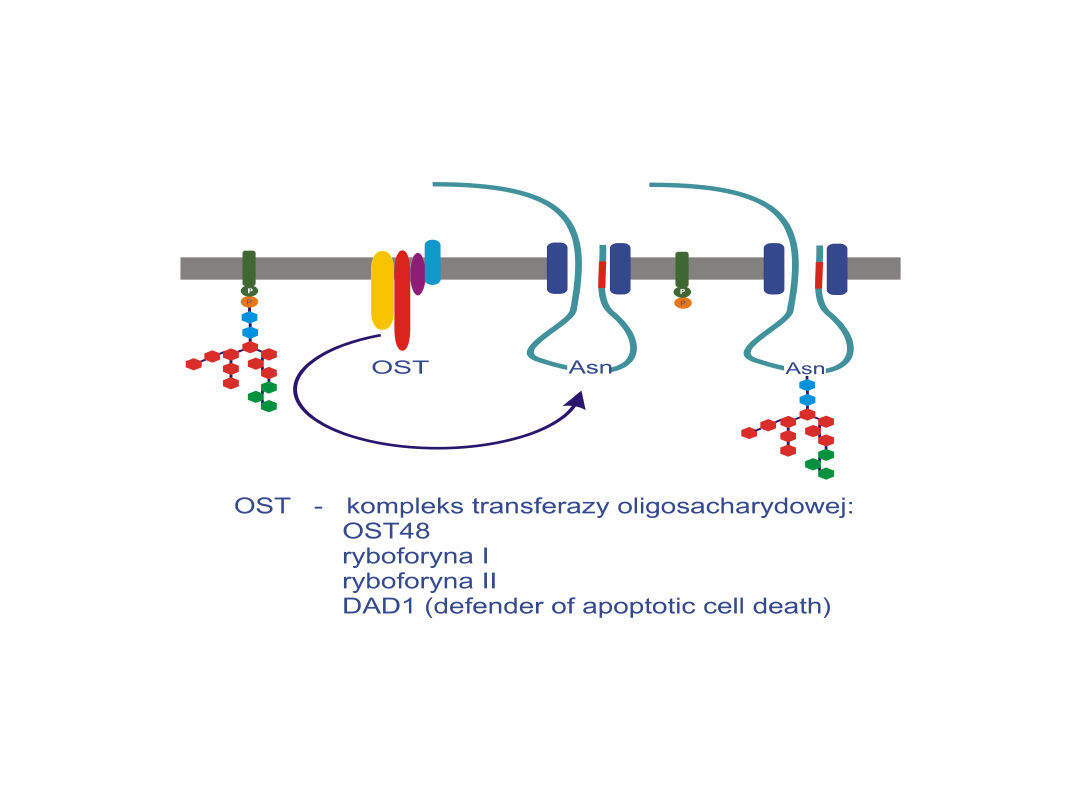
Transferaza oligosacharydowa przenosi łańcuch cukrowy
z fosforanu dolicholu na resztę asparaginy łańcucha
białkowego
Sekwencja, w której Asn może (nie musi) ulegać
glikozylacji
Asn-X- Ser (Thr)

Potranslacyjna obróbka
białka
• fałdowanie łańcucha polipeptydowego
• oligomeryzację w podjednostki białkowe
• glikolizację
• modyfikacja chemiczna

Potranslacyjna modyfikacja N-
końca
1. Usunięcie metioniny
Reakcję prowadzi aminopeptydaza metioninowa
Preferowana jest hydroliza wiązania pomiędzy resztą Met a
małym aminokwasem: G, A, S, C, T, P, V
Prolina w pozycji 3 może hamować tę reakcję
Usunięcie metioniny może warunkować aktywność
biologiczną niektórych białek
Usunięcie metioniny może warunkować inną potranslacyjną
modyfikację - mirystylację

Potranslacyjna modyfikacja N-
końca
2. Acetylacja N-końcowego
aminokwasu
Częsta u Eukaryota, rzadka u Prokaryota
Enzymy odpowiedzialne za ten proces to
N
-końcowe
a
ce
t
ylotransferazy
(NatA, NatB, NatC i Nat D
rozpoznające różne N-końcowe sekwencje białek).
Funkcja? – enigmatyczna. Dla niektórych białek
acetylacja N-końca wydaje się bez znaczenia, dla innych
istotna. Mutacje w genach Nat prowadzą do zaburzeń
wzrostu i funkcjonowania komórek drożdży.
In vitro acetylacja tych białek, które normalnie nie są
acetylowane może prowadzić do zahamowania ich funkcji
– np. acetylacja N-końcowej treoniny podjednostek
proteasomu hamuje aktywność proteolityczną).

ACETYLACJA I METYLACJA
(wewnątrz cząsteczki białka)
ACETYLACJA
•
Proces odwracalny – białka mogą ulegać acetylacji przez
acetylotransferazy i deacetylacji przez deacetylazy
•
Większość poznanych procesów acetylacji zachodzi w
jądrze komórkowym
•
Acetylacji ulegają nieliczne reszty lizyny (sekwencja
zgodności sprzyjająca acetylacji – niezdefiniowana)
•
Aktywność acetylaz jest regulowana przez sygnały
prowadzące do proliferacji i różnicowania (np. poprzez
fosforylację).
Białko
Efekt acetylacji
histony
osłabia oddziaływanie
histonów z DNA -
wzmożona transkrypcja
niektóre czynniki
transkrypcyjne
p53
,
GATA1
miejsce acetylacji
przylega do domeny
wiążącej DNA –
stymulacja wiązania,
stymulacja transkrypcji
niektóre czynniki
transkrypcyjne
HMGI
miejsce acetylacji w
obrębie domeny
wiążącej DNA –
hamowanie wiązania,
hamowanie transkrypcji
niektóre czynniki
transkrypcyjne
TCF
(Drosophila)
acetylacja hamuje
oddziaływanie z białkiem
- aktywatorem
-importyna
?
-tubulina
wzrost stabilności
mikrotubuli

METYLACJA
•
Modyfikacja odwracalna prowadzona przez enzymy: białkowe
metylotransferazy
•
Metylacji może ulegać C-końcowy aminokwas, czasem metylacja
towarzyszy prenylacji (białka G (trimeryczne np. transducyna), Ras) lub
reszta argininy lub lizyny
•
Metylacja może podlegać regulacji, metylacja może regulować
aktywność białek
Istnieje metylotransferaza białkowa wchodząca w interakcję z
receptorem (PRMT1 oddziałuje z receptorem IFN-
Pod wpływem NGF – wzrost stopnia metylacji białek komórkowych
•
Grupy białek ulegające metylacji:
podjednostka białek G np.
transducyny,
małe białka G: Ras, Rho
białkowa fosfataza
histony

Połączenia białek z błonami
Białka mogą zawierać w swojej strukturze domeny o
wysokim powinowactwie do błon biologicznych.
Białka mogą być zakotwiczone w błonie przez swoją
sekwencję N-końcową, C-końcową, lub mogą
przebijać błonę 1x lub wielokrotnie.
Białka mogą być także zakotwiczone w błonie przez
połączenie ze związkami hydrofobowymi.
Kotwica GPI (glikozylofosfatydyloinozytolowa)
Kotwiczy białka po zewnętrznej stronie błony
komórkowej (w trakcie syntezy – wewnątrz ER)
Kotwice z kwasów tłuszczowych i izoprenoidów
– kotwiczą białka po wewnętrznej stronie błony
komórkowej
(w trakcie syntezy – na zewnątrz ER)
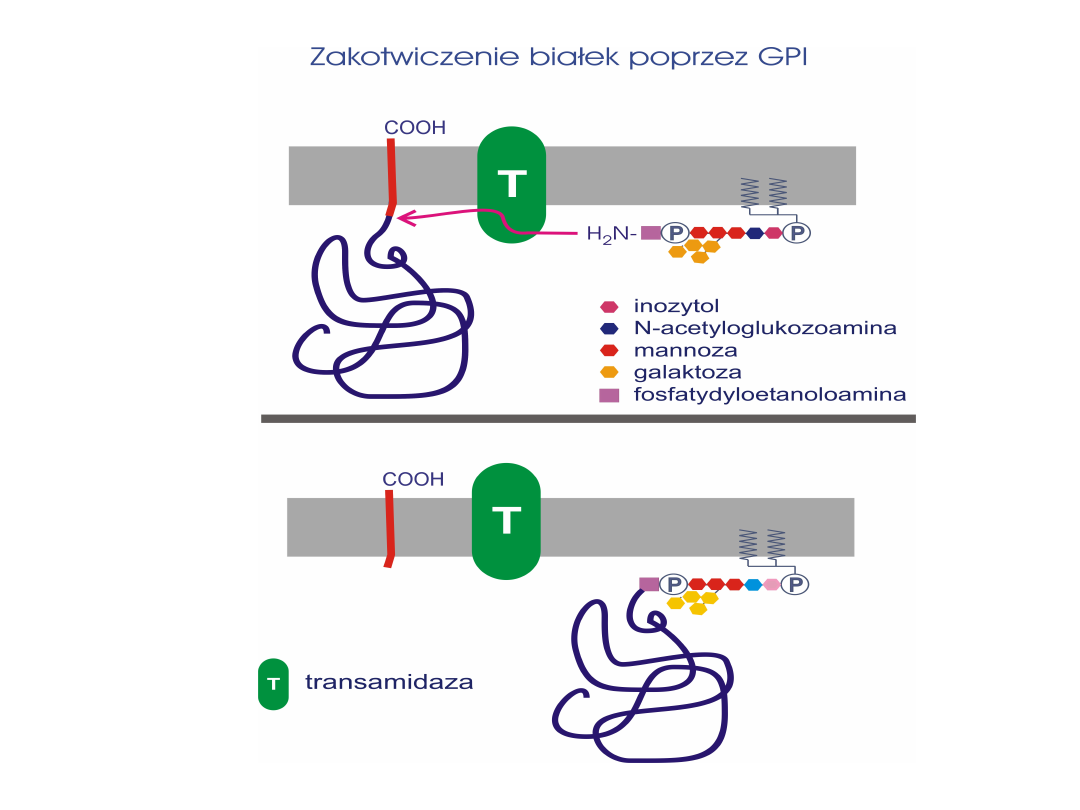
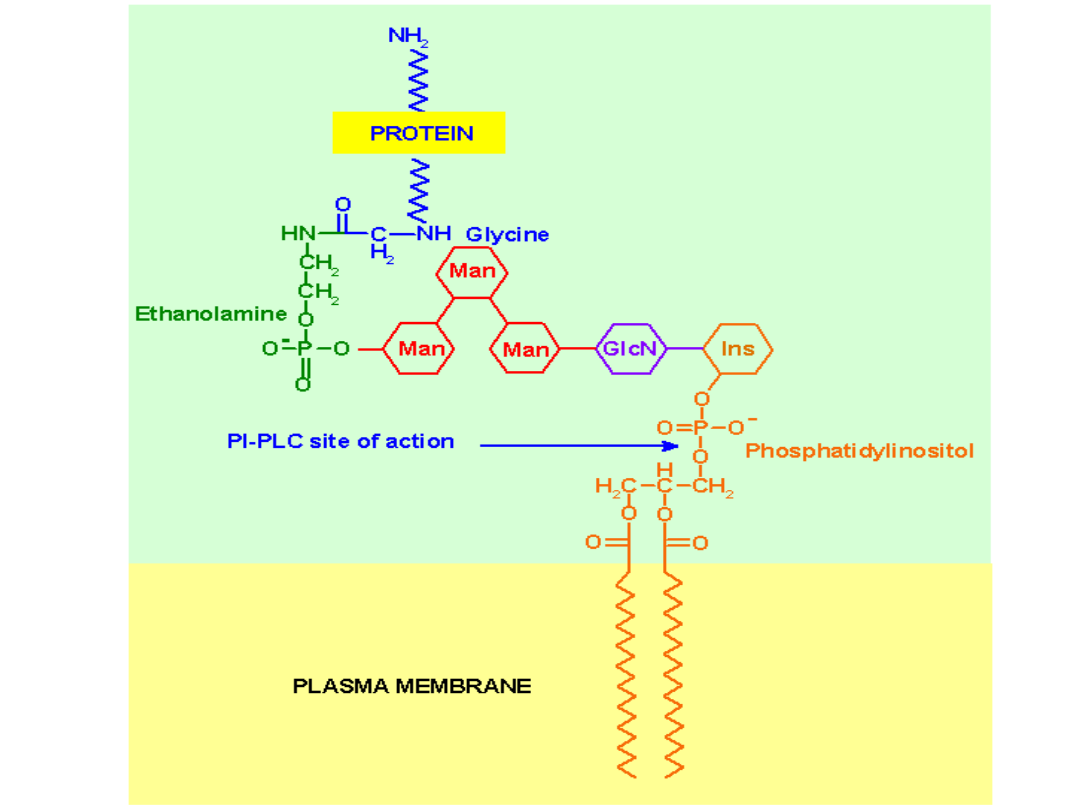

ZAKOTWICZANIE BIAŁEK W BŁONACH
WEWNĄTRZ KOMÓRKI
•
Mirystylacja przy N-końcu
•
Palmitylacja reszt cysteiny
•
Prenylacja:
Farnezylacja przy C-końcu
Geranylogeranylacja przy C-końcu

Struktura DNA umożliwia
funkcjonowanie mechanizmów
dziedziczenia
Specyficzną sekwencję nukleotydów w
DNA, determinującą kolejność
nukleotydów w cząsteczce RNA i
aminokwasów w polipeptydzie
nazywamy
genem
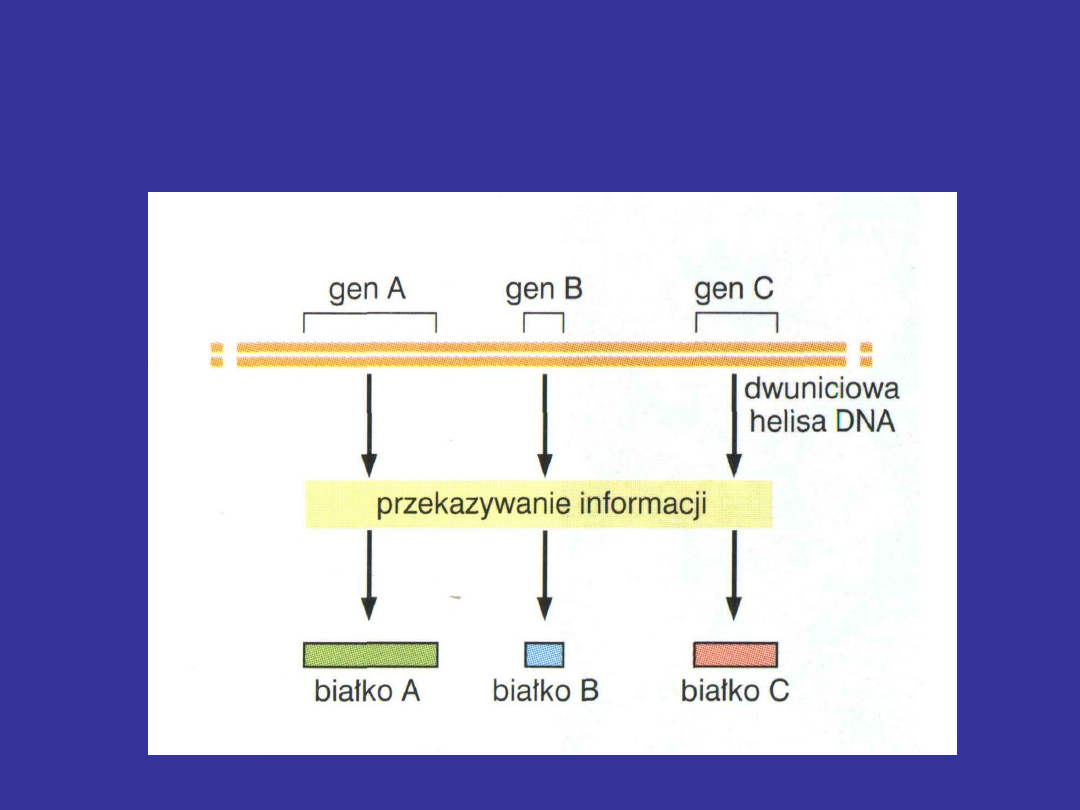
Liniowa sekwencja nukleotydów w genie
decyduje o liniowej sekwencji aminokwasów
w białku

Genom
kompletny zasób informacji
DNA organizmu

Genom człowieka
genom jądrowy
genom jądrowy ma długość
ok. 3 mld par zasad i jest
podzielony na 24
chromosomy
chromosomy. 22 z nich to
chromosomy autosomalne,
natomiast 2 pozostałe to
chromosomy płci
chromosomy płci - X i Y.
W genomie jądrowym
kodowanych jest około
30-40
30-40
tysięcy genów
tysięcy genów
,
, które
stanowią zaledwie kilka (do
10) procent sekwencji
jądrowego DNA. Reszta
genomu to sekwencje
niekodujące, o nieznanej
funkcji.
genom
genom
mitochondrialny
mitochondrialny
człowieka jest
wielokrotnie mniejszy
od jądrowego. Liczy
„zaledwie” 16 569
par zasad, koduje 37
genów. Należy jednak
pamiętać, że w każdej
komórce znajduje się
wiele mitochondriów
a każde
mitochondriom może
zawierać do 10
cząsteczek mtDNA.

• Najważniejsze implikacje
– informacja genetyczna jest zakodowana
w sekwencji zasad w DNA
• Powielanie informacji genetycznej
następuje przez tworzenie nowej cząsteczki
DNA na matrycy starej
– zamiana nukleotydu - mutacja
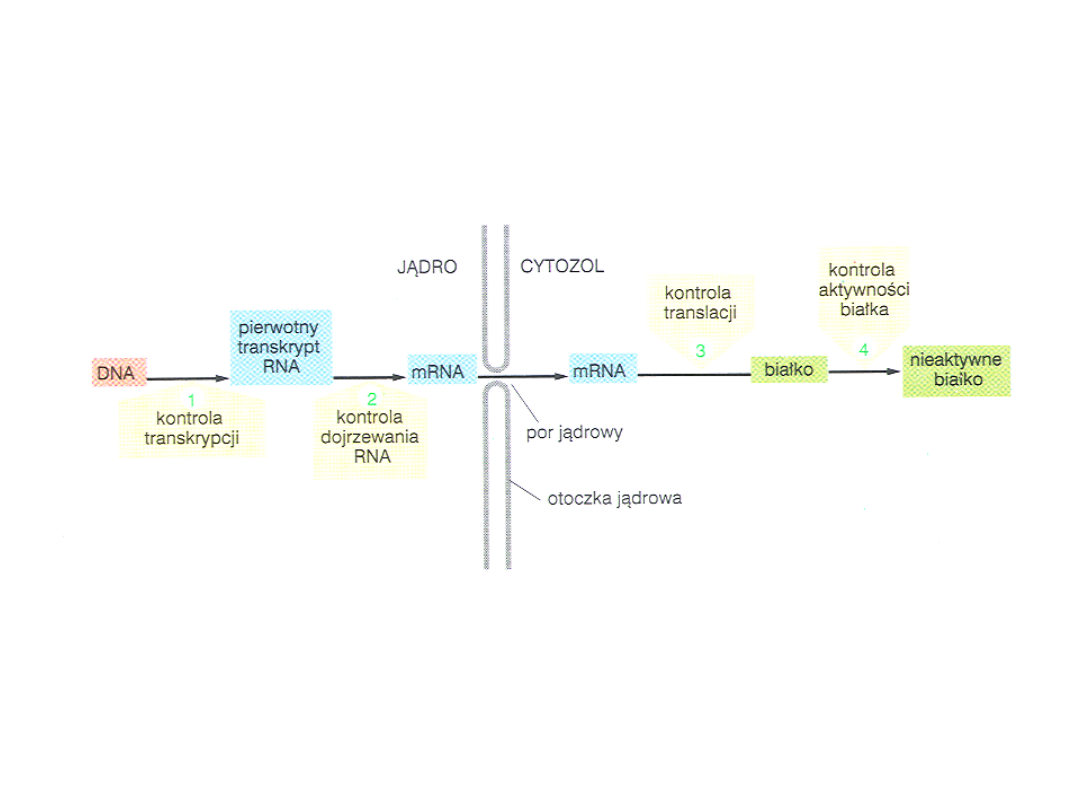
Kontrola ekspresji genów
U ssaków sekwencje kodujące – 2% DNA

Pobudzenie ekspresji genów
(indukcja) może zajść :
• przez czynniki transkrypcyjne (TF),
• niektóre hormony,
• indukcje substratową.

Czynniki transkrypcyjne (TF)
białka regulujące odczytywanie
informacji genetycznej w jądrze
komórkowym.
Działają przez wiązanie się do licznych miejsc
regulatorowych na DNA
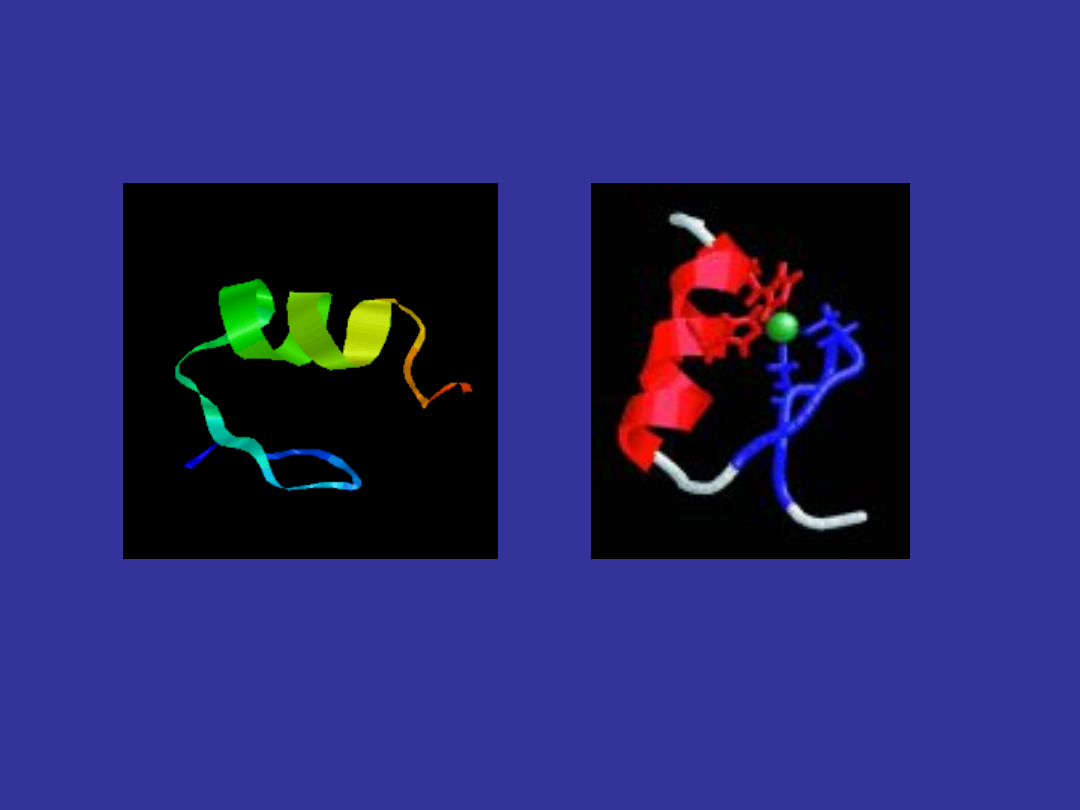
Białkowy motyw strukturalny, zwany palcem
cynkowym
Palec cynkowy jest motywem wiążącym się z DNA
Odcinek palca cynkowego o konformacji alfa-helisy (kolor
czerwony) służy do łączenia się z zasadami DNA. Naprzeciwko tego
odcinka znajduje się krótki fragment o budowie beta-harmonijki
(kolor niebieski). Atom cynku (ciemnozielona kulka) łączy się z
dwoma resztami cysteiny (niebieskie łańcuchy boczne) i dwoma
resztami histydyny (czerwone łańcuchy boczne)
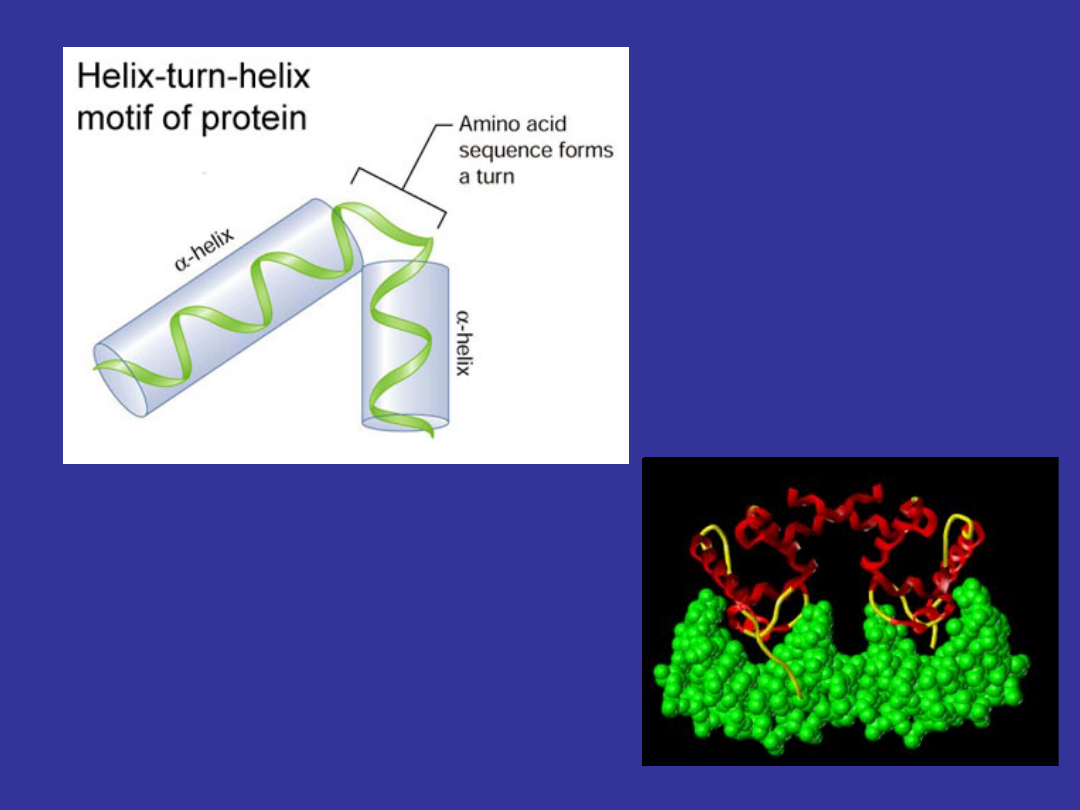
Bierze udział w rozwoju
zarodkowym i różnicowaniu
tkankowym. Skutkiem
oddziaływania takiego białka z
DNA może być modyfikacja jego
aktywności.
Czynnik
transkrypcyjny
helisa-skręt-helisa

Hormony steroidowe
• Białkowe receptory hormonów są
zlokalizowane w cytoplazmie. Mają
domenę wiążącą hormon i domenę
wiążącą DNA. Kompleks hormon-
receptor wnika do wnętrza jądra
komórkowego. Receptor po związaniu
hormonu staje się zdolny do łączenia się
z sekwencją docelową DNA, pobudzając
ekspresję określonego genu.

Indukcja substratowa
• Obserwowana w wątrobie
• Przykładowo karmienie zwierząt
niektórymi aminokwasami powoduje
wzrost aktywności enzymów
uczestniczących w ich degradacji.

Hamowanie ekspresji
• metylacja zasad, szczególnie cytozyny;
fragmenty DNA nie podlegające transkrypcji
są w wysokim stopniu metylowane
•wiązanie histonów

Zmiany sekwencji
nukleotydowych noszą nazwę
mutacji
mutacji
.

Efekty mutacji powstałych u osobnika rodzicielskiego
będą przekazywane z pokolenia na pokolenie tylko
wtedy gdy znajdą się one w komórkach rozrodczych
lub ich komórkach macierzystych.
Mutacja jest, więc dowolnym odstępstwem od
normalnej dla danego organizmu budowy
(sekwencji) i ilości jego DNA.
Mutacja prowadzi do powstania nowej informacji
genetycznej.
Następstwem mutacji jest częściowa zmiana informacji
genetycznej prowadząca do zaburzenia odczytywaniu
kodu genetycznego, co może powodować np., że białko
kodowane przez dany gen ma liczne niewłaściwie
włączone aminokwasy, zatem inne właściwości biologiczne

Mutacja genowa
to zmiana dziedziczna
zachodząca w genie, na poziomie kwasu
deoksyrybonukleinowego (DNA), gdzie
następuje zamiana sekwencji zasad
nukleinowych.
Mutacja punktowa
– zmiana pojedynczego
nukleotydu w DNA.
Może być to:
•tranzycja,
•transwersja,
•delecja lub insercja pojedynczego
nukleotydu.

Mutacje punktowe
•
Tranzycja
Tranzycja
–
zmiana prawidłowych
nukleotydów w DNA na inne w ramach
jednej grupy zasad azotowych (puryn
lub pirymidyn) - adeniny na guaninę, a
cytozyny na tyminę (i na odwrót).
•
Transwersja
Transwersja
–
mutacja genowa,
punktowa zmiana chemiczna w
obrębie nici DNA, w której zasada
purynowa ulega zamianie na
pirymidynową lub odwrotnie
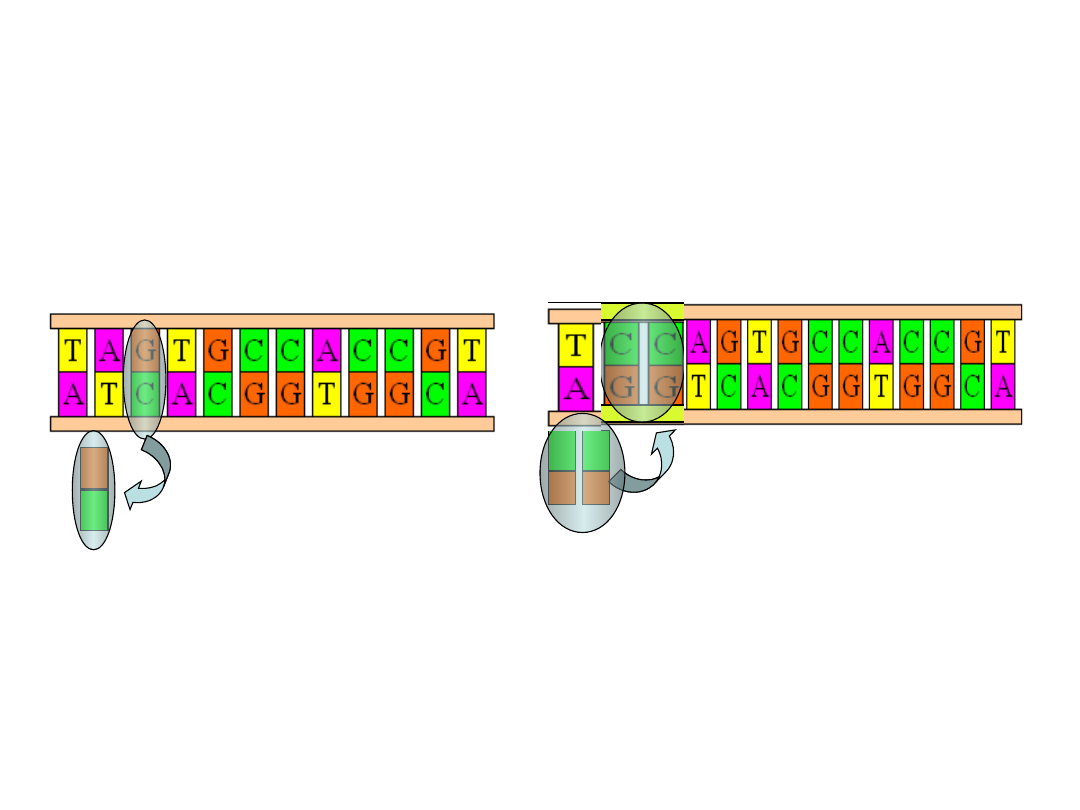
•
Delecja
Delecja – to jeden z typów (najczęściej
spontanicznej) mutacji genowej dotyczącej zmiany
składu nukleotydowego DNA.
Polega na utracie jednej lub kilku par nukleotydów z
DNA genowego.
•
Addycja
Addycja czyli
insercja
insercja – wbudowanie dodatkowej
pary nukleotydowej ( najczęściej spontaniczna
mutacja genu polegająca na wstawieniu krótkiej
dodatkowej sekwencji DNA w obrębie pojedynczego
genu albo wstawieniu dłuższego fragmentu
chromosomu).
G
C
G G
C
C

Powstają zarówno komórkach płciowych, jak innych komórkach
ciała (mutacje somatyczne).
Mutacje mogą być wywoływane przez
różne czynniki:
A). Samorzutne
– powstają spontanicznie bez wyraźnego udziału czynników
fizycznych lub chemicznych.
Najczęściej powstają na skutek przypadkowych błędów w
procesie replikacji DNA. Wynika to ze złożoności tego procesu.
W zależności od genu organizmu częstość genowych mutacji
samorzutnych wynosi od 1 na 10 tys. komórek do 1 na milion
B). Indukowane

B) Indukowane
powstają zarówno w przyrodzie jak i w
sztucznych warunkach laboratoriów przy udziale
czynnika fizycznego lub chemicznego.
Czynniki te nazywamy mutagennymi
(mutagenami):
Mutageny fizyczne
to:
- promieniowanie jonizujące
- promieniowanie rentgenowskie (promienie X)
- promieniowanie gamma wyzwalane w trakcie rozpadu
pierwiastków
- radioaktywnych
- promieniowanie UV
- wysoka temperatura ma wpływ na tempo reakcji i jakość
enzymów

Mutacje to fizyczne zmiany w genach
• Promieniowanie jonizujące
indukuje mutacje
– normalnie częstość mutacji
jest znikomo niska
– przez naświetlenie
promieniami X H.J. Muller
uzyskał w tydzień tyle
mutantów Drosophila, ile
wcześniej zidentyfikowano
przez 15 lat
– geny są zapisane w
cząsteczkach chemicznych
HJ Muller (1890-
1967)

Mutageny chemiczne
to:
specjalną ich grupę stanowią analogi puryn
i pirymidyn wywołujące mutacje przez włączenie
się do DNA w czasie jego replikacji;
- kwas azotawy; powoduje oksydacyjną
dezaminację grupy –C-NH2 zasady azotowej w
nukleotydach DNA i przekształcenie jej w –C=O
co doprowadza do zmiany C w U i A w G
- substancje zawarte w dymie papierosowym

Mogą być bardzo różnorodne. Biorąc jednak pod uwagę
ich bezkierunkowość, najczęściej ich efekty są
niekorzystne dla organizmu w którym zachodzą.
Ze względu na fenotypowy efekt (z punktu widzenia
określonej cechy) wyróżnia się:
niekorzystne
- powodują obniżenie zdolności organizmu do
przeżycia
obojętne
- nie wpływają na organizm; nie dają zmian wartości
adaptacyjnych osobnika. Mają one znaczenie dla procesów
ewolucyjnych
korzystne
- pojawia się względnie rzadko; poprawiają zdolności
adaptacyjne osobnika
letalne
- prowadzą do śmierci; ograniczają zdolność przeżycia
organizmu w każdych warunkach środowiskowych.
subletalne
- prowadzą do upośledzenia organizmu

Choroby genetyczne
Defekty w białkach enzymatycznych
•recesywne
•akumulacja substratu lub brak produktu
fenyloketonuria
•brak aktywności hydroksylazy
fenyloalaninowej
•1/15000 urodzeń
•nadmiar fenyloalaniny w ustroju
•leczenie przez stosowanie diety
fenyloalanina
tyrozyna
hydroksylaza
fenyloalanino
wa
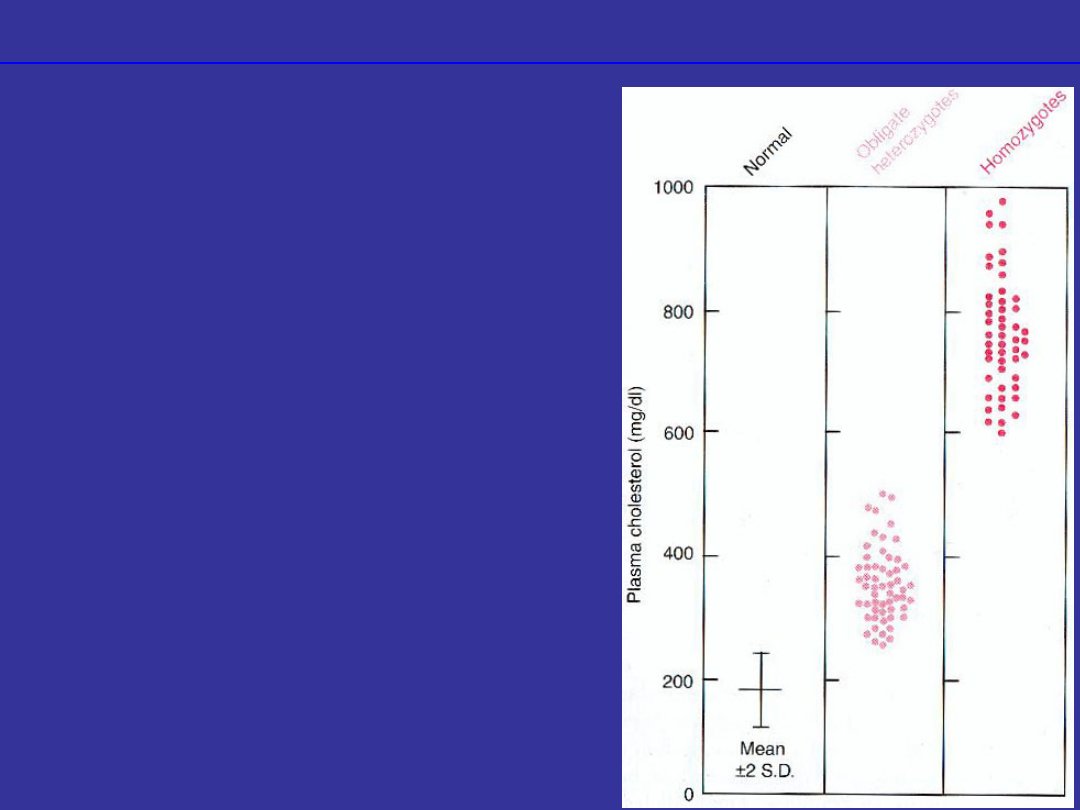
Defekty w białkach
receptorowych
•uszkodzenie białek
rozpoznających inne białka
rodzinna
hipercholesterolemia
•uszkodzenie receptora LDL
•niepełna dominacja,
heterozygoty 1/500 urodzeń
•nadmiar cholesterolu we
krwi
Choroby genetyczne
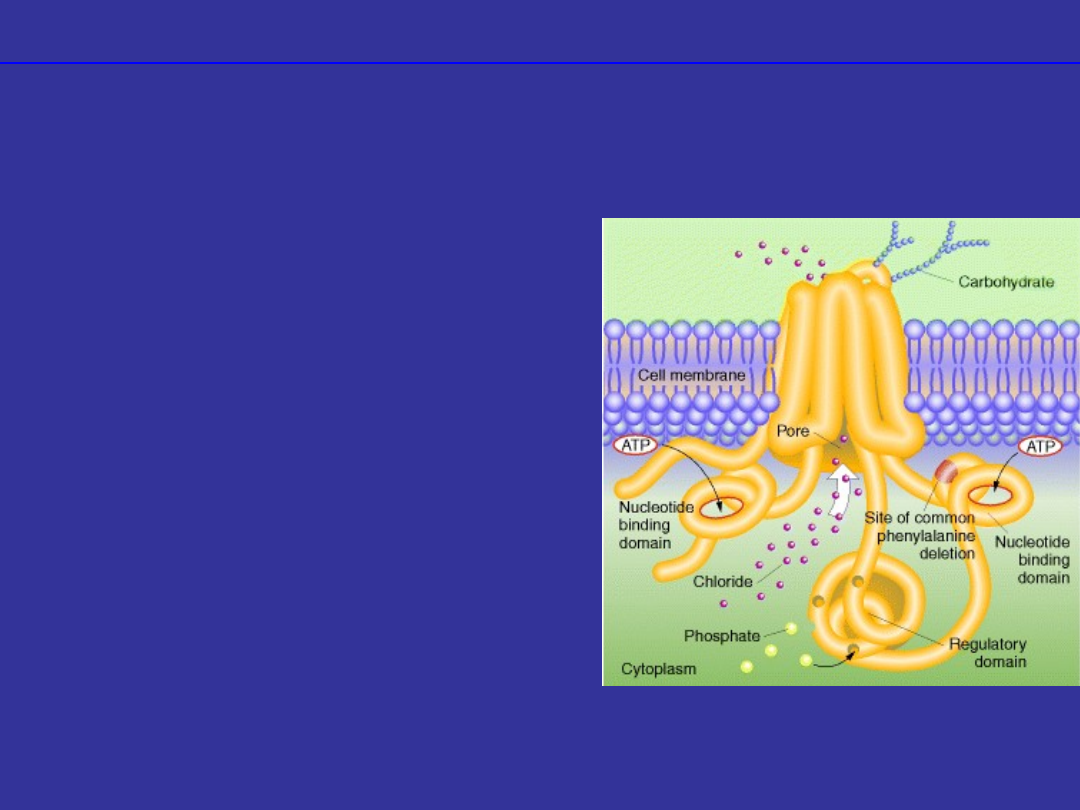
Defekty w białkach
transporterowych
•uszkodzenie białek
odpowiedzialnych za transport
transbłonowy
mukowiscydoza
•uszkodzenie transportera jonów
chlorkowych
•1/2500 urodzeń
•gromadzenie się gęstego śluzu
w płucach
Choroby genetyczne
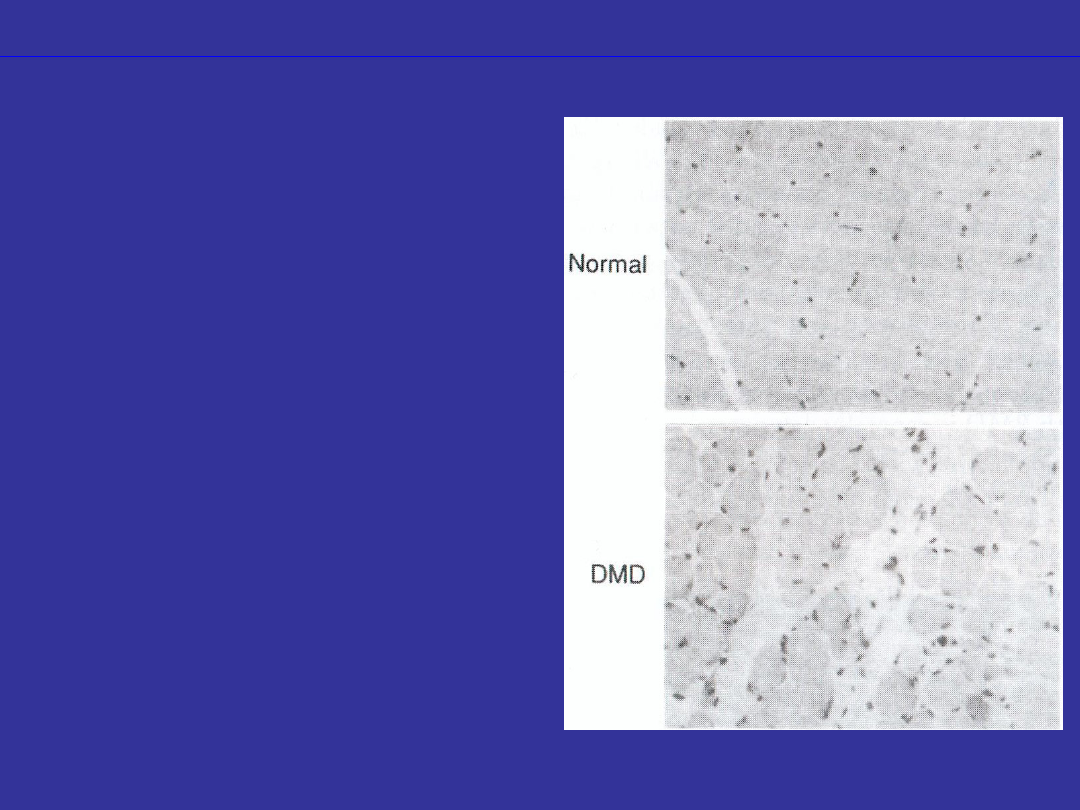
Defekty w białkach
strukturalnych
•uszkodzenie białek
odpowiedzialnych za
tworzenie struktur
biologiczych
dystrofia mięśniowa
•uszkodzenie białka
cytoszkieletu komórek
mięśniowych
•1/3000 urodzonych
chłopców
•powoduje zanik mięśni
Choroby genetyczne
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
Wyszukiwarka
Podobne podstrony:
2014 BPEG część 9 fałdowanie i modyfikacje białek
MODYFIKACJA bialek(1)
modyfikacje białek ptm1
7 Przedziały komórkowe biorące udział w procesie biosyntezy modyfikacji białek
Modyfikacja białek przez stres
modyfikacje potranslacyjne
Biotechnologiczna modyfikacja biologicznych wlasciwosci bialek zboz
Przykłady roli biologicznej białek
Właściwości fizykochemiczne białek
1 Przyswajanie białek przez organizmid 8658 ppt
właściwości białek mięśniowych
Budowa Chemiczna Białek
07 Modyfikacje struktury enzymówid 7062 ppt
Funkcje białek, Biochemia
19.Budowa białek, Notatki AWF, Biochemia
Amoniak można oznaczyć z krwi i moczu produkt rozkładu białek
Projektowanie nowych białek o zadanych właściwościach katalitycznych
więcej podobnych podstron