
Równowaga kwasowo -
zasadowa

Fizjologiczne pH krwi = 7,35 – 7,45
Bufor – układ: słaby kwas + jego anion
Równanie Hendersona – Hasselbacha
–
określa
zależność
pomiędzy
pH
płynów
ustrojowych a stałą dysocjacji kwasu, który wraz
ze swoim anionem stanowi bufor ustrojowy
pH buforu nie zależy od bezwzględnych stężeń
kwasu i jego anionu ale od
stosunku stężenia anionu do stężenia kwasu
pH buforu nie zmienia się po rozcieńczeniu

Istnieje stała tendencja do
zakwaszania organizmu:
Kwasy są dostarczane z pożywieniem
Kwasy – produkt końcowy metabolizmu białek,
lipidów i węglowodanów
CO
2
–
produkt
końcowy
metabolizmu
komórkowego
Kwasy
-
produkty
pośrednie
przemiany
węglowodanów w hipoksji (kwas mlekowy) oraz
tłuszczów
(hydroksymaślan,
acetooctan)
w
cukrzycy lub głodzeniu
Kwasy – produkty utleniania aminokwasów
zawierających siarkę (metionina) oraz fosfolipidów

Bufory krwi
Wodorowęglanowy – 53% poj. buforowej
Hemoglobinianowy – 35% poj. buforowej
Białczanowy – 7% poj. buforowej
Fosforanowy – 5% poj. buforowej

Bufor wodorowęglanowy
Bardzo
efektywny,
gdyż
H
2
CO
3
pozostaje
w
stanie
równowagi
ze
swoim
bezwodnikiem CO
2
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3-
800cz
1cz
0,03cz
0,03cz

Bufor wodorowęglanowy
c.d.
Głównym donorem H
+
jest w sposób
pośredni CO
2
rozpuszczony we krwi
Prawo Henriego – stężenie gazu
rozpuszczonego w cieczy jest wprost
proporcjonalne do ciśnienia gazu nad
cieczą, czyli CO
2
rozp pozostaje w stanie
równowagi
z
CO
2
z
powietrza
pęcherzyków płucnych
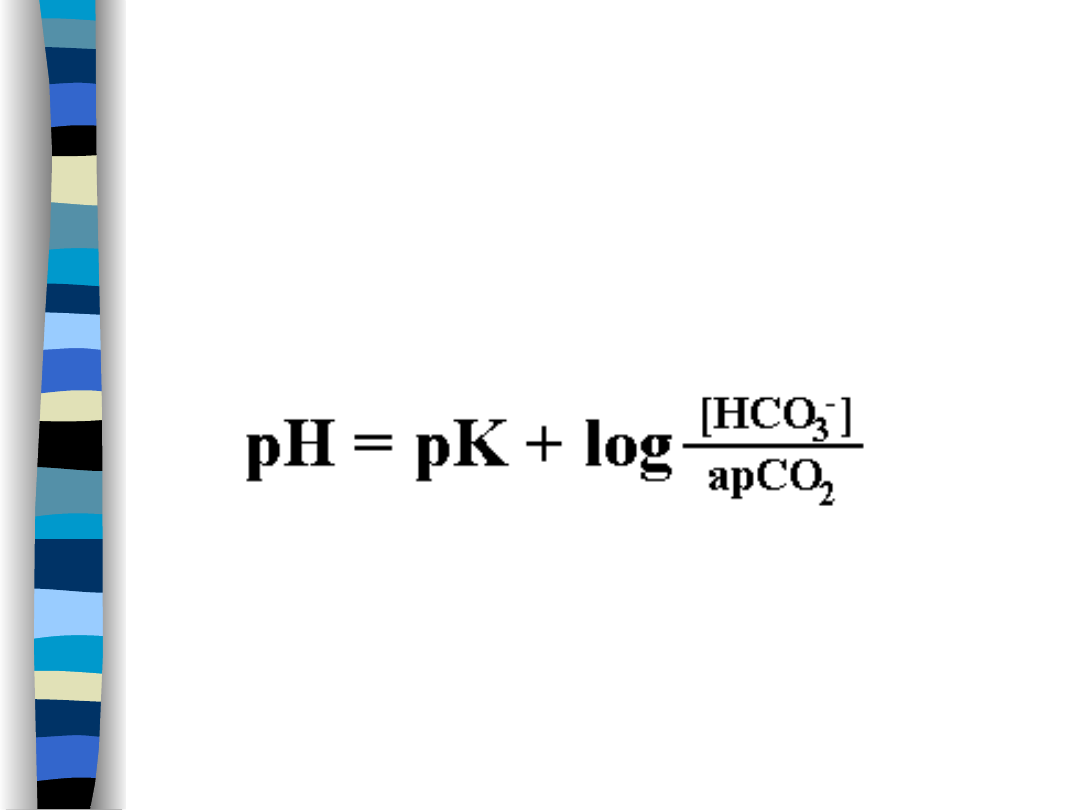
Bufor wodorowęglanowy
c.d.
Równanie Hendersona – Hasselbacha
dla tego buforu
pK = 6,1
a – współczynnik rozpuszczalności CO
2
; w
temp. 37
o
C = 0,03

Bufor wodorowęglanowy
c.d.
To równanie tłumaczy regulację pH we
krwi
w
zależności
od
zmian
metabolicznych i zmian oddechowych

Bufor białczanowy
W fizjologicznym pH osocza = 7,4
większość białek osoczowych jest
anionami (akceptorami H
+
)
Punkty izoelektryczne białek osocza
w pH = 4,9 – 6,4

Bufor hemoglobinianowy
Najważniejszy bufor białkowy krwi – Hb
stanowi prawie 75% całkowitego białka
krwi.
Hb ma charakter kwaśny – grupy
kwasowe
hemu
przeważają
nad
zasadowymi globiny. Stąd Hb ma duże
zdolności wiązania zasad.

Bufor hemoglobinianowy
Kwaśność Hb ulega wybitnej zmianie
w zależności od stopnia utlenowania
Hb utlenowana jest 40 – 70x silniejszym
kwasem niż odtlenowana, stąd Hb
odtlenowana jest lepszym akceptorem
H
+
niż utlenowana.

Rola płuc w regulacji RKZ
Spadek pH, wzrost pCO
2
Pobudzenie ośrodka oddechowego
Przyspieszenie i pogłębienie oddechów
Zwiększone usuwanie CO
2
drogą płuc

Rola przewodu
pokarmowego w regulacji
RKZ
Regulacja
zachodzi
poprzez
wywołanie
wymiotów
w
celu
usunięcia H
+
i Cl
-
Utrata Cl
-
pociąga za sobą wzrost
resorpcji HCO
3-
w nerkach
Ten
typ
buforowania
n.p.
u
pacjentów
z kwasicą ketonową

Rola układu kostnego w
regulacji RKZ
Największy magazyn zasad w organizmie
W procesy buforowania włącza się najpóźniej –
tygodnie, miesiące, lata
Podstawowy
czynnik
buforujący
–
hydroksyapatyt
Oddysocjowanie jednego jonu Ca
2+
wiąże się z
przyłączeniem 2xH
+
Długotrwałe
zakwaszenie
może
więc
prowadzić do patologicznych zmian w kośćcu,
demineralizacji,
czego
konsekwencją
są
złamania

Zaburzenia równowagi
kwasowo - zasadowej

Kwasica oddechowa
Skutek retencji CO
2
w organizmie
Wzrost pCO
2
, obniżenie pH, [HCO
3-
] bez
zmian
Przyczyny
1.
Uszkodzenie nerwowej regulacji oddychania
Choroby OUN, urazy - uszkodzenie ośrodka
oddechowego
Uszkodzenie unerwienia mięśni oddechowych
(toksyny: jad kiełbasiany, kurara)

Kwasica oddechowa
2.
Ograniczenie
ruchomości
klatki
piersiowej
Zmiany w strukturze kostnej klatki
piersiowej (pourazowe, stany zapalne)
Nadmierna otyłość
Upośledzenie
czynności
mięśni
oddechowych (zanik mięśni, skurcz
tężcowy)

Kwasica oddechowa -
przyczyny
3.
Choroby płuc lub opłucnej
Obrzęk płuc, nacieki nowotworowe
4.
Ostra lub przewlekła niewydolność
mięśnia sercowego
5.
Niedostateczne oddychanie sztuczne
lub stosowanie mieszanek gazowych o
dużej zawartości CO
2
Kwasica oddechowa
Ostra
– znaczne
zmiany pH, gdyż
gromadzący się
CO
2
może być
buforowany tylko
przez bufory
wewnątrzkomórk
owe
Przewlekła
-stosunkowo
często występuje
w przewlekłym
zapaleniu oskrzeli
i rozedmie płuc
u palaczy

Kwasica oddechowa –
mechanizmy obronne
Buforowanie chemiczne
Hamowanie glikolizy i cyklu Krebsa
Kompensacja nerkowa – po 2-3 dniach
Hamowanie
glikolizy,
wzrost
glukoneogenezy
Postępowanie terapeutyczne –
poprawa wentylacji płucnej

Zasadowica oddechowa
Efekt
zwiększonej
wentylacji
przy
prawidłowym
wytwarzaniu
CO
2
w
tkankach
Zmniejszenie pCO
2
, wzrost pH, [HCO
3-
]
w normie
Przyczyny
1.
Hiperwentylacja psychogenna – silne
bodźce nerwowe, np. ból, histeria
2.
Urazy lub zmiany chorobowe w obrębie
OUN: gorączka, egzo- lub endotoksyny
(np. w śpiączce wątrobowej), nowotwory

Zasadowica oddechowa
3.
Hipoksja o różnym pochodzeniu
Obniżenie pCO
2
w otoczeniu
W przebiegu przewlekłych chorób
płuc
4.
Posocznica, zatrucie salicylanami
5.
Mechaniczna hiperwentylacja bez
kontroli pO
2
i pCO
2
we krwi

Mechanizmy kompensacji
Buforowanie chemiczne
Buforowanie nerkowe
Zmniejszenie resorpcji HCO
3-
(wzrost
resorpcji Cl
-
)
Zahamowanie
amoniogenezy
i
tworzenia
kwaśności
miareczkowej
moczu

Objawy zasadowicy
oddechowej
Na skutek zwężenia naczyń mózgowych
–
zawroty
głowy,
zaburzenia
świadomości, osłabienie, niepokój

Kwasica metaboliczna
Spadek [HCO
3-
], spadek pH, pCO
2
w
normie

Przyczyny kwasicy
metabolicznej
1.
Zwiększone wytwarzanie lub podaż
z zewnątrz nadmiernej ilości kwasów
przewyższająca możliwości buforowania
i wydzielania
Ciała ketonowe
Mleczany
Salicylany
Metanol, glikol etylenowy
Kwasica mocznicowa

Kwasica metaboliczna -
kompensacja
Hiperwentylacja
Bufory komórkowe
Po kilku tygodniach włącza się układ
kostny

Kwasica ketonowa
Występuje
w
stanach
głodzenia,
niewyrównanej cukrzycy
Wytwarzane
są
nielotne
kwasy:
acetooctowy,
β-hydroksymasłowy
i
aceton
Buforowanie przez HCO
3-
powoduje
stopniowe
wyczerpywanie
zasobów
tego buforu

Zaburzenia RKZ w
zatruciach metanolem i
glikolem etylenowym
Produkty ich metabolizmu mają charakter
kwaśny – kwasica metaboliczna
Przemiany glikolu jak i metanolu zużywają
znaczne ilości NAD
+
. Wzrost stosunku
NADH/NAD
+
prowadzi do zahamowania
glukoneogenezy i akumulacji mleczanu –
kwasica mleczanowa

Zaburzenia RKZ w
zatruciach salicylanami
Kwas
salicylowy,
kwas
acetylosalicylowy, salicylamid, salicylan
sodu

Objawy kliniczne zatrucia
salicylanami
Zartucia lekkie i średnie: nudności,
wymioty, hiperwentylacja, pocenie się,
tachykardia
Zatrucia ostre: j.w. + utrata
przytomności, drgawki, zatrzymanie
akcji serca

Salicylany
Pobudzają ośrodek oddechowy co prowadzi
do hiperwentylacji i alkalozy oddechowej
Zaburzają proces fosforylacji oksydacyjnej
pirogronianu – kwasica mleczanowa
Kwas salicylowy hamuje karboksylazę
pirogronianową
–
zahamowanie
glukoneogenezy
Kwasica metaboliczna jest dodatkowo
wzmacniana przez stymulację glikolizy w
komórkach przez zasadowicę oddechową
Nasilają ketogenezę

Następstwa kwasicy
Hiperkaliemia na skutek kompensacji
komórkowej – ryzyko zatrzymania akcji
serca w rozkurczu
Wpływ na powinowactwo hemoglobiny
do tlenu

Zasadowica metaboliczna
Wzrost pH, na skutek zwiększenia
stężenia HCO
3-
, pCO
2
bez zmian
Buforowanie – układ oddechowy

Zazwyczaj dwa mechanizmy
patogenetyczne
1.
Inicjujący zasadowicę
Nadmierna utrata H+
lub
Nadmierna retencja HCO
3-
2.
Podtrzymujący
(hamujący
wyrównywanie
zaburzeń)
–
w
odpowiedzi na niedobór w ECF H
+
,
KCl, NaCl

Mechanizmy inicjujące
zasadowicę metaboliczną
Utrata H
+
z organizmu: wymioty, leki
moczopędne (furosemid)
Nadmierna
podaż
zasad:
NaHCO
3
,
cytrynian sodu, CaCO
3
Hipokaliemia – powoduje transport H
+
do
komórek, K
+
przechodzi do ECF
Nadczynność
kory
nadnerczy
–
aldosteron powoduje resorpcję zwrotną
Na
+
i HCO
3-
oraz utratę H
+
i K
+
z moczem

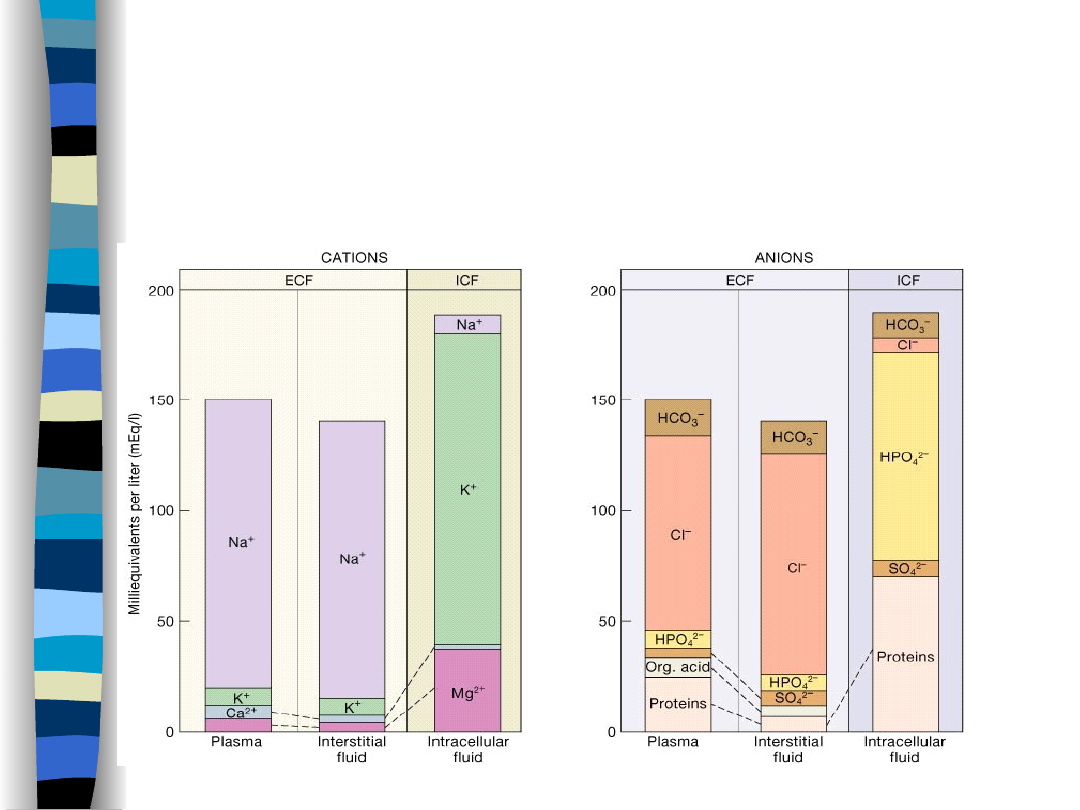
Gospodarka wodno -
elektrolitowa

Całkowita woda organizmu stanowi:
Mężczyźni – 60% m.c.
Kobiety 50% m.c.
Niemowlęta 75% m.c.
i jest uzależniona od:
Płci
Wieku
Poziomu tkanki tłuszczowej
Całkowita woda organizmu
(ok. 60% m.c.)
wewnątrzkomórkowa
(40% m.c.)
zewnątrzkomórkowa
(20% m.c.)
transkomórkowa
(1-3% m.c.)
wewnątrznaczyn.
(2% m.c.)
pozanaczyniowa
(38% m.c)
osocze
(5% m.c.)
płyn tkankowy
(śródmiąższowy)
limfa
(15% m.c.)
Skład elektrolitowy
przestrzeni wodnych
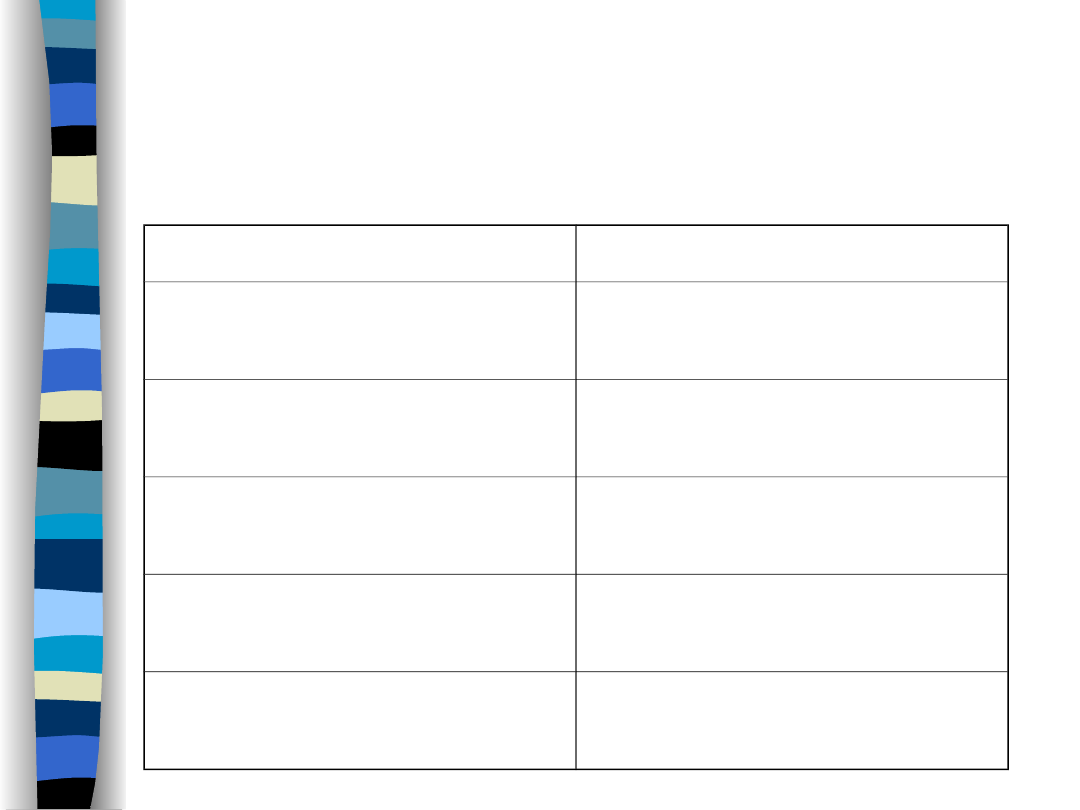
Dobowy bilans wodny
Wydalanie
Pobieranie
Przez skórę 400
ml
Z płynami 1500
ml
Przez płuca 500
ml
Z pokarmem 800
ml
Z moczem 1500
ml
Woda oksyd. 250
ml
Z kałem 150
ml
Razem 2550
ml
Razem 2550
ml

Regulacja bilansu
wodnego

Mechanizmy utrzymujące
izowolemię
Nerwowy – mechanizm pragnienia
Układ RAA
Przedsionkowy peptyd natriuretyczny
ANP
Wazopresyna

Ośrodek
pragnienia
–
okolica
nadwzrokowa podwzgórza
Pobudzenie ośrodka pragnienia poprzez:
Wzrost ciśnienia osmotycznego ECF
(odwodnienie
komórek
ośrodka
pragnienia; progowa wartość ciśnienia
osm. 295 mOsm/ kg)
Zmniejszenie objętości ECF – utrata ECF
bez zmian osmolalności; pobudzenie
ośrodka pragnienia przez angiotensynę II
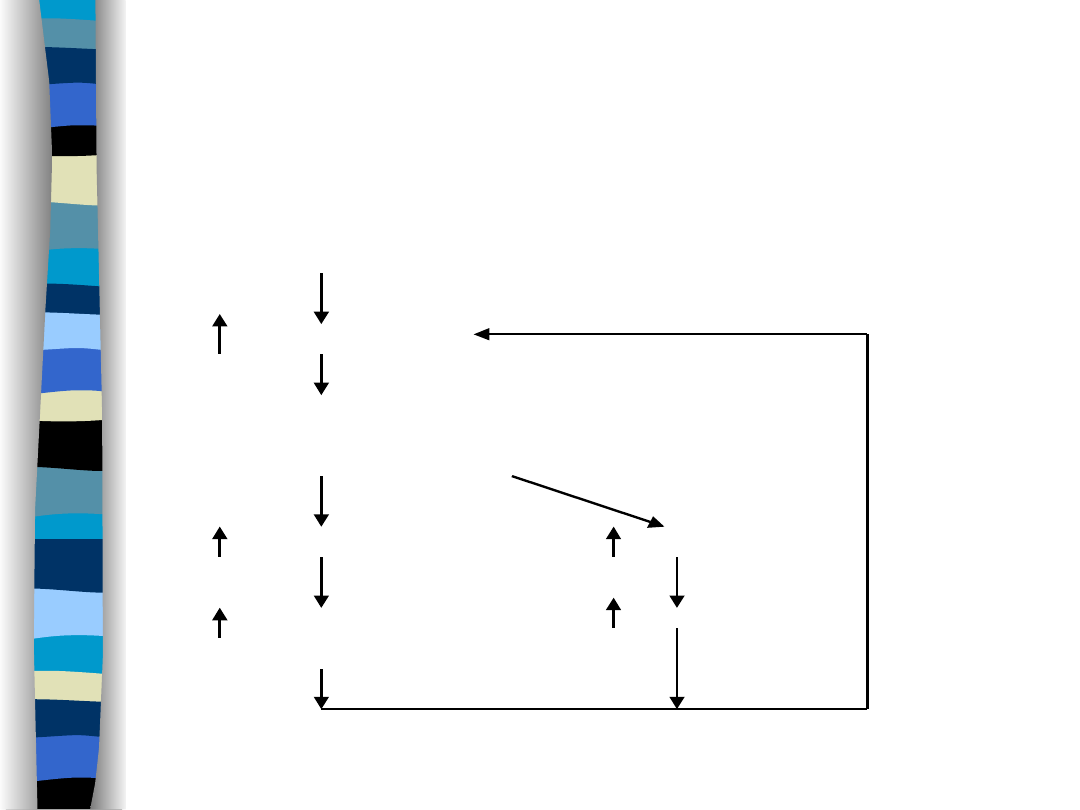
Mechanizm
wazopresynowy
Niedobór wody
(-)
osmolalność ECF
niedobór wody
w komórkach
osmoreceptorowych
wydzielanie ADH
pragnienie
wchłanianie wody –
pobór wody
kanalik dystalny
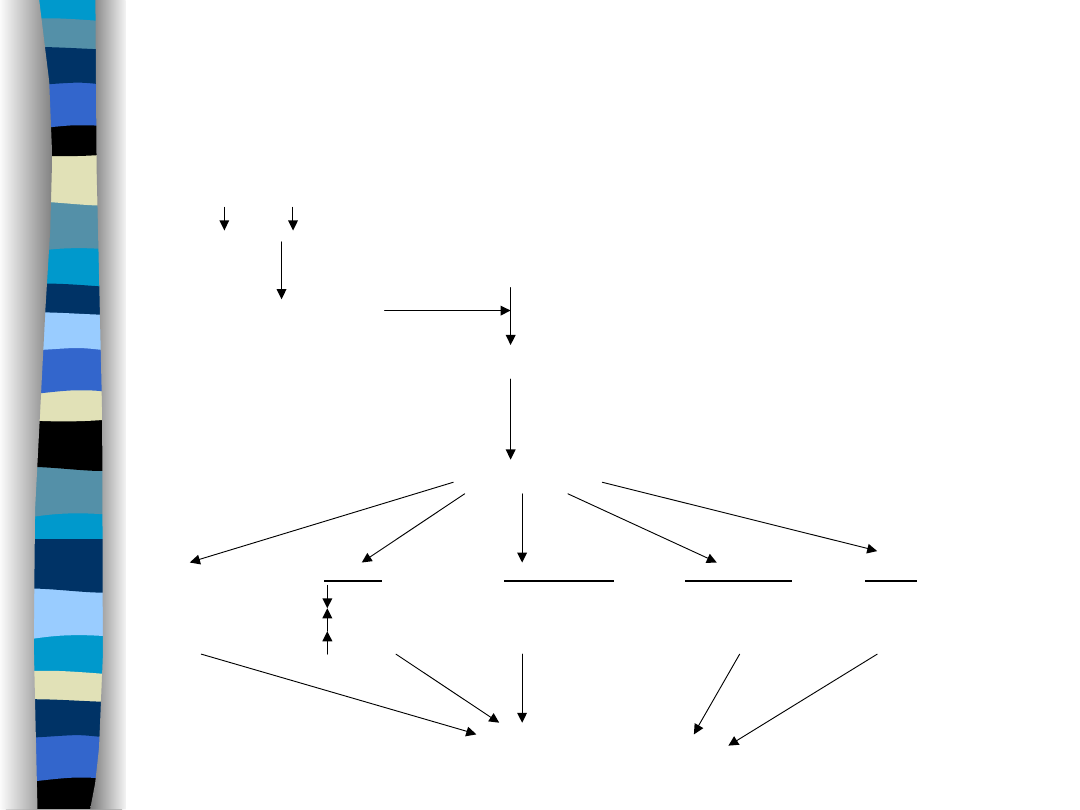
Na+, RR
angiotensynogen
sekrecja reniny
angiotensyna I
angiotensyna II
skurcz
Nerki:
Nadnercza:
Przysadka:
OUN:
obwodowych
GFR
stymulacja
stymulacja
stymulacja
naczyń
resorpcja Na+
sekrecji
sekrecji
ośrodka
krwionośnych
ukrwienie nerki aldosteronu
wazopresyny
pragnienia
wzrost objętości ECF
nasilenie przepływu krwi przez nerki
Układ RAA

Przedsionkowy peptyd
natriuretyczny (ANP)
Nasila natriurezę i diurezę
Hamuje układ RAA
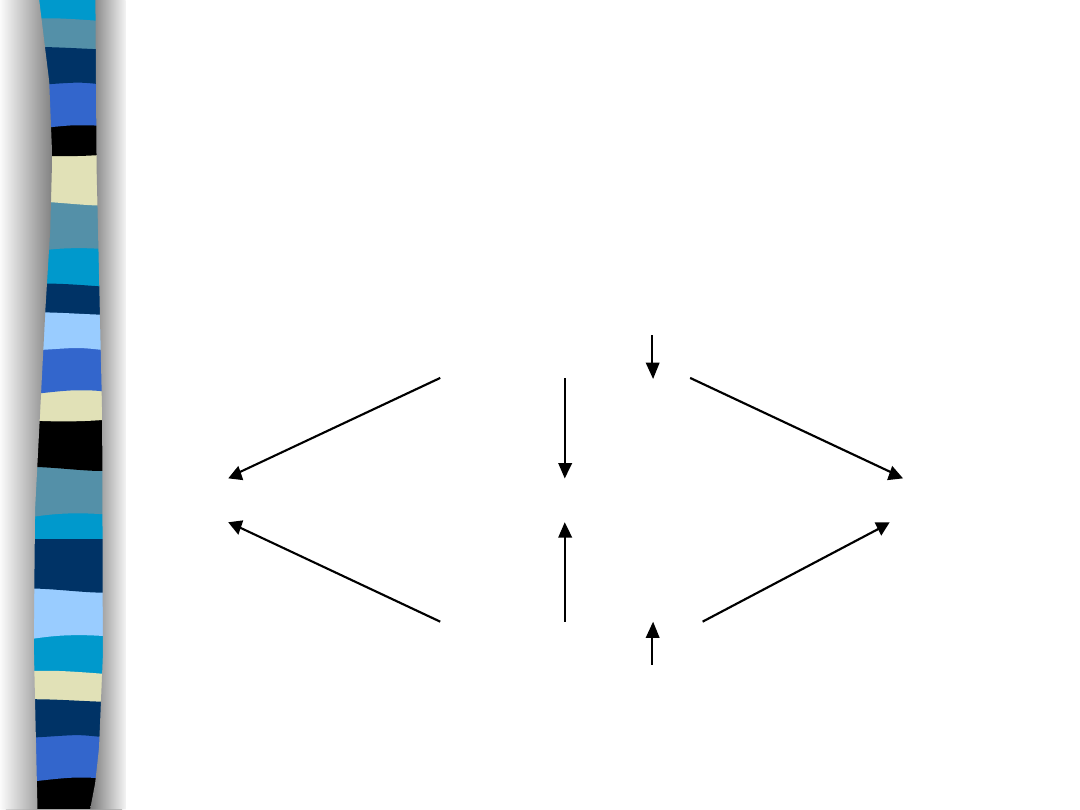
Podział zaburzeń
gospodarki wodnej
Odwodnienie ( ECF)
hipotoniczne
izotoniczne
hipertoniczne
Przewodnienie ( ECF)
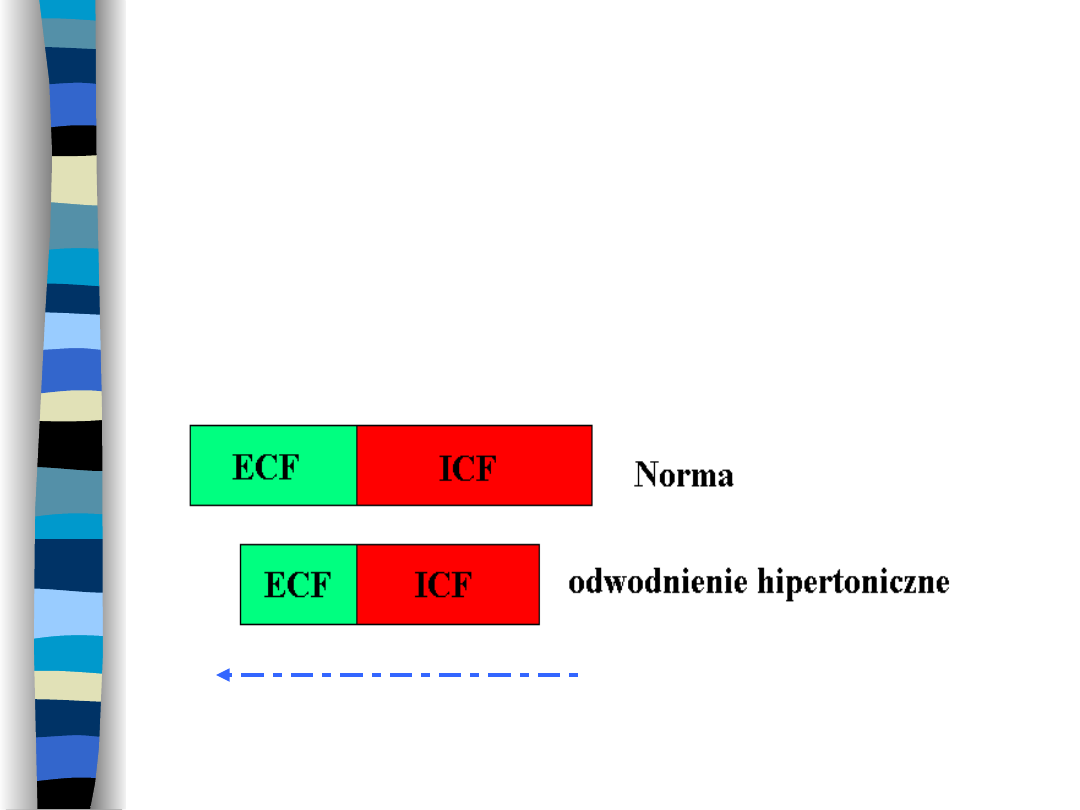
Odwodnienie
hipertoniczne
Wynik utraty czystej wody z przestrzeni
ECF
Ruch H
2
O

Przyczyny odwodnienia
hipertonicznego
1.
Zmniejszone spożycie wody:
Osłabienie
lub
brak
uczucia
pragnienia (osoby nieprzytomne, po
urazach czaszki, niemowlęta)
Niewystarczająca
podaż
płynów
(braki wody w otoczeniu, chorzy
karmieni sondą)

Przyczyny odwodnienia
hipertonicznego c.d.
2. Nadmierna utrata wody i płynów
hipotonicznych:
Nadmierne pocenie się
Hiperwentylacja
Wielomocz po ostrej niewydolności
nerek
Moczówka prosta
Wzmożona diureza osmotyczna (np. w
cukrzycy)
Biegunki
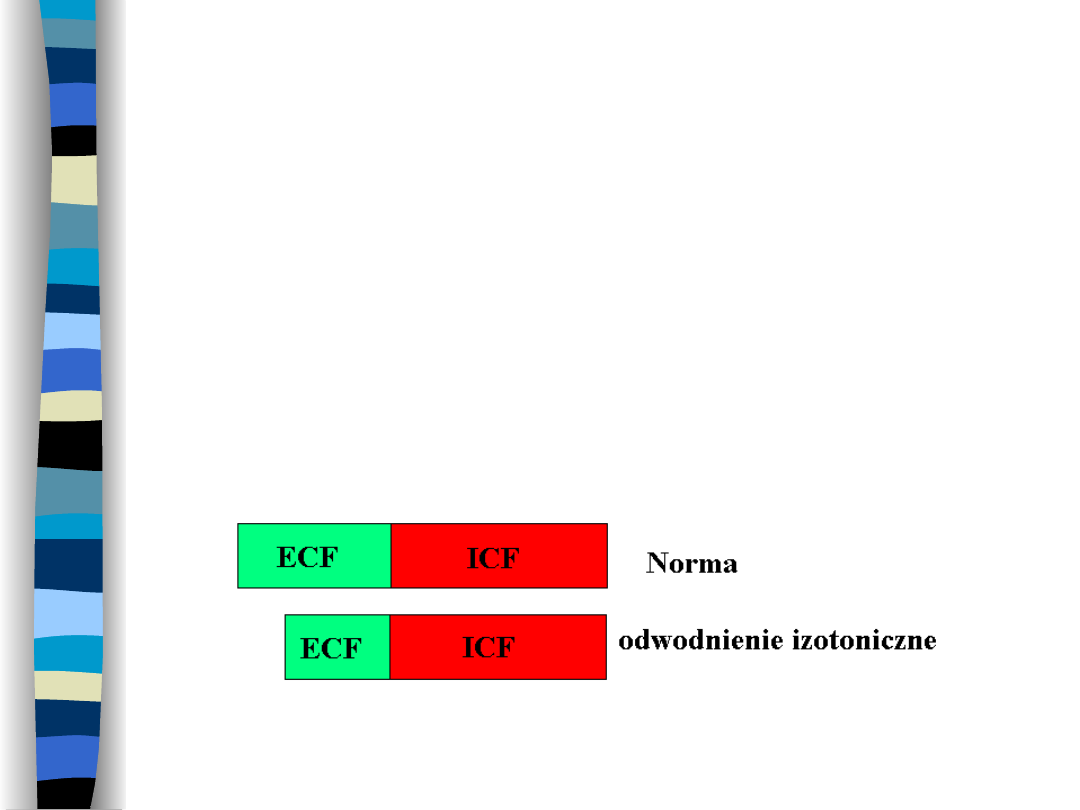
Odwodnienie izotoniczne
Wynik utraty płynów o molalności
normalnej dla ECF
Zmniejsza się objętość ECF, ICF w
normie, osmolalność obu przestrzenie
nie zmienia się

Przyczyny odwodnienia
izotonicznego
Krwotoki – utrata pełnej krwi
Utrata osocza – oparzenia, zapalenie błon
surowiczych, zapalenie trzustki, udar
cieplny)
Wymioty, biegunki, przetoki przewodu
pokarmowego
Leki moczopędne
Przemieszczanie się płynów do przestrzeni
transcelularnej (np. w niedrożności jelit)
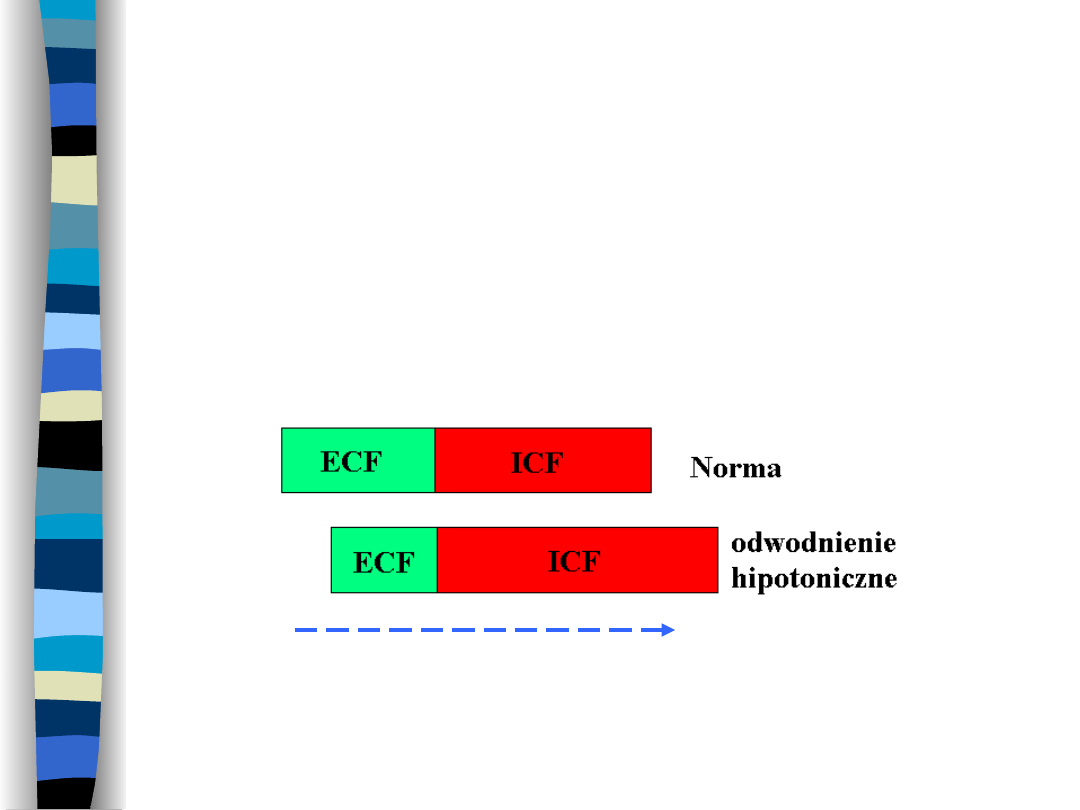
Odwodnienie hipotoniczne
Spowodowane
jest
utratą
płynów
hipertonicznych z przestrzeni ECF
Ruch
H
2
O

Przyczyny odwodnienia
hipotonicznego
1.
Utrata sodu wraz z wodą przez nerki,
skórę lub przewód pokarmowy
Przewlekła niewydolność nerek
Wielomocz po ostrej niewydolności nerek
Niedoczynność kory nadnerczy
(hipoaldosteronizm)
Leki moczopędne
Biegunki, wymioty, nadmierne pocenie się
2.
Niedostateczna podaż sodu

Z powodu hipotonii ECF
i przewodnienia komórek chorzy
z odwodnieniem hipotonicznym
nie odczuwają pragnienia

Objawy wspólne dla
wszystkich rodzajów
odwodnień
Zmniejszenie objętości krwi krążącej
Osłabienie filtracji kłębuszkowej – oliguria
(już przy utracie wody stanowiącej 2% m.c.)
Objawy sercowo – naczyniowe – przy
utracie wody 4 – 6% m.c.: zmniejszenie
pojemności wyrzutowej serca, spadek
ciśnienia tętniczego, tachykardia, wzrost
oporu
naczyniowego,
hipotonia
ortostatyczna, omdlenia

Objawy wspólne dla
wszystkich rodzajów
odwodnień c.d.
Obniżenie napięcia tkankowego –
miękkość
gałek
ocznych,
brak
wygładzania się skóry ujętej w fałd
Zaburzenia ze strony OUN – bóle
i zawroty głowy, znużenie, utrata
świadomości, śpiączka

Odwodnienie ciężkie – utrata wody w
ilości ok. 14% m.c. – śmierć na skutek
braku wypełniania naczyń krwionośnych.
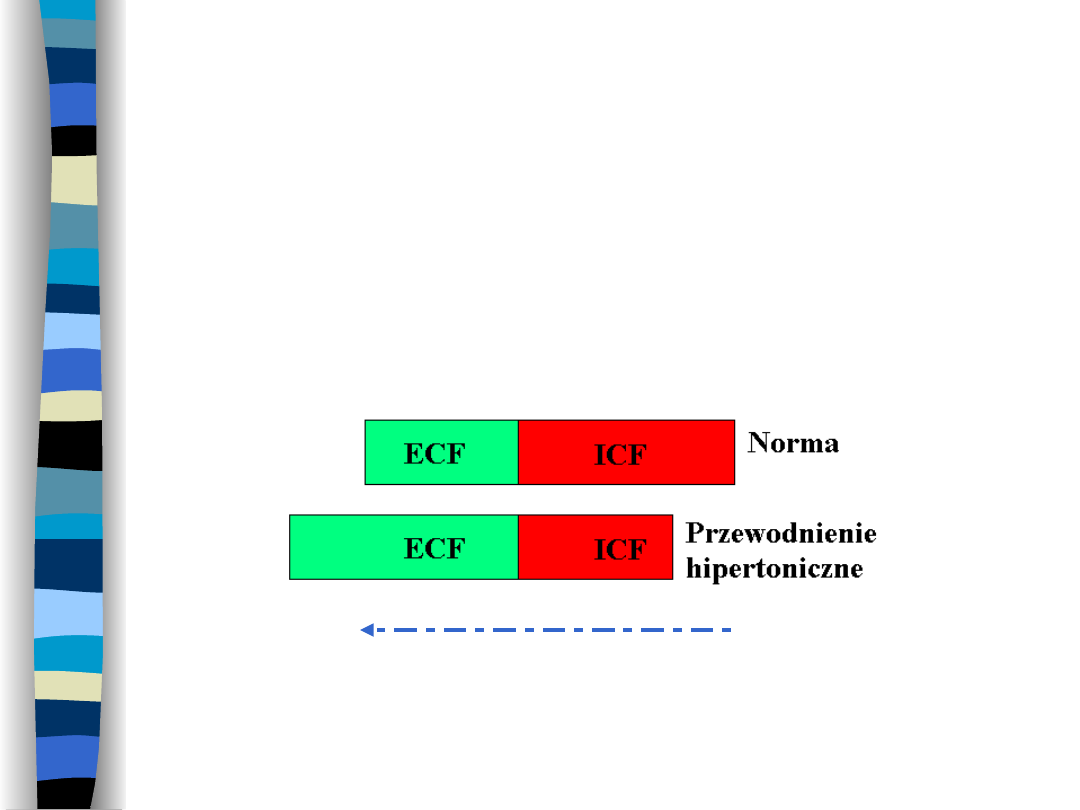
Przewodnienie
hipertoniczne
Wzrost objętości ECF, zmniejszenie
objętości ICF
Ruch H
2
O

Przyczyny przewodnienia
hipertonicznego
1.
Nadmierna podaż sodu – spożywanie
słonych
potraw
przez
osoby
z
niewydolnością nerek, nadczynnością
kory nadnerczy; pozajelitowa podaż
płynów hipertonicznych u chorych po
zabiegach
chirurgicznych
gdy
dochodzi do wzrostu wydzielania
wazopresyny i zmniejszenia diurezy
2.
Retencja sodu w organizmie

Objawy przewodnienia
hipertonicznego
Obrzęki
Zwiększone ciśnienie żylne
Ciśnienie tętnicze prawidłowe lub
nieznacznie podwyższone
Niewydolność lewokomorowa
Stany zastoinowe w płucach, duszność,
przyspieszenie i pogłębienie oddechów

Objawy przewodnienia
hipertonicznego c.d.
Podwyższenie temperatury ciała
Niepokój,
uczucie pragnienia
; przy
znacznym
przewodnieniu
senność,
zaburzenia świadomości
Hipernatremia,
hiperosmia,
zmniejszenie
stężenia
białka
całkowitego,
zmniejszenie
liczby
erytrocytów
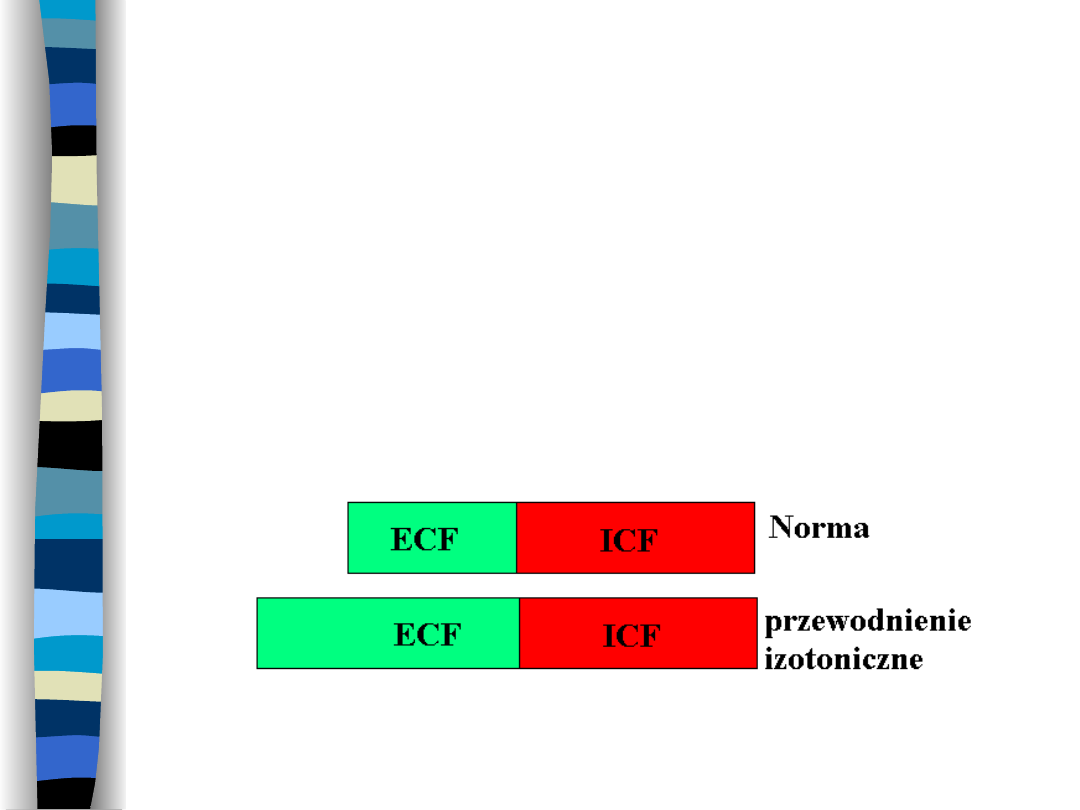
Przewodnienie izotoniczne
Dochodzi do nagromadzenia się płynu
izotonicznego w ECF bez zmian
osmolalności ECF i objętości ICF

Przyczyny przewodnienia
izotonicznego
Przewlekła niewydolność nerek
Zespół nerczycowy
Marskość wątroby
Ostre kłębuszkowe zapalenie nerek
Choroba głodowa
Nadczynność kory nadnerczy

Główny objaw przewodnienia
izotonicznego to
obrzęki o
charakterze uogólnionym
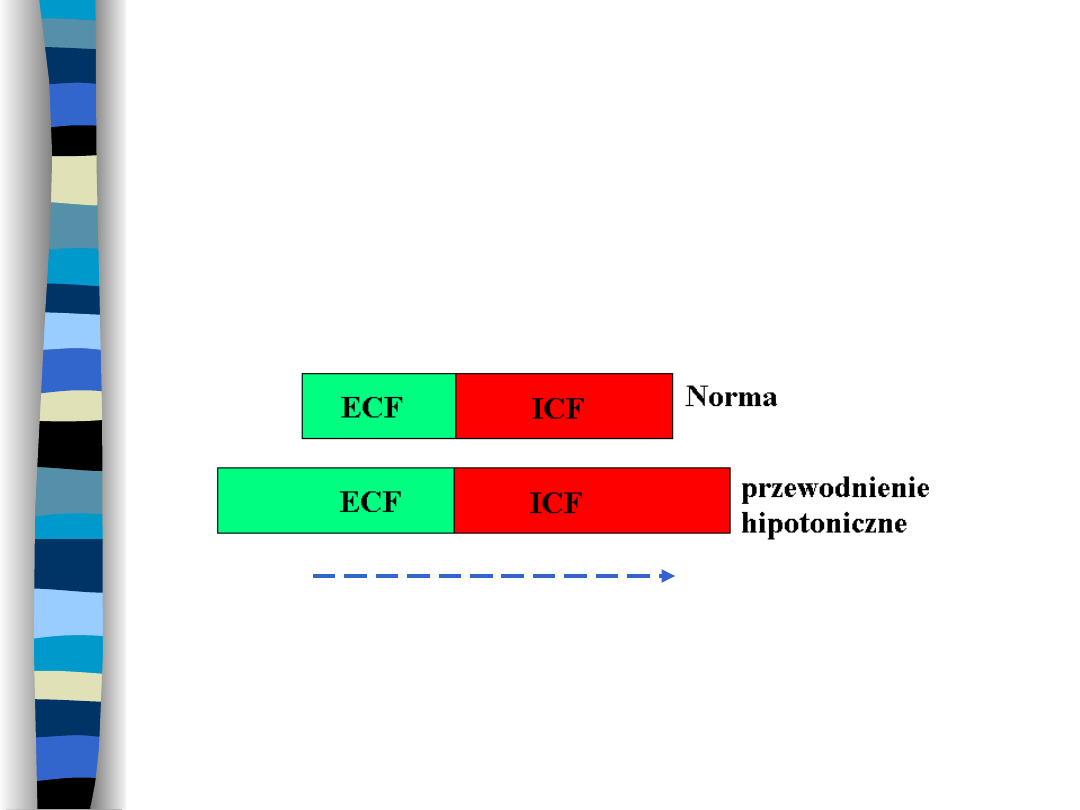
Przewodnienie
hipotoniczne (zatrucie
wodne)
Wzrost objętości przestrzeni ECF i ICF
Ruch H
2
O

Przyczyny przewodnienia
hipotonicznego
Nadmierna retencja wody w ECF na
skutek podaży płynów bezelektrolitowych
drogą doustną lub pozajelitową chorym,
u
których
wydalanie
wody
jest
upośledzone
(stany
pooperacyjne,
choroby nerek, wątroby, niewydolność
kory nadnerczy, osoby niedożywione)
Reakcje stresowe – bodziec do wydzielania ADH
Masywne płukanie żołądka wodą
Zespół Schwartza - Bartera

Przewodnienie
hipotoniczne
Kluczowe są objawy mózgowe –
związane
z
obrzękiem
komórek
mózgowych:
nudności,
wymioty,
drgawki, stany splątania, śpiączka

Zaburzenia gospodarki
elektrolitowej

Sód
Główny
kation
przestrzeni
zewnątrzkomórkowej; [Na
+
]
ECF
= 135 – 145
mmol/l
Zawartość w organizmie – 58 – 60 mmol/kg
m.c.
91% tej ilości w ECF
Sód
Dobowe spożycie
2,5 – 15 g
Wchłanianie:
dwunastnica i
jelito cienkie
Dobowe
zapotrzebowanie
~1 g
Wydalanie:
Nerki 95%
Przewód
pokarmowy
4,5%
Skóra 0,5%

Hiponatremia
1.
Nasilona utrata sodu i wody z organizmu
Przez
skórę
- obfite pocenie się,
niewyczuwalne parowanie
Przez
przewód pokarmowy
- wymioty
i biegunki
Drogą
nerek
- faza diuretyczna w ostrej
niewydolności
nerek,
poliuria
w
przewlekłej niewydolności nerek, leki
moczopędne, zapalenie nerek z utratą
soli
(wybiórcze
uszkodzenie
mechanizmów
odpowiedzialnych
za
resorpcję sodu)

Hiponatremia
2.
Utrata
sodu
przy
prawidłowym
uwodnieniu
Niedoczynność kory nadnerczy
3.
Retencja
wody
w
organizmie
– hiponatremia z rozcieńczenia
Zespół Schwartza – Bartera (SIADH)

Hiponatremia – objawy
kliniczne
Zależą głównie od wzrostu objętości
przestrzeni wewnątrzkomórkowej oraz
zaburzeń w składzie i metabolizmie
komórek
Najważniejsze
są
zaburzenia
neurologiczne skojarzone z obrzękiem
mózgu

Hiponatremia – objawy
kliniczne
135 – 125 mmol/l
Na ogół bez objawów neurologicznych
Brak apetytu, nudności, osłabienie
125 – 110 mmol/l
Bóle głowy, splątanie, senność lub
pobudzenie
< 110 mmol/l
Drgawki, śpiączka

Hipernatremia
Utrata płynów hipotonicznych przez
przewód
pokarmowy,
skórę,
nerki
(moczówka prosta), hiperwentylacja
Nadmierna podaż sodu, np. NaHCO
3
,
spożywanie pokarmów słonych w dużych
ilościach, chorzy dializowani płynem
bogatosodowym
Nieadekwatna podaż wody (dzieci,
obłożnie chorzy)
Hipertoniczność
zależna
od
hiperglikemii

Objawy kliniczne
hipernatremii
Wynikają
przede
wszystkim
z
odwodnienia komórek
Zależą
od
szybkości
narastania
hipernatremii

Objawy kliniczne
hipernatremii
Hipernatremia rzędu 160 mmol/l
narastająca powoli
Zwiększenie
pobudliwości
nerwowej,
wzmożenie
odruchów
ścięgnistych
i
napięcia mięśni szkieletowych, skurcze
mięśni, drgawki
Hipernatremia 170 mmol/l
Zaburzenia orientacji, wysoka gorączka,
drgawki, śpiączka

Potas
Występuje w ilości ok. 50 mmol/kg m.c.
3% tej ilości w ECF, 97% w ICF
Stężenie K+ w osoczu – 3,6 – 5,5
mmol/l
Stężenie K+ w ICF – 130 –150 mmol/l

Potas
Dobowe zapotrzebowanie na potas
wynosi 75 – 100 mmol
Wchłanianie potasu głównie w górnym
odcinku jelita cienkiego
Wnikanie potasu do komórek odbywa
się wbrew gradientowi stężeń na
zasadzie transportu aktywnego

Wydalanie potasu
85 – 90% drogą nerek
10 – 15% z kałem
5% - z potem

Hipokaliemia [K
+
]<3,6
mmol/l
1.
Niedostateczna podaż w pożywieniu
2.
Utrata drogą nerek
Hiperaldosteronizm pierwotny i wtórny
Zespół Cushinga
Terapia sterydami nadnerczowymi
Diureza osmotyczna, tiazydy moczopędne
Wielomocz po ostrej niewydolności nerek
Kwasica kanalikowa typu I i II
Hipokaliemia [K
+
]<3,6
mmol/l
3.
Utrata przez
przewód pokarmowy
Uporczywe wymioty
Biegunki
Przetoki jelitowe
Wrzodziejące
zapalenie jelit
Zespół złego
wchłaniania
Stężenie potasu w:
Ślina – 15 – 25
mmol
Sok żołądkowy 5-
20 mmol
Sok jelitowy 5 –
15 mmol
Żółć – podobne do
osocza

Hipokaliemia [K
+
]<3,6
mmol/l
4.
Redystrybucja
Zasadowica – wzrost pH o 0,1 to
obniżenie [K+] o 0,3 – 0,9 mmol/l
(średnio 0,6 mmol/l)
Wzrost sekrecji/ podaży insuliny

Objawy kliniczne hipokaliemii gdy [K
+
]
< 2,5 mmol/l
OUN: senność, apatia, czasem pobudzenie
Osłabienie
siły
mięśniowej,
uczucie
zmęczenia, niedowłady mięśni, osłabienie
odruchów ścięgnistych
Ze strony serca: tachykardia, zmniejszenie
siły skurczów i pojemności wyrzutowej
komór, zmiany w EKG (arytmia, spłaszczenie
fali T, obniżenie odcinka ST, wykształcenie
się fali U)
Nieprawidłowa motoryka jelit: wzdęcia,
zaparcia, porażenny niedowład jelit

Hiperkaliemia [K+] > 5,5
mmol/l
1.
Zaburzenia czynności nerek
Ostra i przewlekła niewydolność nerek
Mocznica
Kwasica kanalikowa typu IV
2.
Hipoaldosteronizm
3.
Masywny rozpad komórek (po oparzeniach,
zmiażdżeniach, w ostrym zapaleniu trzustki)
4.
Szybkie przetoczenie krwi konserwowanej
– podczas przechowywania erytrocytów uwalnia się
z nich potas
5.
Nadmierna podaż z płynami infuzyjnymi, lekami (K-
penicylina), płynami dializacyjnymi

Hiperkaliemia [K+] > 5,5
mmol/l
6.
Redystrybucja w kwasicy
7.
Rzekoma (hemoliza próbki, ucisk stazy)

Objawy kliniczne
hiperkaliemii
1.
Zaburzenia czynności mięśnia sercowego
[K+] > 7,5 mmol/l – zwolnienie czynności
serca, występują skurcze dodatkowe
[K+] = 9 mmol/l – migotanie komór;
zatrzymanie akcji serca
2.
Zaburzenie
przewodzenia
impulsów
w układzie nerwowym: parestezje, apatia,
senność, śpiączka

Objawy kliniczne
hiperkaliemii
3.
Ze strony układu mięśniowego
Osłabienie siły mięśniowej
Skurcze
Porażenie mięśni, w tym oddechowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
Wyszukiwarka
Podobne podstrony:
Równowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot2 2
Rownowaga kwasowo zasadowa fizjot lic
Rownowaga kwasowo zasadowa fizjot2
Rownowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot3
Rownowaga kwasowo zasadowa fizjot lic ppt
Równowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot3
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
więcej podobnych podstron