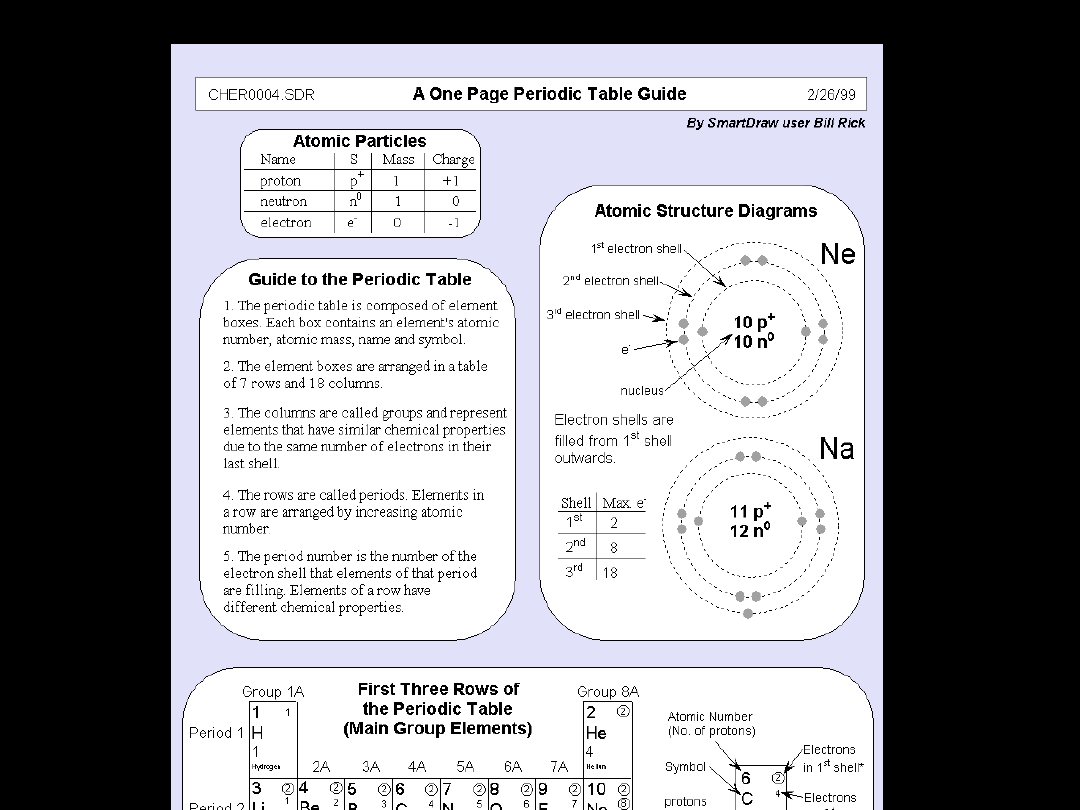
Elektrony najbardziej
zewnętrznych
powłok decydują o:
Elektrony najbardziej
zewnętrznych
powłok decydują o:
Okresowość konfiguracji tych
właśnie elektronów pociąga za
sobą okresowość właściwości
chemicznych
i
fizycznych
pierwiastków
Okresowość konfiguracji tych
właśnie elektronów pociąga za
sobą okresowość właściwości
chemicznych
i
fizycznych
pierwiastków
właściwościach
chemicznych
bardzo wielu
własnościach
fizycznych
właściwościach
chemicznych
bardzo wielu
własnościach
fizycznych

Dymitra MENDELEJEWA
Dymitra MENDELEJEWA
w roku
1869
przez
w roku
1869
przez
Lothara
MEYERA
Lothara
MEYERA
w roku
1870
przez
w roku
1870
przez

własności
chemiczne i fizyczne
pierwiastków
zmieniają się okresowo,
w miarę wzrostu
masy atomowej
własności
chemiczne i fizyczne
pierwiastków
zmieniają się okresowo,
w miarę wzrostu
masy atomowej
wg Mendelejewa
wg Mendelejewa
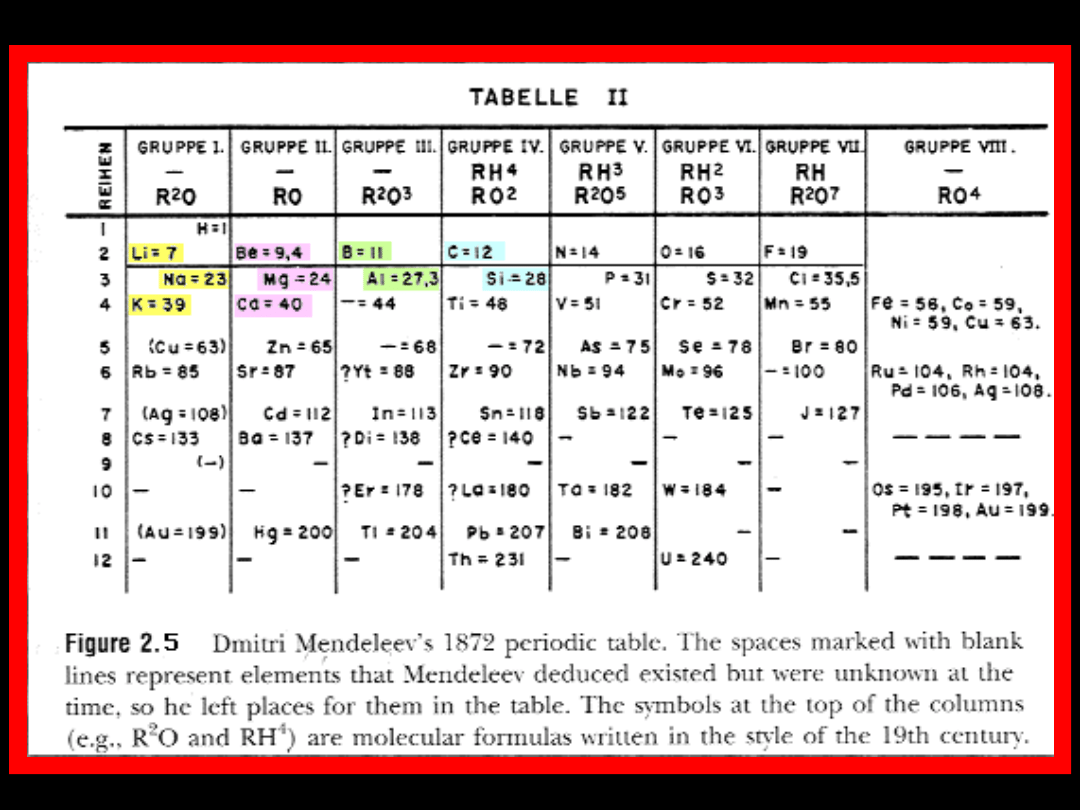
Okre
s
Grupa
I
—
R
2
O
Grupa
II
—
RO
Grupa
III
—
R
2
O
3
Grupa
IV
RH
4
RO
2
Grupa
V
RH
3
R
2
O
5
Grupa
VI
RH
2
RO
3
Grupa
VII
RH
R
2
O
7
Grupa VIII
—
RO
4
1
H=1
2
Li=7
Be=9,
4
B=11
C=12
N=14
O=16
F=19
3
Na=23
Mg=2
4
Al=27,3
Si=28
P=31 S=32
Cl=35,5
4
K=39
Ca=40
— =44
Ti=48
V=51
Cr=52
Mn=55
Fe=56,
Co=59
Ni=59,
Cu=63
5
(As=63
)
Zn=65
— =68
— =72
As=75
Se=78
Br=80
6
Rb=85
Sr=87
?Yt=88
Zr=90
Mo=94
Mo=96
— =100
Ru=104,
Rh=104
Pd=106,
Ag=108
7
Ag=108
Cd=12
In=113
Sn=118
Sb=122
Te=125
J=127
8
Cs=133 Ba=13
7
—
?Ce=140
—
—
—
— — — — —
9
(— )
—
?Di=138
—
—
—
—
10
—
—
?Er=178 ?La=180
Ta=182
W=184
—
Os=195,
Ir=197
Pt=198,
Au=199
11
(Au=19
9)
Hg=20
0
Tl=204
Pb=207
Bi=208 —
—
12
—
—
—
Th=231
—
U=240
—
— — — — —
Tablica pierwiastków chemicznych Mendelejewa z 1869
roku

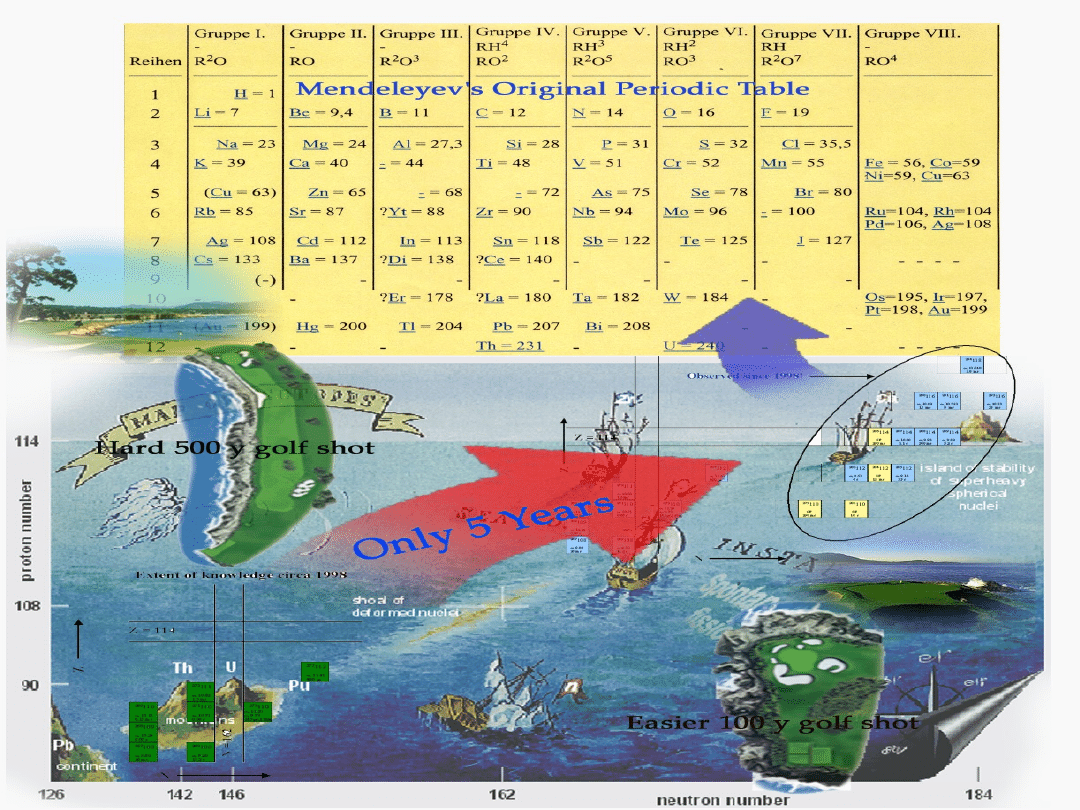
Zasługą Mendelejewa przy
opracowaniu układu
okresowego było:
WYJĄTKI !!!
18 Ar
M-39,9 g/mol
- 19 K
M -39,1 g/mol
27 Co
M-58,9 g/mol
- 28 Ni
M-58,7 g/mol
52 Te
M-127,6 g/mol
- 53 I
M -126,9 g/mol
pozostawienie kilku pustych miejsc
poprawienie wartości kilku mas atomowych
uwzględnienie
kilku
nielicznych
wyjątków
od
reguły
wzrastających
mas
atomowych
M
uranu
M
indu
M
ceru

Ti = 50
Zr = 90
? = 180
V = 51
Nb = 94
Ta = 182
Cr = 52
Mo = 96
W = 186
Mn = 55
Rh
=
104,4
Pt
=
197,4
Fe = 56
Ru
=
104,4
Ir = 198
Ni =
Co = 59
Pd
=
106,6
Os = 199
H = 1
Cu = 63,4
Ag = 108 Hr = 200
Be = 9,4
Mg = 24
Zn = 65,2
Cd = 112
B = 11
Al = 27
? = 68
U = 116
Au = 197
C = 12
Si = 28
? = 70
Sn = 118
N = 14
P = 31
As = 75
Sb = 122 Bi = 210
O = 16
S = 32
Se = 79
Te
=
128?
F = 19
Cl = 35,5
Br = 80
J = 127
Li = 7
Na = 23
K = 39
Rb = 85,4
Cs = 133 Tl = 204
Ca = 40
Sr = 87,6
Ba = 137 Pb = 202
? = 45
Ce = 92
?Er = 56
La = 94
?Yt = 60
Di = 95
?In
=
75,6
Th = 118
Tablica pierwiastków chemicznych
Mendelejewa – 1969 rok
I A
VI IIA
1s
1
H
Wodór
II A
II I A
I VA
VA
VI A
VI IA
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
II IB
IVB
VB
VI B
VI IB
VII IB
VI II B
VI II B
I B
II B
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
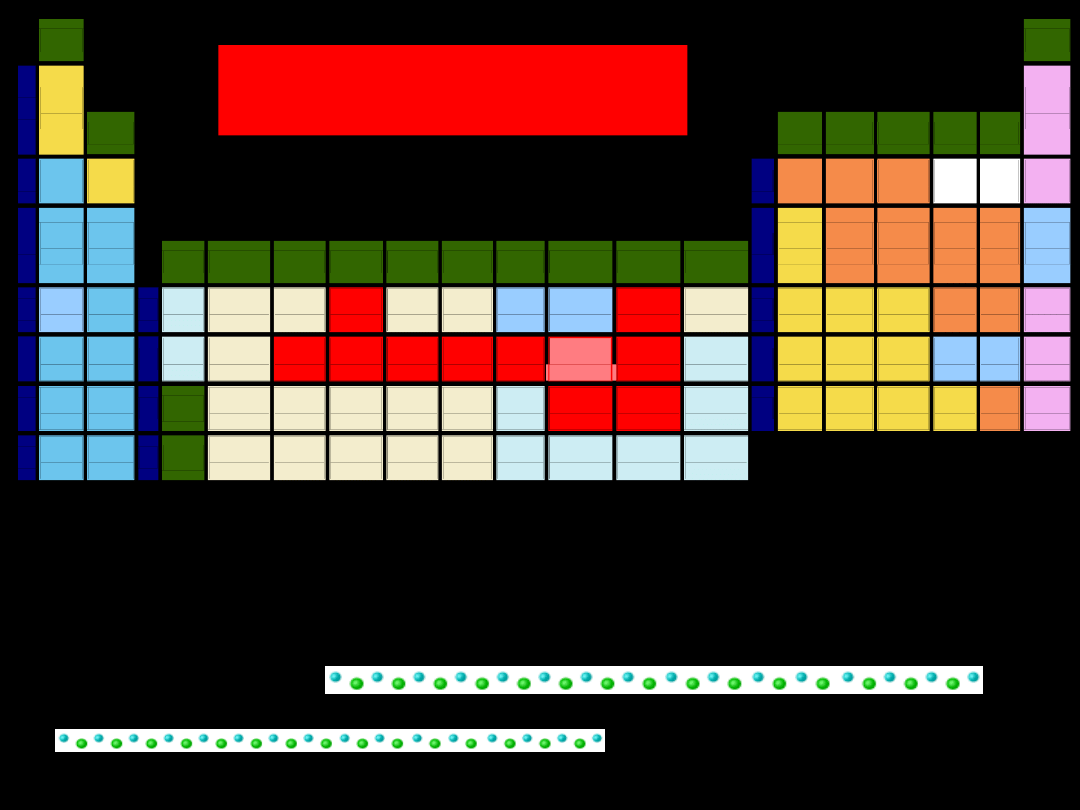
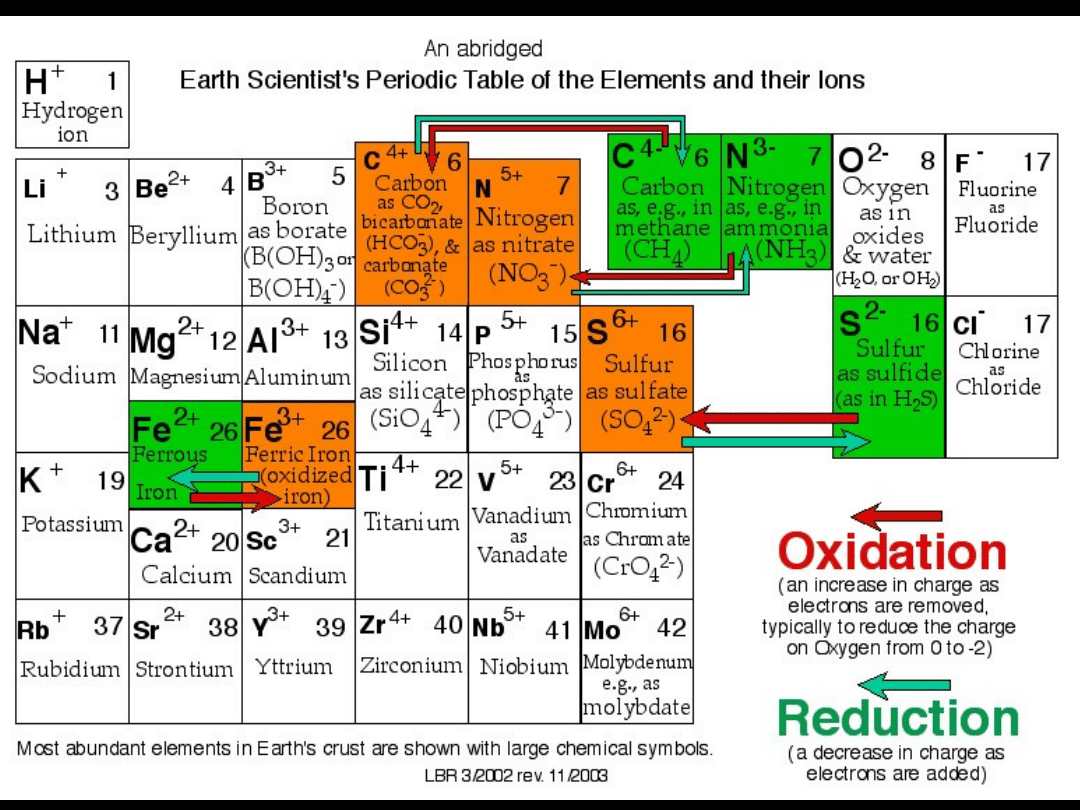
CHARAKTER TLENKU
zasadowy
zasadowy
amfoteryczny
amfoteryczny
kwasowy
gazy szlachetne
WYJĄTKI !!!
1
5
6
7
8
9
10
11 12
13 14 15 16 17
3 4
2
18

Z
Nazwa
wg
Mendeje
wa
Nazwa
Rok
progno
zy
Rok
odkryci
a
Kraj
odkryci
a
31
Ekaglin
Gal
1871
1875
Francja
21
Ekabor
Skand
1871
1879
Szwecja
32 Ekakrzem German
1871
1886
Niemcy
91
Protakt
yn
1871
1918
Niemcy,
Anglia
75
Ren
1871
1925
Niemcy
43
Technet
1871
1937
Włochy
87
Frans
1871
1939
Francja
84
Polon
1889
1898
Francja
Prognozy D.I. Mendelejewa z roku
1871 i 1889
i odkrycia nowych pierwiastków
chemicznych

własności
chemiczne i fizyczne
pierwiastków
zmieniają się
okresowo,
w miarę wzrostu
liczby atomowej
własności
chemiczne i fizyczne
pierwiastków
zmieniają się
okresowo,
w miarę wzrostu
liczby atomowej

Dopiero w 1997 roku IUPAC
przyjęła ostateczne nazwy tych
pierwiastków:
104
Ruthefordium
Rf
(ruterford)
(Ruterford) –
1969r.
105 Dubnium
Db (dubn)
(Dubn) – 1970 r.
106
Seaborgium
Sg (siborg) (Seaborg) –
1974r.
107 Bohrium
Bh
(borium)
(Bohrn) – 1984r.
108 Hassium
Hs
(hassium)
(Has) – 1984r.
109
Meitnerium
Mt
(meitner)
(Meitner) –
1982r.
Pierwiastki od 104 do 109 otrzymano
sztucznie w ilościach niewielu szybko
rozpadających się atomów, dlatego ich
dokładne właściwości nie są dotychczas
poznane
1
18
1
1
H
Wodór
2
13 14
15 16 17
2
He
Hel
2
3
Li
Lit
4
Be
Beryl
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3
11
Na
Sód
12
Mg
Magnez
3
4
5
6
7
8
9
10 11 12
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4
19
K
Potas
20
Ca
Wapń
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5
37
Rb
Rubid
38
Sr
Stront
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6
55
Cs
Cez
56
Ba
Bar
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7
87
Fr
Frans
88
Ra
Rad
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
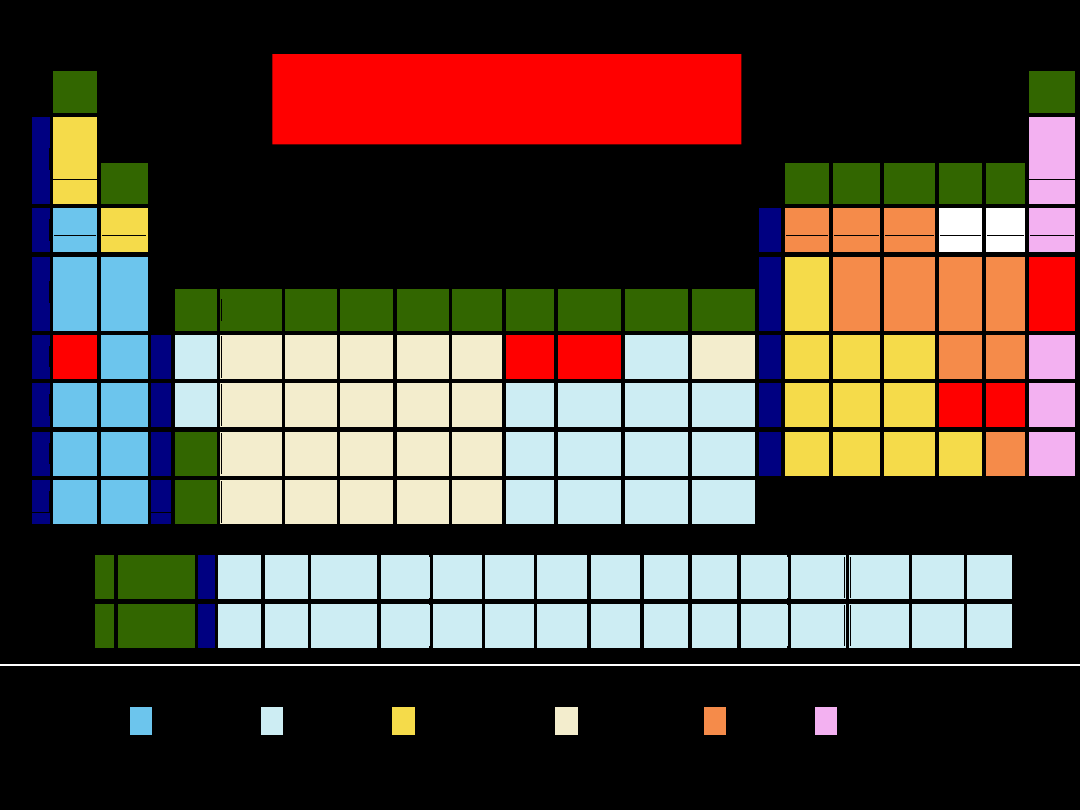
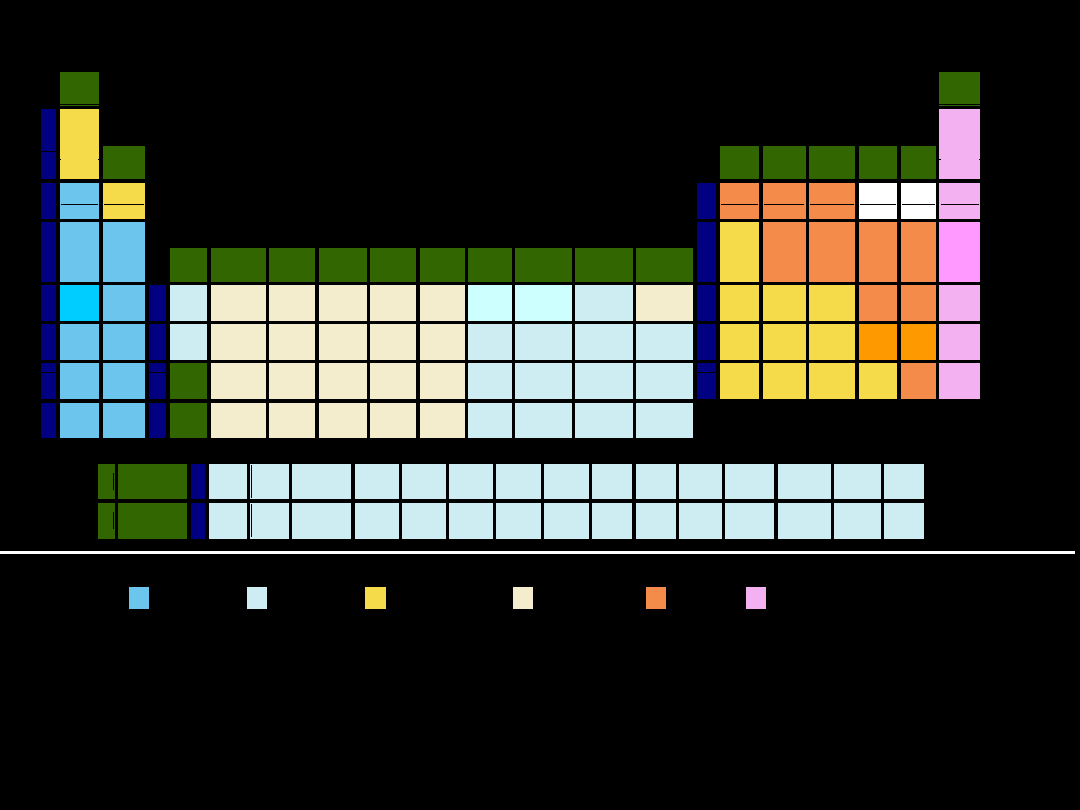
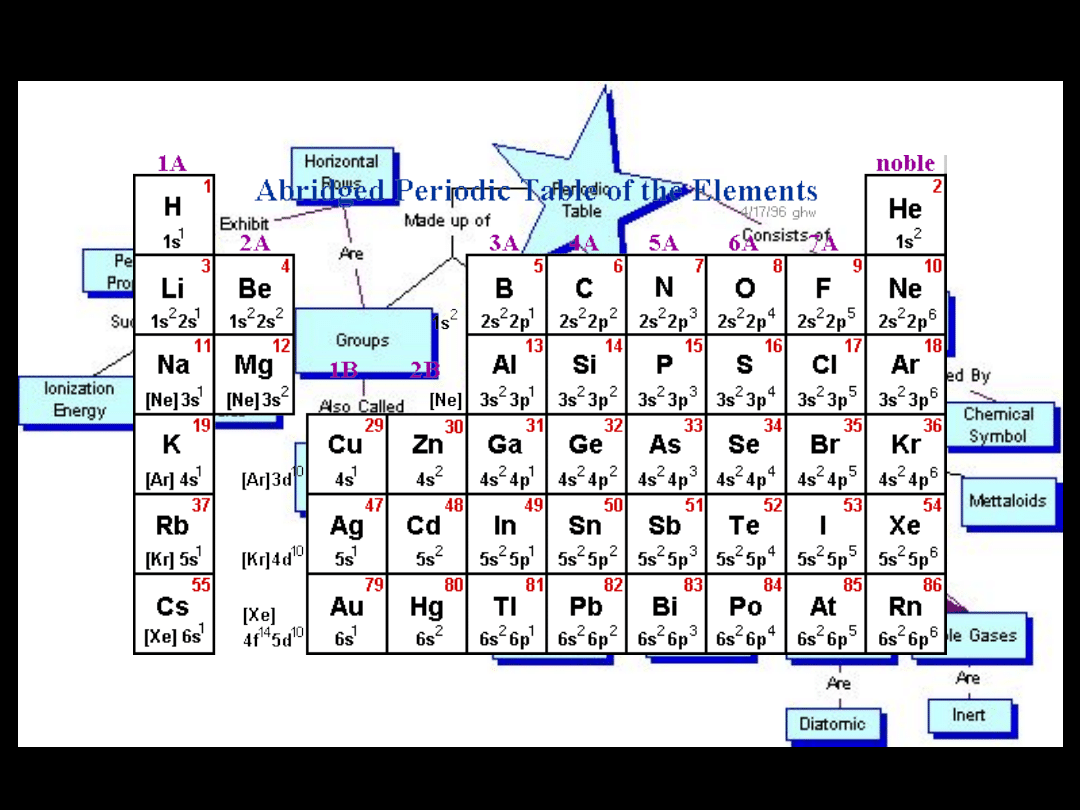
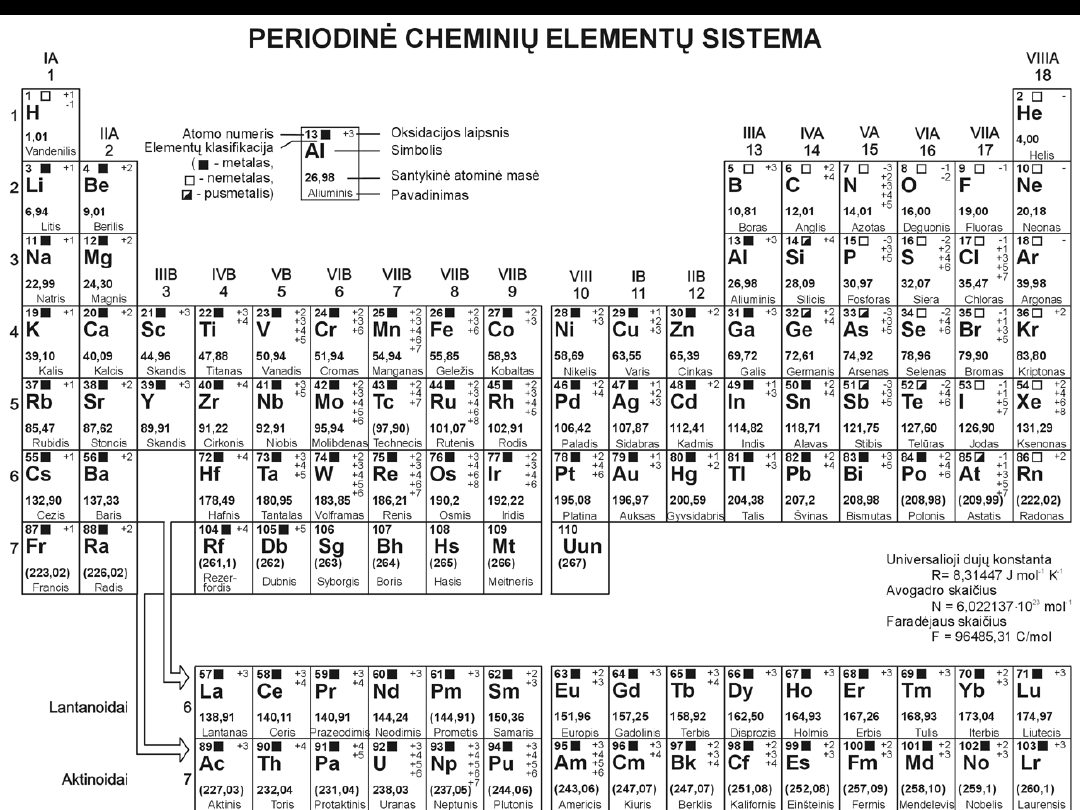
metale półmetale niemetale niemetale: gazy szlachetne
Układ okresowy pierwiastków

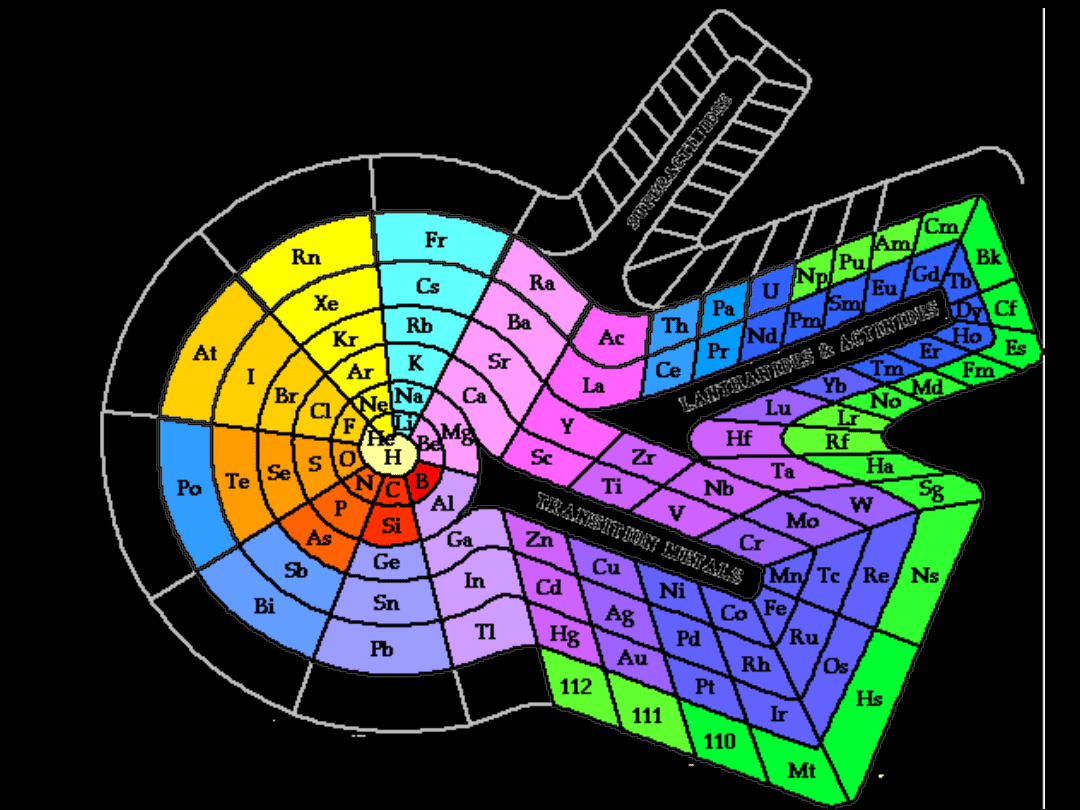
I A
VIIIA
2
13 14 15 16 17
1s
1
H
Wodór
I IA
II IA
IVA
VA
VIA
VII A
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3
4
5
6
7
8
9
10
11
12
3s
11
Na
Sód
12
Mg
Magnez
II IB
IVB
VB
VIB
VI IB
VI II B
VII IB
VI II B
IB
II B
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
18
1
1
2
3
4
5
6
7
Pierwiastki w układzie
okresowym
ułożone są w:
—18 grupach
— 7 okresach
Pierwiastki w układzie
okresowym
ułożone są w:
—18 grupach
— 7 okresach

1
18
1
1
H
Wodór
2
13 14
15
16 17
2
He
Hel
2
3
Li
Lit
4
Be
Beryl
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3
11
Na
Sód
12
Mg
Magnez
3
4
5
6
7
8
9
10
11
12
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4
19
K
Potas
20
Ca
Wapń
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5
37
Rb
Rubid
38
Sr
Stront
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6
55
Cs
Cez
56
Ba
Bar
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7
87
Fr
Frans
88
Ra
Rad
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
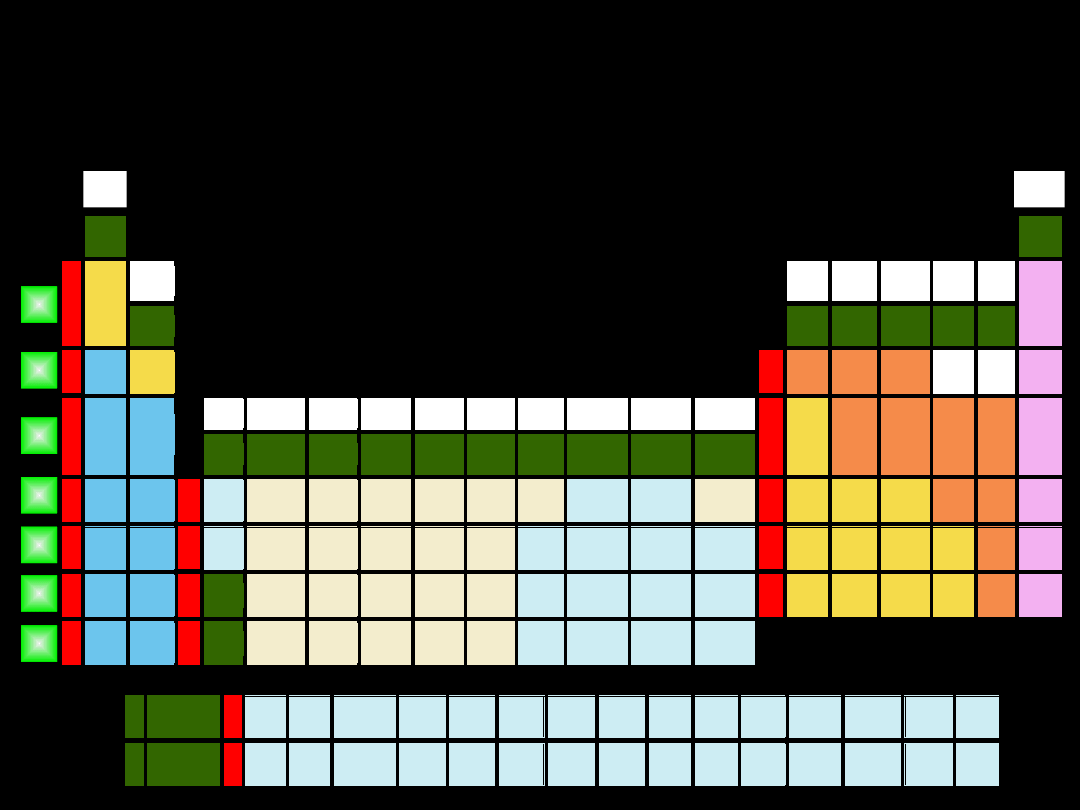
metale półmetale niemetale niemetale: gazy szlachetne
Pierwiastki znajdujące się w tych samych
grupach mają:
analogiczną konfigurację
zewnętrznych powłok
elektronowych
analogiczną konfigurację
zewnętrznych powłok
elektronowych
wykazują wiele podobieństw we
właściwościach fizycznych i
chemicznych

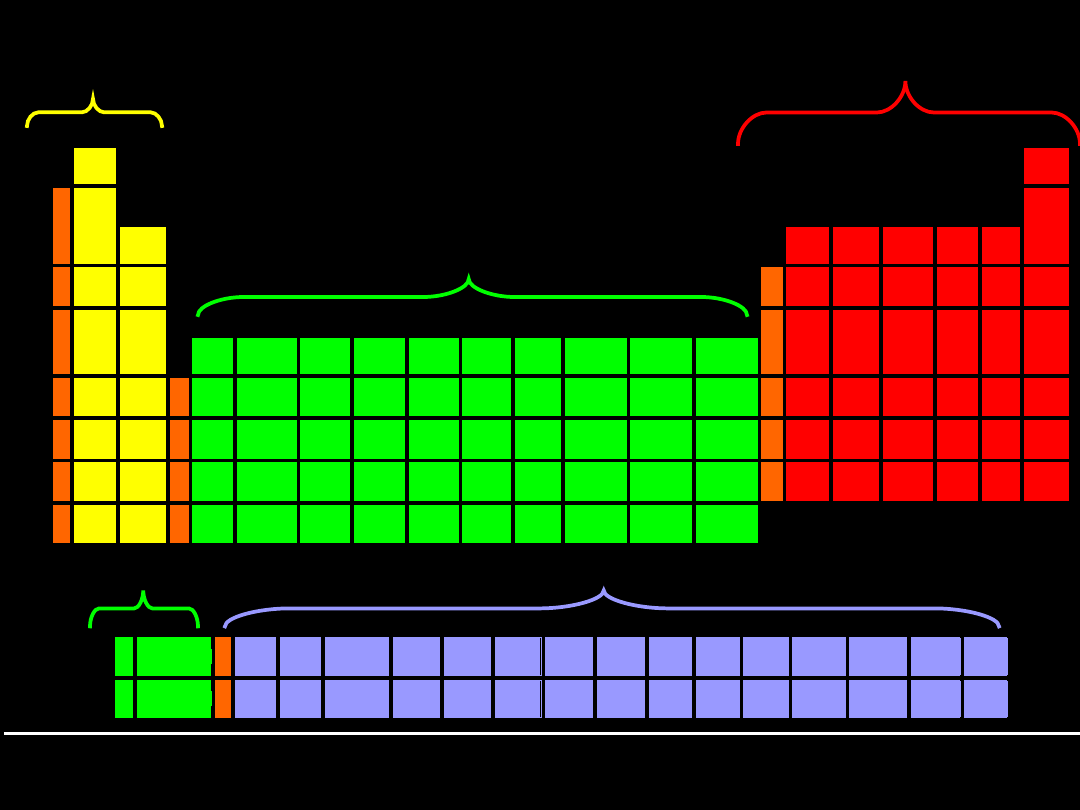
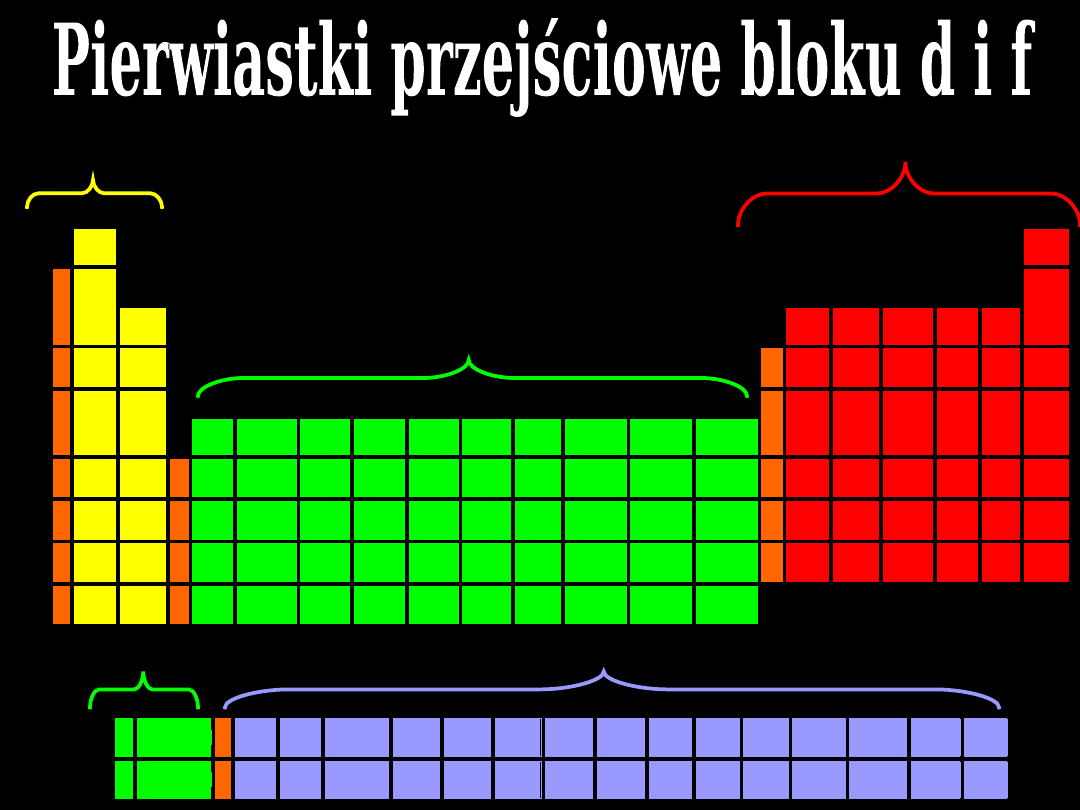
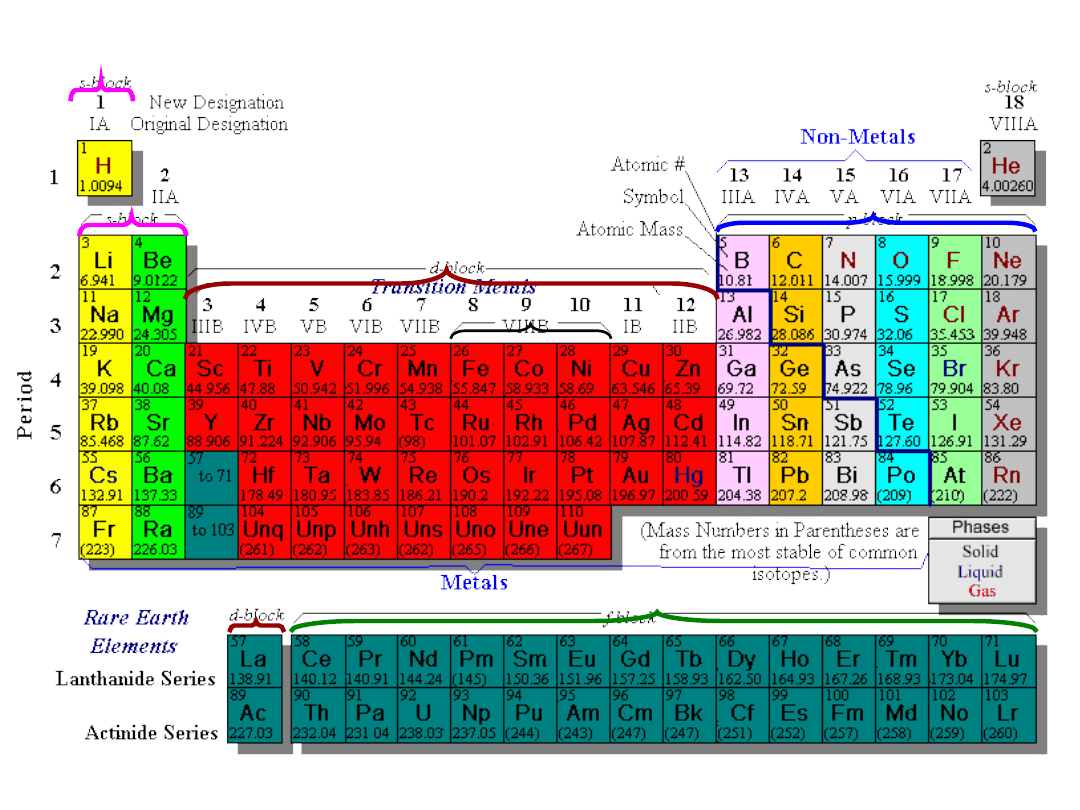
bloku
s
bloku
s
bloku p
bloku p
bloku d
tzw.
zewnątrzprzejściowe
bloku d
tzw.
zewnątrzprzejściowe
bloku f
tzw.
wewnątrzprzejściowe
bloku f
tzw.
wewnątrzprzejściowe
I A
VI I IA
1s
1
H
Wodór
I I A
I I I A
I VA
VA
VI A
VI I A
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
I I I B
I VB
VB
VI B
VI I B
VI I I B
VI I I B
VI I I B
I B
I I B
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
blok d
blok d
blok s
blok p
blok f
1
3
5
6 7
9
8
10 11 12
13 14 15 16
4
17
18
2
IA
6
VIB
5
VB
4
IVB
3
IIIB
13
IIIA
1
0
VIIIB
7
VIIB
14
IVA
12
IIB
11
IB
18
VIIIA
17
VIIA
16
VIA
15
VA
8
9
blok p
blok s
blok s
blok f
blok d
2
3
4
5
6
7
1
blok d
2
IIA

Pierwiastki bloku s
elektrony walencyjne na podpoziomie s
(dwie pierwsze grupy)
Pierwiastki bloku s
elektrony walencyjne na podpoziomie s
(dwie pierwsze grupy)
1 – grupa litowców
(potasowców,
metali
alkalicznych)
Li, Na, K, Rb, Cs, F –
– konfiguracja ns
1
2 – grupa berylowców
(wapniowców,
metali
ziem
alkalicznych)
Be, Mg, Ca, Sr, Ba, Ra
–
– konfiguracja ns
2

Pierwiastki bloku p
elektrony walencyjne na
podpoziomie p
Pierwiastki bloku p
elektrony walencyjne na
podpoziomie p
13 – grupa borowce
(glinowce)
B, Al, Ga, In, Tl –
– konfiguracja ns
2
p
1
14 – grupa węglowce
C, Si, Ge, Sn, Pb
–
– konfiguracja ns
2
p
2
15 – grupa azotowce
N, F, As, Sb, Bi–
– konfiguracja ns
2
p
3
16 – grupa tlenowce
(siarkowce)
O, S, Se, Te, Po –
– konfiguracja ns
2
p
4
17 – grupa fluorowce
(chlorowce)
F, Cl, Br, I, At –
– konfiguracja ns
2
p
5
18 – grupa helowce
(gazy
szlachetne)
He, Ne, Ar, Kr, Xe, Rn
–
– konfiguracja ns
2
p
6

Pierwiastki bloku d
– rozbudowujące
podpowłokę (n-1)d
Pierwiastki bloku d
–
rozbudowujące
podpowłokę (n-1)d
3 – grupa
skandowce
Sc, Y, La, Ac –
– konfiguracja (n-1)d
1
ns
2
4 – grupa
tytanowce
Ti, Zr, Hf –
– konfiguracja (n-1)d
2
ns
2
5 – grupa
wanadowce
V, Nb, Ta –
– konfiguracja (n-1)d
3
ns
2
; (n-1)d
4
ns
1
6 – grupa
chromowce
Cr, Mo, W –
– konfiguracja (n-1)d
4
ns
2
; (n-1)d
5
ns
1
7 – grupa
manganowce
Mn, Tc, Re –
– konfiguracja (n-1)d
5
ns
2
; (n-1)d
6
ns
1
8 – Fe, Ru, Os
– konfiguracja (n-1)d
6
ns
2
; (n-1)d
7
ns
1
9 – Co, Rh, Ir
– konfiguracja (n-1)d
7
ns
2
; (n-1)d
8
ns
1
10 – Ni, Pd, Pt
– konfiguracja (n-1)d
8
ns
2
(n-1)d
9
ns
1
; (n-
1)d
10
11 – grupa
miedziowce
Cu, Ag, Au –
– konfiguracja (n-1)d
10
ns
1
12 – grupa
cynkowce
Zn, Cd, Hg –
– konfiguracja (n-1)d
10
ns
2
IA
VIIIA
1s
1
H
Wodór
IIA
IIIA
IVA
VA
VIA
VIIA
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
IIIB
IVB
VB
VIB
VIIB
VIIIB
VIIIB
VIIIB
IB
IIB
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
Jod
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
WYJĄTKI !!!
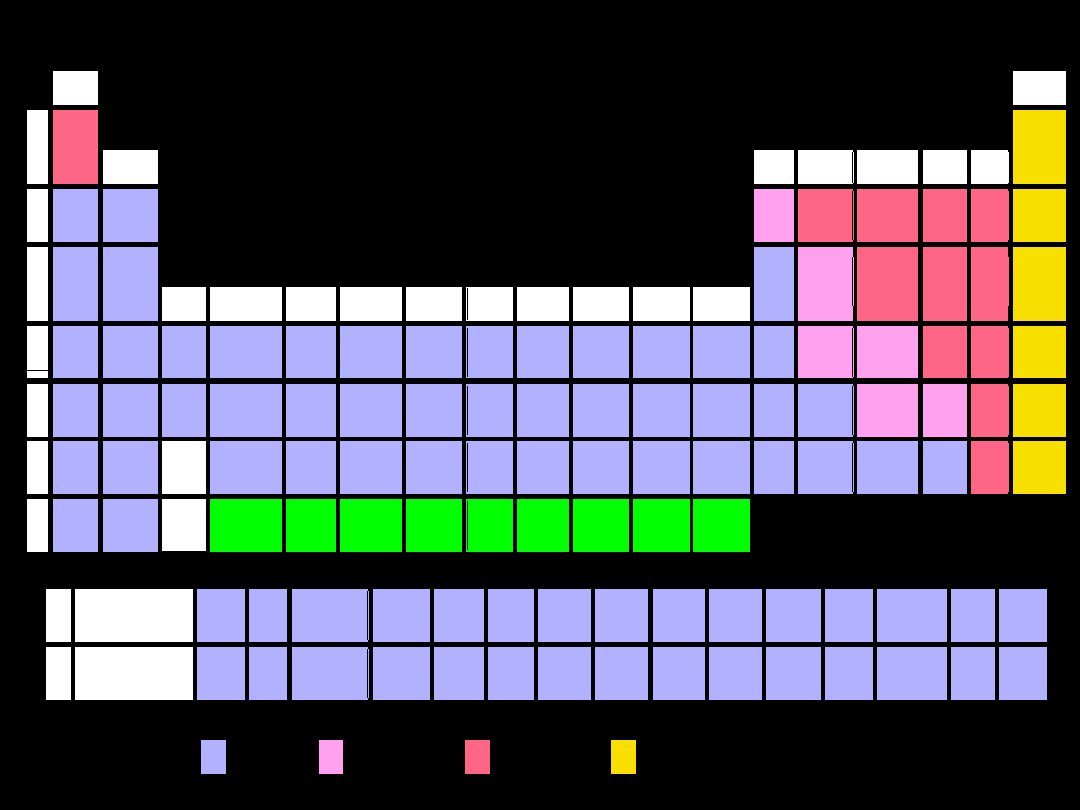
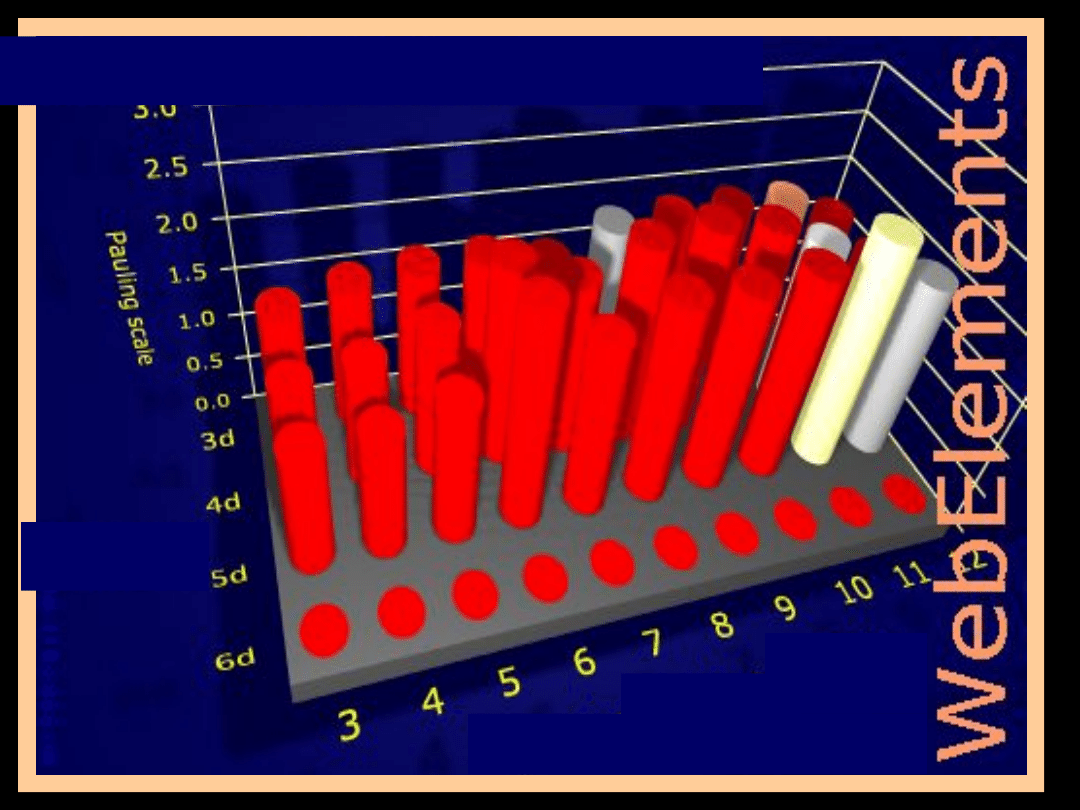
Wszystkie pierwiastki
przejściowe
zachowują
podobieństwo chemiczne w
kierunku poziomym
Wszystkie pierwiastki
przejściowe
zachowują
podobieństwo chemiczne w
kierunku poziomym

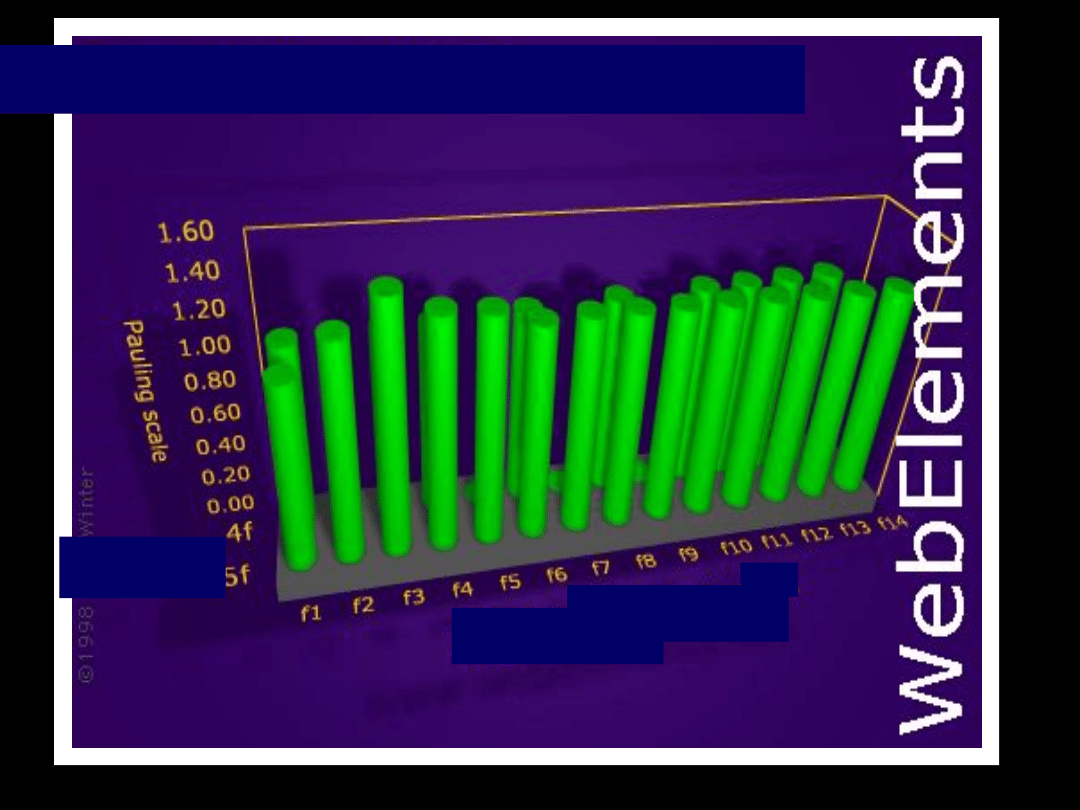
Pierwiastki
bloku
f
–
rozbudowujące podpowłokę (n-
2)f
Pierwiastki
bloku
f
–
rozbudowujące podpowłokę (n-
2)f
lantanowce – od Ce do Lu
aktynowce – od Th do Lr
lantanowce
–
od Ce do Lu
aktynowce
–
od Th do Lr
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens

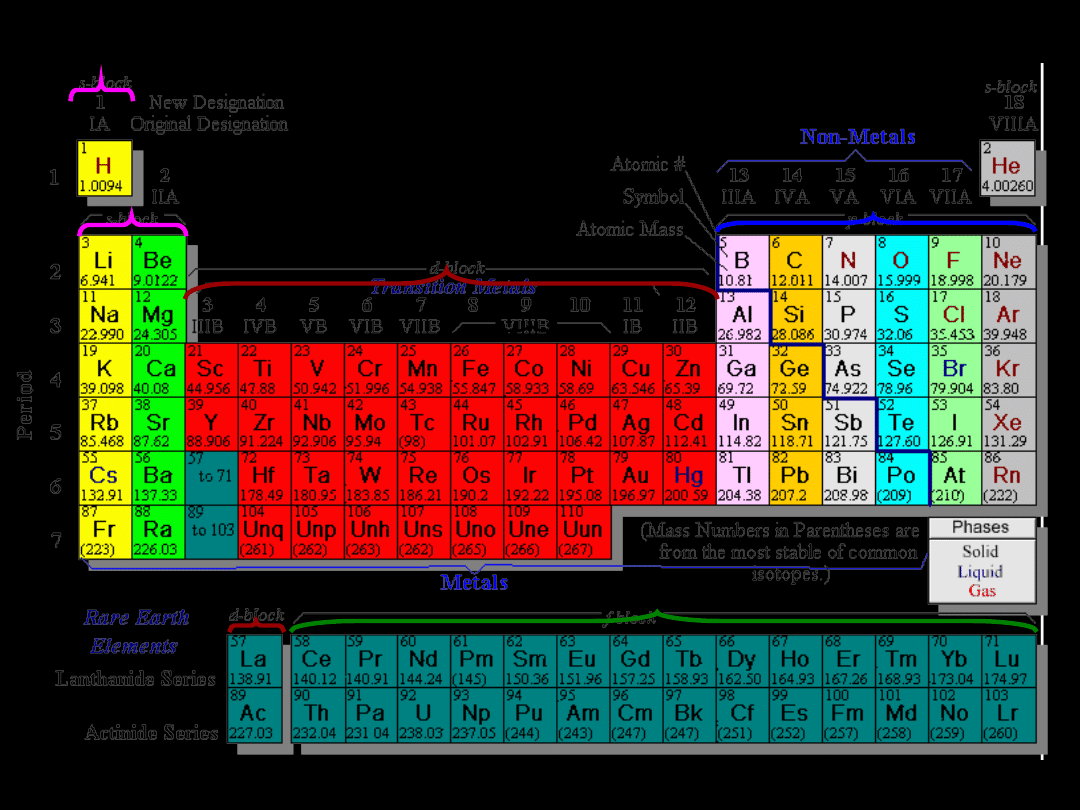
W układzie okresowym
rozróżniamy
7 okresów:
W układzie okresowym
rozróżniamy
7 okresów:
1
H i He
2
8 pierwiastków – od Li do Ne
3
8 pierwiastków – od Na do Ar
4
18 pierwiastków – od K do Kr
5
18 pierwiastków – od Rb do Xe
6
32 pierwiastki – od Cs do Rn
(
zawiera pierwiastki
wewnątrzprzejściowe)
7
niedokończony – od Fr do Mt
liczby
koordynacyjnej
tj.
liczby
jonów
przeciwnego
znaku otaczających w
najbliższym
sąsiedztwie dany jon
liczby
koordynacyjnej
tj.
liczby
jonów
przeciwnego
znaku otaczających w
najbliższym
sąsiedztwie dany jon
Promienie jonowe w
kryształach zależą od:
Promienie jonowe w
kryształach zależą od:
typu wiązania chemicznego
typu wiązania chemicznego
natury chemicznej otaczających je jonów
natury chemicznej otaczających je jonów
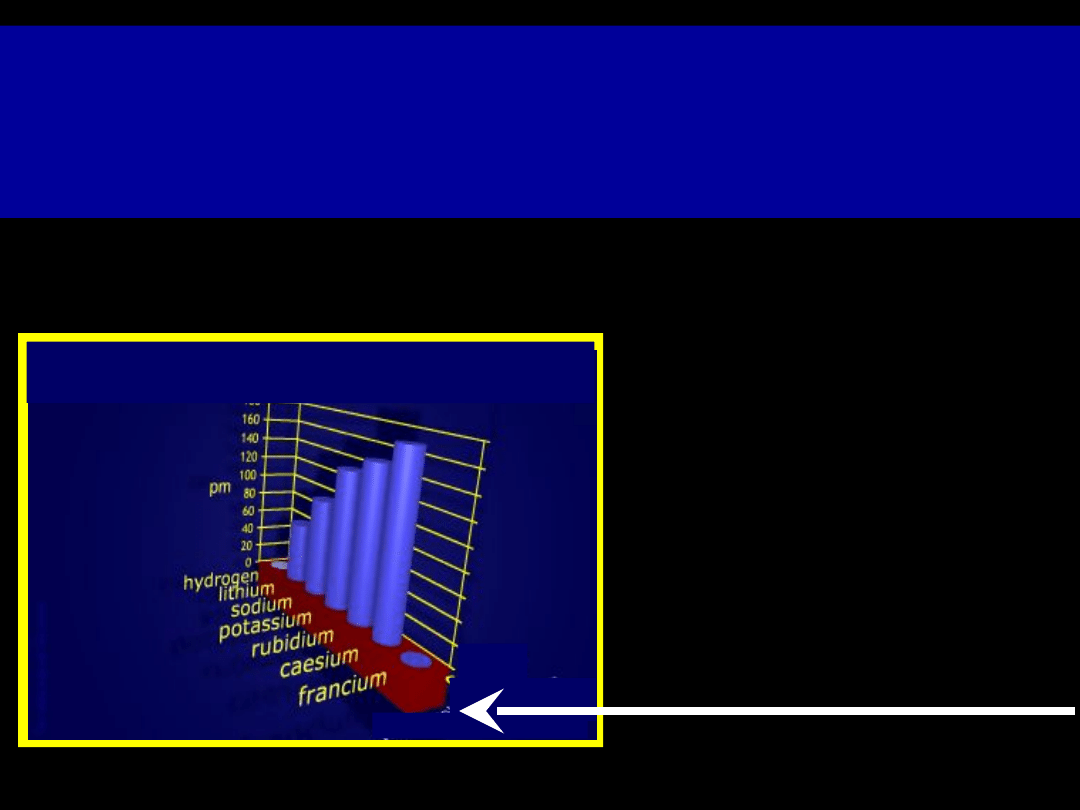
Promienie jonowe
Grupa 1
w grupach promienie wzrastają w dół
kolumny
(zwiększa się liczba powłok
elektronowych)
w grupach
promienie wzrastają w dół
kolumny
(zwiększa się liczba powłok
elektronowych)
Zależność wielkości jonu od
położenia pierwiastka w układzie
okresowym
Zależność wielkości jonu od
położenia
pierwiastka w układzie
okresowym
Li
+
— 0,78A
Na
+
— 0,98A
K
+
— 1,33A
Rb
+
— 1,49A
Cs
+
— 1,65A
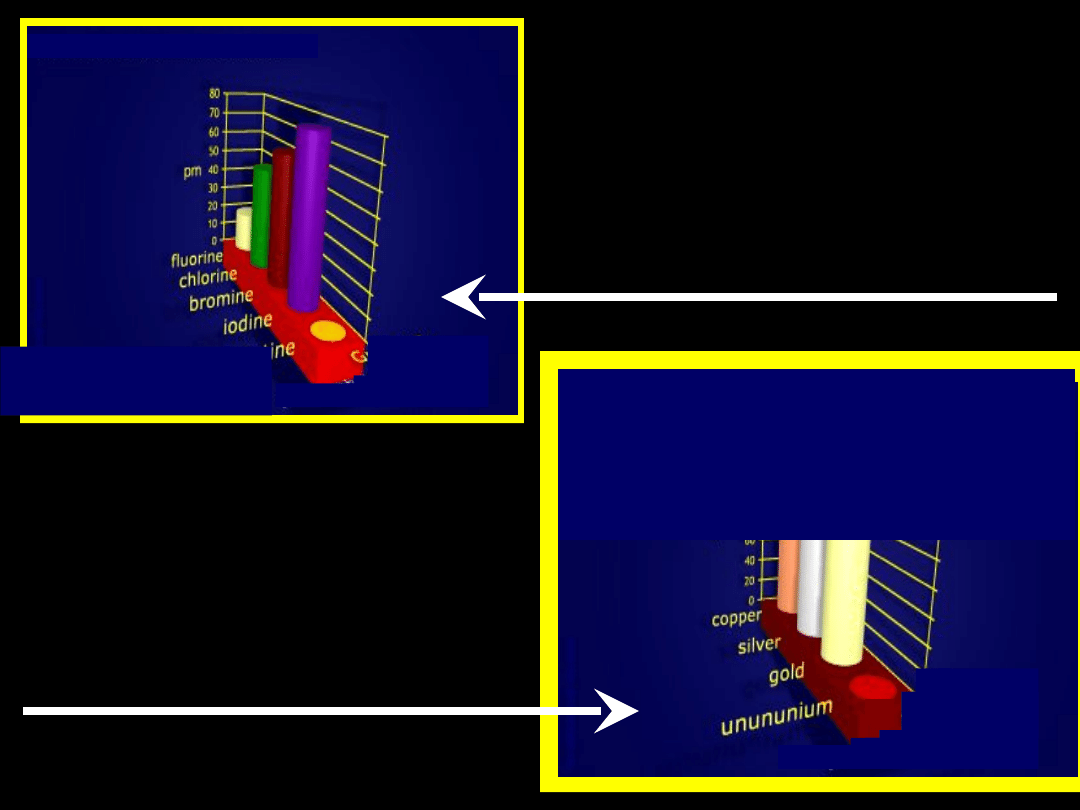
Grupa 17
Promienie jonowe
Promienie jonowe – grupa
11 –
blok d
Grupa 11
F
–
— 1,35A
Cl
–
— 1,81A
Br
–
— 1,96A
I
–
— 2,20A
Cu
+
— 0,96A
Ag
+
— 1,13A
Au
+
— 1,37A
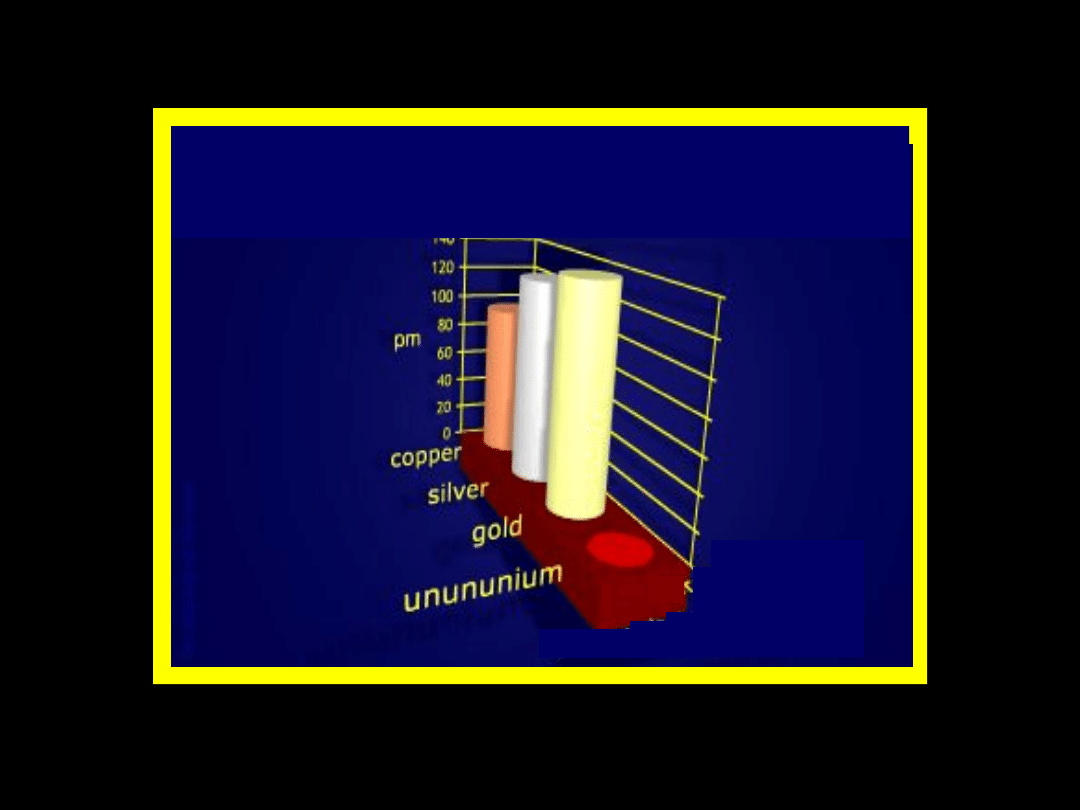
Promienie jonowe – grupa 11
– blok d
Grupa 11

— zmniejszanie się
promienia jonowego wraz
ze wzrostem liczby
porządkowej
— zmniejszanie się
promienia jonowego wraz
ze wzrostem liczby
porządkowej
jony lantanowców
(pierwiastków
ziem rzadkich)
i aktynowców
wykazują:
jony lantanowców
(pierwiastków
ziem rzadkich)
i
aktynowców
wykazują:
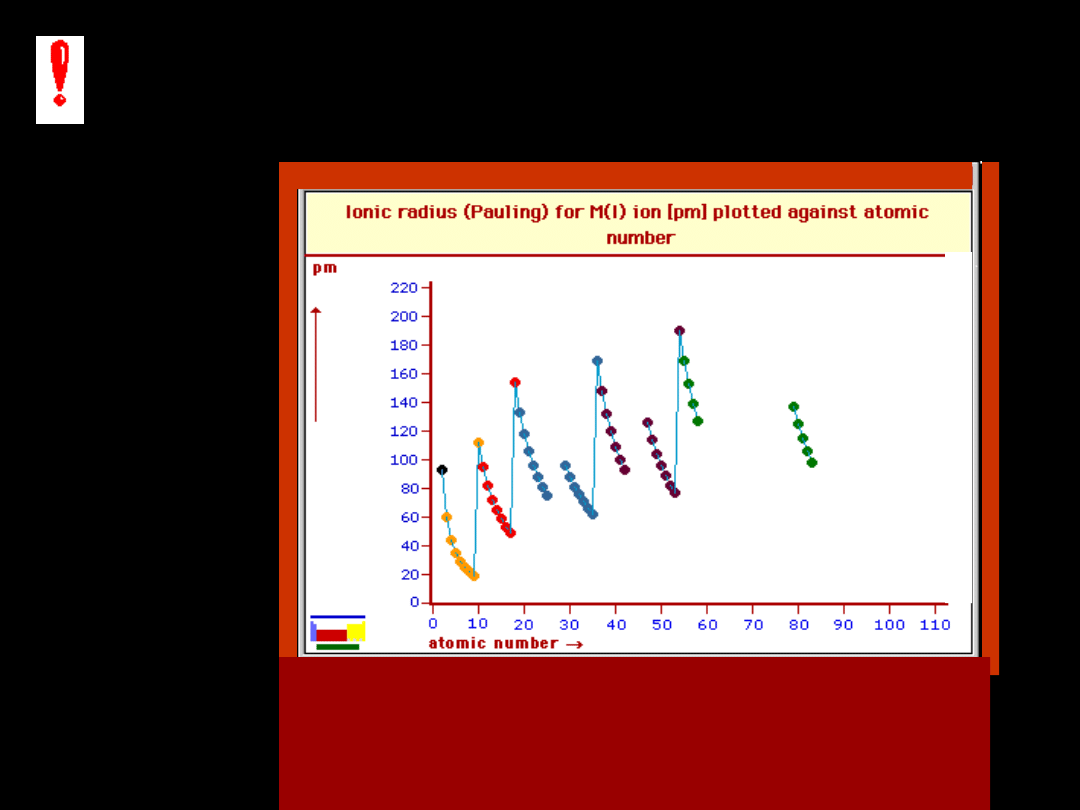
Jony niektórych pierwiastków leżących
po przekątnej tablicy Mendelejewa
mają zbliżone rozmiary
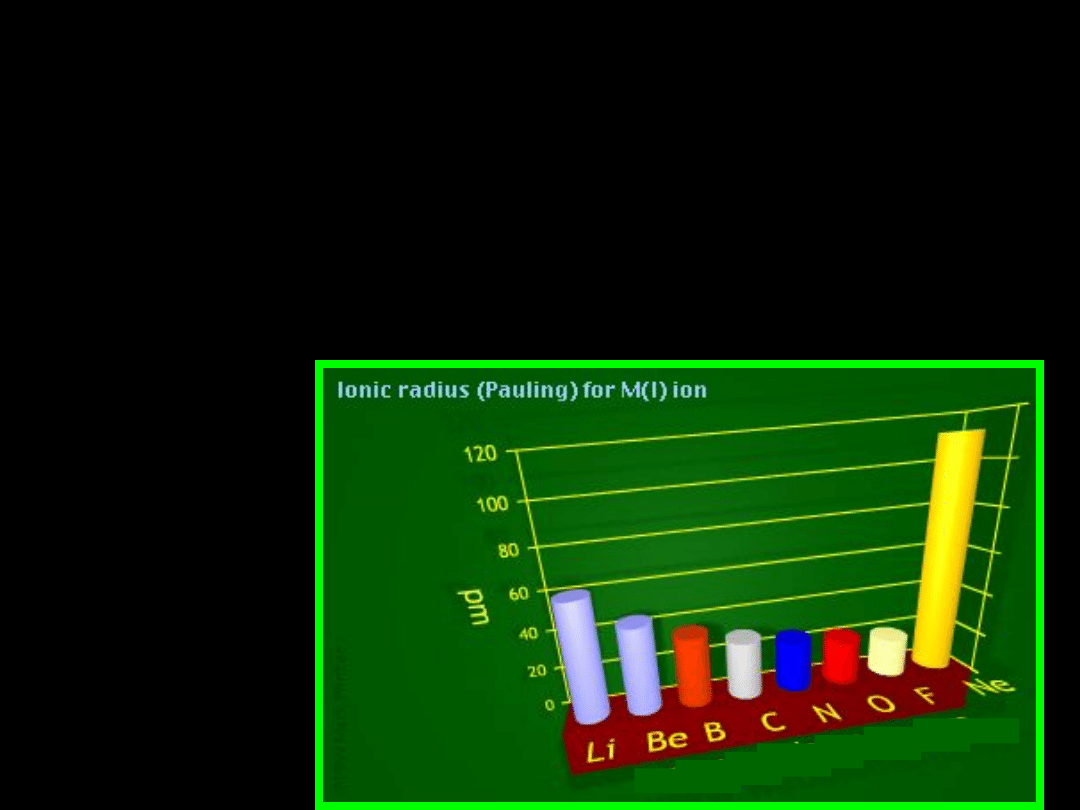
3 Li
+
- 0,78A
12 Mg
2+
-
0,78A
21 Sc
3+
- 0,83A 40 Zr
4+
- 0,87A
Li
Sc
Mg
Zr
Li
+
- 0,78A
Mg
2+
- 0,78A
Sc
3+
- 0,83A
Zr
4+
- 0,87A
19
K
+
– 1,33 A
20
Ca
2+
–
1,06 A
21
Sc
3+
– 0,83A
22
Ti
4+
–
0,64 A
23
V
5+
– 0,4 A
24
Cr
6+
–
0,35A
19
K
+
– 1,33 A
20
Ca
2+
–
1,06 A
21
Sc
3+
– 0,83A
22
Ti
4+
–
0,64 A
23
V
5+
– 0,4 A
24
Cr
6+
–
0,35A
w okresach -
zmniejszenie promienia
kationów
ze wzrostem liczby
porządkowej

rozmiary anionów powiększają
się
przy
przejściu
od
tlenowców do fluorowców
S
2-
–1,74A S
0
– 1,06A S
6+
– 0,34A
aniony
są na ogół większe od
atomów i kationów, gdyż
zawierają więcej elektronów

Promienie kowalencyjne atomów
zmieniają się w układzie okresowym w
podobny sposób jak promienie jonów
— w grupach – wzrastają z góry do dołu kolumny
— w okresach – zmniejszają się z lewej strony układu
w prawo
Zmiany promienia atomowego
w obrębie układu okresowego
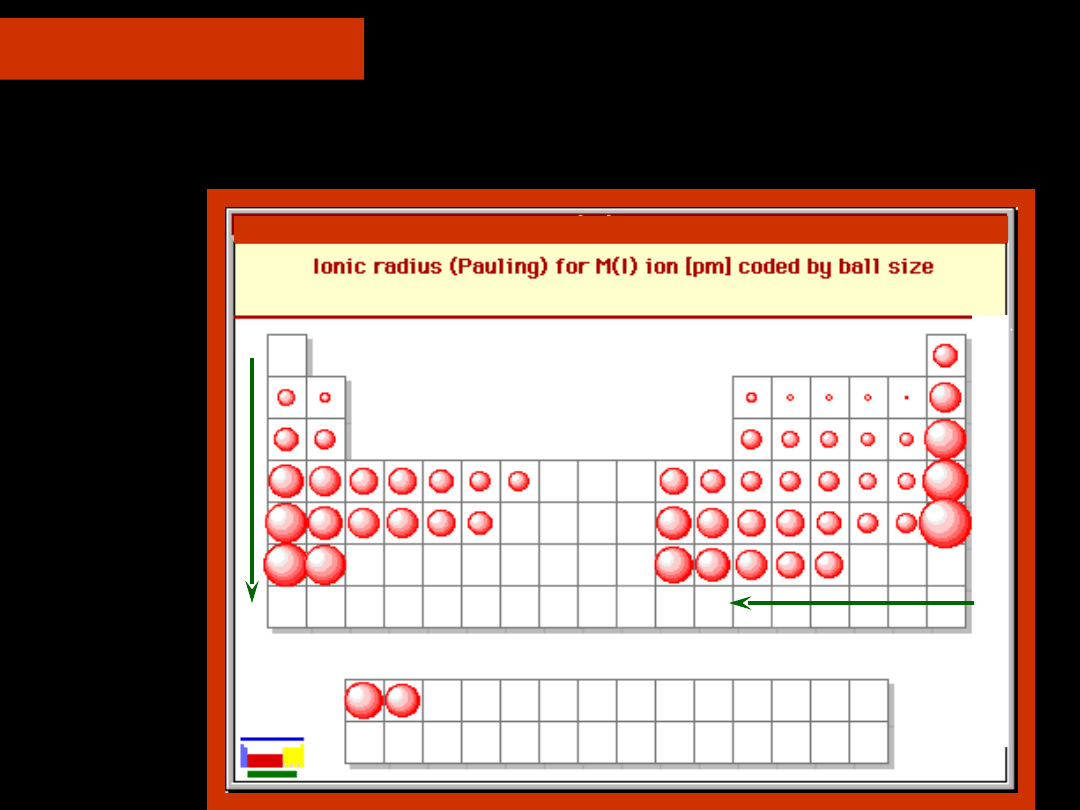
Ze względu na:
Ze względu na:
— zmniejszenie się promieni w
okresach
— zwiększenie się promieni w
grupach
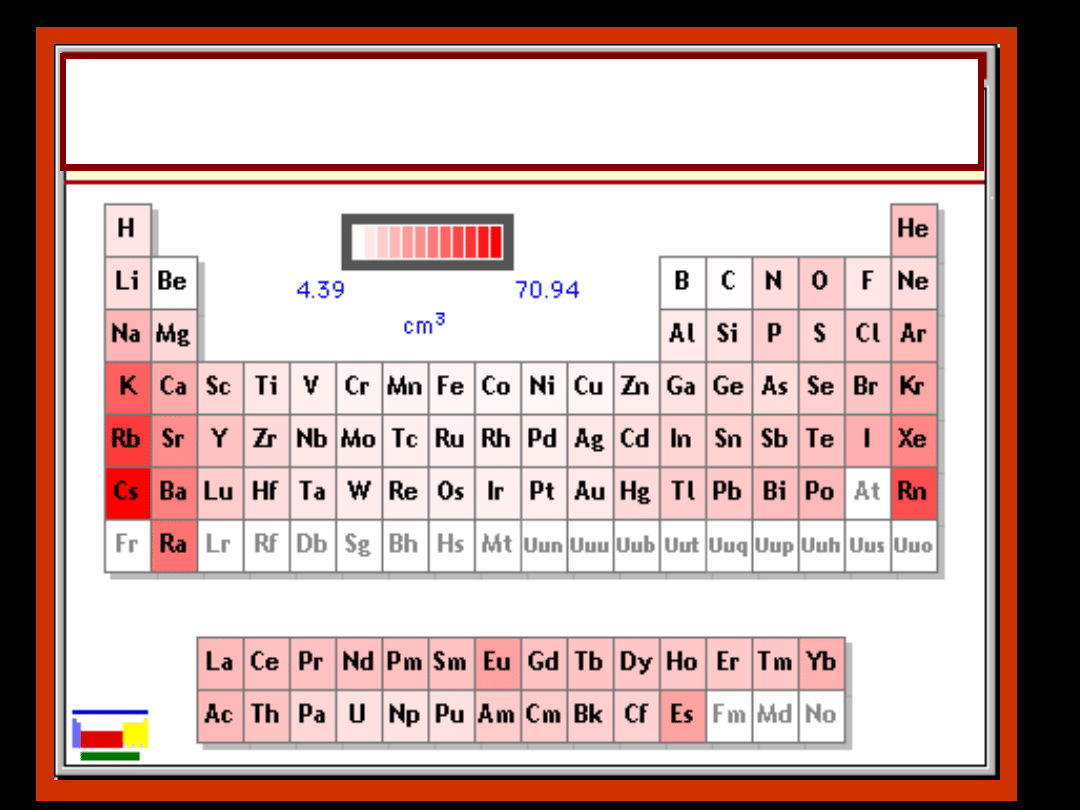
Zmiana objętości atomów
w układzie okresowym

potencjał jonizacyjny – energia
potrzebna do oderwania
z pojedynczego atomu
najluźniej związanego
elektronu
e
A
E
A
e
A
E
A
2
2
1
e
A
E
A
e
A
E
A
2
2
1
1
2
E
E
1
2
E
E
W ramach jednego okresu
energia jonizacji
rośnie wraz ze
wzrostem liczby atomowej
Na Mg Al Si P S Cl Ar
496 738 578 787 1010
995 1255
1521
kJ/mol

W ramach jednej grupy
energia jonizacji
zmniejsza się
wraz
ze
wzrostem
liczby
atomowej
Li Na K Rb
Cs
520 496
419 403
316
kJ/mol
Wielkość energii jonizacji
zależy od:
wielkości atomów — mierzonej
odległością
zewnętrznego
elektronu od przyciągającego
go jądra
budowy powłoki, z której
elektron jest usuwany
skuteczności ekranowania tego
ładunku
przez
pozostałe
elektrony
ładunku jądra

energia uwalniana
po przyłączeniu
elektronu
do elektrycznie
obojętnego atomu
energia
uwalniana
po przyłączeniu
elektronu
do elektrycznie
obojętnego atomu
2
2
1
E
X
e
X
E
X
e
X
2
2
1
E
X
e
X
E
X
e
X

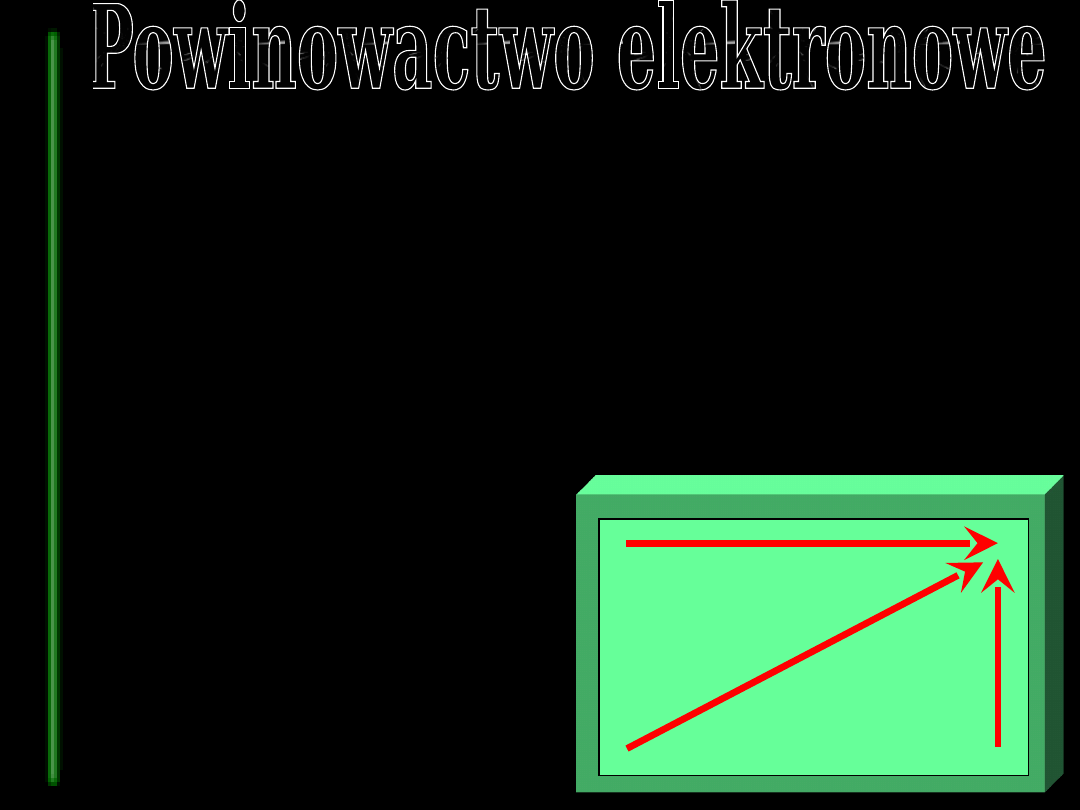
wielkość powinowactwa
elektronowego zależy od tych
samych czynników co i energia
jonizacji
uwolniona energia
jest miarą siły
wiązania między atomem a
dodatkowym elektronem
powinowactwo elektronowe jest
charakterystyczne wyłącznie dla
pierwiastków tworzących
proste jony
ujemne
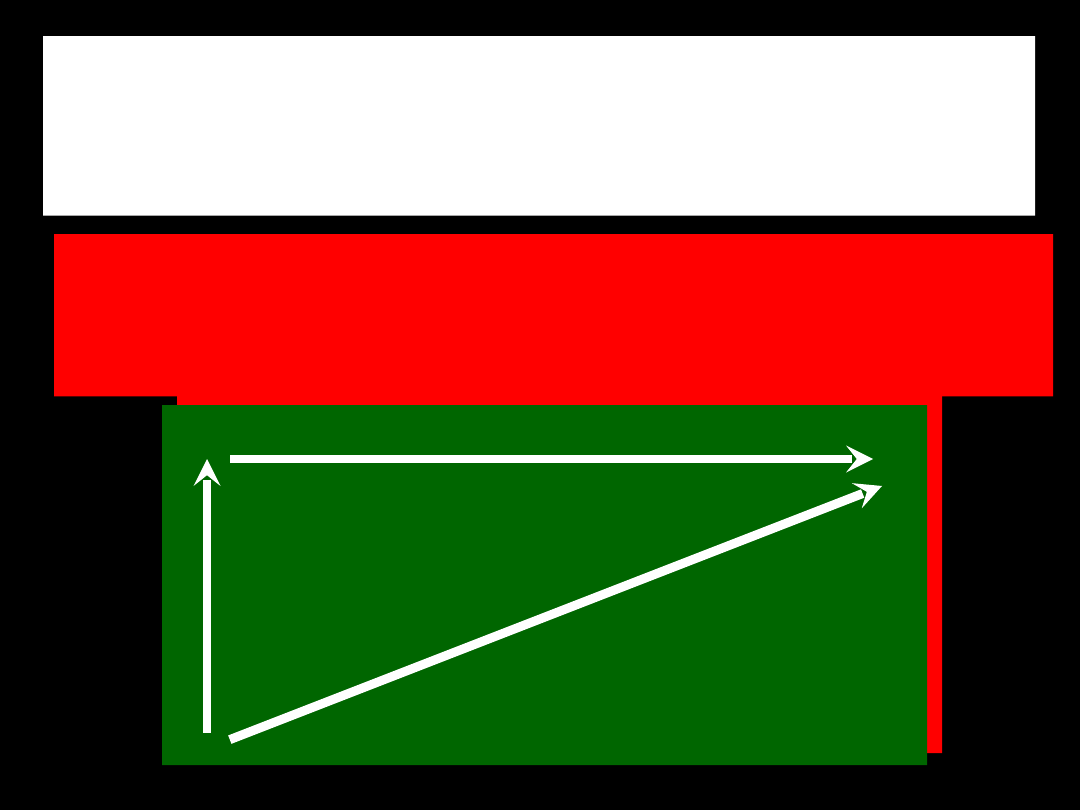
im mniejszy atom - tym silniej
wiąże przyłączony elektron,
gdyż elektron
ten znajduje się bliżej jądra
największe powinowactwo
elektronowe mają pierwiastki o niemal
całkowicie zapełnionych powłokach
elektronowych
największe powinowactwo
elektronowe
mają pierwiastki o niemal
całkowicie zapełnionych powłokach
elektronowych
litowce
(pierwiastki
o największym promieniu
atomowym)
najmniejsze wartości
powinowactwa
elektronowego

dążność
atomów do
przyłączania
elektronów
dążność
atomów do
przyłączania
elektronów

Liczby
w skali Paulinga
określają
względną
zdolność atomu
do przechodzenia
w stan ujemny
podczas
tworzenia się
wiązania
chemicznego
między atomami
i
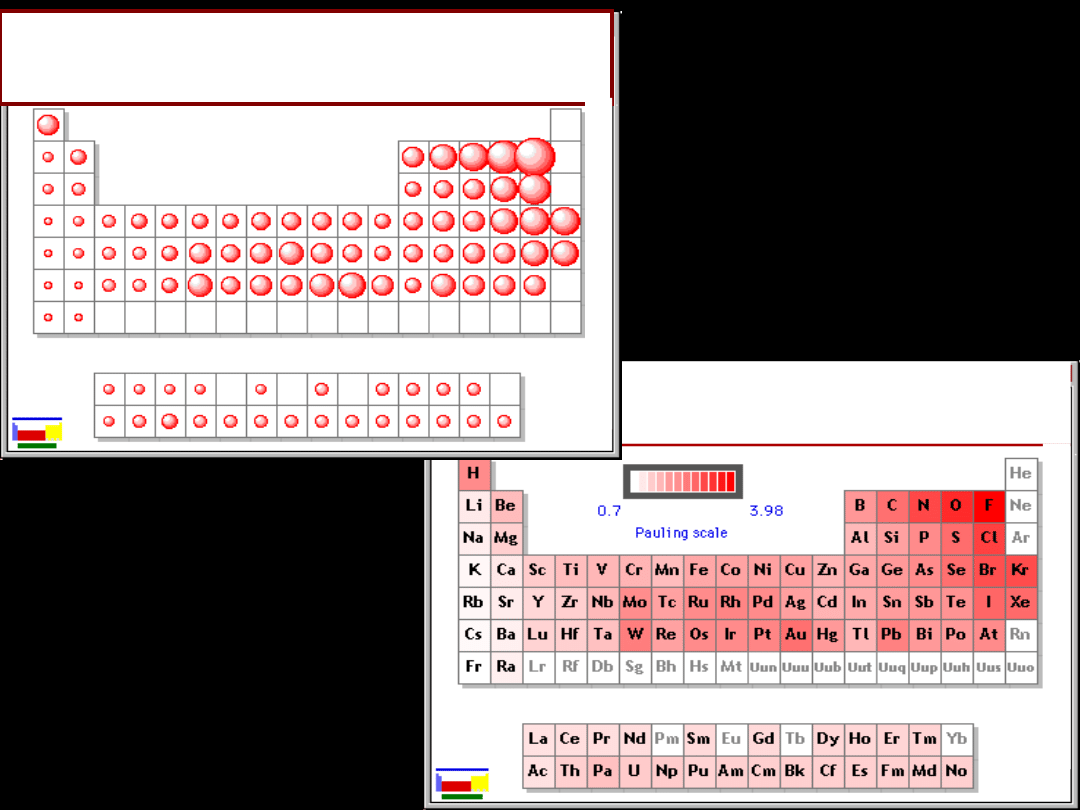
zawarte są między
0,6-4,0
Liczby
w skali Paulinga
określają
względną
zdolność atomu
do przechodzenia
w
stan ujemny
podczas
tworzenia się
wiązania
chemicznego
między atomami
i
zawarte są między
0,6-4,0

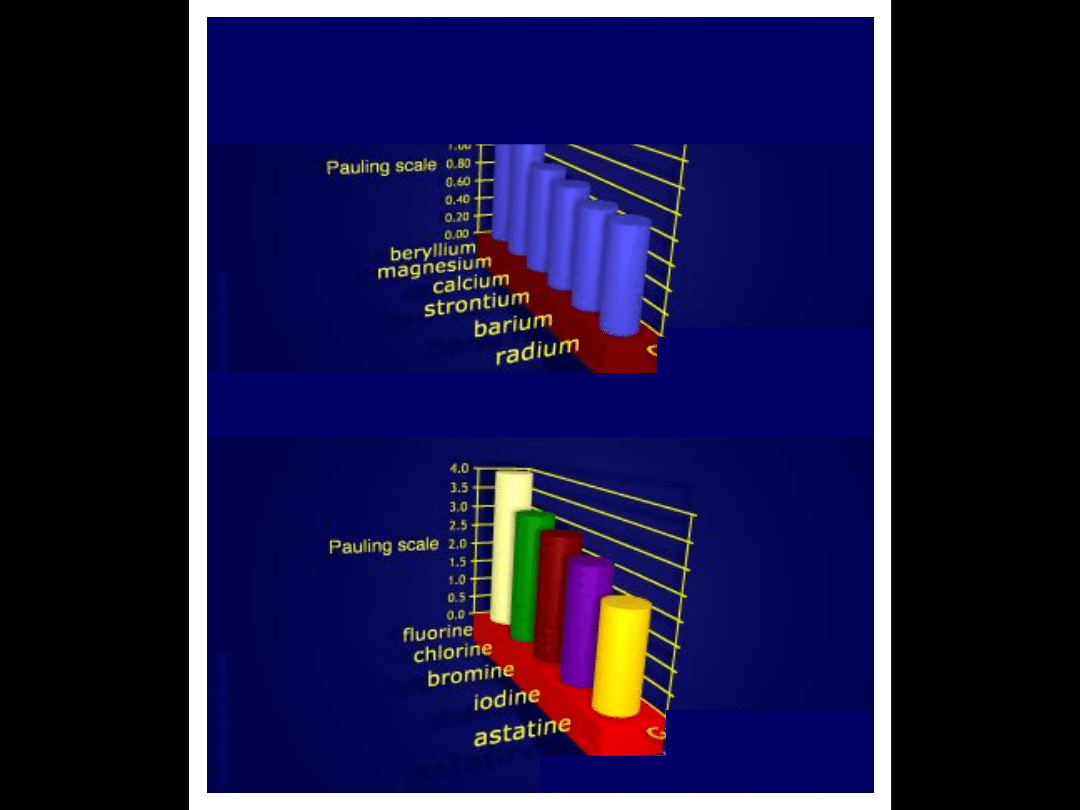
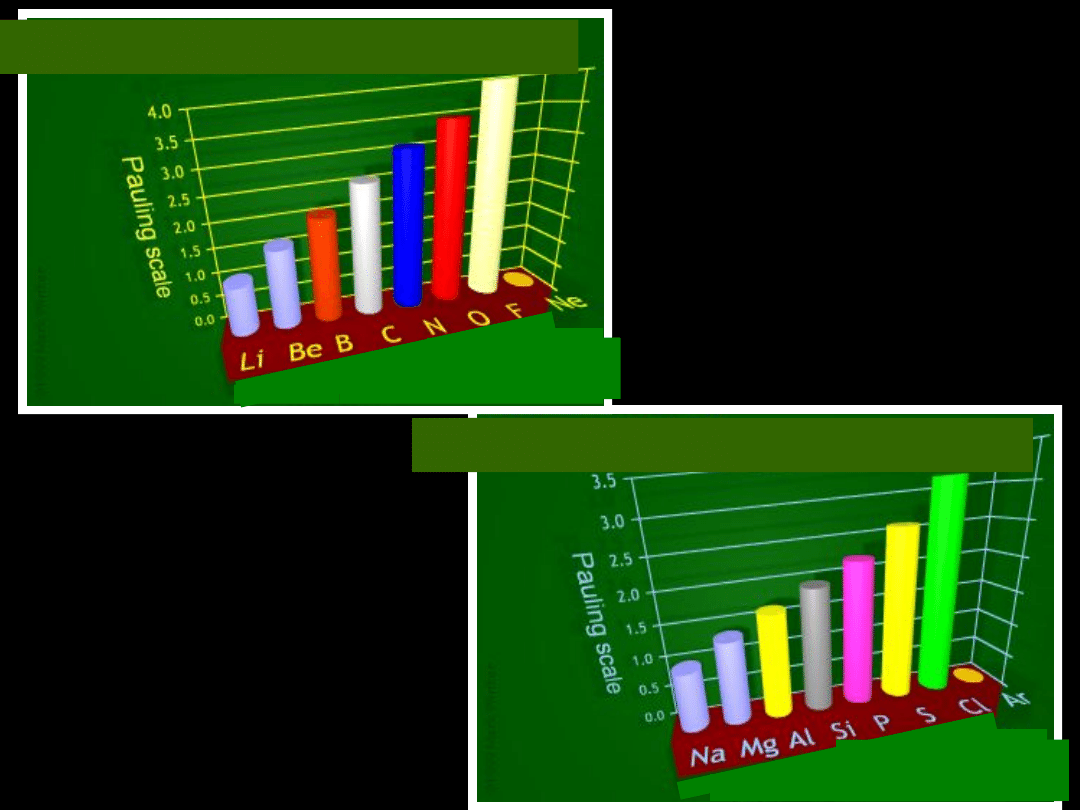
Grupa 1
Elektroujemność wg Paulinga
w
miarę
wzrostu
promienia
atomowego
(liczby atomowej) maleje
tendencja do przyłączenia
elektronów
ZMIANA
ELEKTROUJEMNOŚCI
Elektroujemność wg
Paulinga
Grupa 2
Grupa 17
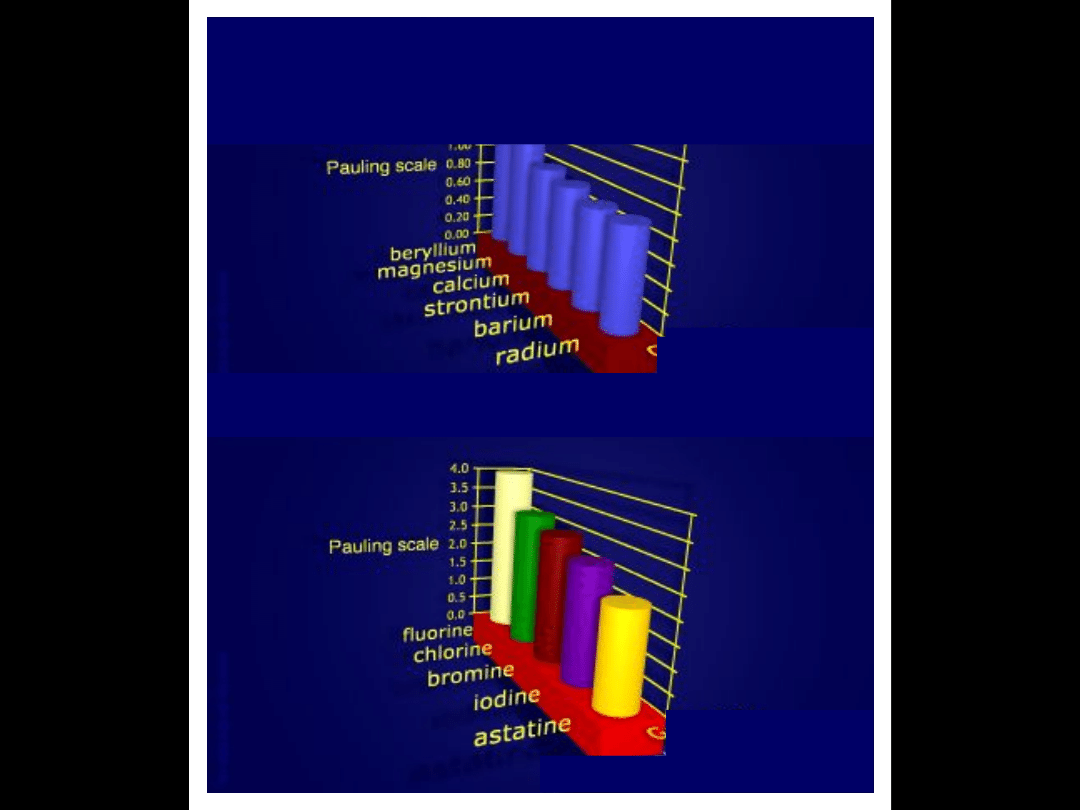
Elektroujemność wg
Paulinga
Grupa 2
Grupa 17
Elektroujemność wg Paulinga
Grupa
Elektroujemność wg Paulinga
Grupa

Elektroujemność wg
Paulinga
elektroujemność jest tym
większa
im więcej elektronów
zawiera warstwa
zewnętrzna
ZMIANA
ELEKTROUJEMNOŚCI
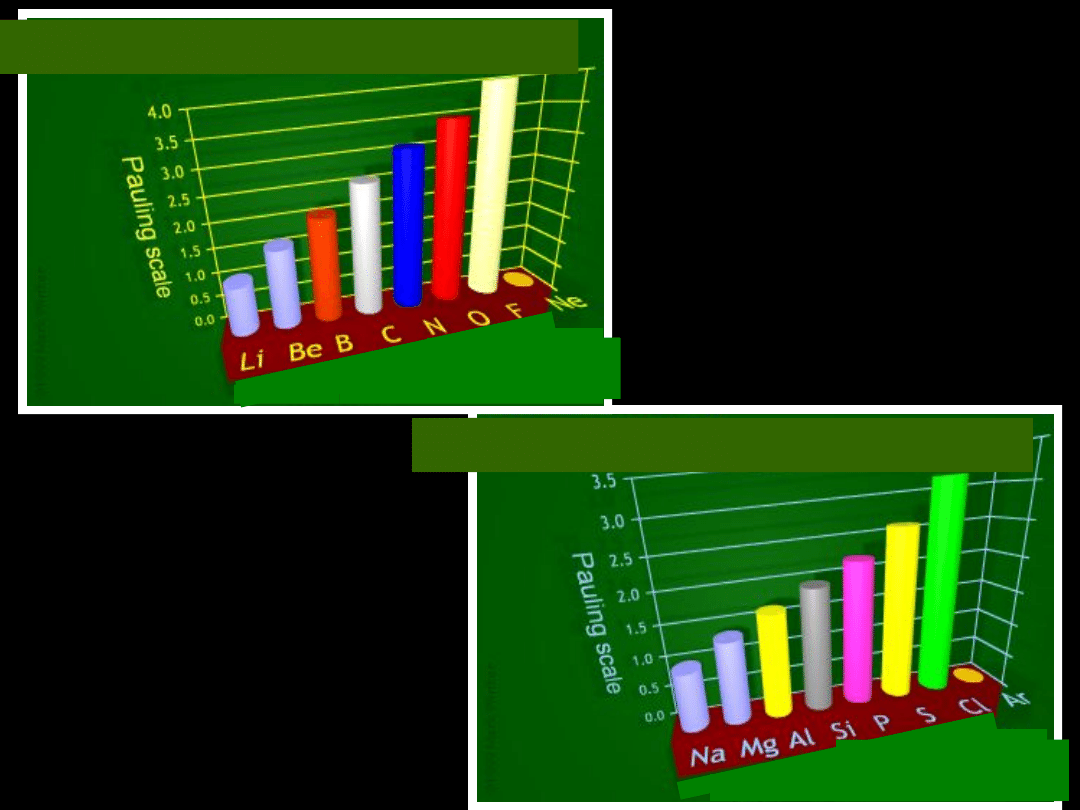
Elektroujemność wg Paulinga
Okres III
Elektroujemność wg Paulinga
Okres I
Elektroujemność wg Paulinga
Okres III
Elektroujemność wg Paulinga
Okres I
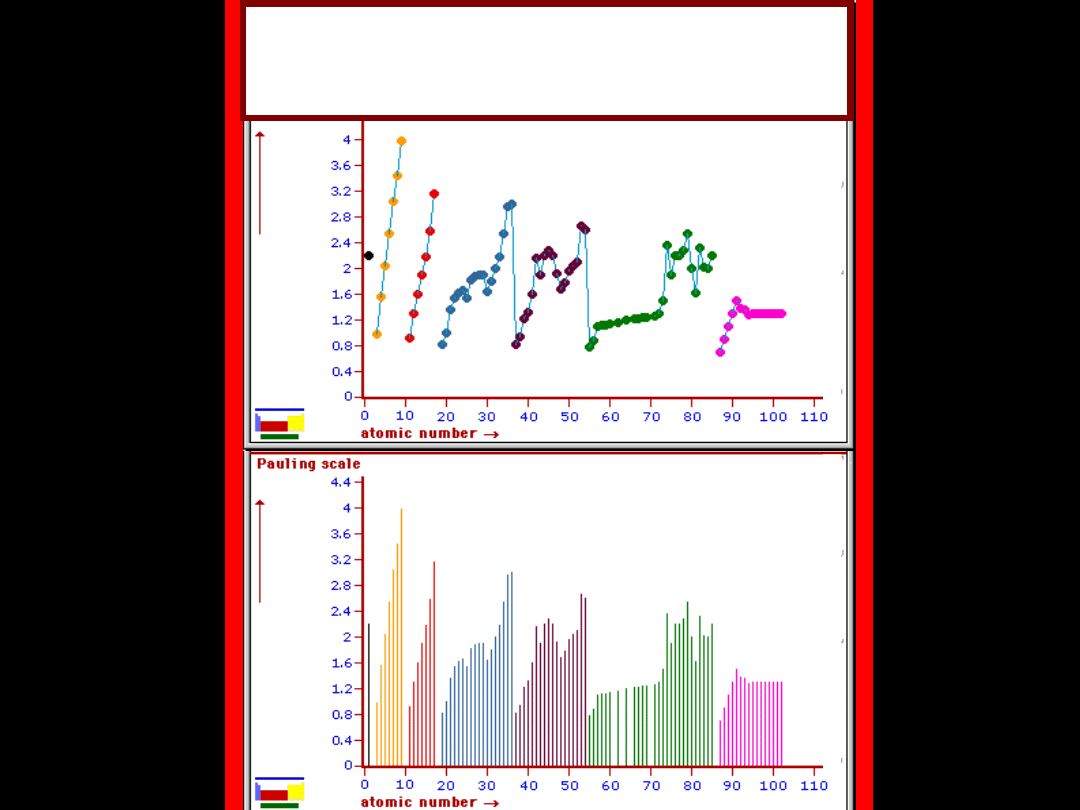
Zmiana elektroujemności w
zależności
od liczby atomowej
Zmiany elektroujemności
w układzie okresowym

Elektroujemność
pozwala określić
polarność wiązania
chemicznego
i jego odporność na
działanie
czynników chemicznych
— rodzaju atomów tworzących wiązanie
— krotności wiązania
— obecności niewiążących par elektronowych i
pustych orbitali
— stopnia zjonizowania wiązania
— stopnia utlenienia pierwiastka (ze wzrostem
stopnia utlenienia
wzrasta charakter
niemetaliczny)
Elektroujemność wiązania
zależy od:

liczba oddawanych lub
przyjmowanych elektronów
w procesie tworzenia
wiązania chemicznego
liczba wiązań tworzonych
przez atom danego
pierwiastka z innymi
atomami w zawiązku
chemicznym
liczba orbitali atomu
zaangażowanych w
tworzeniu wiązań
chemicznych
Stopnie utlenienia
pierwiastków dawnych grup głównych
Grupa
Powłoka
walencyj
na
Stopień
utlenienia
Przykłady związków
1
s
1
+1
Na
2
O, NaCl,
NaOH
2
s
2
+2
CaO, CaCl
2
, CaF
2
13
s
2
p
1
+3
Al
2
O
3
, Al(OH)
3
,
AlCl
3
14
s
2
p
2
–4, +2,
+4
–4 do
+4
CH
4
, CO, Na
2
CO
3
w związkach
organicznych
15
s
2
p
3
–3, +3,
+5
NH
3
, N
2
O
3
, NaNO
3
16
s
2
p
4
–2, +4,
+6
H
2
S, SO
2
, H
2
SO
4
17
s
2
p
5
od –1 do
+7
HCl, HClO
3
,
HClO
4
18
s
2
p
6
0

wszystkie występują na
+2
stopniu
utlenienia
występują
na
–1
stopniu
utlenienia
w
niektórych
połączeniach organicznych
występują
na
0
stopniu
utlenienia w karbonylkach
oraz na
zmiennych
stopniach
utlenienia

w praktyce chemicznej
najbardziej istotna jest
okresowość właściwości
chemicznych rozumiana jako
zdolność pierwiastków
do tworzenia określonych
związków
w praktyce chemicznej
najbardziej istotna jest
okresowość właściwości
chemicznych rozumiana jako
zdolność pierwiastków
do tworzenia określonych
związków
WODORKI dawnych grup głównych
WODORKI dawnych grup głównych
I (1)
II
(2)
III
(3)
IV
(14)
V
(15)
VI
(16)
VII
(17)
LiH BeH
2
B
2
H
6
CH
4
NH
3
H
2
O
HF
NaO
H
MgH
2
(AlH
3
)
x
SiH
4
PH
3
H
2
S
HCl
KH
CaH
2
Ga
2
H
6
GeH
4
AsH
3
H
2
Se
HBr
RbH SrH
2
InH
3
SnH
4
SbH
3
H
2
Te
HI
CsH BaH
2
TlH
3
PbH
4
BiH
3
H
2
Po
HAt
Wodorki pierwiastków II okresu
LiH, BeH
2
, B
2
H
6
, CH
4
,
NH
3
, H
2
O, HF
jonowe jonowe niepolarny atomowe atomowe spolaryzowane
Be
Be
Be
H
H
H
H
H
H
H
H
Be
Be
Be
Be
H
H
H
H
H
H
H
H
Be
OH
H
O
H
H
2
2
OH
H
O
H
H
2
2
H
H
H
H
H
H
B
B

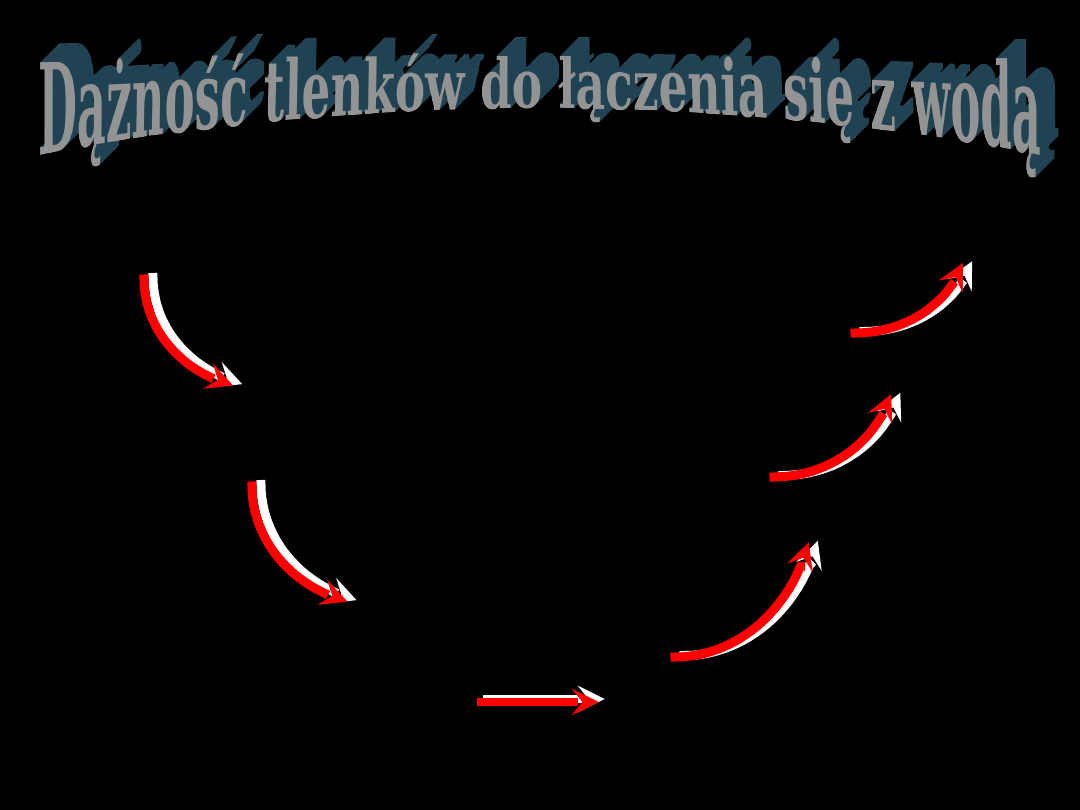
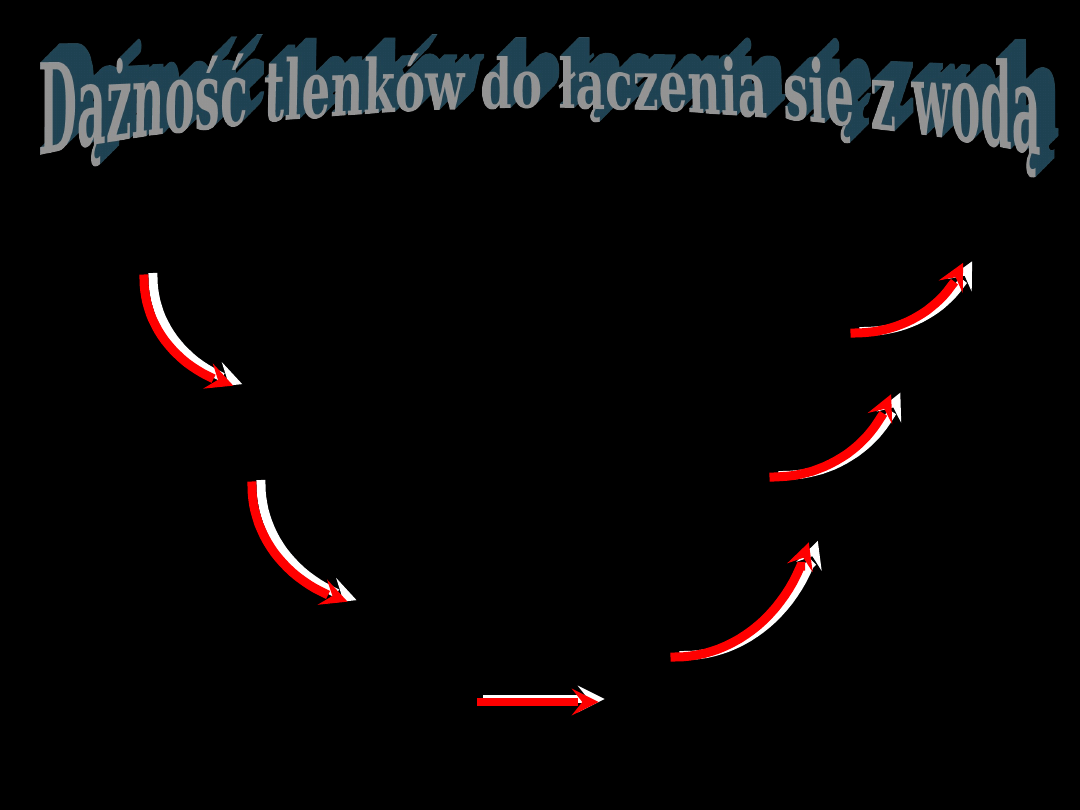
Wiele prawidłowości można
zaobserwować w szeregu połączeń
pierwiastków dawnych grup głównych z
tlenem
Na
2
O
Mg
O
Al
2
O
3
SiO
2
P
2
O
5
SO
3
Cl
2
O
7
wiązania
jonowe
przeważa
charakter
jonowy
wiązanie
kowalencyjne
silnie
spolaryzowane
wiązania
kowalencyjne
ciała stałe o wysokich
temperaturach topnienia
wysoka
temperatura
topienia ze
względu na
trójwymiarową
ciągłą strukturę
bardzo niskie
temperatury
topnienia
charakter
zasadowy
amfoterycz
ny
słabo kwasowy
kwasowy
umiarkowany silnie
bardzo silnie
NaOH
NaOH
Mg(OH)
2
Mg(OH)
2
Al
2
O
3
.
nH
2
O
Al(OH)
3
i
AlO
2
H
istnieją
Al
2
O
3
.
nH
2
O
Al(OH)
3
i
AlO
2
H
istnieją
HClO
4
HClO
4
H
3
PO
4
H
3
PO
4
H
2
SO
4
H
2
SO
4
SiO
2
.
nH
2
O
KOH
KOH
Ca(OH)
2
Ca(OH)
2
Ga
2
O
3
.
nH
2
O
Ga(OH)
3
i
GaO
2
H
istnieją
Ga
2
O
3
.
nH
2
O
Ga(OH)
3
i
GaO
2
H
istnieją
nie wyodrębniony
nie wyodrębniony
H
3
AsO
4
H
3
AsO
4
H
2
SeO
4
H
2
SeO
4
GeO
2
.
nH
2
O

pierwiastki przejściowe
mają częściowo
zapełnione
podpowłoki d lub f
pierwiastki przejściowe
mają częściowo
zapełnione
podpowłoki d lub f
I A
VI I IA
1s
1
H
Wodór
I I A
I I I A
I VA
VA
VI A
VI I A
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
I I I B
I VB
VB
VI B
VI I B
VI I I B
VI I I B
VI I I B
I B
I I B
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
blok d
blok d
blok s
blok p
blok f
1
3
5
6 7
9
8
10 11 12
13 14 15 16
4
17
18
2

wszystkie są
metalami
praktyczne wszystkie stanowią
twarde, wytrzymałe, trudno
topliwe i wysokowrzące metale,
dobrze przewodzące ciepło i
elektryczność
Istnieje
66
pierwiastków
przejściowych. Pierwiastki
do liczby atomowej 104
mają pewne wspólne
właściwości:

liczne
metale
przejściowe
są
dostatecznie
elektrododatnie,
by
roztwarzać się w kwasach mineralnych;
nieliczne są „szlachetne” tj. mają tak
wysokie potencjały elektrodowe, że nie
ulegają działaniu prostych kwasów
z
bardzo
nielicznymi
wyjątkami
wykazują zmienną wartościowość oraz
tworzą barwne jony i związki na
jednym, a nawet wszystkich stopniach
utlenienia
ze względu na częściowo zapełnione
podpowłoki elektronowe przynajmniej
niektóre związki metali przejściowych
są paramagnetyczne
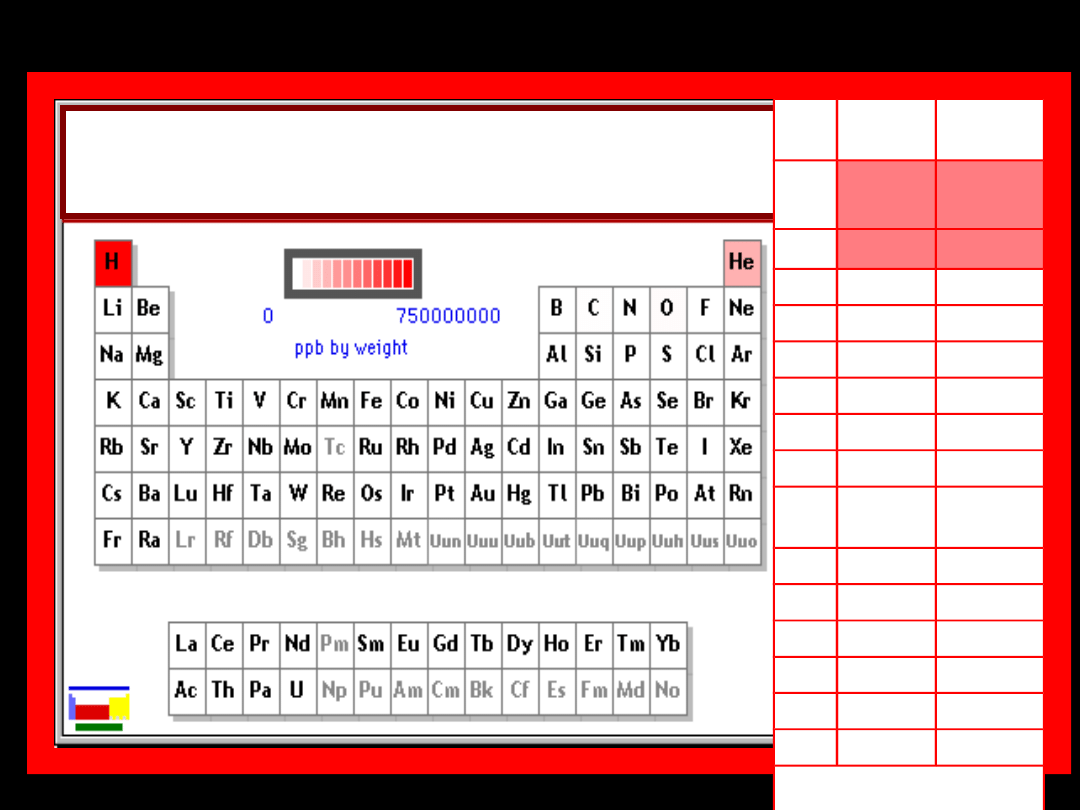
Pierwiastki występujące w
największych ilościach we
wszechświecie
L.p
.
Nazwa
%
masy
1.
wodó
r
73,0
2.
hel
25,0
3.
tlen
0,78
4.
węgiel 0,3
5.
żelazo
0,16
6.
neon
0,12
7.
azot
0,094
8.
krzem
0,07
9.
magn
ez
0,05
10. siarka
0,04
11. argon
0,018
12. nikiel
0,0086
13. wapń
0,0059
14. glin
0,005
15. sód
0,003
Razem:
99,6545
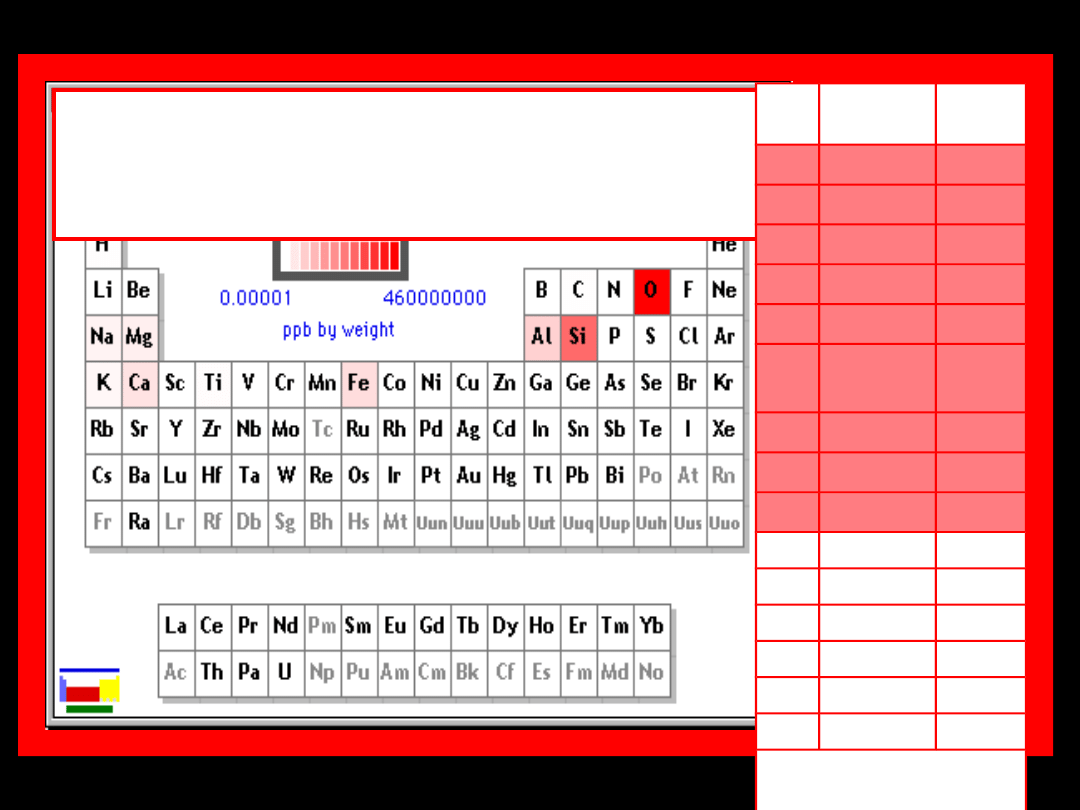
Pierwiastki występujące w
największych ilościach w
zewnętrznych warstwach ziemi
L.p
.
Nazwa
%
masy
1.
tlen
45,0
2.
krzem
27,0
3.
glin
8,22
4.
żelazo
6,14
5.
wapń
4,62
6.
magne
z
2,74
7.
sód
2,3
8.
potas
1,82
9.
wodór
0,9
10. tytan
0,63
11. chlor
0,19
12. fosfor
0,11
13. mangan 0,105
14. fluor
0,054
15. siarka
0,04
Razem:
99, 869
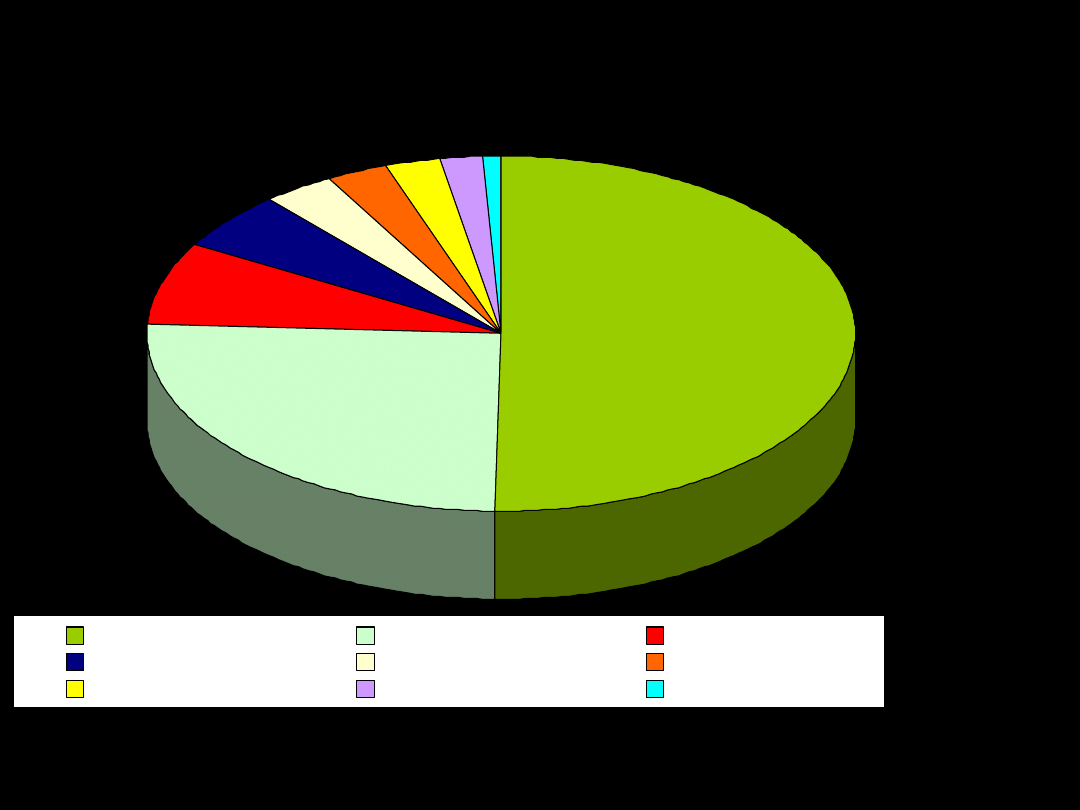
Spośród
88
naturalnych pierwiastków
chemicznych tylko
9
należy do grupy
pierwiastków pospolitych:
Razem: 98,60%
tlen 49,5%
krzem 25,3%
glin 7,5%
żelazo 5,08%
wapń 3,39%
sód 2,63%
potas 2,4%
magnez 1,93%
wodór 0,87%
tlen
krzem
glin
żelazo
wapń
sód K
Mg
Pierwiastki występujące w
największych
ilościach na słońcu
L.p
.
Nazwa
%
masy
1.
wodó
r
70,0
2.
hel
28,0
3.
tlen
0,8
4.
węgiel 0,3
5.
żelazo
0,14
6.
azot
0,1
7.
krzem
0,09
8.
magn
ez
0,07
9.
neon
0,05
10. siarka
0,04
11. nikiel
0,009
12. wapń
0,062
13. glin
0,006
14. sód
0,0035
15. argon
0,003
Razem:
99,6277

Pierwiastki występujące w
największych ilościach w
organizmie człowieka
L.p
.
Nazwa
%
masy
1.
tlen
65,0
2.
węgie
l
18,0
3.
wodó
r
10,0
4.
azot
3,0
5.
wapń
1,5
6.
fosfo
r
1,0
7.
siarka
0,25
8.
potas
0,2
9.
sód
0,15
10. chlor
0,15
11. magn
ez
0,05
12. żelazo
0,0057
13. cynk
0,0033
14. rubid
0,0017
15. stront
0,0002
Razem:
99,3109
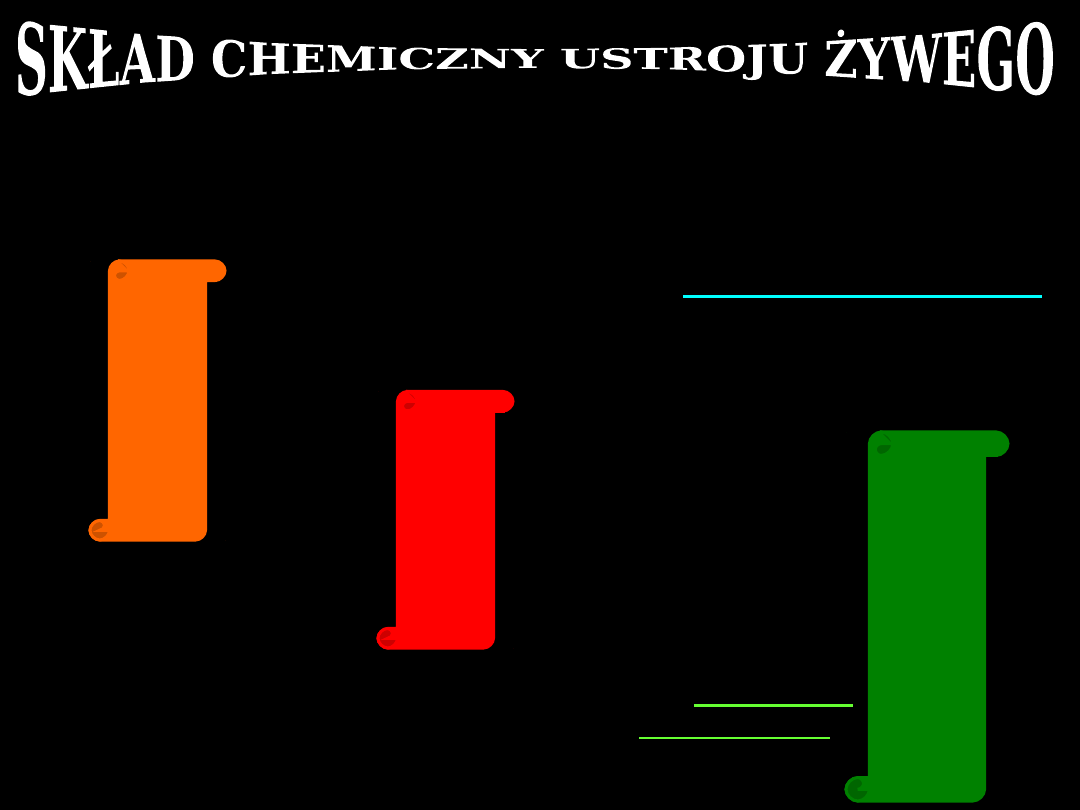
Organizmy roślinne i zwierzęce
składają się
z tych samych
podstawowych
pierwiastków chemicznych
(Lavoisier – XVIII)
C
H
O
N
P
oraz
takic
h
jak:
Ca
K
Na
Mg
Cl
pozostałe
pierwiastki
występują
w organizmach
w
ilościach
śladowych
:
F
I
Fe
Mg
Zn
Cu
Co

Poszczególne pierwiastki biorą udział
w budowie i funkcji ustroju żywego np.:
O
składnik wody,
H
składnik wody i związków
organicznych,
C
składnik związków
organicznych,
N
składnik aminokwasów, zasad
purynowych i pirymidynowych,
Fe
składnik Hb i katalizatorów
reakcji oddychania
Co
składnik witaminy B
12
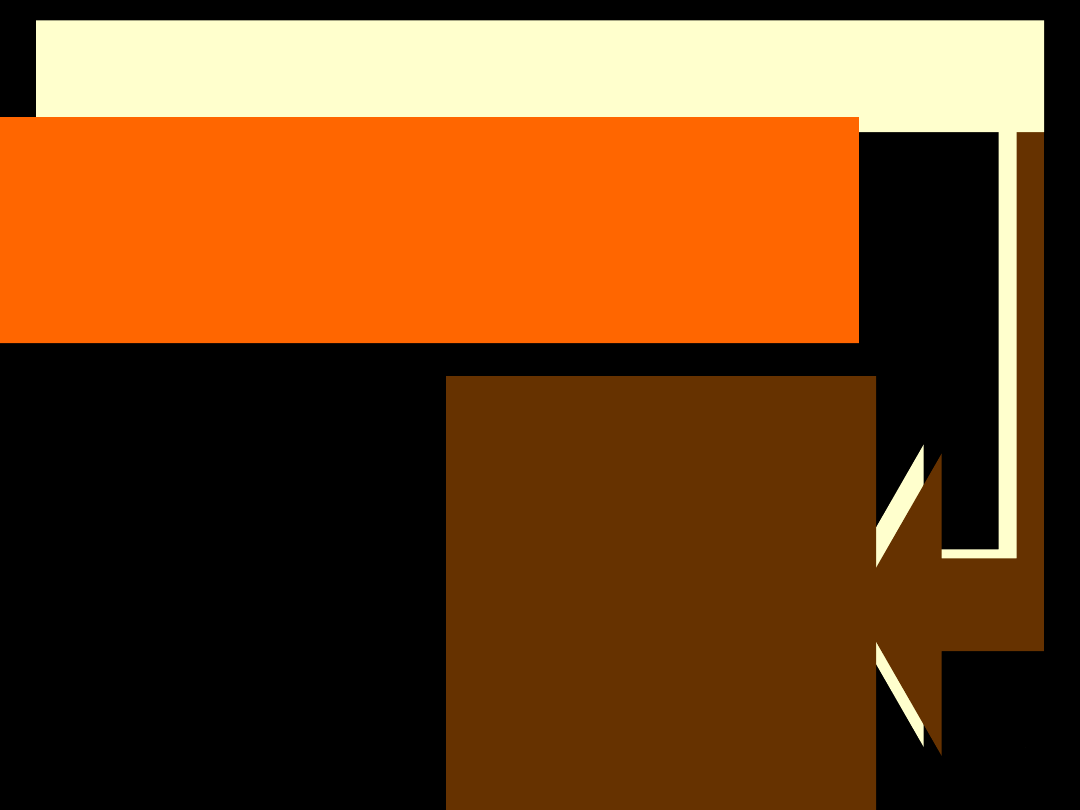
Przeważającą część masy
organizmów żywych stanowi woda:
MIEJSCE
WYSTĘPOWANIA:
ślina - 99,5%
sok żołądkowy - 97%
krew - 79%
serce - 79%
jelita - 77%
mięśnie
- 76%
skóra - 72%
chrząstki - 55%
dentyna zębów - 10%
WIEK:
kilkumiesięczny embrion - 97%
3 miesięczny płód - 94%
noworodek
- 66%
człowiek dorosły - 63-72%


1
18
1s
1
H
Wodór
2
13 14
15 16 17
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
3
4
5
6
7
8
9
10
11
12
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
J od
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
CHARAKTER TLENKU
zasadowy
zasadowy
amfoteryczny
amfoteryczny
kwasowy
gazy szlachetne
Układ z możliwością modyfikacji

IA
6
VIB
5
VB
4
IVB
3
IIIB
13
IIIA
1
0
VIIIB
7
VIIB
14
IVA
12
IIB
11
IB
18
VIIIA
17
VIIA
16
VIA
15
VA
8
9
blok p
blok s
blok s
blok f
blok d
2
3
4
5
6
7
1
blok d
2
IIA
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
Wyszukiwarka
Podobne podstrony:
9 wykad Ukady dyspersyjne [F] 2006
9 wykad Ukady dyspersyjne [F] 2006
9 wykad Ukady dyspersyjne [F] 10 2008
Semestr 2, Wykład 15, WYK˙AD XV
Semestr 2, Wykład 15, WYK˙AD XV
10 wykad Statyka kinetyka chemiczna[F 2006]
UK AD OKRESOWY PIERWIASTKOW
23 wykad 13 gr[1] borowce[F]2006
25 wykad 15 gr azotowce 01 2006[F]
folder, 15 wyk-ad, Uczeń
folder, 15 wyk-ad, Uczeń
12 wykad roztwory buforowe [F]2006
Ci±¬a bliąniacza (wyk ad&[1][1] 10 2006)
21 wykładów, MIKRO15, Wyk˙ad 15.
wyk%c5%82ad 7 15 12 12
uk ad pokarmowy
6 wykad WiĄzania chemiczne[F]
więcej podobnych podstron