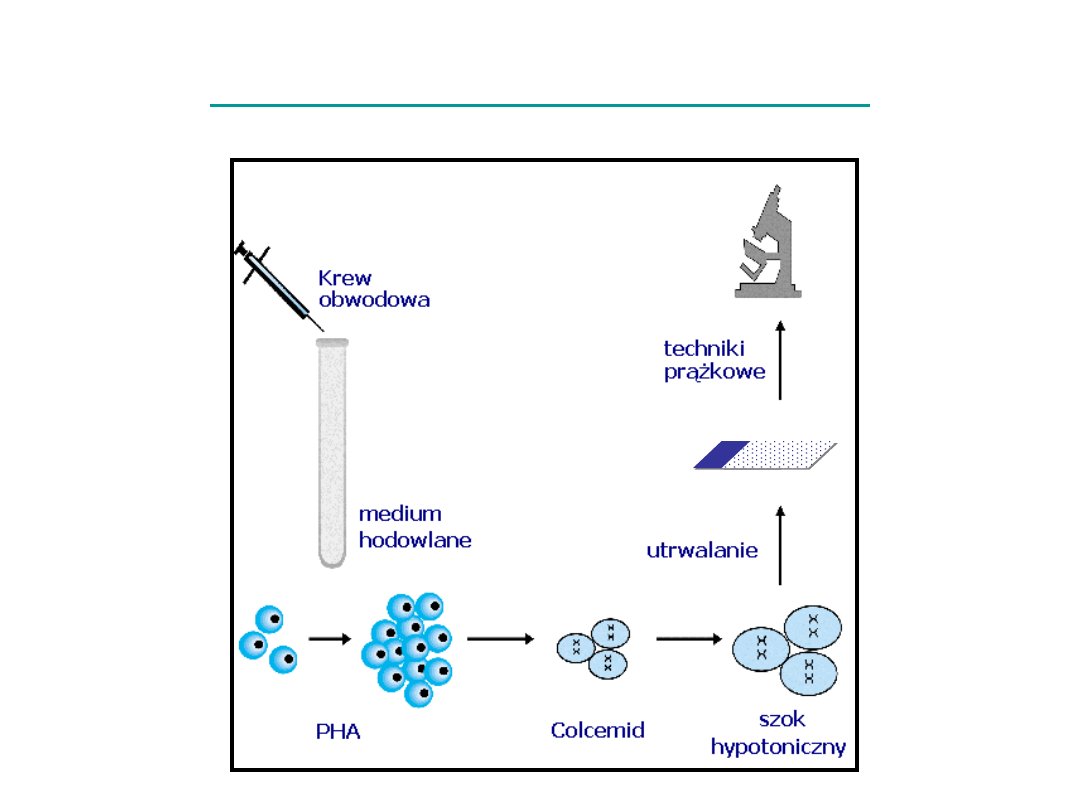
Oznaczanie kariotypu
Zakład Genetyki Medycznej
UM w Łodzi
mgr E. Zając

Etapy badania
cytogenetycznego
• Namnożenie komórek w hodowli in vitro w celu uzyskania
komórek dzielących się mitotycznie
• Nagromadzenie komórek w stadium metafazy uzyskane
poprzez inkubację z kolchicyną
• Zakończenie hodowli i sporządzenie preparatów
chromosomowych
szok hipotoniczny
utrwalenie komórek
naniesienie zawiesiny komórek na szkiełko podstawowe
• Wybarwienie chromosomów metoda prążkową
• Analiza chromosomów w mikroskopie przy powiększeniu 1000 x
• Sporządzenie dokumentacji obrazu chromosomów – kariogramu
• Wypisanie wyniku badania
• Zastosowanie technik cytogenetyki molekularnej w
uzasadnionych przypadkach.
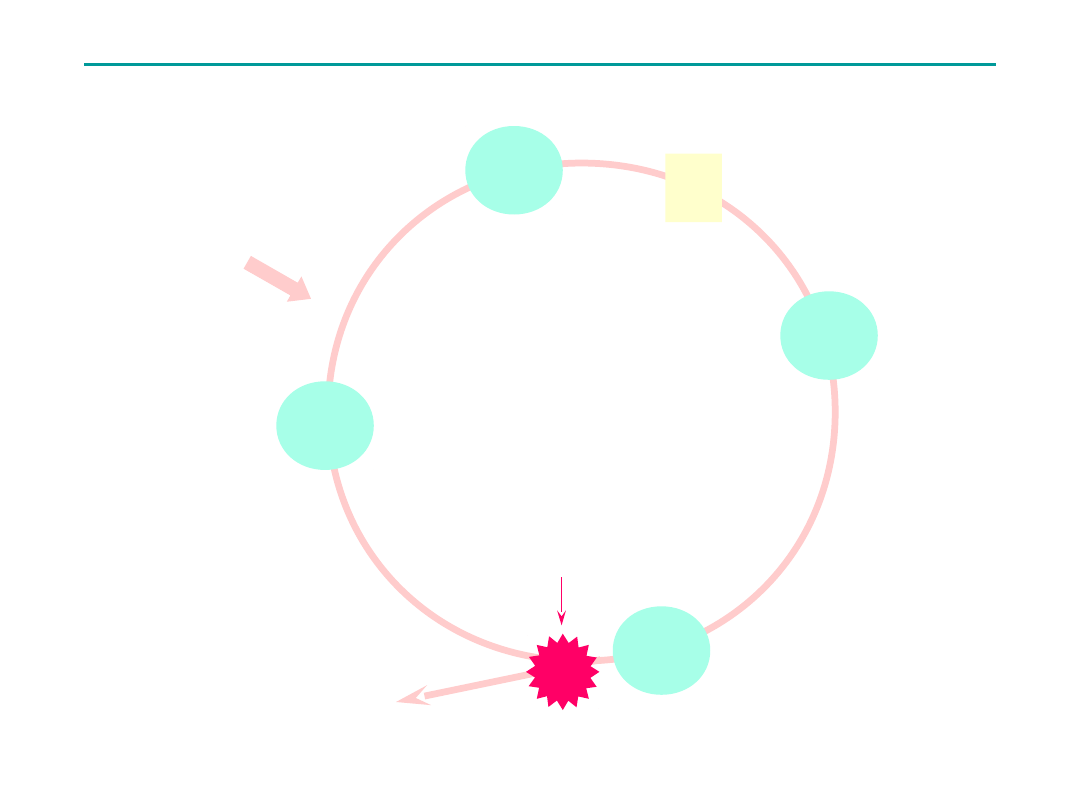
Standardowa hodowla limfocytów
G
0
G
1
G
2
wykończenie hodowli
M
S
stymulacja limfocytów
do wzrostu
Colcemid
PHA
Analiza cytogenetyczna:

Wymagania konieczne do
prowadzenia hodowli
cytogenetycznej
•Podłoże hodowlane odpowiednie dla rodzaju
hodowanej tkanki
•Jałowe naczynie w którym przebiega hodowla
•Inkubator ustawiony do temperatury 37 st.C z
automatycznym przepływem dwutlenku węgla ( 5
% CO2 )
Do momentu wykończenia każda hodowla
cytogenetyczna przebiega w warunkach jałowych

Rodzaje tkanek w których
oznacza się kariotyp
• Diagnostyka postnatalna:
– limfocyty krwi obwodowej (3-5 ml)
– fibroblasty skóry (biopsja skóry)
• Diagnostyka prenatalna:
– komórki owodniowe (zależnie od hbd)
– komórki trofoblastu
– komórki popłodu
• Diagnostyka nowotworowa:
– szpik
– komórki nowotworowe

Sposób pozyskiwania materiału
• limfocyty krwi obwodowej
2 ml pełnej krwi pobranej na heparynę w celu uniknięcia skrzepu w
proporcji 0,1 ml heparyny / 1 ml krwi
• komórki płodu
zawiesina komórek uzyskana po odwirowaniu wód płodowych
pobranych w czasie zabiegu amniopunkcji
• komórki trofoblastu
fragment trofoblastu uzyskany na drodze biopsji
• fibroblasty skóry
niewielki fragment skóry właściwej pobranej przy użyciu odpowiednich
narzędzi ( skin biopsy punches )
• fibroblasty gonad
materiał pobrany śródoperacyjnie
• fibroblasty popłodu
niewielki fragment tkanki popłodu pobrany w czasie sekcji
• szpik
biopsja szpiku (~1 ml)
• komórki nowotworowe
fragment guza litego

Założenie, przebieg i
wykończenie hodowli
Postnatalne badania cytogenetyczne
• Limfocyty krwi obwodowej
w probówce do hodowli limfocytów umieszczamy 9 ml kompletnego
podłoża Karyotyping, 0,5 ml mitogeu – LF-7 i 0,8 ml pełnej krwi
inkubujemy w cieplarce przez 72 h ( raz w ciągu dnia dokładnie
mieszamy )
po 48 h wymieniamy podłoże na świeże bez mitogenu
po upływie 72 h wykańczamy hodowlę poprzez dodanie Colcemidu,
zastosowanie
szoku hipotonicznego przy użyciu 0,075 M KCL i utrwalenie w
mieszaninie metanolu i kwasu octowego w stosunku 3:1
wykonujemy preparaty poprzez nakraplanie utrwalonej zawiesiny
na przygotowane szkiełka podstawowe

Założenie, przebieg i
wykończenie hodowli
Postnatalne badania cytogenetyczne
• Fibroblasty skóry, gonad, popłodu, komórki nowotworowe
fragment skóry właściwej inkubujemy w probówce w roztworze
Kolagenazy Typ IV w celu uzyskania zawiesiny pojedynczych komórek
zawiesinę komórkową przenosimy do naczynia ‘’ typu Falcon ‘’ i
dodajemy 6 ml kompletnego podłoża BioAmf-2
po upływie 5 – 7 dni po raz pierwszy obserwujemy hodowlę w
mikroskopie odwróconym, w przypadku uzyskania wzrostu komórek
wymieniamy podłoże co
2 -3 dni
w momencie uzyskania wzrostu komórkowego na całej powierzchni
naczynia wykonujemy pierwszy pasaż, czyli podział i przeniesienie
hodowanego materiału do kolejnych naczyń
wykańczamy hodowlę gdy obserwujemy odpowiedni wzrost i
odpowiednią liczbę figur podziałowych w jednym z naczyń poprzez
dodanie Colcemidu, zastosowanie szoku hipotonicznego przy użyciu 0,4
% chlorku potasu i cytrynianu sodu, utrwalenie w mieszaninie metanolu
i kwasu octowego w stosunku 3:1
wykonujemy preparaty poprzez nakraplanie utrwalonej zawiesiny na
przygotowane szkiełka podstawowe

Założenie, przebieg i
wykończenie hodowli
Prenatalne badania cytogenetyczne
•Komórki płodu - hodowla in situ
uzyskane wody płodowe wirujemy, supernatant przekazujemy do
badania biochemicznego, osad komórkowy zawieszamy w 0,5 ml
kompletnego podłoża BioAmf-2
nanosimy zawiesinę komórkową równomiernie na cztery szkiełka
nakrywkowe umieszczone w jałowych szalkach Petriego
po 24 h dodajemy 2 ml podłża, które następnie wymieniamy co 2 dni
wykańczamy hodowlę gdy obserwujemy odpowiedni wzrost komórek
i odpowiednią liczbę figur podziałowych w szalkach poprzez dodanie
Colcemidu, zastosowanie szoku hipotonicznego przy użyciu 0,8 %
cytrynianu sodu, utrwalenie w mieszaninie metanolu i kwasu
octowego w stosunku 3:1 oraz 2:3
preparatami są szkiełka nakrywkowe z utrwalonymi koloniami
amniocytów

Założenie, przebieg i
wykończenie hodowli
Prenatalne badania cytogenetyczne
• Komórki trofoblastu – hodowla bezpośrednia
uzyskane kosmki trofoblastu umieszczamy w szalce Petriego z
2ml podłoża BioAmf-2
po 72 h wykańczamy hodowlę poprzez dodanie Colcemidu,
zastosowanie szoku hipotonicznego przy użyciu 0,8 %
cytrynianu sodu, utrwalenie w mieszaninie metanolu i kwasu
octowego w stosunku 3:1
wykonujemy preparaty poprzez nakroplenie i rozprowadzenie
utrwalonej zawiesiny komórkowej na przygotowanych szkiełkach
podstawowych

Czas trwania hodowli
•Limfocyty krwi obwodowej – 72 godziny
•Fibroblasty skóry i inne – 2 do 3 tygodni
•Komórki płodu po hodowli in situ – 7 do 10 dni
•Komórki trofoblastu po hodowli bezpośredniej –
3 dni

Barwienie preparatów
Preparaty uzyskane po hodowli
cytogenetycznej barwimy
rutynowo techniką
prążków G ( GTG )
W przypadku stwierdzenia nieprawidłowości
wzoru prążków G wymagane jest
zastosowanie innych technik prążkowych :
•Technika prążków C ( CBG )
•Technika prążków Q ( QFQ )
•Technika prążków NOR
•Technika prążków DAPI

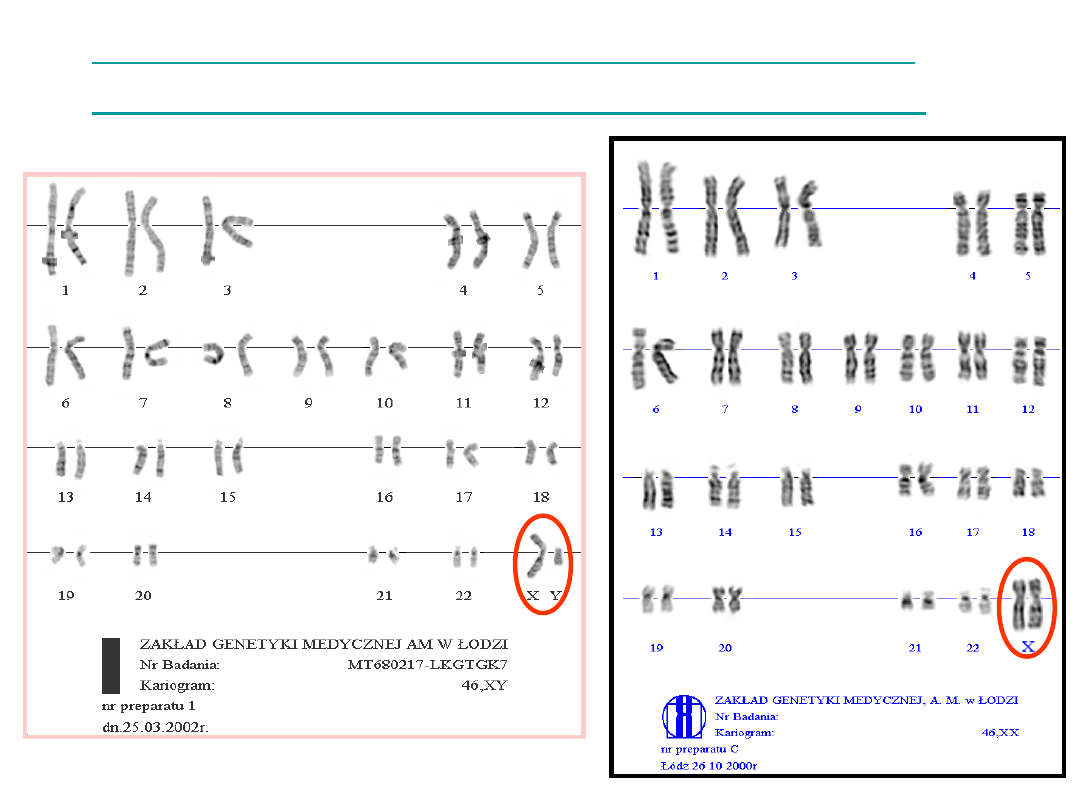
Technika prążków G (GTG)
Charakterystyczny wzór prążkowy dla każdego
chromosomu – na przemian jasne i ciemne
poprzeczne prążki.

Technika prążków GTG
46 chromosomów
22 autosomy
2 gonosomy
23 chromosomy od matki
23 chromosomy od ojca
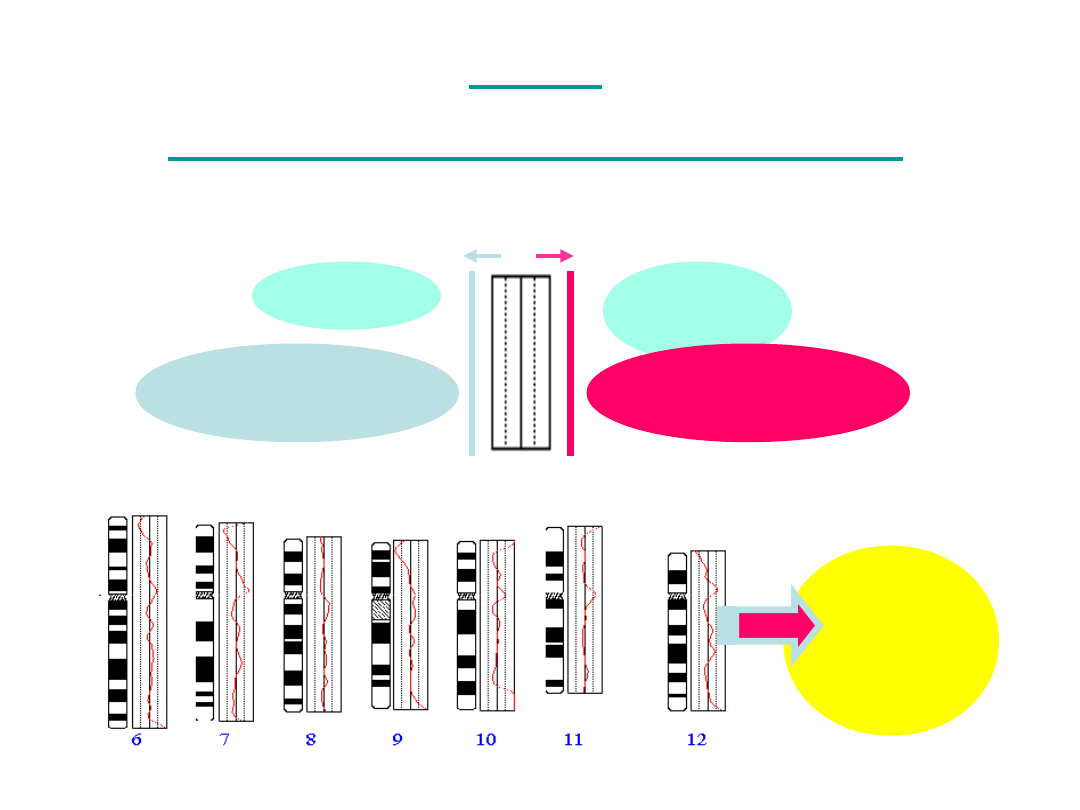
Numerowanie
prążków
centromer -> telomer
p =
krótkie ramię
q =
długie ramię
Ideogramy
Chromosomy:
• metacentryczne (pq)
• akrocentryczne (p<<q)
• submetacentryczne (p<q)
Technika GTG – prawidłowy karityp
męski, prawidłowy kariotyp żeński
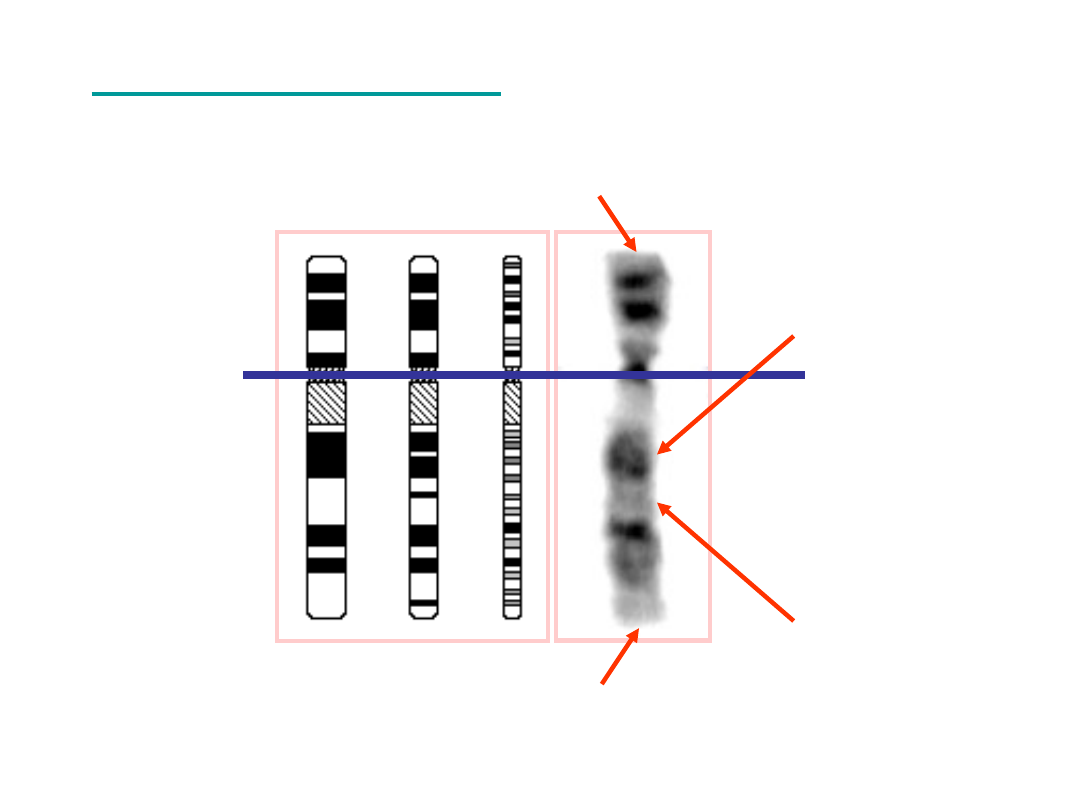
telomery
telomery
Prążki
G-pozytywne
AT
nieliczne geny
P
q
Prążki
G-negatywne
GC
głównie geny
centromer
Technika GTG

Technika prążków Q (QFQ)
Podobny do G wzór prążkowy uzyskany po barwieniu
quinakryną (barwnik fluorescencyjny). Intensywnie
zabarwia się dystalna część ramienia długiego chr.Y

Technika prążków C (CBG)
W postaci ciemnych prążków barwią się centromery wszystkich
chromosomów i heterochromotyna konstytutywna w
chromosomach 1, 9, 16, i Y.
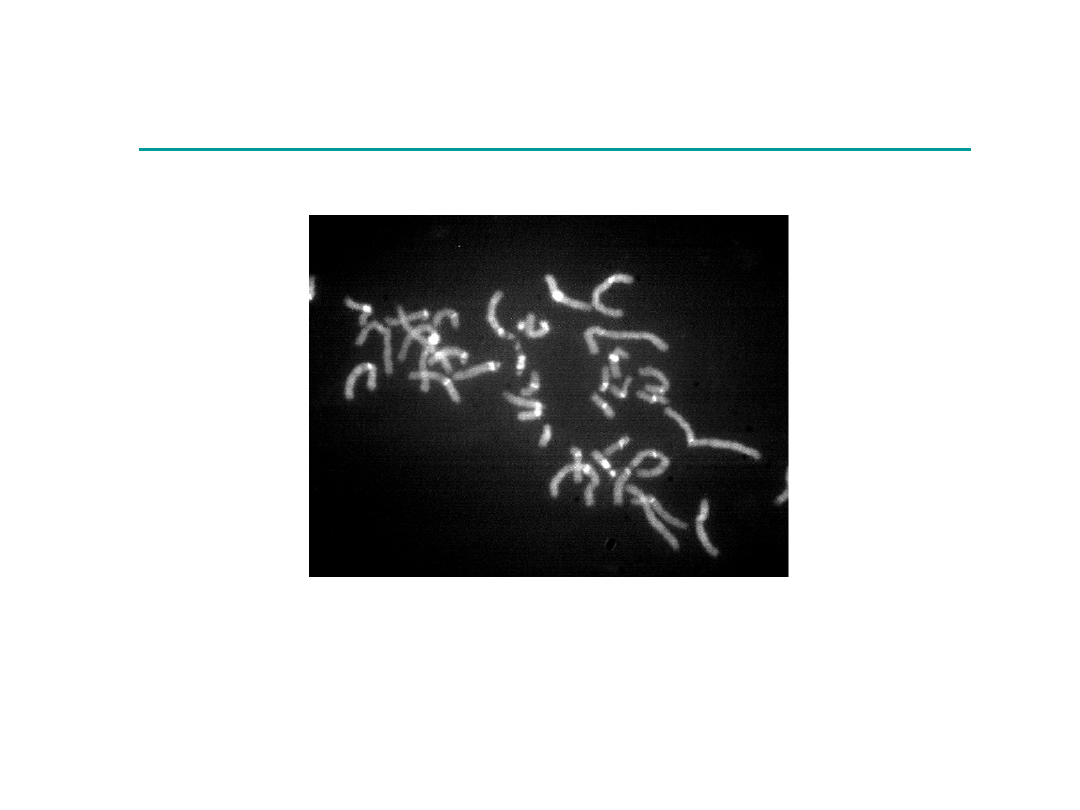
Technika barwienia DAPI
Wybarwia się heterochromatyna okołocentromerowa
chromosomów 1, 9, 16, dystalna część ramienia
długiego Y, ramiona krótkie chromosomu nr 15.

Technika barwienia NOR
Wybarwiają się obszary aktywnych organizatorów
jąderka wszystkich chromosomów akrocentrycznych.

•
Połączenie technik biologii molekularnej
z technikami klasycznej cytogenetyki
•
Identyfikacja rearanżacji chromosomowych
i chromosomów markerowych „de novo”
•
Detekcja niektórych aberracji chromosomowych
w komórkach okresu interfazy (cytogenetyka
interfazowa)
•
Określanie punktów złamań chromosomowych;
badania nad strukturą i funkcją
specyficznych regionów chromosomowych
•
Mapowanie fizyczne (fiber FISH)
Cytogenetyka molekularna
- założenia
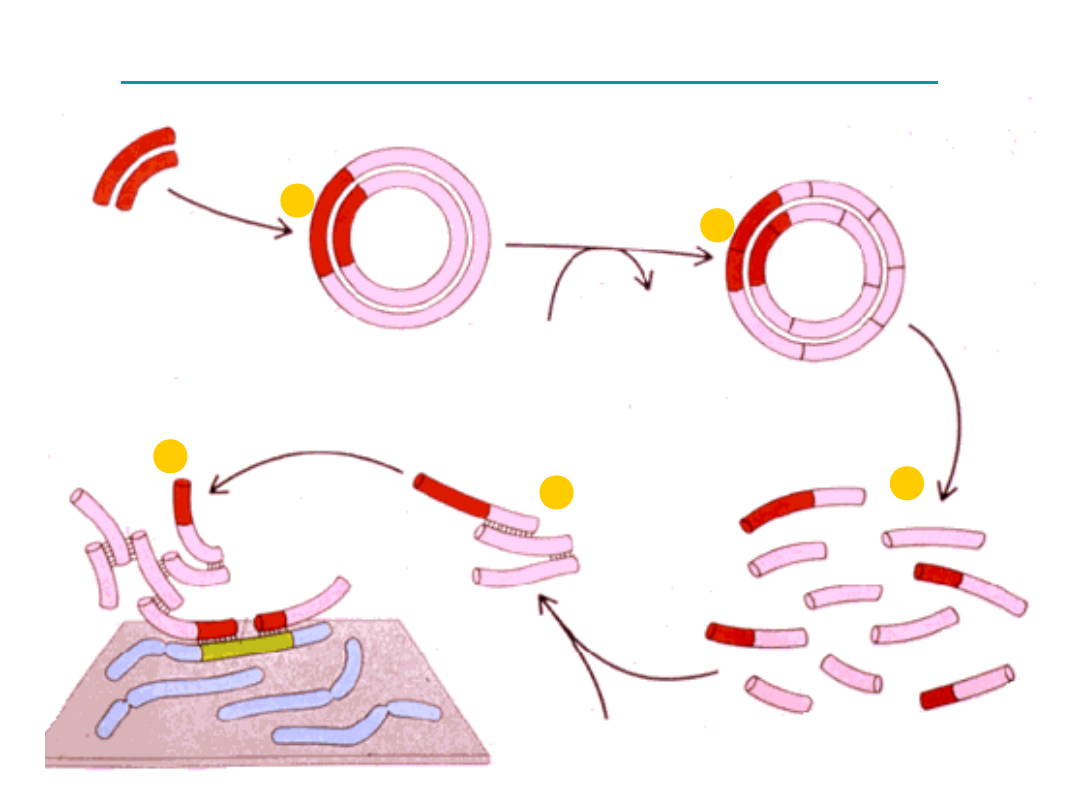
1
2
3
4
5
Sonda molekularna
DNA (dwuniciowa)
Wektor (plazmid)
denaturacja
dextran
hybrydyzacja
gen
Proces hybrydyzacji in situ

Techniki cytogenetyki
molekularnej
• FISH
( fluorescencyjna hybrydyzacja in situ )
• M-FISH
( wielokolorowy FISH )
• SKY
( spektralna analiza widmowa kariotypu )
• CGH
( porównawcza hybrydyzacja genomowa )
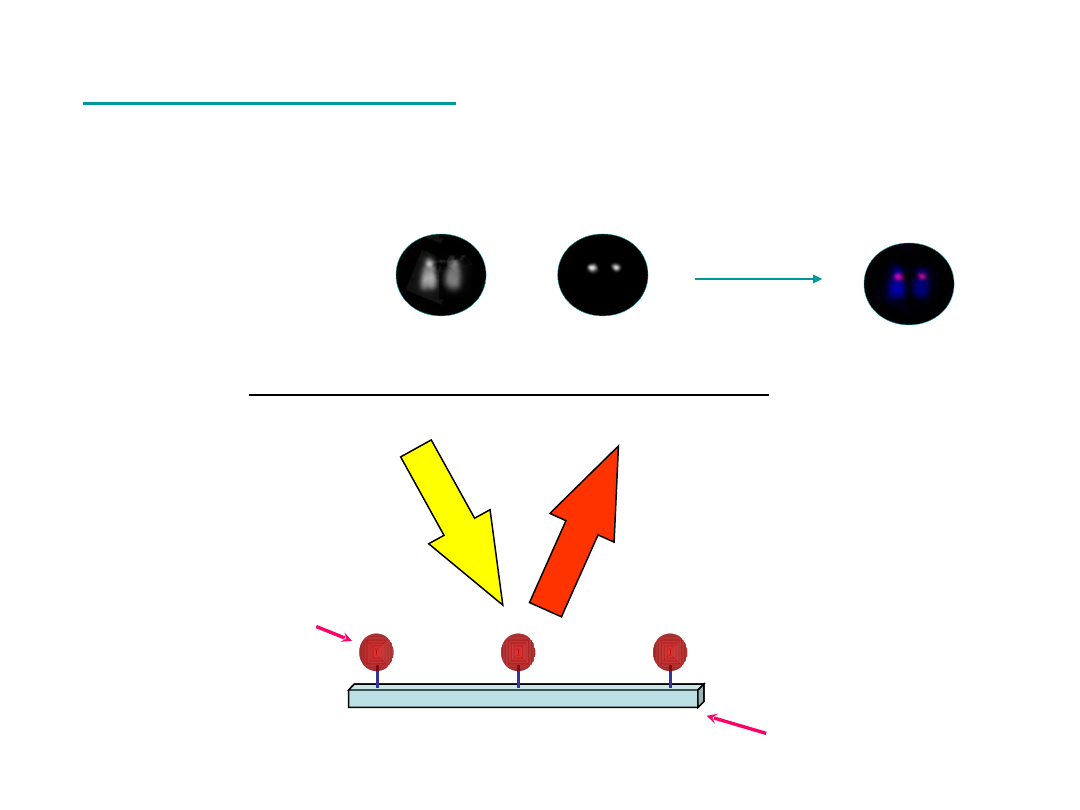
Technika FISH
wzbudzenie
emisja
fluorochrom
„sonda” DNA
filtr optyczny
DAPI
TRITC
+

Zastosowanie techniki FISH
•
Charakterystyka cytogenetyczna
aberracji strukturalnych
chromosomów
•
Wykrywanie
aneuploidii/poliploidii
•
Wykrywanie
aberracji
chromosomowych specyficznych
dla chorób nowotworowych

Technika FISH
- typy sond molekularnych
sonda
centromerowa
sonda
unikalna
z kontrolą
płytki metafazowe
- identyfikacja chromosomów
cytogenetyka interfazowa
- aberracje liczbowe chromosomów
identyfikacja regionu chromosomowego
zaangażowanego w rearanżację
chromosomową
identyfikacja chromosomu
sonda
malująca
identyfikacja chromosomów
markerowych
identyfikacja regionów chromosomowych
zaangażowanych w translokacje
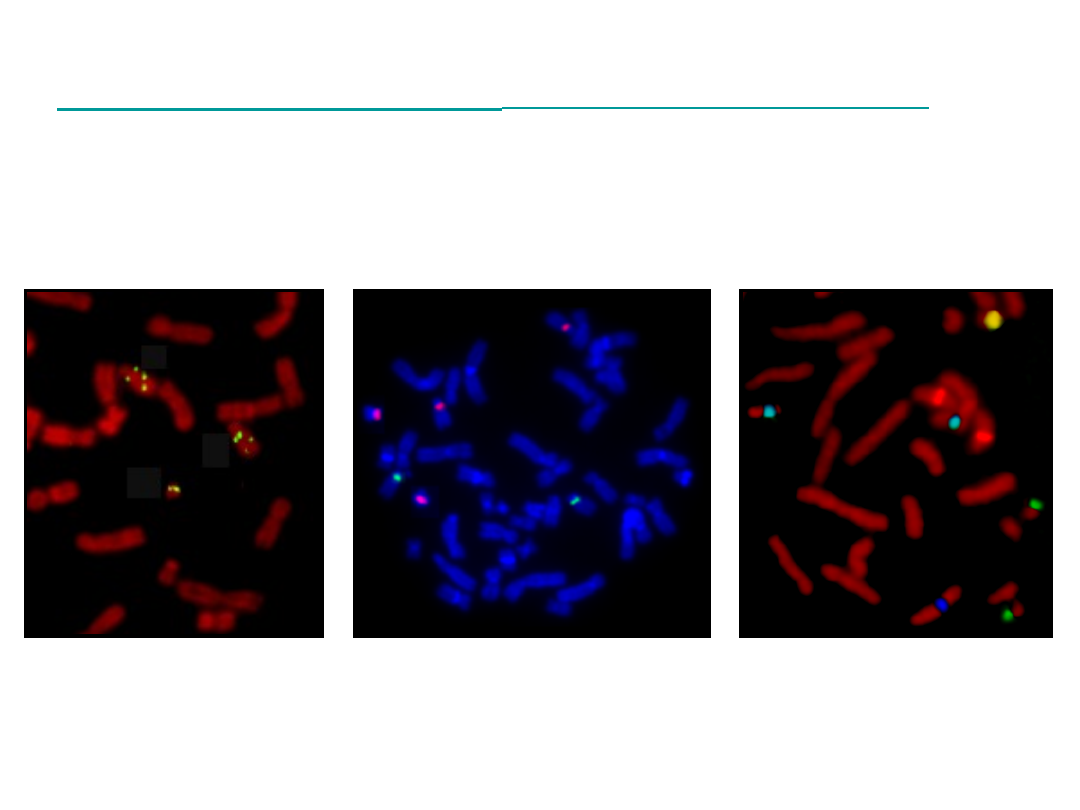
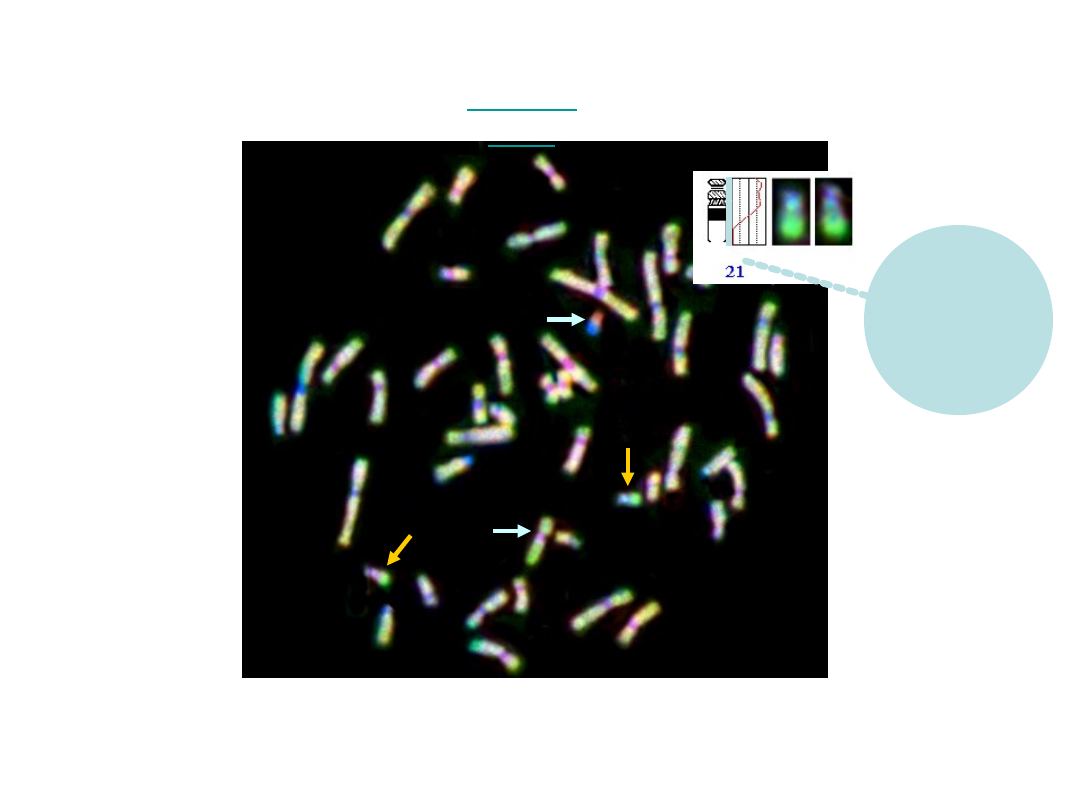
Technika FISH
- płytka metafazowa
LSI SNRPN
CEP13,21/CEP14,22
LSI13/LSI18/LSI21/CEPX/CEPY
FISH
dwukolorowa FISH
wielokolorowa FISH
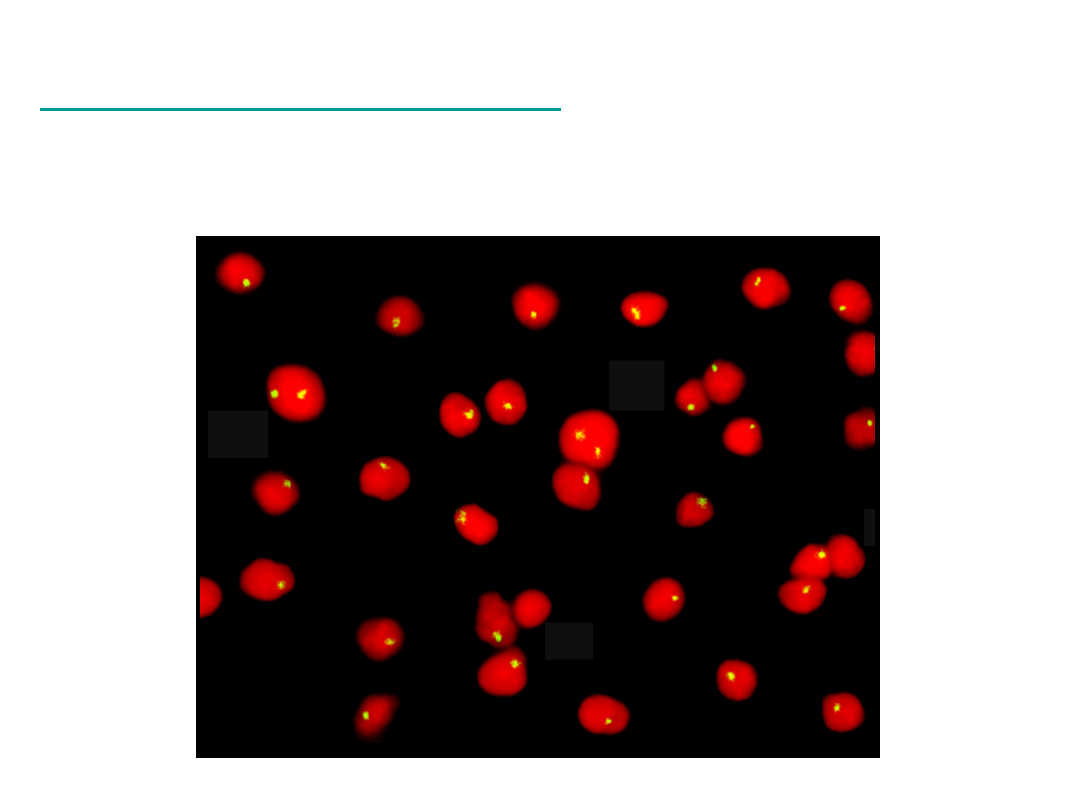
Interfazowy FISH
CEP Y

Multiplex FISH
M – FISH
Pula sekwencji DNA
każdego
chromosomu jest
bezpośrednio
znakowana jednym
lub kilkoma z pięciu
wykorzystywanych
fluorochromów
dzięki czemu po
hybrydyzacji
uzyskuje się
unikalny kolor dla
każdego z 24
chromosomów
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
X
Y
500
600
700
500
600
700
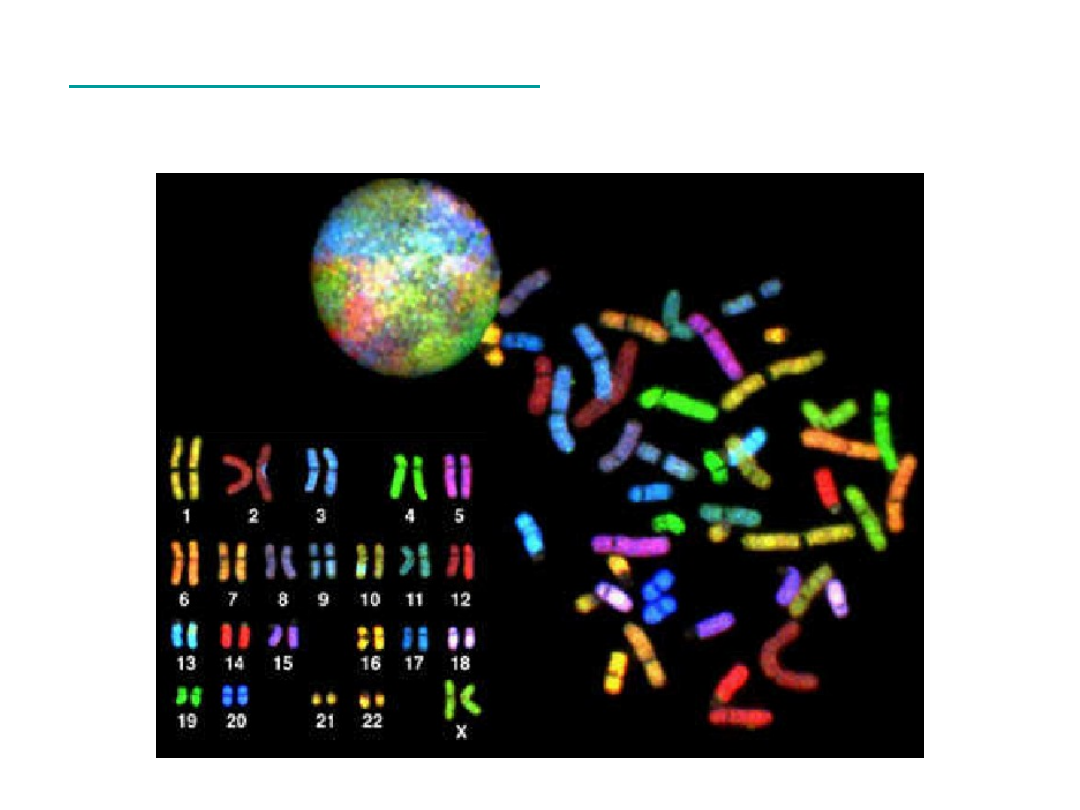
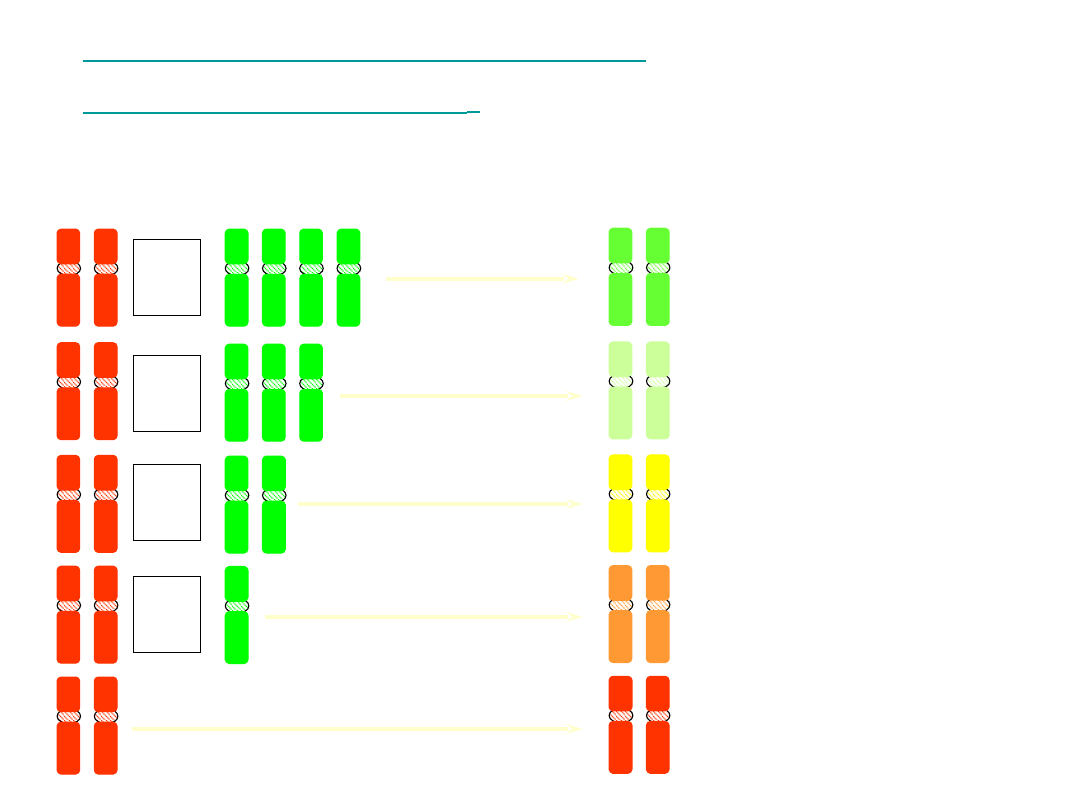
Multiplex FISH
M – F I S H

•
Rejestracja obrazu przy użyciu
monochromatycznej
kamery CCD
(w skali szarości) oddzielnie dla każdego
z 5 fluorochromów
•
Składanie obrazów i przypisanie pseudokolorów
dla każdej pary chromosomowej
• „Kolorowy”
kariotyp
•
Analiza chromosomów
nie jest możliwa
bezpośrednio
pod mikroskopem
Multiplex FISH
M–FISH

Spectral Karyotyping
SKY
•
Generowanie „obrazu” płytki metafazowej na podstawie
pomiaru spektrofotometrycznego dla każdego piksela w
odpowiedniej macierzy obrazu
•
Przypisanie pseudokolorów dla każdej pary
chromosomowej na podstawie uzyskanego wzoru (widma)
spektralnego
• „Kolorowy”
kariotyp

Diagnostyka :
•
translokacji chromosomowych zwłaszcza tych
obejmujących więcej niż dwa chromosomy
•
chromosomów markerowych
M–FISH i SKY - aplikacje
Określanie punktów złamań chromosomowych?

•
Detekcja
utraty lub amplifikacji
regionów chromosomowych na
poziomie prążka chromosomowego
•
Bez konieczności prowadzenia hodowli komórkowej
•
DNA badane i referencyjne wyznakowane różnymi
fluorochromami
•
Jednoczesna hybrydyzacja do kontrolnego preparatu
cytogenetycznego
•
Porównanie natężenia fluorescencji w chromosomów danej
pary
•
Możliwość detekcji różnic w ilości kopii DNA pomiędzy
referencyjnym i badanym DNA
CGH - założenia
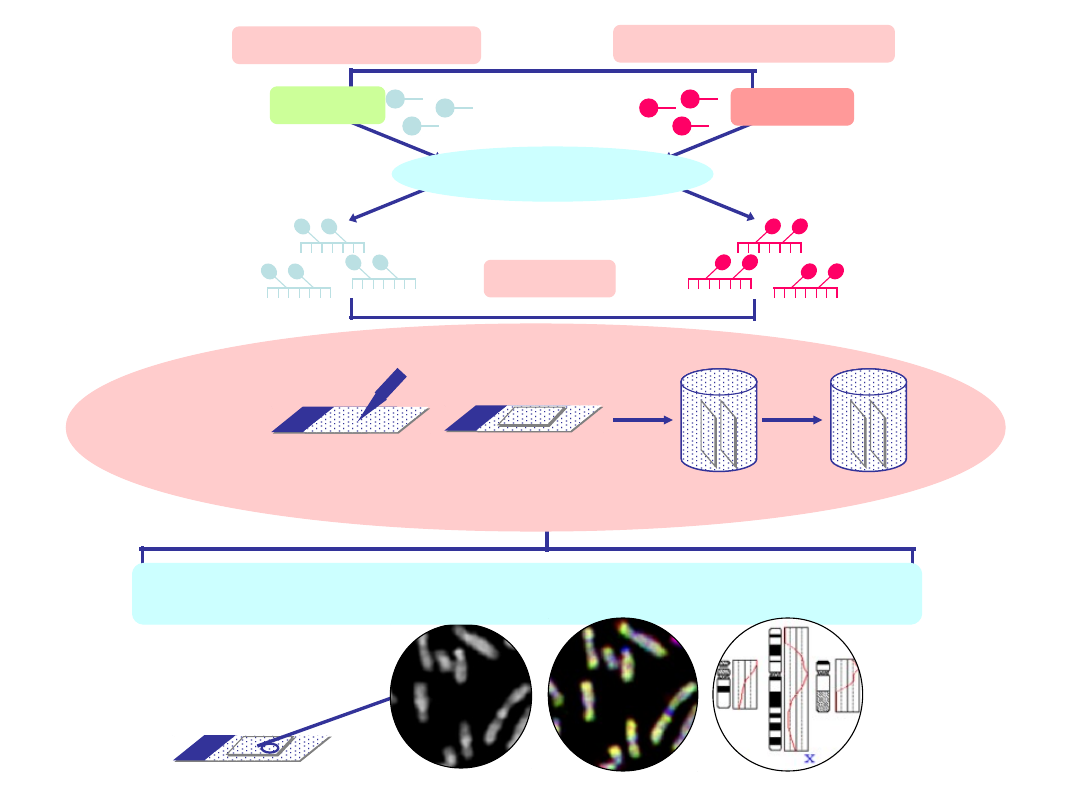
BADANE DNA - ?
KONTROLNE DNA – 46,XY
Cot-1 DNA
PREPRAT KONTROLNY -
46,XY
fragmenty DNA - 300-600 bp
SR-dUTP
SG-dUTP
Nick Translation
KO-DENATURACJA (73°C, 5-8’)
HYBRYDYZACJA (37°C, 3 dni)
0,3% NP-40
3’, 70°C
0,1% NP-
40
1’,
t.pok.
REJESTRACJA OBRAZU, IDENTYFIKACJA CHROMOSOMÓW, ANALIZA
STATYSTYCZNA
POLISOMIA,
DUPLIKACJA
MONOSOMIA
,
DELECJA
CGH
ANALIZA STATYSTYCZNA
„więcej kopii danej
sekwencji w badanym
DNA”
„więcej kopii danej
sekwencji w
kontrolnym DNA”
„tyle samo
kopii danych
sekwencji w
badanym i
kontrolnym
DNA”
COMPRATIVE GENOMIC
HYBRIDIZATION
RENUMERICAL
GREEN/RED
RATIO
KARIOTYPE
REFERENCE
DNA
(RED)
TEST DNA
(GREEN)
CGH
FINDINGS
+
+
+
+
4/2=2,0
3/2=1,5
2/2=1,0
1/2=0,5
TOTAL LOSS
TETRASOMY
TRISOMY
DISOMY
MONOSOMY
0/2=0,0

46,XX
Y
X
„brak
sekwencji
chromosomu
Y w
badanym
DNA”
„więcej
sekwencji
chromosomu
X w
badanym
DNA”
47,XX,
+21
Y
21
21
X
„więcej
sekwencji
chromosomu
21 w
badanym
DNA”

•
Detekcja
aneuploidii
chromosomowych oraz
amplifikacji DNA w trakcie diagnostyki
nowotworowej
•
•
Identyfikacja
chromosomów markerowych
w
trakcie diagnostyki pre- i postnatalnej
•
Detekcja
niezrównoważonych aberracji
chromosomowych
w trakcie diagnostyki pre-
i postnatalnej
•
Analiza chromosomów nie jest możliwa
bezpośrednio pod mikroskopem
CGH - aplikacje
!!! CGH nie umożliwia detekcji zrównoważonych aberracji chromosomowych !!!

Zastosowanie technik
cytogenetyki molekularnej
PREPARATY CYTOGENETYCZNE
•
Chromosomy
metafazowe
•
Jądra interfazowe
ABERRACJE CHROMOSOMOWE
•
Liczbowe
•
Strukturalne
•
Mikrodelecje/duplikacje
(+
)
(+
)
(+
)
(+
)
(+
)
(-)
(-)
(+)
(+)
(?)
(+)
(-)
(+)
(+)
(-)
FISH
CGH
M-
FISH

Podsumowanie
• Hodowla komórkowa
• Analiza kariotypu z wykorzystaniem
technik prążkowych
• Zastosowanie dodatkowych technik
cytogenetyki molekularnej (jeżeli jest
taka konieczność)
• Wynik + epikryza diagnostyczna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
Oznaczanie kariotypu
Oznaczanie kwasowości
Metody oznaczania ogólnej liczebności drobnoustrojów
rodzaje oznaczen i ich ochrooona
oznaczanie mas molowych
Calka oznaczona
co oznacza malzenstwo WWW ALEJAJA PL
Etanol skażony formaldehydem w nielegalnym obrocie napojami alkoholowymi wykrywanie i oznaczanie
www literka pl oznaczenia rezystorow,archiwum,2815,druku
Oznaczanie lipidów
Oznaczanie cynku
Oznaczanie zawartości wilgoci w węglu
oznaczenia warystorów
Oznaczanie kwasowości Wymiennej i Glinu Wymiennego metodą So, gleboznawstwo
OPONY - oznaczenia, AUDI 80 B4
Typologia bledow i sposoby ich oznaczania, inibsrinib, dydaktyka
więcej podobnych podstron