
Chemia Organiczna
Chemia Organiczna
kurs podstawowy
Anna Janecka
Zakład Chemii Biomolekularnej
Uniwersytet Medyczny w Łodzi
Chemia organiczna - związek z żywymi
organizmami.
XVIII wiek - teoria witalizmu
Związki organiczne izolowane z materiału
biologicznego.
Co to jest chemia organiczna ?
Co to jest chemia organiczna ?
C
H O N
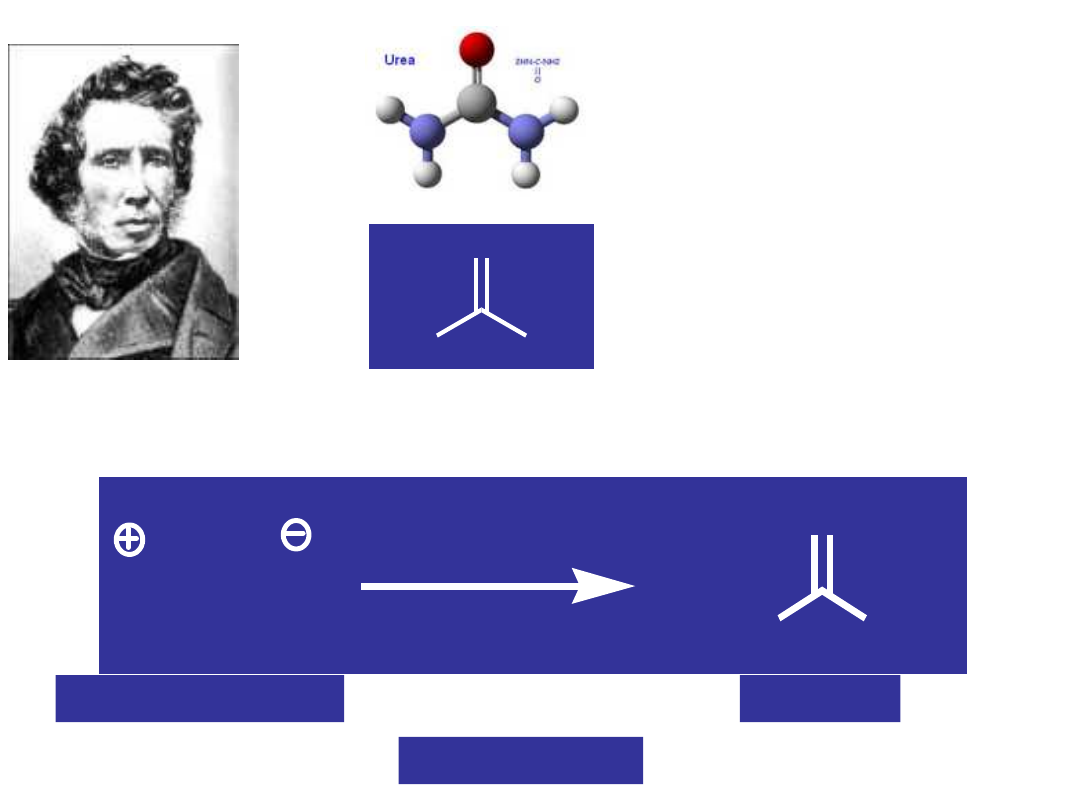
Mocznik
– końcowy
produkt
metabolizmu
białek, obecny w
moczu wszystkich
ssaków
O
H
2
N
NH
2
Friedrich Wöhler
(1800 – 1882)
cyjanian amonu
O
H
2
N
NH
2
NH
4
NCO
Getynga, 1828
mocznik

Chemia organiczna - nauka o
związkach węgla.
C
C
C
C
C
C
H
C
H
H
H
H
H
H
H
H
H
H H
H
H
H
H
C
C
C
C
C
C
H
H
H
H
H
H
Dlaczego węgiel jest tak wyjątkowym
pierwiastkiem?
Dlaczego węgiel jest tak wyjątkowym
pierwiastkiem?

Wszystkie związki organiczne zawierają jeden lub więcej
atomów węgla. Jednak nie wszystkie związki chemiczne
zawierające węgiel to związki organiczne
Cu(II)CO
3
diament
grafit

SH
S
S
Nikotyna –
alkaloid
zawarty w
liściach tytoniu
Tiol obecny w
wydzielinie skunksa
Zapach trufli
pochodzi
od tego związku
N
N
Przykłady związków organicznych w żywych organizmach
Naturalne versus syntetyczne
Związki naturalne - wyprodukowane przez rośliny
lub
w organizmach zwierzęcych.
Związki syntetyczne - otrzymane w laboratorium.
O C
O
CH
3
COOH
OH
COOH
A
B
kwas salicylowy kwas acetylosalicylowy (aspiryna)
•penicylina – naturalna, często powoduje reakcje
alergiczne, modyfikowana - nie

Wiązania
chemiczne
Wiązania
chemiczne
Cząsteczki posiadają zwykle niższą energię niż
pojedyncze atomy. Dążność atomów do obniżania
swojej energii jest siłą napędową tworzenia się
cząsteczek.
Gazy szlachetne – nie reagują z innymi pierwiastkami.
stabilna konfiguracja elektronowa - 8 elektronów
walencyjnych
(wyjątek He – 2 elektrony walencyjne)
Atomy innych pierwiastków starają się uzyskać konfigurację gazu
szlachetnego położonego najbliżej w układzie okresowym.

Reguła
oktetu
Reguła
oktetu
Atomy mogą
tracić, zyskiwać
lub
uwspólniać
elektrony,
aby uzyskać 8 elektronów (oktet) w powłoce
walencyjnej (tak jak gazy szlachetne).
Wyjątek:
H, Li, Be dążą do uzyskania 2 elektronów
walencyjnych (tak jak w powłoce He).
atomy
tracą
elektrony
atomy
zyskują
elektrony
atomy
uwspólniają
elektrony
wiązanie jonowe
wiązanie
kowalencyjne
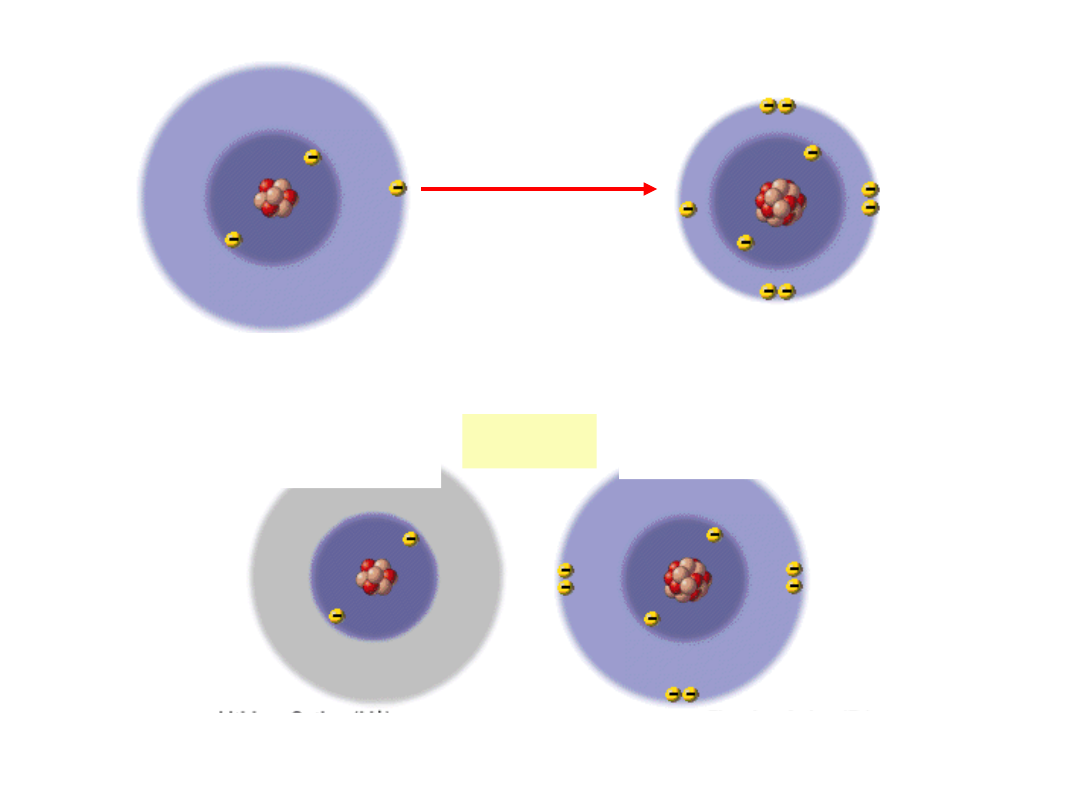
Wiązanie jonowe
3
Li -
1s
2
2s
1
9
F -
1s
2
2s
2
2p
5
1 elektron w
powłoce
walencyjnej
7 elektronów w
powłoce
walencyjnej
powłoka walencyjna
wypełniona
powłoka walencyjna
wypełniona
Li
+
F
-
Metale są elektrododatnie
Niemetale są elektroujemne
tworzą jony
dodatnie
(kationy)
tworzą jony
ujemne (aniony)
Wiązania jonowe tworzą się pomiędzy
metalami
i
niemetalami.
Atomy
elektrododatnie
- tendencja do
oddawania
elektronów
(np.Li).
Atomy
elektroujemne
- tendencja do
przyłączania
elektronów
(np.F).
Wiązanie
kowalencyjne
Wiązanie
kowalencyjne
podobna elektroujemność -uwspólnienie
elektronów
A. .B A:B
:
H. + .H
H:H + ciepło
Wspólna para elektronów -
wiązanie
kowalencyjne
Wiązania kowalencyjne tworzą się pomiędzy
niemetalami
.
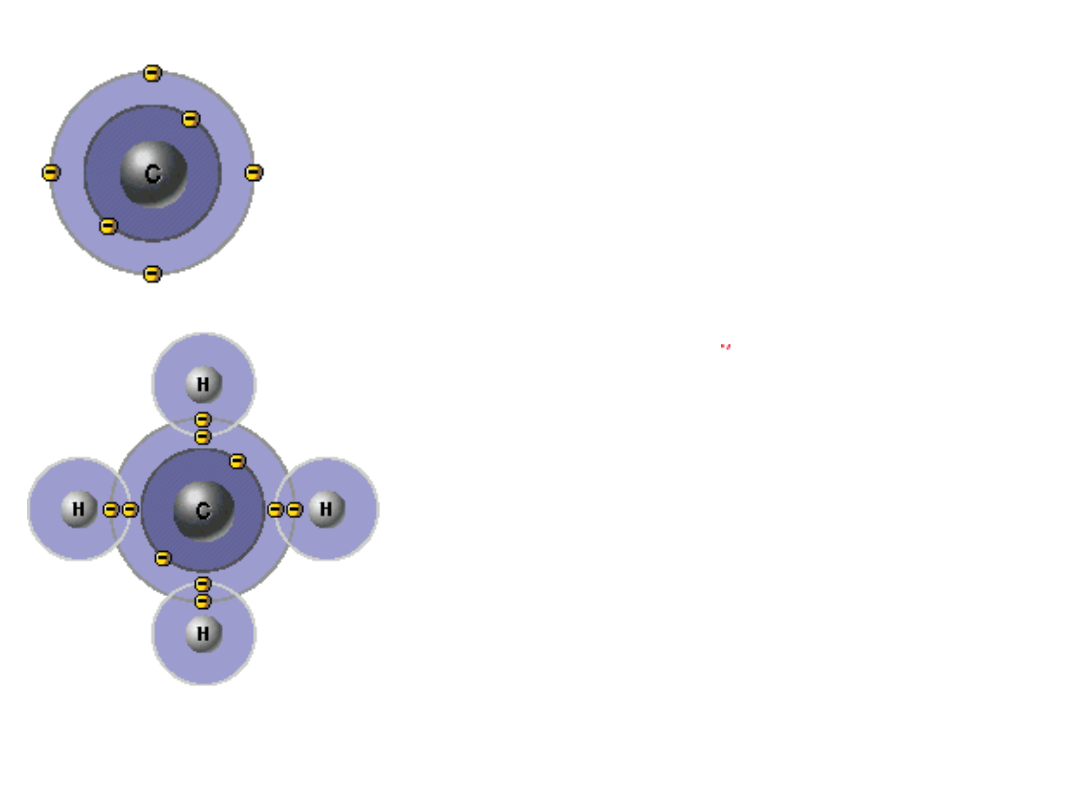
CH
4
6
C -
1s
2
2s
2
2p
2
atom węgla
4 elektrony w powłoce walencyjnej
(niewypełniona)
cząsteczka metanu CH
4
8 elektronów w powłoce walencyjnej
atomu węgla (wypełniona)
2 elektrony w powłoce walencyjnej
atomu wodoru (wypełniona)

Wiązania kowalencyjne
niepolarne i polarne
Wiązania kowalencyjne
niepolarne i polarne
Polarne wiązanie kowalencyjne można przedstawić
następująco:
ð
+
ð
-
H :Cl lub H Cl
ð
-
ð
+
O
ð
+
H H
ð – ładunek częściowy
pomiędzy atomami
tego samego
pierwiastka
pomiędzy atomami
różnych pierwiastków
niepolarne H:H
:O::O:
polarne H :Cl H
:O: H
..
..
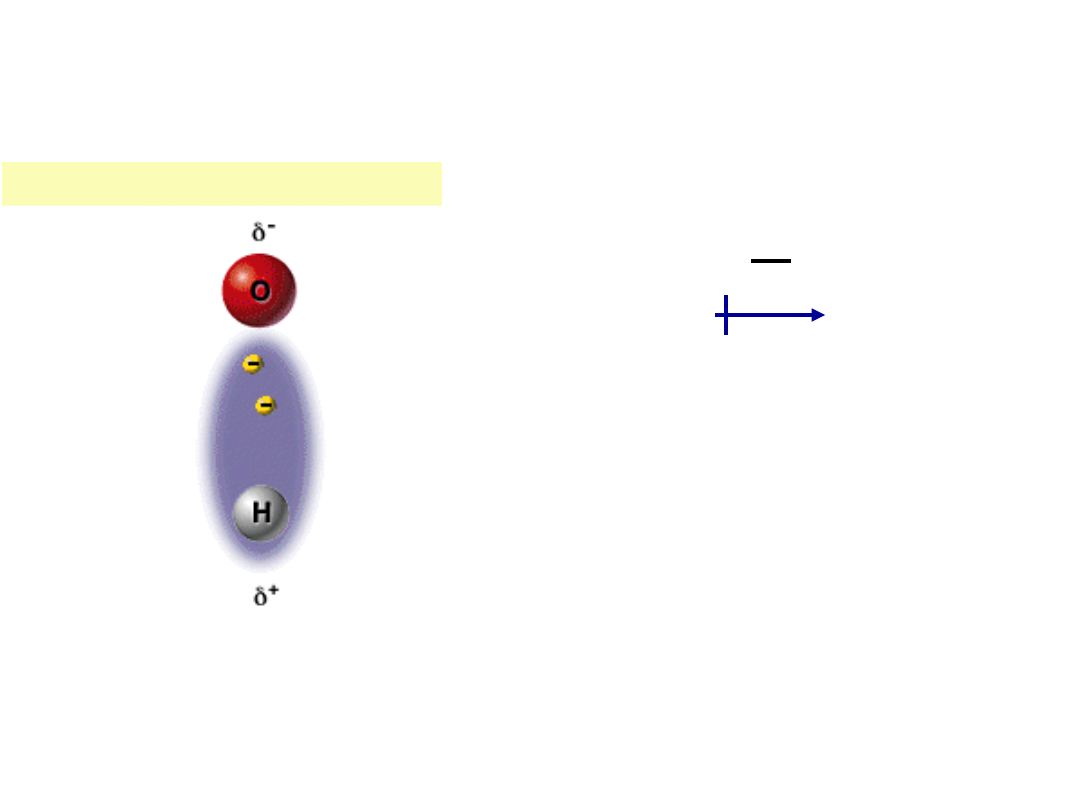
ð
+
ð
-
H Cl
dipol
Polarne wiązanie kowalencyjne
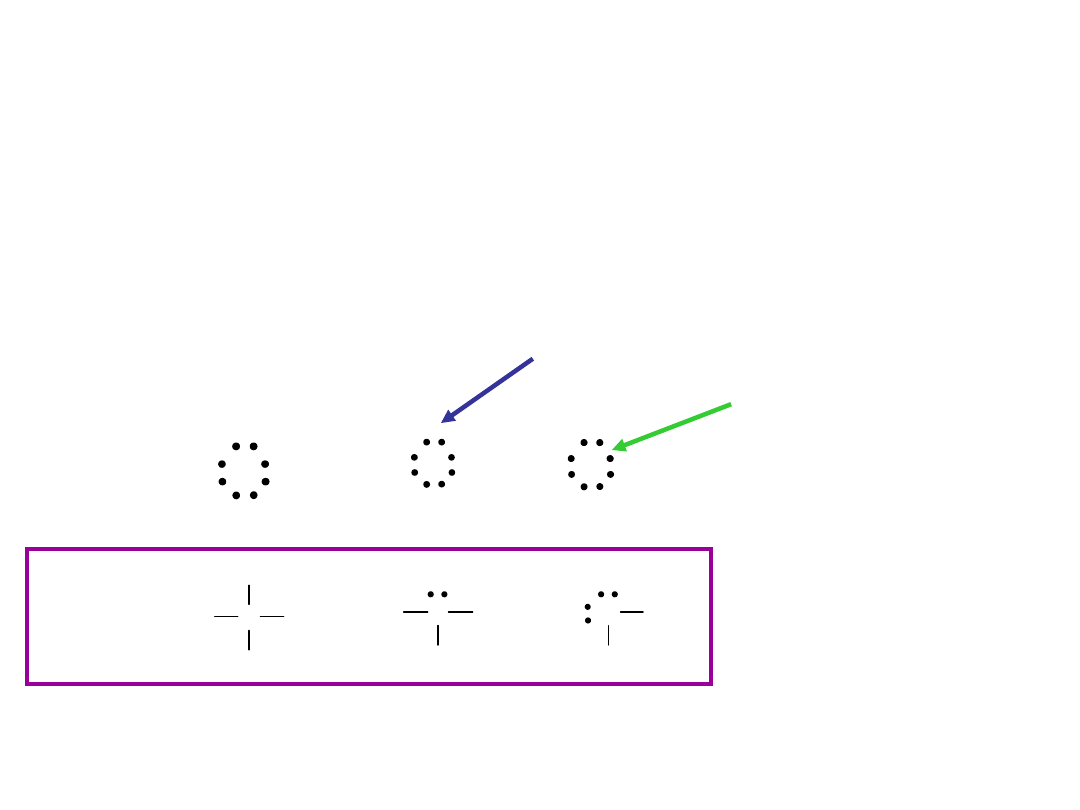
Struktury Lewisa
Struktury Lewisa
Wiązanie kowalencyjne - para elektronów
wspólna dla obu połączonych atomów.
struktury Lewisa
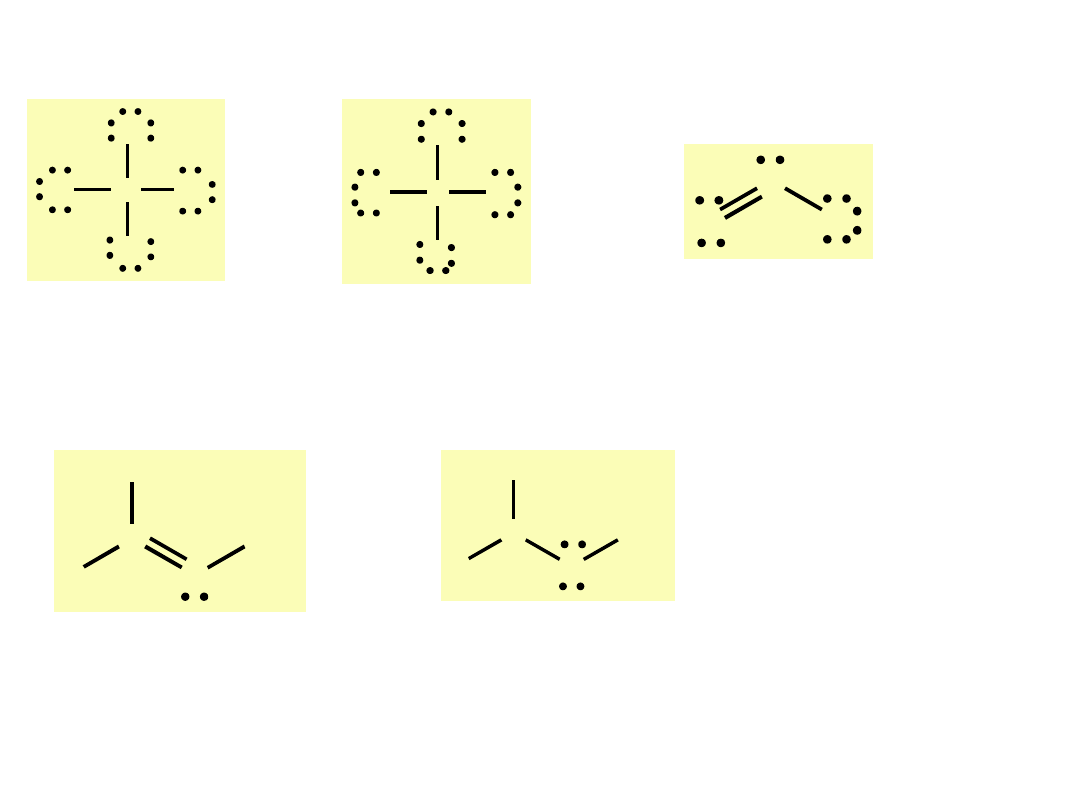
H:H
C H
H
H
H
N H
H
H
O H
H
H C H
H
H
H N H
H
O H
H
CH
4
NH
3
H
2
O
H-H
H
2
elektrony wiążące
elektrony niewiążące
Elektroujemność - zdolność atomu w cząsteczce
do przyciągania elektronów.
Układ
okresowy
wzrost elektroujemności
najbardziej F 4
elektroujemne O 3.5
N, Cl 3
Br
2.8
C, S
2.5
I 2.5
H
2.2
najmniej Ca 1
elektroujemne
Na
0.9
K 0.8
różnica elektroujemności > 1.7 – wiązanie jonowe
< 1.7 - wiązanie
kowalencyjne
Elektroujemność
Elektroujemność

Które wiązanie jest bardziej polarne?
H – CH
3
czy Cl - CH
3
Używając symboli
ð
+
i
ð
-
zaznaczyć polarność
wskazanych wiązań, np.
ð
+
ð
-
H
3
C - OH
HO – H
H
3
C – NH
2
HO - Br
H
3
C-NH
2
czy H
3
C-OH
H – Cl czy H – F
Cząsteczki polarne i niepolarne
H – H
Cl – Cl
wiązania polarne
wiązania niepolarne
cząsteczki niepolarne
O=C=O
ð
-
2ð
+
ð
-
H – Cl
ð
+
ð
-
cząsteczka
niepolarna μ=0
cząsteczka
polarna μ=0
W związkach organicznych występują głównie wiązania
kowalencyjne.
metal
niemetal
+
wiązanie jonowe
niemetal
niemetal
+
wiązanie kowalencyjne
Strukturalna teoria w
chemii organicznej
Strukturalna teoria w
chemii organicznej
H C H
H
H
Teoria strukturalna opiera się na 2 założeniach:
1. Atomy w związkach organicznych mogą tworzyć
określoną ilość wiązań, odpowiadającą ich
wartościowości.
O
H
Cl
Wartościowość
pierwiastka - liczba wiązań, które atom
tego pierwiastka może utworzyć.
Wartościowość = liczbie elektronów, które atom
musi przyłączyć, oddać lub uwspólnić, aby uzyskać oktet.
2. Atom węgla może użyć jedną lub więcej swoich
wartościowości, aby utworzyć wiązania z innymi
atomami węgla.
-C-C- C=C -C C-
Ładunek
formalny
Ładunek
formalny
_
Ładunek
formalny
=
liczba elektronów
walencyjnych w
atomie
liczba elektronów
niewiążących
połowa liczby
elektronów
wspólnych
+
dla H
dla O
Ładunek formalny=1-(0+1) = 0
Ładunek formalny=6-(2+3) = +1
H O H
+
H-O-H
+
H
Na którym atomie znajduje się ładunek?
_
Ładunek
formalny
=
liczba elektronów
walencyjnych w
atomie
kropki
wiązania
+
H
3
O
+
lub
jon
hydroniowy
lub
H
..
..
..
..
..
Cl
Al
Cl
Cl
Cl
O
S
O
O
O
H
C
O
CH
3
H
H
C
O
CH
3
H
Policzyć ładunek formalny dla poszczególnych atomów:
O
O
O
1
2
3

Cząstka mająca na atomie węgla ładunek dodatni to
karbokation
.
Cząstka mająca na atomie węgla ładunek ujemny to
karboanion
.
Cząstka zawierająca atom z niesparowanym
elektronem to
rodnik (lub wolny rodnik).
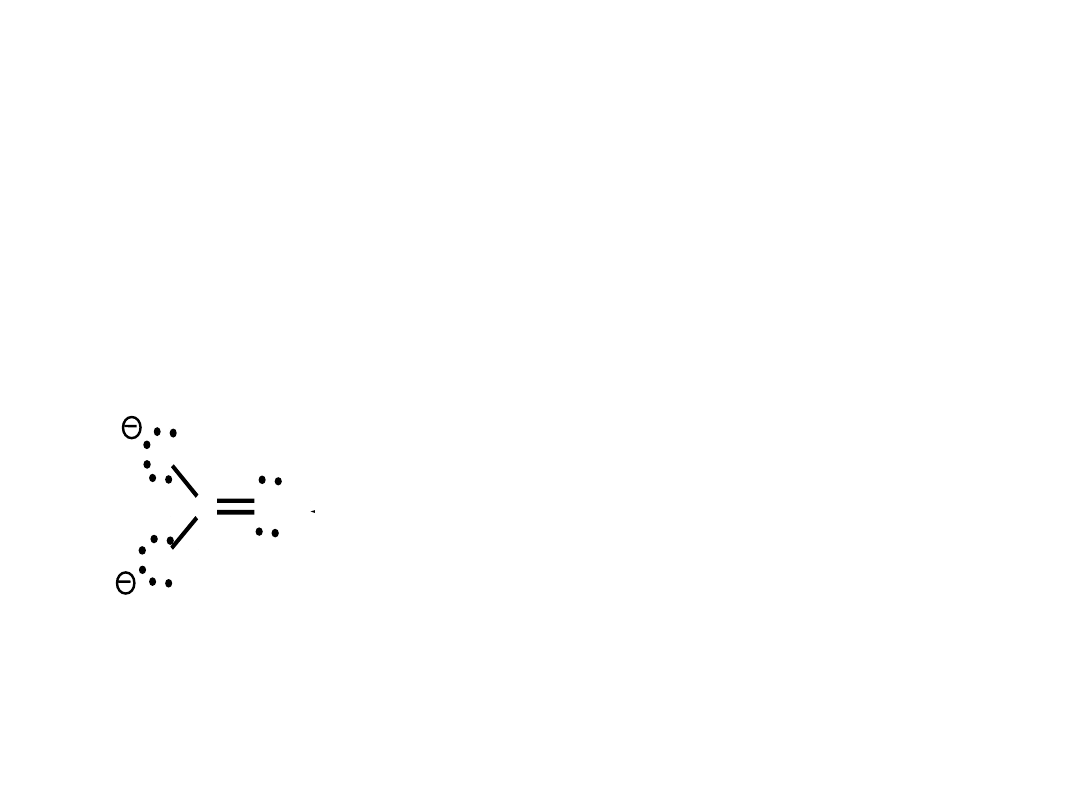
karbokation karboanion wolny
rodnik
H C
H
H
H C
H
H
H C
H
H
Rezonan
s
Rezonan
s
Nie wszystkie związki da się zapisać przy pomocy jednej
struktury Lewisa.
O
C
O
O
O
C
O
O
O
C
O
O
jon węglanowy CO
3
2-
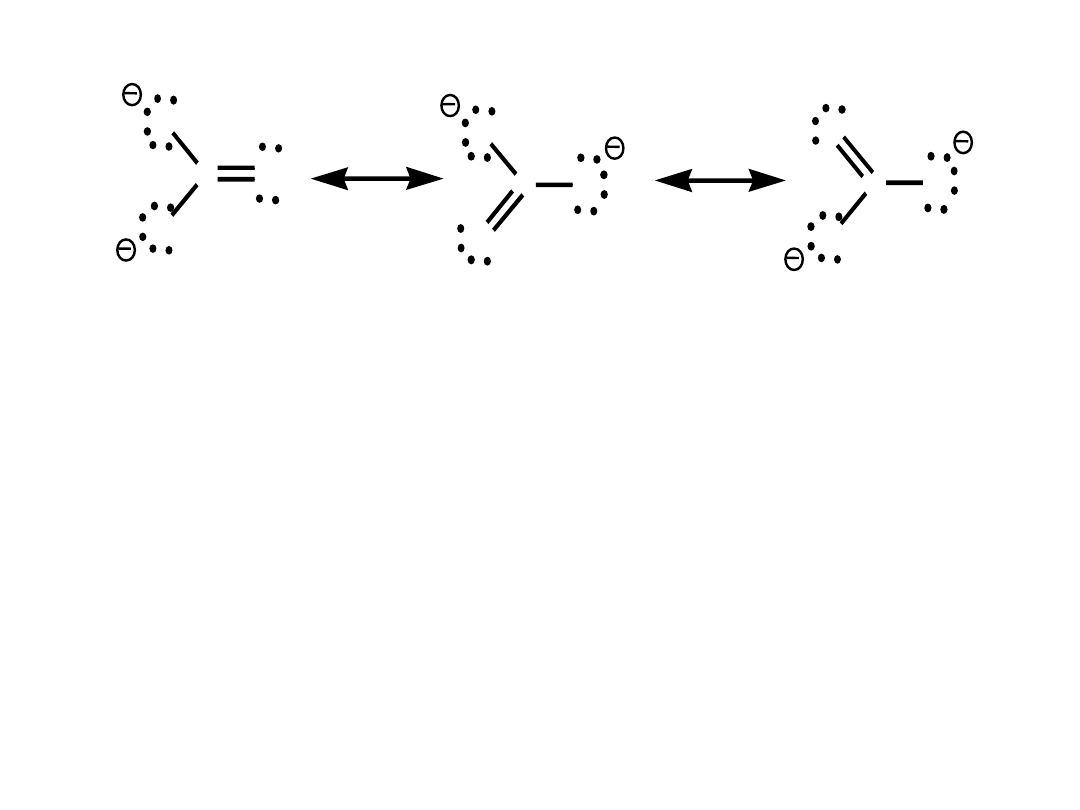
•wszystkie 3 atomy tlenu - równocenne
•wszystkie wiązania C-O - jednakowej długości
•CO
3
2-
- hybryda rezonansowa 3 struktur
•ładunek ujemny - zdelokalizowany (każdy
atom
tlenu ma częściowy ładunek ujemny)
Rozmycie ładunku – bardziej stabilny jon
.
O
C
O
O
O
C
O
O
O
C
O
O

Rezonans
jest metodą opisywania związków,
których nie da się przedstawić przy pomocy
jednej struktury Lewisa.
Strukturę takich związków oddaje najlepiej
hybryda rezonansowa, która jest wypadkową
dwóch lub więcej
fikcyjnych struktur rezonansowych.
Energia hybrydy rezonansowej, czyli rzeczywistej
cząsteczki jest zawsze niższa niż energia każdej
ze struktur rezonansowych. Mówimy, że struktura
takiego związku jest
stabilizowana przez
rezonans
.

Zasady rysowania struktur rezonansowych:
1.Przemieszczać można tylko elektrony, atomy nie
zmieniają pozycji.
2.Jedyne elektrony, które można przemieszczać to
elektrony
i wolne pary elektronowe.
3. Ogólna liczba elektronów w cząsteczce się nie zmienia,
a więc wszystkie struktury rezonansowe muszą mieć
taki sam ładunek wypadkowy.
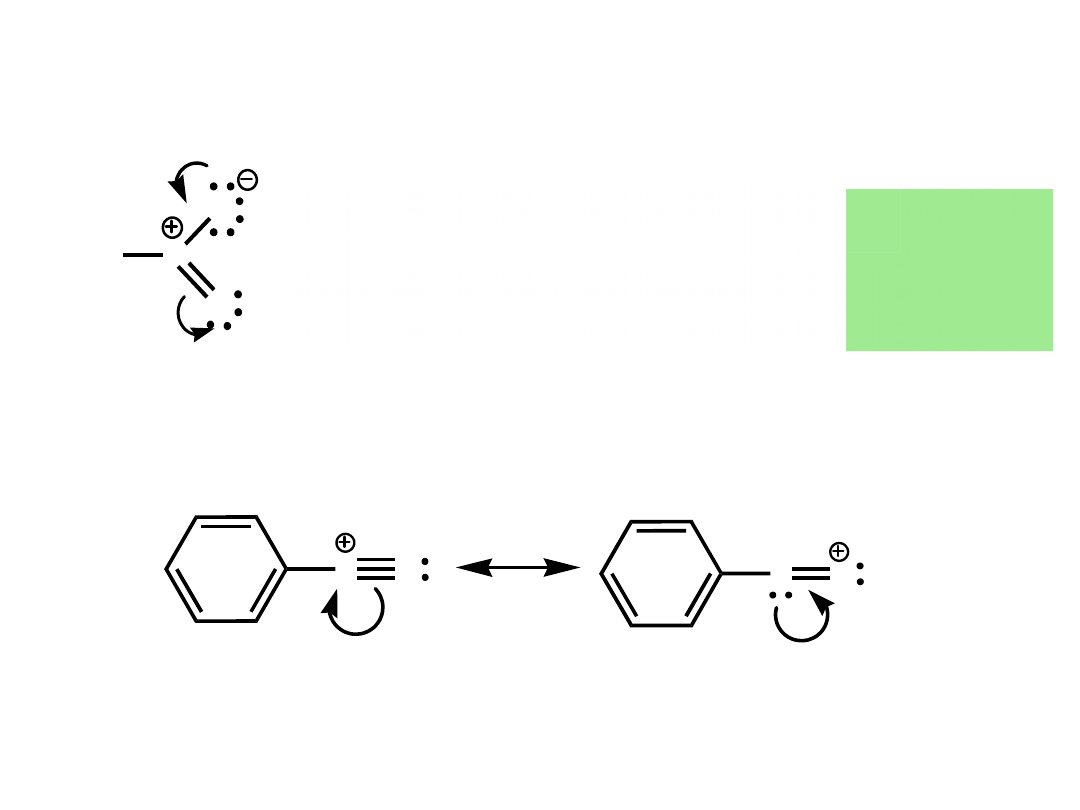
Struktury rezonansowe mają tak samo połączone
atomy,
a różnią się rozmieszczeniem elektronów.
H
3
C
N
O
O
N
N
N
N
nitrometan CH
3
-NO
2
kation benzenodiazoniowy

Hybryda jest wypadkową struktur
rezonansowych,
ale nie wszystkie struktury mają jednakowy
udział w
rzeczywistej strukturze cząsteczki.
Które struktury rezonansowe wnoszą większy
udział w rzeczywistą strukturę cząsteczki?
1. Więcej oktetów
2. Więcej wiązań
3. Ujemne ładunki na elektroujemnych atomach
4. Jak najmniej rozdzielonych ładunków
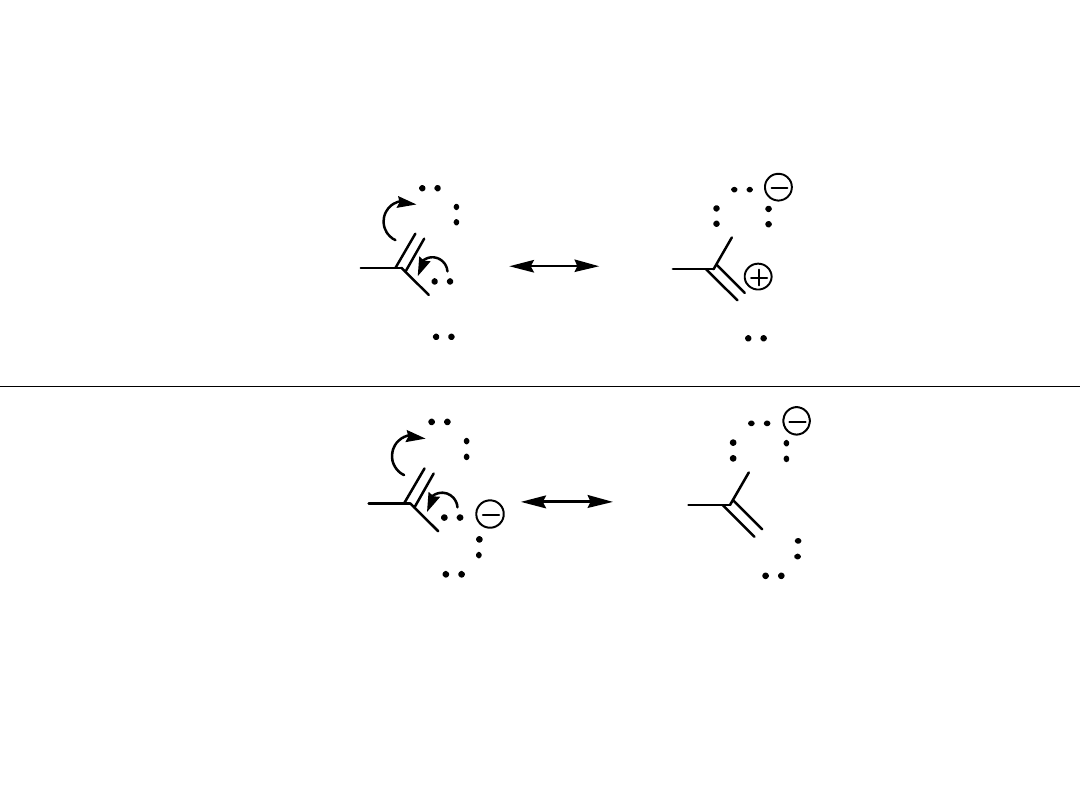
R
O
OH
R
O
OH
R
O
O
R
O
O

Kwasowość kwasów karboksylowych można wytłumaczyć
przez rezonans.
H
3
C-
OH

Podsumowanie rezonansu:
1. Struktury rezonansowe rysuje się dla związków,
których nie da się przedstawić przy pomocy jednej
struktury Lewisa.
2. Struktury rezonansowe nie są w równowadze;
związek ma jedną określoną strukturę, której nie
można narysować przy pomocy jednego wzoru.
3. Struktura cząsteczki jest wypadkową struktur
rezonansowych.
4. Hybryda rezonansowa jest bardziej trwała niż każda
ze struktur.
5. Elektrony, które mogą się przemieszczać nazywamy
zdelokalizowanymi.
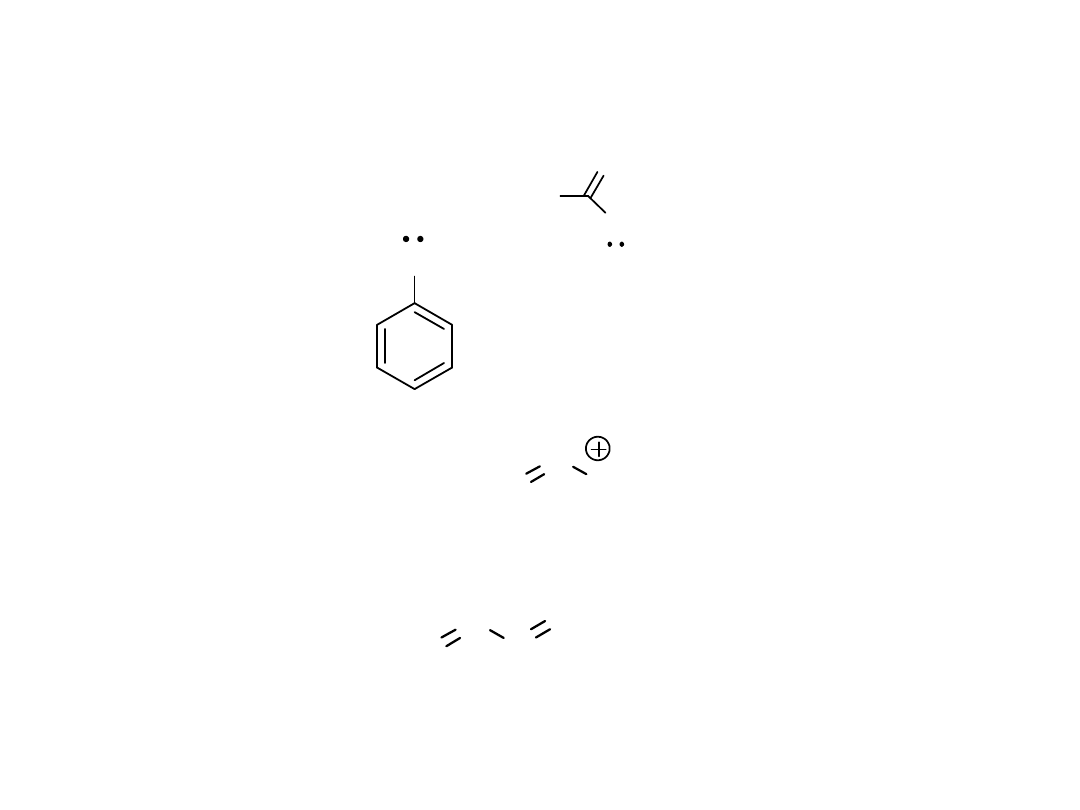
Narysować wszystkie możliwe struktury rezonansowe dla
następujących związków
Amid kw octowego
Anilina
Kation allilowy
Butadien-1,3
H
3
C
O
NH
2
NH
2
H
2
C
H
C
CH
2
H
2
C
H
C
C
H
CH
2
Teorie kwasów i
zasad
Teorie kwasów i
zasad
1. Teoria Arrheniusa:
kwas dysocjuje dając H
+
HCl
H
+
+ Cl
-
zasada dysocjuje dając OH
-
NaOH
Na
+
+ OH
-
zobojętnienie
HCl
+ NaOH
Na
+
Cl
-
+
H
2
O
Ograniczenia tej teorii:
HCl
+ NH
3
NH
4
+
Cl
-
H
+
+
OH
-
H
2
O
2. Teoria Bronsteda-Lowry’ego:
kwas – donor H
+
HCl
H
+
+ Cl
-
zasada – akceptor H
+
OH
-
+ H
+
H
2
O
Kwasowość
– tendencja do oddawania protonu.
Im silniejszy kwas tym łatwiej oddaje proton.
Zasadowość
– tendencja do przyjmowania protonu.
Im silniejsza zasada tym łatwiej przyjmuje proton.
HCl + H
2
O Cl
-
+
H
3
O
+
kwas
kwas
zasada
zasada
sprzężone pary
NH
3
+ HCl
NH
4
Cl
..
zasada
kwas
Substancje amfiprotyczne – mogą być kwasem lub
zasadą w zależności od tego z czym reagują:
HCO
3
-
,
HSO
4
-
,
H
2
O
Im silniejszy kwas tym słabsza sprzężona z nim zasada.
HCl + HCO
3
-
Cl
-
+
H
2
CO
3
mocny
kwas
słaby
kwas
mocna
zasada
słaba
zasada
HCO
3
-
+ OH
-
CO
3
2-
+ H
2
O
kwas
HCO
3
-
+ HCl H
2
CO
3
+ Cl
-
zasada
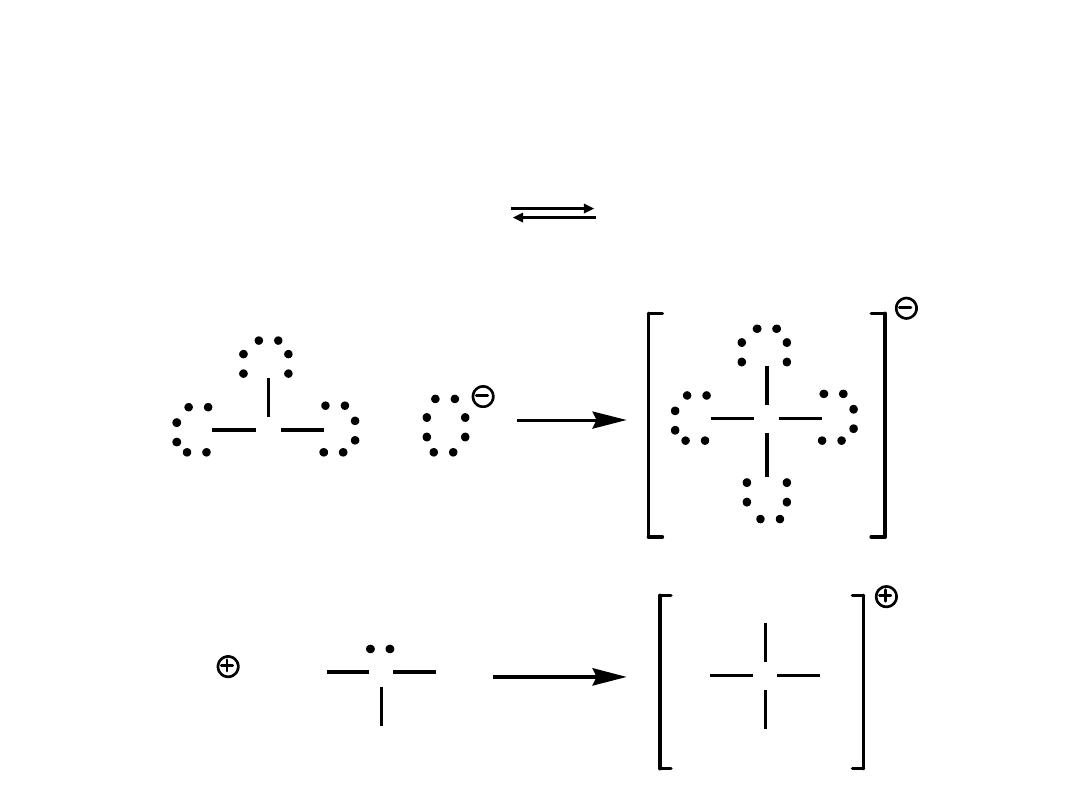
3. Teoria Lewisa:
kwas – akceptor pary elektronów
zasada – donor pary elektronów
H
+ +
:NH
3
H-NH
3
+
kwas
akceptor
zasada
donor
B
F
F
F
+ F
B
F
F
F
F
H
N
H
H
H
+
N
H
H
H
H

kwas Bronsteda
HCl
NH
4
+
HCO
3
-
zasada Bronsteda
OH
-
NH
3
Cl
-
kwas Lewisa
BF
3
H
+
AlCl
3
zasada Lewisa
OH
-
NH
3
Cl
-
=
=
W chemii organicznej
kwasy Lewisa
nazywaja się
elektrofilami,
zasady Lewisa
nazywają się
nukleofilami.
Strzałki w chemii
organicznej
Strzałki w chemii
organicznej
1. Proste strzałki w równaniach reakcji wskazują
kierunek reakcji.
A+B C
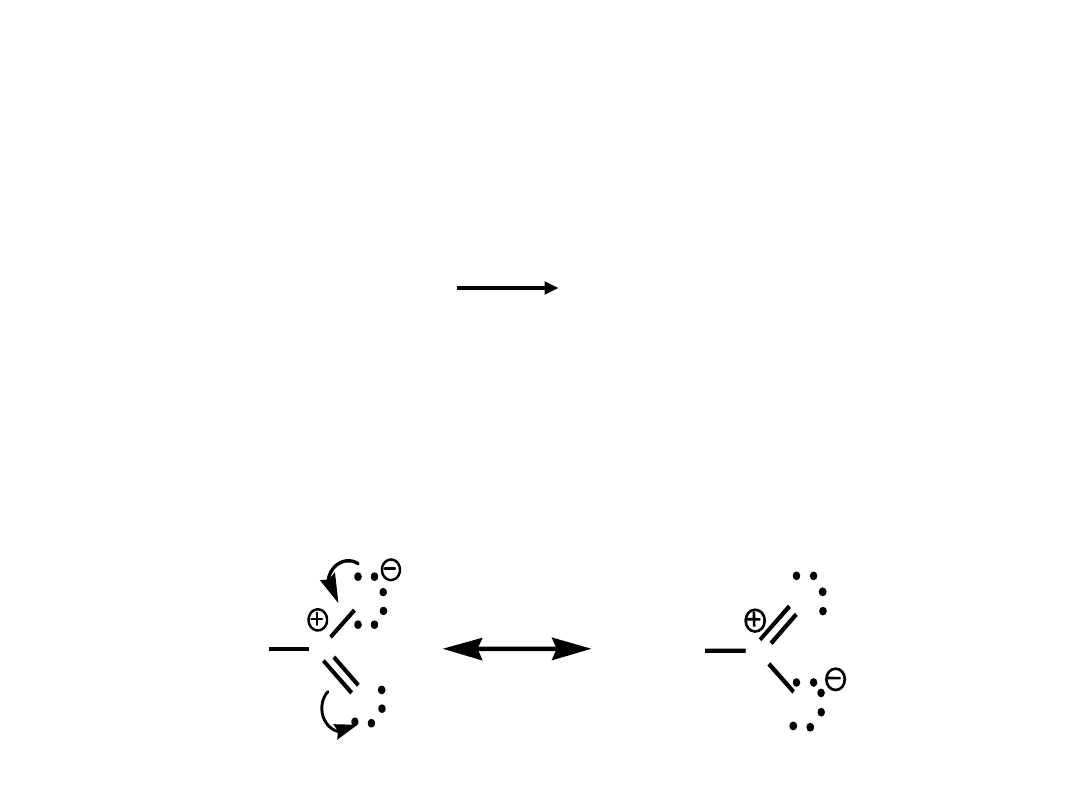
2. Strzałki z obustronnym grotem wskazują na struktury
rezonansowe.
H
3
C
N
O
O
H
3
C
N
O
O
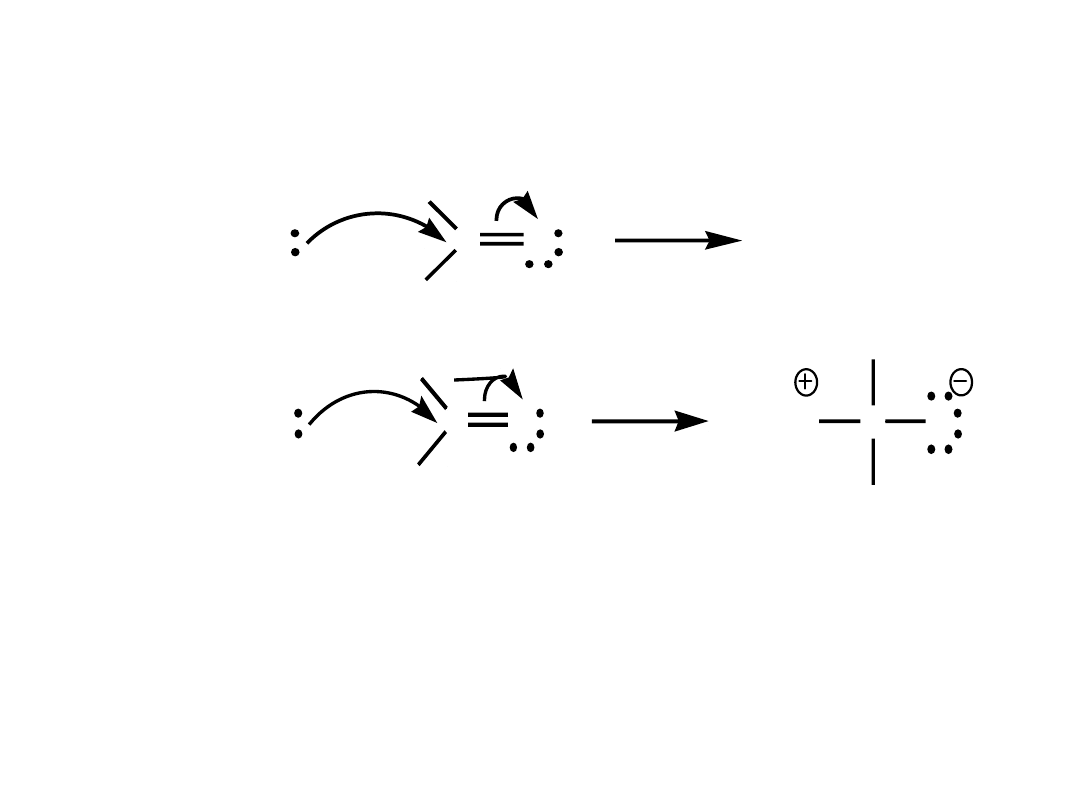
H
3
N
R
C
R
O
?
3. Zakrzywione strzałki pokazują kierunek
przemieszczania się elektronów.
H
3
N
R
C
R
O
H
3
N
C
R
R
O
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
PZ wyklad stud
ETH wykład wyniki0 do stud
JBZ Wyklad2 dla stud
Wykład dla stud zaocznych 20 12 2008
Wykład IX dla stud, Wykład IX
Relacje i funkcje ćw 2(2), stud, I semsetr, ALGEBRA, Ćwicenia i wyklady
Wyklad 1 CIAGI 2012 13 wer stud
JBZ Wyklad 3 dla stud
MFW2011 stud, Podręczniki i materiały dydaktyczne, wykłądy
Rach bankowa wyklad rozliczenia pieniezne stud
ochr srod wyklad 1 biologia dla stud
WARTOŚĆ DODANA I PRODUKCJA FINALNA W GOSPODARCE NARODOWEJ-stud, Wykłady, Makroekonomia, makra, Makro
Wykład VI dla stud, Wykład IV
ArchKomp CISC RISC Wyklad PKos Stud
wykład 3 skrót stud Gierusz 2
więcej podobnych podstron