1
ZAGADNIENIA...
• Gdy zmieszamy dwa pierwiastki......
jaki stan równowagi osiągniemy?
• W szczególności, dla określonych warunków...
- składu chem. (np., % Cu - % Ni),
- temperatury (T
)
wtedy...
Ile będzie faz?
Jaki bedzie skład chem. każdej z faz?
Jaki bedzie skład fazowy?
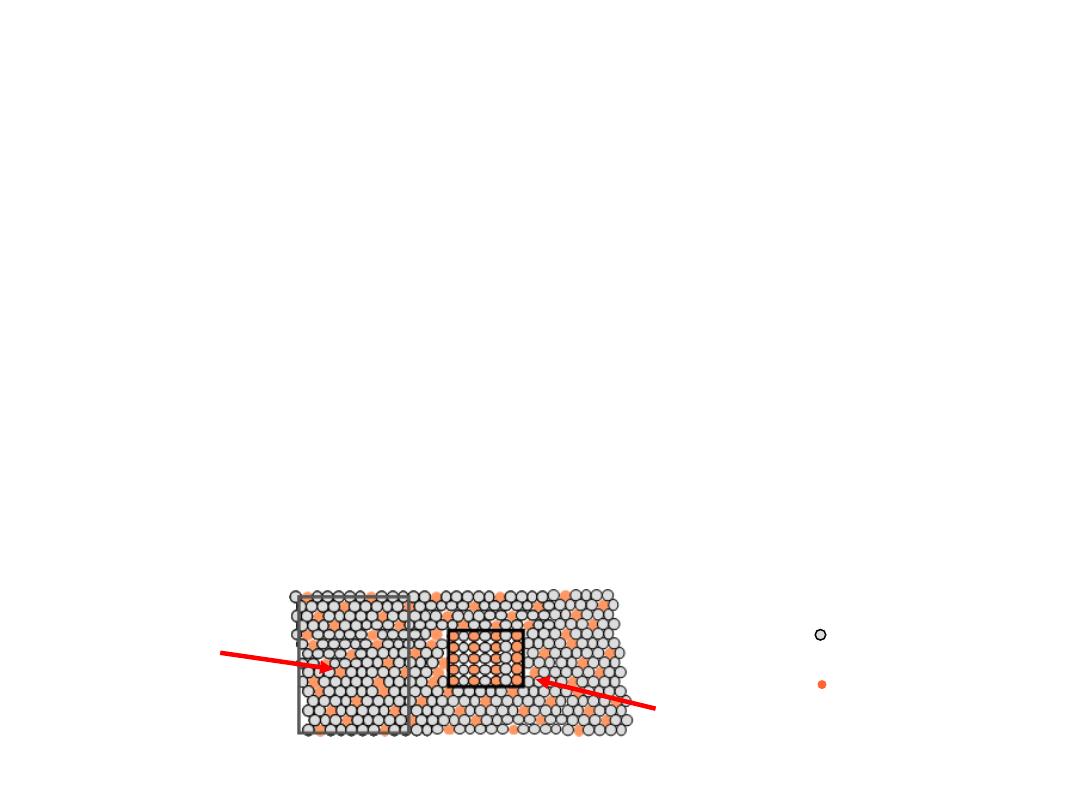
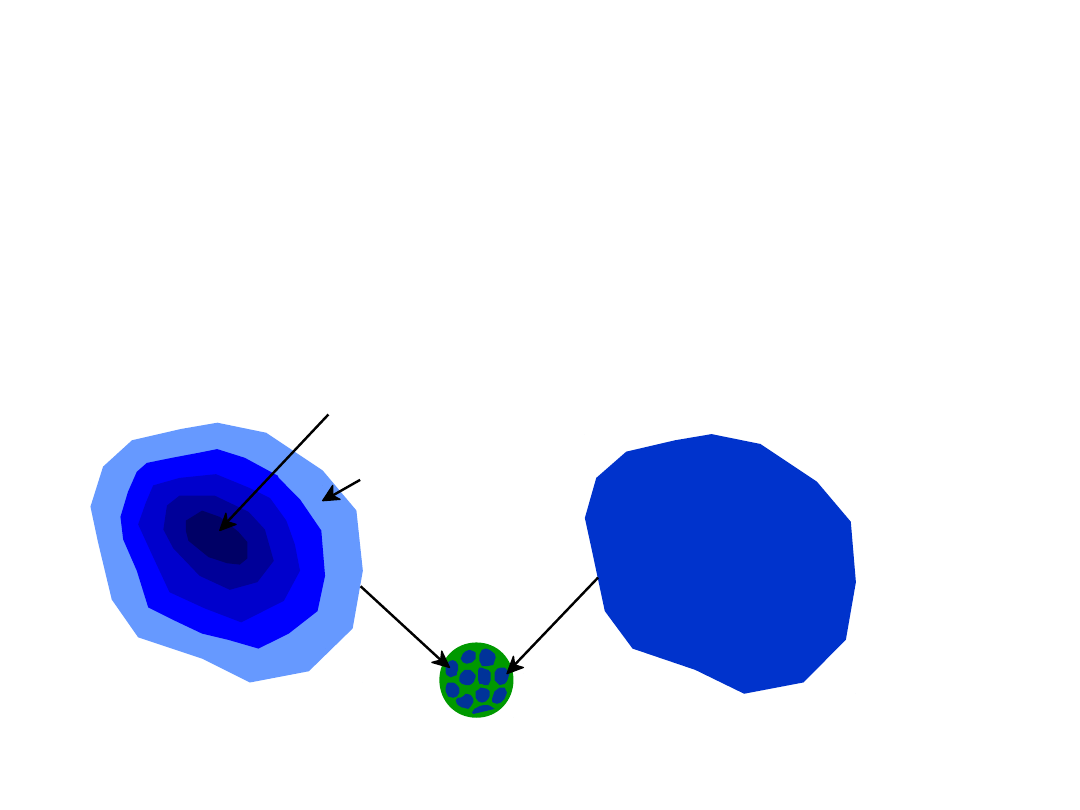
Układy Równowagi Fazowej
Faza B
Faza A
Atom Al
Atom Cu
np.:
2
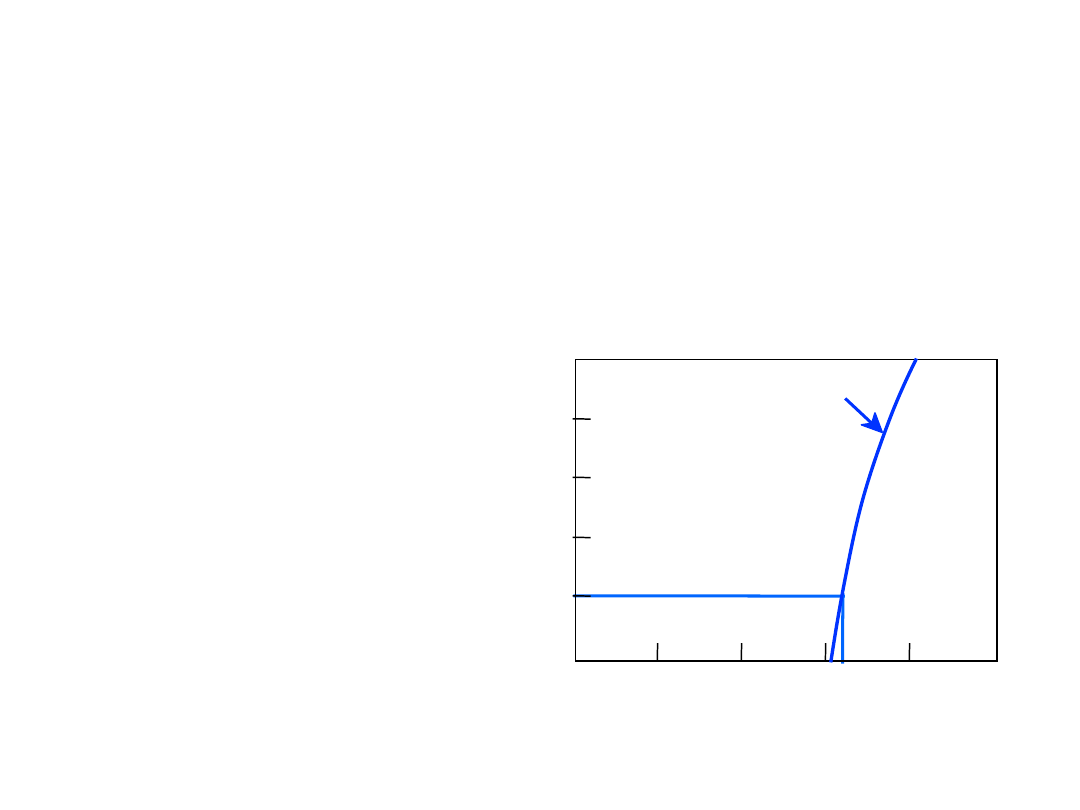
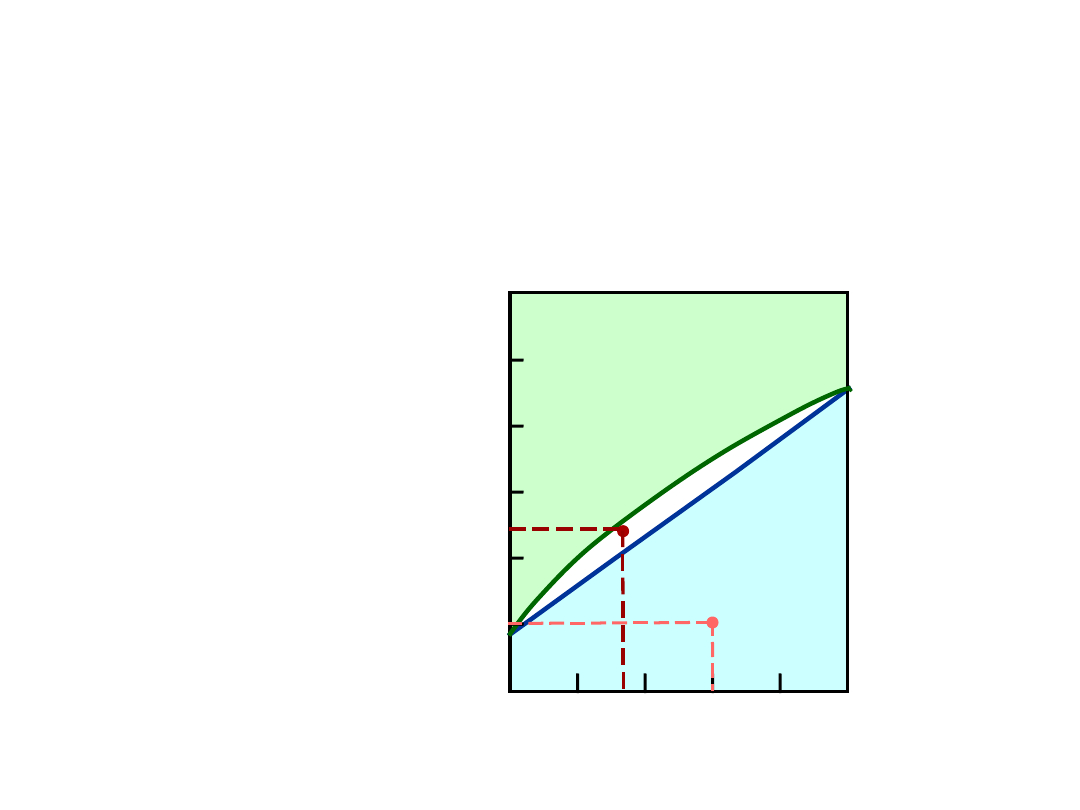
Równowaga Fazowa: Rozpuszczalność
Graniczna
Wstęp
– Roztwory
– roztwory stałe, jedna faza
– Mieszaniny
– więcej niż jedna faza
•
Granica
rozpuszczalności
:
Max koncentracja, dla której
występuje tylko jedna faza
(roztwór)
Pytanie: Jaka jest granica
rozpuszczalności w
20°C
?
Odp.:
65% mas. cukru
Gdy C
o
< 65% cukru:
syrop
Gdy C
o
> 65% cukru:
syrop + cukier
65
Wykres fazowy
Cukier/Woda
C
zy
s
ty
C
u
k
ie
rr
Te
m
p
e
ra
tu
ra
(
°C
)
0
20
40
60
80
100
C
o
=Stężenie cukru, % mas.)
L
(roztwór wodny
tzn., syrop)
Granica
Rozpuszcz.
L
(ciecz)
+
S
(cukier
stały)
20
40
60
80
100
C
zy
s
ta
W
o
d
a

3
•
Składniki
:
Pierwiastki lub związki obecne w układzie
(np., Al lub Cu)
•
Fazy
:
Fizycznie i chemicznie rozróżnialne części
układu oddzielone od reszty układu wyraźną
granicą, na której przynajmniej niektóre
makroskopowe własności ulegają skokowej
zmianie (np., lub ).
Stop Aluminium-
Miedź
Składniki i Fazy
faza
faza
4
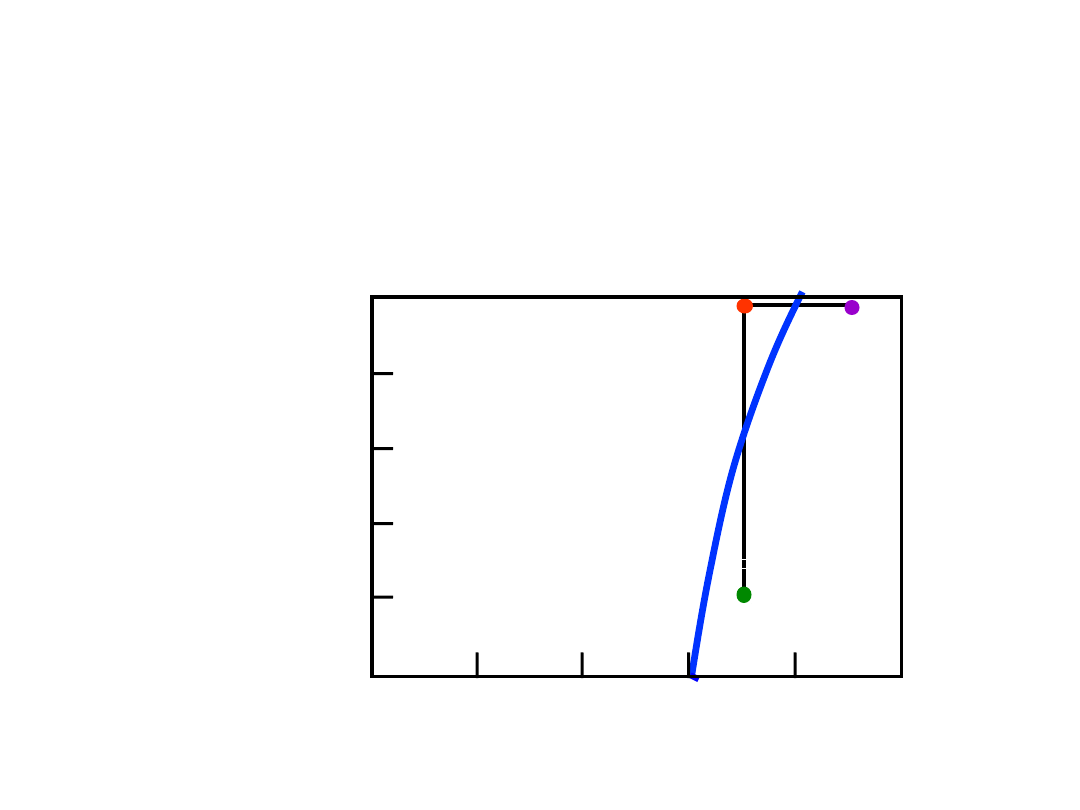
Wpływ T i Składu Chemicznego
(C)
• Zmieniając T można zmienić
liczbę faz:
D
(100°C,90)
2 fazy
B
(100°C,70)
1 faza
droga
A
do
B
.
• Zmieniając C można zmienić liczbę faz:
droga
B
do
D
.
A
(20°C,70)
2 fazy
70 80
100
60
40
20
0
Te
m
p
e
ra
tu
ra
(
°C
)
C Skład chemiczny
L
(
roztwór stały
tzn. syrop)
20
100
40
60
80
0
L
(ciecz)
+
S
(stały
cukier)
Układ
woda
-
cukie
r
5
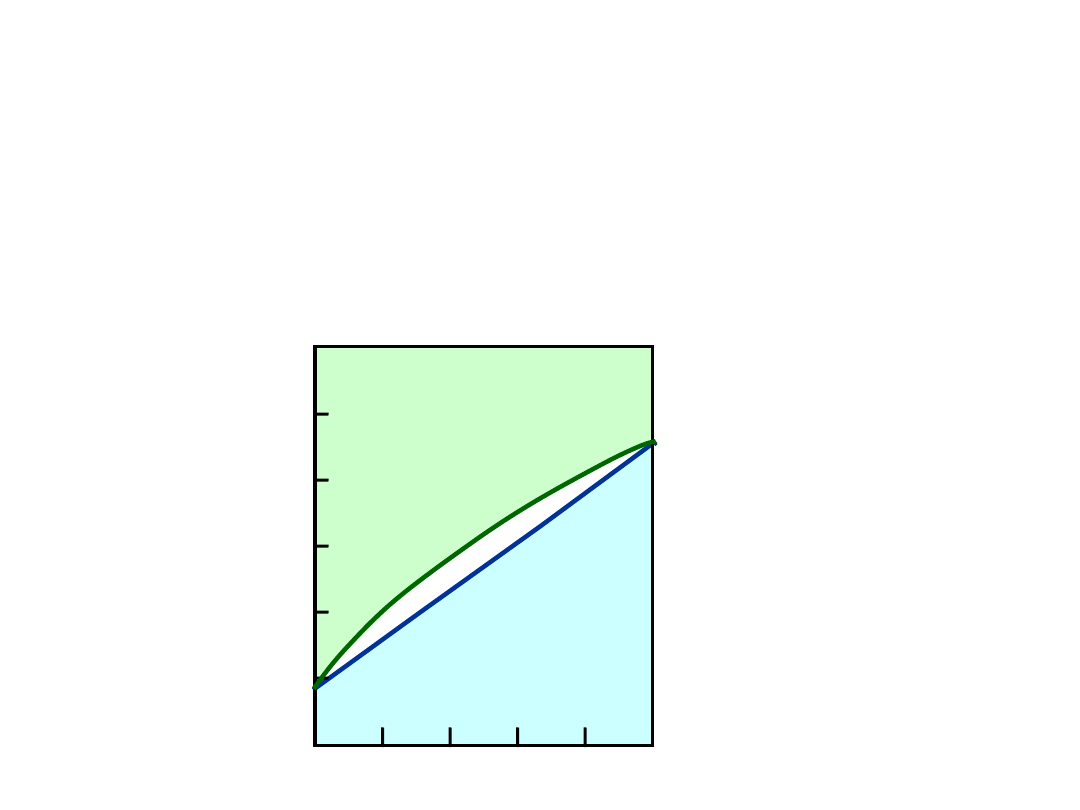
Układy Równowagi Fazowej
•
Pokazują fazy jako funkcje T, C, oraz P.
•
Najprostsze:
- układy podwójne: tylko 2 składniki
- zmienne niezależne: T oraz C
(P = 1 atm nie zmienia się).
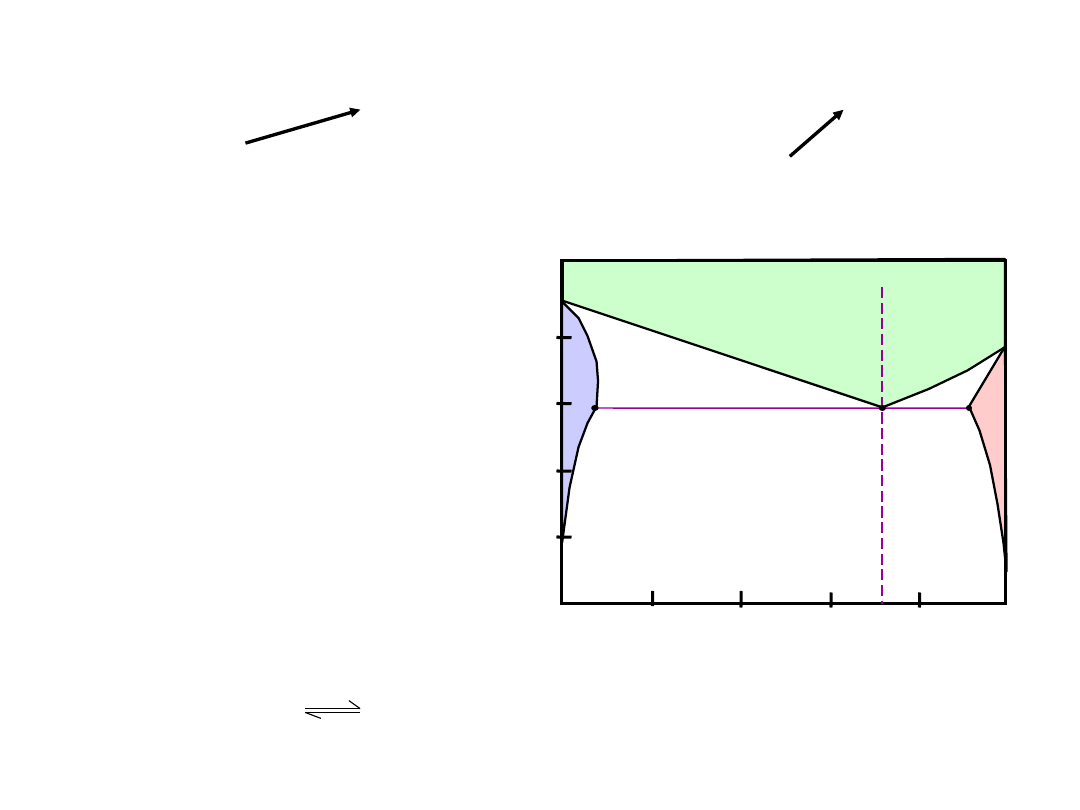
Wykres
dla
układu
Cu-Ni
• 2 fazy:
L
(ciecz)
(roztwór stały)
• 3 pola fazowe:
L
L +
% Ni
20
40
60
80 100
0
1000
1100
1200
1300
1400
1500
1600
T(°C)
L (ciecz)
(roztwór
stały)
L
+
liq
uid
us
so
lid
us
6
% Ni
20
40
60
80 100
0
1000
1100
1200
1300
1400
1500
1600
T(°C)
L (ciecz)
(roztwór
stały)
L
+
liq
uid
us
so
lid
us
Wykresy Fazowe – liczba i
rodzaje faz
•
Reguła 1:
Gdy znamy T i C, to wiemy ile i jakie
fazy występują w tych warunkach
• Przykłady:
A (1100°C, 60):
1 faza:
B
(1250°C, 35):
2 fazy: L +
B (
1
2
5
0
°C
,3
5
)
A(1100°C,60)
Wykres
dla
układu
Cu-Ni

7
Ni % mas.
20
1200
1300
T(°C)
L (ciecz)
(c. stałe)
L
+
liqu
idu
s
soli
dus
30
40
50
L
+
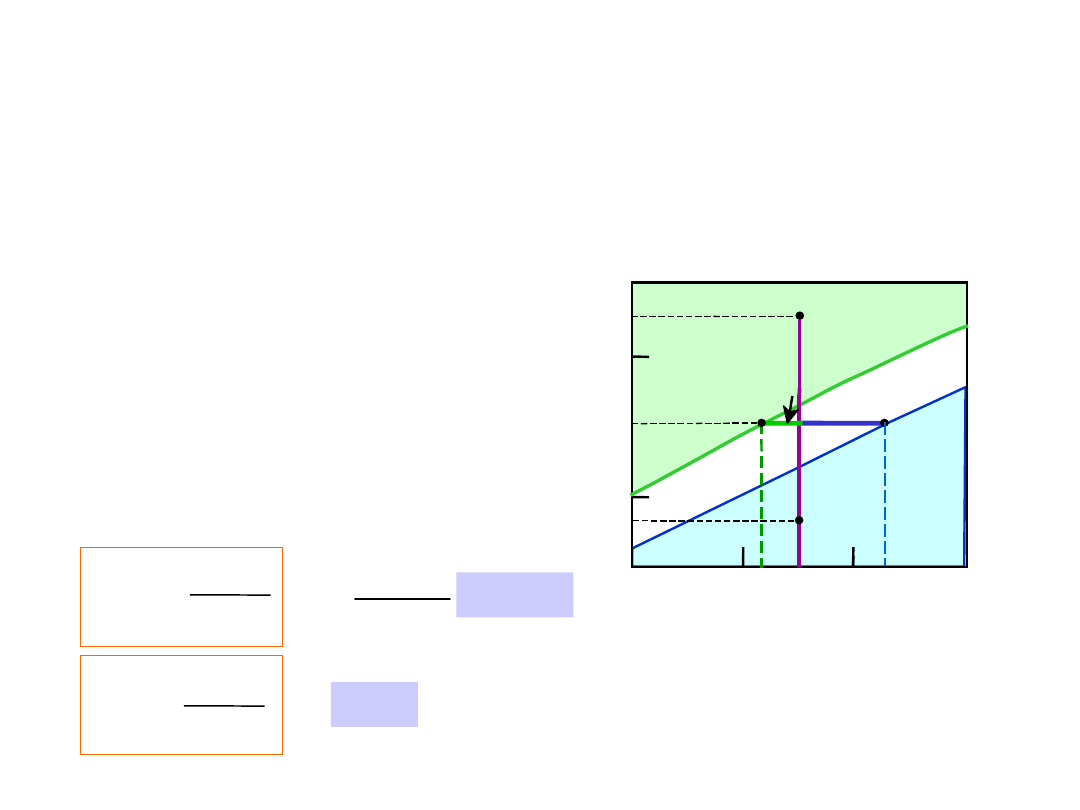
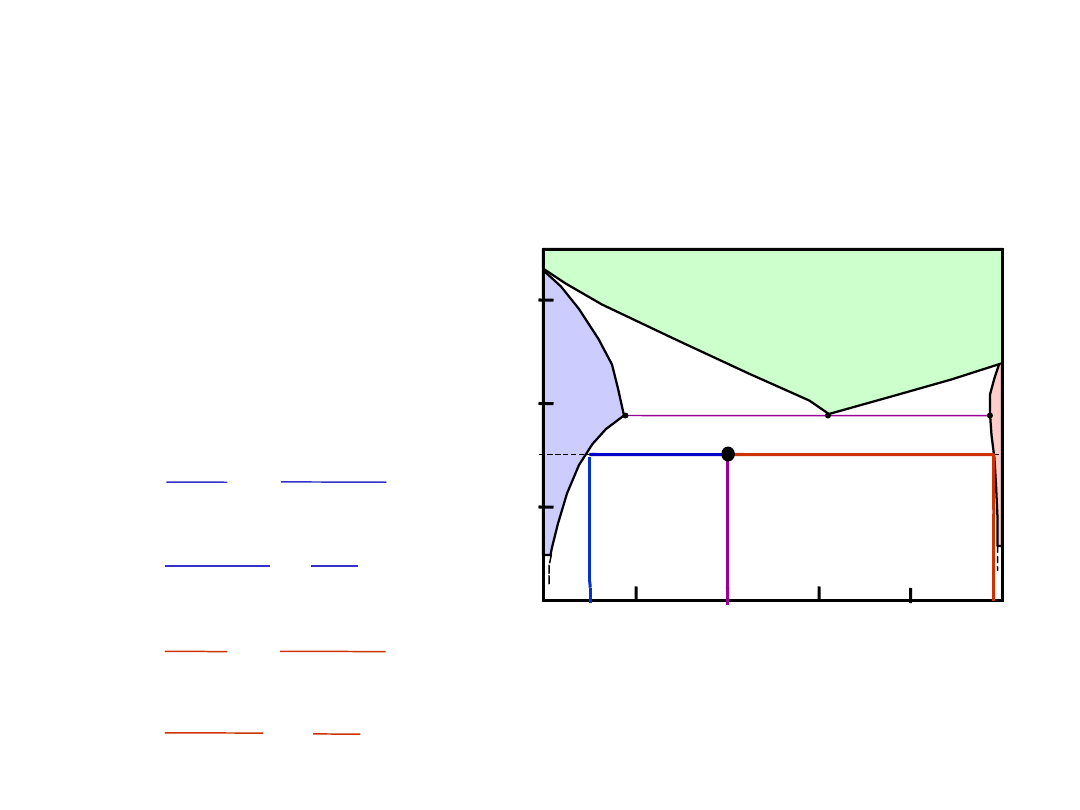
Wykresy Fazowe – skład chemiczny
faz
•
Reguła 2:
gdy znamy T oraz C
o
, to
wiemy, jaki jest skład chemiczny faz
• Przykłady:
TA
A
35
Co
32
CL
At TA = 1320°C:
Tylko ciecz (L)
CL = Co
( = 35% Ni)
At TB = 1250°C:
Zarówno L i
CL = C
liquidus
( = 32% Ni)
C = C
solidus
( = 43% Ni)
At TD = 1190°C:
Tylko c. stałe ()
C = Co
( = 35% Ni)
Co = 35% Ni
B
TB
D
TD
4
C
3
Układ Cu-Ni
8
•
Reguła 3:
gdy znamy T oraz C
o
, to
możemy obliczyć ilość każdej z faz (w %
mas.)
• Przykłady:
At TA: Tylko ciecz (L)
W
L = 100%, W = 0
At TD: Tylko c. stałe
W
L = 0, W = 100%
Co = 35% Ni
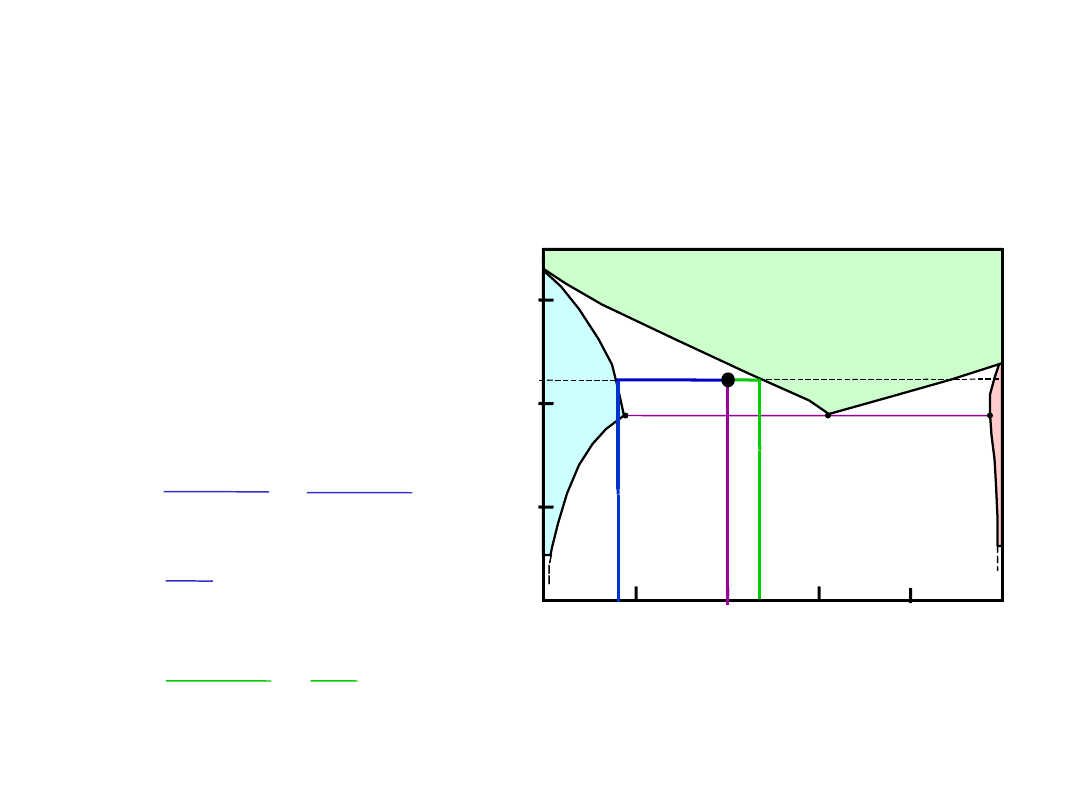
Wykresy Fazowe – ułamki wagowe
faz
% Ni
20
1200
1300
T(°C)
L (ciecz)
(c.stałe)
L
+
liqu
idu
s
soli
dus
30
40
50
L
+
TA
A
35
Co
32
CL
B
TB
D
TD
4
C
3
R
S
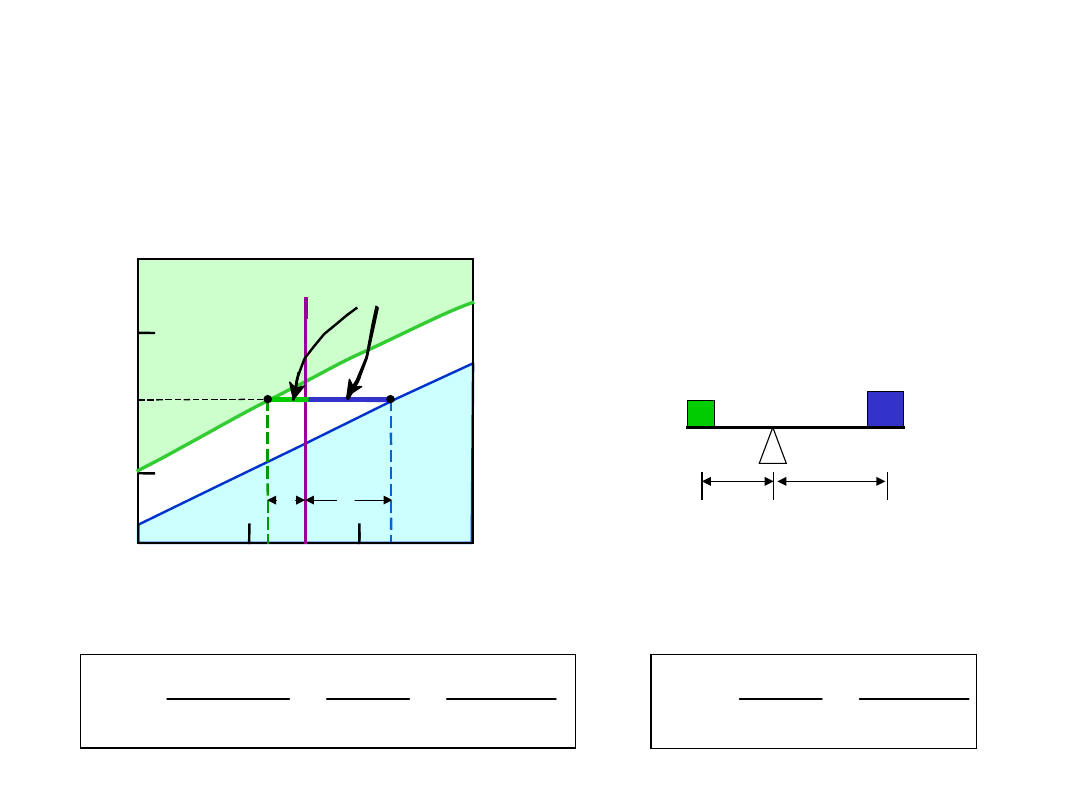
At TB: Zarówno jak i L
%
73
32
43
35
43
= 27%
W
L
S
R
+
S
W
R
R
+
S
Układ Cu-Ni
9
• Linia pozioma poprowadzona przez punkt stanu
(
B
) – łączy fazy będące w równowadze - izoterma
Reguła Dźwigni
Ile jest każdej z faz?
Linię traktujemy jak dźwignię
M
L
M
R
S
R
M
S
M
L
L
L
L
L
L
L
C
C
C
C
S
R
R
W
C
C
C
C
S
R
S
M
M
M
W
0
0
% Ni
20
1200
1300
T(°C)
L (ciecz)
(c. stałe)
L
+
liqu
idu
s
soli
dus
30
40
50
L
+
B
TB
izoterma
Co
CL
C
S
R
B
10
% mas. Ni
20
1200
1300
30
40
50
1100
L (ciecz)
(c. stałe)
L
+
L
+
T(°C)
A
35
Co
L: 35%Ni
Układ
Cu-Ni
• Wykres Fazowy:
Układ Cu-Ni
• Układ jest:
-
podwójny
t.j., 2 składniki:
Cu i Ni.
-
izomorficzny
tzn., całkowita
rozpuszczalność
jednego składnika w
drugim; pole fazy
rozciąga się od 0 do
100% Ni.
• Rozważmy
C
o
= 35%Ni
.
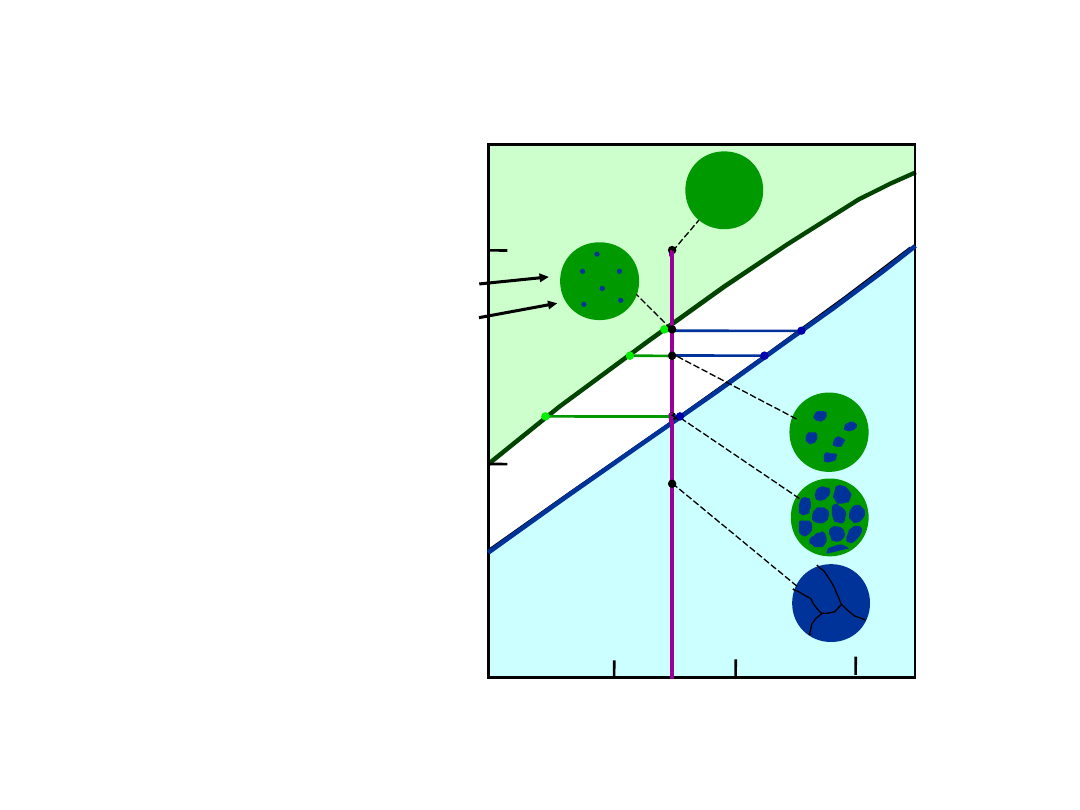
Chłodzenie w układzie Cu-Ni
46
35
43
32
43% Ni
L: 32% Ni
L: 24% Ni
36% Ni
B
: 46% Ni
L: 35% Ni
C
D
E
24
36
11
• C
zmienia się podczas krzepnięcia.
• w Cu-Ni:
• Duża szybkość
chłodzenia:
niejednorodność
chemiczna
• Mała szybkość:
Jednorodność składu
Pierwsze kryształy mają C
= 46% Ni.
Ostatnie kryształy mają C
= 35% Ni.
Jednorodność Faz
Pierwsze kryształy
46% Ni
Jednorodne C
35% Ni
ostatnie kryształy
< 35% Ni
12
:
Min. temp. topnienia T
E
2 składniki
ma temp.
topnienia niższą
niż składniki
Układ Podwójny z Eutektyką
• Reakcja
Eutektyczna
L(C
E
) (C
E
) + (C
E
)
• 3 pola fazowe
(L, )
•
Ograniczona
rozpuszczalność:
: przeważa Cu
: przeważa Ag
• T
E
:
Poniżej T
E
nie ma cieczy
• C
E
Np.: układ Cu-Ag
Układ
Cu-Ag
L (ciecz)
L
+
L
+
C
o
, % mas. Ag
20
40
60
80
100
0
200
1200
T(°C)
400
600
800
1000
C
E
T
E
8.0
71.9 91.2
779°C
13
L
+
L
+
+
200
T(°C)
18.3
C, % mas. Sn
20
60
80
100
0
300
100
L (ciecz)
183°C
61.9
97.8
• Dla stopu 40% Sn-60% Pb i temp. 150°C,
znaleźć...
- obecne fazy:
Układ
Pb-Sn
Przykład: Układ Pb-Sn (1)
+
- skład chem. faz:
C
O
= 40% Sn
-udziały mas. każdej z
faz:
150
40
C
o
11
C
99
C
S
R
C
= 11% Sn
C
= 99% Sn
W=
C
- C
O
C
- C
= 99 - 40
99 - 11
= 59
88
= 67%
S
R+S
=
W=
C
O
- C
C
- C
=
R
R+S
=
29
88
= 33%
=
40 - 11
99 - 11
14
L
+
+
200
T(°C)
20
60
80
100
0
300
100
L (ciecz)
L
+
183°C
• Dla stopu 40% Sn-60% Pb i temp. 220°C,
znaleźć...
- obecne fazy:
Przykład: Układ Pb-Sn (2)
+
L
- skład chem. faz:
C
O
= 40% Sn
-udziały mas. każdej z
faz:
W=
C
L
- C
O
C
L
- C
=
46 - 40
46 - 17
=
6
29 = 21%
WL=
C
O
- C
C
L
- C
=
23
29 = 79%
40
C
o
46
C
L
17
C
220
S
R
C
= 17% Sn
C
L
= 46% Sn
C, % mas. Sn
Układ Pb-Sn
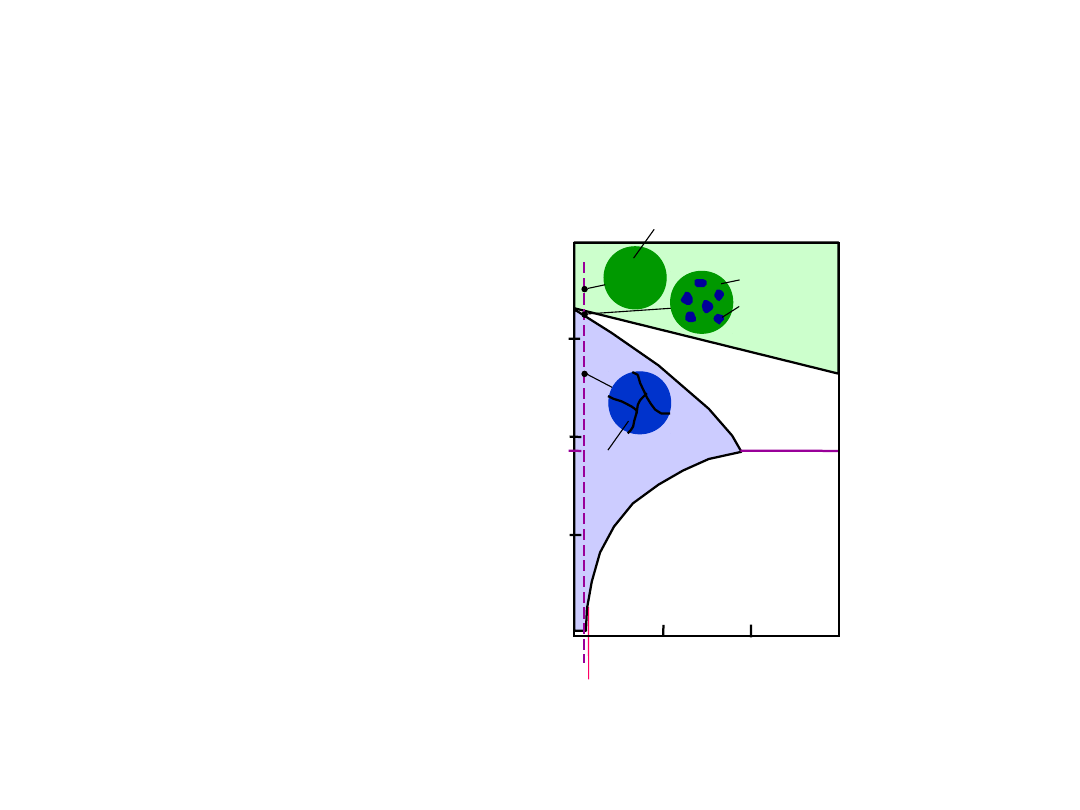
15
• C
o
< 2% mas. Sn
• Tylko jedna faza stała
Microstruktury w Układach z
Eutektyką: I
0
L
+
200
T(°C)
C
o
,
% mas. Sn
10
2
20
C
o
300
100
L
30
+
400
(granica rozpuszczalności w temp. pokojowej
T
E
L
L: C
o
wt% Sn
: C
o
wt% Sn
Układ
Pb-Sn
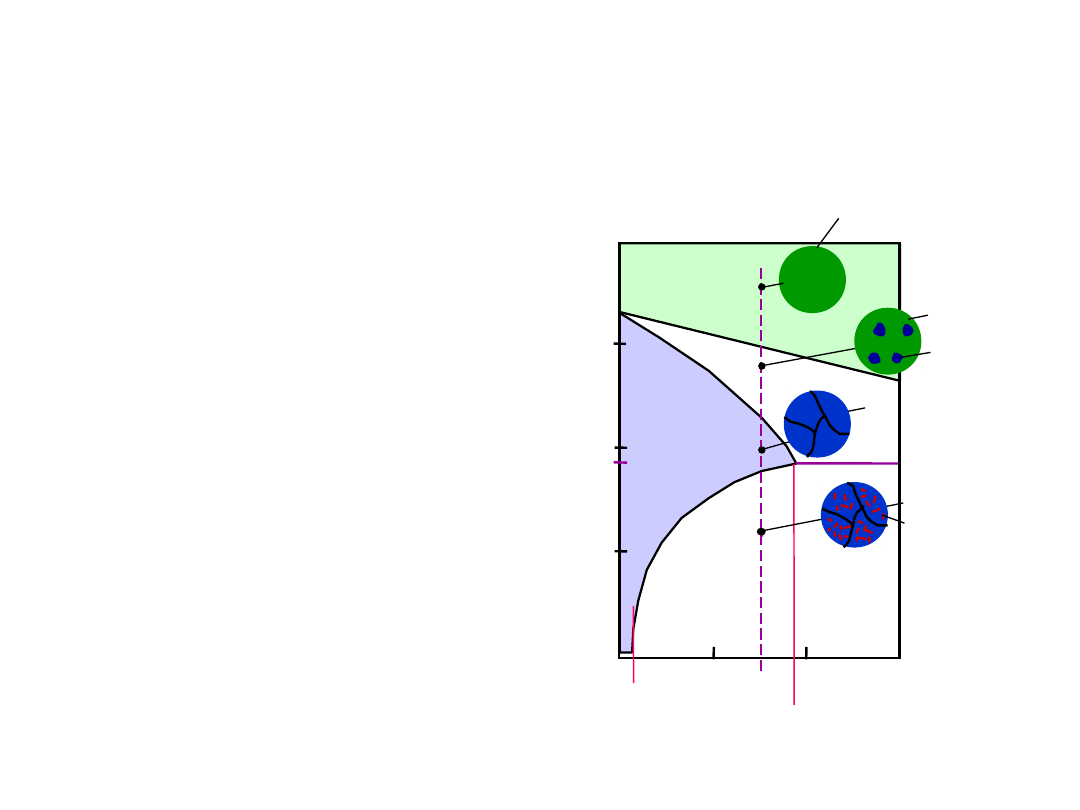
16
• 2% Sn < C
o
< 18.3% Sn
Początkowo ciecz +
potem tylko
ostatecznie dwie fazy
polikrystaliczna
drobne wtrącenia
Microstruktury w Układach z
Eutektyką: II
L
+
200
T(°C)
C
o
,
10
18.3
20
0
C
o
300
100
L
30
+
400
(gr. rozp.w T
E
)
T
E
2
(gr. rozp. w T
pok
)
L
L: C
o
% Sn
: C
o
% Sn
Układ
Pb-Sn
% mas. Sn
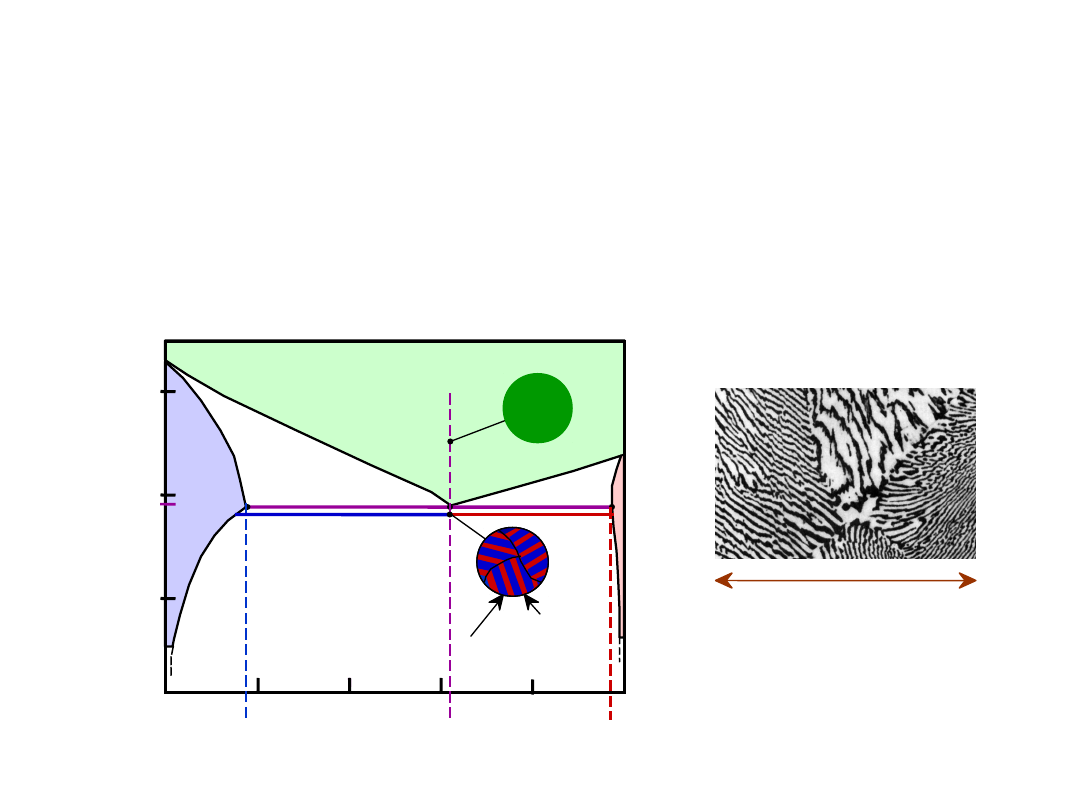
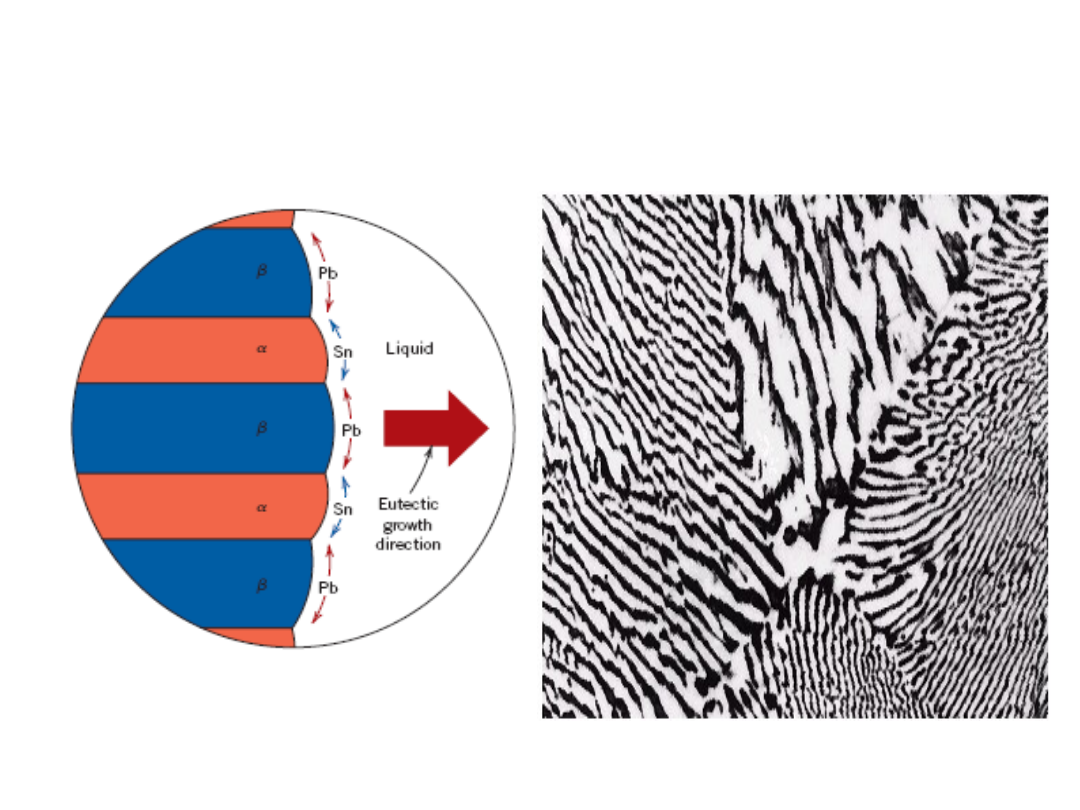
17
• C
o
= C
E
• Mikrostruktura e
utektyczna (płytkowa)
- naprzemianległe warstwy (płytki) kryształów
i
Microstruktury w Układach z
Eutektyką: III
160
m
Mikrofotografia
struktury
eutektycznej w
stopie Pb-Sn
L
200
T(°C)
20
60
80
100
0
300
100
L
L
+
183°C
40
T
E
18.3
: 18.3 %Sn
97.8
: 97.8 % Sn
C
E
61.9
L: C
o
% Sn
Układ
Pb-Sn
% mas. Sn
18
Struktura Płytkowa
Eutektyki
19
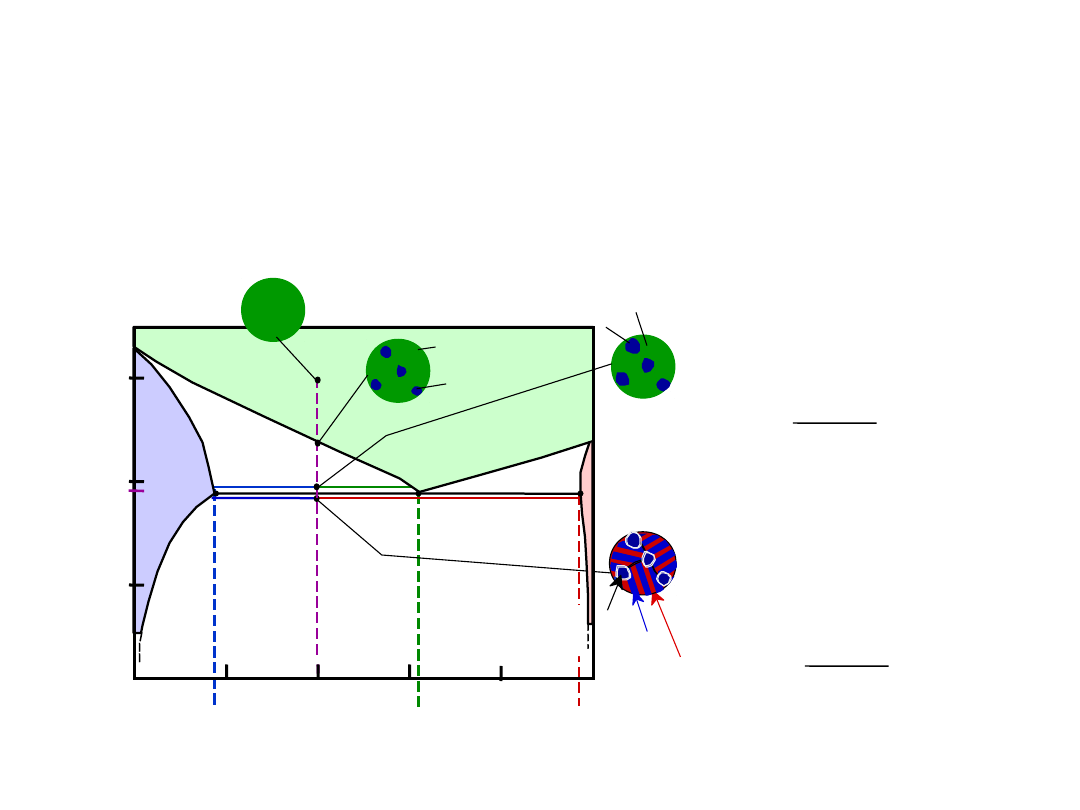
• 18.3% Sn < C
o
< 61.9% Sn
• Kryształy
i mikrostruktura eutektyczna
Microstruktury w Układach z
Eutektyką: IV
18.3
61.9
S
R
97.8
S
R
pierwotne
eutekt.
eutekt.
W
L
= (1-W) = 50%
C
= 18.3% Sn
C
L
= 61.9% Sn
S
R
+
S
W =
= 50%
•
Nieznaczne powyżej T
E
:
•
Nieznacznie poniżej T
E
:
C
= 18.3% Sn
C
= 97.8% Sn
S
R
+
S
W =
= 73%
W
= 27%
L
+
200
T(°C)
20
60
80
100
0
300
100
L
L
+
40
+
T
E
L: C
o
% Sn
L
L
Układ
Pb-Sn
% mas. Sn
20
L
+
L
+
+
200
20
60
80
100
0
300
100
L
T
E
40
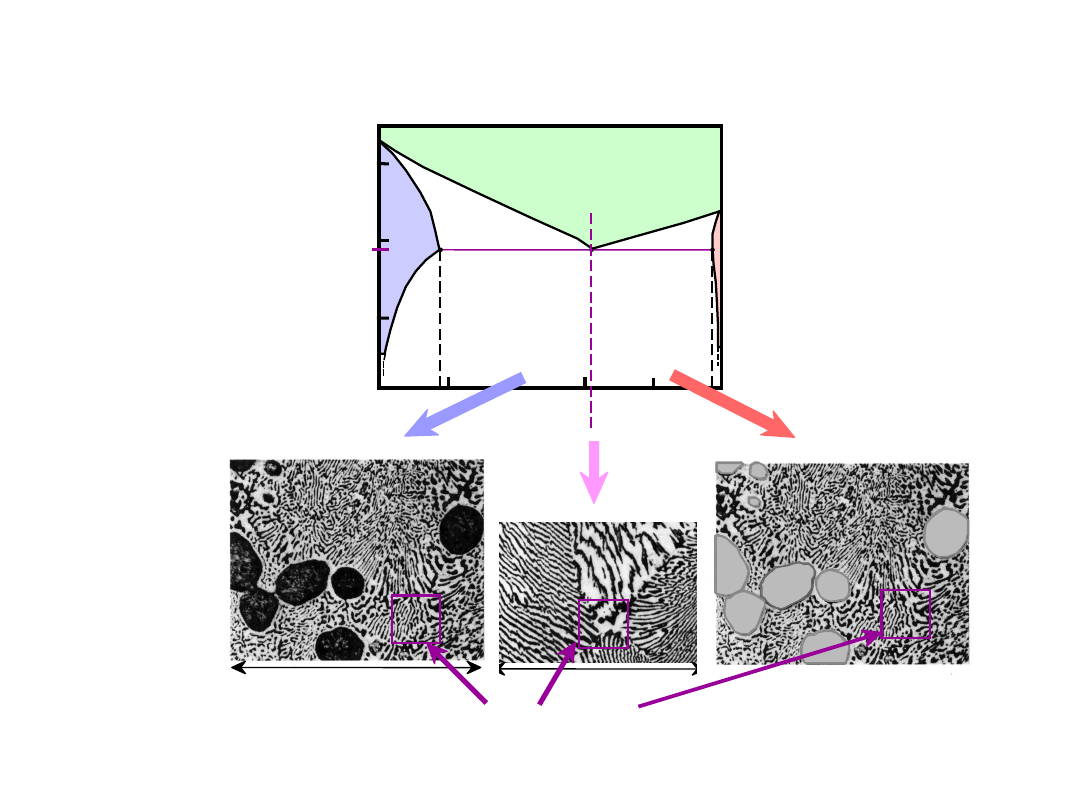
Mikrostruktury Pod- i
Nadeutektyczne
160 m
eutektyka
mikrostr. nadeutektyczna
175 m
mikr. podeutektyczna:C
o
= 50 wt% Sn
T(°C)
61.9
eutectic
eutektyka:C
o
=
61.9% Sn
Układ
Pb-Sn
% mas. Sn
21
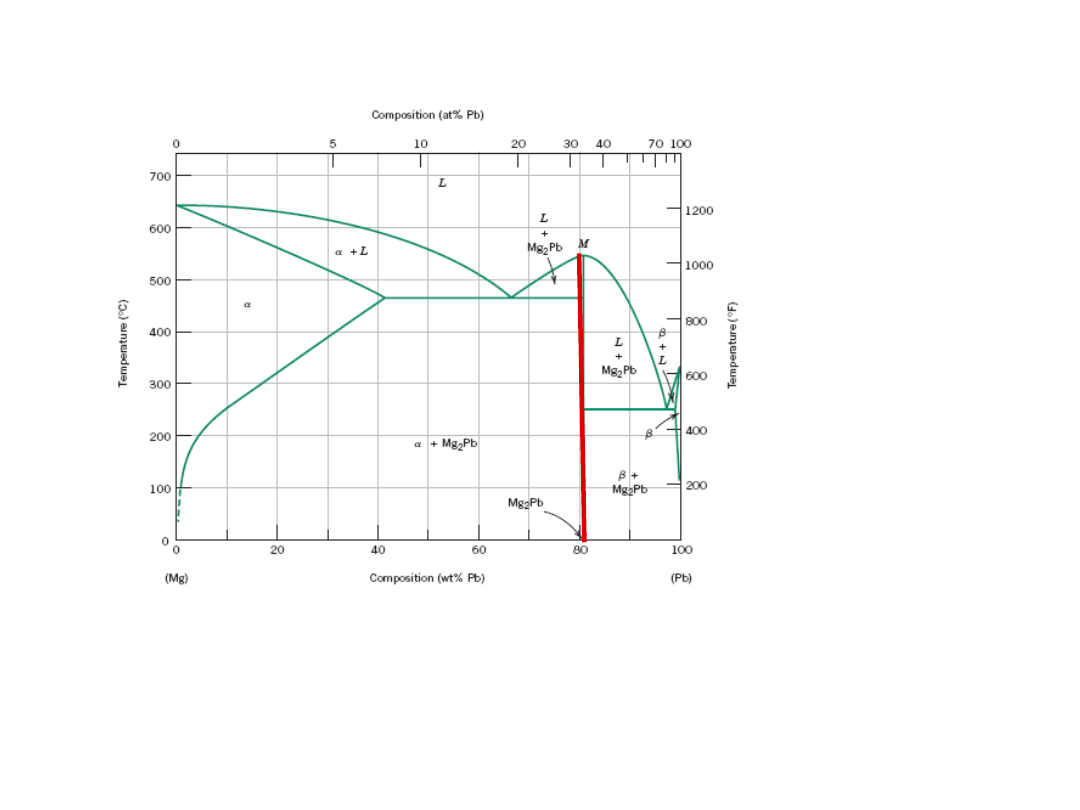
Fazy Międzymetaliczne
Mg
2
Pb
Związki międzymetaliczne są reprezentowane
przez linię pionową, gdyż mają określony skład
stechiometryczny

22
Eutektoid & Perytektyka
•
Eutektyka
– ciecz w równowadze z dwoma fazami
stałymi
L +
chłodz.
grzanie
cementyt
chłodz.
grzanie
• Eutectoid
– faza stała w równowadze z
dwoma innymi fazami stałymi
S
2
S
1
+S
3
+ Fe
3
C
(727ºC)
chłodz.
grzanie
• Perytektyka
- ciecz + f. stała 1
f. stała 2
S
1
+ L S
2
+ L
(1493ºC)
w
stalach
23
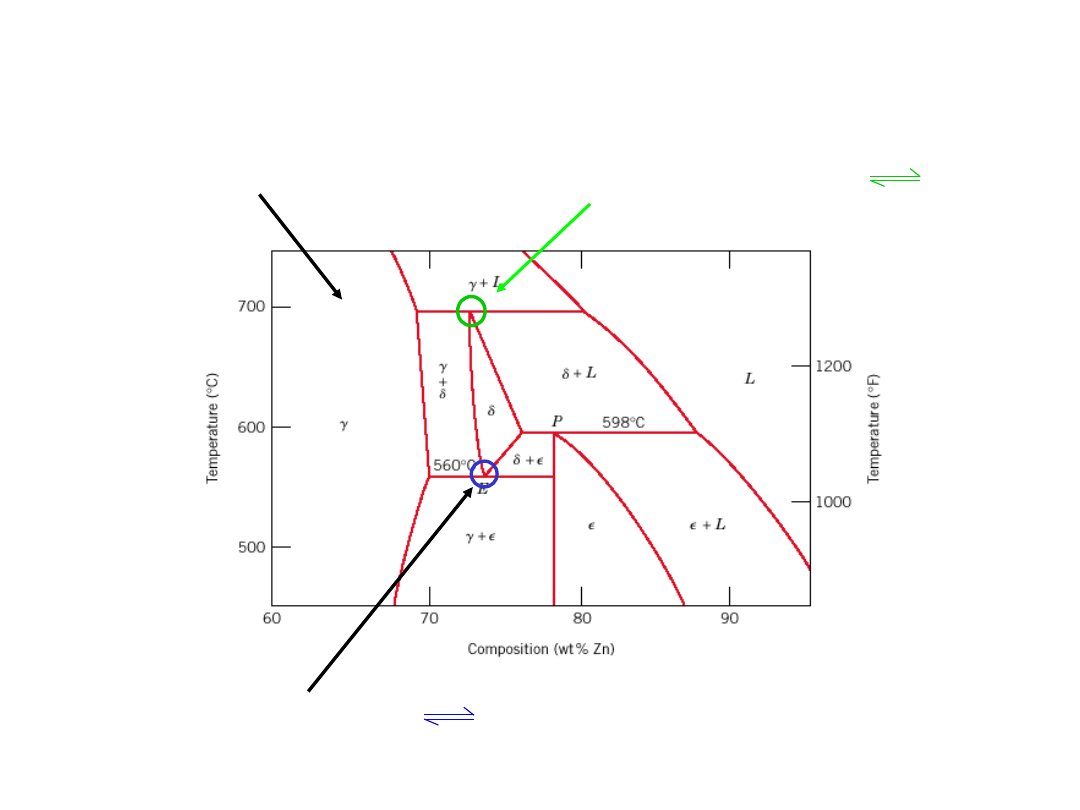
Eutektoid & Perytektyka
Układ Cu-Zn
Przemiana eutektoidalna
+
Przemiana perytektyczna + L
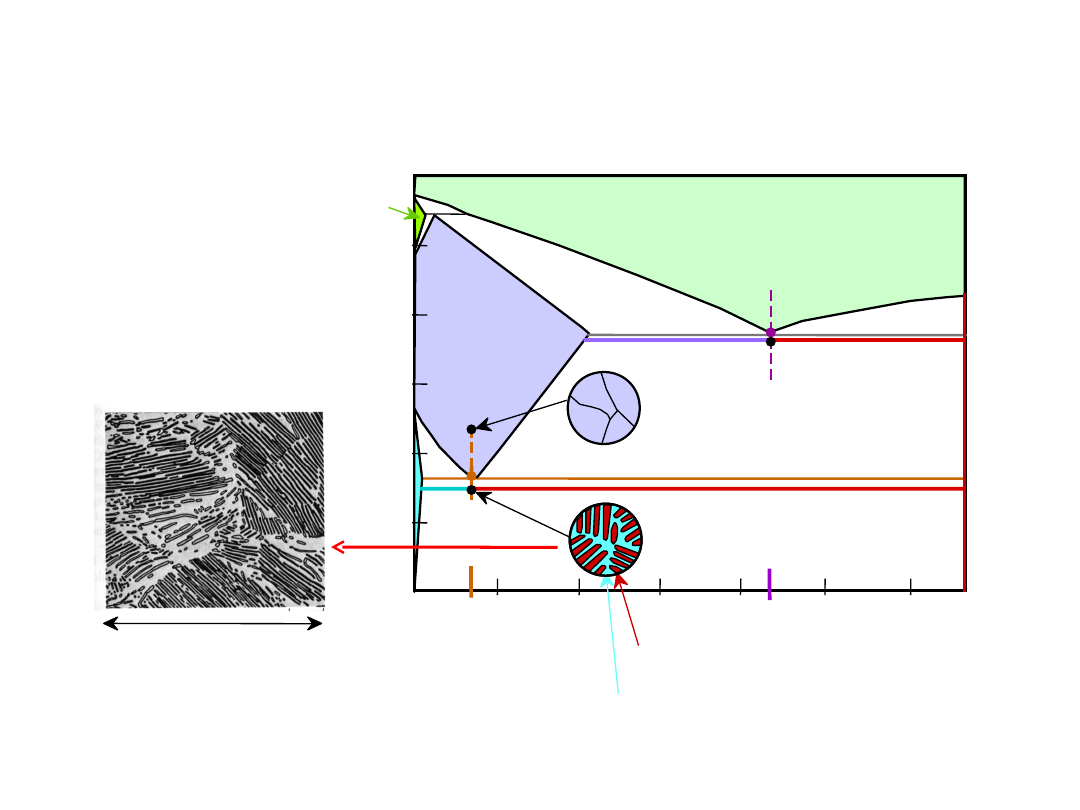
24
Układ Fazowy Żelazo-Węgiel (Fe-
C)
2 ważne punkty
-Eutektoid (B):
+Fe
3
C
-Eutektyka (A):
L +Fe
3
C
Fe
3
C
(
ce
m
e
n
ty
t)
1600
1400
1200
1000
800
600
400
0
1
2
3
4
5
6
6.7
L
(austenit)
+L
+Fe
3
C
+Fe
3
C
+
L+Fe
3
C
(Fe)
C
o
, % mas. C
1148°C
T(°C)
726°C = T
eutectoid
A
S
R
4.30
Wynik przemiany: Perlit
naprzemianległe płytki
faz i Fe
3
C
120 m
R
S
0.76
C
e
u
te
ct
o
id
B
Fe
3
C (cementyt-twardy)
(ferryt-miękki)
25
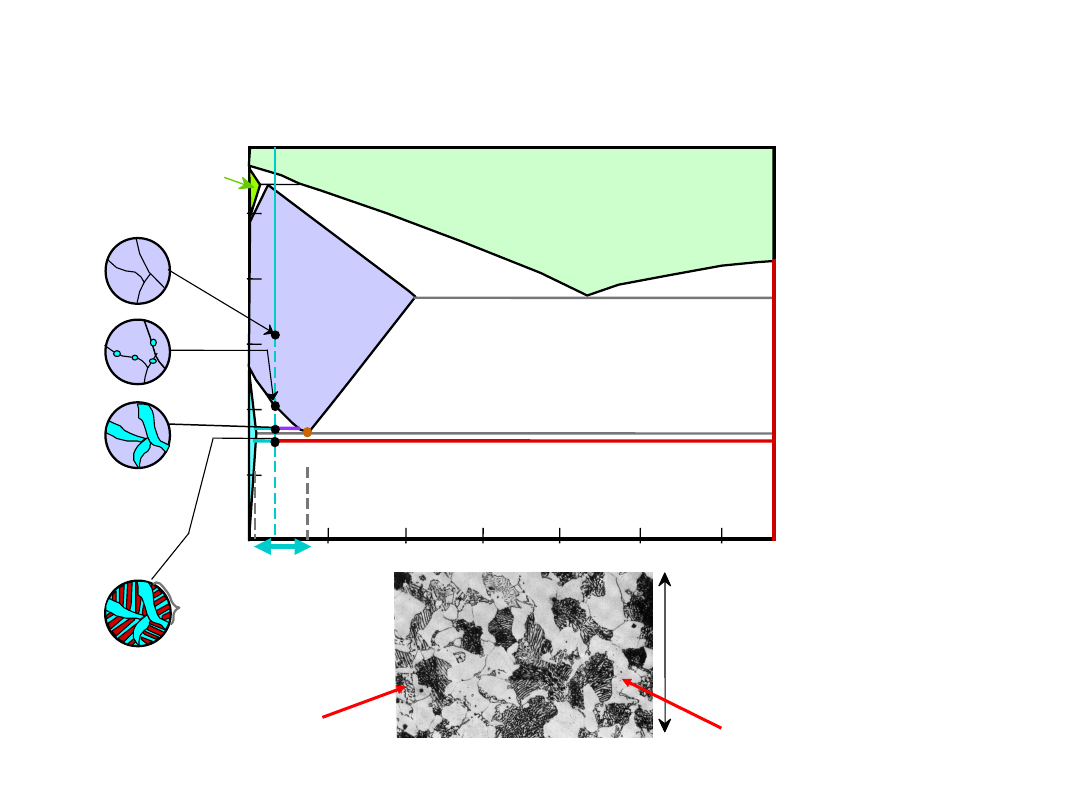
Stal Podeutektoidalna
Fe
3
C
(
ce
m
e
n
ty
t)
1600
1400
1200
1000
800
600
400
0
1
2
3
4
5
6
6.7
L
(austenit)
+L
+
Fe
3
C
+
Fe
3
C
L+Fe
3
C
(Fe)
C
o
, % mas. C
1148°C
T(°C)
727°C
Układ Fe-C
C
0
0
.7
6
ferryt
przedeutektoidal
ny
perlit
100 m
Stal Podeutektoidalna
R
S
w
=
S
/(
R
+
S
)
w
Fe
3
C
=(1-
w
)
perlit
=
w
perlit
r
s
w
=
s
/(
r
+
s
)
w
=(1-
w
)
W
26
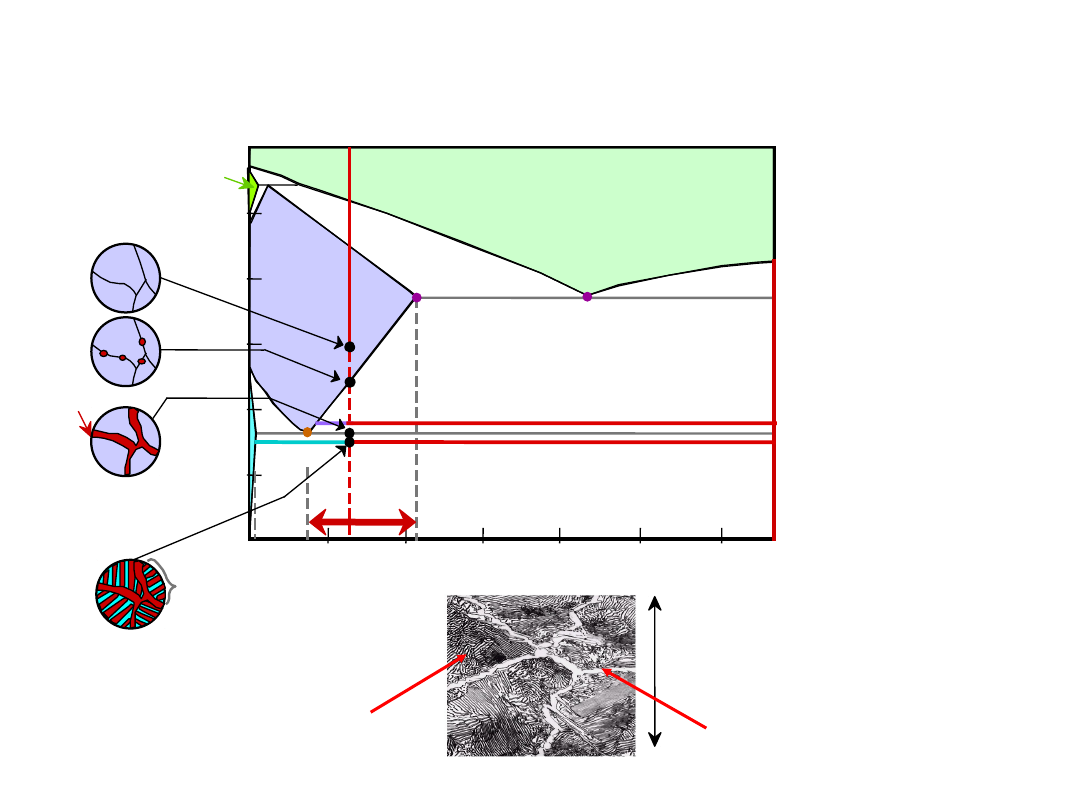
Stal Nadeutektoidalna
Fe
3
C
(
ce
m
e
n
ty
t)
1600
1400
1200
1000
800
600
400
0
1
2
3
4
5
6
6.7
L
(austenit)
+L
+Fe
3
C
+Fe
3
C
L+Fe
3
C
(Fe)
C
o
, % mas. C
1148°C
T(°C)
0
.7
6
C
o
Fe
3
C
przedeutektoidalny
60 m
Stal Nadeutektoidalna
perlit
R
S
w
=
S
/(
R
+
S
)
w
Fe
3
C
=(1-
w
)
w
perlit
=
w
perlit
s
r
w
Fe
3
C
=
r
/(
r
+
s
)
w
=(1-
w
Fe
3
C
)
Fe
3
C
Układ Fe-C

27
Przykład: Równowaga
Fazowa
Dla stali 99.6% Fe, 0.40% C (% mas.) w
temperaturze nieznacznie niższej od
eutektoidalnej określić:
a)
skład Fe
3
C i ferrytu ()
b)
ilość cementytu w gramach w 100 g stali
c)
ilość perlitu i przedeutektoidalnego ferrytu
()
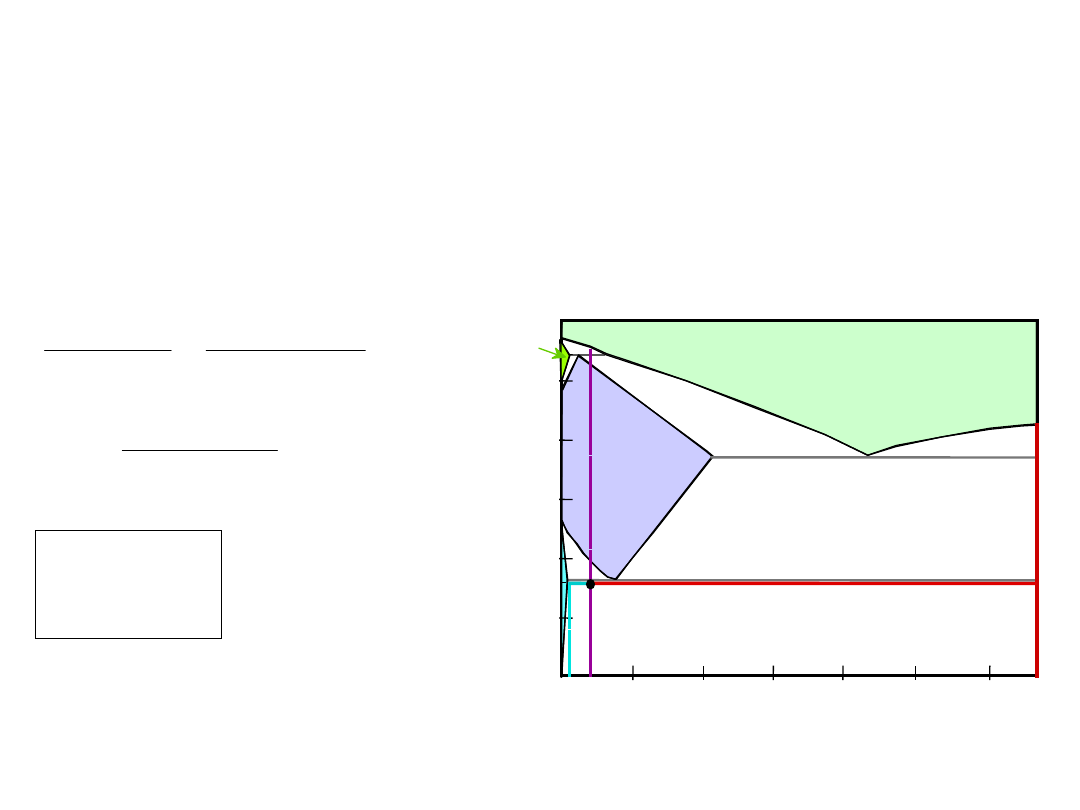
28
Równowaga Fazowa
g
3
.
94
g
5.7
C
Fe
g
7
.
5
100
022
.
0
7
.
6
022
.
0
4
.
0
100
x
C
Fe
C
Fe
3
C
Fe
3
3
3
x
C
C
C
C
o
b) ilość cementytu
w 100 g stali
a) skład Fe
3
C i ferrytu ()
C
O
= 0.40% C
C
= 0.022% C
C
Fe C
= 6.70% C
3
Fe
3
C
(
ce
m
e
n
ty
t)
1600
1400
1200
1000
800
600
4000
1
2
3
4
5
6 6.7
L
(austenit)
+L
+
Fe
3
C
+
Fe
3
C
L+Fe
3
C
C
o
, wt% C
1148°C
T(°C)
727°C
C
O
R
S
C
Fe C
3
C
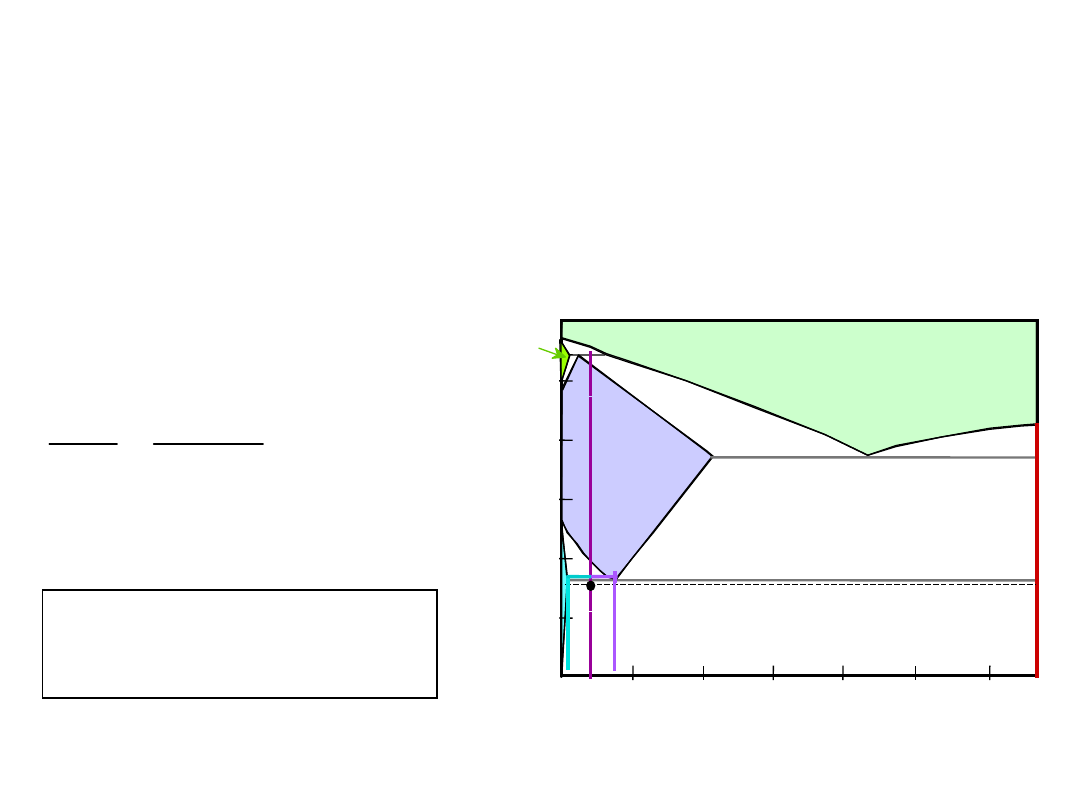
29
Równowaga Fazowa
c) ilość perlitu i przedeutektoidalnego ferrytu ()
uwagaż: ilość perlitu = ilość tuż powyżej T
E
C
o
= 0.40% C
C
= 0.022% C
C
perlit
= C
= 0.76% C
C
o
C
C
C
x 10051.2 g
perlit = 51.2 g
przedeutekt. = 48.8 g
Fe
3
C
(
ce
m
e
n
ty
t)
1600
1400
1200
1000
800
600
4000
1
2
3
4
5
6 6.7
L
(austenite)
+L
+
Fe
3
C
+
Fe
3
C
L+Fe
3
C
C
o
, % mas. C
1148°C
T(°C)
727°C
C
O
R
S
C
C
30
Dodatki Stopowe w Stali
Zmiana T
eutektoid
Zmiana C
eutektoid
T E
u
te
kt
o
id
(°
C
)
% mas. pierwiatska
Ti
Ni
Mo
Si
W
Cr
Mn
% mas. pierwiastka
C e
u
te
kt
o
id
(
%
C
)
Ni
Ti
Cr
Si
Mn
W
Mo

31
•
Wykresy fazowe
są użytecznym
narzędziem do określania:
- liczby i rodzajów faz,
- % mas. każdej z faz,
- składu chem. każdej z faz
dla danej T i składu chemicznego stopu.
• Dodatki stopowe w roztworach stałych:
- zwiekszają wytrzymałość (R
m
)
- zmniejszenie ciągliwości.
•
Eutektyki
i
eutektoidy
pozwalają
na tworzenie wielu rodzajów
mikrostruktur.
Podsumowanie
Document Outline
- Układy Równowagi Fazowej
- Równowaga Fazowa: Rozpuszczalność Graniczna
- Składniki i Fazy
- Wpływ T i Składu Chemicznego (C)
- Slide 5
- Wykresy Fazowe – liczba i rodzaje faz
- Wykresy Fazowe – skład chemiczny faz
- Wykresy Fazowe – ułamki wagowe faz
- Reguła Dźwigni
- Chłodzenie w układzie Cu-Ni
- Jednorodność Faz
- Układ Podwójny z Eutektyką
- Przykład: Układ Pb-Sn (1)
- Przykład: Układ Pb-Sn (2)
- Microstruktury w Układach z Eutektyką: I
- Microstruktury w Układach z Eutektyką: II
- Microstruktury w Układach z Eutektyką: III
- Struktura Płytkowa Eutektyki
- Microstruktury w Układach z Eutektyką: IV
- Mikrostruktury Pod- i Nadeutektyczne
- Fazy Międzymetaliczne
- Eutektoid & Perytektyka
- Slide 23
- Układ Fazowy Żelazo-Węgiel (Fe-C)
- Stal Podeutektoidalna
- Stal Nadeutektoidalna
- Przykład: Równowaga Fazowa
- Równowaga Fazowa
- Slide 29
- Dodatki Stopowe w Stali
- Podsumowanie
Wyszukiwarka
Podobne podstrony:
Wyklad 5b Uklady Fazowe
Wyklad uklady fazowe
Wyklad uklady fazowe
W3B Układy fazowe
Zestaw 3 układy fazowe
ŚrodkiTransportu Dalekiego wykład 5b
Wyklad 15 Układy motoryczne
Wyklad IV Uklady
Wykład 5b cd PRCz
Wyklad 5b zapobieganie zagrożeniom
Wykład 5b, Koszty finansowania zewnętrzneg o
Wykład Ch F równowagi fazowe
Wyklad Nr 1 UKLADY ROWNAN LINIOWYCH
stres wyklad 5b
Wyklad 5b Dobor zmiennych
Wykład XIII, Układy asynchroniczne
Wykład XIV- Układy asynchroniczn e kodowanie
więcej podobnych podstron