
Typy reakcji chemicznych
Procesy utleniania i
redukcji

Typy reakcji chemicznych
Reakcje syntezy
reakcja, w której z dwu lub kilku
substancji prostszych powstaje jedna
substancja bardziej złożona według
schematu:
A + B → C
S + O
2
→ SO
2
CaO + CO
2
→ CaCO
3

Reakcje analizy (rozkładu)
przemiana, w której z jednej substancji
złożonej tworzą się dwie lub kilka
substancji prostszych, odwrotność
reakcji syntezy:
AB → A + B
Typy reakcji chemicznych
CaCO
3
→ CaO + CO
2

Reakcje wymiany
najczęściej spotykany typ reakcji,
następuje tu wymiana składników
pomiędzy substancjami reagującymi,
wyróżnia się:
reakcje wymiany pojedynczej
A + BC → AC + B
Typy reakcji chemicznych
Mg + 2HCl → MgCl
2
+ H
2
reakcje wymiany
podwójnej
AB + CD → AD + BC
2NaOH + H
2
SO
4
→ Na
2
SO
4
+2H
2
O

Przemianom chemicznym towarzyszą efekty
energetyczne
• reakcja, w której układ reagujący pochłania
energię z otoczenia (reakcja o ujemnym
bilansie energetycznym) to
PROCES
ENDOENERGETYCZNY
np. ogrzewanie
chloranu potasu
• reakcja o dodatnim bilansie energetycznym,
taka, w której układ reagujący wydziela
energię do otoczenia to
PROCES
EGZOENERGETYCZNY
np. reakcja kwasu
solnego z węglanem wapnia
Typy reakcji chemicznych

reakcje strącania osadu związków
trudno rozpuszczalnych
reakcje otrzymywania słabych
elektrolitów (kwasów lub zasad)
reakcje zobojętniania
reakcje hydrolizy
Typy reakcji chemicznych

Reakcje strącania osadu związków
trudno rozpuszczalnych: wiele z tych
reakcji ma znaczenie analityczne np.
analiza jakościowa kationów i anionów.
Ważne
Jaką barwę ma osad…
Jaką ma postać (galaretowaty, krystaliczny
itp.)…
W czym się rozpuszcza…
Typy reakcji chemicznych

CdCl
2
+ Na
2
S CdS↓ + 2NaCl
Cd
2+
+ 2Cl
-
+ 2Na
+
+
S
2-
CdS↓ + 2Na
+
+ 2Cl
-
Cd
2+
+ S
2-
CdS↓
kanarkowo żółty osad siarczku kadmu
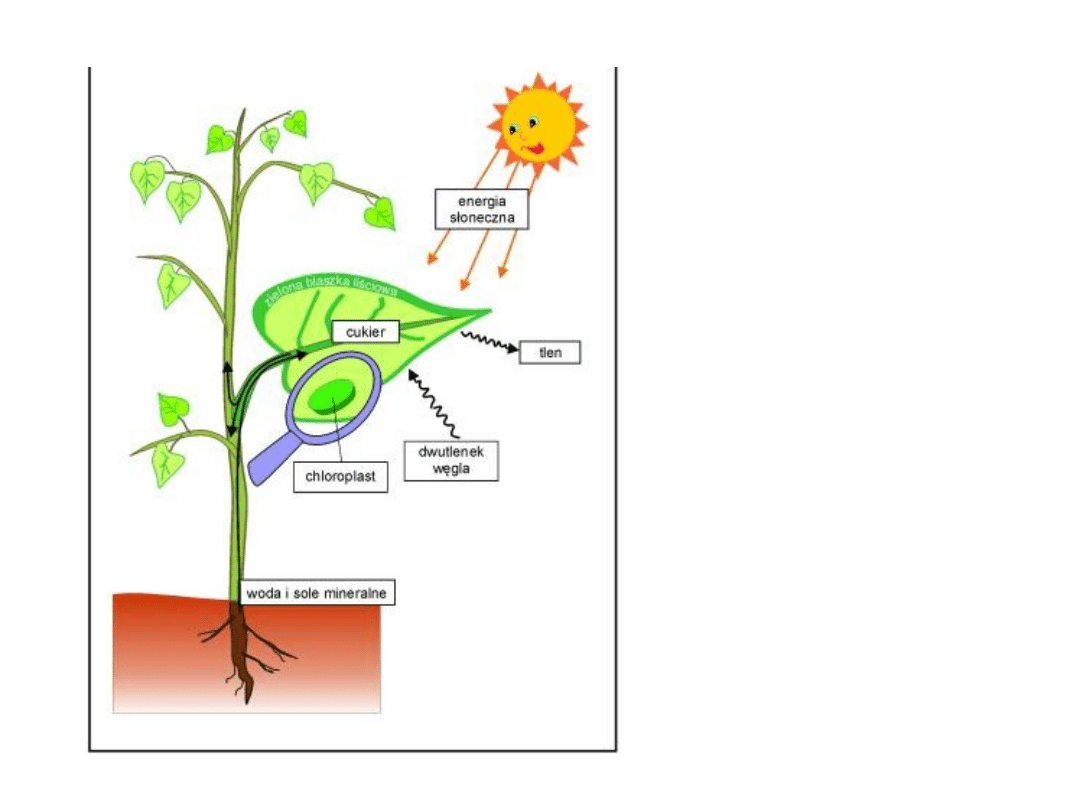
woda + dwutlenek węgla + światło słoneczne ---> cukry
(węglowodany)
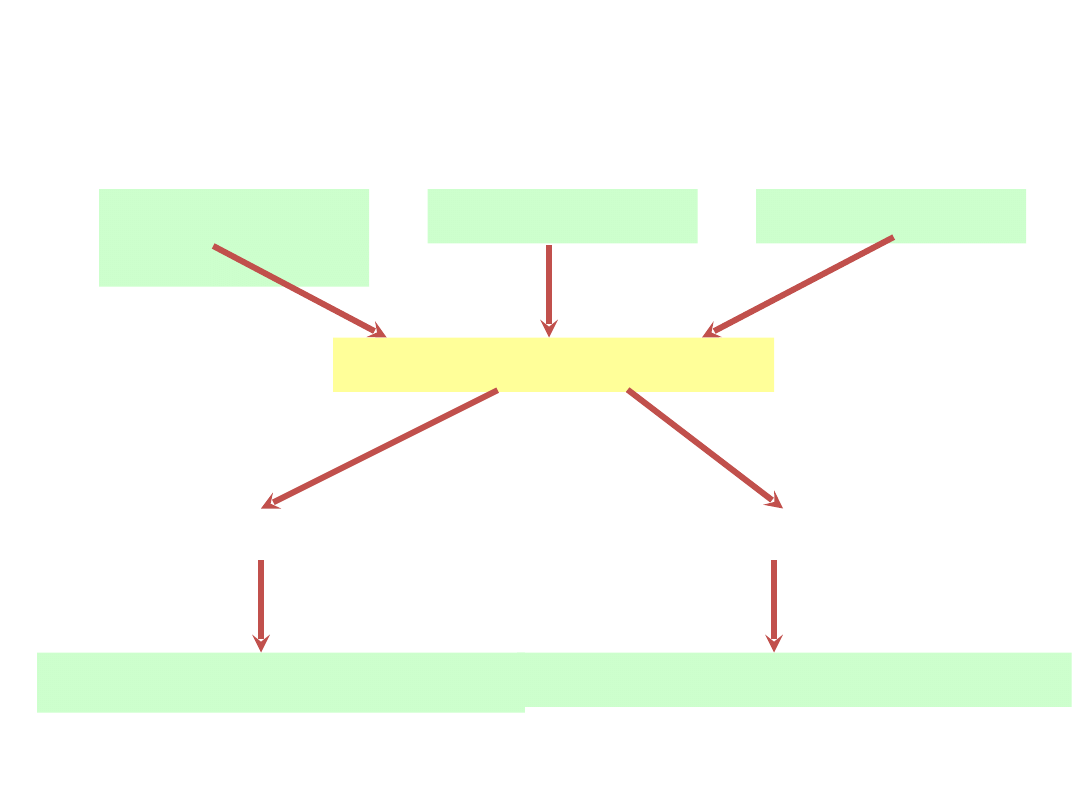
Oddychanie komórkowe
węglowoda
ny
tłuszcze
białka
kwas pirogronowy
oddychanie tlenowe
oddychanie
beztlenowe
O
2
CO
2
+ H
2
O +
E (38 ATP)
kwas mlekowy +
E (2 ATP)

etanol -----> aldehyd octowy -----> kwas
octowy

Wiele procesów zachodzących w
organizmach żywych to efekt
procesów utleniania i redukcji.

Procesy redoks
• Reakcje utleniania i redukcji przebiegają
ze zmianą stopni utlenienia
STOPIEŃ UTLENIENIA
• liczba dodatnich lub ujemnych ładunków,
jakie przypisalibyśmy atomom danego
pierwiastka, gdyby cząsteczki tej
substancji miały budowę jonową.
• liczba elektronów, które atom danego
pierwiastka wykorzystuje do utworzenia
wiązania chemicznego
POJĘCIE UMOWNE!

REAKCJE, W KTÓRYCH NASTĘPUJE
PRZENIESIENIE ELEKTRONU OD
JEDNEJ SUBSTANCJI DO DRUGIEJ
NAZYWAMY REAKCJAMI
UTLENIANIA-REDUKCJI (REDOKS)
W wyniku reakcji redoks następuje
zmiana stopni utlenienia
Procesy redoks
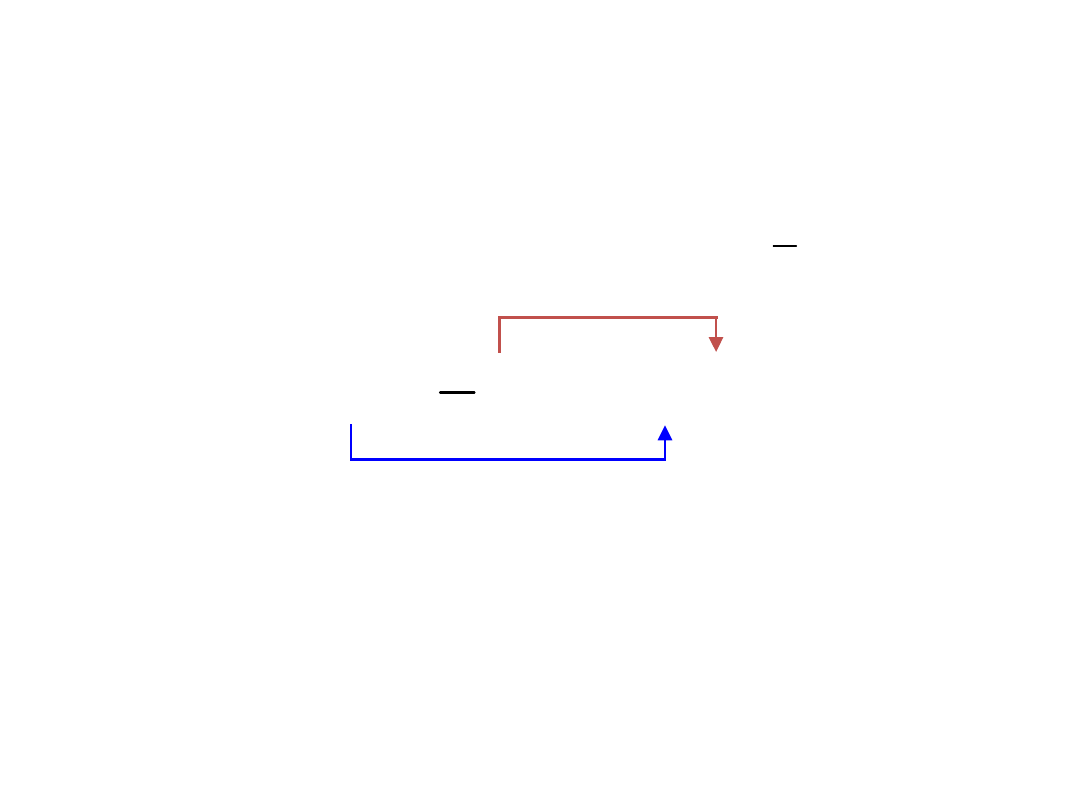
CaO
O
2
1
Ca
2
-2e
+2e
utlenianie
redukcja
Substancja oddająca
elektrony to
REDUKTOR
,
utlenia się
w
reakcji
Substancja pobierająca
elektrony od reduktora
to
UTLENIACZ
,
redukuje się
w reakcji
2
2
O
2e
O
2
1
2e
Ca
Ca
2

• W każdej reakcji utleniania i redukcji
utlenianiu towarzyszy redukcja i
odwrotnie.
• Ogólna liczba oddanych przez
reduktor elektronów musi być równa
liczbie elektronów pobranych przez
utleniacz
Procesy redoks

Reguły określające przypisywanie ładunków (stopni
utlenienia)
1. Stopień utlenienia atomu pierwiastka występującego w
stanie wolnym, we wszystkich odmianach alotropowych
równy jest ZERU.
2. Suma stopni utlenienia atomów w cząsteczce jest równa
zeru, a w jonie jest równa ładunkowi jonu.
3. Fluor we wszystkich związkach posiada stopień utlenienia -1.
4. Wodór posiada stopień utlenienia +1, z wyjątkiem połączeń z
metalami,
w których wodór ma stopień utlenienia -1 (wodorki litowców i
berylowców np. NaH).
5. Stopień utlenienia tlenu wynosi -2, z wyjątkiem połączeń
nadtlenkowych, w których tlen jest na -1 stopniu utlenienia
(np. BaO
2
), oraz fluorku tlenu OF
2
, w którym tlen jest na +2
stopniu utlenienia. W ponadtlenkach przyjmuje się stopień
utlenienia -1/2 (np.KO
2
)
6. Stopień utlenienia litowców wynosi +1, a berylowców +2.

Bilansowanie reakcji
redoks
1. określić stopnie utlenienia
poszczególnych pierwiastków
reakcji
KMnO
4
+ Na
2
SO
3
+ H
2
O MnO
2
+
Na
2
SO
4
+ KOH
+1 +7 -2 +1 +4 -2 +1 -2
KMnO
4
+ Na
2
SO
3
+ H
2
O
+4 -2 +1 +6 -2 +1 -2 +1
MnO
2
+ Na
2
SO
4
+ KOH
Bilansowanie reakcji
redoks
2.zaznaczyć pierwiastki
zmieniające swój stopień
utleniania – wskazać utleniacz i
reduktor
+1 +7 -2 +1 +4 -2 +1
-2
K
Mn
O
4
+ Na
2
S
O
3
+ H
2
O
+4 -2 +1 +6 -2 +1 -2
+1
Mn
O
2
+ Na
2
S
O
4
+ KOH
Mangan przeszedł z +7 stopnia utlenienia na +4:
zredukował się
;
jest utleniaczem
Siarka zmieniła stopień utlenienia z +4 na +6;
utleniła się;
jest reduktorem

Bilansowanie reakcji
redoks
3. ustalić, ile elektronów oddają
atomy reduktora, a ile
elektronów pobierają atomy
utleniacza, zapisać oddzielnie
procesy utleniania i redukcji
Utlenianie:
S
+4
- 2e = S
+6
· 3
Redukcja:
Mn
+7
+ 3e =
Mn
+4
.
2
czyli:
3S
+4
- 6e = 3S
+6
2Mn
+7
+ 6e = 2Mn
+4

4. dobrać współczynniki przy
utleniaczu i reduktorze (liczba
elektronów biorących udział w
procesie utleniania musi być
równa liczbie elektronów w
procesie redukcji
2
KMnO
4
+
3
Na
2
SO
3
+ H
2
O
2
MnO
2
+
3
Na
2
SO
4
+
2
KOH
Bilansowanie reakcji
redoks

5. sprawdzić poprawność
współczynników poprzez bilans
atomów tlenu
(liczba atomów tlenu po stronie
substratów musi być równa liczbie
atomów tlenu po stronie
produktów)
Bilansowanie reakcji
redoks
2
KMn
O
4
+
3
Na
2
S
O
3
+
H
2
O
2
Mn
O
2
+
3
Na
2
S
O
4
+
2
K
O
H
Strona lewa
Strona
prawa
Tlen
8
9
+ 1
18
4
12
+ 2
18
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
PROCESY UTLENIANIA I REDUKCJI dgfd
Procesy utleniania i redukcji, LICEUM różne, CHEMIA
PROCESY UTLENIANIA I REDUKCJI 2
PROCESY UTLENIANIA I REDUKCJI
W14S-Procesy utlenienia-redukcji, chemia, szkolka
W15 reakcje utlenienia redukcji
5 Reakcje utleniania i redukcji Reakcje w roztworach
CHEM OG, cw 4, REAKCJE UTLENIANIA I REDUKCJI
06 Sprawozdanie z reakcji utleniania i redukcji Naprawiony
Nowoczesne procesy utleniania
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Zad
więcej podobnych podstron