
Fizykochemia wody
występowanie cząsteczki wody w
materiałach budowlanych:
1. Woda krystalizacyjna:
- koordynacyjna – silnie związana z
jonami hydratów, np. [Al(H
2
O)
6
]Cl
3
- sieciowa – zajmująca określone miejsce
w sieci krystalicznej, np. BaCl
2
*2H
2
O
- konstytucyjna – występująca w postaci
grup hydroksylowych OH
-

- śródwęzłowa (międzysieciowa, zeolityczna,
międzywarstwowa, międzypakietowa) –
luźno związana, w lukach strukturalnych
2. Woda kapilarna – w mikroporach (d<10
-
7
m) materiału
3. Woda swobodna – w makroporach, jamach
międzyziarnowych, na powierzchni jako
woda zaadsorbowana
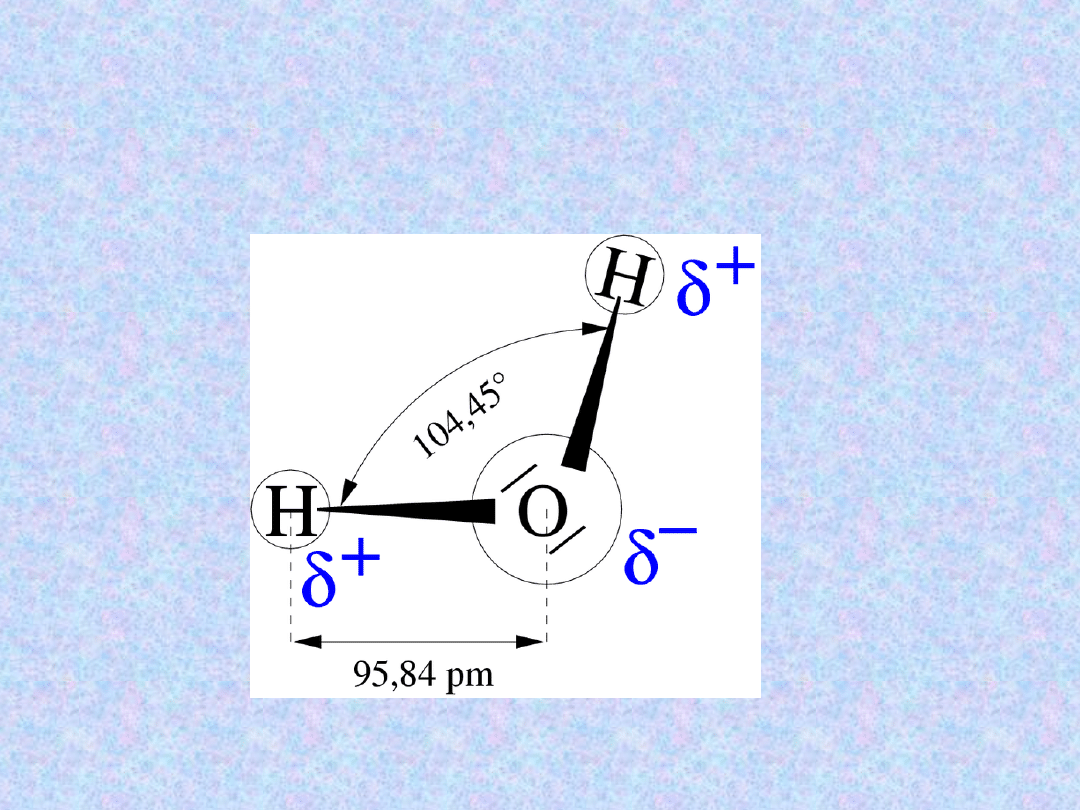
Struktura wody
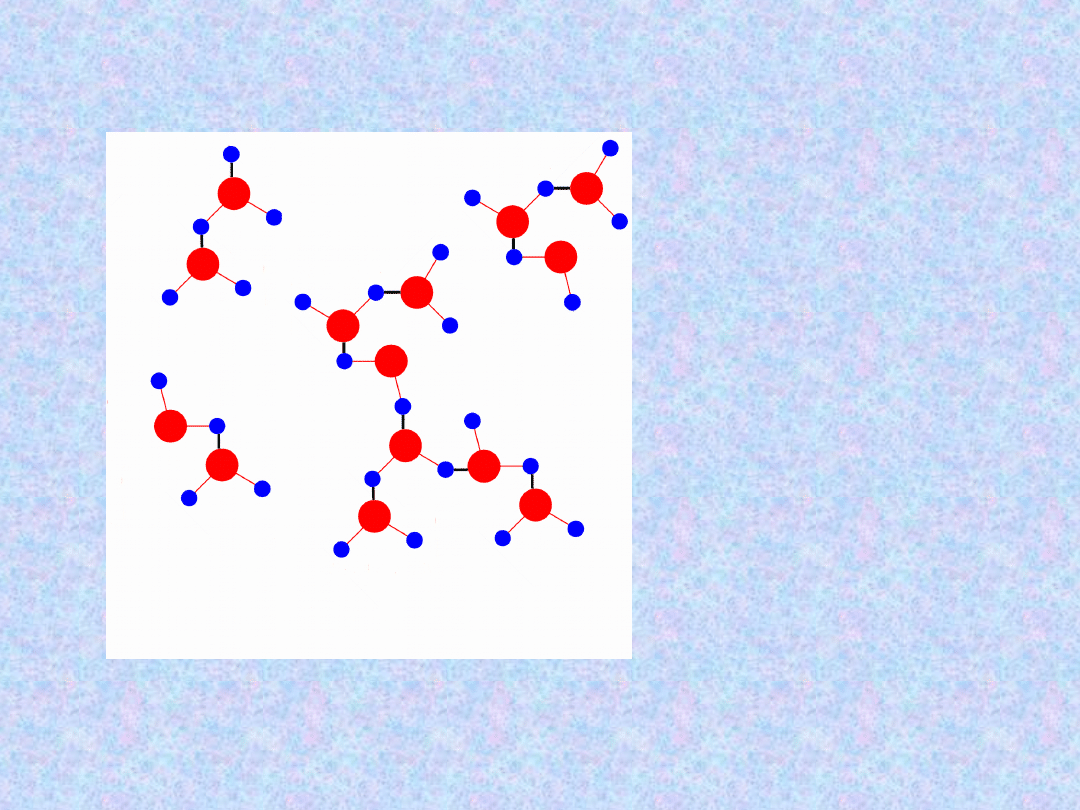
Czerwony – wiązania
atomowe
czarny – wiązania
wodorowe

Tworzenie się wody
• 2H
2
+O
2
→2H
2
O ΔH
0
= - 572,0 kJ/mol
• H
+
+ OH
-
→H
2
O ΔH
0
= - 57,15 kJ/mol
• CH
4
+2O
2
→CO
2
+2H
2
O
• Odszczepienie wody z minerałów
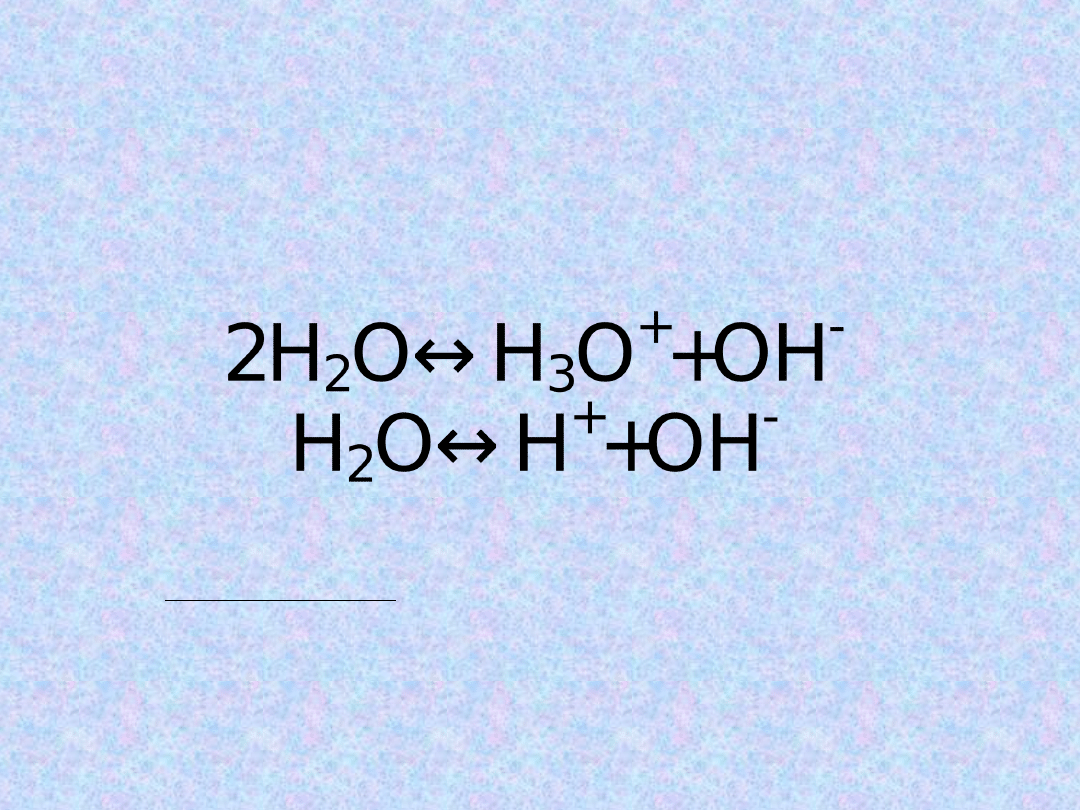
Dysocjacja elektrolityczna
wody
Reakcja autoprotolizy (dysocjacji elektrolitycznej)
K
c
=
[H
+
][OH
-
]
[H
2
O]
=1,8*10
-16
mol/dm
3

Iloczyn jonowy wody
K
w
=[H
+
][OH
-
]=10
-14
mol/dm
3
[H
+
]=[OH
-
]= √K
w
=
10
-7
mol/dm
3
Wykładnik jonów wodorowych:
pH=-lg[H
+
]
Wartość pH = pOH w czystej wodzie,
tzw. pH neutralne, wynosi 7 i
określa umowny środek skali pH.

Oznaczanie pH
• Wskaźniki kwasowo – zasadowe
rodzaj
zakres pH, w
kt. zmienia
się barwa
barwa w roztworze
kwaśnym
zasadowy
m
Oranż
metylowy
3,1 – 4,4 czerwona żółta
Czerwień
metylowa
4,2 – 6,3 czerwona żółta
Błękit
bromotymo
lowy
6,0 – 7,6 żółta
niebieska
fenoloftalei
na
8,3 - 10
bezbarwn
a
czerwona
-papierek lakmusowy
- pH-metr

hydroliza
Rozpad substancji na jony pod
wpływem wody
• sól mocnej zasady i słabego kwasu –
odczyn zasadowy
• sól słabej zasady i mocnego kwasu –
odczyn kwaśny
• sól słabej zasady i słabego kwasu –
odczyn obojętny
• sól mocnej zasady i mocnego kwasu
– nie ulega hydrolizie i jest całkowicie
zdysocjowana odczyn obojętny

Roztwory buforowe
• Roztwory słabych kwasów lub zasad
z ich solami
• Niewielki dodatek kwasu lub zasady
nie zmienia wartości ich pH

Twardość wody
• Woda zawiera zanieczyszczenia w
postaci soli wapnia i magnezu
• Miarą twardości wody jest:
mmol/dm
3
, mval/dm
3
i stopnie
niemieckie
o
n
1mmol/dm
3
=2 mval/dm
3
=5,6
o
n
Określa zawartość związków wapnia i
magnezu w przeliczeniu na CaO.

Twardość wody spowodowana jest
obecnością jonów Ca
2+
, Mg
2+
, Sr
2+
, Ba
2+
- twardość ogólna
Twardość węglanowa – kwaśne węglany
wapnia i magnezu,
Gotowanie: Ca(HCO)
3
→CaCO
3
+H
2
O+CO
2
Kamień kotłowy
Twardość niewęglanowa – rozpuszczalne
sole wapnia i magnezu – twardość
stała

Skala twardości wody
STOPIEŃ TWARDOŚCI TWARDOŚĆ OGÓLNA
mmol/dm
3
Bardzo miękka
0 – 0,75
Miękka
0,75 – 1,50
Średnio twarda
1,50 – 3,30
Twarda
3,30 – 5,0
Bardzo twarda
> 5,0

Zmiękczanie wody
Strącanie trudno rozpuszczalnych
osadów jonów Ca
2+
, Mg
2+
• Metoda wapienno – sodowa:
twardość węglanowa:
Ca(OH)
2
+Ca(HCO
3
)
2
→2CaCO
3
↓+2H
2
O
Ca(OH)
2
+Mg(HCO
3
)
2
→MgCO
3
↓+
2CaCO
3
↓ +2H
2
O

Twardość niewęglanowa:
Ca(OH)
2
+MgSO
4
→2Mg(OH)
2
↓+CaSO
4
↓
Na
2
CO
3
+CaSO
4
→CaCO
3
↓+Na
2
SO
4
• Metoda fosforanowa:
2Na
3
PO
4
+3Ca(HCO
3
)
2
→Ca
3
(PO
4
)
2
↓+
6NaHCO
3
2Na
3
PO
4
+3CaSO
4
→Ca
3
(PO
4
)
2
↓+3Na
2
SO
4

• Metoda wymiany jonowej:
Jonity nieorganiczne – zeolity
Jonity organiczne - wofatyty
Kt-H
2
+ CaSO
4
→ Kt-Ca + H
2
SO
4
An-(OH)
2
+ H
2
SO
4
→ An-SO
4
+ 2H
2
O
• Oczyszczanie ścieków

Woda zarobowa
• Siarczany – ze składnikami cementu tworzą
związki znacznie zwiększające objętość, co
może powodować rozsadzanie betonu,
wody o małej zawartości siarczanów tworzą
gips, częściowo uszczelniający beton
wody o dużej zawartości tworzą np. sól
Candlota: 3CaO·Al
2
O
3
·3CaSO
4
·32H
2
O

• Siarkowodór i jego sole – łatwo się
utleniają do siarczanów(IV) i (VI).
reakcja z Ca(OH)
2
: powstawanie
wodorosiarczanu wapniowego
Ca(HS)
2
– łatwo rozpuszczalny w
wodzie, nie posiadający właściwości
wiążących
• Kwasy – reakcja ze składnikami
cementu i produktami uwodnienia
cementu – powstawanie łatwo
rozpuszczalnych związków

• Cukier – główny składnik: sacharoza
(C
12
H
22
O
11
) tworzy z Ca(OH)
2
cukrzany
wapniowe utrudniające wiązanie i
obniżające wytrzymałość
• Substancje humusowe – zawierają
kwas huminowy, który reaguje z
wodorotlenkiem wapnia tworząc
nierozpuszczalny huminian wapniowy
• Wymagania stawiane wodzie
zarobowej określa norma PN-88/B-
32250: „Woda do betonów i zapraw”

PODZIAŁ MATERIAŁÓW
BUDOWLANYCH
Kompozyty:
rodzaj fazy rozproszonej:
-
wypełniacz włóknisty - laminaty, np. epoksydowo –
szklane jako wykładzina antykorozyjna na betonie,
-
wypełniacz ziarnisty – kompozyty betonopodobne,
zaprawy i betony cementowe, żywiczne
-
wypełniacz mieszany – np. durobeton, zaprawy lub betony
zbrojone ciętym włóknem stalowym

- Organiczne: drewno, bitumy,
tworzywa sztuczne i nieorganiczne
(mineralne): materiały kamienne i
metale
Ziarniste naturalne materiały
kamienne (kruszywa):
– wielkość ziaren (pyły, piaski, żwiry)
– sposób pozyskania: naturalne i
łamane

- rodzaj skał (magmowe, osadowe,
przeobrażeniowe)
Sztuczne materiały kamienne:
- wypalana do spieku ceramika budowlana,
- wypalane do stopu szkło budowlane,
leizna kamienna, wełna mineralna
- betony i zaprawy (ziarna kruszywa
zespolone materiałem wiążącym)
Materiały wiążące
- mechanizm wiązania: spoiwa i lepiszcza
spoiwa żywiczne

Tworzywa sztuczne:
Polimery – wielkocząsteczkowe substancje
o masie cząsteczkowej powyżej 10
4
Modyfikatory: przeciwutleniacze, barwniki,
środki antyelektrostatyczne, wypełniacze
mineralne
Termoplasty – miękną z podwyższeniem
temperatury
Duroplasty – przechodzą nieodwracalnie w
stan utwardzony pod wpływem
temperatury
Elastomery - kauczukopodobne

CHEMIA MINERALNYCH
MATERIAŁÓW BUDOWLANYCH
• DWUTLENEK KRZEMU
870ºC
1470 ºC
1710 ºC
kwarc ↔ trydymit ↔ krystobalit ↔ szkło
amorficzny: żel krzemionkowy, ziemia
okrzemkowa,
Tworzy: piaskowce, granity, gnejsy,
Odporny na działanie kwasów z
wyjątkiem kwasu fluorowodorowego
(SiF
4
)

W wysokiej temp. reaguje z zasadowymi
tlenkami wodorotlenkami oraz solami:
SiO
2
+2FeO→Fe
2
SiO
4
SiO
2
+2NaOH→Na
2
SiO
3
+H
2
O
SiO
2
+CaCO
3
→CaSiO
3
+CO
2
Zastosowanie SiO
2
:
- piasek kwarcowy do betonów i zapraw,
- bardzo czysty – do produkcji szkła
- do produkcji ceramiki budowlanej

Kwasy krzemowe i ich sole
• Kwas ortokrzemowy, kwas
krzemowy(IV)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
FIZYKOTERAPIA wykład 1, FIZYKOTERAPIA - WYKŁAD
wykładII Fizykoterapia
PYTANIA Z WYKŁADU OCZYSZCZANIE WODY
Właściwości fizykochemiczne wody, Inżynieria Ekologiczna, Sprawozdania
FIZ-sem2, fizjoterapia, Układ nerwowy, fizjoterapia, WIEDZA, wykłady, FIZJOTERAPIA, wykłady fizyko
ELEKTROLECZNICTWO wyklady, Fizykoterapia, Fizykoterapia
Wykład 3 - Fizykoterapia (dr Szczepanowska-Wołowiec), UJK.Fizjoterapia, - Notatki - Rok II -, Fizyko
Wykład 1 - Fizykoterapia (dr Szczepanowska-Wołowiec), UJK.Fizjoterapia, - Notatki - Rok II -, Fizyko
Wykład 4 - Fizykoterapia (dr Szczepanowska-Wołowiec), UJK.Fizjoterapia, - Notatki - Rok II -, Fizyko
wykłady z fizyko-ultra, fizykoterapia
wykłady z fizyko-elektorstymulacja , fizykoterapia
Wyklad z fizykoterapii 25.10, fizjoterapia materiały WSZYSTKO cz.2
wyklady - z fizykoterapii AWF Elektroterapia- prądy, Fizjoterapia, Fizykoterapia, Prądy- Elektrotera
Wykład 4 zanieczyszcenia wody i attmosfery w Polsce(1)
więcej podobnych podstron