

BEZKATALITYCZNE I KATALITYCZNE
BEZKATALITYCZNE I KATALITYCZNE
PROCESY
PROCESY
UTLENIANIA
UTLENIANIA
WĘGLOWODORÓW
WĘGLOWODORÓW
ALKILOAROMATYCZNYCH
ALKILOAROMATYCZNYCH
W
W
FAZIE CIEKŁEJ
FAZIE CIEKŁEJ
Jan Zawadiak
Jan Zawadiak
Politechnika Śląska, Katedra Technologii
Politechnika Śląska, Katedra Technologii
Chemicznej Organicznej i Petrochemii
Chemicznej Organicznej i Petrochemii
1

procesy przebiegające bez udziału
procesy przebiegające bez udziału
katalizatorów
katalizatorów
produkt - wodoronadtlenek
produkt - wodoronadtlenek
katalityczne procesy utleniania
katalityczne procesy utleniania
węglowodorów alkiloaromatycznych
węglowodorów alkiloaromatycznych
produkty - keton, alkohol, nadtlenek,
produkty - keton, alkohol, nadtlenek,
kwas
kwas
2

Porównanie stężeń produktów katalitycznego
Porównanie stężeń produktów katalitycznego
i bezkatalitycznego utleniania kumenu
i bezkatalitycznego utleniania kumenu
Czas
[h]
ROOH
[%]
ROOR
[%]
FP
[%]
PhAc
[%]
Bez katalizatora
8.5
32.0
ślady
3.0
0.3
Z katalizatorem*
8.5
3.0
15.0 37.0 41.0
Temperatura 110
C; przepływ tlenu 15 dm
3
/h
*Katalizator: CuCl
2
·2H
2
O (0.064 mola/dm
3
)+ TBAB (1.34.10
-3
mola/dm
3
)
FP
2-Fenylo-2-propanol; PhAc Acetofenon
3
J.
Zawadiak, D. Gilner,
Pol. J. Applied Chem., 41, (3), 169-178 (1997)

Heinrich Hock 1887-1971
1907 - 1912 - studia w
1907 - 1912 - studia w
Monachium,
Monachium,
1912 – 1927 - praca w
1912 – 1927 - praca w
przemyśle,
przemyśle,
1927 – 1958 -
1927 – 1958 -
Akademia Górnicza w
Akademia Górnicza w
Clausthal, docent,
Clausthal, docent,
profesor
profesor
4
4

Berichte der deutschen Chemischen
Gesellschaft,
77, 257, 1944
5

Schemat reakcji w „procesie
kumenowym”
ArH + CH
3
-CH=CH
2
Ar C H
CH
3
CH
3
Ar C H
CH
3
CH
3
+ O
2
Ar C OOH
CH
3
CH
3
Ar C OOH
CH
3
CH
3
Ar OH +
C
CH
3
CH
3
O
H
+

Technologia
Hercules Inc.
Hercules Inc.
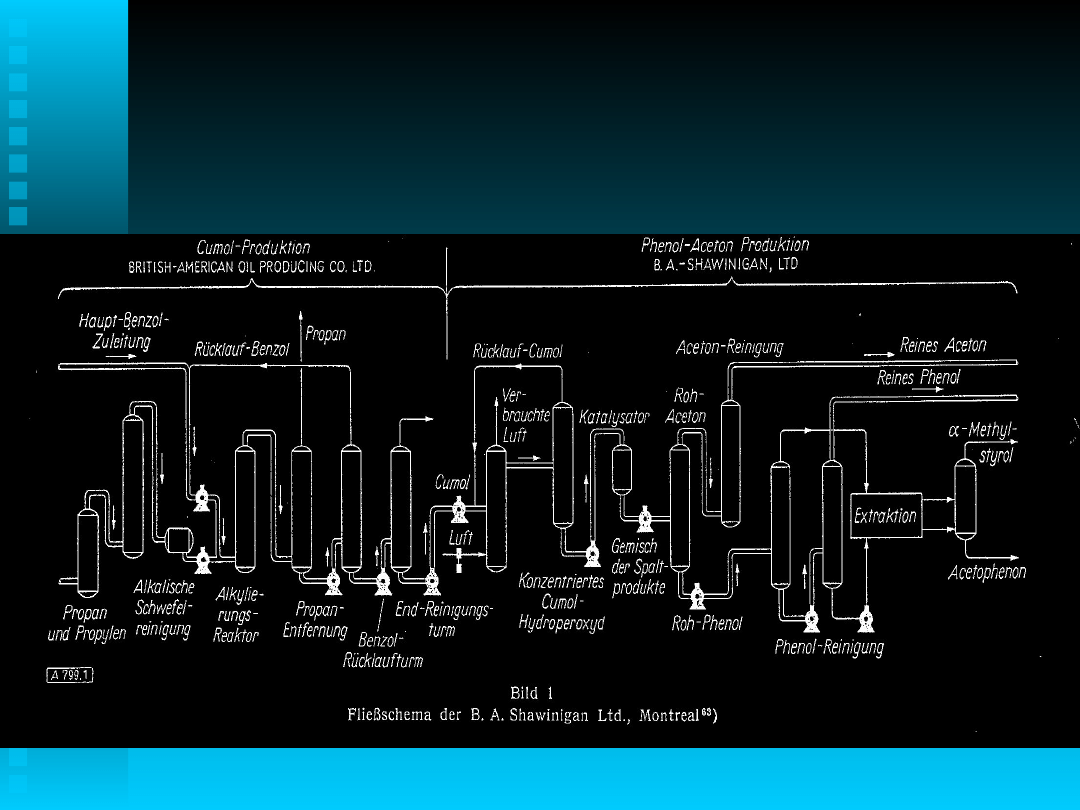
Technologia
Proces w układzie homogenicznym
Proces w układzie homogenicznym
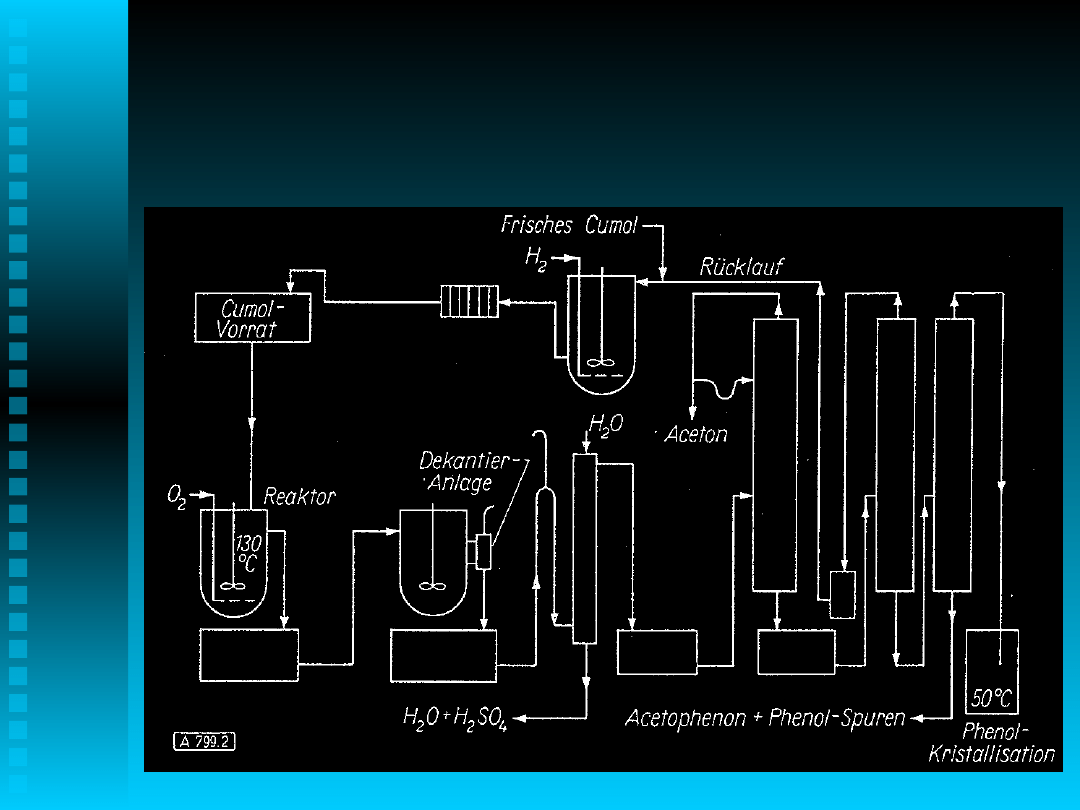
Technologia
Proces w emulsji
Proces w emulsji
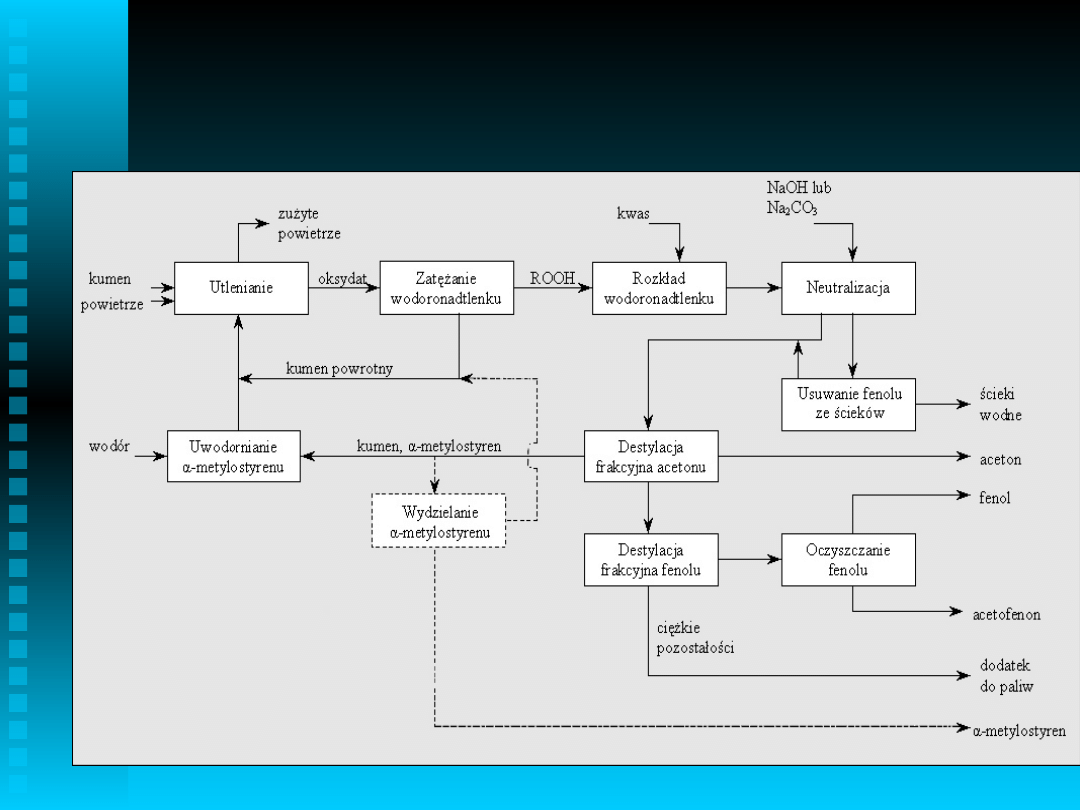
Schemat ideowy „procesu
kumenowego”

Rozkład wodoronadtlenku
kumylowego
Proces heterogeniczny, izotermiczny
Kaskada
reaktorów rozkładu
wodoronadtlenku
aceton
H
2
SO
4
wodoronadtlenek
Kalorymetr
aceton

Rozkład wodoronadtlenku
kumylowego
Proces homogeniczny, nieizotermiczny
Kaskada
reaktorów rozkładu
wodoronadtlenku
woda
chłodząca
H
2
SO
4
wodoronadtlenek
woda
Kalorymetr

Największe instalacje syntezy fenolu
w roku 2000
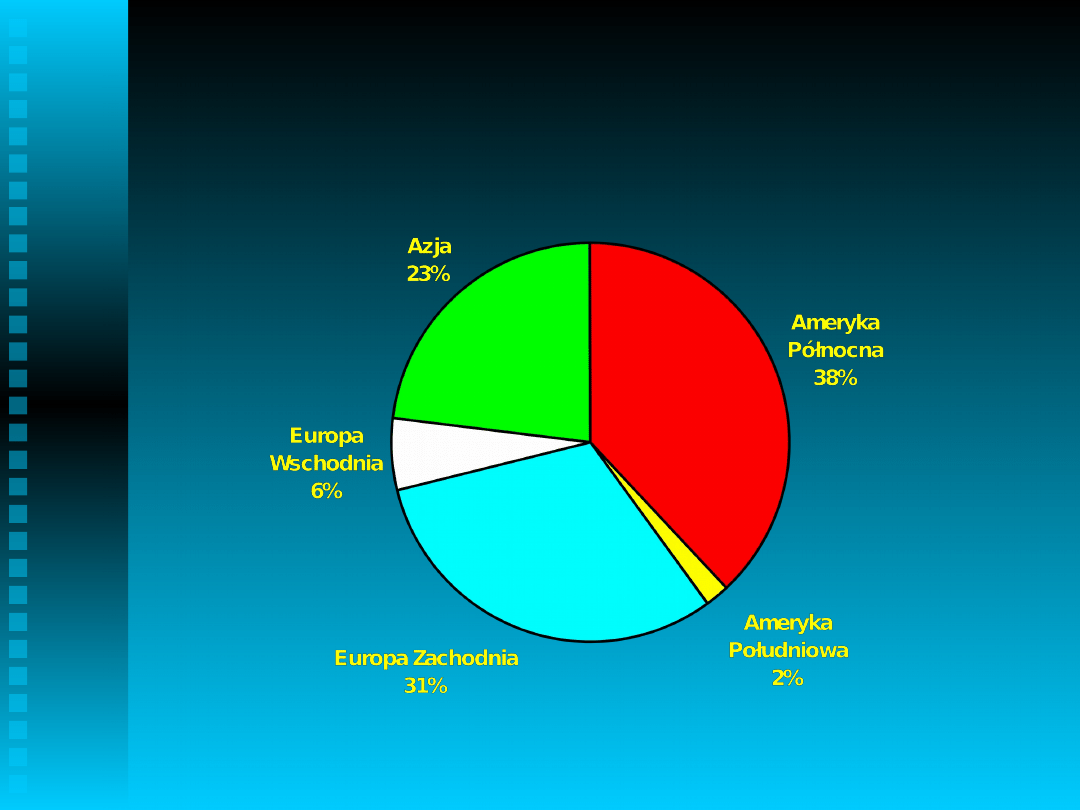
Światowa produkcja fenolu w roku
2000

Ar
H
O
2
Ar
OH
Ar
OOH
H
2
O
2
, H
+
Ar OH
C
H
3
C
H
3
gdzie Ar
Otrzymywanie hydroksyaromatów
Krezole-światowa produkcja szacowana jest na
Krezole-światowa produkcja szacowana jest na
80 tyś. t/r.
80 tyś. t/r.
Dwie instalacje po 20 tyś. t/rok firm Sumitomo i
Dwie instalacje po 20 tyś. t/rok firm Sumitomo i
Mitsui
Mitsui
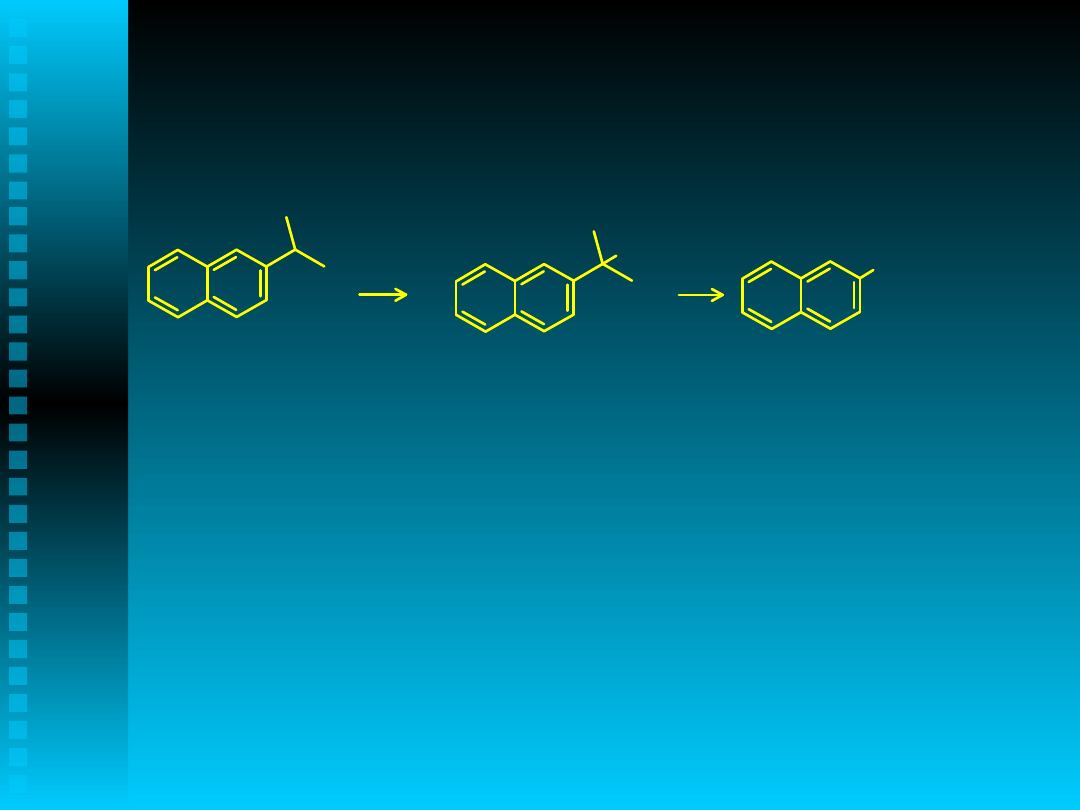
2-izopropylonaftalen → 2-naftol
m-cymen → m-krezol
p-cymen → p-krezol
4-izopropylobifenyl → 4-
hydroksybifenyl
7
OOH
OH
O
2
H
+
CH
3
COCH
3
+
Otrzymywanie 2-naftolu z 2-izopropylonaftalenu
J. Zawadiak, B. Orlińska, Z. Stec, Pol. J. Applied Chem., 44,
41-6 (2000)
J. Zawadiak, Z. Stec, B. Orlińska, Org. Proc. Res. and Dev.,
6, 670-3, (2002)
8
Z. Stec, J. Zawadiak, U. Knips, R. Zellerhoff, D. Gilner, B. Orlińska,
J. Polaczek, W. Tęcza, Z. Machowska
Patent Polski nr PL 181 496 (2001),
Patent USA nr 6,107,527 (2000).
Patent Europejski nr EP 0 796 833 B1 (2001),
Patent Chińskii nr 82 412 (2002).
r = (2ek
d
C
i
)
0,5
* k
p
/k
t
0,5
*C
RH
Dane kinetyczne utleniania
izopropylonaftalenów i kumenu
ACHN k
d
=5,24*10
16
exp(-34 500/RT)
r
i
=2eC
i
k
d
, e=0,6
T=100
o
C, C
ACHN
=12,282*10
-3
mol/dm
3
WĘGLOWODÓ
R
r*10
5
[mol/dm
3
s]
k
p
/k
t
0,5
*10
2
[(dm
3
/mol*s)
0
,5
]
2-IPN
7,13
1,11
1-IPN
0,75
0,11
Kumen
10,48
1,36
9
O
OH
OOH
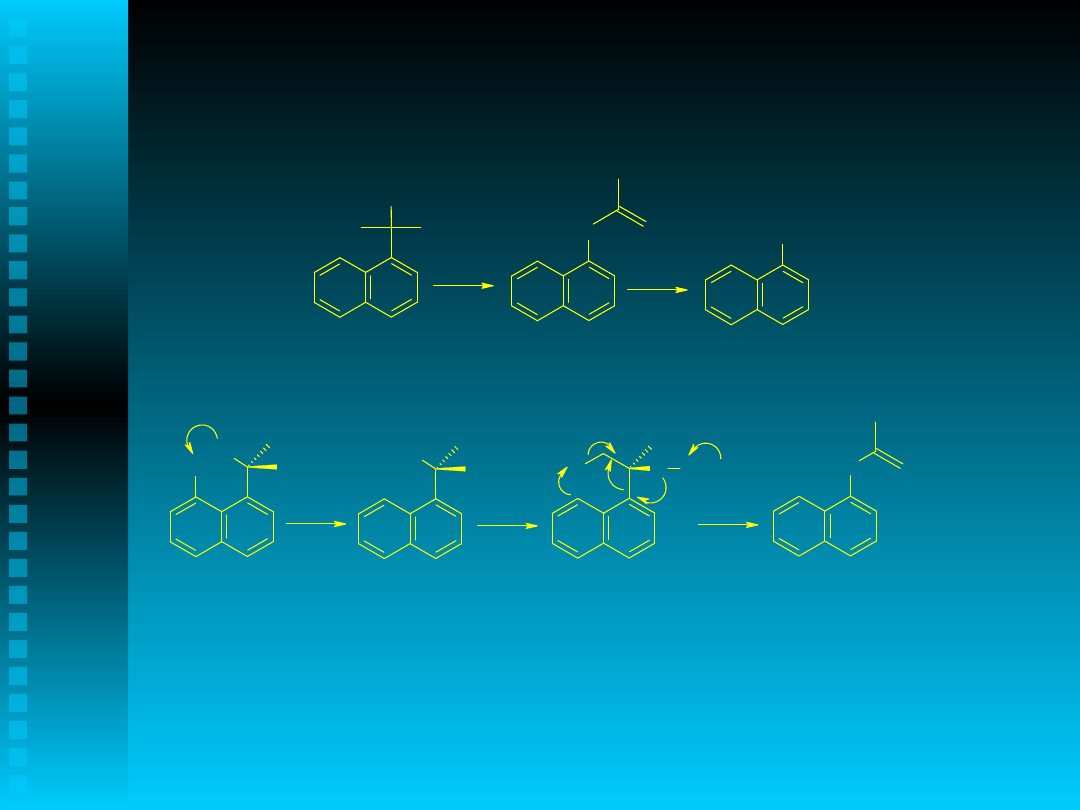
Wyjaśnienie inhibicyjnego działania
wodoronadtlenku 1-metylo-1-(1-naftylo)etylowego
O
H
.
O
H
.
O H
H
.
OR
.
O
+
ROH
10
ISOFR 9 th, Porto-Vecchio, France, 6-11 czerwiec 2004, J.
Zawadiak, B. Orlińska, Z.
Stec, R. Mazurkiewicz „The Effect of 1-Methyl-1-(1-naphthyl)ethyl and 1-Methyl-1-
(2-naphthyl)ethyl Hydroperoxides on the Liquid-Phase Oxidation of Isopropylarenes
with Oxygen“
R. Mazurkiewicz , J. Zawadiak, B. Orlińska, Z. Stec, P. Fiedorow, “The Mechanism of
the Inhibition Effect of 1-Methyl-1-(1-naphthyl)ethyl Hydroperoxide in the Liquidd-
Phase Free-radical oxidation of Isopropylarenes with Oxygen”
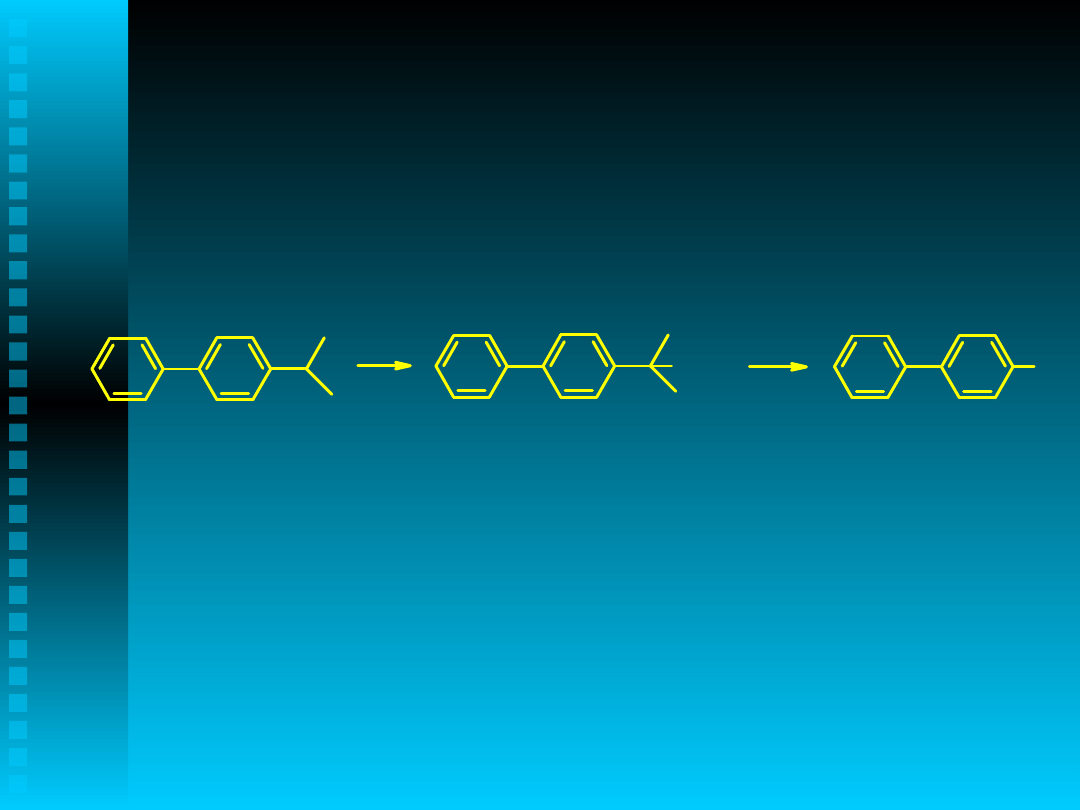
Synteza 4-hydroxybifenylu
Synteza 4-hydroxybifenylu
OOH
HP PBP
PBP
O
2
OH
HBP
H
+
11
Utlenianie 4-izopropylobifenylu
Utlenianie 4-izopropylobifenylu
Inicjator - ACHN
HP PBP
40%
1
2
H
Ar
H
O
2
H
Ar
OOH
OOH
Ar
OOH
O
H
Ar
OOH
O
H
Ar
OH
H
2
O
2
, H
+
O
H
Ar OH
gdzie Ar:
2,6-diizopropylonaftalen → 2,6-
dihydroksynaftalen
4,4’-diizopropylobifenyl → 4,4’-
dihydroksybifenyl
1,3-diizopropylobenzen →
rezorcyna
1,4-diizopropylobenzen →
hydrochinon
Otrzymywanie dihydroksyaromatów
13

Otrzymywanie
dihydroksyaromatów
Hydrochinon-
w 2001 r. ponad 40 tyś. t/r Mitsui (1975 r.
5 tyś. t/rok), Sumitomo (1981 r. 2 tyś. t/rok) Signal Chemical
USA 2,7 tyś. t/rok),
Rezorcyna-
w 2000 46 tyś. t/rok Mitsui (1980 r. 3 tyś.
t/rok), Sumitomo (1981 r. 5 tyś. t/rok),
2,6-Dihydroksynaftalen-
brak produktu na rynku
Rütgers i Mitsui mają produkt w swoich ofertach,
4,4’-Dihydroksybifenyl-
zapotrzebowanie 5 tyś. t/r
cena 6-10 Euro.
14
OH
O
H
OOH
HOO
O
2
H
+
+ 2 CH
3
COCH
3
OOH
OOH
HOO
2,6 DIPN
MHP
DHP
OH
OH
HOO
HHP
O
2
OH
O
H
DH
O
2
O
2
MH
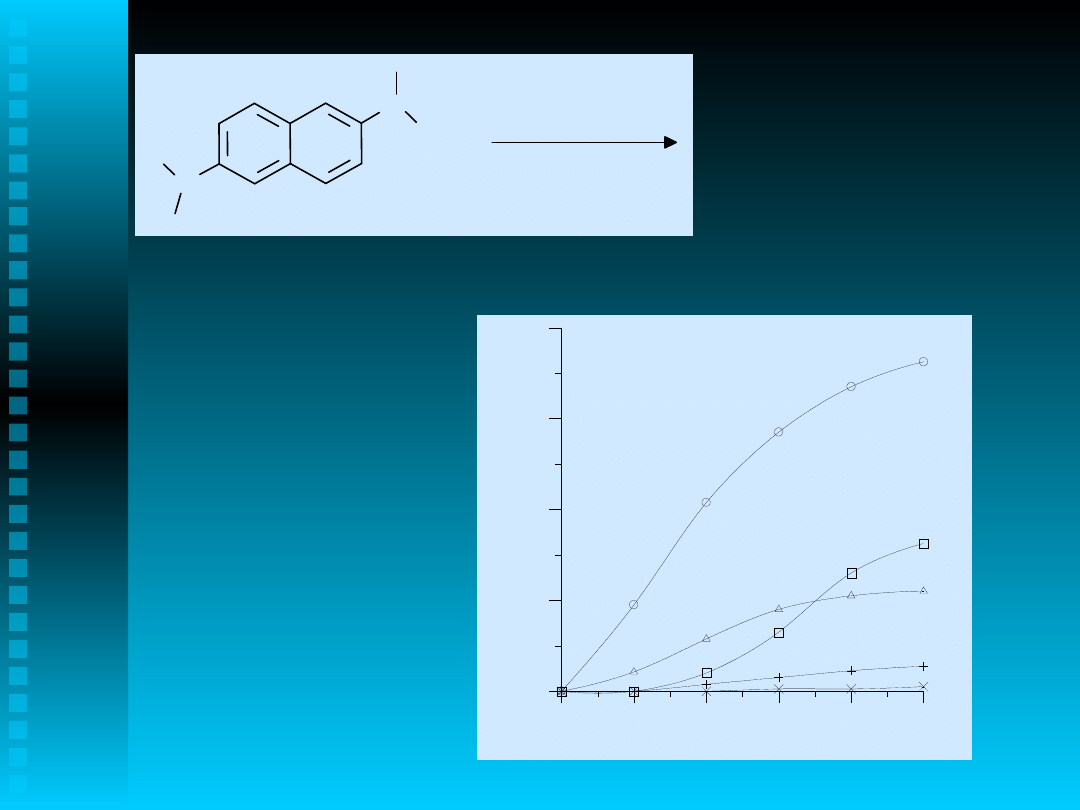
Schemat otrzymywania 2,6-
dihydroksynaftalenu
1
5
R. Mazurkiewicz, Z. Stec, J. Zawadiak, Magn. Reson. Chem., 38, 213-215 (2000)
J. Zawadiak, B. Orlińska, Z. Stec, Fresenius’ J. Anal. Chem., 367, 502-505 (2000)
O2
rozp.
90oC
aq.NaOH
C
H
CH
CH
3
CH
3
C
H
3
C
H
3
2,6DIPN
= 70%
S
MHP
= 54%
S
MH
= 16%
S
DHP
= 21%
S
HHP
= 7%
S
DH
= 0,7%
0
4
8
1 2
1 6
2 0
t [ h ]
0
4
8
1 2
1 6
C
[
%
]
F i g . 4
M H P
D H P
M H
H H P
D H
16
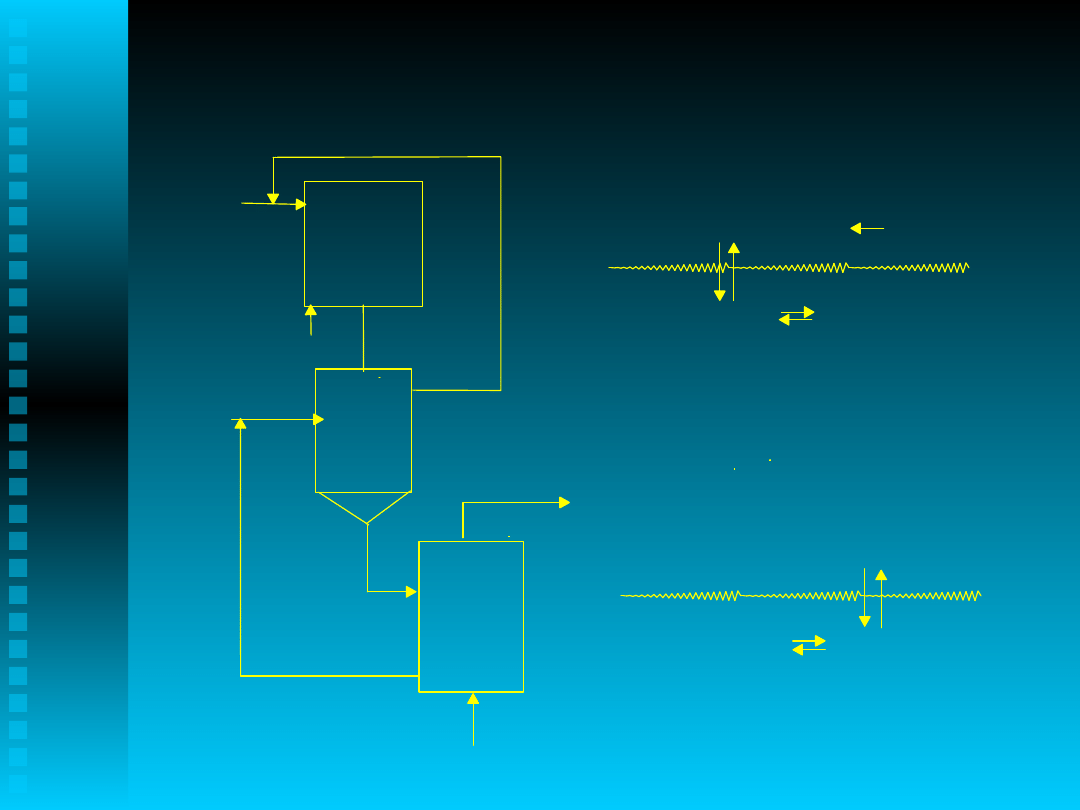
Proces bezciśnieniowy, ~50% konwersja,
wydzielanie przez selektywną ekstrakcję roztworem
ługu
DHP(Na)+ H
2
O
NaOH + DHP
MHP, MH, DHP,HHP, DH
Faza organiczna
Faza wodna
2,6DIPN
O
2
DHP(Na)+ H
2
O
DHP + NaOH
DHP
Faza organiczna
Faza wodna
17
2,6DIPN
Rozpuszczalnik
NaOH
Recykl 2,6DIPN, MHP, MH, HHP, DH
Recykl NaOH
DHP w rozpuszczalniku
Utlenianie
Rozdział
Ekstrakcja
Rozpuszczalnik
O
2
DPBP
HOO
OOH
OOH
O
2
MHP
DHP
O
2
OH
O
H
OOH
MH
HHP
O
2
O
H
OH
DH
18
Z.
Stec, J. Zawadiak, R. Zellerhoff, B. Orlińska, Przemysł Chemiczny, 82 (8-9), 637-639, (2003)
Utlenianie 4,4’-diizopropylobifenylu
Utlenianie 4,4’-diizopropylobifenylu
inicjator - ACHN, T=100
o
C
45% MHP
13% DHP
19

Katalityczne procesy utlenia
Katalityczne procesy utlenia
węglowodorów alkiloaromatycznych z
węglowodorów alkiloaromatycznych z
udziałem soli metali przejściowych i soli
udziałem soli metali przejściowych i soli
amoniowych
amoniowych
CuCl
2
- bromek tetrabutyloamoniowy
20
Sposób katalitycznego utleniania węglowodorów izoalkiloaromatycznych
J. Zawadiak, Z. Stec, U. Knips, R. Zellerhoff, D. Gilner,B. Orlińska, J. Polaczek
Patent Polski PL 182 675 (2002),
Patent USA 5,990,357 (1999),
Patent Europejski EP 0 796 835 B1 (2000).
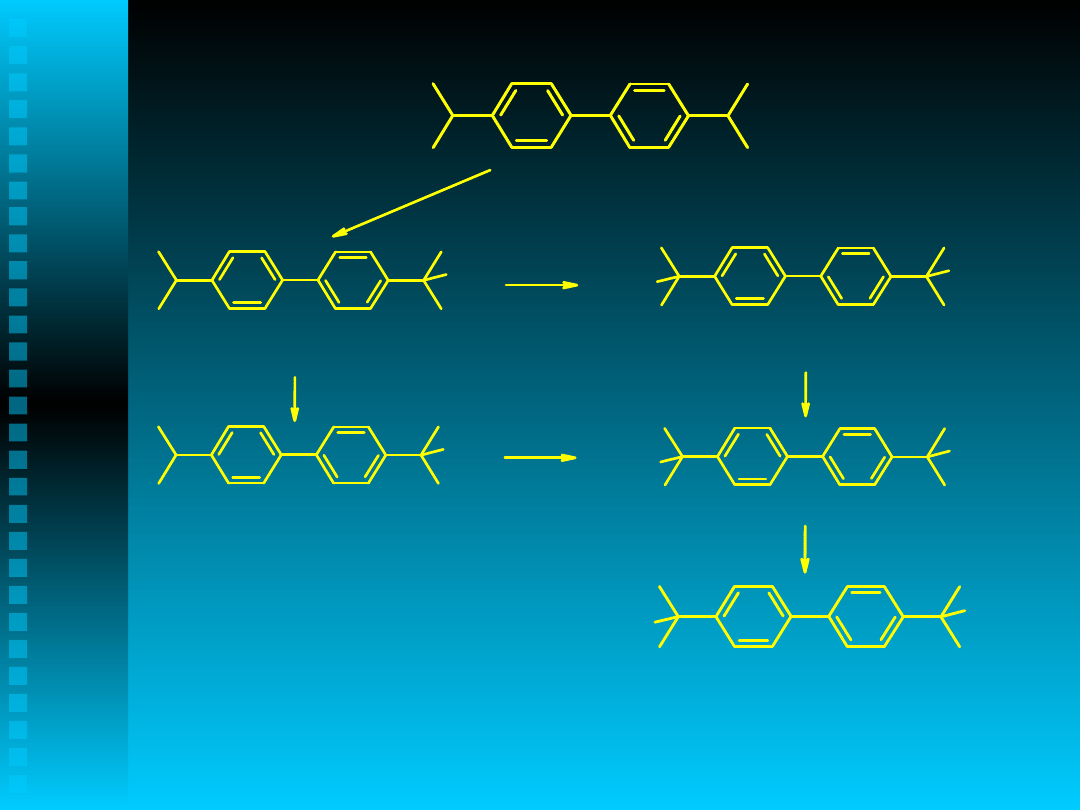
R
O
.
O
R
+ RH
R
OH + R.
+ CH
3
.
- H
2
O
CH
2
R
+ RO.
R
O O R
CH
3
OH
HCHO
HCOOH
Produkty reakcji utleniania
Produkty reakcji utleniania
gdzie R:
O
J. Zawadiak, D. Gilner, Pol. J. Applied Chem., 41,
169-78 (1997)
B. Orlińska, J. Zawadiak, D. Gilner, Applied
Catalysis A: General, 287, 68-74, (2005)
21

Maksymalne stężenia produktów
Maksymalne stężenia produktów
katalitycznego utleniania
katalitycznego utleniania
węglowodorów
węglowodorów
WĘGLOWODÓR NADTLENEK
[%]
ALKOHOL
[%]
KETON
[%]
KUMEN
32
42
60
p-CYMEN
14
39
18
2-IPN
10
36
24
2,6DIPN
34
34
27
Warunki utleniania: czas 3-6h; katalizator CuCl
2
2H
2
O 50-100*10
-3
mol/dm
3
TBAB 1*10
-3
mol/dm
3
; tlen 10 dm
3
/h; temp. 80-110
0
C
22
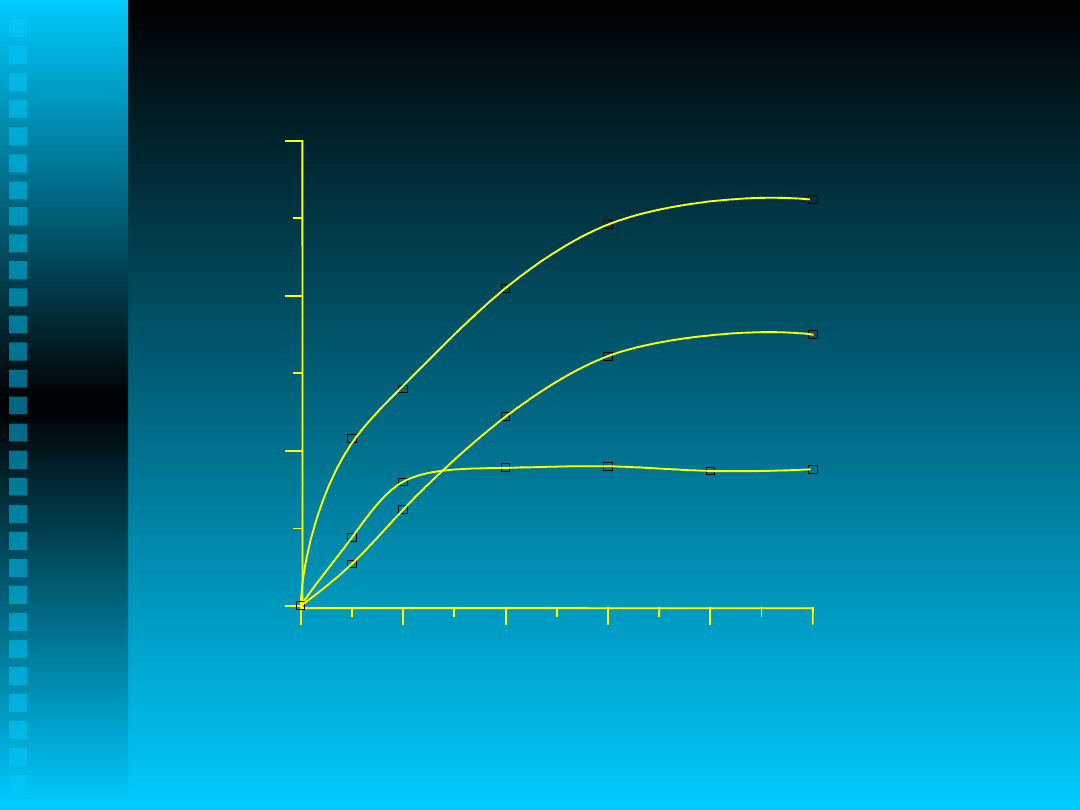
0.00
1.00
2.00
3.00
4.00
5.00
0.00
10.00
20.00
30.00
S
tę
że
n
ie
[%
m
a
s
]
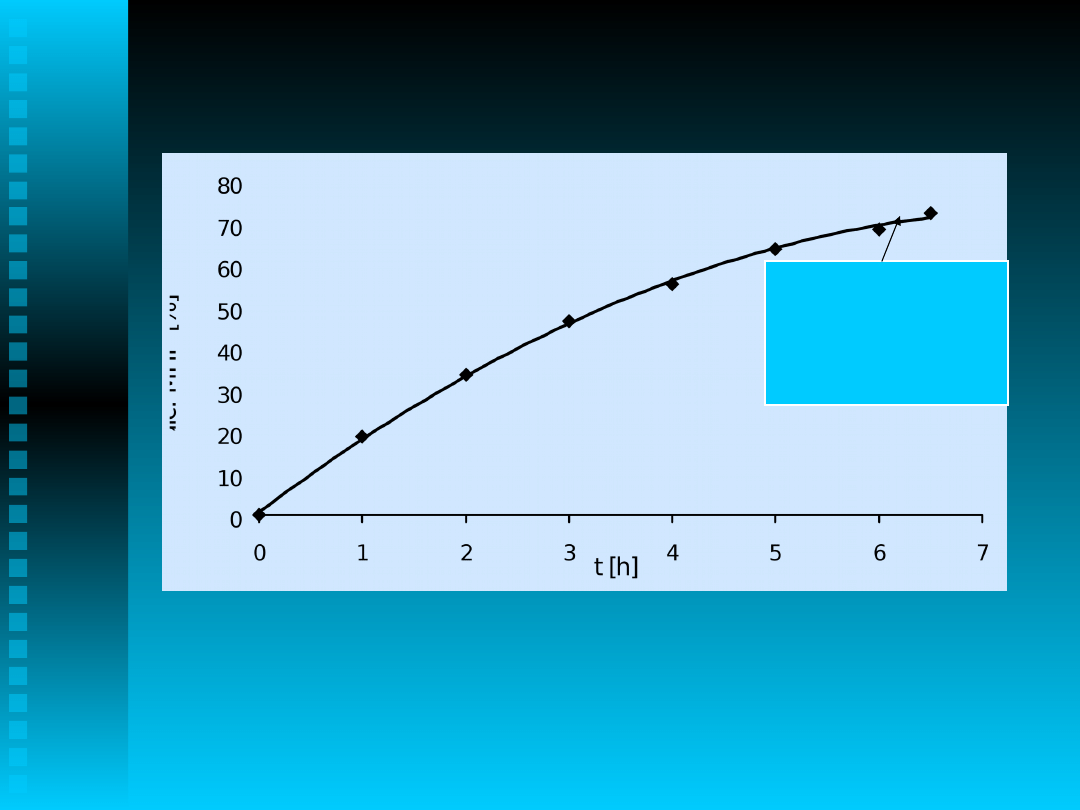
czas [h]
Alkohol
Keton
Nadtlenek
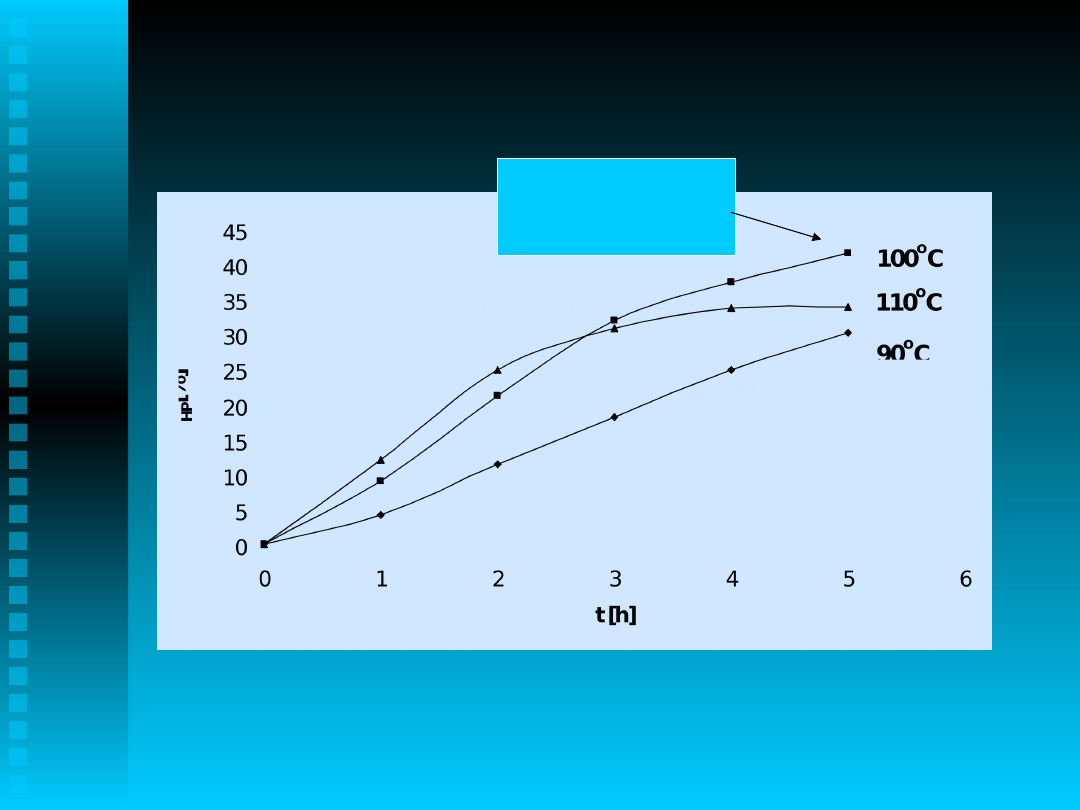
UTLENIANIE 2-IZOPROPYLONAFTALENU
UTLENIANIE 2-IZOPROPYLONAFTALENU
Katalizator- CuCl
2
-
5.26*10
-2
mol/dm
3
, TBAB-
1.085*10
-3
mol/dm
3
, 90
o
C

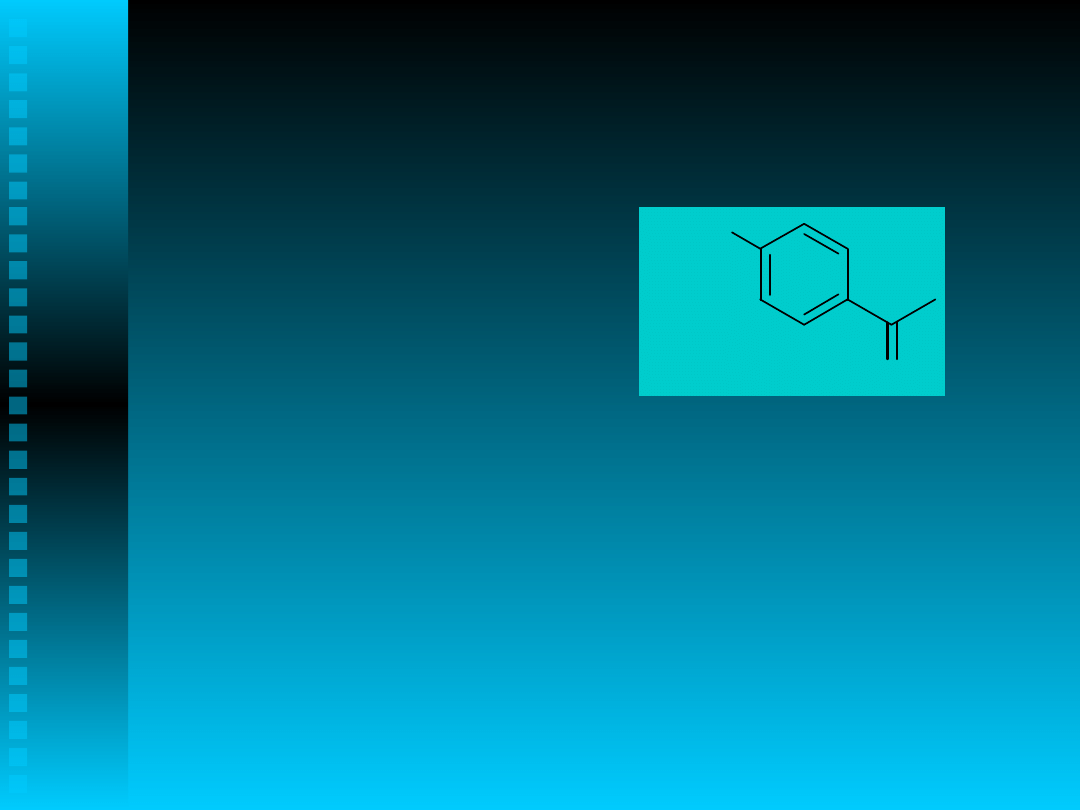
Otrzymywanie
Otrzymywanie
1-(4-metoksyfenylo)etanon
1-(4-metoksyfenylo)etanon
u
u
na drodze katalitycznego utleniania
na drodze katalitycznego utleniania
alkilowych pochodnych metoksybenzenu
alkilowych pochodnych metoksybenzenu
Zastosowanie
Zastosowanie
1-(4-metoksyfenylo)etanon
1-(4-metoksyfenylo)etanon
u
u
•
filtr UV
• składnik kompozycji
zapachowych
• dodatek do żywności
• składnik środków
odstraszających ptaki
• komponent środków
antybakteryjnych i
antygrzybicznych
• półprodukt w syntezie
leków
H
3
CO
O
1,4-
MFE
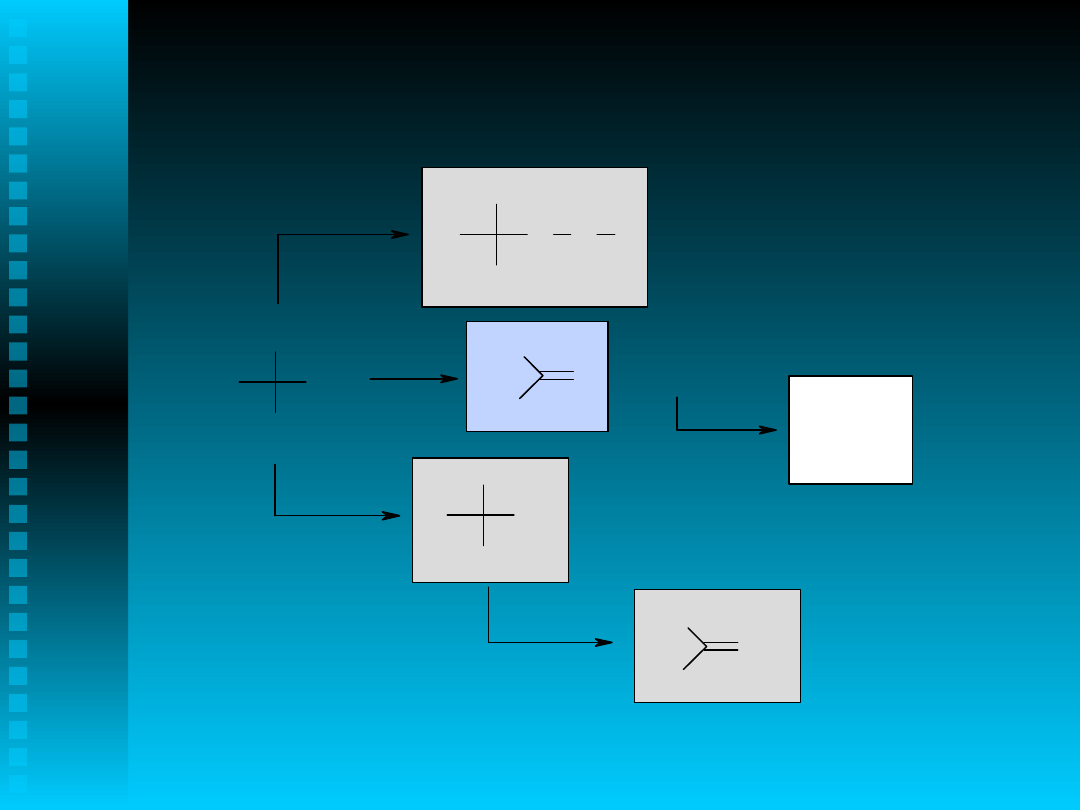
Ar
CH
3
CH
3
O
.
O
C
H
3
Ar
+ RH
Ar
CH
3
CH
3
OH + R.
+ CH
3
.
- H
2
O
CH
2
C
H
3
Ar
+ RO.
Ar
CH
3
CH
3
O O R
CH
3
OH
HCHO
HCOOH
Produkty reakcji utleniania
Produkty reakcji utleniania
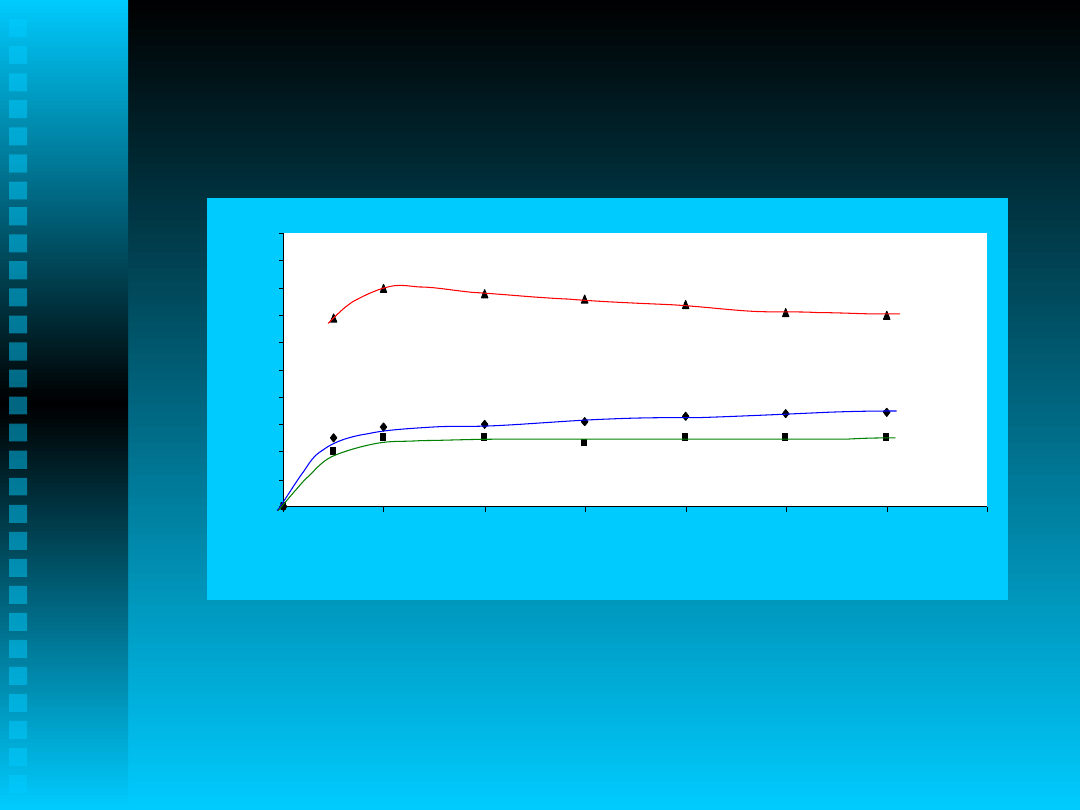
Przebieg reakcji utleniania
Przebieg reakcji utleniania
0
10
20
30
40
50
60
70
80
90
100
0
1
2
3
4
5
6
7
czas [h]
[%
]
Utlenianie 1,4-MiPB (C=6,28 mol/dm
3
) tlenem w 100ºC przez 6h w obecności
CuCl
2
*2H
2
O (C= 6,421*10
-2
mol/dm
3
) i TBAB (C=1,474*10
-3
mol/dm
3
)
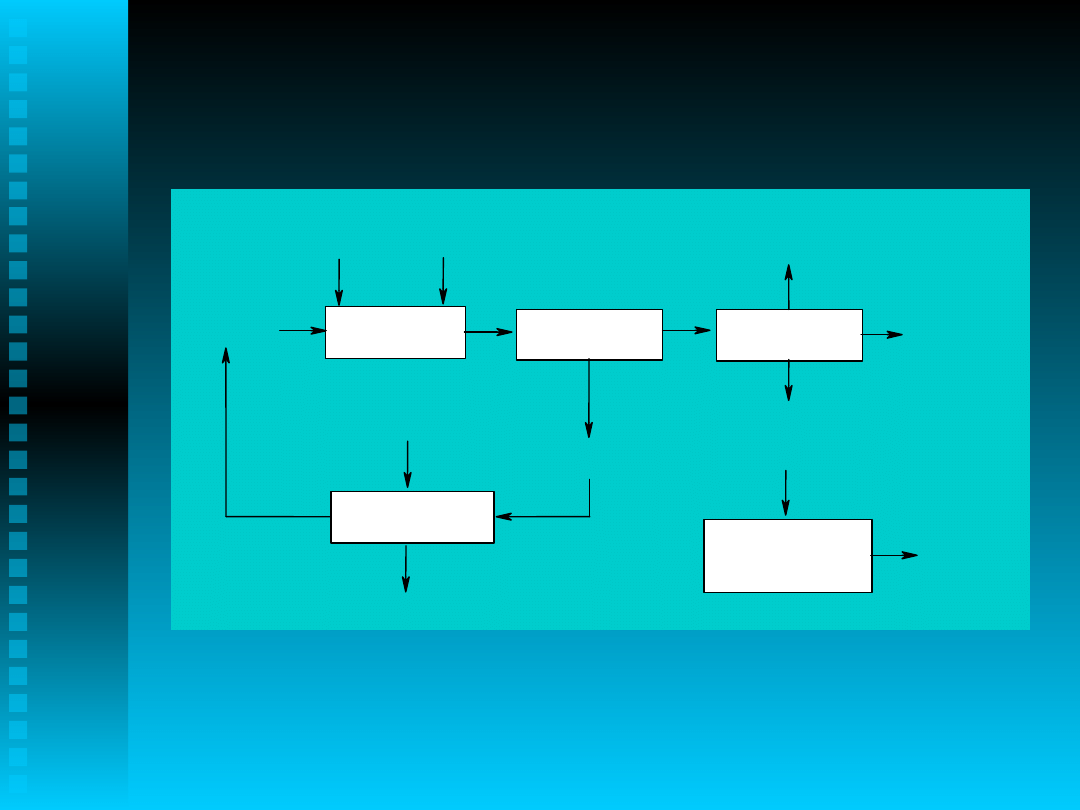
Schemat ideowy
Schemat ideowy
otrzymywania
otrzymywania
1-(4-metoksyfenylo)etanon
1-(4-metoksyfenylo)etanon
u
u
1,4-MiPB
utlenianie
CuCl
2
*2H
2
O
TBAB
O
2
destylacja
przemywanie
20% NaOH
aq
ścieki
1,4-MiPB
1,4-MiPB-2'-en
smoły +
katalizator
surowy
1,4-MFE
krystalizacja
z heksanu
1,4-MFE
destylacja
destylacja
przemywanie
krystalizacja
z heksanu

Katedra Technologii Chemicznej
Organicznej i Petrochemicznej
Zespół:
Zespół:
dr inż. Zbigniew Stec
dr inż. Zbigniew Stec
dr inż.Danuta Gillner
dr inż.Danuta Gillner
dr inż. Beata Orlińska
dr inż. Beata Orlińska
mgr inż. Bartłomiej Jakubowski
mgr inż. Bartłomiej Jakubowski
Prof.
Prof.
Roman Mazurkiewicz
Roman Mazurkiewicz
Instytut Chemii Przemysłowej-dr inż. Jerzy Polaczek
Instytut Chemii Przemysłowej-dr inż. Jerzy Polaczek
Instytut Ciężkiej syntezy Organicznej-mgr inż. Zofia Pokorska
Instytut Ciężkiej syntezy Organicznej-mgr inż. Zofia Pokorska
UAM-Prof.H.Koroniak, dr P.Fiedorow
UAM-Prof.H.Koroniak, dr P.Fiedorow
mgr.inż. Zofia Machowska
mgr.inż. Zofia Machowska

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Nowoczesne procesy utleniania
Podstawy technologii chemicznej nowoczesne procesy utleniania
w8 Procesy utleniania i redukcji
PROCESY UTLENIANIA I REDUKCJI dgfd
Procesy utleniania-utlenianie ksylenów, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technologia C
ćw B Procesy utleniania-utlenianie ksylenów, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technolo
Procesy utleniania i redukcji, LICEUM różne, CHEMIA
PROCESY UTLENIANIA I REDUKCJI 2
PROCESY UTLENIANIA I REDUKCJI
W14S-Procesy utlenienia-redukcji, chemia, szkolka
Staliwa węglowe i konstrukcyjne stopowe, Inżynieria chemiczna i procesowa, Materiało- i maszynoznaws
więcej podobnych podstron