
1
MECHANIZM DZIAŁANIA ROZTWORÓW BUFOROWYCH.
Na zajęciach koła chemicznego postanowiłam poszerzyć i utrwalić wiedzę młodzieży na
temat roztworów buforowych. Zauważyłam, że to zagadnienie sprawia uczniom wiele
trudności. Mają oni problemy z rozwiązywaniem zadań, brakuje im informacji na temat
występowania i zastosowania buforów. Podczas spotkań, wiadomości teoretyczne staraliśmy
się potwierdzić doświadczeniami chemicznymi. Uczniowie sami sporządzili odpowiednie
roztwory buforowe i zbadali ich właściwości. Prócz tego wykonali w programie MS Excel
symulacje komputerowe pozwalające obliczyć pH buforu, pojemność buforową, zmiany pH
buforu i jego pojemności po dodaniu kwasu lub zasady.
1. Skład roztworów buforowych.
Roztwory buforowe, zwane też buforami lub moderatorami odgrywają bardzo ważną rolę
w procesach biochemicznych organizmów roślinnych i zwierzęcych, zapewniając ściśle
określoną kwasowość środowiska, zmienną w bardzo wąskim zakresie.
Bufory mają również znaczenie w chemii analitycznej oraz w wielu procesach
technologicznych np. w fermentacji, w galwanicznych pokryciach metali.
Buforowaniem nazywamy zdolność utrzymywania stałych wartości pH. Roztworem
buforowym jest więc roztwór, którego pH zmienia się w niewielkim stopniu przez
rozcieńczanie lub przez dodatek niewielkich ilości kwasu lub zasady.
Roztwory buforowe są „pierwszą linią obrony” przed zmianą odczynu płynów
ustrojowych, takich jak krew czy płyn rdzeniowo-mózgowy. Tą dużą stałość pH nazywamy
homeostazą. Każde większe odchylenie od podanych wartości fizjologicznych znamionuje
stany patologiczne. Wartość pH krwi różna o 0,3 jednostki od wartości optymalnej jest „nie
do pogodzenia z życiem”.
Roztwory buforowe to najczęściej równomolowe mieszaniny składające się:
a) ze słabego kwasu i soli tego kwasu z mocną zasadą ,
b) ze słabej zasady i soli tej zasady z mocnym kwasem,
c) z dwóch soli o różnej kwasowości.
Według teorii Brönsteda i Lowry’ego buforami są zatem roztwory słabych kwasów
i sprzężonych z nimi zasad albo roztwory słabych zasad i sprzężonych z nimi kwasów.
Przykłady roztworów buforowych:
Kwas Brönsteda
Zasada Brönsteda
CH
3
COOH
CH
3
COO
-
H
2
CO
3
HCO
3
-
H
3
PO
4
H
2
PO
4
-
H
2
PO
4
-
HPO
4
2-
NH
4
+
NH
3
RNH
3
+
RNH
2
Sól aminy
Amina
Kwas – protonodawca
Zasada – protonobiorca
Poza tym stosowane są do różnych celów roztwory buforowe bardziej złożone np.
Na
2
CO
3
+ H
3
BO
3
+ KCl i szereg innych.
Tabela 1

2
2. pH roztworów buforowych.
W buforze typu słaby kwas i jego sól z mocną zasadą, mamy słabo zdysocjowany kwas:
HA + H
2
O H
3
O
+
+ A
-
,
którego stała dysocjacji wyraża się wzorem:
[H
3
O
+
] * [A
-
]
K
k
=
[HA]
Sól natomiast jest oczywiście dobrze zdysocjowana. Obecność tej soli powoduje znaczne
zmniejszenie stopnia dysocjacji słabego kwasu ze względu na wzrost stężenia anionu. Można
wtedy przyjąć, że w stanie równowagi stężenie kwasu [HA] będzie się praktycznie równało
całkowitemu stężeniu kwasu C
k
, a stężenie jego anionu [A
-
] całkowitemu stężeniu dodanej
soli C
s
. Stąd:
[HA] C
k
[H
3
O
+
] = K
k
* = K
k
*
[A
-
] C
s
Po zlogarytmowaniu i pomnożeniu obu stron równania przez –1 otrzymujemy tak zwane
równanie Hendersona-Hasselbacha:
C
k
pH = pK
k
– log
C
s
Podobnie postępuje się w celu wyznaczenia wzoru na pH buforu zbudowanego ze słabej
zasady i soli tej zasady z mocnym kwasem. W efekcie otrzymujemy:
C
z
[OH] = K
z
*
C
k
K
H
2
O
* C
z
[H
3
O
+
] =
K
z
* C
k
C
z
pH = 14 – pK
z
+ log
C
s
1. Wpływ kwasu na pH buforów.
Dodając niewielkie ilości rozcieńczonego kwasu solnego do mieszaniny CH
3
COONa -
CH
3
COOH spowodujemy, że jony H
+
pochodzące z całkowicie zdysocjowanego HCl będą
reagowały z jonami CH
3
COO
-
pochodzącymi z octanu sodu, stanowiącego składnik roztworu
buforowego, przez co powstanie bardzo słabo dysocjujący CH
3
COOH. Pochodzące z HCl
jony H
+
zostały w ten sposób „wyłapane” i nie zmieniło się ich stężenie w roztworze
buforowym.
A
-
+ H
3
O
+
à HA + H
2
O
A- - aniony soli
H
3
O
+
- kationy kwasu
HA – słaby elektrolit.

3
Przykład:
Wyliczenie zmiany pH roztworu buforowego zawierającego 0,1 mola CH
3
COOH i 0,1 mola
CH
3
COONa w 1 dm
3
roztworu po wprowadzeniu do niego 0,01 mola HCl. K
k
= 1,8* 10
-5
.
C
k
pH = pK
k
– log
C
s
pH = 4,74 – log
0,1
pH = 4,74
0,1
CH
3
COO
-
+ HCl à CH
3
COOH + Cl
-
C
k
= 0,1 + 0,01 = 0,11 [mol/dm
3
]
C
s
= 0,1 - 0,01 = 0,09 [mol/dm
3
]
pH = pK – log 0,11/0,09
pH = 4,74 – 0,09
pH = 4,65
Po dodaniu do 1 dm
3
buforu octanowego 0,01 mola HCl pH buforu zmniejszyło się o 0,09
jednostki pH (4,74 – 4,65).
2. Wpływ zasady na pH buforów.
Dodając do buforu octanowego niewielkie ilości NaOH, spowodujemy, że wodorotlenek
sodowy zostanie zobojętniony przez znajdujący się w roztworze kwas octowy i powstanie
octan sodu, który praktycznie nie zmieni wartości pH buforu. W wyniku tego procesu zniknie
pewna ilość CH
3
COOH, ale ponieważ tylko jedna cząsteczka na sto cząsteczek tego kwasu
wnosi jakiś wkład do stężenia jonów wodorowych, wobec tego zniknięcie niewielkich ilości
kwasu octowego nie wpłynie na wartość pH. Dodatek zasady będzie również buforowany
przez roztwór buforowy.
OH
-
+ HA à A
-
+ H
2
O
Z wyliczeń wynika, że po dodaniu 0,01 mola NaOH do roztworu buforowego identycznego
jak poprzednio, pH zwiększy się tylko o 0,09.
3. Wpływ rozcieńczania na pH buforów.
Z równania Hendersona-Hasselbacha wynika, że pH roztworu buforowego nie zmienia się
podczas rozcieńczania, ponieważ rozcieńczenie zmienia stężenie obu składników buforu
w takim samym stosunku. W praktyce laboratoryjnej można przyjąć, że przy niewielkich
zmianach stężeń tj. przy nieznacznym rozcieńczeniu buforu, jego pH nie zmienia się.
4. Wpływ kwasu na pH wody.
Jeżeli do jednego dm
3
wody dodamy 0,01 mola HCl to pH zmienia się o 5 jednostek,
z pH=7 dla wody do pH=2.
5. Pojemność buforowa.
Zdolność buforowania roztworu może być określona za pomocą wielkości zwanej
pojemnością buforową oznaczaną symbolem β. Pojemność buforowa jest to liczba moli
mocnej zasady lub kwasu, która musi być dodana do 1 litra roztworu, aby spowodować
zmianę pH o jednostkę. Pojemność buforowa wyraża się wzorem:
β = ΔB/ΔpH
gdzie: ΔB - dodana ilość mocnej zasady (w molach/litr)
ΔpH – przyrost pH
4
Jeżeli do roztworu buforowego wprowadzono mocny kwas, to we wzorze należy umieścić
znak minus.
Przykład:
Wprowadzenie 0,001 mola HCl do 1 litra buforu amonowego spowodowało obniżenie pH
o 0,01 jednostki. Pojemność buforowa tego roztworu będzie wynosić:
β = -0,001/-0,01 = 0,1 [mol/l]
W miarę zwiększania ilości dodawanego kwasu lub zasady pojemność buforowa
zmniejsza się i staje się równa zeru, ponieważ cała zawarta w buforze sól zmieni się w słaby
kwas lub też cały słaby kwas zostanie przeprowadzony w sól. Największą pojemność
buforową mają roztwory, w których stosunek stężeń soli i kwasu (ewentualnie zasady) jest
równy jedności. Dla takich roztworów pH = pK
k
lub pH = pK
z
, gdzie K
k
lub K
z
oznacza
odpowiednio stałą dysocjacji słabego kwasu lub słabej zasady.
Pojemność buforowa jest równa 1 wówczas, gdy dodanie 1 mola kwasu (zasady) do 1 litra
roztworu buforowego spowoduje zmianę pH tego roztworu o jedną jednostkę.
Pojemność buforowa zależy również od stężenia roztworu buforowanego. Im większe jest
stężenie buforu, tym większa jest jego pojemność buforowa. Wynika to ze wzoru van Slyke’a:
K
k
* [H
3
O
+
]
β = 2,303 * C *
(K
k
+ [H
3
O
+
])
2
gdzie: K
k
– stała dysocjacji kwasu
C – ogólne stężenie buforu (C = [HA] + [A
-
])
Dla danego stężenia C maksymalna wartość pojemności buforowej (przy pH = pK
k
)
wyraża się więc uproszczonym wzorem:
β = 0,58 * C
Rozcieńczenie buforów jest niekorzystne. Nie wpływa na pH, ale zmniejsza ich
pojemność.
Zmiana pH wody i roztworów buforowych
Woda
Bufor octanowy
C
k
=0,1mol/dm
3
Cs=0,1mol/dm
3
Bufor amonowy
Cz=0,1mol/dm
3
Cs=0,1mol/dm
3
pH początkowe
pH = 7
pH = 4,74
pH = 9,26
pH po dodaniu 0,01
mola HCl na 1 dm
3
roztworu
pH = 2
Ck+0,01
pH = pK – log
Cs-0,01
pH = 4,65
Cz-0,01
pH=14-pK+log
Cs+0,01
pH = 9,17
Zmiana pH
ΔpH = 7-2 = 5
ΔpH = 4,74 - 4,65=0,09
ΔpH = 9,26-9,17=0,09
Równanie reakcji
HClàH
+
+ Cl
-
CH
3
COONa+HCl=CH
3
COOH+NaCl
NH
4
OH+HCl=NH
4
Cl+H
2
O
pH po dodaniu 0,01
mola NaOH na
1 dm
3
roztworu
pH = 12
Ck-0,01
pH = pK – log
Cs+0,01
pH = 4,83
Cz+0,01
pH=14-pK+log
Cs-0,01
pH = 9,36
Zmiana pH
ΔpH = 7-12 = -5
ΔpH = 4,74 - 4,83 =-0,09
ΔpH = 9,26-9,35=-0,09
Równanie reakcji
NaOHàNa
+
+OH
-
CH
3
COOH+NaOH=CH
3
COONa+H
2
O
NH
4
Cl+NaOH=NH
4
OH+NaCl
Tabela 2
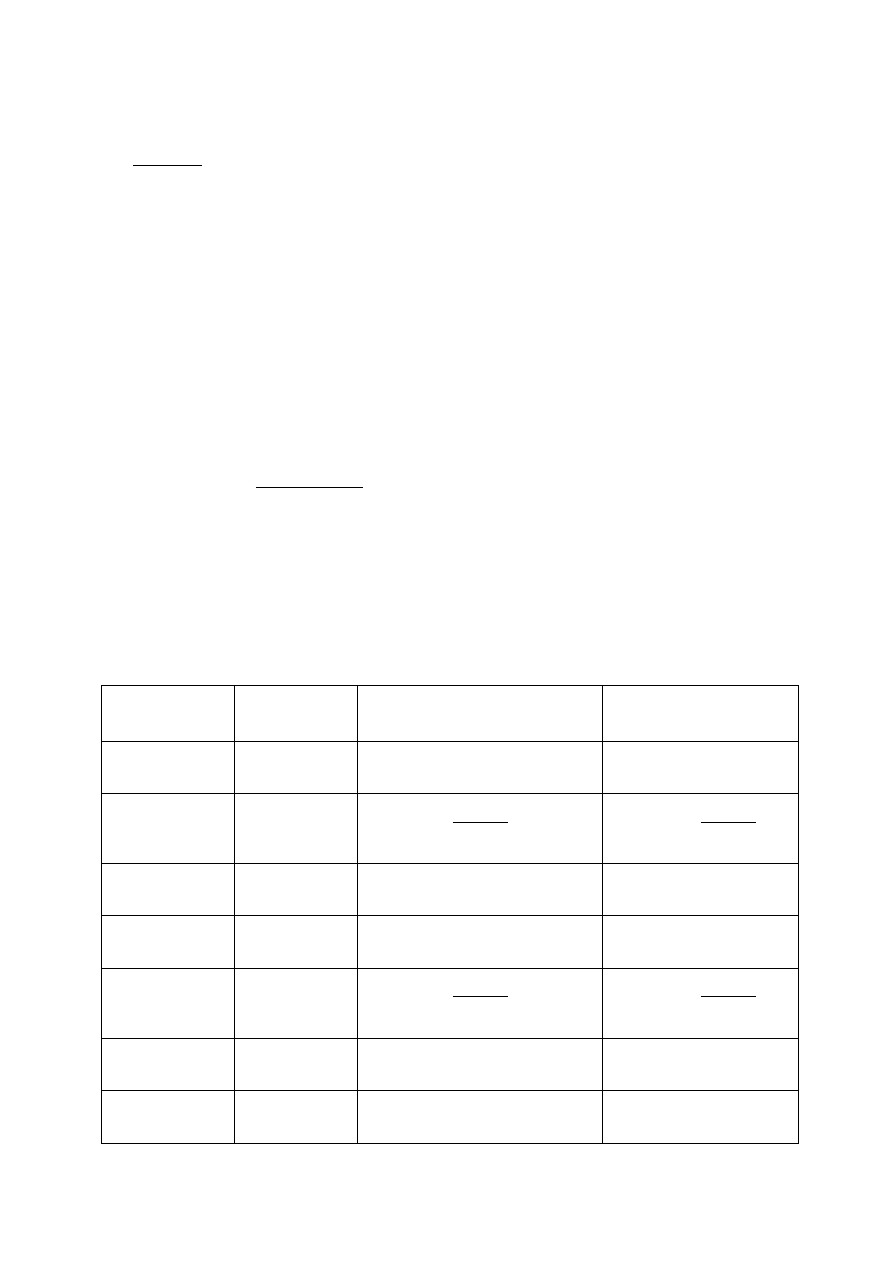
5
Zale
żność pH buforu octanowego od ilości dodanego kwasu - symulacja
C
HCl
=
0,25 mol/dm
3
C
k
=
0,1 mol/dm
3
C
s
=
0,1 mol/dm
3
V
p
=
20 cm
3
pH
p=
4,74
pK
kw
=
4,74
lp
V
k
n
k
V
b
n
k/l=
c
k'=
c
s'
c
s
-c
s
'
V
k/l
pH
pH
p
-pH
pojemno
ść
[cm
3
] [mol]
[cm
3
]
[mol/dm
3
]
[mol/dm
3
] [cm
3
]
[mol/dm
3
]
1
1
0,0003
21
0,0119
0,0881
50 4,636 0,104
0,115
2
2
0,0005
22
0,0227
0,0773
100 4,539 0,201
0,113
3
3
0,0008
23
0,0326
0,0674
150 4,446 0,294
0,111
4
4
0,0010
24
0,0417
0,0583
200 4,355 0,385
0,108
5
5
0,0013
25
0,0500
0,0500
250 4,263 0,477
0,105
6
6
0,0015
26
0,0577
0,0423
300 4,169 0,571
0,101
7
7
0,0018
27
0,0648
0,0352
350 4,069 0,671
0,097
8
8
0,0020
28
0,0714
0,0286
400 3,962 0,778
0,092
9
9
0,0023
29
0,0776
0,0224
450 3,841 0,899
0,086
10
10
0,0025
30
0,0833
0,0167
500 3,699 1,041
0,080
11
11
0,0028
31
0,0887
0,0113
550 3,517 1,223
0,073
12
12
0,0030
32
0,0938
0,0063
600 3,249 1,491
0,063
13
13
0,0033
33
0,0985
0,0015
650 2,623 2,117
0,047
14
14
0,0035
34
0,1029
-0,0029 700 2,531 2,209
0,047
15
15
0,0038
35
0,1071
-0,0071 750 2,146 2,594
0,041
16
16
0,0040
36
0,1111
-0,0111 800 1,954 2,786
0,040
17
17
0,0043
37
0,1149
-0,0149 850 1,828 2,912
0,039
Tabela 3
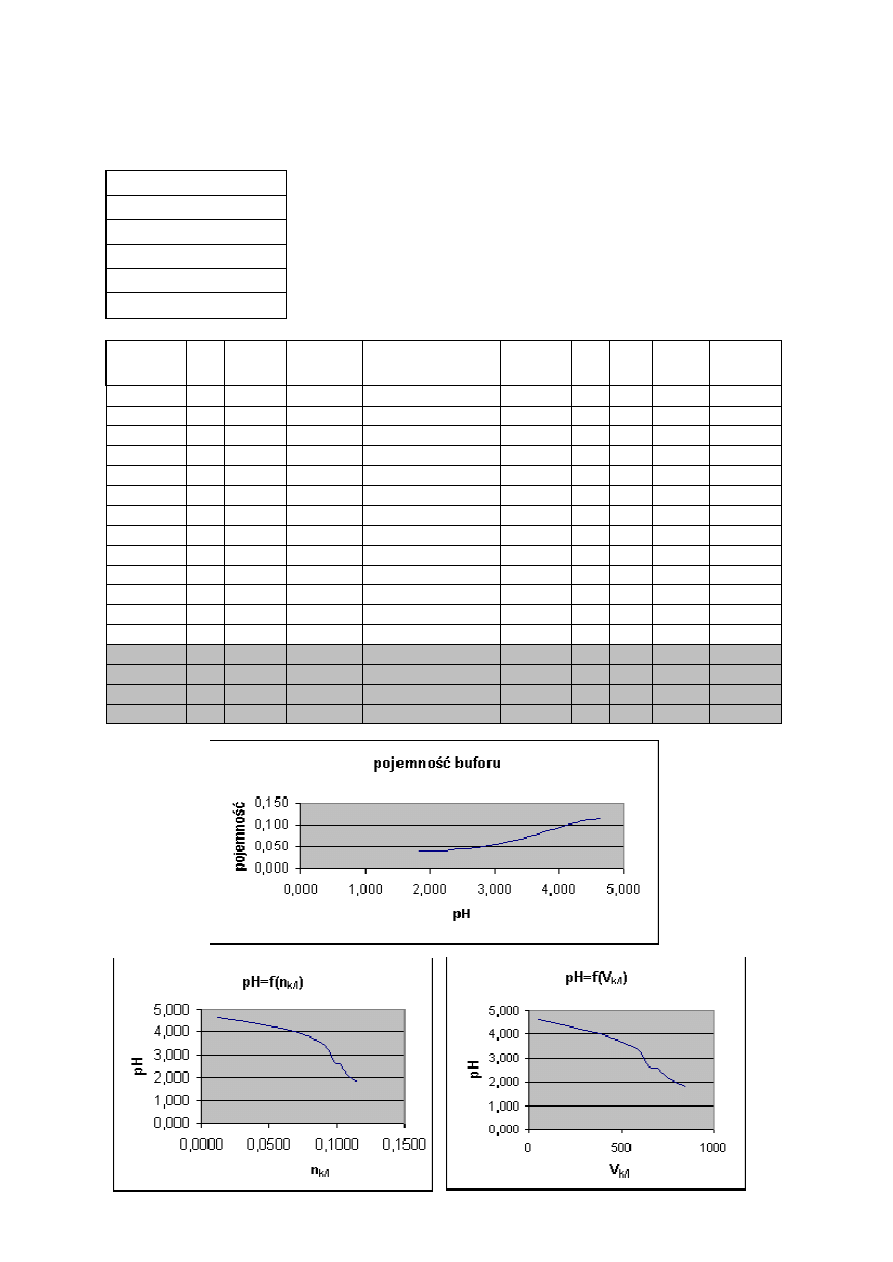
6
Zale
żność pH buforu octanowego od ilości dodanej zasady - symulacja
C
NaOH
=
0,25
mol/dm
3
C
k
=
0,1
mol/dm
3
C
s
=
0,1
mol/dm
3
V
p
=
20
cm
3
pH
p
=
4,74
pK
kw
=
4,74
lp
V
z
n
z
V
b
n
z/l=
c
k'=
c
s'
c
k
-c
k'
V
z/l
pH
pH-pH
p
pojemno
ść
[cm
3
] [mol]
[cm
3
] [mol/dm
3
]
[mol/dm
3
]
[cm
3
]
[mol/dm
3
]
1
1
0,0003
21
0,0119
0,0881
50
4,844
0,104
0,115
2
2
0,0005
22
0,0227
0,0773
100
4,941
0,201
0,113
3
3
0,0008
23
0,0326
0,0674
150
5,034
0,294
0,111
4
4
0,0010
24
0,0417
0,0583
200
5,125
0,385
0,108
5
5
0,0013
25
0,0500
0,0500
250
5,217
0,477
0,105
6
6
0,0015
26
0,0577
0,0423
300
5,311
0,571
0,101
7
7
0,0018
27
0,0648
0,0352
350
5,411
0,671
0,097
8
8
0,0020
28
0,0714
0,0286
400
5,518
0,778
0,092
9
9
0,0023
29
0,0776
0,0224
450
5,639
0,899
0,086
10
10
0,0025
30
0,0833
0,0167
500
5,781
1,041
0,080
11
11
0,0028
31
0,0887
0,0113
550
5,963
1,223
0,073
12
12
0,0030
32
0,0938
0,0063
600
6,231
1,491
0,063
13
13
0,0033
33
0,0985
0,0015
650
6,857
2,117
0,047
14
14
0,0035
34
0,1029
-0,0029
700
11,469
6,729
0,015
15
15
0,0038
35
0,1071
-0,0071
750
11,854
7,114
0,015
16
16
0,0040
36
0,1111
-0,0111
800
12,046
7,306
0,015
17
17
0,0043
37
0,1149
-0,0149
850
12,172
7,432
0,015
18
18
0,0045
38
0,1184
-0,0184
900
12,265
7,525
0,016
Tabela 4

7
7. Występowanie buforów w organizmie człowieka.
1) Układy buforowe krwi.
We krwi działają jednocześnie trzy układy buforowe.
1. Kwas węglowy i wodorowęglan
2. Kwas fosforowy i wodorofosforan
3. Białka i aniony białek.
Krew spełnia główną rolę w wydalaniu jonów wodorowych. Wytworzony w tkankach
CO
2
nie zakwasza osocza krwi dzięki buforującemu działaniu układu hemoglobinowego
HbO
2
/HHb.
Hemoglobina usuwa wolne jony wodorowe powstałe w reakcji:
CO
2
+ H
2
O à H
3
O
+
+ HCO
3
-
tworząc sprotonowaną hemoglobinę, uwalniając równoważną liczbę moli HCO
3
-
.
H
3
O
+
+Hb
-
HHb + H
2
O
H
3
O
+
+HbO
2
-
HHb + H
2
O +O
2
Reakcje te zachodzą w krwinkach czerwonych. Niewielkie ilości jonów wodorowych,
jakie powstają w skutek rozpuszczenia CO
2
w osoczu są z dostateczną wydajnością
buforowane przez układ białczanowy osocza, białko
-
/białko-H.
H
3
O
+
+ białko
-
à białko-H + H
2
O
W osoczu najbardziej podstawowe znaczenie ma układ wodorowęglanowy HCO
3
-
/ CO
2
stanowiący 72% całej pojemności buforowej krwi. Ośrodek oddechowy reguluje w tym
buforze ciśnienie cząstkowe CO
2
, a nerka stężenie zasady [HCO
3
-
]. Wiązanie lub oddawanie
jonów wodorowych obniża pojemność buforową danego układu, dlatego istnieje potrzeba
regeneracji zużywających się układów buforowych. Proces ten zachodzi w nerkach i płucach,
a w warunkach chorobowych także w układzie kostnym i pokarmowym.
Wpływ herbaty z cytryną na organizm człowieka.
Picie herbaty zakwaszonej cytryną powoduje przyspieszenie oddechu, a w rezultacie
sapanie. Cechą charakterystyczną wszystkich organizmów żywych jest zdolność
utrzymywania odczynu płynów ustrojowych bez zmiany. Od tego zależy w decydującym
stopniu normalna praca organizmu. Układy buforowe reagują natychmiast na wszelkie
zmiany odczynu i wyrównują pH. Krew ludzka zdrowego organizmu ma stałe pH = 7,35.
Składnikiem buforującym jest między innymi kwaśny węglan sodowy. Jeśli nastąpi nagły
dopływ substancji zakwaszających do krwi, zachodzi ich szybka reakcja z wodorowęglanem
sodowym, przy czym wydziela się wolny dwutlenek węgla.
RCOOH + NaHCO
3
RCOONa + H
2
O +
CO
2
Centra oddechowe reagują natychmiast na zakwaszenie krwi wydalając przez szybki
oddech nadmiar dwutlenku węgla.
2) Układ buforowy kości.
Kości magazynują dużą ilość zasad, które w razie potrzeby mogą wiązać nadmiar jonów
wodorowych. W procesie osteogenezy powstaje hydroksyapatyt zawierający dodatkowo
pewną ilość węglanów i cytrynianów, które z powodu powierzchniowego umiejscowienia
w kościach ulegają łatwo wymianie i mogą być użyte do wiązania jonów wodorowych.

8
CZĘŚĆ DOŚWIADCZALNA
Doświadczenie 1
Wyznaczanie pojemności buforu octanowego.
Aparatura i przyrządy:
Zlewki o pojemności 250 cm
3
Pipety o pojemności 25 cm
3
Pehametr cyfrowy typu Cp215
Elektroda szklana
Odczynniki:
Bufor octanowy (0,2-molowy CH
3
COOH i 0,2-molowy CH
3
COONa)
Roztwór 0,25-molowy HCl
Roztwór 0,25-molowy NaOH
Wykonanie:
Sporządzić 40 cm
3
roztworu buforu octanowego, w którym stężenia CH
3
COOH
i CH
3
COONa są równe i wynoszą 0,1 mol/dm
3
. (Zmieszać po 20 cm
3
0,2 – molowego
CH
3
COOH i 0,2 – molowego CH
3
COONa). Podzielić sporządzony roztwór na dwie równe
porcje. Otrzymany roztwór powinien mieć pH = 4,74 (jeżeli wskazania pehametru różnią się
od powyższej wartości, należy ustawić pehametr na wartość 4,74).
I Do jednej porcji buforu (20 cm
3
) dodać 1 cm
3
0,25 – molowego roztworu HCl
i zmierzyć pH roztworu. Powtórzyć tę czynność piętnastokrotnie mierząc pH roztworu po
dodaniu każdej następnej porcji (po 1 cm
3
).
Obserwacje:
Dodanie do buforu octanowego porcjami po 1 cm
3
roztworu HCl powoduje, że pH buforu
początkowo zmniejsza się nieznacznie od 4,74 do 3,65, a potem coraz bardziej do pH =2.
Wnioski:
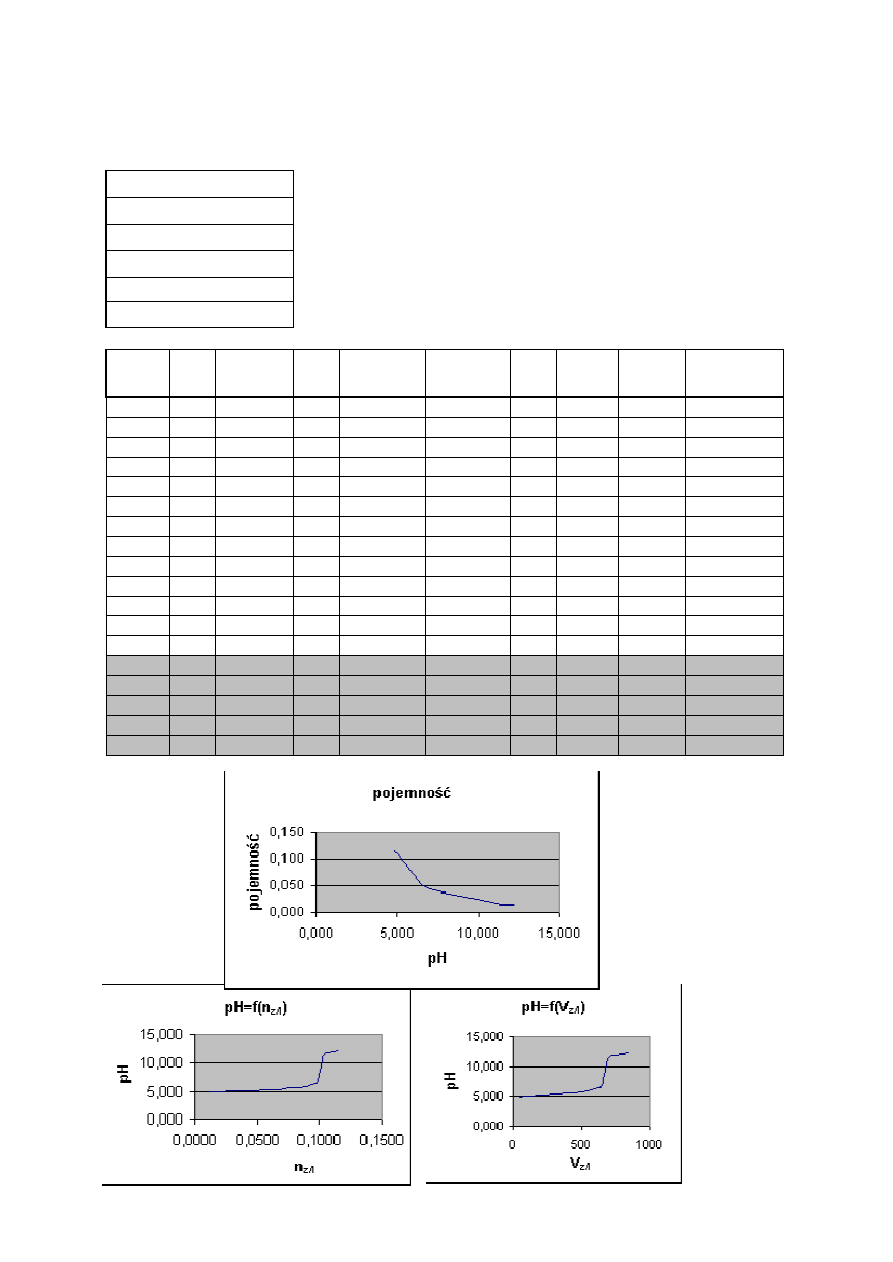
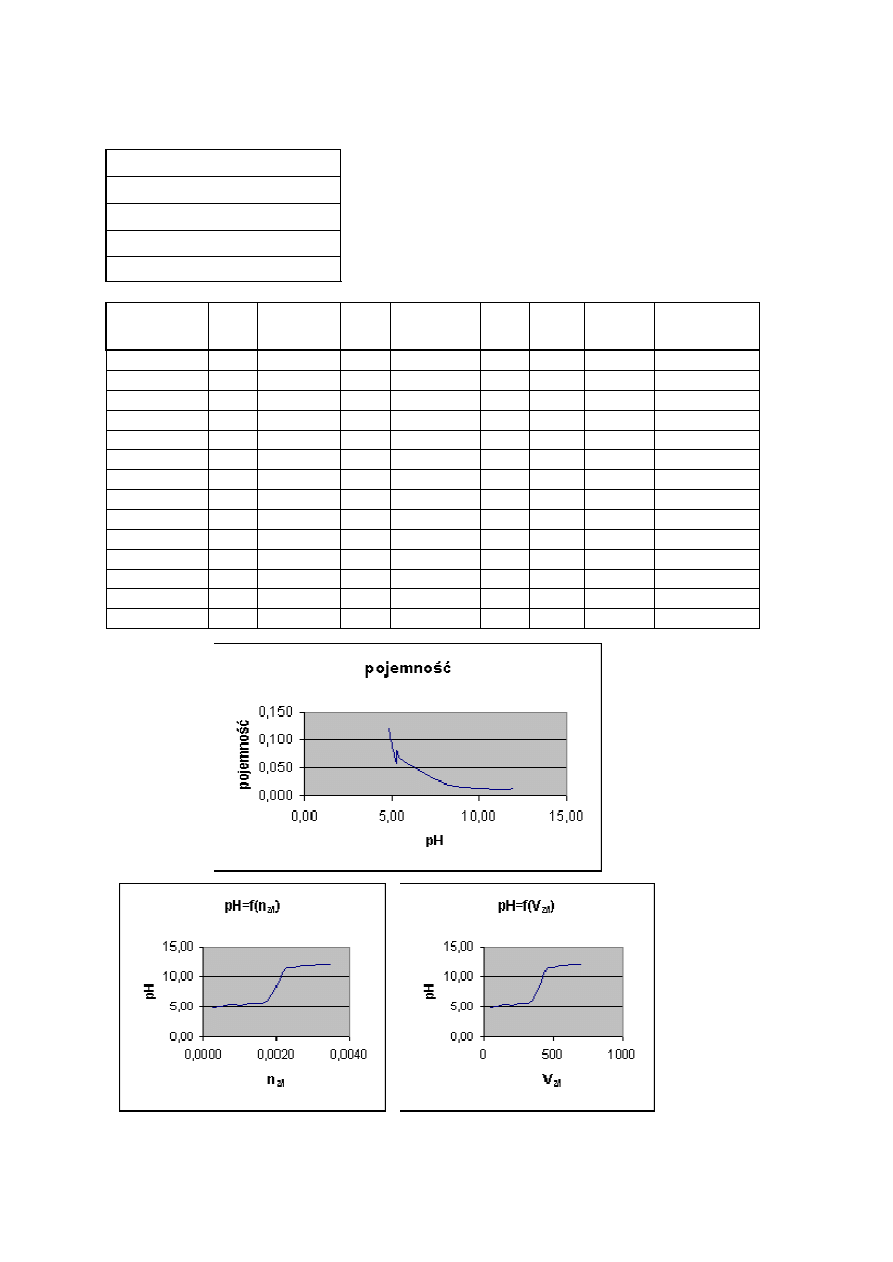
Przy nadmiarze mocnego kwasu cała sól zostaje zobojętniona, a na pH ma wpływ tylko
mocny kwas. Początkowa pojemność buforu β = 0,119 maleje stopniowo w miarę dodawania
kwasu. Wyznaczona pojemność, jak i pomiary pH są zbliżone do wartości obliczonych
teoretycznie.
II Do drugiej porcji buforu (20 cm
3
) dodać 1 cm
3
0,25-molowego roztworu NaOH
i zmierzyć pH podobnie jak w pierwszej części doświadczenia.
Obserwacje:
Wyniki umieszczone są w tabeli 3
Wnioski:
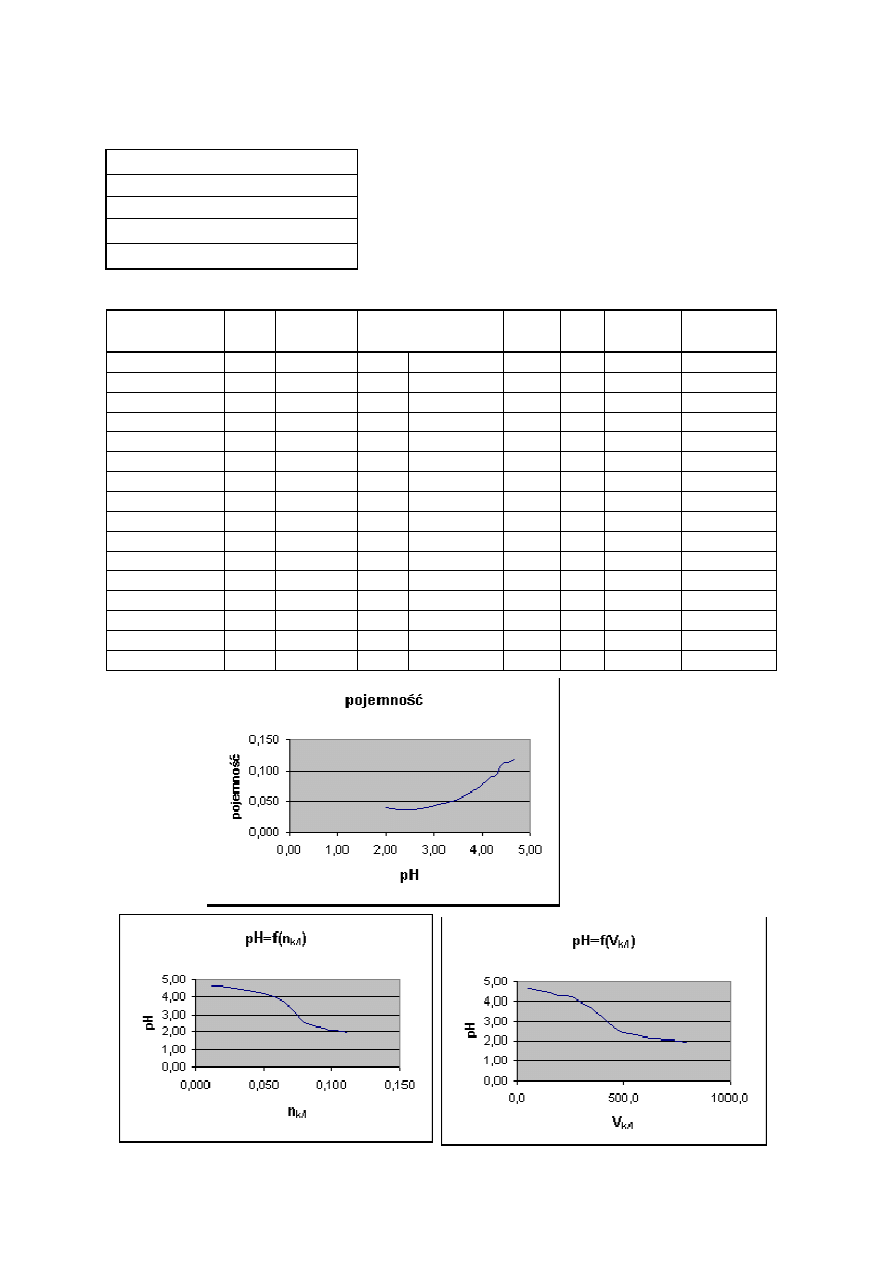
Dodanie do buforu octanowego porcjami roztworu NaOH powoduje, że pH roztworu
początkowo zmienia się nieznacznie, a po dodaniu większej ilości zasady wartość pH rośnie
do około 12. Oznacza to, że gdy cały kwas został zobojętniony na pH ma wpływ dodawana
mocna zasada. Największą wartość ma pojemność buforowa gdy stosunek stężenia zasady do
stężenia soli jest zbliżony do 1. Im więcej ten stosunek jest mniejszy od jedności tym bardziej
pojemność maleje. Wyniki doświadczenia są zbliżone do obliczeń teoretycznych.
9
Zale
żność pH buforu octanowego od ilości dodanego kwasu - wyniki doświadczalne
C
HCl
=
0,25 mol/dm
3
Ck=
0,1 mol/dm
3
Cs=
0,1 mol/dm
3
V
p
=
20 cm
3
pH
p
=
4,74
lp
V
k
n
k
V
b
n
k/l=
c
k'=
c
s'
V
k/l
pH
pH
p
-pH
pojemno
ść
[cm
3
]
[mol]
[cm
3
]
[mol/dm
3
]
[cm
3
]
[mol/dm
3
]
1
1
0,00025
21,0
0,012
50,0
4,64
0,10
0,119
2
2
0,00050
22,0
0,023
100,0 4,54
0,20
0,114
3
3
0,00075
23,0
0,033
150,0 4,45
0,29
0,112
4
4
0,00100
24,0
0,042
200,0 4,29
0,45
0,093
5
5
0,00125
25,0
0,050
250,0 4,19
0,55
0,091
6
6
0,00150
26,0
0,058
300,0 3,96
0,78
0,074
7
7
0,00175
27,0
0,065
350,0 3,65
1,09
0,059
8
8
0,00200
28,0
0,071
400,0 3,22
1,52
0,047
9
9
0,00225
29,0
0,078
450,0 2,72
2,02
0,038
10
10
0,00250
30,0
0,083
500,0 2,43
2,31
0,036
11
11
0,00275
31,0
0,089
550,0 2,29
2,45
0,036
12
12
0,00300
32,0
0,094
600,0
2,2
2,54
0,037
13
13
0,00325
33,0
0,098
650,0 2,12
2,62
0,038
14
14
0,00350
34,0
0,103
700,0 2,08
2,66
0,039
15
15
0,00375
35,0
0,107
750,0 2,03
2,71
0,040
16
16
0,00400
36,0
0,111
800,0 1,97
2,77
0,040
Tabela 5
10
Zale
żność pH buforu octanowego od ilości dodanej zasady - wyniki doświadczalne
C
NaOH
=
0,25
mol/dm
3
C
k
=
0,1
mol/dm
3
C
s
=
0,1
mol/dm
3
V
p
=
20
cm
3
pH
p
=
4,74
lp
V
z
n
z
V
b
n
z/l=
c
k'=
c
s'
V
z/l
pH
pH-pH
p
pojemno
ść
[cm
3
] [mol]
[cm
3
] [mol/dm
3
]
[cm
3
]
[mol/dm
3
]
1
1
0,0003
21
0,012
50
4,84
0,10
0,119
2
2
0,0005
22
0,023
100
4,97
0,23
0,099
3
3
0,0008
23
0,033
150
5,30
0,56
0,058
4
4
0,0010
24
0,042
200
5,25
0,51
0,082
5
5
0,0013
25
0,050
250
5,47
0,73
0,068
6
6
0,0015
26
0,058
300
5,64
0,90
0,064
7
7
0,0018
27
0,065
350
5,86
1,12
0,058
8
8
0,0020
28
0,071
400
8,27
3,53
0,020
9
9
0,0023
29
0,078
450
11,34
6,60
0,012
10
10
0,0025
30
0,083
500
11,55
6,81
0,012
11
11
0,0028
31
0,089
550
11,80
7,06
0,013
12
12
0,0030
32
0,094
600
11,91
7,17
0,013
13
13
0,0033
33
0,098
650
11,95
7,21
0,014
14
14
0,0035
34
0,103
700
11,99
7,25
0,014
Tabela 6

11
Doświadczenie 2
Wpływ rozcieńczania na pH buforu.
Aparatura i przyrządy:
Zlewki o pojemności 250 cm
3
Pipety o pojemności 25 cm
3
Pehametr cyfrowy typu Cp215
Elektroda szklana
Odczynniki:
Bufor octanowy o pH = 3,72
Woda destylowana
Wykonanie:
Sprawdzić doświadczalnie, jak będzie się zmieniało pH buforu octanowego po 2-, 5-, 10-,
20- i 100-krotnym rozcieńczaniu.
Obserwacje:
n-krotne rozcieńczanie
pH buforu
ΔpH = (pH
o
– pH)
2
5
10
20
100
3,74
3,75
3,81
3,90
4,07
+0,02
+0,03
+0,09
+0,18
+0,35
Wniosek:
Rozcieńczanie roztworu buforowego w zasadzie nie wpływa na jego wartość pH.
Doświadczenie 3
Wpływ zmiany stosunku stężeń kwasu i soli na pH roztworów buforowych.
Aparatura i przyrządy:
Probówki
pipety o pojemności 10 cm
3
.
Odczynniki:
CH
3
COOH o stężeniu 1 mol/dm
3
CH
3
COONa o stężeniu 1 mol/dm
3
Czerwień metylowa
Oranż metylowy
Bufor o pH = 4
Bufor o pH = 6
Wykonanie:
a) Do 1 cm
3
1–molowego roztworu kwasu octowego dodać 2,5 cm
3
1–molowego
roztworu octanu sodu, dobrze wymieszać i dodać dwie krople czerwieni metylowej.
Porównać barwę badanego roztworu z barwą „skali”. „Skalę” sporządza się dodając
po dwie krople wskaźnika, czerwieni metylowej i osobno oranżu metylowego do
wcześniej przygotowanych roztworów buforowych o pH = 4 i pH = 6. Do
sporządzenia „skali” używać po około 0,5 cm
3
roztworu buforu.
b) Sporządzić octanowy roztwór buforowy o innym stosunku stężeń kwasu i soli niż
w punkcie a. W tym celu zmieszać 0,5 cm
3
1–molowego roztworu CH
3
COONa z 2,5
cm
3
1–molowego roztworu CH
3
COONH. Roztwór dokładnie wymieszać, dodać 2
krople oranżu metylowego i oznaczyć pH mieszaniny porównując jej barwę
z roztworami „skali” o pH = 4 i pH = 6.
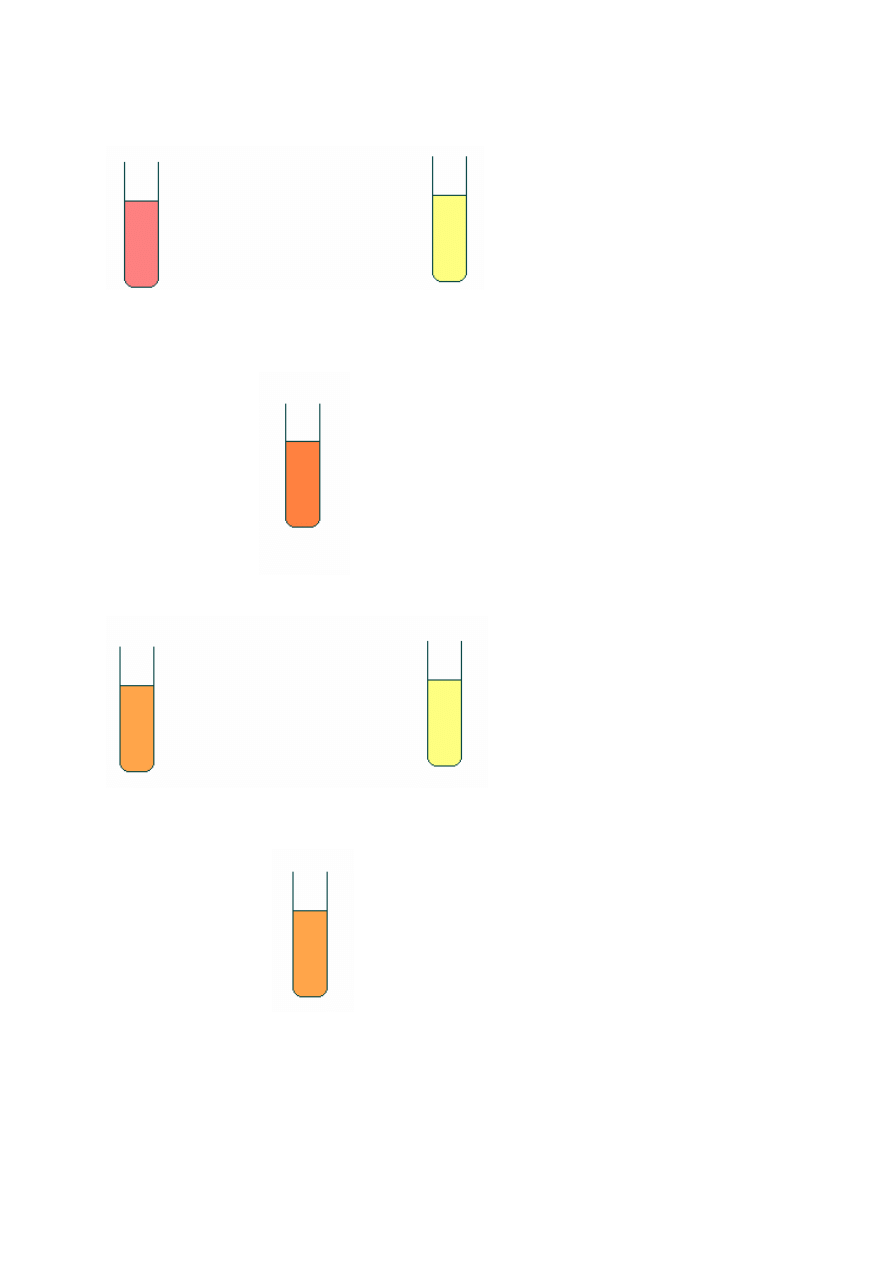
12
Skala
bufor o pH = 4 bufor o pH = 6
+ czerwień metylowa + czerwień metylowa
Roztwór badany
C
k
/C
s
= 1/2,5 pH ~5
Skala
bufor o pH = 4 bufor o pH = 6
+oranż metylowy +oranż metylowy
Ck/Cs = 1/ 0,2 pH ~ 4
Wniosek:
Stosunek stężeń kwasu do soli w roztworze buforowym ma wpływ na pH roztworu
buforowego. Większe stężenie kwasu powoduje zmniejszenie pH roztworu buforowego.

13
PODSUMOWANIE
Roztwory buforowe odgrywają dużą rolę zarówno w przyrodzie jak i w praktyce
chemicznej. Wiele procesów przebiega w sposób optymalny przy określonej wartości pH.
Gdy w procesach takich powstają kwasy lub zasady, muszą one być w układzie buforowym
„wychwycone”.
W procesach przemiany materii powstają nieprzerwanie duże ilości kwasów, np. kwasu
węglowego i mlekowego, a także zasad. Buforujące działanie płynów ustrojowych zapobiega
niebezpiecznym dla organizmu zmianom pH.
Cechą charakteryzującą roztwory buforowe jest ich pojemność, która mówi, ile można
dodać do buforu moli kwasu lub zasady, aby zmienić wartość pH o jednostkę. Największą
pojemność wykazują roztwory buforowe składające się z równomolowych ilości kwasu i
sprzężonej z nim zasady.
Rozcieńczanie buforu praktycznie nie wpływa na zmianę jego pH. Rozcieńczanie zmienia
stężenie obydwu składników buforu w takim samym stosunku. Zmniejszeniu ulega jednak
pojemność buforowa. Właściwości roztworów buforowych wykorzystuje się podczas
wytrącania osadów. Bufory powodują utrzymanie odpowiedniego pH roztworu, uzyskanie
całkowitego wytrącenia osadu, uzyskanie w ogóle osadu.
Stosunek stężeń składników buforu ma istotny wpływ na jego pH.
Sporządzone roztwory buforowe wykorzystane zostały do kalibrowania pehametru. Dzięki
temu można było wykorzystać to urządzenie do przeprowadzenia alkacymetrycznego
miareczkowania Coca-coli i do badania buforów. Wyniki przeprowadzonych doświadczeń
były bardzo zbliżone do sporządzonych w MS Excel symulacji komputerowych.
Dzięki poszerzeniu wiedzy teoretycznej, zajęciom laboratoryjnym i pracy z arkuszem
kalkulacyjnym, młodzież z większym zrozumieniem zaczęła podchodzić do zagadnienia
buforów. Zebrane informacje znalazły zastosowanie na lekcjach chemii podczas obliczeń
chemicznych lub doświadczeń i na lekcjach biologii.
LITERATURA
1. „Chemia dla studentów medycyny”, Klaus Beyermann, PZWL, Warszawa 1983.
2. „Chemia i życie”, Jerzy Stobiński, Instytut Wydawniczy Nasza Księgarnia 1974.
3. „Aparatura kontrolno-pomiarowa w przemyśle chemicznym” Praca zbiorowa.
WSiP, Warszawa 1993.
4. „Pracownia chemiczna. Analiza jakościowa”, Szczęsny, Rosołowski, WSiP
Warszawa 1997.
Opracowała:
mgr inż. Renata Gawron
Częstochowa 2005 rok
Wyszukiwarka
Podobne podstrony:
bufory 2 id 95044 Nieznany (2)
prezentacja bufory id 391506 Nieznany
cw 6 bufory lek id 122079 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron