
1
Literatura:
Minczewski J., Marczenko Z.: Chemia analityczna. T.1. Podstawy teoretyczne i analiza jakościowa. Wyd. 10. PWN, Warszawa 2009
Kocjan R.: Chemia analityczna. Analiza jakościowa. Analiza klasyczna; tom 1, Wyd.1 PZWL, Warszawa, 2000.
Skrypt do ćwiczeń z chemii ogólnej, nieorganicznej i analitycznej, Białystok 2010, pod redakcją E. Skrzydlewskiej.
Szmal Z., Lipiec T.: Chemia analityczna z elementami analizy instrumentalnej. Wyd. VII poprawione i unowocześnione PZWL, Warszawa, 1997.
Celem ćwiczenia jest opanowanie wiedzy i umiejętności praktycznych analizy systematycznej mieszaniny kationów grup I - V.
Zakres materiału obowiązującego na ćwiczenie:
Umiejętność zapisywania równań reakcji chemicznych charakterystycznych dla kationów grup I - V i reakcji rozpuszczania trudno rozpuszczalnych
osadów powstałych w wyniku w/w reakcji w dobrze rozpuszczalne sole. Umiejętność uzasadnienia przeprowadzenia analizy rozdzielenia dowolnej
mieszaniny kationów grup I-V wraz z wyjaśnieniem kolejności przeprowadzanych postępowań oraz ze znajomością równań reakcji chemicznych i efektów
zachodzących reakcji. Znajomość obliczeń chemicznych – pH słabych elektrolitów.
Zagadnienia z wykładów poprzedzających ćwiczenie.
I. Część wprowadzająca
Wiadomości teoretyczne dotyczące ćwiczeń 3-6
.
Ćwiczenie 7
Rozdzielanie mieszaniny kationów I- V grupy analitycznej
2
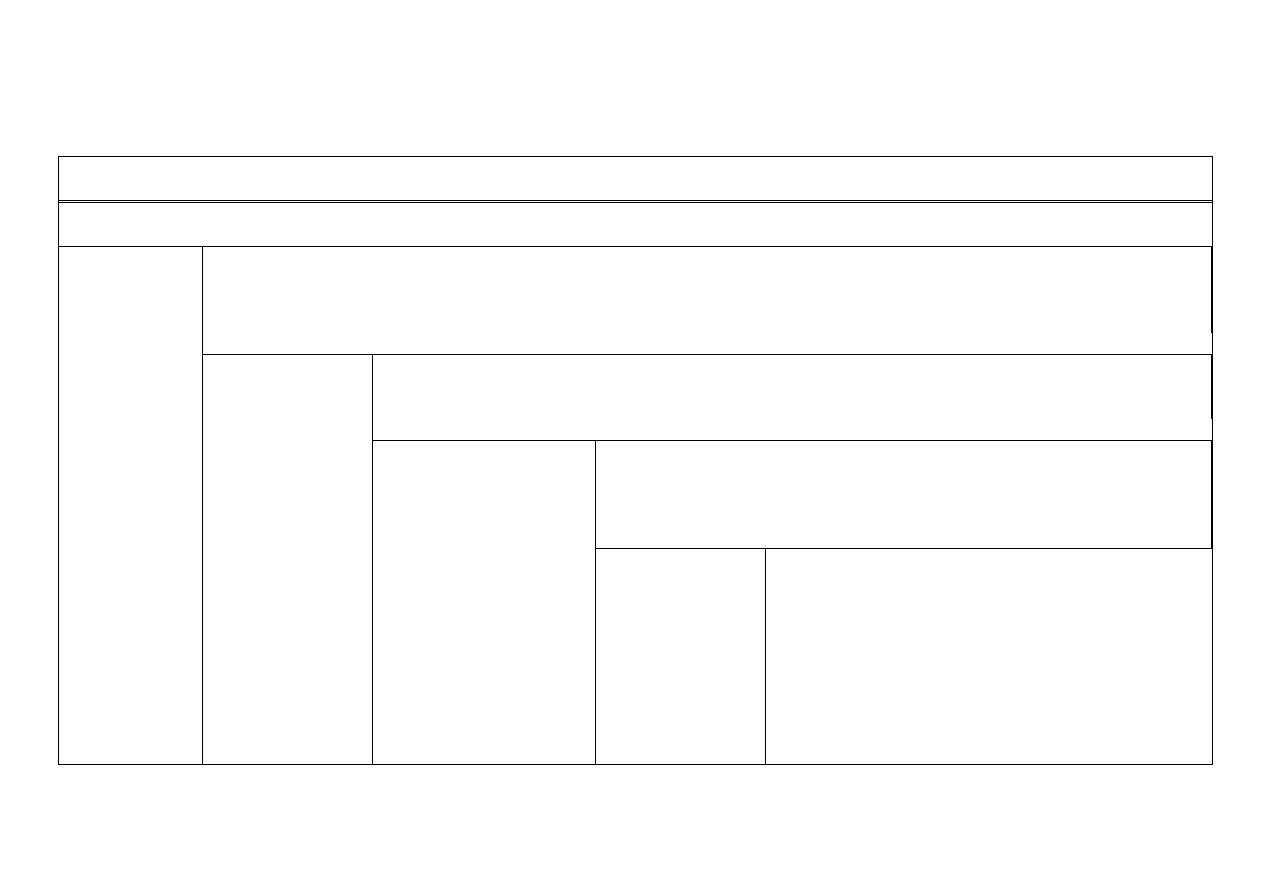
II. Część doświadczalna
Rozdzielanie mieszaniny kationów I-V grupy analitycznej
Próby wstępne na obecność kationów: Fe
2+
, Fe
3+
, NH
4
+
5 ml roztworu zawierającego kationy grup I – V zadaje się 2M HCl do całkowitego wytrącania osadu i ogrzewa; po oziębieniu otrzymany osad 1 odsącza się i
przemywa wodą zakwaszoną kilkoma kroplami HCl
Osad 1 chlorków
kationów I grupy
- patrz tabela
rozdzielania
kationów I grupy
Przesącz 1 zawierający kationy grup II – V oraz nadmiar HCl zobojętnia się amoniakiem (aż do wystąpienia słabego zmętnienia),
zakwasza się kilkoma kroplami stężonego HCl do odczynu kwaśnego (sprawdzić papierkiem uniwersalnym). Ogrzewa do wrzenia i zadaje
tioacetamidem, aż do osiągnięcia całkowitego wytrącenia. Otrzymany osad 2 odsącza się i przemywa wodą z dodatkiem tioacetamidu i
NH
4
Cl
Osad 2 siarczków
kationów II grupy -
patrz tabela
rozdzielania kationów
Przesącz 2 zawierający kationy grup III – V oraz nadmiar H
2
S i HCl gotuje się do ulotnienia H
2
S, odsącza
wytrąconą siarkę, zobojętnia stęż. amoniakiem, dodaje 2M NH
4
Cl, ogrzewa do wrzenia i dodaje (NH
4
)
2
S do
całkowitego wytrącenia osadu. Osad 3 odsącza się i przemywa wodą z (NH
4
)
2
S i 2M NH
4
Cl
II grupy
Osad 3 siarczków i
wodorotlenków kationów III
grupy - patrz tabela
rozdzielania kationów III
grupy
Przesącz 3 zawierający kationy grup IV i V oraz nadmiar (NH
4
)
2
S i NH
4
Cl
zakwasza się stężonym CH
3
COOH, gotuje się aż do całkowitego ulotnienia się H
2
S,
odsącza wytrąconą siarkę, Roztwór alkalizuje się NH
3
aq., dodaje NH
4
Cl, ogrzewa
do wrzenia i zadaje (NH
4
)
2
CO
3
. Wytrącony osad 4 przemywa się wrzącą wodą.
Część przesączu bada się na obecność Mg
2+
Osad 4 węglanów
kationów IV grupy
rozpuszcza się w
gorącym roztworze
2M CH
3
COOH i
wykonuje reakcje
różnicujące kationy
IV grupy
Przesącz 4 przenieść do parowniczki, odparować do sucha,
a następnie prażyć do całkowitego rozkładu soli
amonowych (do zaniku białych dymów). Pozostałość
rozpuścić w 2 ml wody z dodatkiem 0,5 ml 2M HCl. W
razie obecności Mg
2+
do roztworu dodaje się 0,2M
Ba(OH)
2
. Powstający osad Mg(OH)
2
odsącza się, a
przesącz odparowuje do sucha, pozostałość zwilża 2M
H
2
SO
4
i odparowuje jego nadmiar, dodaje się gorącej wody.
Odsączyć, osad BaSO
4
– odrzucić. Przesącz bada się na
obecność kationów Na
+
, K
+
3
Uwagi do rozdzielania mieszaniny pięciu grup kationów
Przed przystąpieniem do systematycznej analizy mieszaniny kationów należy wykonać pewne
czynności wstępne, które w wielu przypadkach umożliwią wyciągnięcie wniosków co do obecności bądź
braku określonych jonów.
1. Odczyn próbki, np. jeśli jest kwaśny, może świadczyć o obecności większości kationów grup I-III lub
jonów Mg
2+
, NH
4
w obecności anionów pochodzących od mocnych kwasów.
2. Rozcieńczenie próbki wodą może w pewnych przypadkach [Bi(III), Sb(III), Sb(V), Sn(II), Sn(IV)]
spowodować zmętnienie roztworu na skutek powstania okso- lub hydroksosoli.
3. Barwa próbki może zasugerować obecność niektórych kationów, jak np.
Cu(II)
niebieski,
Ni(II)
zielony,
Co(II)
różowy,
Cr(III)
od zielonego poprzez niebieskozielony do fioletowego,
Fe(III)
brunatny w różnych odcieniach,
Fe(II)
bladozielony.
4. Barwa płomienia palnika po wprowadzeniu na pręciku platynowym badanego roztworu może świadczyć
o obecności takich jonów, jak np.
Na
+
płomień intensywnie żółty,
K
+
różowofioletowy (zaleca się obserwację płomienia przez szkło kobaltowe
celem wyeliminowania wpływu innych kationów),
Cu
2+
trawiastozielony,
Ca
2+
ceglastoczerwony,
Sr
2+
karminowoczerwony,
Ba
2+
żółtozielony (w przypadku kationów grupy IV nie należy poprzestawać na
tej próbie, ale również wykonać odpowiednie reakcje chemiczne
zamieszczone w poniższym schemacie, gdyż próba ta nie jest
jednoznaczna).
5. Jon amonu -
NH
4
- stwierdza się jego obecność przed systematyczną analizą, gdyż w jej trakcie jest
często wprowadzany do próbki.
Wykonanie: próbkę badaną zalkalizować mocna zasadą, ogrzać, trzymając u wylotu wilgotny papierek
uniwersalny wskaźnikowy (nie dotykać papierkiem ścianki probówki). Niebieskie
zabarwienie świadczy o obecności jonów NH
4
Wyszukiwarka
Podobne podstrony:
Analiza kationow i anionow
Sprawozdanie analiza kationów
analiza kationów gr IV i V
2545 Analiza kationów
Analiza kationow i anionow wersja 2
Chemia Ogólna i Nieorganiczna 2015 Analiza kationów
analiza kationów III gr (2)
analiza kationow 2 id 60685 Nieznany
Analiza kationow i anionow wersja 2
Analiza kationów reakcje
analiza kationow i anionow mate Nieznany
analiza kationów II gr (2)
ANALIZA KATIONÓW I,II,III GRUPY ANALITYCZNEJ
ANALIZA KATIONÓW IV i V GRUPY ANALITYCZNEJ, Studia, Chemia
Analiza kationow i anionow
analiza kationów
labka - analiza kationów, AGH, I semestr
Analiza kationów na przykładzie V grupy
Analiza kationów sprawozdanie, UP Wrocław, IŚ I SEM, Chemia
więcej podobnych podstron