
1
POLITECHNIKA POZNAŃSKA
WYDZIAŁ
TECHNOLOGII
CHEMICZNEJ
PRACA ZALICZENIOWA
Przedmiot: Chromatografia procesowa
Metody chromatograficzne w kontroli składu i jakości żywności
S tud ent :
N ata lia Gun ia ( 952 88)
Da ria Jac ko ws ka ( 9529 2)
Agn ie s zk a Kr zy żko ws ka (95312 )
J oanna L ew andow s ka ( 95320 )
Marta Martyła (95327)
Kierunek studiów:
T e chno logi a Ch emi czn a
Specjalność:
T e chno logi a Organ icz na
Prowadzący:
prof. dr hab. inż. A. Voelkel
Poznań 2014

2
Spis treści:
Wstęp…………………………………………………………………………………
4
1. Analiza żywności i jej znaczenie…………………………………………………..
5
2. Wykorzystanie chromatografii w kontroli podstawowych składników
odżywczych zawartych w pożywieniu………………………………………………..
8
2.1. Sacharydy (cukry)………………………………………………………
8
2.2. Białka i aminokwasy……………………………………………………
12
2.3. Lipidy…………………………………………………………………..
17
2.3.1. Definicja i podział…………………………………………..
17
2.3.2. Metody oznaczania lipidów w żywności……………………
17
2.3.2.1. Oznaczanie tłuszczu surowego…………………..
18
2.3.2.2. Oznaczanie poszczególnych grup lipidów……….
18
2.3.2.2.1. Chromatografia kolumnowa………….
18
2.3.2.2.2. Chromatografia cienkowarstwowa…...
18
2.3.2.2.3.
Wysokosprawna
chromatografia
cieczowa…………………………………………
19
2.3.2.3. Oznaczanie składu kwasów tłuszczowych………
19
2.3.2.3.1. Chromatografia gazowa……………..
20
2.3.2.3.2.
Wysokosprawna
chromatografia
cieczowa…………………………………………
20
2.4. Witaminy………………………………………………………………..
21
3. Chromatografia a jakość dodatków do żywności…………………………………
26
3.1. Kontrola jakości przeciwutleniaczy…………………………………….
27
3.2. Kontrola jakości konserwantów………………………………………..
30
3.3. Środki słodzące………………………………………………………….
33
3.4. Związki zapachowe……………………………………………………..
35
3.4.1. Chromatografia gazowa – olfaktometria…………………….
35
3.5. Barwniki………………………………………………………………..
39
3.5.1. Definicja i podział………………………………………….
39
3.5.2. Metody oznaczania barwników…………………………….
39
3.5.2.1. Chromatografia cienkowarstwowa………………
39
3.5.2.2. Wysokosprawna chromatografia cieczowa………
40
4. Chromatografia w kontroli zanieczyszczeń żywności……………………………..
40

3
Podsumowanie………………………………………………………………………..
53
Literatura……………………………………………………………………………...
54

4
Wstęp
Analiza żywności wchodzi w zakres multidyscyplinarnej nauki o żywności i żywieniu
człowieka, która korzysta ze zdobyczy takich dziedzin jak matematyka, chemia, fizyka,
biologia, biochemia, mikrobiologia, fizjologia, inżynieria, informatyka, a także ekonomia,
organizacja produkcji czy marketing. Jakość produktów żywnościowych jest bardzo ważna
dla konsumentów, gdyż wpływa na ich zdrowie, a także decyduje o walorach smakowych. O
jakości żywności decyduje przede wszystkim jej skład chemiczny, uzależniony od warunków
produkcji roślinnej i zwierzęcej, parametrów procesów technologicznych, opakowania oraz
warunków transportu i przechowywania. Podstawowym celem analizy jakościowo-ilościowej
składników żywności jest wyszukiwanie czynników, które obniżają jakość zdrowotną
żywności oraz zapewniają odpowiednie jej bezpieczeństwo. Analiza pozwala stwierdzić, jaka
jest wartość odżywcza produktu spożywczego oraz czy proces technologiczny produkcji
przebiegał prawidłowo. Znajomość metod oznaczania podstawowych składników żywności,
dodatków do żywności, zanieczyszczeń, czy zmian zachodzących podczas przetwarzania i
przechowywania żywności jest niezbędna dla specjalistów zajmujących się produkcją i
kontrolą jakości żywności oraz przydatna wszystkim osobom zainteresowanym zrozumieniem
zależności między spożywaną żywnością, a zdrowiem człowieka.
5
1. Analiza żywności i jej znaczenie
Już w starożytności zdawano sobie sprawę z ogromnego wpływu spożywanego
pożywienia na zdrowie człowieka. Obecnie wiadomo, że między żywnością, żywieniem a
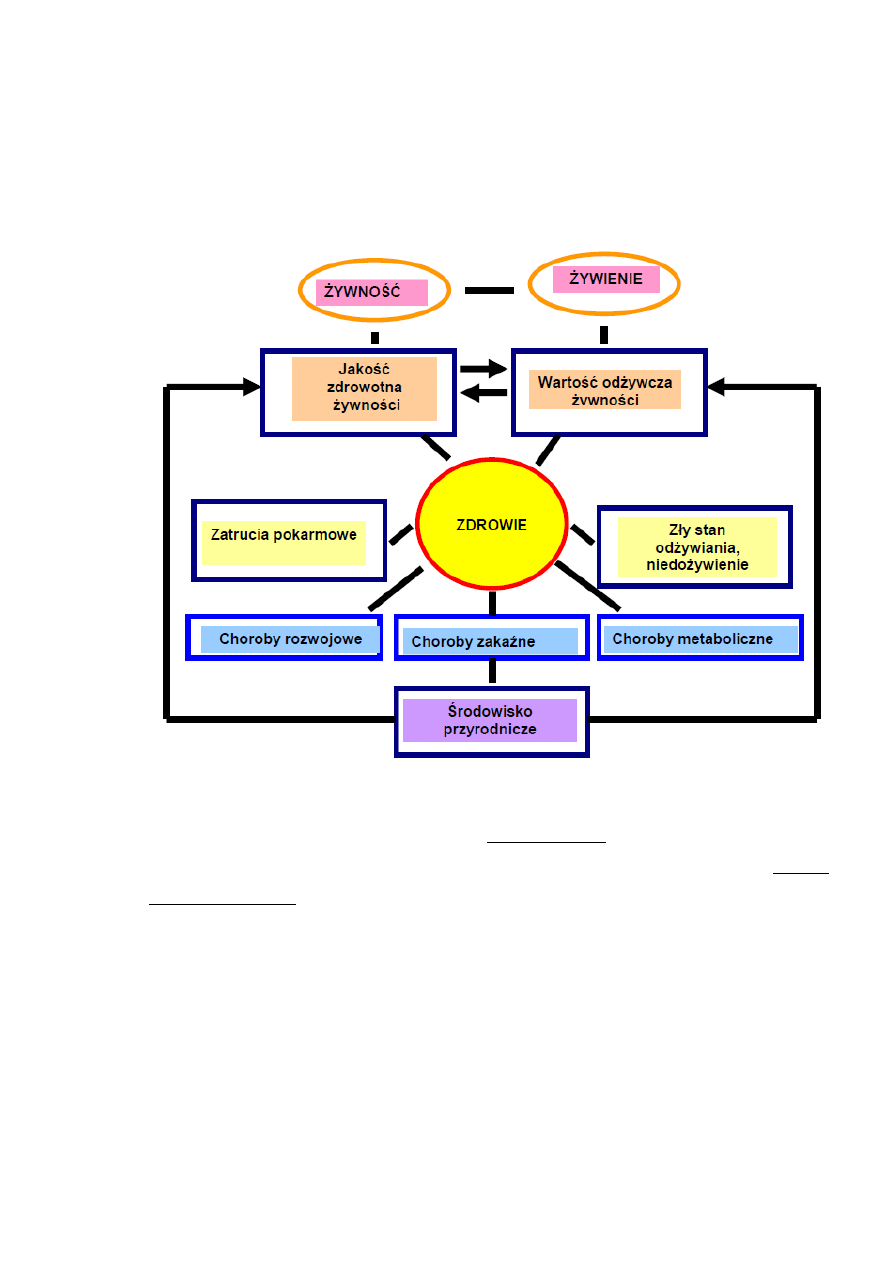
zdrowiem człowieka istnieją ścisłe zależności (rysunek 1) [1].
Rysunek 1. Żywność, żywienie, a zdrowie – ilustracja zależności [1].
Centralną pozycję zajmują w nim dwie cechy: jakość żywności, na którą wpływ mają głównie
sanitarno-higieniczne warunki produkcji, przetwórstwa i obrotu handlowego oraz wartość
odżywcza żywności, informująca o zawartości niezbędnych dla organizmu składników, ich
wzajemnych proporcjach i biodostępności. Obie cechy są ze sobą powiązane. O jakości
żywności decyduje ponadto zawartość w niej naturalnych związków toksycznych,
zanieczyszczeń środowiskowych, technologicznych i biologicznych.
Podstawowym zadaniem analizy żywności jest dokonanie analizy jakościowej i
ilościowej produktów żywnościowych na każdym etapie ich wytwarzania, począwszy od
etapu surowców, poprzez etap produkcji, obrotu handlowego, aż do etapu konsumpcji.
Analizie, oprócz produktów spożywczych poddane są także materiały i wyroby przeznaczone

6
do kontaktu z żywnością. Dzięki postępowi w zakresie analizy żywności stało się możliwe [1,
2]:
- poznanie szczegółowego składu większości surowców i produktów żywnościowych;
- ustalenie wartości kalorycznej artykułów spożywczych;
- opracowanie szybkich oznaczeń składników żywności, przy małym nakładzie pracy;
- prowadzenie badań na temat funkcjonalnych właściwości składników żywności;
- oznaczanie zanieczyszczeń żywności na bardzo niskim poziomie stężeń, rzędu kilku pg/g;
- oznaczanie biologicznych zanieczyszczeń żywności oraz badanie jego wpływu na jakość
produktów spożywczych;
- poznanie mechanizmów przemian chemicznych i biochemicznych zachodzących w czasie
przechowywania i przetwarzania surowców i produktów żywnościowych;
- zmniejszenie strat składników odżywczych i zapobieganie tworzenia się związków
szkodliwych w trakcie obróbki technologicznej żywności;
- opracowanie nowych dodatków do żywności, spełniających szereg funkcji technologicznych
i sensorycznych, które są zgodne z obowiązującymi normami;
- monitorowanie procesu produkcji i obrotu produktami żywnościowymi pod kątem
zapewnienia właściwej jakości zdrowotnej żywności i przestrzegania zasad bezpieczeństwa
żywności.
Żywnością nazywamy jadalne części tkanek roślinnych i zwierzęcych w stanie
naturalnym lub przetworzonym, które po zjedzeniu i przyswojeniu przez organizm ludzki
mogą być źródłem różnych składników odżywczych. Zgodnie z terminologią pojęcie
żywności nie obejmuje:
- środków żywienia zwierząt, żywych zwierząt, jeżeli nie są wprowadzone do obrotu jako
żywność przeznaczona bezpośrednio dla konsumenta,
- roślin przed zbiorem,
- produktów leczniczych,
- kosmetyków, tytoniu i wyrobów tytoniowych,
- środków odurzających i substancji psychotropowych,
- pasz,
- pozostałości i zanieczyszczeń.
Składnikiem odżywczym jest natomiast składnik pokarmowy niezbędny do
odżywiania organizmu człowieka. Wyróżnia się obecnie ponad 400 różnych składników
odżywczych, z tym że tylko 60 z nich to tzw. składniki niezbędne. Składniki niezbędne muszą
być dostarczone w pożywieniu, ponieważ organizm nie jest w stanie sam ich wytworzyć, ani
7
niczym zastąpić. Każdy ze składników odżywczych pełni odrębną rolę, a zapotrzebowanie na
każdego z nich jest różne i zależne od wieku człowieka, płci, okresu wzrostu, wykonywanej
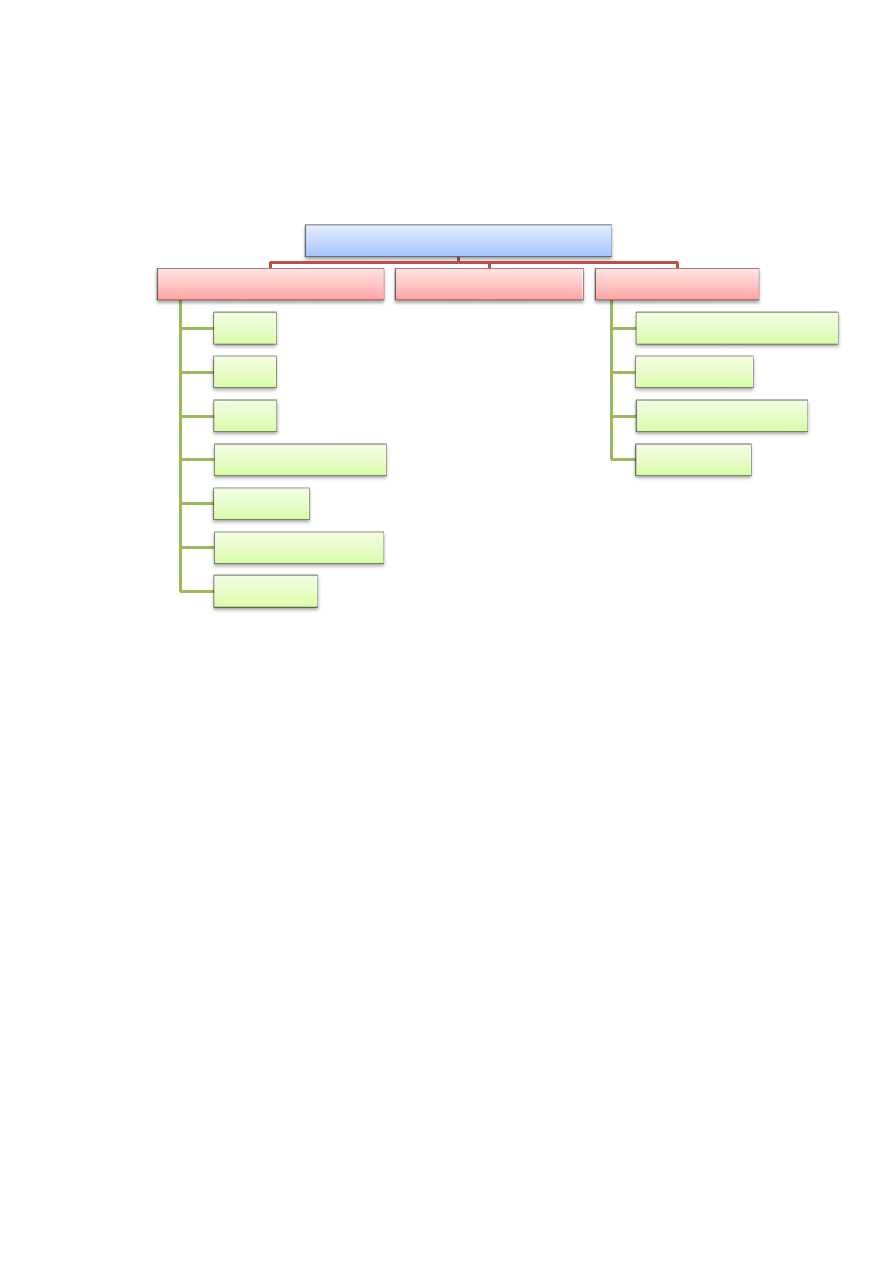
pracy i stopnia aktywności fizycznej. Skład chemiczny żywności obrazuje rysunek 2 [1, 2]:
Rysunek 2. Składniki żywności [2].
Ponieważ zasadniczą cechą żywności jest to, iż posiada składniki odżywcze powstała
klasyfikacja uwzględniająca występowania w niej dominującego składnika odżywczego.
Zgodnie z nią żywość podzielono na cztery zasadnicze grupy:
- produkty białkowe,
- żywność bogatą w sacharydy,
- tłuszcze jadalne,
- owoce i warzywa.
SKŁAD CHEMICZNY ŻYWNOŚCI
PODSTAWOWE SKŁADNIKI
ŻYWNOŚCIOWE
WODA
BIAŁKA
LIPIDY
KWASY TŁUSZCZOWE
WITAMINY
ZWIĄZKI MINERALNE
SACHARYDY
ZANIECZYSZCZENIA
ŻYWNOŚCI
DODATKI DO
ŻYWNOŚCI
ZAPOBIEGAJĄCE ZEPSUCIU
SENSORYCZNE
TEKSTUROTWÓRCZE
POMOCNICZE

8
2. Wykorzystanie chromatografii w kontroli podstawowych składników odżywczych
zawartych w pożywieniu
2.1. Sacharydy (cukry)
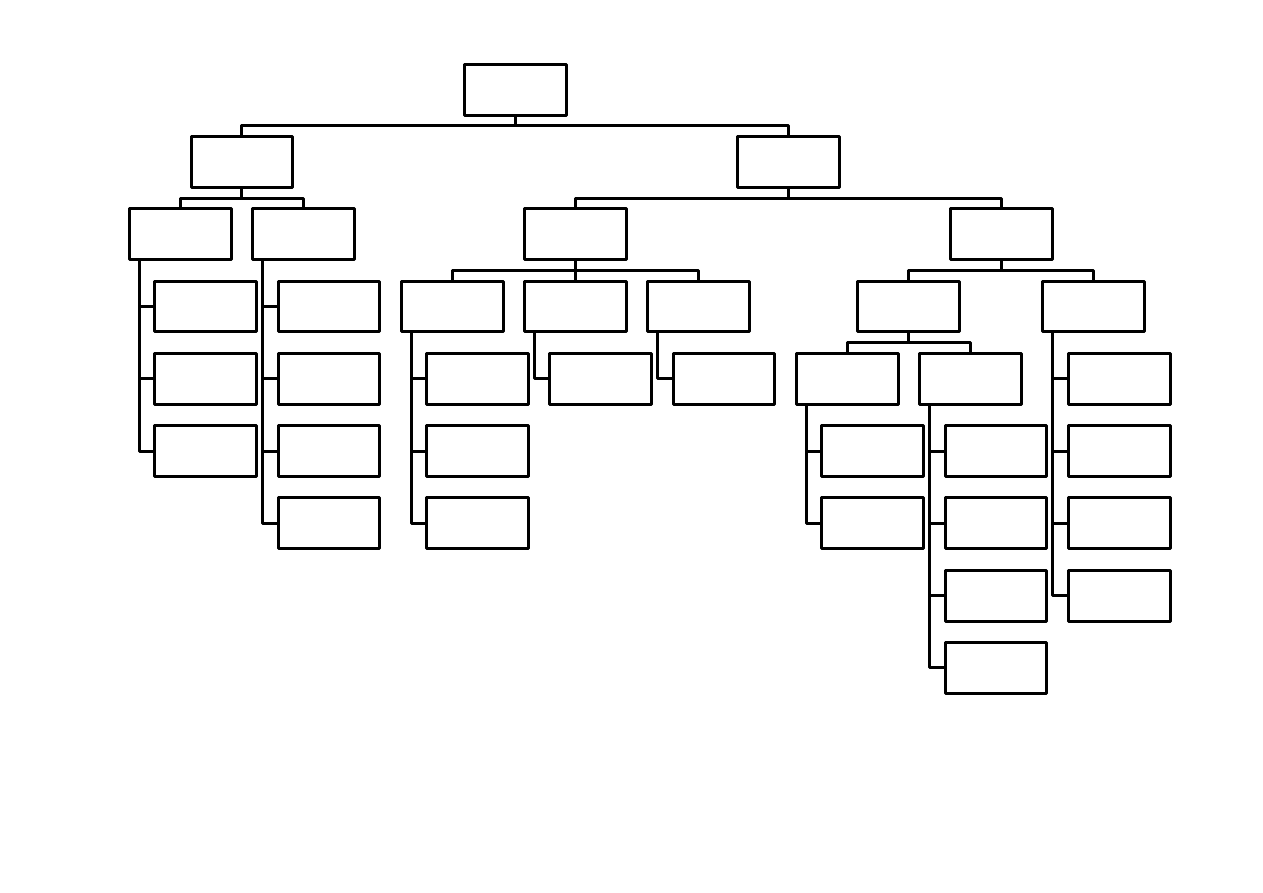
Sacharydy stanowią liczną grupę związków, które ze względu na budowę chemiczną
dzieli się na mono-, oligo- i polisacharydy (rysunek 3). Nazwa sacharydy wywodzi się od
sacharozy, sacharydu powszechnie używanego w celach spożywczych i zwanego potocznie
cukrem. Tradycyjnym wzorem ogólnym cukrów jest C
n
H
2n
O
n
, choć wiele sacharydów tego
wzoru nie spełnia. W literaturze cukry znane są też pod nazwą węglowodanów. Nazwa cukru
składa się z liczebnika podającego liczbę atomów węgla i charakterystycznej dla cukrów
końcówki – oza. Monosacharydy charakteryzują się obecnością w cząsteczce asymetrycznych
atomów węgla (połączonych z 4 różnymi grupami chemicznymi), zwanych centrami
stereogenicznymi.
Obecność asymetrycznych atomów węgla stwarza możliwość
występowania licznych izomerów optycznych i przestrzennych. Cukrami prostymi nazywane
są sacharydy, które nie ulegają hydrolizie; należy do nich m.in. ryboza, glukoza. Jeżeli
cząsteczka cukru składa się z dwóch lub więcej reszt monosacharydów, to zaliczany jest on
do cukrów złożonych, a ich hydroliza prowadzi do otrzymania cukrów prostych. Cukry
złożone, zawierające od 2 do 10 reszt monosacharydowych, nazywane są oligosacharydami,
natomiast cukry powyżej 10 reszt – polisacharydami [1, 2].
Sacharydy są głównym składnikiem większości roślinnych produktów spożywczych.
Glukoza, fruktoza występują głównie w miodzie, owocach i warzywach. Sacharoza w
największych ilościach znajduje się w buraku cukrowym, trzcinie cukrowej, laktoza to
sacharyd obecny w mleku ssaków. Skrobia natomiast w większych ilościach występuje w
ziarnie zbóż, w przetworach zbożowych oraz ziemniakach.
Monosacharydy i oligosacharydy są słodkie, rozpuszczalne w wodzie, łatwo
krystalizują i mają określoną masę cząsteczkową. W przeciwieństwie do nich polisacharydy
nie mają smaku słodkiego, są mniej lub wcale nierozpuszczalne w wodzie i są zróżnicowane
pod względem masy cząsteczkowej. Wszystkie cukry są nielotne i rozpadają się przed
osiągnięciem temperatury wrzenia. Krystalizują z roztworów opornie (wyjątkiem jest
sacharoza) i mają tendencję do tworzenia gęstych, syropowatych cieczy, zwłaszcza jeśli nie są
czyste. Monosacharydy zawierają synegriczne atomy węgla i dlatego są związkami optycznie
czynnymi; wodne roztwory sacharydów wykazują zdolność skręcania płaszczyzny światła
spolaryzowanego [1].
9
Rysunek 3. Podział cukrów.
SACHARYDY
CUKRY PROSTE
(monosacharydy)
pentozy
L-arabinoza
D-ksyloza
D-ryboza
heksozy
D-galaktoza
D-glukoza
D-mannoza
D-fruktoza
CUKRY ZŁOŻONE
KILKOCUKRY
(oligosacharydy)
dwucukry
laktoza
maltoza
sacharoza
trójcukry
rafinoza
czterocukry
stachioza
WIELOCUKRY
(polisacharydy)
właściwe
pentozany
arabany
ksylany
heksozany
celuloza
glikogen
inulina
skrobia
kwaśne
gumy
hemicelulozy
pektyny
śluzy

10
Ze względu na to, że sacharydy stanowią zróżnicowaną grupę związków zarówno pod
względem budowy, jak i właściwości fizykochemicznych, wybór odpowiedniej metody
analitycznej uzależniony jest od celu badania. Do najczęściej wykorzystywanych właściwości
sacharydów w ich analizie zaliczamy:
- właściwości redukujące,
- zachowanie wobec silnych kwasów mineralnych (rozpad do związków o charakterze
aldehydów typu furfural, które dają reakcje barwne),
- zdolność skręcania płaszczyzny światła spolaryzowanego,
- zdolność do tworzenia w wodzie roztworów jednorodnych,
- uleganie fermentacji.
Sposoby przygotowania próbek żywności dostosowane są do konkretnego produktu i
podaje się je wraz z procedurą oznaczania ilościowego. W przypadku oznaczania sacharydów
w produktach stałych należy je rozpuścić w wodzie lub wodnych roztworach alkoholi.
Uzyskane w ten sposób roztwory zawierają z reguły wiele substancji przeszkadzających w
metodach analitycznych, stąd należy je oczyścić, np. przez traktowanie octanem ołowiu(II)
ekstraktów roślinnych, syropów, produktów owocowych, warzywnych, napoi czy dodatek
tlenku glinu do miodu. Substancje przeszkadzające (barwniki, białka, lipidy, inne substancje
niesacharydowe o właściwościach redukcyjnych) usuwa się przez klarowanie i odbarwianie
[2].
W celu analizy sacharydów stosuje się również metody chromatograficzne.
Wykorzystywane są zarówno do oznaczeń jakościowych, jak i ilościowych. Stosowane w tym
celu są [1, 2, 3]:
- chromatografia cienkowarstwowa lub chromatografia bibułowa,
- chromatografia kolumnowa,
- chromatografia gazowa,
- wysokosprawna chromatografia cieczowa.
Rozdział metodą chromatografii cienkowarstwowej na żelu krzemionkowym lub
chromatografii bibułowej pozwala między innymi na identyfikację pentoz, heksoz i
disacharydów w mieszaninie cukrów. Identyfikację przeprowadzamy przez porównanie R
f
oraz na podstawie charakterystycznych dla poszczególnych sacharydów reakcji barwnych z
odpowiednimi odczynnikami. Jako fazę stacjonarną stosuje się najczęściej żel krzemionkowy
(Silica gel), tlenek glinu (Alumina), ziemię okrzemkową oraz krzemian magnezu (Florisil).
Za pomocą chromatografii kolumnowej w zależności od zastosowanej metody
rozdziału można uzyskać jakościowy rozdział sacharydów, a oznaczenie ilościowe wykonuje

11
się metodami chemicznymi lub enzymatycznymi. Rozdzielenia chromatograficzne prowadzi
się zarówno na złożach jonowymiennych (kationowymiennych i anionowymiennych), fazach
cyklodekstrynowych (możliwość rozróżnienia enancjomerów), związanych fazach
aminowych, impregnowanych in situ aminami żelach krzemionkowych, niepolarnych fazach
C
18
, czy na grafityzowanym węglu.
W przypadku zastosowania techniki GC-FID (detektor płomieniowo-jonizacyjny),
sacharydy przed oznaczeniem muszą być poddane procesowi sililacji, w wyniku którego
przekształcone są w lotne pochodne trimetylosililowe. Po rozdziale na odpowiedniej
kolumnie chromatograficznej na podstawie porównania czasów retencji cukrów i
odpowiednich wzorów można zidentyfikować określone sacharydy w próbce, a na podstawie
wielkości piku w oparciu o krzywą kalibracyjną określić ilość badanego sacharydu. I tak np.
do oznaczenia glukozy i galaktozy w chlebie wykorzystano kolumnę zawierającą
zmodyfikowaną fazę stacjonarną 3% SP-2330 na złożu 100/120 mesh Supelcoport, analizę
prowadzono w temp. 215°C, a do detekcji posłużył detektor FID. Innym przykładem jest
analiza zawartości glukozy, fruktozy, sacharozy i maltozy w miodzie, którą wykonano na
kolumnie wypełnionej złożem 100/200 mesh Diatomite CQ zmodyfikowanym 10% E-20;
program temperaturowy 100-230°C, detektor FID.
W przypadku HPLC po rozdziale sacharydów na kolumnie chromatograficznej
dokonuje się ich analizy na podstawie wartości współczynnika załamania światła
poszczególnych sacharydów, który mierzymy detektorem refraktometrycznym (RI).
Identyfikacja dokonywana jest metodą porównania ze wzorcem. Przykładem zastosowania tej
techniki jest oznaczanie glukozy, sacharozy i rafinozy w jogurcie, podczas którego do
ekstrakcji analitów użyto 70% etanolu, a rozdział uzyskanego ekstraktu przeprowadzono z
wykorzystaniem fazy stacjonarnej Spherisorb-NH2, fazę ruchomą stanowiła mieszanina
woda/acetonitryl (36:64, v/v), do detekcji służył detektor refraktometryczny. Z kolei
oznaczanie glukozy w hydrolizacie skrobiowym wykonano poprzez ekstrakcję analitu za
pomocą wody, rozdzielenie chromatograficzne uzyskanej próbki na kolumnie Dextropak
podczas którego do Lucji wykorzystano wodę, a do detekcji detektor RID.
Metody chromatograficzne GC i HPLC charakteryzują się dużą precyzją oraz
łatwością i szybkością wykonania w porównaniu z metodami chemicznymi. Technika HPLC
jest wykorzystywana przede wszystkim do oznaczania średnio- i wysokocząsteczkowych
węglowodanów i w porównaniu z metodą GC charakteryzuje się krótszym czasem analizy (o
50%), wyższymi wartościami odzysku i lepszą dokładnością oznaczeń. Z kolei technika GC
stosowana jest głównie do analizy monosacharydów, do jej zalet zaliczamy wysoką czułość i

12
doskonałą rozdzielczość (możliwość odróżnienia α i b anomerów); do wad konieczność
derywatyzacji.
2.2. Białka i aminokwasy
Białka to niezbędne składniki pokarmowe. Ich zawartość w produktach spożywczych
pozwala określić wartość odżywczą. Związki te są podstawowym składnikiem budulcowym
tkanek, tworzą też enzymy i hormony, regulują procesy przemiany materii, są elementami
układu odpornościowego (przeciwciała). Białka mogą być zbudowane wyłącznie
z aminokwasów – białka proste lub aminokwasów, części prostetycznych niebiałkowych –
białka złożone. Różnorodność białek wynika ze składu i różnorodności uszeregowania reszt
tych grup. Aminokwasy przedstawiono na rysunku [1].
Białka mogą ulegać denaturacji. Jest to proces nieodwracalny (niszczenie struktury
pod wpływem ogrzewania czy dodatku związków zdolnych do rozerwania wiązań
wodorowych – mocznika, kwasów i zasad) lub odwracalny, co prowadzi do agregacji
czy strącania [1]. W strukturze białek występują grupy zasadowe i kwasowe stąd właściwości
silnie zależą od pH i mogą mieć ładunek dodatni lub ujemny. Charakterystycznym punktem
natomiast jest punt izoelektryczny, czyli taki w którym ładunki + i – się równoważą
i sumaryczny ładunek wynosi zero. Większość białek dobrze rozpuszcza się w wodzie i ulega
hydratacji. Obserwuje się efekt wysolenia, polegający na zmniejszeniu rozpuszczalności
białek w obecności soli nieorganicznych.
Bogatym źródłem białka w żywności są przede wszystkim jajka, mleko i przetwory
mleczne, mięso zwierząt i ryb. Białko w nich zawarte posiada wysoką wartość odżywczą,
tzn., że w ich skład wchodzą wszystkie aminokwasy egzogenne (których organizm ludzki
nie syntezują i trzeba je dostarczać). Produkty pochodzenia roślinnego, szczególnie nasiona
roślin strączkowych i zbóż również mają dużą zawartość białek, ale są one
niepełnowartościowe.
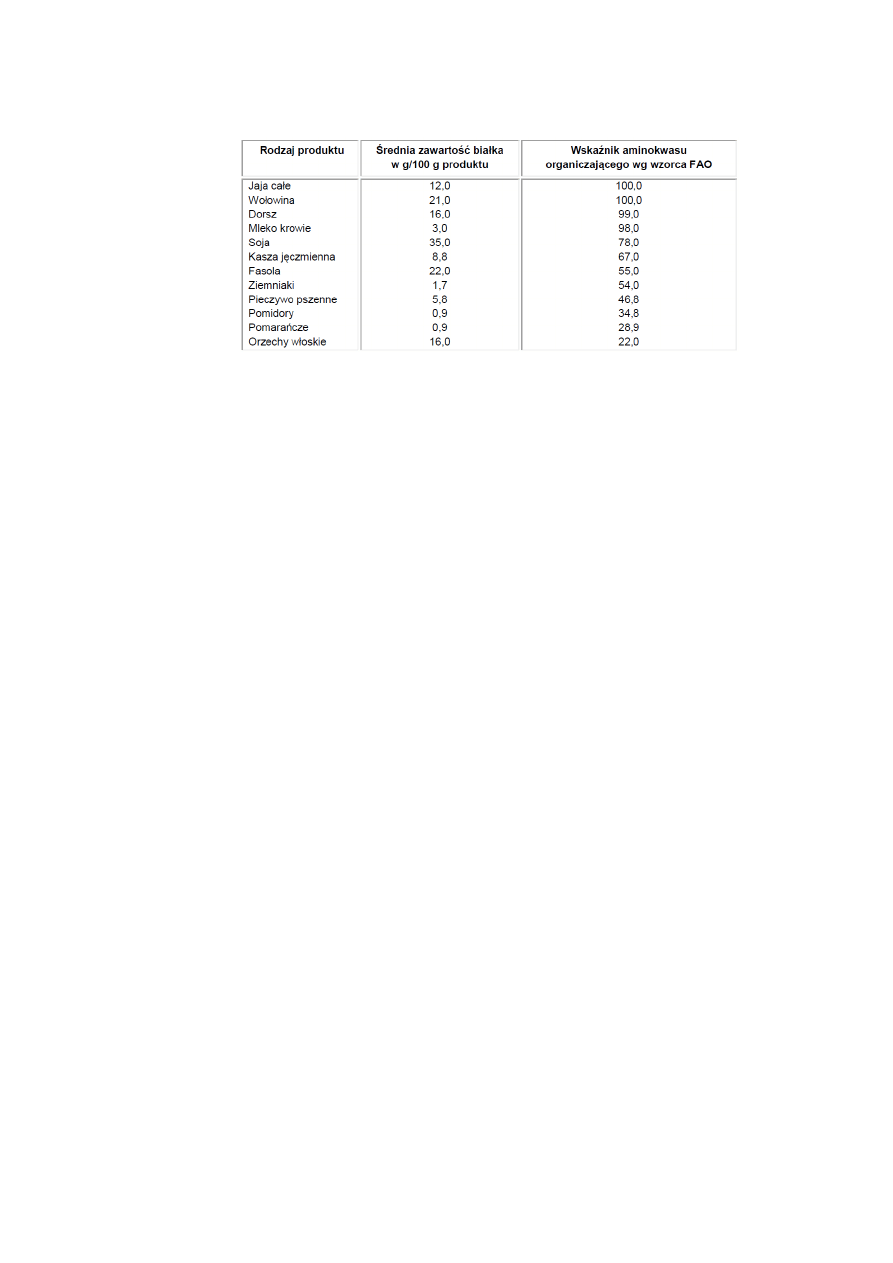
Zawartość białek w różnych produktach i wartość odżywczą przedstawioną jako wskaźnik
aminokwasu ograniczającego – stosunku niezbędnych aminokwasów w badanym białku do
zawartości tego aminokwasu we wzorcu) zestawiono w tabeli poniżej [1].
13
Tabela 1. Białko w produktach spożywczych [1].
Analiza
Celem analizy ilościowej i jakościowej białka, surowca czy produktu spożywczego
jest ocena wartości odżywczej, czyli zdolności zaspokojenia potrzeb pokarmowych.
Zawartość aminokwasów jest istotna w produktach spożywczych specjalnego przeznaczenia
– suplementach diety, dla sportowców, dla osób starszych czy niemowląt. Aminokwasy
są także prekursorami powstających w czasie obróbki technologicznej związków
aromatycznych. Znając zatem skład można przewidywać jakie zmiany zajdą w czasie
przetwórstwa. Pozwala to także na kontrolę prawidłowości procesów przetwórstwa,
np. mleka. Analiza aminokwasów ponadto stosowana jest przy wykrywaniu zafałszowań
żywności,np. analiza 3-metylohistydyny świadczy o dodatku kolagenu lub białek roślinnych
do przetworów mięsnych. Innym celem jest sprawdzenie zawartości asparaginy, która jest
prekursorem rakotwórczego akrylamidu powstającego w czasie wysokotemperaturowej
obróbki produktów skrobiowych [4].
Celem analizy może być oznaczenie wolnych aminokwasów lub związanych w białkach.
Przed właściwą analizą należy odpowiednio przygotować próbkę, poprzez ekstrakcję,
oczyszczanie, często derywatację przed lub po analizie.
Wykorzystanie metod chromatograficznych
Chromatografia gazowa ma małe zastosowanie ze względu na konieczność przeprowadzenia
analitu w lotne estry. Częściej wykorzystuje się chromatografię cieczową i jej różne odmiany
(scharakteryzowane w tabeli poniżej) głównie do rozdziału białek i analizy,
przy czym najczęściej wykorzystuje się HPLC w odwróconym układzie faz. Do detekcji
najczęściej wykorzystuje się detektory spektrofotometryczne, gdy w strukturze są chromofory
aromatyczne, gdy tylko od wiązania peptydowego często stosuje się derywatację.

14
Gdy białaka rozdzielane są w śladowych ilościach wykorzystuje się detektory fluorescencyjne
FLD (bardziej czułe) przy zastosowaniu prekolumnowej lub postkolumnowej.
Oznaczanie wolnych aminokwasów przygotowania próbki przez ekstakcję, np. roztworem
1M HCl oraz oczyszczanie z białek, węglowodanów i tłuszczów metodami fizycznymi
(wirowanie i filtracja) i chemicznymi (wytrącanie, denaturacja). Z kolei oznaczanie
aminokwasów związanych w białkach wymaga oprócz etapu oczyszczania jeszcze
przeprowadzenia efektywnej hydrolizy białek – enzymatycznej, kwasowej, zasadowej,
przy czym dominuje kwasowa.
Kolejnym etapem jest derywatacja w celu polepszenia detekcji. Głównie stosuje się:
detektor spektroskopowy UV-VIS – ninhydryna, chlorek dabasylu (w świetle
widzialnym), fenyloizotiocyjanian (UV)
detektor fluorescencyjny – chlorek dansylu, o-ftalaldehyd
detektor fluorescencyjny – fluorescamina
detektor elektrochemiczny – otrzymywanie pochodnych obdarzonych ładunkiem
W analizie najczęściej wykorzystywana jest chromatografia jonowymienna oraz RP-HPLC.
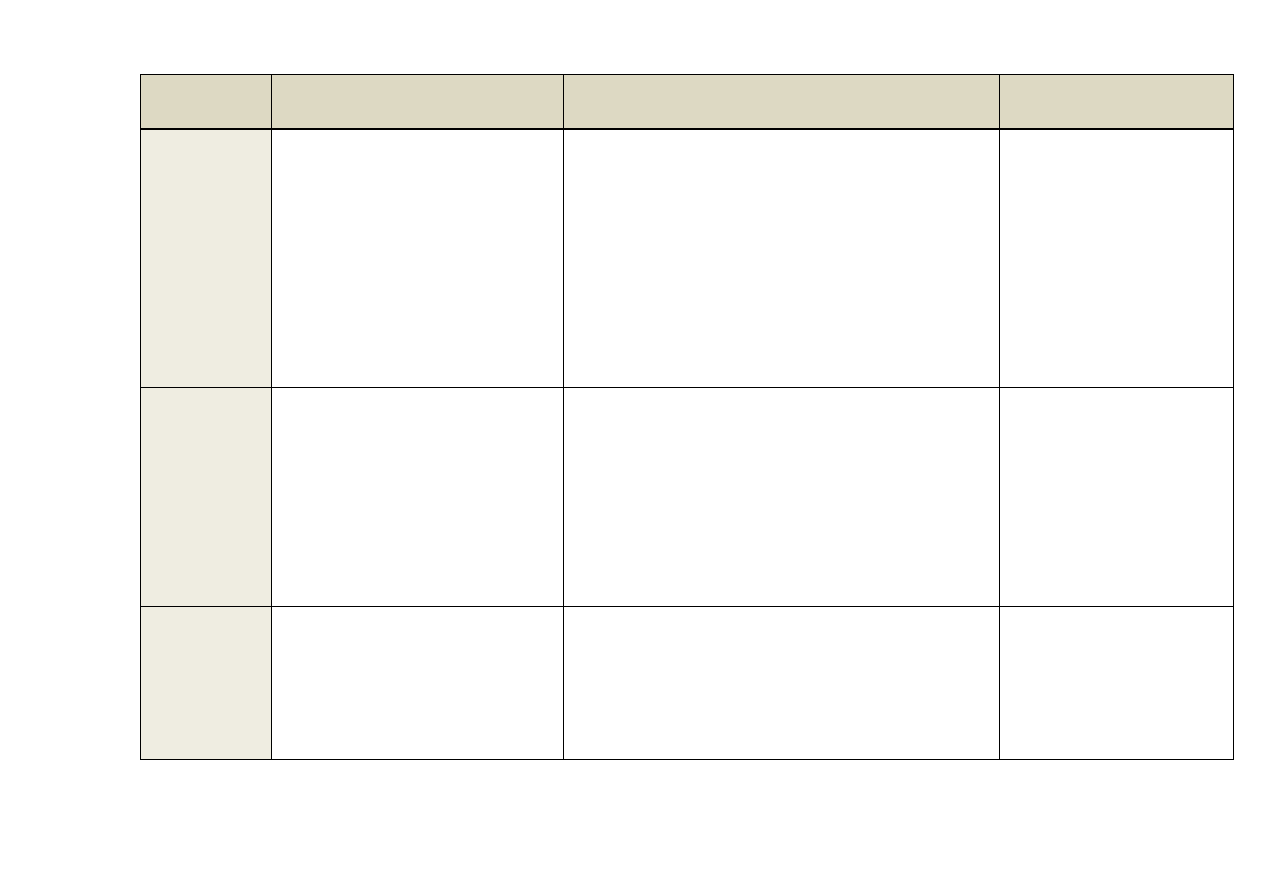
15
Tabela 2. Metody chromatografii stosowane przy oczyszczaniu i analizie białek [4, 5, 6].
Metoda
Zasada
Stosowane fazy
Zastosowanie
SEC
Chromatografia
żelowa (sączenie
molekularne)
rozdział na podstawie wielkości i kształtu
cząsteczek – małe cząsteczki
zatrzymywane są w porach, co spowalnia
ich wędrówkę duże wypływają z
kolumny jako pierwsze
Cząsteczki nie wiążą się z wypełniaczem
wypełnienie: ziarna nierozpuszczalnego polimeru, np.
poliakryloamidu, ziarna, których podstawowym składnikiem
jest dekstran (SEPHANDEX) lub agaroza (SEPHAROSE)
eluent jest obojętny, spełnia tylko rolę przenośnika, woda lub
alkohole dla polarnych wypełnień, w przypadku niepolarnych
chloroform, dichlorometan, toluen , THF
do oczyszczania białek
wrażliwych na pH czy stężenie
jonów, odpowiednio
skalibrowana metoda może
służyć do wyznaczenia masy
cząsteczkowej białka
IC
Ch.
jonowymienna
rozdział zależny od ładunku
powierzchniowego białka
polega na odwracalnej wymianie jonowej
ze znajdującym się w roztworze
przeciwjonem wymieniacza jonowego
wypełnienie: w przypadku białek o ładunku ujemnym: kolumny
z dodatnio naładowanymi grupami – dietyloaminoetylowe
(DEAE-celuloza, DEAE-Sephadex)
w przypadku białek o ładunku dodatnim:wypełniacze z
ładunkiem ujemnym grypu karboksylwe – CMceluloza i
CMSephandex lub z grupami sulfonowymi
eluent: bufor wymywający o odpowiednim pH i sile jonowej,
ma zastosowanie analityczne i
preparatywne
HIC
Ch.
Oddziaływań
hydrofobowych
polega na hydrofobowym oddziaływaniu
ligandu związanego z fazą stacjonarną, a
niepolarną częścią białka, dodatek soli
powoduje odsłonięcie hydrofobowej
części białka, co zwiększa oddziaływania
hydrofobowe
faza stacjonarna: sorbenty typu C3-C6 wiązane z sieciowaną
agarozą lub kopolimerem syntetycznym
eluent z dodatkiem soli (siarczan sodu, amonu, octany sody,
potasu, wodorofosforany czy chlorek sodu)
Proces przy malejącym gradiencie stężenia soli
głównie do białek o dużej masie
cząsteczkowej, zaletą jest
zachowanie aktywności
biologicznej białek
część białek może nie ulec
rozdziałowi
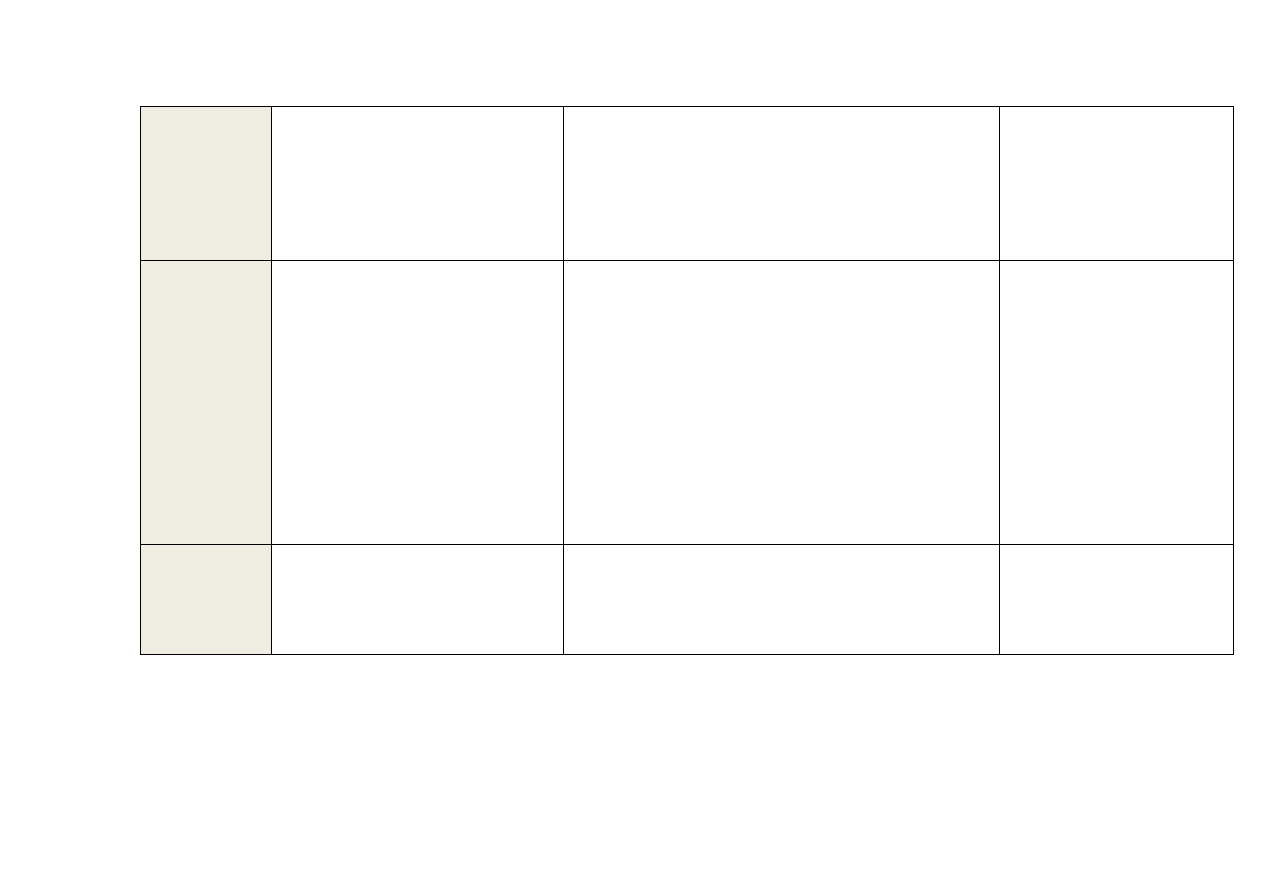
16
AC
Chromatografia
powinowactwa
wykorzystuje wzajemne powinowactwo
dwóch substancji, rozdział na podstawie
odwracalnej reakcji, bardzo skuteczną
metodą jest wykorzystywanie
unieruchomionych przeciwciał
faza stacjonarna zawiera ligand o dużym powinowactwie do
analitu, mogą być to przeciwciała
eluent: często roztwór denaturujący (np. mocznik) czy o
skrajnych wartościach pH ze względu na silne oddziaływania
metoda o dużej selektywności
do specyficznych zastosowań
w czasie elucji może dojść do
zmiany struktury
RP-HPLC
Ch. W układzie
faz
odwróconych
mechanizm obejmuje oddziaływania
pomiędzy eluentem fazą stacjonarną a
analitem i polega na współzawodniczeniu
pomiędzy cząsteczkami analitu a fazy
ruchomej o miejsce na adsorbencie, w
przeciwieństwie do narmalnego układu
faz w RP-HPLC stosuje się słabopolarne
lub niepolarne fazy stałe
f. stacjonarna: sorbenty siloksanowe modyfikowane grupami
alkilowymi, fenylowymi i difenylowymi typu C18, C8, C4
(C5, C6), C2,.
elucja gradientowa
faza ruchoma : wodę i acetonitryl z dodatkiem kwasu
trifluorooctowego (TFA), zarówno w eluencie A (niższe
stężenie acetonitrylu 5
– 25 %) jak i w eluencie B (wyższe stężenie acetonitrylu 75 –
95 %).
szerokie zastosowanie w
analizie i rozdziale białek
może dojść do denaturacji, aby
tego uniknąć stosuje się dodatek
do eluentu soli stabilizujących
strukturę białka (np. NaCl,
AcNa, (NH4)2SO4). Trzeba się,
jednak, liczyć się z tym, że taki
dodatek
często modyfikuje retencję
substancji
Elektroforeza
kapilarna
rozdziała w wyniku przepływu
elektroosmotycznego na skutek
przyłożonego napięcia
kapilary kwarcowe wypełnione roztworem buforującym,
duża zdolność rozdzielcza,
krótki czas analizy, bardzo duża
czułość
17
2.3. Lipidy
2.3.1. Definicja i podział
Lipidy to liczna grupa związków organicznych o złożonej budowie, których cechą
charakterystyczną jest to, że rozpuszczają się w tzw. rozpuszczalnikach tłuszczowych do
których zalicza się np. eter etylowy lub naftowy, chloroform, benzen, aceton, tetrachlorek
węgla, a także alkohole w podwyższonych temperaturach. Zdecydowana większość lipidów
nie rozpuszcza się w wodzie, jako wyjątek od tej reguły można wymienić lecytynę, związek z
grupy fosfolipidów, który wykazuje częściową rozpuszczalność w wodzie [7, 8].
Lipidy dzieli się na trzy duże grupy: prostych, złożonych i wtórnych, te z kolei dzielą
się na mniejsze zbiory. Lipidy wtórne to pochodne lipidów prostych i wtórnych, powstałych
w wyniku ich hydrolizy.
Rysunek 4. Podział lipidów [9].
Lipidy stanowią niezbędny element diety człowieka, bowiem powinny dostarczać około 40 %
dziennego zapotrzebowania na energię. Powszechnie używany termin „tłuszcze” oznacza
wieloskładnikowa mieszankę lipidów, których znaczącą część stanowią kwasy tłuszczowe.
2.3.2. Metody oznaczania lipidów w żywności
Oznaczanie lipidów to jedna z podstawowych analiz przeprowadzanych w celu
ustalenia składu produktów spożywczych, a także określenia ich wartości energetycznej. Ze
LIPIDY
proste
lipidy właściwe
:
estry kwasów tłuszczowych i
glicerolu
woski:
estry wyższych kwasów
tłuszczowych i alkoholi (z
wyjątkiem glicerolu)
złożone
fosfolipidy:
lipidy zawierające kwas
fosforowy jako mono - lub
diester
glikolipidy:
związki zawierające
przynajmniej jedną reszztę
cukrówą połączoną
wiązaniem glikozydowych z
częscią lipidową
wtórne
kwasy tłuszczowe
alkohole lipidowe
węglowodory

18
względu na to, że związki te posiadają bardzo złożoną budowę, a dodatkowo są niestabilne,
ich analiza nie należy do łatwych. Lipidy są szczególnie wrażliwe na obecność czynników
utleniających, w tym tlenu atmosferycznego, w związku z czym w czasie analizy należy
zachować środki ostrożności i w miarę możliwości przeprowadzać badania w atmosferze gazu
obojętnego lub użyć przeciwutleniaczy. Dodatkowy problem stanowi pobranie, z materiału
biologicznego, reprezentatywnej próbki [8].
2.3.2.1. Oznaczanie tłuszczu surowego
Tłuszczem surowym w analizie żywności nazywa się substancję, która podczas
suszenia w temperaturze 105
o
C w czasie jednej godziny, nie jest lotna i dodatkowo da się
wyekstrahować rozpuszczalnikiem organicznym. Do oznaczania tego typu tłuszczu stosuje się
metody ekstrakcyjne, objętościowe i instrumentalne [9].
2.3.2.2. Oznaczanie poszczególnych grup lipidów
Oprócz oznaczenia ogólnej zawartości tłuszczu surowego, bardzo ważne jest
zidentyfikowanie konkretnych klas lipidów. Całkowitą analizę lipidów w artykułach
żywnościowych przeprowadza się z użyciem chromatografii kolumnowej (LC),
cienkowarstwowej (TLC) lub wysokosprawnej chromatografii cieczowej (HPLC).
2.3.2.2.1. Chromatografia kolumnowa
Chromatografia kolumnowa to najpopularniejsza metoda rozdzielania lipidów.
Wymywanie poszczególnych grup lipidów następuje poprzez zmianę składu eluenta np.
stosując kolumnę wypełnioną żelem krzemionkowym, za pomocą chloroformu wymywa się
lipidy neutralne, aceton wymywa glikolipidy, a metanol fosfolipidy. W ten sposób
rozdzielone grupy lipidów można poddać dalszemu rozdziałowi. Stosując jako eluent heksan
lub heksan z dodatkiem 2% , 5% lub 15% eteru można rozdzielić lipidy neutralne na
węglowodory, estry cholesterolu, cholesterol. Analizę ilościową konkretnych lipidów
przeprowadza się za pomocą chromatografii gazowej z dodatkiem wzorca wewnętrznego [1].
2.3.2.2.2. Chromatografia cienkowarstwowa
Jako fazę stacjonarną w chromatografii cienkowarstwowej stosuję się na ogół płytki z
żelu krzemionkowego, fazę ruchomą stanowi mieszania rozpuszczalników organicznych
(heksan, eter dietylowy i kwas octowy). Taki dobór faz umożliwia rozdział lipidów

19
neutralnych - acylogliceroli, wolnych steroli, estrów steroli, wolnych kwasów tłuszczowych i
innych. Gdy jako fazę ruchomą użyje się mieszanin chloroform – metanol – woda lub
chloroform – metanol - kwas octowy, możliwy jest rozdział fosfolipidów. Zaletami tego typu
rozdziału lipidów są niskie koszta, szybkość oraz prostota [1].
2.3.2.2.3. Wysokosprawna chromatografia cieczowa
Przed przeprowadzeniem analizy techniką wysokosprawnej chromatografii cieczowej
(HPLC) należy próbkę odpowiednio przygotować, tj. rozdzielić mieszaninę lipidów na
konkretne grupy za pomocą ekstrakcji do fazy stałej (SPE). Poszczególne frakcje lipidowe
wymywane są za pomocą mieszaniny rozpuszczalników organicznych (eter dietylowy,
heksan, chloroform, etanol) a fazę stałą stanowią na ogół kolumny krzemionkowe. Zaletą
rozdziału lipidów za pomocą ekstrakcji do fazy stałej jest fakt, że metoda ta wymaga znacznie
mniejszej ilości eluentu. Początkowo do tego celu stosowano chromatografy z detektorem
UV, dlatego metodą tą można była analizować jedynie lipidy nienasycone, bowiem tylko te
absorbowały promieniowanie UV. Aktualnie, przy zastosowaniu detektora laserowego,
możliwa jest analiza ilościowa i jakościowa wszystkich grup lipidów. Zaletami tej
chromatografii jest wysoka zdolność rozdzielcza lipidów oraz to, że do analizy
wykorzystywane są małe ilości próbki [1].
2.3.2.3. Oznaczanie składu kwasów tłuszczowych
Podstawowym składnikiem tłuszczów są kwasy tłuszczowe. Ze względu na ważną
rolę jaką pełnią w organizmie ludzkim – są głównym materiałem zapasowym, kładziony jest
duży nacisk na oznaczanie ich zawartości w artykułach spożywczych. Kwasy tłuszczowe to
związki o ogólnych wzorze RCOOH, w których R oznacza łańcuch węglowodorowy.
Łańcuch ten, w naturalnych tłuszczach, jest prosty i może zawierać wiązania nienasycone.
Naturalne kwasy tłuszczowe, zawierają parzystą liczbę węgli w łańcuch, która na ogół wynosi
od 12 do 20. Dobór metody , za pomocą której analizuje się kwasy tłuszczowe zależy w
głównej mierze od długości łańcuch, ilości wiązań podwójnych, a także obecności grup
funkcyjnych. Najczęściej w tym celu stosuje się chromatografię gazową (GC) oraz
wysokosprawną chromatografię cieczową (HPLC) [9].

20
2.3.2.3.1. Chromatografia gazowa
Podstawowym problemem przy zastosowaniu chromatografii gazowej w analizie
kwasów tłuszczowych jest ich mała lotność. Ze względu na to, przed analizą należy związki
te przeprowadzić w bardziej lotne pochodne np. estry metylowe, estry butylowe lub
trimetylosililowe (TMS). Pochodne kwasów tłuszczowych analizuję się na kolumnach
kapilarnych o różnej polarności, jednak wykazano, że im kolumna jest bardziej polarna, tym
rozdział jest efektywniejszy. Najlepsze fazy stacjonarne to fazy cyjanoetylosilikonowe oraz
cyjanopropylosilikonowe. Gdy badaniu poddaje się mieszaninę krótko i długołańcuchowych
kwasów tłuszczowych, w celu lepszego rozdziału, należy zastosować analizę w
programowanej temperaturze. Najczęściej stosowanym detektorem w oznaczaniu kwasów
tłuszczowych jest detektor płomieniowo-jonizacyjny (FID), w przypadku analizy estrów
metylowych kwasów tłuszczowych używa się także detektor wychwytu elektronów (ECD).
Często do analizy wykorzystuję się chromatograf gazowy sprzężony ze spektrometrem
masowym (GC-MS). Zastosowanie takiego układu pozwala na rejestrację widm masowych
oraz parametrów retencji, co umożliwia przeprowadzenie kompleksowej identyfikacji.
Analizę ilościową przeprowadza się za pomocą metody wzorca wewnętrznego [1].
2.3.2.3.2. Wysokosprawna chromatografia cieczowa
Tak jak w przypadku chromatografii gazowej, aby móc analizować kwasy tłuszczowe
metodą wysokosprawnej chromatografii cieczowej, należyte najpierw przeprowadzić w
odpowiednie pochodne. Jeżeli kwasy tłuszczowe podda się działaniu alkoholu lub amidu,
otrzymane estry można identyfikować za pomocą detektora UV. Gdy do procesu estryfikacji
użyje się alkoholu o właściwościach fluorescencyjnych, można zastosować detektor
fluorescencyjny. Często analizę kwasów tłuszczowych prowadzi się w odwróconym układzie
faz. Używanymi do tego celu fazami stacjonarnymi są żele krzemionkowe modyfikowane
grupami oktadecylowymi oraz ortylowymi. Rozdział zachodzi przy wykorzystaniu
rozpuszczalników polarnych i może zachodzić zarówno w warunkach izokratycznych, jak i w
gradiencie temperaturowym. Kolejność wymywania kwasów tłuszczowych zależy od
długości ich łańcucha, a także od stopnia nienasycenia. Wraz ze wzrostem długości łańcucha,
wydłuża się czas retencji, natomiast wraz ze wzrostem ilości wiązań podwójnych w łańcuch
czas ten maleje [1].

21
2.4. Witaminy
Witaminy należą do grupy niskocząsteczkowych związków organicznych
posiadających różnorodną budowę chemiczną. Pełnią one funkcję katalizatorów reakcji
biochemicznych, wchodzą w skład enzymów i koenzymów, są niezbędne do wzrostu i
podtrzymania funkcji życiowych. Dla wielu organizmów są to związki chemiczne, które nie
mogą być syntetyzowane przez określony organizm, a są niezbędne w procesach
biochemicznych w nim przebiegających (związki egzogenne), dlatego muszą być dostarczane
z pożywieniem. Niektóre z nich okazały się również egzogennym elementem wzrostowym
dla wielu drobnoustrojów. Dwie z witamin pełnią również funkcję niezbędnych
biokatalizatorów dostarczanych za pomocą bakterii glebowych rośliną wyższym (witamina
B12) i niższym (witamina B1). Witaminy rozważa się jako substancje działające w bardzo
małych ilościach w odróżnieniu od innych składników pokarmowych, poza kwasem
askorbinowym, dzienne zapotrzebowanie na pozostałe witaminy nie przekracza 20 mg.
Prowitaminami nazywamy związki chemiczne przekształcające się w organizmie w witaminę,
np. niektóre witaminy są wytwarzane przez zwierzęta z odpowiednich związków
syntetyzowanych przez rośliny (np. β-karoten).
Witaminy i prowitaminy produkowane są przez rośliny oraz bakterie żyjące w przewodzie
pokarmowym, a także tkanki zwierzęce. Ze względu na synergiczne działanie wielu witamin,
ich rzeczywiste zapotrzebowanie ilościowe jest trudne do określenia. Uzależnione jest ono od
cech osobniczych, stanu zdrowia, i okresu życia człowieka. Choroba polegająca na
całkowitym braku lub znacznym niedoborze witamin nazywana jest awitaminozą.
Hipowitaminozą nazywamy niekorzystny stan pośredni pomiędzy awitaminozą a optymalnym
zaspokojeniem zapotrzebowania organizmu na daną witaminę. Nadmiar witamin
w organizmie ludzkim, głównie witamin rozpuszczalnych w tłuszczach nazywany jest
hiperwitaminozą. Jednym z głównych wskaźników jakości witamin jest ich zawartość
w surowcach i produktach żywnościowych. Większość witamin to substancje mało odporne
na działanie różnych czynników fizycznych i chemicznych, dlatego ich straty są nieraz bardzo
duże [1].
Podstawowy podział witamin:
witaminy rozpuszczalne w tłuszczach (witamina A, D, E, K)
witaminy rozpuszczalne w wodzie (witamina B
1
, B
2
, PP, B
5
, B
6
, B
8
, B
9
, B
12
,
H, C).

22
Oznaczanie witamin
Występowanie witamin w bardzo niewielkich ilościach oraz ich wrażliwość na czynniki
fizykochemiczne, sprawia wiele trudności w ich ilościowym oznaczaniu. Liczna grupa
witamin występuje w produktach spożywczych w postaci związanej, co wymaga
zastosowania np. hydrolizy enzymatycznej lub kwasowej. Do jakościowego i ilościowego
oznaczania witamin i prowitamin stosuje się różne metody (chemiczne, fizykochemiczne).
Coraz częściej do analizy witamin w produktach spożywczych wykorzystuje się
wysokosprawną chromatografię cieczową, najczęściej w odwróconym układzie faz
z zastosowaniem kolumny RP-C18. Fazę ruchomą stanowi mieszanina wody (z dodatkiem
kwasu octowego lub trifluorooctowego) i acetonitrylu lub wody (z dodatkiem kwasu
octowego lub trifluorooctowego) i metanolu. Do wykrywania związków lub ich grup można
stosować różne rodzaje detektorów, jednak najczęściej stosowane są detektory
spektrofotometryczne (UV), spektrofotometryczne z matrycą diod (DAD), a także
spektrometry mas (MS). Detektory te są stosowane zarówno do wykrywania pojedynczych
składników np. witaminy A, a także do mieszanin wieloskładnikowych np. witaminy A
oraz E [1].
Oznaczanie witamin rozpuszczalnych w wodzie
Cyjanokobalaminę (witamina B
12
) ekstrahuje się 50 mM buforu octanu sodu o pH równym
4,0 i temperaturze 100
°C przez 35 min, w obecności cyjanku sodu. Powstały ekstrakt należy
poddać oczyszczeniu w kolumnie powinowactwa immunologicznego. Odseparowaną
witaminę B
12
oznacza cię metodą HPLC z detektorem UV przy 361 nm w odwróconym
układzie faz. Eluent stanowi mieszanina wody z dodatkiem kwasu trifluorooctowego 0,025%
i acetonitrylu.
Chcąc równocześnie oznaczyć witaminę PP (nikotynamid), B
1
(tiaminę), B
2
(ryboflawina),
B
12
(cyjanokobalaminę), B
9
(kwas foliowy) i formy witaminy B
6
(pirydoksyna, pirydoksal,
pirydoksamin) w mleku dla niemowląt stosuje się wysokosprawną chromatografię cieczową.
Do rozdziału witamin stosuje się kolumnę C18. Mieszanina metanolu, wody (15:85, v/v),
5 mM kwasu oktanosulfonowego, 0,5% trietyloaminy, pH 3,6 stanowią fazę ruchomą. Przed
rozpoczęciem analizy chromatograficznej próbki należy poddać zakwaszeniu, strąceniu białek
oraz odwirowaniu strąconego osadu. Otrzymany supernatant filtruje się przez filtr
membranowy i analizuje według opisu przedstawionego powyżej. Podczas analizy
chromatograficznej witamin rozpuszczalnych w wodzie warunki procesu mogą być

23
następujące: kolumna C18, detektor spektrofotometryczny z matrycą diodową (DAD)
rejestrujący przy dwóch długościach fali: λ= 210 nm dla witamin B
5,
B
8
(inozytol) i B
12
oraz
λ= 275 nm dla witamin B
1
, B
2
, C, PP, B
6
, B
9.
Jako fazę ruchomą stosuje się mieszaninę
rozpuszczalników: acetonitryl (faza A), 0,025% wodny roztwór kwasy trifluorooctowego
o pH równym 2,6 (faza B).
Jedną z metod oznaczania witaminy C (zwanej też kwasem L-askorbinowym oraz kwasem
askorbowym) w produktach spożywczych jest wysokosprawna chromatografia cieczowa. Do
ekstrakcji witaminy C z próbek stałych oraz do rozcieńczania stosuje się rozcieńczone
roztwory kwasów z uwagi na to, że witamina C jest najbardziej stabilna w tym środowisku.
W tym celu używa się 2% kwasu szczawiowego, 3% kwasu metafosforowego (V), 8% kwasu
octowego lub 2% kwasu solnego. Metoda ta polega na oznaczeniu łącznej zawartości kwasu
L-askorbinowego
i
dehydroaskorbinowego.
W
wyniku
redukcji
kwasu
dehydroaskorbinowego za pomocą ditiotreitolu (DTT) otrzymywany jest kwas
L-askorbinowy. Witamina C oznaczana jest techniką wysokosprawnej chromatografii
cieczowej z użyciem kolumny RP-C18 i detektora spektrofotometrycznego UV przy długości
fali
λ= 254 nm.
Do jakościowego oznaczenia zawartości witaminy C wykorzystuje się technikę
chromatografii cienkowarstwowej. Roztwór kwasu L-askorbinowego będącego wskaźnikiem
i badaną próbkę (witamina C zawarta np. w owocach) należy nanieść na płytkę
chromatograficzną. Jako eluent można zastosować octan etylu. Chromatogram TLC należy
umieścić pod lampą UV, gdzie na tej samej wysokości będą widoczne dwie plamki, jedna
pochodząca od wzorca a druga od badanej próbki. Do analizy jakościowej wykorzystuje się
wartość współczynnika opóźnienia R
f
, który jest charakterystyczny dla danej substancji
w danych warunkach chromatograficznych, dlatego może służyć do jej identyfikacji [1].
W celu oznaczenia zawartości β-karotenu w surowcach spożywczych stosuje się techniki
chromatografii kolumnowej (metodą adsorpcyjną). Polega ona na wyodrębnieniu z badanego
materiału (np. marchew, szpinak, szczaw, pomidory) barwników karotenoidowych i rozdziale
ich aktywnych form metodą chromatografii adsorpcyjnej na kolumnie. Przed przystąpieniem
do rozdziału należy przygotować badaną próbkę przeprowadzając jej homogenizację z wodą
do konsystencji papki. Następnie ekstrahuje się ją acetonem i poddaje rozdzieleniu faz.
Ekstrakt eterowy poddaje się sączeniu przez warstwę bezwodnego Na
2
SO
4
i nanosi na
24
kolumnę chromatograficzną. Uzyskane pasmo karotenów eluuje się roztworem acetonu
w eterze do momentu uzyskania bezbarwnego eluatu [10].
Oznaczanie witamin rozpuszczalnych w tłuszczach
Oznaczanie witamin rozpuszczalnych w tłuszczach przeprowadza się techniką
wysokosprawnej chromatografii cieczowej z detekcją spektrofotometryczną lub
fluorymetryczną. Proces rozdziału witamin rozpuszczalnych w tłuszczach realizuje się
zarówno w normalnym, jak i odwróconym układzie faz. Warunki panujące podczas rozdziału
mieszanin witamin rozpuszczalnych w tłuszczach mogą być następujące (Tabela 3, 4):
Tabela 3. Przykłady układów NP-HPLC do oznaczania witamin rozpuszczalnych w
tłuszczach [1].
Kolumna
Wymiary [mm]
Faza ruchoma [v:v]
Długość fali [nm]
Polygosil
250 x 8
izooktan/butanol (99:1)
265
LiChrospher
250 x 4
n-heksan:propan-2-ol (99:1)
265
LiChrospher
250 x 4
n-heksan:propan-2-ol (98:2)
265
μPorasil
krzemionka
300 x 3,9
n-heksan:tetrahydrofuran:
propan-2-ol (98/1:1)
265
Tabela 4. Przykłady układów RP-HPLC do oznaczania witamin rozpuszczalnych w
tłuszczach [1].
Kolumna
Wymiary [mm]
Faza ruchoma [v:v]
Długość fali [nm]
Hypersil ODS, 5 μm
250 x 4,6
Metanol
265
LiChrospher 100 RP18,
5 μm
250 x 4,0
Metanol:woda (95:5)
265
Vydac 20TP 54
250 x 4,6
Metanol:woda (93:7)
265
25
Nucleosil C18, 5 μm
250 x 4,0
Acetonitryl:metanol
(70:30)
265
Zorbax ODS
250 x 4,6
Acetonitryl:metanol (95:5)
265
Dla większości przypadków proces chromatograficzny musi być poprzedzony zmydlaniem
badanego materiału, a następnie wyekstrahowaniem badanej witaminy za pomocą właściwej
ekstrakcji (Tabela 5).
Tabela 5. Przykłady odpowiednich warunków ekstrakcji i zmydlania stosowanych przy
oznaczaniu witamin rozpuszczalnych w tłuszczach [1].
Zmydlanie
Ekstrakcja
8 g tłuszczu, 100 cm
3
etanolu, 1 g
askorbinianu sodu, 0,04 g siarczku sodu,
12 g KOH, 50 cm
3
wody, 80°C przez 30 min.
n-heksan 3 x 100 cm
3
, przemywanie wodą
4 x100 cm
3
12 g tłuszczu, 30 cm
3
etanolu, 30 cm
3
metanolu, 0,1 g kwasu askorbinowego,
30 cm
3
50% KOH, 100°C przez 30 min.
eter dietylowy 2 x 100 cm
3
, przemywanie
wodą 4 x 50 cm
3
8 g tłuszczu, 100 cm
3
etanolu, 1 g kwasu
askorbinowego, 50 cm
3
50% KOH, 20°C
przez 2 h
mieszanina eteru naftowego i dietylowego
(1:1), 2 x 200 cm3, przemywanie wodą
4 x 50 cm
3
24 g tłuszczu, 90 cm
3
etanolu, 0,5 g
askorbinianu sodu, 30 cm
3
60% KOH, 100°C
przez 45 min pod chłodnicą zwrotną
eter dietylowy 1 x 150 cm
3
, 3 x 75 cm
3
,
przemywanie wodą 4 x 200 cm
3
Oznaczanie tokoferoli (formy witaminy E) w oleju słonecznikowym
Oznaczenie tokoferoli polega na wprowadzeniu do badanej próbki zawierającej olej
słonecznikowy, kwasu askorbinowego oraz roztworu KOH w etanolu. Proces zmydlania
prowadzi się w łaźni wodnej w temperaturze ok. 95°C. W kolejnym etapie witaminę E
ekstrahuje się eterem naftowym. Następnie połączone ekstrakty przemywa się wodą, a ślady
wody usuwa stosując bezwodny siarczan sodu. Przygotowany ekstrakt eterowy poddaje się
odparowaniu do sucha na odparowywaczu obrotowym. Otrzymaną próbkę należy rozpuścić
w fazie ruchomej, a następnie poddać analizie chromatograficznej metodą HPLC. Do
przeprowadzenia analizy można użyć układu HPLC z detektorem spektrofotometrycznym UV
(
λ= 292) oraz kolumnę C18 (250 x 4,6 mm). Fazę ruchomą stanowi mieszanina
rozpuszczalników: acetonitryl (faza A) i metanol (faza B). Rozdział przebiega z
zastosowaniem elucji izokratycznej: 80% fazy A i 20% fazy B [1].

26
Oznaczanie tokoferoli w nasionach roślin oleistych można oznaczyć również metodą
adsorpcyjną z zastosowaniem techniki cienkowarstwowej (TLC). Polega ono na
odseparowaniu tokoferoli od innych składników badanego materiału stosując zmydlanie
i ekstrakcję, a następnie naniesieniu odpowiedniej ilości ekstraktu na płytkę
chromatograficzną pokrytą adsorbentem i rozwijaniu w komorze chromatograficznej. Po
rozdziale prowadza się identyfikację składników w świetle UV. Przed naniesieniem ekstraktu
na płytkę chromatograficzną należy ją uprzednio przygotować. W tym celu przygotowuje się
mieszaninę żelu krzemionkowego G, wody oraz 0,004% wodnego roztworu soli sodowej
fluoresceiny i energicznie wstrząsa, a następnie powleka płytkę warstwą o grubości 0,25 mm.
Płytki powierzchniowo suche aktywuje się w temperaturze 130°C przez 1,5h. Przed
przystąpieniem do analizy chromatograficznej należy zmielić nasiona roślin oleistych
i przeprowadzić proces zmydlania w obecności pirogalolu, etanolu absolutnego oraz 60%
KOH. Zawartość próby poddaje się ekstrakcji mieszaniną eterów dietylowego i naftowego.
Następnie nanosi się próby na płytki chromatograficzne i rozwija chromatogram [10].
3. Chromatografia a jakość dodatków do żywności
Rozwój przemysłu spożywczego i stosowanie nowoczesnych technologii
spowodowały konieczność używania wielu dotychczas nie wykorzystywanych składników,
których dodatek do tradycyjnych surowców powoduje uzyskanie nowych cech produktu oraz
poprawienie jego jakości. Dodatki tego typu wprowadzone w procesie technologicznym do
podstawowych surowców roślinnych lub zwierzęcych, są określane jako substancje
dodatkowe, dodatki do żywności oraz dodatki funkcjonalne do żywności. Celem stosowania
dodatków do żywności jest [1]:
- wydłużenie okresu trwałości produktów przez ograniczenie i zapobieganie niekorzystnym
zmianom, wywołanym procesami biochemicznymi oraz zapewnienie bezpieczeństwa
produktu,
- zapobieganie zmianom jakości (barwy, smaku, zapachu, tekstury),
- ochrona składników decydujących o wartości odżywczej i dietetycznej produktów,
- zwiększenie atrakcyjności i dyspozycyjności produktów dla konsumentów,
- zwiększenie wydajności produkcji przez ograniczenie ubytków oraz przez substytucję,
- otrzymanie produktów nowego rodzaju, szczególnie dietetycznych oraz dla diabetyków.

27
Technologiczną klasyfikację dodatków do żywności można uszeregować w czterech
zasadniczych grupach, a w nich poszczególne kategorie zgodnie z określeniem funkcji
przyjętych przez Unię Europejską (Tabela 6).
Tabela 6. Kategorie dodatków do żywności [14].
Zapobiegające
zepsuciu
- konserwanty, kwasy, bufory,
- przeciwutleniacze, sekwestranty,
- stabilizatory, gazy (atmosfera kontrolowana)
Sensoryczne
- barwniki, nabłyszczające, kwaszące,
- słodziki, wzmacniające smakowitość, aromaty
Teksturotwórcze
emulgatory, przeciwzbrylające, skrobia modyfikowana,
spulchniające, stabilizatory, zagęszczające, zwiększające masę,
zwilżające, żelujące
Pomocnicze
enzymy, gazy wypierające, polepszacze mąki, pianotwórcze,
przeciwpieniące, rozpuszczalniki
3.1.
Kontrola jakości przeciwutleniaczy
Przeciwutleniacze, to substancje, które przedłużają trwałość żywności dzięki
zabezpieczeniu jej przed rozkładem (jełczenie, zmiana barwy) spowodowanym utlenianiem
pod wpływem tlenu z powietrza. Stosuje się je we względu na podatność niektórych
produktów żywnościowych na utlenianie [1, 11].
Zjawisko utleniania w produktach nietłuszczowych obserwujemy przy udziale
enzymów (oksydaz), które znajdują się w surowcu. Zapobiegamy temu zjawisku stosując
dezaktywację enzymów [11].
Jełczenie tłuszczów pogarsza cechy sensoryczne oraz wartość odżywczą żywności.
Rozrywanie łańcuchów węglowych prowadzi do powstawania niskocząsteczkowych
produktów: węglowodorów, aldehydów, ketonów, kwasów, estrów, lak tonów, alkoholi
i estrów. Przy długim utlenianiu tłuszczów mogą powstać również substancje toksyczne, jak
również wolne rodniki. Produkty utleniania lipidów mogą niszczyć biologicznie czynne
białka, działać mutagennie na kwasy tłuszczowe oraz destrukcyjnie na karotenoidy
i witaminę A. Jełczeniu podlegać może również żywność o stosunkowo niskiej zawartości
tłuszczów, ale dobrze rozwiniętej powierzchni (mąka) [11].

28
Główną przyczyną stosowania przeciwutleniaczy jest zapobieganie przemiany
nienasyconych substancji tłuszczowych. Przemiany te zachodzą z lub bez udziału enzymów
[11].
Aby zahamować proces utleniania podejmuje się różne działania np.: pakuje się
produkty pod próżnią w atmosferze gazu obojętnego (azotu). Jednak dla niektórych
produktów jest to niewystarczające, więc wtedy stosuje się przeciwutleniacze naturalne,
syntetyczne lub synergenty [1, 12].
Przeciwutleniacze naturalne występują w olejach roślinnych: tokoferole, z których
największe działanie przeciewutleniające posiada δ-tokoferol (zapobiega jełczeniu
nienasyconych kwasów tłuszczowych oraz związków aromatycznych). Naturalnymi
przeciwutleniaczami są również: flawonoidy i fenylokwasy, występujące w owocach,
liściach, nasionach, przyprawach [1, 12].
Przeciwutleniacze syntetyczne wśród nich wyróżniamy estry: propylowy, ortylowy
i dodecylowy kwasu galusowego oraz butylohydroksyanizol i butylohydroksy toluen. Używa
się je do utrwalania tłuszczów smażalniczych oraz utrwalenia smażonego produktu (np.
chipsy, frytki, pączki) [1, 12].
Synergenty, ich rolą jest wspomaganie i przedłużanie działania przeciwutleniaczy,
aktywują funkcje przeciwutleniacza i kompleksują jony metali ciężkich, które katalizują
procesy utleniania. Tworzą one trwałe kompleksy z jonami metali. Wyróżniamy wśród nich:
wersenian wapniowo-sodowy EDTA, kwasy: cytrynowy, winowy, jabłkowy oraz difosforany
(V), aminokwasy i peptydy [1, 12].
Do analizy substancji przeciwutleniających używa się metody chromatograficzne.
Wykorzystuje się chromatografię bibułową oraz cienkowarstwową. Zaletami tych metodą są:
niskie koszty wyposażenia oraz prostota analizy. Szybsza jest chromatografia
cienkowarstwowa, jednak obserwuje się gorszą powtarzalność. Chromatografia bibułowa
w odwróconym układzie faz jest często stosowana ze względu na różną polarność
syntetycznych
przeciwutleniaczy.
W
chromatografii
bibułowej
wykorzystywane
są rozpuszczalniki: roztwory metanolu, etanolu, dioksanu, octanu etylu i metylu, aceton,
tetrachlorek węgla oraz ich mieszaniny. Za to reagentami, które wywołują chromatografy są:
kwas molibdenofosforowy lub azotan (VI) sodu w obecności amoniaku [11].
W chromatografii cienkowarstwowej stosuje się modyfikowane żele krzemionkowe,
acetylowaną celulozę, tlenek glinu lub poliamidy jako fazę stacjonarną. Jako rozpuszczalniki
stosuje się wcześniej wymienione przy chromatografii bibułowej oraz benzen, ksylen,
chloroform, propanol, glikol polietylenowy oraz ich mieszaniny. Substancjami wywołującymi

29
są: kwas fosforomolibdenowy, kwas sulfanilowy, azotan (V) srebra, siarczan (VI) żelaza (III),
odczynnik Folin-Ciocalteau oraz odczynnik Gibba [11].
Z analizie przeciwutleniaczy wykorzystuje się również chromatografię gazową, która
jest metodą z dużą selektywnością, czułością i małą czasochłonnością. W tym rodzaju
chromatografii wykorzystuje się kolumny nisko polarne oraz polarne, które termostatowane
są w szerokim zakresie temperatur. Gazami nośnymi mogą być: azot, argon i hel.
Wykorzystuje się detektory płomieniowo-jonizacyjne, cieplno-przewodnościowe oraz
wychwytu elektronów. Literatura donosi również o wykorzystaniu technik sprzężonych GC-
IR i GC-MS [11].
Wysokosprawna chromatografia cieczowa posiada szerokie zastosowanie w analizie
przeciwutleniaczy. Pozwala na szybki rozdział i analizę ilościową nielotnych i termicznie
labilnych związków. Metodą tą można oznaczać pojedyncze oraz mieszaniny
przeciwutleniaczy. Analizę można przeprowadzać w normalnym lub odwróconym układzie
faz, a także z zastosowaniem chromatografii par jonowych, jonowymiennej lub micelarnej.
Wykorzystuje się szeroką gamę faz stacjonarnych: BondaPak 18, z wypełnieniem Corasil II,
LiChrosrb RP18, NovaPak C19, Spherisorb i Ultraphere ODS, LiChrosrb NH
2
i inne,
zarówno w elucji izokratycznej, jak i gradientowej. Najczęściej wykorzystuje się fazy, gdzie
kolumna wypełniona jest złożem C18. Jako eluaty przy elucji gradientowej stosuje się:
cykloheksan, tetrahydrofuran, n-heptan, dichlorometan, metanol, acetonitryl, dioksan, octan
amonu, propanol oraz różne bufory i ich mieszaniny, m.in. mieszanina metanolu i wody
(70:30, v/v) lub acetonitrylu i wody (68:32, v/v). Detekcja odbywa się w ultrafiolecie
w zakresie od około 235 nm do 360 nm. Jednak można również wykorzystać detektory:
fluorymetrycznego, amperometrycznego, z matrycą diodową oraz elektrochemiczny [1, 11].
Do oznaczania przeciwutleniaczy w gumie do żucia m.in. galusanu propylu,
trihydroksybutyrofenonu, butylohydroksyanizolu, palmitynianu askorbylu, stosuje się metodę
HPLC z detektorem DAD. Ekstrakcję acetonitrylem z zastosowaniem ultradźwięków stosuje
się przed właściwą analizą. W analizie wykorzystuje się kolumnę wypełnioną C18. Fazą
ruchomą zazwyczaj stosuje się wodę z dodatkiem kwasu siarkowego – faza A oraz acetonitryl
– faza B, przepływ fazy ruchomej 0,5 ml/min. Proces rozdzielania wykonuje się stosując
elucję gradientową [1].
Przeciwutleniacze fenolowe oznacza się za pomocą chromatografii cieczową
z detekcją UV. Przed właściwą analizą próbkę (oleju) rozcieńcza się mieszaniną izopropanolu
i heksanu (4:1, v/v). Do analizy wykorzystuje się kolumnę C18 w odwróconym układzie faz,

30
wykorzystując mieszaninę wody/acetonitrylu/metanolu/izopropanolu jako fazy ruchomej.
Oznaczenie wykorzystuje się z zastosowaniem elucji gradientowej [1].
Przeciwutleniacze fenolowe można również oznaczać za pomocą chromatografii
gazowej z detektorem płomieniowo-jonizacyjnym. Do około 30-60 mg próbek handlowych,
czyli np. masła, oleju, margaryny, sera, majonezu dodaje się 1 ml eteru dietylowego.
Do w ten przygotowany sposób próbek dodaje się wzorca wewnętrznego (8-chinolinol)
i następnie analizuje próbki [1].
3.2. Kontrola jakości konserwantów
Konserwanty, czyli substancje konserwujące, związki mające na celu zmniejszanie,
względnie całkowite zahamowanie procesów biologicznych powodowaniem mikroflory lub
enzymów tkankowych, które są odpowiedzialne za psucie się lub obniżanie jakości żywności.
Charakterystyczną cechą jest hamowanie rozwoju mikroorganizmów albo ich niszczenie przy
niskich dawkach, najczęściej ok. 0,1% [1, 12, 13].
Podczas przechowywania żywności zachodzą w niej zmiany, na ogół niepożądane,
są to zmiany:
fizjologiczne – na skutek działania enzymów tkankowych związanych
z procesami dojrzewania, oddychania i transpiracji, takie zmiany zachodzą
w surowcach roślinnych,
chemiczne – spowodowane reakcjami chemicznymi składników żywności
między sobą lub ze składnikami środowiska,
fizyczne – zmiany struktur fizycznych samego produktu lub z oddziaływania
czynników fizycznych otoczenia,
mikrobiologiczne – powodowane przez działalność drobnoustrojów [13].
Mechanizm działania substancji konserwujących na drobnoustroje jest złożony.
Zależny jest od wielu czynników, m.in. rodzaj i liczba drobnoustrojów, skład i właściwości
żywności. Najważniejszą rolę w tym mechanizmie odgrywa hamowanie lub blokowanie
procesów biochemicznych w komórce drobnoustroju Dzieje się to przez:
zmianę przepuszczalności ścian komórkowych lub błon cytoplazmatycznych,
ingerencję w mechanizm genetyczny,
hamowanie aktywności lub inaktywację niektórych enzymów biorących udział
w metabolizmie wewnątrzkomórkowym,

31
hamowanie syntezy DNA, białka i innych niezbędnych składników
odżywczych komórki,
inaktywowanie składników niezbędnych do rozwoju drobnoustrojów,
gwałtowne
aktywowanie
enzymów
powodujących
rozkład
wysokoenergetycznych nukleotydów [1, 12, 13].
Wyróżniamy dwie grupy konserwantów: antyseptyki – związki syntetyczne o prostej
budowie pochodzenia pozamikrobiologicznego, mogą posiadać swoje odpowiedniki
w przyrodzie, stosuje się je w ilościach poniżej 0,2%, antybiotyki – posiadają skomplikowaną
budowę oraz działają w bardzo małych dawkach (od kilku do kilkuset ppm), wytwarzane są
przez drobnoustroje [1, 12, 13].
Efektywność działania konserwantów zależy od ich aktywności w stosunku do rodzaju
drobnoustrojów, warunków środowiska, stężenia jonów wodorowych, temperatury, składu
chemicznego produktów, obecności substancji zmniejszających aktywność wody oraz pH
środowiska. Największe znaczenie ma oddziaływanie pH. Im niższe pH, tym dodatki
konserwujące o charakterze słabych kwasów lub ich soli wykazują silniejsze działanie, gdyż
najsilniej działają w stanie niezdysocjowanym, a wraz ze wzrostem pH wzrasta stopień ich
dysocjacji. Bardzo często wykorzystuje się dwa lub nawet kilka konserwantów, które
wykazują efekt synergistyczny, dzięki czemu przy mniejszych dawkach konserwantów
uzyskuje się podobny efekt [1, 12, 13].
Związek do utrwalania żywności powinien: być nietoksyczny; łatwo ulegać
metabolizmowi w organizmie człowieka i nie odkładać w tkance tłuszczowej; być
niezawodny w szerokim spektrum hamowania bakterii, drożdży i pleśni; być rozpuszczalny
w wodzie; być obojętny chemicznie wobec składników żywności; być trwały na procesy
technologiczne, którymi jest poddawany produkt; być tani [1, 12].
Chemiczne konserwanty powinny mieć charakter pomocniczy i stosowane powinny
być w najniższych uzasadnionych stężeniach. Należy dążyć do stosowania metod fizycznych,
takich jak: pasteryzacja, sterylizacja, mrożenie czy suszenie, oraz metod biologicznych
np. ukwaszanie [13].
Najważniejsze konserwanty: kwas benzoesowy, kwas sorbowy, ditlenek siarki,
niazyna, azotan (III) sodu i potasu, azotan (V) sodu i potasu, estry kwasu
p-hydroksybenzoesowego oraz ich sole sodowe (parabeny) [1, 12, 13].
Do jakościowej i ilościowej analizy konserwantów (kwas sorbowy, kwas benzoesowy)
stosuje się wysokosprawną chromatografię cieczową w odwróconym układzie faz (RP, C18).

32
Fazami ruchomymi, które stosujemy w analizie to mieszaniny: woda/metanol/kwas octowy
(69:28:3, v/v/v), metanol/bufor octanu amonu pH 4,6 (50:50, v/v) [1, 12].
W oznaczaniu kwasu benzoesowego i sorbowego metodą HPLC w dżemie, przed
wykonaniem właściwej analizy należy usunąć białka i tłuszcze, w tym celu dodaje się
metanol. Po strąceniu, osad usuwa się przez odwirowanie, a supernatant analizuje się metodą
HPLC. Rozdzielanie wykonuje się w warunkach izokratycznych z kolumną C18 i eluatem:
mieszanina buforu octowego i metanolu. Faza ruchoma jest monitorowana przy 235 nm [1].
Próbki mięsa ekstrahuje się etanolem, następnie analizuje się chromatografię cieczową
z detektorem UV przy długości fali 254 lub 280 nm. Fazą stacjonarną jest kolumna
wypełniona złożem C18, faza ruchoma: mieszanina buforu octanu amonu i metanolu.
Do rozdzielania kwasu benzoesowego i sorbowego stosowana jest elucja gradientowa [1].
W metodzie chromatografii gazowej kwasy tj.: sorbowy, benzoesowy i salicylowy,
uprzednio się metyluje, ponieważ estry metylowe tych kwasów są bardziej lotne niż wolne
kwasy [12].
Przy analizie kwasu benzoesowego i sorbowego metodą GC, próbkę łączy się z wodą,
kwasem siarkowym (VI) i eterem, następnie wytrząsa się mieszaninę. Potem odwirowuje się
próbkę, a warstwę eteru przenosi się do kolby i ekstrahuje dwukrotnie NaOH i NaCl.
Ekstraktu zakwasza się roztworem HCl do pH<1, dodaje się dichlorometanu i bezwodnego
Na
2
SO
4
, następnie odparowuje się do sucha. Taką próbkę poddaje się reakcji derywatyzacji,
a następnie poddaje się analizie metodą GC-FID [1].
Estry kwasu p-hydroksybenzoesowego oraz ich sole sodowe oznaczamy
wykorzystując wysokosprawną chromatografię cieczową w odwróconym układzie faz.
Eluentem w tym wypadku jest acetonitryl z wodą i kwasem octowym lub acetonitryl
z octanem amonu oraz metanol z wodą. Wykorzystuje się detektor UV [13].
Azotany (III) i (V) oznacza się metodą HPLC z zastosowaniem kolumny
jonowymiennej lub w odwróconym układzie faz (kolumna RP8) z detekcją przy długości fali
205 nm [13].

33
3.3. Środki słodzące
Zastępowanie sacharozy niskoenergetycznymi związkami syntetycznymi o dużej sile
słodzącej jest spowodowane względami dietetycznymi. Pojęcie słodzik obejmuje zarówno
substancje słodzące pochodzenia naturalnego, jak i syntetyczne związki, charakteryzujące się
intensywnym słodkim smakiem. Słodziki zapewniają słodki smak bez dostarczania energii
(kalorii) lub z bardzo małą ich ilością. Większość z nich nie jest trawiona przez organizm i
dlatego nie dostarczają kalorii. Słodkość substancji słodzących określa się jako stosunek
intensywności słodkości jednostki wagowej danej substancji do słodkości sacharozy, którą
przyjmuje się za 1. Substancje słodzące dzielą się na dwie grupy: półsyntetyczne, o niezbyt
dużej intensywności słodkości (lakitol, izomalt, mannitol, sorbitol) oraz syntetyczne, silnie
słodzące (cyklaminiany, aspartam, sacharyna). Półsyntetyczne słodziki to alkohole cukrowe
otrzymywane przez redukcję odpowiednich cukrów, dlatego posiadają pewną wartość
odżywczą [15]. W tabeli 7 zebrano zalety i wady stosowania słodzików w żywnieniu:
Tabela 7.
Słodziki, a żywienie.
ZALETY
WADY
Niska lub żadna wartość kaloryczna
Odczuwanie metalicznego posmaku
Większa siła słodząca słodzików
syntetycznych w porównaniu do cukru –
mniejszy ich dodatek pozwala uzyskać taką
samą słodkość (względy finansowe)
Zakaz spożywania niektórych słodzików
przez dzieci i kobiety ciężarne
Brak wpływu na zęby w postaci próchnicy
Zakaz spożywania produktów bogatych w
aspartam przez chorych na fenyloketonurię
Niskokaloryczne słodziki pozwalają uzyskać
słodki smak bez obniżania poziomu cukru we
krwi
Możliwość wywołania biegunek po
nadmiernym ich spożyciu
Łatwa kontrola diety cukrzyków
Rakotwórcze właściwości niektórych
substancji słodzących (dane sprzeczne)
Technika HPLC jest najczęściej stosowana do oznaczania syntetycznych substancji
sładzących. Za jej pomocą można oznaczyć kilka substancji podczas jednej analizy.
Rozdzielenie wykonuje się w układzie faz odwróconych z detekcją spektrofotometryczną
(długość fali 220 nm). Przed wykonaniem analizy właściwej próbkę należy odpowiednio

34
przygotować. W przypadku produktów klarownych (Tonic) badaną próbkę odgazowuje się w
łaźni ultradźwiękowej i rozcieńcza 10-krotnie wodą dejonizowaną. Uzyskany roztwór
przesącza sie przez filtr membranowy o wielkości porów 0,45 μm i poddaje analizie metodą
HPLC. Gdy badany napój zawiera barwniki, czy też substancje smakowo-zapachowe, próbkę
po odgazowaniu w łaźni ultradźwiękowej oczyszcza się metodą ekstrakcji do fazy stałej.
Kolumienkę ze złożem C18, przemywa się metanolem, a następnie buforem octan sodu/kwas
octowy (pH 4,5). Na tak przygotowaną kolumienkę wprowadza się około 10 ml próbki. Po
usunięciu zanieczyszczeń syntetyczne substancje słodzące eluuje się metanolem. Eluat
odparowuje się do sucha, a następnie rozpuszcza w fazie ruchomej. Przed analizą próbkę
przesącza się przez filtr membranowy i analizuje metodą HPLC. W przypadku produktu,
który zawiera naturalne wyciągi owocowe i warzywne, oczyszczanie wykonuje się za pomocą
roztworów Carreza I (K
4
[Fe(CN)
6
] · 3 H
2
O) i Carreza II (ZnSO
4
· 7 H
2
O). Następnie napój
sączy się dwukrotnie: przez sączek bibułowy i sączek membranowy (wielkość porów 0,45
μm) [1, 2].
Do analiz wykorzystuje się zestaw HPLC-UV (λ = 220 nm) wyposażony w kolumnę
C18 (150 x 4,6 mm). Jako fazę ruchomą stosuje się układ rozpuszczalników: acetonitryl (faza
A) i bufor octan sodu/kwas octowy (faza B). Rozdzielenie prowadzi się z zastosowaniem
elucji gradientowej, przepływ fazy ruchomej - 0,8 cm
3
/min. Do rozdzielenia syntetycznych
substancji słodzących można zastosować również kolumnę typu RP i mieszaninę buforu
fosforanowego (0,0125 mol/dm
3
, pH 3,5) i acetonitrylu w stosunku 90:10 (v/v) [5].
Przebieg procesu oznaczania słodzików metodą HPLC-MS obrazuje rysunek 5.
Rysunek 5. Przebieg procesu HPLC-MS oznaczania substancji słodzących [15].
odważenie
próbki i jej
homogenizacja
rozpuszczenie
próbki /
ekstarkcja
analitów
oczyszczenie
ekstraktu
rozdzielanie
analitów
detekcja
analitów

35
3.4. Związki zapachowe
Substancje zapachowe żywności to grupa kilku tysięcy związków, należących do
wielu klas. Związki te są obecne w produktach i surowcach w bardzo zróżnicowanych
stężeniach i liczbie. Liczba związków zapachowych identyfikowanych w żywności na
przestrzeni ostatnich 40 lat zwiększyła się 10-krotnie od ok. 600 na rok 1960 do ok. 6000 na
rok 1995 [16]. Zawdzięczamy to głównie postępowi technik chromatograficznych.
Kształtowanie zapachu jest procesem dynamicznym. W wyniku działania enzymów
powstaje aromat określany jako pierwotny. W rezultacie przemian termicznych i działalności
mikroorganizmów powstają związki tworzące aromat wtórny. Drogi tworzenia związków
lotnych żywności obejmują zarówno reakcje chemiczne, jak i enzymatyczne. Obok
pożądanych zmian w aromacie produktu mogą pojawiać się także zmiany niepożądane – jako
wynik procesów oksydacyjnych, hydrolitycznych, degradacji termicznej i wielu innych
przemian. Z punktu widzenia konsumenta związki odpowiedzialne za obcy zapach żywności
odgrywają niebagatelne znaczenie. Próg wyczuwalności sensorycznej, czyli najniższe
stężenie, w którym można wyczuć dany związek, decyduje o jego wpływie na aromat danego
surowca lub produktu. Zarówno więc bezwzględna zawartość związku, jak i jego próg
wyczuwalności sensorycznej są istotne w charakterystyce zapachu produktu. W celu
powiązania tych wartości wprowadzono pojęcie wartości aktywności aromatu OAV (ang.
Odor Activity Value), będące ilorazem stężenia substancji do progu jej wyczuwalności
sensorycznej. Zapach związku zależy od budowy przestrzennej cząsteczki i bardzo często
nieznaczne różnice w budowie sferycznej związków powodują ich zupełnie odmienną
percepcję. Na rodzaj i intensywność zapachu wpływa też stężenie danego związku. Często
związki występujące w śladowych ilościach (nawet na poziomie ng/l) wywierają większy
wpływ na właściwości sensoryczne produktów spożywczych niż te, które występuję w
wysokich stężeniach (rzędu setek mg/l) [16].
3.4.1. Chromatografia gazowa - olfaktometria
Bardzo istotną techniką, która znajduje zastosowanie tylko w analizie związków
zapachowych, jest połączenie chromatografii gazowej z olfaktometrią (GC-O) [17, 18, 19].
Identyfikacja najważniejszych związków zapachowych w żywności polega na
wyselekcjonowaniu spośród wielu związków lotnych tych, które decydują o zapachu.
Narzędziem do identyfikacji tych związków musi być ludzki nos, dlatego też rolę detektora w
GC-O pełni przeszkolona grupa osób lub zespół osób oceniających. Wąchanie analitów jest
36
możliwe dzięki obecności specjalnie skonstruowanej przystawki (portu olfaktometrycznego)
zamontowanej równolegle z konwencjonalnymi detektorami, np. płomieniowo-jonizacyjnym
FID (rysunek 6).
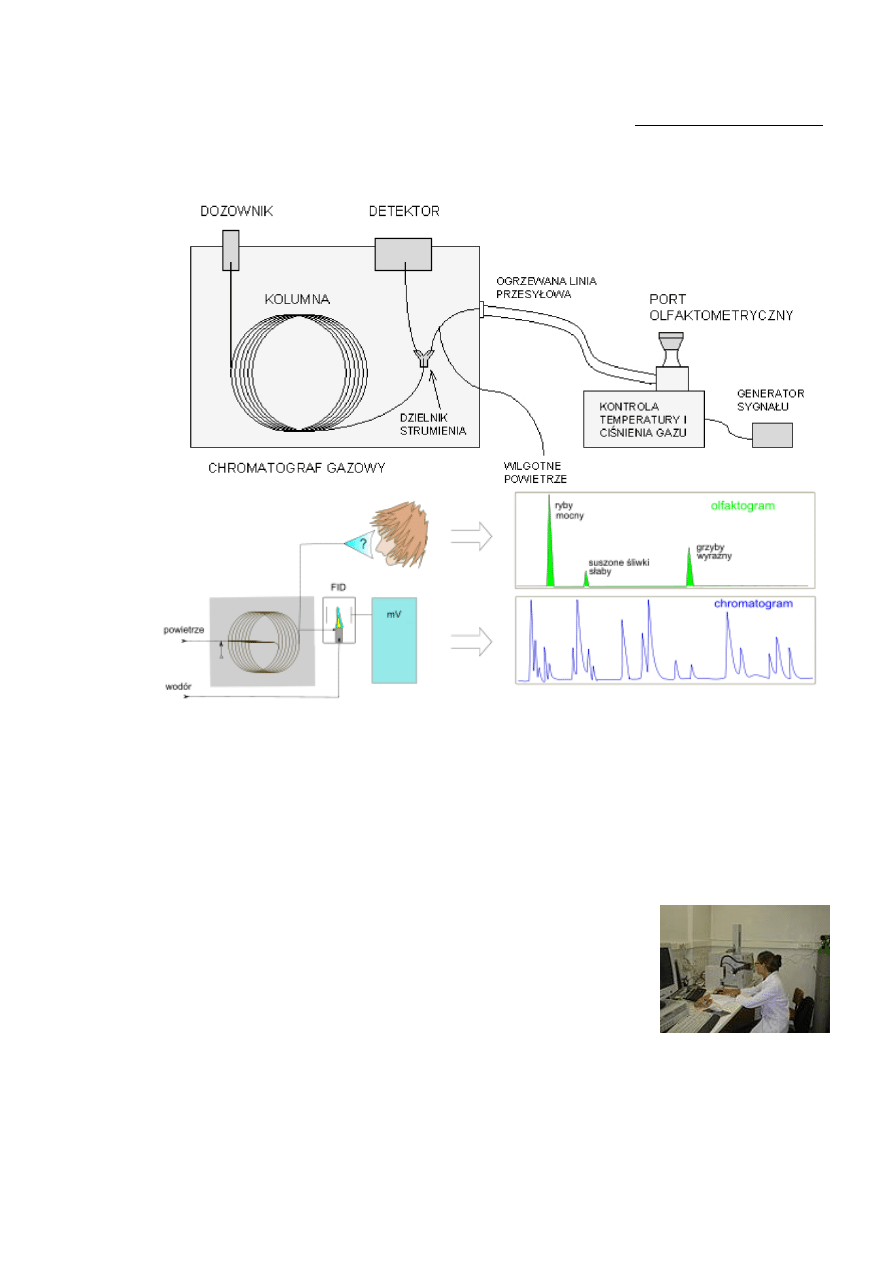
Rysunek 6. Schemat chromatografu gazowego z detektorem olfaktometrycznym [18].
Strumień eluatu z kolumny po przejściu przez odpowiednio skonstruowaną linię przesyłową
jest wąchany w szklanym lub teflonowym stożkowym porcie dopasowanym do kształtu nosa.
Linia przesyłowa jest ogrzewana, aby zapobiec kondensacji trudno lotnych analitów na
ściankach kapilary. Jednocześnie, aby uniknąć wysuszenia śluzówki nosa osoby oceniającej,
co mogłoby powodować dyskomfort, zwłaszcza w czasie długich
analiz, do eluatu doprowadzany jest gaz pomocniczy w postaci
wilgotnego powietrza. Linia transferowa musi być na tyle długa, by
zapewnić wygodną siedzącą pozycję oceniającego w czasie detekcji
i uniknąć dyskomfortu związanego z bliskim sąsiedztwem gorących
elementów chromatografu. Jeżeli analizowany ekstrakt jest wystarczająco skoncentrowany,
niekiedy możliwy jest podział eluatu na kilka strumieni i jednoczesna detekcja w kilku

37
równolegle podłączonych portach olfaktometrycznych dokonywana przez kilka osób
jednocześnie. Uzyskane wyniki są bardziej zgodne [17, 18].
Oznaczanie substancji zapachowych z wykorzystaniem technik instrumentalnych
składa się z dwóch etapów. Szczególnie ważna jest pierwsza faza analizy, czyli izolacja
analitów z matrycy. Kluczowym krokiem jest dobór odpowiedniej metody przygotowywania
próbki. Najkorzystniejsze jest stosowanie takich metod ekstrakcji, które obrazują raczej
uwalnianie lotnych składników z matrycy, niż pozwalają na oznaczenie całkowitej zawartości
tych składników i które mogą być dzięki temu łatwiej skorelowane z wynikami analizy
sensorycznej. Do metod tego typu należą metody wykorzystujące analizę fazy
nadpowierzchniowej, w tym zarówno metody statyczne, jak i dynamiczne, przy czym ze
względu na możliwość wzbogacenia analitów, znacznie częściej stosowane są metody
dynamiczne [18].
Wygląd olfaktogramów ściśle zależy od procedury izolacji analitów oraz od
stosowanej metody ilościowej. Istnieje kilka metod ilościowego oznaczania intensywności
zapachu i względnego wpływu poszczególnych analitów na zapach próbki. Metody te można
podzielić na trzy grupy, różniące się zasadą oznaczania (rysunek 7).
Rysunek 7. Metody ilościowej analizy w GC-O [19].
Krótka charakterystyka przedstawionych na rysunku metod [17, 19]:
- metody częstości detekcji, zespół oceniający analizuje tę samą próbkę i obliczany jest
procent osób, które wyczuły związek zapachowy w określonym czasie retencji; związki, które
wyczuwane są częściej od innych, uznawane są za mające najistotniejszy wpływ na zapach
danej próbki,
GC-O
metody
częstości
detekcji
metody rozcieńczania
do progu
wyczuwalności
CHARM
AEDA
metody bezpośredniej
intensywności
metody
późniejszej
oceny
intensywności
metody
jednoczesnej
oceny
intensywności
metoda
rozpiętości
palców

38
- metody rozcieńczenia do progu wyczuwalności, ilościowy opis potencjału zapachowego
danego związku (bazą jest stosunek jego stężenia w próbce do progu jego wyczuwalności
sensorycznej w powietrzu), przygotowana zostaje seria różnych rozcieńczeń ekstraktu
związków zapachowych i następuje ocena każdej próbki z wykorzystaniem detektora
zapachowego; AEDA pozwala zmierzyć największe rozcieńczenie próbki, przy którym
zapach badanego związku jest jeszcze wyczuwalny, obliczamy współczynnik rozcieńczenia
zapachu (FD); CHARM wymaga ponadto określenia czasu trwania wrażenia zapachowego w
eluacie z kolumny i pozwala na stworzenie swego rodzaju piku chromatograficznego,
- metody bezpośredniej intensywności, pomiar intensywności bodźca węchowego oraz czas
jego trwania, stosując różnego rodzaju skale do ilościowego pomiaru natężenia zapachu
eluującego związku; może być to pomiar pojedynczy uśredniony czasowo, rejestrowany po
elucji analitu (metody późniejszej oceny intensywności), bądź pomiar dynamiczny, w którym
pojawienie się zapachu, maksimum jego intensywności i zanik rejestrowany jest w sposób
ciągły (metoda rozpiętości palców); uzyskany olfaktogram przedstawia zależność
intensywności zapachu w funkcji czasu retencji (wysokość piku – maksymalne natężenie
zapachu analitu, szerokość piku – długość bodźca zapachowego).
Poniżej znajdują się przykłady zastosowań chromatografii gazowej z detekcją
olfaktometryczną w analizie żywności [19]:
- tworzenie profili zapachowych wędlin, serów, napojów alkoholowych, charakterystycznych
dla danego kraju i regionu,
- poznanie procesu powstawania i kształtowania aromatu produktów spożywczych (np.
wędliny) oraz wpływ czynników takich jak np. rodzaj użytych przypraw na zapach,
- kontrola procesu technologicznego produkcji żywności,
- identyfikacja związków odpowiedzialnych za niepożądane zapachy i wykrycie przyczyny
ich pojawiania się w końcowym produkcie (kontrola jakości żywności),
- ocena dojrzałości owoców i warzyw, sposobu ich pakowania i przechowywania,
- analiza porównawcza aromatu owocu, jego soku i olejku aromatycznego.

39
3.5. Barwniki
3.5.1. Definicja i podział
Wśród licznej grupy dodatków do żywności wymienić można różnego rodzaju
barwniki. Nie stanowią one żadnej wartości odżywczej, a wpływają jedynie na poprawę
walorów estetycznych produktu. Barwniki mogą być pochodzenia naturalnego lub mogą być
syntezowane, te dzieli się na organiczne i nieorganiczne. Barwniki naturalne to najczęściej
barwniki pochodzenia roślinego, pozyskiwane z roślin tropikalnych, glonów, owoców,
warzyw. Najbardziej znane z tej grupy barwników to karoteny (E160), chlorofil (E140),
antocyjany, kurkumina. Syntetyczne barwniki organiczne to głównie związki azowe,
występujące w postaci proszku, granulatu, pasty, roztworu wodnego. W Polsce,
dopuszczonych do barwienia żywności jest 8 związków chemicznych, są to : żółcień
chinolinowa (E104), azorubina (E122), żółcień pomarańczowa (E 110), czerwień koszenilowa
(E124), błękit patentowy (E 131), indygotyna (E 132), czerń brylantowa (E 151), fiolet
metylowy. Barwniki te są tanie, trwałe i odporne na warunki środowiska. Aby uniknąć
maskowania wad żywności za pomocą syntetycznych barwników, wprowadzono ograniczenia
w wykorzystywaniu ich w przemyśle żywności [20].
3.5.2. Metody oznaczania barwników
Zawartość barwników w produktach żywnościowych można określić na wiele różnych
sposobów. Najczęściej strukturę nowych zsyntezowanych barwników, a także do ustalenia ich
zanieczyszczeń wykorzystuję się magnetyczny rezonans jądrowy (NMR). Popularnymi
metodami oznaczania barwników są także metody chromatograficzne : chromatografia
cienkowarstwowa oraz wysokosprawna chromatografia cieczowa [1].
3.5.2.1. Chromatografia cienkowarstwowa
W tej metodzie fazę stacjonarną na ogół stanowi celuloza oraz żel krzemionkowy. W
przypadku tej pierwszej, jako układ rozdzielający należy zastosować mieszaninę cytrynianu
sodu, amoniaku oraz metanolu. Gdy stosuję się żel krzemionkowy, wymagany jest inny układ
: octan etylu, etanol, dietyloamina, woda [1].

40
3.5.2.2. Wysokosprawna chromatografia cieczowa
Wykazano, że najlepszy rozdział barwników z zastosowaniem wysokosprawnej
chromatografii cieczowej, uzyskuje się z zastosowaniem odwróconego układu faz. Fazę
stacjonarną powinno stanowić złoże C18 , a fazę ruchoma mieszanina izopropanolu i wody
[1].
4. Chromatografia w kontroli zanieczyszczeń żywności
W żywności mogą być obecne zanieczyszczenia toksyczne dla człowieka - szkodliwe
produkty metabolizmu, substancje wchłonięte ze środowiska przez rośliny czy zwierzęta,
pozostałości nawozów, pestycydów, związki stosowane w leczeniu zwierząt, substancje
powstające w skutek obróbki i wprowadzane w procesie technologicznym. Szczególnie
niebezpieczne dla zdrowia są metale ciężkie, pestycydy, wielopierścieniowe węglowodory
aromatyczne, dioksyny, mykotoksyny. [21]. Innym źródłem zanieczyszczeń są substancje
migrujące z opakowań do żywności. Najczęściej stosowane są opakowania szklane
(najbezpieczniejsze), papierowe i z tektury oraz z tworzyw sztucznych (największe ryzyko).
W opakowaniach z tworzyw sztucznych polimery są uznawane za nietoksyczne
nie migrują ze względu na duże rozmiary cząsteczek. Zagrożenie jednak wynika
z obecności monomerów i środków pomocniczych takich jak antyutleniacze i stabilizatory
UV (pochodne fenoli, tioestry, związki trójwartościowego fosforu), środki antystatyczne
(pochodne amin, alifatyczne sulfoniany), plastyfikatory (poliestry, PVC, estry kwasu
ftalowego), środki poślizgowe (amidy nienasyconych kwasów tłuszczowych, alkiloaminy)
oraz rozpuszczalniki z farb i lakierów. Niezbędne jest zatem monitorowanie zanieczyszczeń
w surowcach i gotowych produktach, co wymaga odpowiednich metod analitycznych.
Opakowania przeznaczone do kontaktu z żywnością muszą spełniać określone wymagania
sanitarno- higieniczne. Istotne jest określenie migracji globalnej, czyli sumy wszystkich
substancji przenoszonych do żywności z opakowania oraz migracji specyficznej (SML)
określającej przeniesienie konkretnego składnika [22, 23].

41
Analiza zanieczyszczeń metodami chromatograficznymi
Techniki
wykorzystywane
muszą
charakteryzować
się
dużą
czułością
i selektywnością, a przy tym ekonomicznością i dobrą szybkością oznaczeń. Metodą szeroko
wykorzystywaną jest chromatografia często stosowana w połączeniu z innymi technikami.
Ze względu na złożoność matrycy i niewielkie stężenia oznaczanych zanieczyszczeń
przed przystąpieniem do właściwej analizy niezbędne jest odpowiednie przygotowanie
próbki.

42
Tabela 8. Przykłady zanieczyszczeń żywności [1, 22, 24, 25, 26, 27].
Budowa
Przykłady
Występowanie
Właściwości
Metoda
chromatograf.
Mi
ko
toksyny
Aflatoksyny
Ochratoksyna
Patulina
Fumonizyny
Deoksyniwalenol
Zearalenon
- głównie w zbożu i jego przetworach, orzechach,
przyprawach, kukurydzy, kawie, kakao, herbacie,
suszonych owocach, winie, mleku
- powstają jako produkty wtórnego metabolizmu grzybów
(pleśni)
- tworzą się w czasie wegetacji, zbioru lub
nieprawidłowego magazynowania
- silnie toksyczne, efekt toksyczny zależy
od rodzaju mikotoksyny i dawki
- długotrwałe narażenie: przewlekłe
choroby w tym nowotwory nerek i
wątroby
- jednorazowa duża dawka: ostre zatrucie
- zapobieganie: należy chronić produkty
przed wilgocią, zapewnić odpowiednie
warunki przechowywania i produkcji,
można stosować dodatek środków
grzybobójczych
TLC
HPLC
GC
GC-MS
LC-MS
HPLC-RP (FLD)

43
D
ioksyny
Grupa 75 związków z
różnym podstawieniem
chloru
- największe stężenie dioksyn jest w przetworach
mlecznych, mleku i rybach
- mogą dostawać się do pożywienia z papierowych
produktów takich jak talerzyki papierowe czy filtry do
kawy
- toksyczność zależy od podstawienia,
najbardziej niebezpieczne są pochodne
podstawione w pozycji 2,3,7,8.
- szkodliwe działanie: zmiany
trądzikowe, zwyrodnienie nerwów oraz
uszkodzenie wątroby
GC-MS/MS
GC-SIM
GCxGC
44
PC
B
s
Polichlorowane bifenyle
-szczególnie dużo jest w organizmach wodnych, głównie
w wątrobie i tkance tłuszczowej ryb, ale także w mięsie i
produktach mleczarskich
- powstają w czasie chlorowania wody pitnej
- bardzo dobrze rozpuszczają się w tłuszczach
- wykazują działanie rakotwórcze ponadto
mają zdolność do bioakumulacji
GC-MS/MS
Wi
el
opi
er
ści
eni
ow
e w
ęgl
ow
odory
arom
a
tyc
zne W
WA
Dibenzo(a,h)antracen
Benzo(a)piren
Benzo(a)fluoranten
Antracen
- powstają w czasie przetwórstwa (suszenie zbóż, prażenie
kawy), obróbki termicznej (pieczenie, smażenie,
grillowanie) przy czym ich zawartość rośnie ze wzrostem
temperatury i czasu, utrwalania przez wędzenie
- WWA mogą także przenikać do żywności bezpośrednio
ze środowiska – powietrza, gleby, wody
- wysoce niebezpieczne, mają
właściwości kancerogenne i mutagenne,
GC (FID)
GC-MS
HPLC (DAD,FLD,
UV)
H
et
er
o
cykl
icz
n
e a
m
iny
arom
a
tyc
zne
- powstają w czasie obróbki cieplnej produktów o dużej
zawartości białka, występują głównie w smażonym mięsie
i rybach
>300°C powstają produkty piroliy białek i aminokwasów
150-200°C pochodne chinoliny i chinoksaliny, pirydyny
- działają mutagennie i rakotwórczo
- ich liczba zależy od obecności
prekursorów, inhibitorów, temperatury,
czasu procesu, odczynu środowiska
HPLC (DAD)
HPLC-ESI-MS
LC-MS
45
N
it
ro
zoa
m
iny
- w peklowanym mięsie, wędzonych rybach, piwie, sosie
sojowym i innych produktach spożywczych
- ok. 90% z nich wykazuje działanie
rakotwórcze, przy czym najsilniejsze
N-nitrozodimetyloamina
- aby ograniczyć ich powstawanie w
czasie obróbki dodaje się
przeciwutleniacze
GC-MS/MS
GC-TFA
HPLC-TFA
Pest
y
cydy
Bakteriocydy
Herbicydy
Fungicydy
Zoocydy
(fenoksykwasy, pochodne
sulfonylomocznika,
zw. fosforoorganiczne,
karbaminiany,
fenyloaminy, azole)
- produkty spożywcze pochodzenia roślinnego
- źródłem zanieczyszczeń jest nadmierne stosowanie
środków ochrony roślin w nieodpowiednich terminach
wegetacji
- mają zdolność do biokumulacji
- jednorazowe dawki nie są szkodliwe, ale
w przypadku stałego przyjmowania mogą
być niebezpieczne
GC
GCxGC
HPLC
TLC
A
ntybi
o
tyki
podstawowa jednostka
budowy tetracyklin
Β-laktamy, tetracykliny,
sulfonamidy, makrolidy,
azalidy, chinolony
- pozostałości antybiotyków w mięsie i produktach
pochodzenia zwierzęcego – jajka, mleko, tłuszcz, miód
- powodem zanieczyszczenia jest głównie
nieprzestrzeganie okresu karencji i nadużywanie
antybiotyków
- przyjmowanie długotrwałe nawet w
małych ilościach może powodować
powstawanie w organizmie
lekoodpornych szczepów bakterii, reakcje
alergiczne czy zaburzenia w
funkcjonowaniu tkanek i narządów
LC (DAD lub FLD)
LC-MS
LC-MS/MS
TLC

46
A
ler
gen
y
Alergeny się pochodzić z różnych źródeł, to złożona mieszanina różnych substancji
chemicznych obejmująca białka z gryki, jaja, orzeszki ziemne, zboża zawierające
gluten, orzechy, skorupiaków, ryb, soi, sezamu, gorczycy i selera, oraz substancje
chemiczne, takie jak siarczyny
- powodują różnego typu reakcje
alergiczne
LC-MS
HPLC
A
zot
any
NO
-
3
, NO
-
2
- azotany w wodzie, warzywach liściastych: burak,
szpinak, seler, sałata, kapusta, mogą występować także w
produktach pochodzenia zwierzęcego, a źródłem ich jest
pasza
- azotany (III) występują w mniejszych ilościach, ale na
skutek redukcji azotanów (V) ich ilość rośnie
- azotany (V) są mało toksyczne, mogą
jednak powodować podrażnienia
przewodu pokarmowego, azotany (III)
mogą powodować bóle brzucha, zawroty
głowy, a nawet doprowadzić do zapaści,
azotany mogą być źródłem
N-nitrozoamin
IC
HPLC (UV)

47
Z
anie
cz
ysz
cz
en
ia
m
ig
ruj
ące
z opak
ow
ań
Opakowania papierowe i z tektury
heksanal
benzofenon, metylobenzofenon (SML <0,6 mg/kg)
4,4”-bis(dimetyloamino)benzofenon (keton Michlera),
ftalan diizobutylu (DIBP) QM 1mg/kg, ortofenylofenol,
pentachlorofenol (PCP)SML 0,15mg/kg zw.chloroorganiczne
Opakowania z tworzyw sztucznych
4,4-diizocyjanian difenylometylu (1mg/kg wyrobu)
2,4-diizocyjanian toluilu (1mg/kg wyrobu)
1,3-butadien (SML 0,02mg/kg)
Chlorek winylidenu (SML 0,05 mg/kg)
- szkodliwe działania na zdrowie
człowieka
- niektóre z nich mają potwierdzone
działanie rakotwórcze
- mają wpływ na jakość produktu poprzez
pogorszenie właściwości
organolepycznych,
GC (FID lub ECD)
GC-MS
HPLC

48
Przygotowanie próbek
Celem jest wyodrębnienie analitu, wzbogacenie próbki, usunięcie przeszkadzających
składników oraz nadanie odpowiednich właściwości pozwalających na analizę substancji.
Stosuje się filtrację, ultrafiltrację, dializę, destylację, przepuszczanie przez kolumny żelowe,
rozpuszczanie, stapianie z odpowiednio dobranymi topikami oraz ekstrakcję [1, 24].
a) ekstrakcja
jest jedną z najpowszechniej używanych metod przygotowania próbek, może być realizowana
w różnych wariantach: ciecz-ciecz, ciecz-ciało stałe w aparacie Soxhleta, ekstrakcja do fazy
stałej (SPE), dyspersyjna ekstrakcja do fazy stałej (dSPE) mikroekstrakcja do fazy stałej
(SPME), ekstrakcja płynem w stanie nadkrytycznym, metoda przyspieszonej ekstrakcji
rozpuszczalnikiem.
Szczególne
znaczenie
ma
metoda
SPE,
która
opiera
się na chromatograficznym rozdziale analitu od pozostałości, przy zastosowaniu kolumn
z odpowiednim wypełnieniem – modyfikowanymi materiałami krzemionkowymi
i polimerowymi. Możliwe jest także stosowanie kolumn powinowactwa immunologicznego,
szczególnie przydatne w przegotowaniu próbek toksyn, alergenów. Ekstrakcja
wykorzystywana jest także w analizie migracji związków z opakowań. Badane tworzywo
zanurza się w odpowiednich płynach modelowych (woda destylowana, 3% kwas octowy,
10% etanol oraz oliwę z oliwek lub olej słonecznikowy) w ściśle określonych warunkach
czasu i temperatury zgodnie z normami.
b) analiza nadpowierzchniowa headspace
polega na badaniu fazy gazowej znajdującej się w równowadze z fazą ciekłą lub stałą
umieszczoną w szczelnej fiolce. Zaletą tej metody jest fakt, że na kolumnę wprowadza
się tylko lotne składniki, a nielotne pozostają w roztworze, poza tym pozwala na oznaczenie
bardzo małych stężeń bez wprowadzania dodatkowych substancji. Metoda wykorzystywana
m.in. do oznaczenia lotnych związków organicznych z opakowań.
c) kompleksowa analiza QuEChERS (Quick Easy Cheap Effective Rugged and Safe) [28, 29]
jest to metoda szybka, prosta, tania, efektywna i bezpieczna. Pozwala na niewielkie zużycie
odcznników i próbki, wysoki odzysk analitu oraz efektywne usuwanie matrycy. Szczególne
zastosowanie ma do oznaczania pestycydów będących grupą związków o zróżnicowanych
właściwościach. Metodę postępowania przedstawiono na rysunku. Stosuje się także
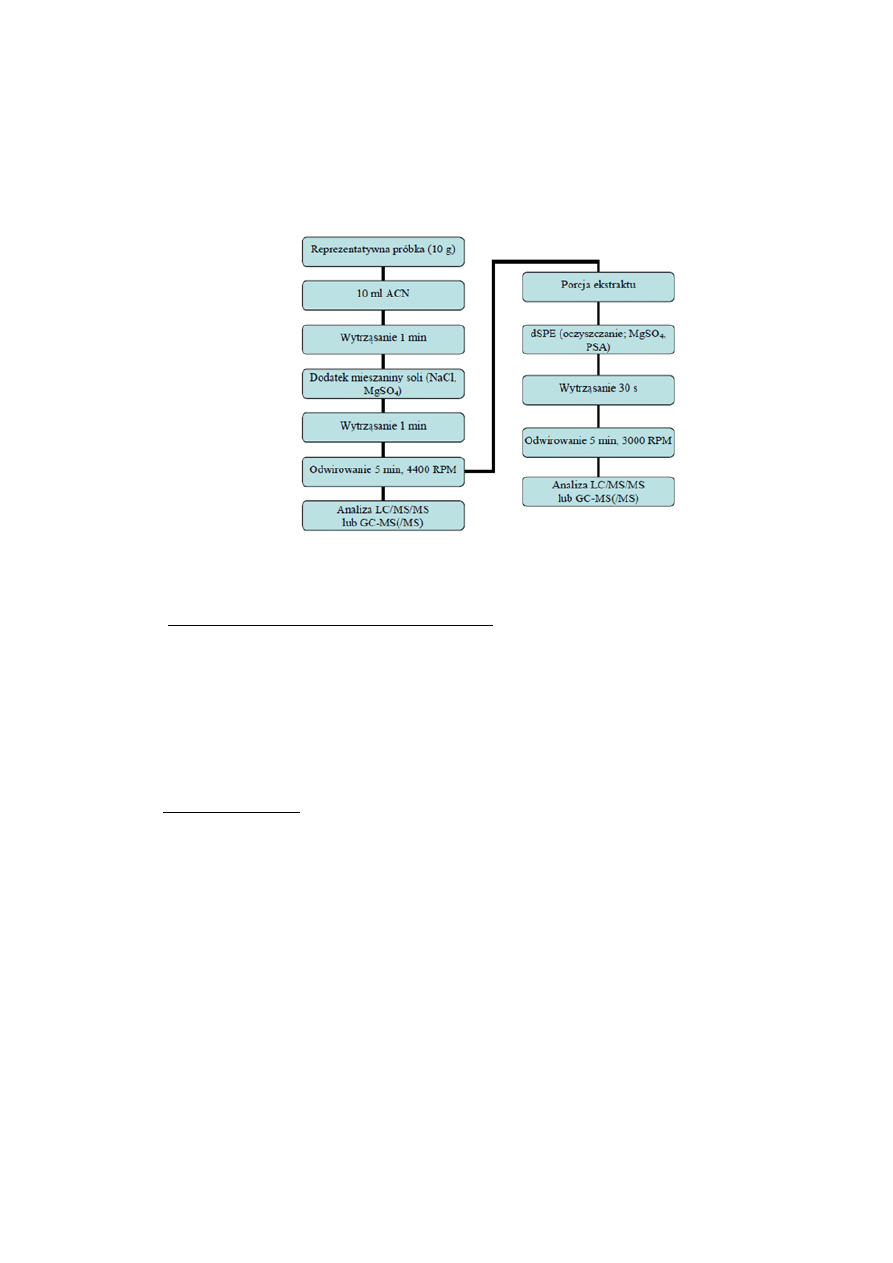
49
modyfikacje procesu przez dodatek C8 lub C18 jako sorbentów, w celu usunięcia
przeszkadzających steroli, tłuszczu czy pigmentów lub dodatek kwasu octowego, co poprawia
ekstrakcję polarnych fosforoorganicznych pestycydów.
Rysunek 8. Kompleksowa analiza QuEChERS.
d) oczyszczanie metodą chromatografii żelowej
umożliwia rozdział małocząsteczkowych związków od wielkocząsteczkowych. Najczęściej
stosuje się żywice – kopolimery styrenu i diwinylobenzenu. Eluentem jest zazwyczaj octan
etylu, cykloheksan, eter dietylowy i mieszaniny. Wadą tego typu rozwiązań jest konieczność
użycia dużych ilości rozpuszczalnika i długi czas rozdziału.
e) dodatek izotopów
stosuje się dodatek wzorców – analogów badanej substancji ze znaczonymi izotopami węgla
13
C o ściśle określonym składzie i stężeniu, celem takiego zabiegu jest określenie stopnia
odzysku, gdy straty substancji są duże w czasie przygotowania próbki, np. w przypadku
dioksyn czy PCD.
Właściwa analiza
Podstawowymi technikami wykorzystywanymi są GC Chromatografia gazowa
oraz Chromatografia cieczowa LC, HPLC. Wykorzystanie tych technik w zależności od
właściwości przedstawiono na rysunku.
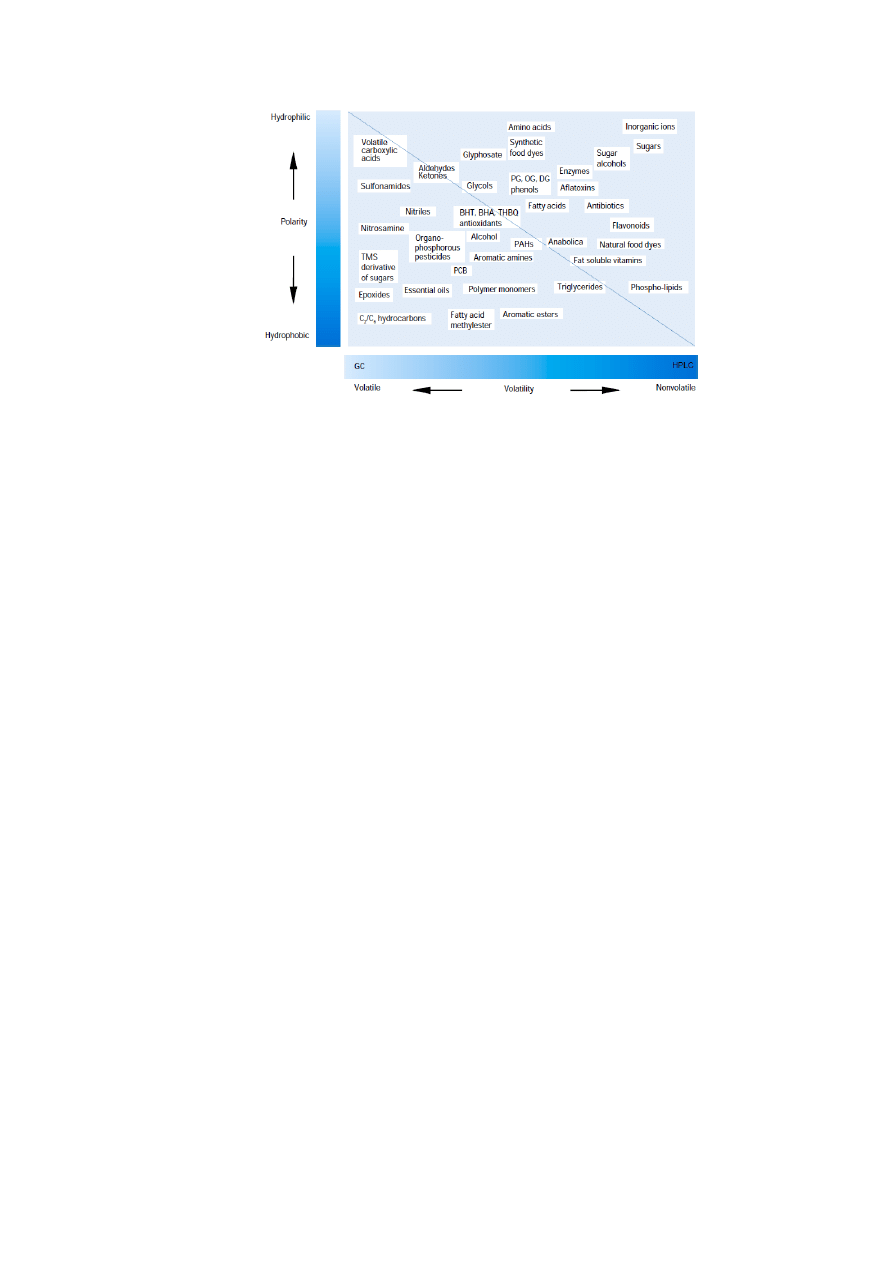
50
Rysunek 9. Zależność doboru metody od właściwości analitu.
Stosowanymi fazami stacjonarnymi są głównie żele krzemionkowe, żele ze związanymi
grupami aminowymi, cyjanowymi. Jako eluent stosuje się wtedy heksan, chloroform,
izopropanol. W odwróconym układzie faz fazę stacjonarną stanowią wypełnienia z grupami
metylowymi, oktylowymi, oktadecylowymi, fazę ruchomą natomiast woda, metanol
i acetonitryl. Stosuje się detektory FID czy wychwytu elektronów ECD lub spektrometr
masowy, co pozwala na potwierdzenie struktury i określenie jakościowe i ilościowe
związków w mieszaninie
TLC
Może być wykorzystywana, np. w analizie mikotoksyn, które umieszcza się na płytce
pokrytej silikonowym żelem, przy zastosowaniu odpowiednich rozpuszczalników.
Po wysuszeniu obserwuje się fluorescencję plam [22]. Można też przeprowadzić mikotoksyny
w pochodne z kwasem trifluorooctowym, co znacznie poprawia wykrywalność (0,25-9 ng.g).
Może być stosowany także w przypadku anliz pozostałości antybiotyków.
Sprzężenie ze spektrometrem mas GC-MS lub LC-MS
Połączenie ze spektrometrem mas pozwala na jednoczesne oznaczanie związków różnych
grup, przy czym spektrometr może pracować w dwóch opcjach – full scan – tryb całkowitego
skaningu widma masowego oraz selected ion monitoring (SIM) – tryb monitorowania
konkretnych jonów. Istnieje także możliwość zwiększenia czułości stosując tandemową
spektrometrię masową MS/MS. Jony rozdzielone w pierwszym analizatorze są następnie
fragmentowane w kolejnym. Metoda ta pozwala na rozdzielanie, identyfikację i analizę
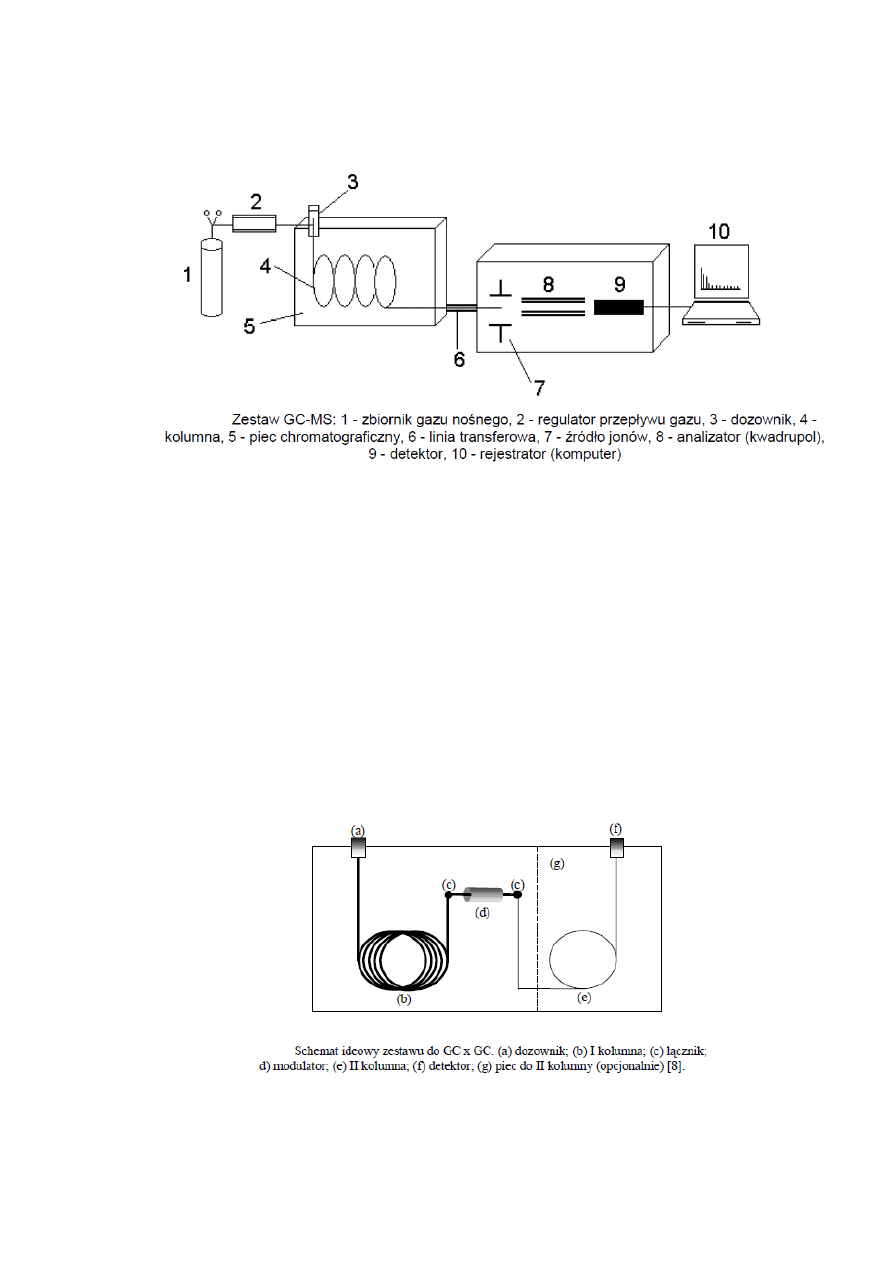
51
ilościową. Charakteryzuje się wysoką czułością 10
-9
-10
-12
g. Schemat takiego połączenia
przedstawiono na rysunku [1].
Chromatografia wielowymiarowa GCxGC, LCxLC
Pozwala na uzyskanie lepszej czułości, rozdziału pików, a przede wszystkim zmniejszenie
wpływu matrycy. Nie trzeba w tym przypadku stosować tak wielu operacji oczyszczania
próbek. Metoda ta zapewnia oddzielenie sygnałów analitu od matrycy. wykorzystuje dwie
kolumny chromatograficzne różniące się polarnością, które łączy modulator. Jego zadaniem
jest zatężenie analitów elujących z pierwszej kolumny i uwolnienie ich do drugiej kolumny,
dzięki czemu uzyskuje się polepszenie rozdzielenia substancji i wykrywalności. Schemat
takiego połączenia przedstawiono na rysunku.
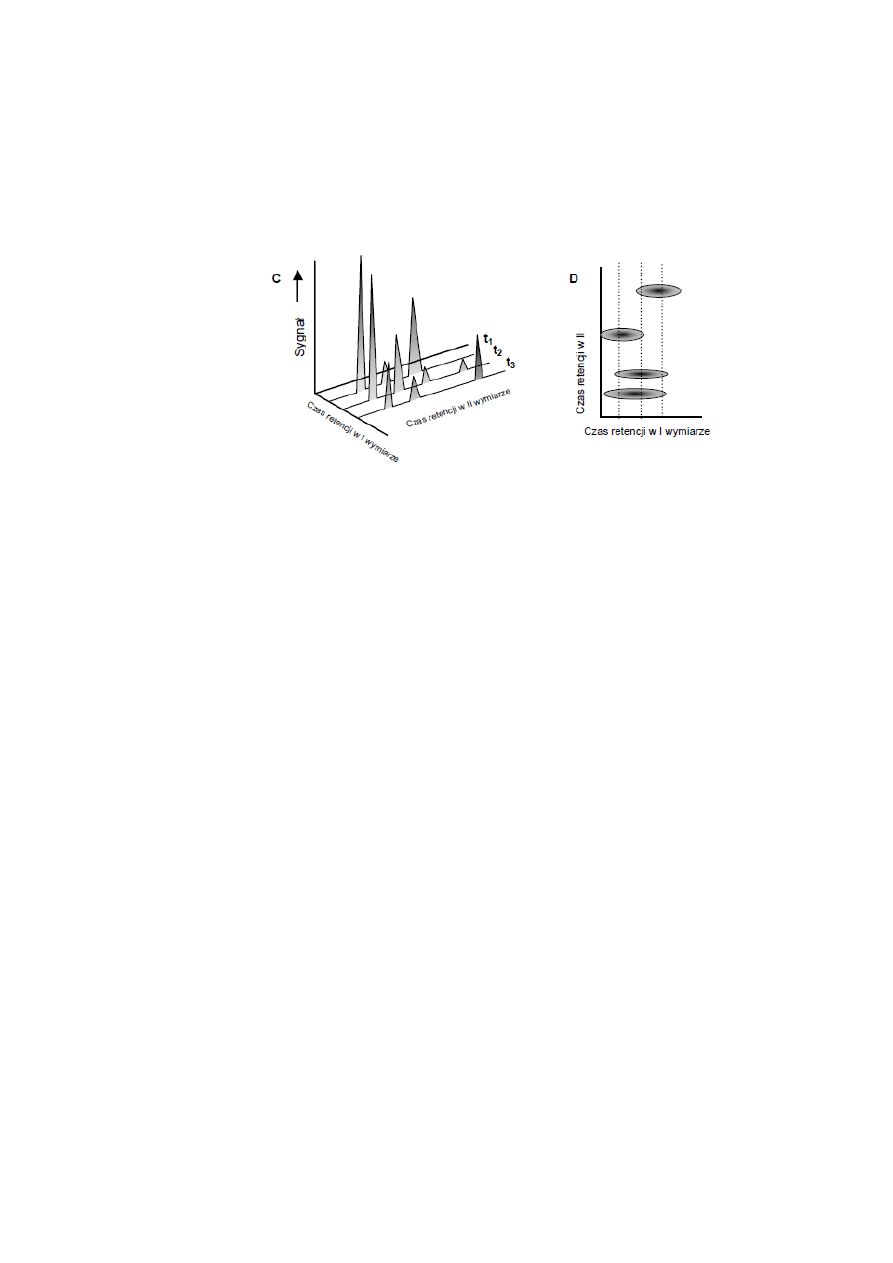
52
Chromatogramy liniowe otrzymane są trudne do interpretacji stąd odpowiednie
oprogramowanie przetwarza je na chromatogram konturowy poziomy, w którym
intensywność zabarwienia odpowiada stężeniu.
Piki wychodzące z drugiej kolumny są bardzo wąskie, dlatego istotne jest częste
próbkowanie, co wyklucza część detektorów. Przydatne okazują się FID i ECD. MS
w większości przypadków słabo się sprawdza lepiej zaś spektrometr czasu przelotu (TOF
MS), który jest jednak bardzo kosztowny. Takie wykorzystanie chromatografii jest
szczególnie przydatna w analizie pestycydów. Przeprowadzono badania, w których udało się
oddzielić i oznaczyć 58 analitów z możliwością oznaczenia ilościowego.

53
Podsumowanie
Metody analizy sacharydów za pomocą chromatografii gazowej i wysokosprawnej
chromatografii cieczowej charakteryzują się dużą precyzją, łatwością i szybkością wykonania
w porównaniu z metodami chemicznymi.
Lipidy jako związki o złożonej budowie stanowią trudny materiał do analizy.
Często lipidy przeprowadza się w różnego rodzaju pochodne, które są zdecydowanie
łatwiejsze do oznaczenia. Wykorzystywanymi metodami do identyfikacji klas lipidów są:
chromatografia cieczowa, cienkowarstwowa, wysokosprawna chromatografia cieczowa,
chromatografia gazowa.
Występowanie witamin w bardzo niewielkich ilościach oraz ich wrażliwość na
czynniki fizykochemiczne, sprawia wiele trudności w ich ilościowym oznaczaniu. Do
jakościowego i ilościowego oznaczania witamin i prowitamin stosuje się różne metody
(chemiczne, fizykochemiczne). Coraz częściej do analizy witamin w produktach
spożywczych wykorzystuje się wysokosprawną chromatografię cieczową, najczęściej w
odwróconym układzie faz z zastosowaniem kolumny RP-C18.
Przeciwutleniacze to substancje, które przedłużają trwałość żywności dzięki
zabezpieczeniu jej przed rozkładem (jełczenie, zmiana barwy) spowodowanym utlenianiem
pod wpływem tlenu z powietrza. Stosuje się je ze względu na podatność niektórych
produktów żywnościowych na utlenianie. Do analizy przeciwutleniaczy wykorzystuje się
chromatografię bibułową, cienkowarstwową, gazową i wysokosprawną chromatografię
cieczową. Można również wykorzystywać techniki sprzężone GC-IR i GC-MS.
Konserwanty, czyli substancje konserwujące, związki mające na celu zmniejszanie,
względnie całkowite zahamowanie procesów biologicznych powodowaniem mikroflory lub
enzymów tkankowych, które są odpowiedzialne za psucie się lub obniżanie jakości żywności.
Substancje te oznaczane są metodą HPLC oraz chromatografii gazowej.
Oznaczanie syntetycznych substancji słodzących metodą HPLC jest sposobem
zalecanym przez normy europejskie, gdyż dzięki niej można oznaczać jednocześnie kilka
substancji słodzących.
Do analizy związków zapachowych wykorzystano technikę GC-O, w której strumień
gazu nośnego z kolumny chromatograficznej rozdziela się między klasyczny detektor FID lub
MS, a port olfaktometryczny, jakim jest nos ludzki. Pozwala określić czy dany związek jest
aktywny sensorycznie przy danym stężeniu, jaki ma zapach i jaka jest jego intensywność oraz
czas aktywności sensorycznej.

54
Literatura
[1] Kumirska J., Gołębiowski M., Paszkiewicz M., Bychowska A., Analiza żywności,
Wydawnictwo Uniwersytetu Gdańskiego, Gdańsk 2010.
[2] Małecka M., Wybrane metody analizy żywności: Oznaczanie podstawowych składników,
substancji dodatkowych i zanieczyszczeń, Wydawnictwo Akademii Ekonomicznej, Poznań
2006.
[3] Florowska A., Krygier K., Zastosowanie nietrawionych oligosacharydów w produktach
spożywczych, Przemysł Spożywczy, 2004, 58 (5), 44-46.
[4] Gałkowska D., Gałkowska-Pachota M., Oznaczanie aminokwasów w żywności i
suplementach diety, Laboratorium, 9-10 (2010) 44-47.
[5] Rosiński M., Piasecka-Kwaitkowska D., Warchalewski J., Przegląd metod separacji i
oznaczania
białek
przydatnych
w
badaniach
i
analizie
żywności,
ŻYWNOŚĆ.Nauka.Technologia.Jakość, 3 (2005) 5-22.
[6] Jastrzębski D., Romanik G., Kolumnowa chromatografia cieczowa w rozdziale peptydów i
białek, 26 Konferencja chromatograficzna w Szczyrku 2005.
[7] Derlacz R., Girstun A., Kowalska-Loth B., Kozłowski P., Piekiełko-Witkowska A.,
Szakiel A., Trzcińska-Danielewicz J.: Podstawy biochemii dla ochrony środowiska,
Warszawa 2009, 23-27.
[8] Drozdowski B. : Lipidy [w:] Sikorski. Z.E. : Chemia żywności T.2, WNT, Warszawa
2007, 73-142.
[9] Analiza kwasów tłuszczowych w smalcu metoda chromatografii gazowej, Instrukcja do
ćwiczeń laboratoryjnych, Gdańsk 2008.
[10] Nogala-Kałucka M., „Analiza żywności, Wybrane metody jakościowych i ilościowych
oznaczeń składników żywności”, Wydawnictwo Uniwersytetu Przyrodniczego w Poznaniu,
Poznań 2010.
[11] L.Juszczak, Laboratorium, 2007, 4, 28-32.

55
[12] Uniwersytet Gdański – Wydział Chemii, Instrukcja do ćwiczeń laboratoryjnych.
Ćwiczenie 6, Gdańsk 2008.
[13] Sobolewska-Zielińska, Laboratorium, 2006, 10, 36-41.
[14] Dyrektywa Unii Europejskiej nr 89/10/EEC.
[15] Juszczak L., Substancje słodzące i metody ich oznaczania, Laboratorium, 2006, 12, 30-
34.
[16] Jeleń H. H., Związki zapachowe żywności – wyzwanie dla analityka, Przemysł
Spożywczy, 2004, 58 (5), 18-24.
[17] Jeleń H., Zawirska-Wojtasiak R., Chromatografia gazowa – olfaktometria do
identyfikacji związków zapachowych żywności, Przemysł Spożywczy, 2010, 64 (11), 21-23.
[18] Plutowska B., Wardencki W., Chromatografia gazowa z detekcją olfaktometryczną (GC-
O) w analizie żywności: Charakterystka metody, Analityka: nauka i praktyka, 2008, 1, 55-57.
[19] Plutowska B., Gromadzka J., Wardencki W., Chromatografia gazowa z detekcją
olfaktometryczną (GC-O) w analizie żywności: Metody i zastosowania, Analityka: nauka i
praktyka, 2008, 3, 24-28.
[20] Wielska-Jeszka J.: Barwniki, [w:] Sikorski. Z.E. : Chemia żywności T.1, WNT,
Warszawa 2007, 142-170.
[21] Juszczak L., Chemiczne zanieczyszczenia żywności, Laboratorium – Przegląd
Ogólnopolski, 3 (2009) 38-42.
[22] Bal K., Mielniczuk Z., Metody badań migracji szkodliwych substancji z opakowań do
żywności, Przegląd papierniczy, 66 (2010) 459-462.
[23] Leks-Stępień J., Metody analityczne wskaźnikiem przydatności opakowań do kontaktu z
produktami spożywczymi, Przegląd papierniczy, 67 (2011) 102-104.
[24] Herrero M., Ibanez E., Cifuentes A., Berneal J., Multidimensional chromatography in
food analysis, Journal of Chromatography A, 1216 (2009) 7110–7129.

56
[25] Posyniak A., Występowanie antybiotyków w żywności – aspekty prawne i analityczne
kontroli pozostałości, Życie weterynaryjne 9 (2011) 717-721.
[26] Czeczko R., Zastosowanie metod chromatograficznych do oznaczania pozostałości
pestycydów w owocach i warzywach, Ochrona Środowiska i Zasobów Naturalnych, 48 (2011)
462-465.
[27] Stufka-Olczyk J., Michniewicz M., Milczarek A., Badania zawartości związków
szkodliwych w materiałach opakowaniowych z materiału i tektury, Przegląd papierniczy, 68
(2012) 149-155.
[28] Kujawski M. W., Nowe metodyki badań składników obcych w miodach pszczelich,
Rozprawa doktorska, Gdańsk 2011.
[29] Sadowska-Rociek A., Cieślik E., Stosowane techniki i najnowsze trendy w oznaczaniu
pozostałości pestycydów w żywności metodą chromatografii gazowej, Metrologia, 1-2 (2008)
33-38.
[30]
Romanik
G.,
Opracowanie
nowych
procedur
rozdzielania
i
oznaczania
wieloskładnikowych mieszanin z zastosowaniem kolumnowej chromatografii z przepływem
zwrotnym, Rozprawa doktorska, Gdańsk 2009.
[31] Targoński Z., Stój A., Zafałszowania żywności i metody ich wykrywania, Żywność.
Nauka. Technologia. Jakość, 4 (2005) 30-40.
[32] Witkiewicz Z., Podstawy chromatografii, WNT, Warszawa 2000.
Wyszukiwarka
Podobne podstrony:
METODY BIOLOGICZNE W KONTROLI JAKOŚCI WODY
SKJZ Z1 CW 29.09, Dietetyka 2012,2013, Systemy kontroli jakości żywności
Pytania z SKJ sem letni zaoczni 2011, Dietetyka 2012,2013, Systemy kontroli jakości żywności
SYSTEMY KONTROLI JAKOCI mini sciaga 2, Dietetyka 2012,2013, Systemy kontroli jakości żywności
Pytania zzarządzania jakością żywnościsem.zimowy 2012 na 2013. niestacj. (1), Dietetyka 2012,2013
organy kontrolujace jakosc zywnosci w polsce
Wywiad z inspektorem kontrolującym jakość żywności
jakość żywności
Metody mikroskopowe w badaniach struktury produktów żywnościowych
analiza egzamin 2010(1), technologia żywności, analiza i ocena jakości żywności
W 5, dietetyka II rok, analiza i ocena jakości żywności
Analiza i ocena jakości żywności W D 1
Kontrola Ilościowa i Jakościowa w przedsiębiorstwie gastronomicznym oraz przyczyny reklamacji
AA Analiza i ocena jakości żywności, Technologia żywnosci i Żywienie człowieka, 4 SEMESTR, Analiza ż
20130917 CAF PRI alternatywne metody samooceny kontroli zarzadczej, kontrola zarządcza
ocena jakości żywności, Cwiczenie 1ART, Artur Kryszczuk
Ocena jakości żywności 3, Artur Kryszczuk
sprawozdanie oznaczanie sacharydów, TŻ UR, II rok, Analiza i ocena jakości żywności
więcej podobnych podstron