
MIKROBIOLOGIA
ĆWICZENIA 2 i 3
Sterylizacja.
Od kiedy większość eksperymentów przeprowadzana jest na czystych kulturach
mikroorganizmów, tzn. na pojedynczych, określonych gatunkach, koniecznością stała się
możliwość skutecznej sterylizacji/wyjaławiania (pozbawienia żywych organizmów oraz ich
form przetrwalnych) różnych materiałów, m.in. podłoży hodowlanych, końcówek do pipet,
butelek oraz innych naczyń i przyrządów służących do przechowywania czy posiewu
mikroorganizmów i utrzymywanie ich w takim stanie przez dłuższy czas. Jeśli taki
wyjałowiony materiał zostanie zanieczyszczony innymi mikroorganizmami, nie dodanymi
tam celowo, to mówi się wówczas o zakażeniu. Sterylizację można przeprowadzić różnymi
metodami, dostosowanymi do właściwości sterylizowanego materiału.
Sterylizacja parowa – najczęściej używanym urządzeniem do sterylizacji jest
autoklaw. Służy on do sterylizacji podłoży, plastików laboratoryjnych, i innych
materiałów wrażliwych na wysokie temperatury. Dzięki zastosowaniu autoklawu,
czyli pojemnika umożliwiającego ogrzewanie pod zwiększonym ciśnieniem można
osiągnąć temperatury powyżej punktu wrzenia wody pod ciśnieniem atmosferycznym.
Aktualna temperatura pary wytwarzanej z wody w autoklawie zależy od ciśnienia, ale
temperatura przy danym ciśnieniu jest znacznie niższa, jeśli w komorze znajduje się
powietrze. Ponieważ efektywność sterylizacji zależy od temperatury, a nie od
ciśnienia, należy zapewnić usunięcie powietrza ze sterylizatora za pomocą zaworu.
Sterylizacja sucha – stosowane do sterylizacji szkła i innych materiałów odpornych na
wysokie temperatury oraz materiałów nieodpornych na wilgoć.
Filtrowanie – metoda stosowana do sterylizacji płynnych roztworów substancji
termowrażliwych, np. antybiotyki czy witaminy oraz do sterylizacji powietrza
przepływającego przez komory laminarne. Do sterylizacji płynów najczęściej
wykorzystywany jest sterylny filtr nastrzykawkowy o średnicy porów 0,2 – 0,45 µm.
Naświetlanie – najczęściej stosowane w laboratoriach jest promieniowanie UV o
długości fal ok. 260 nm. Służy do częściowej sterylizacji pomieszczeń, komór
laminarnych.
Podłoża mikrobiologiczne.
Podłoże mikrobiologiczne jest to sztucznie stworzone środowisko do hodowli
drobnoustrojów zawierające, w postaci przyswajalnych związków, wszystkie pierwiastki
uczestniczących w tworzeniu masy komórkowej. Mikroorganizmy do wzrostu wymagają
źródła energii, węgla, soli mineralnych i czasem tzw. czynników wzrostowych. Czynniki
wzrostowe to substancje odżywcze, takie jak witaminy, aminokwasy czy zasady purynowe i
pirymidynowe. Substancje te wchodzą w skład komórek, ale nie wszystkie komórki mogą je
syntetyzować. Organizmy wymagające do wzrostu takich dodatkowych czynników nazywają
się auksotrofami, w odróżnieniu do prototrofów, które nie są uzależnione od dodatkowych
substancji odżywczych. Ze względu na skład, podłoża dzielimy na minimalne, pełne i
wzbogacone. Podłoża minimalne zawierają tylko źródło energii, węgla i sole mineralne oraz
czasem pojedyncze czynniki wzrostowe. Podłoża pełne zawierają wszystkie substancje
niezbędne do dobrego wzrostu drobnoustrojów (źródło węgla, azotu, sole mineralne, wiele
czynników wzrostowych). Podłoża wzbogacone stosuje się do hodowli drobnoustrojów słabo
rosnących in vitro, wymagających dodatkowych substancji odżywczych. Jako czynniki
wzbogacające podłoża stosuje się: krew, surowicę, płyny wysiękowe, wyciąg wątrobowy,
mleko, żółtko jaj, sok z pomidorów.

Ze względu na konsystencje podłoża dzielimy na płynne, półpłynne i stałe. Pierwsze
kultury bakteryjne prowadzone były na pożywce płynnej - bulionie odżywczym (wyciąg z
tkanek zwierzęcych). Robert Koch wykorzystał plaster ziemniaka, kiedy uświadomił sobie
potrzebę pożywek stałych. Jednakże nie wszystkie mikroorganizmy rosną na ziemniaku.
Kolejną próbą było dodanie żelatyny do pożywki płynnej, jednakże żelatyna ulega
upłynnieniu w warunkach standardowej inkubacji. Wtedy zastosowano agar jako czynnik
zespalający pożywki mikrobiologiczne, który obecnie jest najbardziej uniwersalnym
czynnikiem. Agar jest nie rozkładany przez większość bakterii. Otrzymuje się go z morskich
krasnorostów, u których występuje w ścianach komórkowych. Agar rozpuszcza się w
temperaturze 100
o
C, krzepnie przy temperaturze 45
o
C (stężenie 2% w pH obojętnym). Agar
zestalony może być inkubowany w temperaturach do 100
o
C i pozostaje w konsystencji stałej.
Podłoża ze względu na przeznaczenie i zastosowanie dzielimy na namnażające,
wybiórcze (zawierają dodatek substancji chemicznych hamujących wzrost konkretnej grupy
drobnoustrojów), namnażająco -wybiórcze (pozwala na namnożenie jednego typu organizmu,
a hamuje wzrost innych), oraz pożywki izolacyjne (podłoże stałe zawierające odpowiedni
wskaźnik pozwalający odróżnić od siebie kolonie bakterii).
Podłoża do hodowli mogą być przygotowane w różnej formie. Hodowle płynne w
zależności od ilości podłoża prowadzi się w probówkach, kolbach, butlach lub
fermentatorach. Hodowle na podłożu stałym wykonujemy na szalkach Petriego, słupach, lub
skosach.
Przykładowe pożywki drożdżowe:
Podłoże minimalne płynne:
Zestaw soli mineralnych (nitrogen base)
6,7 g
Glukoza
20 g
Woda destylowana
1000 ml
Podłoże pełne stałe:
Bacto-Ekstrakt drożdżowy
10 g
Bacto-Pepton
20 g
Glukoza
20 g
Agar
20 g
Woda destylowana
1000 ml
Przechowywanie mikroorganizmów
Mikroorganizmy przechowywane w różnych warunkach różnią się znacznie od siebie czasem
przeżywania okresu przechowywania. W celu krótkoterminowego – kilka dni do ok. dwóch
tygodni - przechowywania drobnoustrojów wystarczy je włożyć do chłodziarki w formie
takiej jakiej są – w podłożu płynnym lub posiane na szalce agarowej. Chcąc je przechować
dłużej należy je zamrozić. Aby zamarzająca woda nie zniszczyła komórek drobnoustrojów,
zamraża się je w 15% roztworze glicerolu. W temperaturze –20 C mikroorganizmy mogą być
przechowywane kilka miesięcy a w temperaturze –70 C mogą być przechowywane
praktycznie bezterminowo.
Cykl życiowy drożdży
Drożdże Saccharomyces cerevisiae są bardzo dobrym eukariotycznym organizmem
modelowym dzięki posiadaniu małego genomu, małej liczbie chromosomów oraz krótkiego
czasu podwojenia. Są łatwe w hodowli, szybko rosną, są łatwe do manipulacji genetycznych.
Nie formują grzybni, rozmnażają się tylko przez pączkowanie. Ogromną zaletą drożdży jest
możliwość utrzymywania ich zarówno jako szczepy diploloidalne jak i haploidalne. Istnienie
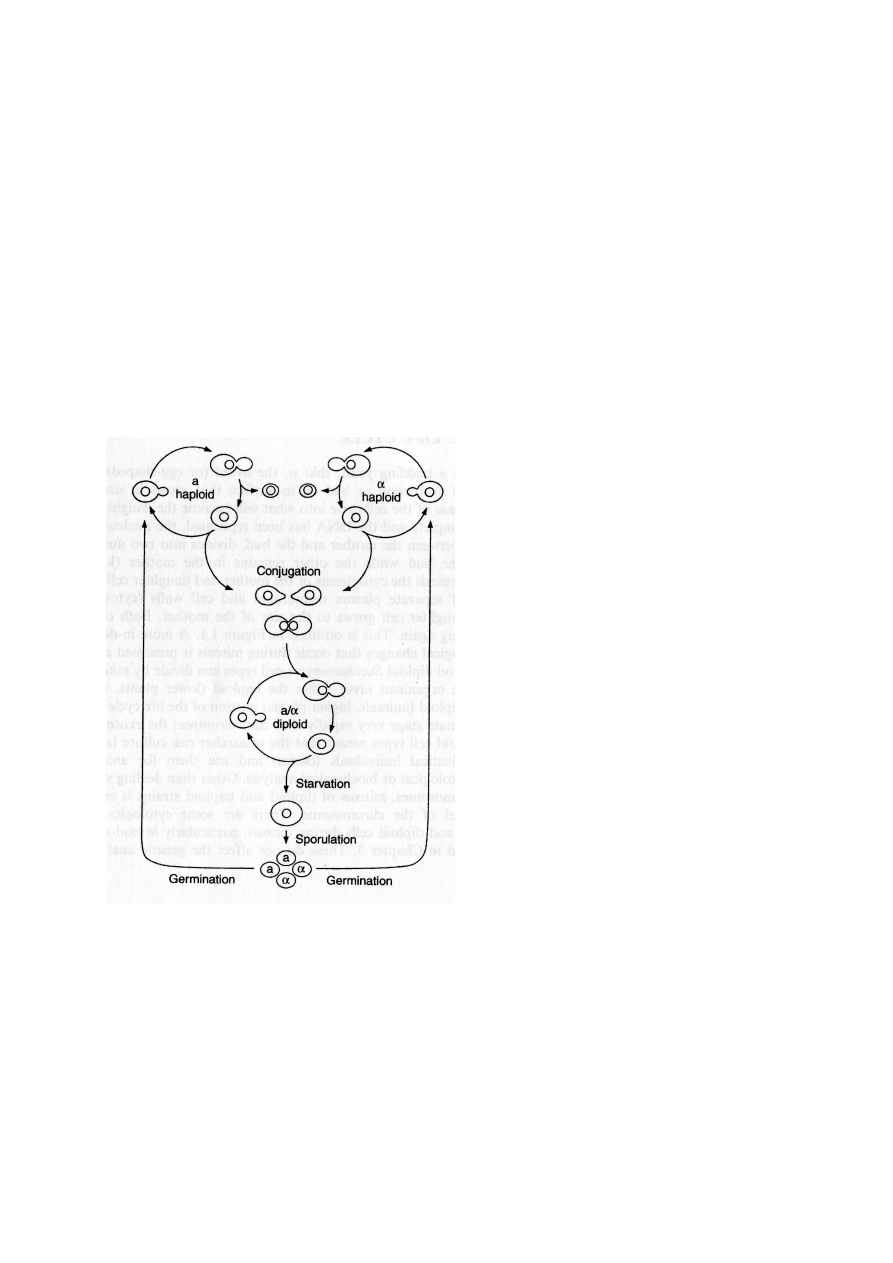
stabilnej fazy haploidalnej jest wyjątkowo atrakcyjne dla genetyków ze względu na
możliwość izolacji i identyfikacji szczepów niosących recesywne mutacje. Naturalnie
występujące szczepy drożdży są diploidalne i mają funkcjonalny allel genu HO, powodujący
spontaniczną zmianę typu kojarzeniowego co każdy podział. Szczepy laboratoryjne mają
zmutowany gen ho i dzięki temu mogą być utrzymywane jako szczepy o niezmiennym typie
kojarzeniowym. Haploidy mogą występować jako dwa typy kojarzeniowe, typ kojarzeniowy
a- lub α-, różniące się od siebie tylko w jednym locus, zwanym locus MAT. Dwa allele tego
locus to MATa i MATα. Stabilne szczepy a- lub α- dzielą się mitotycznie produkując
identyczne klony komórek. Szczep MATa kojarzy się ze szczepem MATα poprzez
kompleksowy proces cytoplazmatycznej i jądrowej fuzji dzięki czemu powstaje komórka
diploidalna. Taka komórka jest również stabilna i dzieląc się mitotycznie produkuje
identyczny genetycznie klon. Istnienie stabilnego diploida jest również bardzo korzystne dla
genetyków. Pozwala na określenie recesywności lub dominacji nowej mutacji lub na
przeprowadzenie testu komplementacji (czy szczepy niosące po jednej mutacji niosą allele
tego samego genu czy są to mutacje w różnych genach).
Gdy drożdże są wystawione na działanie niekorzystnych warunków pokarmowych,
komórki diploidalne przechodzą mejozę produkując cztery komórki potomne, zwane
askosporami: dwie typu kojarzeniowego a- i dwie typu kojarzeniowego α-. Askospory tworzą
tetradę, która jest zawarta w pojedynczej strukturze zwanej ascus (worek). Gdy przywróci się
odpowiednie warunki pokarmowe, każda z tych czterech askospor wykiełkuje i zacznie się
rozmnażać jako komórki haploidu.
Zadanie nr 1: Kojarzenie drożdży
Celem doświadczenia jest skojarzenie dwóch haploidalnych szczepów drożdży i otrzymanie
szczepu diploidalnego, zdolnego do wzrostu na podłożu minimalnym. Szczepy haploidalne
użyte w tym doświadczeniu są auksotrofami różnych aminokwasów i nie są w stanie rosnąć

na podłożu minimalnym. Dopiero po skojarzeniu powstaje heterozygotyczny diploid zdolny
do syntezy wszystkich aminokwasów. Należy skojarzyć szczepy każdy z każdym.
Materiały:
- probówki z trzema płynnymi kulturami haploidalnych drożdży
- pipeta i sterylne końcówki do pipety
- szalki Petriego ze stałym podłożem minimalnym
Przebieg doświadczenia:
Praca w grupach pod komorami laminarnymi.
1. Połóż szalkę minimalną na części z agarem i ją otwórz zdejmując pokrywkę.
2. Wstrząśnij płynną kulturę haploida nr1 na worteksie.
3. Nastaw pipetę na 10
l.
4. Otwórz naczynie ze sterylnymi końcówkami do pipet i delikatnie nabij jeden na pipetę
dbając, by podczas wyciągania nie dotknąć niczego jej sterylnym końcem.
5. Włóż delikatnie pipetę do probówki i przenieś kroplę zawiesiny drożdży na szalkę
umieszczając ją po lewej stronie szalki.
6. Dbając, by niczego po drodze nie dotknąć, przenieś drugą kroplę zawiesiny drożdży i
umieść ją na środku szalki.
7. Wstrząśnij płynną kulturę haploida nr2 na worteksie.
8. Zmień końcówkę pipety i przenieś kroplę zawiesiny na prawą stronę szalki.
9. Zmień końcówkę pipety, przenieś kroplę zawiesiny i umieść ją na kropli będącej już na
środku szalki.
10. Poczekaj, aż krople wyschną.
11. Powtórz to wszystko dla drugiego (nr1 i nr3) i trzeciego (nr2 i nr3) kojarzenia i przełóż
szalkę do inkubatora.
Kontynuacja doświadczenia tydzień później.
12. Wyjmij szalki z inkubatora i oceń wzrost poszczególnych szczepów.
Zadanie nr 2: Test replik
Na otrzymanych szalkach z podłożem pełnym YPD (yeast peptone dextrose) wysiano
prototroficzny pod względem syntezy leucyny szczep drożdży. Istnieje jednak podejrzenie, że
nastąpiło zakażenie kultury wyjściowej innym, auksotroficznym pod tym samym względem
szczepem drożdży. W celu sprawdzenie, które kolonie wyrosłe na szalce z podłożem pełnym
są auksotroficzne, należy wykonać test replik na podłożu nie zawierającym leucyny.
Założeniem tej metody jest odbicie drożdży z powierzchni agaru na sterylny welwet, a
następnie transfer tego „wzoru” na kolejną szalkę. Doświadczenie ma na celu oszacowanie
proporcji kolonii drożdży auksotroficznych pod względem syntezy leucyny do kolonii
prototroficznych, wyrosłych na tej samej szalce za pomocą testu replik.
Materiały:
- szalki z wyrośniętymi koloniami drożdży na podłożu YPD
- sterylne szmatki welwetowe
- szalki Petriego ze stałym podłożem SC-leu
Procedura:
Praca w grupach pod komorami laminarnymi.
1. Wyjmij z naczynia sterylny welwet i ostrożnie rozprostuj go uważając, by nie dotknąć
palcami powierzchni z włoskami w centrum szmatki.

2. Rozprostowaną szmatkę połóż na stemplu włoskami do góry i przymocuj do niego gumką
recepturką.
3. Szalkę matrycę otwórz, delikatnie przyciśnij agarem do welwetu i zamknij.
4. Szalkę docelową otwórz, delikatnie przyciśnij do welwetu, zamknij i umieść w
inkubatorze.
Kontynuacja doświadczenia tydzień później.
5. Wyjmij szalki z inkubatora i określ proporcję kolonii nie rosnących na podłożu testowym.
Zadanie nr 3: Obserwacja komórek wegetatywnych i zesporulowanych
drożdży pod mikrospkopem.
Materiały:
- płynne kultury drożdży wegetatywnych i zesporulowanych
- sterylne patyczki drewniane
- szkiełka mikroskopowe i nakrywkowe
Procedura:
Na szkiełko podstawowe należy nanieść pipetą kroplę kultury drożdży i nakryć szkiełkiem
nakrywkowym. Narysuj komórki wegetatywne i spory.
Zadanie nr 4: Oznaczanie genotypu drożdży wegetatywnych na podłożach
selekcyjnych
Doświadczenie ma na celu określenie genotypów pięciu szczepów drożdży na podstawie ich
zdolności do wzrostu lub jej braku na różnych podłożach. Podłoża, na których będą
przeprowadzane testy to podłoża syntetyczne pełne SCminus , czyli w pełni zdefiniowane o
dokładnie poznanym składzie, w których brakuje pojedynczego czynnika wzrostowego, w
tym wypadku są to poszczególne aminokwasy. Na takim podłożu mogą rosnąć tylko te
drożdże, które mają sprawny szlak syntezy danego aminokwasu. Gdy szlak ten jest
uszkodzony na jakimś etapie, drożdże na takim podłożu nie rosną i nazywane są aksotrofami
tego poszczególnego nutrientu, np. szczep nie rosnący na podłożu SC-ura to auksotrof
uracylu.
Materiały:
- szalki z wyrośniętymi koloniami drożdży o nieznanym genotypie na podłożu pełnym
bulionowym YPD
- szalki z wykonanymi replikami na podłożach SC-lys, SC-ade, SC-ura, SC-leu, SC-his
Procedura:
Na podstawie wyników wzrostu kolonii odbitych na szalkach testowych określ genotypy
poszczególnych szczepów drożdży.
Zadanie nr 5: Oznaczanie genotypu askospor na podłożach selekcyjnych
Używając mikromanipulatora można rozdzielić askospory pochodzące z jednej tetrady.
Uzyskuje się w ten sposób genetycznie identyczne haploidalne klony będące produktem
mejozy jednej komórki diploidalnej. W ten sposób można otrzymać szczepy o nowym
pożądanym genotypie. Doświadczenie ma na celu określenie genotypów askospor powstałych
w wyniku sporulacji diploidalnego szczepu drożdży oraz określenie, czy askospory
rzeczywiście pochodzą z jednej tetrady.

Materiały:
- szalka z wyrośniętymi koloniami powstałymi w wyniku rozłożenia za pomocą
mikromanipulatora nadtrawionych tetrad na pełnym bulionowym podłożu YPD
- szalki z wykonanymi replikami na podłożach SC-lys, SC-ade, YPD+nat
Procedura:
Na podstawie wyników wzrostu kolonii odbitych na szalkach testowych określ genotypy
poszczególnych kolonii wyrosłych z pojedynczych askospor i określ na tej podstawie czy
dana tetrada jest tetradą prawdziwą czy fałszywą.
Document Outline
- Zadanie nr 1: Kojarzenie drożdży
- Zadanie nr 2: Test replik
- Zadanie nr 3: Obserwacja komórek wegetatywnych i zesporulowanych drożdży pod mikrospkopem.
- Zadanie nr 4: Oznaczanie genotypu drożdży wegetatywnych na podłożach selekcyjnych
- Zadanie nr 5: Oznaczanie genotypu askospor na podłożach selekcyjnych
Wyszukiwarka
Podobne podstrony:
Cykl życiowy komórki
Mikrobiologia, Sterylizacja, STERYLIZACJA - I
mikrobiologia?zynfekcja i sterylizacja
mikrobiologia sciaga, Podłoża używane w Mikrobiologii:
mikrobiologia sterylizacja id 3 Nieznany
Cykl zyciowy komorki, Fizjoterapia i Rehabilitacja, Genetyka ćwiczenia
16. Wirus HIV â cykl życiowy i przebieg infekcji u człowieka, licencjat eksperyment
BYT 2005 Cykl zyciowy oprogramowania
(),Mikrobiologia L, Sterylizacja
Rekordowy cykl życiowy (2)
Cykl życiowy komórki
cykl życiowy gumka do mazania Katarzyna Bagińska
Żymańczyk Duda, mikrobiologia, składniki podłoża mikrobiologicznego
Cykl życiowy wirusa grypy 2
cykl życiowy jabłka
Cykl życiowy komórki
mikrobiologia sterylizacja
więcej podobnych podstron