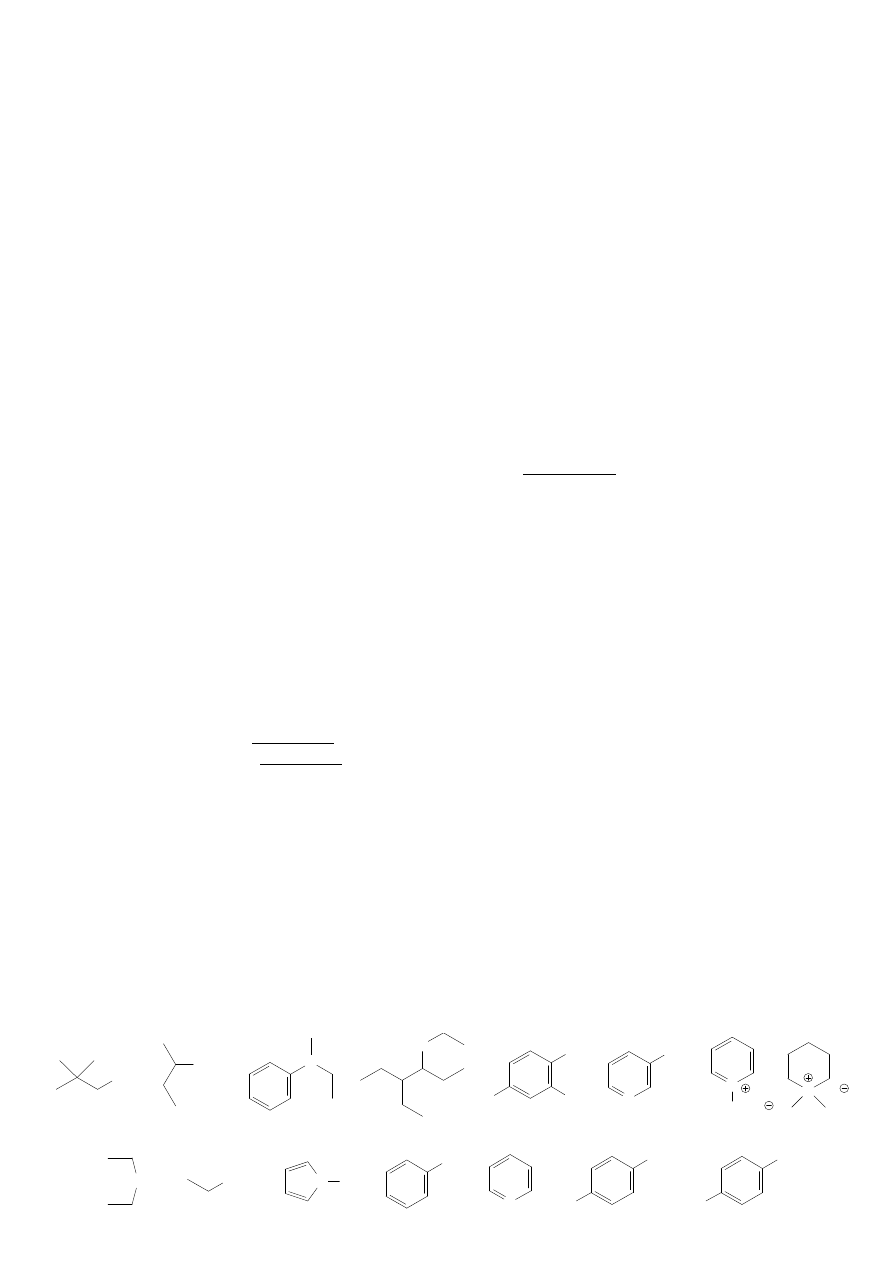
14. Aminy.
(konwersatorium, gr. D1 – Chemia, II rok, 2011/2012Z)
Zagadnienia
a) Nazewnictwo systematyczne i zwyczajowe amin.
b) Klasyfikacja amin: a) I, II oraz III-rz.; IV-rz. sole amoniowe; b) aminy alifatyczne, aromatyczne,
heterocykliczne.
c) Struktura grupy aminowej. Wiązania wodorowe w cząsteczkach amin. Sprzężenie grupy aminowej
z pierścieniem aromatycznym (aminy aromatyczne, np. anilina), wiązaniem podwójnym (enaminy) lub
grupą karbonylową (amidy). Zasadowość i nukleofilowość amin. Zależność zasadowości amin od ich typu,
rzędowości oraz charakteru podstawników. Wpływ podstawników elektronodonorowych i elektrono-
akceptorowych na zasadowość aniliny.
d) Otrzymywanie amin alifatycznych: a) reakcje S
N
2 halogenków alkilu z amoniakiem (NH
3
) oraz aminami
I lub II-rz.; b) synteza azydkowa (redukcja azydków alkilowych /hydrogenacja katalityczna, kat. Pd lub
redukcja LiAlH
4
/, →aminy I i II-rz.); c) metoda Gabriela (ftalimidek potasu+halogenek alkilu, hydroliza
zasadowa powstałego N-alkiloimidu); d) redukcje: nitryli -C≡N (red. LiAlH
4
), amidów –CONH
2
(red.
LiAlH
4
, metoda często połączona z wcześniejszym otrzymywaniem amidów na drodze acylowania amin
chlorkami kwasowymi), nitroalkanów R-NO
2
(red. Fe/HCl), imin C=N (H
2
/Ni) oraz oksymów C=NOH
(Na/EtOH); e) aminowanie redukcyjne aldehydów i ketonów (1. NH
3
[otrz. iminy], 2. H
2
/Ni lub np.
NaBH
3
CN.[red. iminy]); f) przegrupowanie Hofmanna (NaOH, Br
2
/H
2
O, amid I-rz.→amina I-rz.); g) prze-
grupowanie Curtiusa (ogrzew., azydki acylowe→aminy I-rz.). Mechanizmy reakcji a), c), e), f) oraz g).
e) Otrzymywanie amin aromatycznych: a) nitrowanie zw. aromatycznych [S
E
(Ar)
] połączone z redukcją grupy
nitrowej: uwodornienie katalityczne; Fe, Zn, Sn w r-rach kwaśnych; SnCl
2
/H
3
O
+
(łagodny środek
redukujący, stosowany gdy w cząsteczce obecne są inne grupy mogące ulec redukcji, np. CHO); Na
2
S
x
(polisiarczki; selektywna red. gr. –NO
2
, np. w 1,3-dinitrobenzenie); b) przegrupowanie Hofmanna (NaOH,
Br
2
/H
2
O, amid I-rz. kwasu aromatycznego→I-rz. amina aromatyczna).
f) Reakcje amin alifatycznych i aromatycznych: a) alkilowanie (amina I, II lub III-rz +halogenek I-rz.
(S
N
2)→amina II, III-rz. lub IV-rz. sól amoniowa) lub acylowanie (amina+chlorek lub bezwodnik
kwasowy→amid); b) eliminacja Hofmanna (eliminacja wodorotlenku tetraorganoamoniowego /ogrzew.
z Ag
2
O/→alken); c) addycja nukleofilowa do grupy karbonylowej; d) reakcja amin II-rz. z NaNO
2
/H
+
(→N-nitrozoaminy); d) reakcja III-rz. amin aromatycznych lub alifatyczno-aromatycznych z NaNO
2
/H
+
(→pochodne arylonitrozowe).
g) Reakcje charakterystyczne tylko dla amin aromatycznych: a) substytucja elektrofilowa w pierścieniu
aromatycznym [S
E
(Ar)
] (mechanizm!, przypomnienie!); b) reakcja I-rz amin aromatycznych z NaNO
2
/H
+
(→sole arenodiazoniowe; mechanizm!);
h) Reakcje soli arenodiazoniowych: a) hydroliza soli diazoniowych (→fenole; H
2
SO
4
, H
2
O, ogrzewanie; tzw.
reakcja zagotowania; mechanizm typu S
N
1 /pośredni kation fenyliowy/); b) reakcja z H
3
PO
2
(→areny);
c) reakcja Sadmeyera (sól diazoniowa+zw. miedzi(I) /CuCl, CuBr, CuCN/→chlorki, bromki oraz nitryle
aromatyczne; mechanizm rodnikowy: Preparatyka Organiczna, A. I. Vogel; analogiczna reakcja z użyciem
HCl lub HBr i pyłu Cu→reakcja Gattermanna); d) podstawienie grupy diazoniowej atomem jodu (reakcja
z KI, mechanizm: 2 teorie-mech. rodnikowy lub S
N
(Ar)
); e) sprzęganie soli diazoniowych z fenolami lub
aminami aromatycznymi (→związki diazowe, S
E
(Ar)
, Ar-N
2
+
- słabe elektrofile).
i) Czwartorzędowe sole amoniowe jako katalizatory przeniesienia międzyfazowego. Chiralność
czwartorzędowych soli amoniowych.
j) Pirol, pirydyna, pirymidyna, pirolidyna oraz piperydyna jako przykłady amin heterocyklicznych.
Zadania
1. Nazwij poniższe związki.
a)
b)
c)
d)
f)
g)
h)
NH
2
NH
2
N
HN
N
NO
2
N
H Cl
NH
2
Cl
O
2
N
e)
N
I
2. Uszereguj poniższe aminy w kolejności malejącej zasadowości.
a)
b)
c)
d)
e)
g)
f)
NH
2
NH
N
H
N
NH
2
NH
2
HO
NH
2
NC
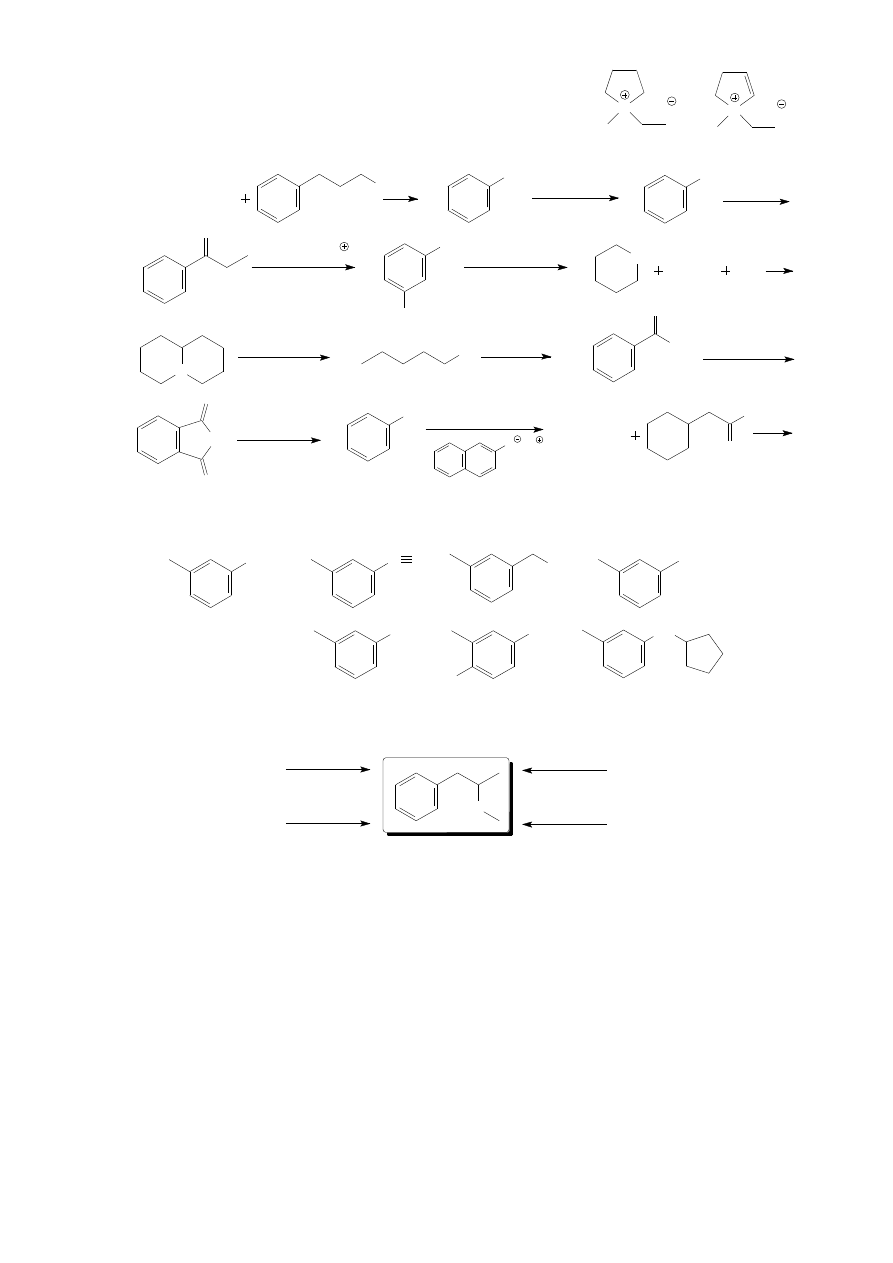
3. Które z poniższych związków posiadają enancjomery możliwe do rozdzielenia?
a) N-etylo-N-metyloanilina b) 2-metylopiperydyna c) 1-metylopiperydyna d)
e)
N
Cl
N
Cl
4. Przedstaw produkty poniższych reakcji.
a) NH
3
(nadmiar)
Br
b)
CH
3
NH
2
O
Cl
c)
NH
NaNO
2
HCl
d)
NO
2
Zn, HCl
e)
NH
2
NO
2
1. NaNO
2
, HCl
2. H
3
PO
2
f)
O
2. Na / EtOH
g)
h)
Br
1. NaN
3
2. LiAlH
4
i)
O
NH
2
NaOH, Br
2
k)
NH
2
1. NaNO
2
, HCl
2.
l)
NH
2
nadmiar Br
2
1. NH
2
OH, H
N
1. CH
3
I (nadm.)
2. Ag
2
O
3. ogrzew.
NH
O
O
1. KOH
2. CH
3
CH
2
Br
O Na
j)
5. Pokaż w jaki sposób można przekształcić 3-metyloanilinę (m-toluidynę) w poniższe związki, używając
dowolnych potrzebnych odczynników. Podaj nazwy przedstawionych produktów.
NH
2
m-toluidyna
a)
C
N b)
NH
2
c)
I
d)
OH
e)
f)
NH
2
O
2
N
NH
6. Narysuj wzory strukturalne związków A-D, z których można otrzymać metamfetaminę używając
wskazanych odczynników.
HN
A
B
C
D
CH
3
Br
1. CH
3
NH
2
2. NaBH
3
CN
CH
3
NH
2
LiAlH
4
Wyszukiwarka
Podobne podstrony:
Kultura - wyklad - 25.10.2011, Notatki filologia angielska
MSW 25 10 2011
25 10 2011 BIBLIOGRAFIA publikacje cz I
25.10.2011, IPSIR UW IV i V rok, resocjalizacyjna pedagogika antropologiczna (opracowane teksty z ć
25 10 2011
Prawo administracyjne 25 10 2011
1Geografia 25 10 2011
25 10 2011 BIBLIOGRAFIA publikacje cz I
patomorfologia wyklad 2 14 10 2011 2
14 10 2011 expression ecritid 1 Nieznany (2)
14 10 2011 expression écrit (un récit)
Laboratorium nr 2, 14 10 2011
Prawo cywilne ćw.10 2011-03-14, Prawo Cywilne
14 10 2011
14.10.2011
więcej podobnych podstron