
1
CHEMIA NIEORGANICZNA II - LABORATORIUM
REAKCJE CHARAKTERYSTYCZNE KATIONÓW IV GRUPY
Al
3+
, Cr
3+
, Fe
3+
, Zn
2+
, Mn
2+
, Ni
2+
, Co
2+
I. GLIN, Al
Glin należy do metali nieszlachetnych i z roztworów wodnych kwasów i zasad wypiera wodór:
2Al + 6H
+
= 2Al
3+
+ 3H
2
2Al + 2OH
-
+ 6H
2
O = 2Al(OH)
4
-
+ 3H
2
Na powietrzu utlenia się powoli, pokrywając się cienką warstwą tlenku, która chroni metal przed
dalszą korozją. Wodorotlenek glinu jest amfoteryczny.
REAKCJE CHARAKTERYSTYCZNE KATIONU Al
3+
1.
Reakcja kationu Al
3+
z nadmiarem NaOH
Al
3+
+ 3OH
-
= Al(OH)
3
Al(OH)
3
-
+ OH
-
= Al(OH)
4
-
2.
Reakcja kationu Al
3+
z nadmiarem amoniaku
Al
3+
+ 3(NH
3
·H
2
O) = Al(OH)
3
+ 3NH
4
+
3.
Reakcja kationu Al
3+
z AKT w obecności buforu amoniakalnego
2Al
3+
+ 3S
2-
+ 6H
2
O = 2Al(OH)
3
+ 3H
2
S
4.
Reakcja kationu Al
3+
z alizaryną
Wykonanie: Do probówki wprowadzić ok. 5 kropli związku Al
3+
i dodawać rozcieńczonego roztworu
NaOH do momentu roztworzenia się wytrąconego osadu. Następnie dodać 5 kropli roztworu
alizaryny i 10 kropli 1M roztworu kwasu octowego w celu rozłożenia nadmiaru alizaryny (fioletowe
zabarwienie przechodzi w czerwone). W obecności jonów Al
3+
powstaje czerwony osad lub roztwór
zabarwia się na kolor czerwony.
II. CHROM, Cr
Chrom należy do metali nieszlachetnych i z rozcieńczonych roztworów kwasów nieutleniających
wypiera wodór:
Cr + 2H
+
= Cr
2+
+ H
2
Na powietrzu związki chromu(II) natychmiast utleniają się do związków chromu(III):
4Cr + 12HCl + O
2
= 4CrCl
3
+ 2H
2
O + 4H
2

2
W kwasach o własnościach utleniających chrom nie roztwarza się, gdyż na powierzchni metalu
tworzy się cienka i bardzo ścisła warstewka tlenku chroniąca metal przed dalszym działaniem kwasu.
REAKCJE CHARAKTERYSTYCZNE KATIONU Cr
3+
1.
Reakcja kationu Cr
3+
z AKT w obecności buforu amoniakalnego
2Cr
3+
+ 3S
2-
+ 6H
2
O = 2Cr(OH)
3
+ 3H
2
S
2.
Reakcja kationu Cr
3+
z nadmiarem NaOH
Cr
3+
+ 3OH
-
= Cr(OH)
3
Cr(OH)
3
+ OH
-
= Cr(OH)
4
-
3.
Reakcja kationu Cr
3+
z nadmiarem amoniaku
Cr(OH)
3
+ 3(NH
3
·H
2
O) + 3NH
4
Cl = [Cr(NH
3
)
6
]Cl
3
+ 6H
2
O
Wykonanie: do szklanej probówki wprowadzić ok. 10 kropli roztworu związków Cr(III) a następnie
nadmiar roztworu amoniaku do wytracenia się osadu Cr(OH)
3
. Oddzielić roztwór od osadu
(najlepiej przez odwirowanie). Roztwór znad osadu zlać do pojemnika na odpady. Do otrzymanego
osadu (nie przemywać wodą destylowaną!) dodać ok. 1,0 cm
3
stężonego amoniaku oraz 1-2 łyżeczki
stałego NH
4
Cl (nie roztworu!), wymieszać. Probówkę z zawartością pozostawić w statywie na ok. 10
minut. Po pewnym czasie pojawia się czerwone zabarwienie roztworu pochodzące od związku
kompleksowego [Cr(NH
3
)
6
]Cl
3
.
4.
Reakcja kationu Cr
3+
z CH
3
COONa i ogrzewanie do wrzenia w łaźni wodnej
5.
Reakcja kationu Cr
3+
z H
2
O
2
2Cr(OH)
4
-
+ 3H
2
O
2
+ 2OH
-
= 2CrO
4
2-
+ 8H
2
O
2CrO
4
2-
+ 2H
+
= Cr
2
O
7
2-
+ H
2
O
Cr
2
O
7
2-
+ 3H
2
O
2
+ 8H
+
= 2Cr
3+
+ 7H
2
O + 3O
2
Produktem przejściowym ostatniej reakcji jest prawdopodobnie CrO
5
o niebieskim zabarwieniu
i niewielkiej trwałości.
Wykonanie: Do szklanej probówki wprowadzić ok. 0,5 cm
3
roztworu związku Cr
3+
i kroplami,
rozcieńczony roztwór NaOH aż do roztworzenia się wytrąconego osadu. Następnie dodać ok. 1 cm
3
roztworu H
2
O
2
i ogrzewać zawartość probówki w łaźni wodnej. Po zakończeniu reakcji schładzamy
zawartość probówki i dodajemy rozcieńczony roztwór kwasu siarkowego(VI) do uzyskania kwaśnego
odczynu (zmiana zabarwienia roztworu na pomarańczowy) a następnie 0,5–1,0 cm
3
alkoholu
izoamylowego i 0,5–1,0 cm
3
roztworu H
2
O
2
.
Wymieszać zawartość probówki energicznie. Warstwa
alkoholowa zabarwia się na kolor niebieski (zabarwienie nie jest trwałe).

3
III. śELAZO, Fe
ś
elazo jako metal nieszlachetny wypiera z roztworów kwasów wodór gazowy:
Fe + 2H
+
= Fe
2+
+ H
2
4Fe + 10HNO
3
= 4Fe(NO
3
)
2
+ NH
4
NO
3
+ 3H
2
O
REAKCJE CHARAKTERYSTYCZNE KATIONU Fe
3+
1.
Reakcja kationu Fe
3+
z AKT w obecności buforu amoniakalnego
2Fe
3+
+ H
2
S = 2Fe
2+
+ S + 2H
+
2Fe
3+
+ 3S
2-
= Fe
2
S
3
Fe
2
S
3
+ 4H
+
= 2Fe
2+
+ S + 2H
2
S
2.
Reakcja kationu Fe
3+
z nadmiarem amoniaku
Fe
3+
+ 3(NH
3
·H
2
O) = Fe(OH)
3
+ 3NH
4
+
3.
Reakcja kationu Fe
3+
z KSCN
Fe
3+
+ 3SCN
-
= Fe(SCN)
3
4.
Reakcja kationu Fe
3+
z K
4
[Fe(CN)
6
]
4Fe
3+
+ 3Fe(CN)
6
4-
= Fe
4
[Fe(CN)
6
]
3
5.
Reakcja kationu Fe
3+
z CH
3
COONa i ogrzewanie na łaźni wodnej
Fe
3+
+ 3CH
3
COO
-
= Fe(CH
3
COO)
3
Fe(CH
3
COO)
3
+ 2H
2
O = Fe(OH)
2
CH
3
COO + 2CH
3
COOH
IV. CYNK, Zn
Cynk należy do metali nieszlachetnych i z roztworów kwasów wypiera wodór gazowy:
Zn + 2H
+
= Zn
2+
+ H
2
Przy czym w rozcieńczonym HNO
3
wydzielający się wodór redukuje azotany(V) do soli amonowych:
4Zn + 10HNO
3
= 4Zn(NO
3
)
2
+ NH
4
NO
3
+ 3H
2
O
a w obecności stężonego HNO
3
wydzielają się tlenki azotu:
3Zn + 8HNO
3
= 3Zn(NO
3
)
2
+ 2NO + 4H
2
O
4
Cynk roztwarza się również w roztworach wodorotlenków:
Zn + 2H
2
O + 2OH
-
= Zn(OH)
4
2-
+ H
2
REAKCJE CHARAKTERYSTYCZNE KATIONU Zn
2+
1.
Reakcja kationu Zn
2+
z nadmiarem amoniaku
Zn
2+
+ 2(NH
3
·H
2
O) = Zn(OH)
2
+ 2NH
4
+
Zn(OH)
2
+ 6(NH
3
·H
2
O) = [Zn(NH
3
)
6
]
2+
+ 2OH
-
+ 6H
2
O
2.
Reakcja kationu Zn
2+
z nadmiarem NaOH
Zn
2+
+ 2OH
-
= Zn(OH)
2
Zn(OH)
2
+ 2OH
-
= [Zn(OH)]
4
2-
3.
Reakcja kationu Zn
2+
z AKT w obecności buforu amoniakalnego
Zn
2+
+ H
2
S = ZnS + 2H
+
4.
Reakcja kationu Zn
2+
z (NH
4
)
2
[Hg(SCN)
4
]
Zn
2+
+ [Hg(SCN)
4
]
2-
= Zn[Hg(SCN)
4
]
V. MANGAN, Mn
Mangan z roztworów kwasów wypiera wodór:
Mn + 2H
+
= Mn
2+
+ H
2
REAKCJE CHARAKTERYSTYCZNE KATIONU Mn
2+
1. Reakcja kationu Mn
2+
z AKT w obecności buforu amoniakalnego
Mn
2+
+ H
2
S = MnS + 2H
+
2. Reakcja kationu Mn
2+
z amoniakiem
Mn
2+
+ 2(NH
3
·H
2
O) = Mn(OH)
2
+ 2NH
4
+
W obecności soli amonowych osad Mn(OH)
2
nie wytrąca się wskutek znacznego obniżenia stężenia
jonów OH
-
.
5
3. Reakcja kationu Mn
2+
z Pb
3
O
4
2Mn
2+
+ 5Pb
3
O
4
+ 24H
+
= 2MnO
4
-
+ 15Pb
2+
+ 12H
2
O
Wykonanie: Do szklanej probówki wsypać ok.2 łyżeczki Pb
3
O
4
, dodać ok. 1,0 cm
3
stężonego HNO
3
a
następnie 2-3 krople roztworu soli Mn
2+
(najlepiej siarczanu manganu (II)) i ogrzewać w łaźni
wodnej.
VI. KOBALT, Co
Kobalt roztwarza się w rozcieńczonych kwasach wypierając wodór gazowy:
Co + 2H
+
= Co
2+
+ H
2
REAKCJE CHARAKTERYSTYCZNE KATIONU Co
2+
1.
Reakcja kationu Co
2+
z AKT w obecności buforu amoniakalnego
Co
2+
+ H
2
S = CoS + 2H
+
Ś
wieżo wytrącony osad CoS roztwarza się w rozcieńczonych kwasach nieorganicznych. Po pewnym
czasie przechodzi w formę nierozpuszczalną i aby przeprowadzić do roztworu należy stosować
utleniacze:
CoS + 2H
+
+ H
2
O
2
= Co
2+
+ S + 2H
2
O
2.
Reakcja kationu Co
2+
z nadmiarem amoniaku
Co
2+
+ NO
3
-
+ NH
3
·H
2
O = CoNO
3
(OH) + NH
4
+
CoNO
3
(OH) + 7(NH
3
·H
2
O) = [Co(NH
3
)
6
]
2+
+ 2OH
-
+ NH
4
+
+ NO
3
-
+ 6H
2
O
3.
Reakcja kationu Co
2+
z (NH
4
)
2
[Hg(SCN)
4
]
Co
2+
+ Hg(SCN)
4
2-
= Co[Hg(SCN)
4
]
4.
Reakcja kationu Co
2+
z KSCN
Co
2+
+ 4SCN
-
= [Co(SCN)
4
]
2-
Wykonanie: w probówce umieścić 0,5 cm
3
roztworu soli Co
2+
, dodać 0,5 cm
3
wody destylowanej,
1,0 cm
3
alkoholu izoamylowego oraz łyżeczkę stałego KSCN. Zawartość probówki wymieszać.
Warstwa alkoholowa barwi się na kolor niebieski.
5.
Reakcja kationu Co
2+
z KSCN w obecności jonów Fe
3+
Wykonanie: do probówki wprowadzić 0,5 cm
3
roztworu soli Co
2+
, 2-3 krople roztworu soli Fe
3+
,
0,5–1,0 cm
3
wody destylowanej, 0,5–1,0 cm
3
alkoholu izoamylowego oraz łyżeczkę stałego KSCN.
6
Zawartość probówki wymieszać. Następnie dodać łyżeczkę stałego NH
4
F i wymieszać. Warstwa
alkoholowa zmienia zabarwienie z czerwonej na niebieską.
6.
Reakcja kationu Co
2+
z KNO
2
Co
2+
+ 2CH
3
COOH + 7NO
2
-
+ 3K
+
= K
3
[Co(NO
2
)
6
] + 2CH
3
COO
-
+ H
2
O +NO
Wykonanie: W probówce umieszczamy 0,5 cm
3
roztworu soli Co
2+
, 0,5 cm
3
wody destylowanej,
łyżeczkę stałego KNO
2
(jeżeli jest NaNO
2
należy dodać łyżeczkę innej soli potasu np. KNO
3
) oraz ok.
0,5 cm
3
kwasu octowego. Wytrąca się żółty, krystaliczny osad (jeśli nie wytrąca się, to pocieramy
ś
cianki probówki szklaną bagietką).
VII. NIKIEL, Ni
Metaliczny nikiel najlepiej roztwarza się w rozcieńczonym HNO
3
:
3Ni + 8HNO
3
= 3Ni(NO
3
)
2
+ 2NO + 4H
2
O
Nikiel nieznacznie roztwarza się w rozcieńczonym HCl i H
2
SO
4
.
Reakcje charakterystyczne kationu Ni
2+
1.
Reakcja kationu Ni
2+
z AKT w obecności i buforu amoniakalnego
Ni
2+
+ H
2
S = NiS + 2H
+
Ś
wieżo wytrącony osad NiS roztwarza się w rozcieńczonych kwasach nieorganicznych. Po pewnym
czasie przechodzi w formę nierozpuszczalną i aby przeprowadzić do roztworu należy stosować
utleniacze:
NiS + 2H
+
+ H
2
O
2
= Ni
2+
+ S + 2H
2
O
2.
Reakcja kationu Ni
2+
z nadmiarem amoniaku
Ni
2+
+ Cl
-
+ NH
3
·H
2
O = NiCl(OH) + NH
4
+
NiCl(OH) + 6(NH
3
·H
2
O) = [Ni(NH
3
)
6
]
2+
+ OH
-
+ Cl
-
+ 6H
2
O
3.
Reakcja kationu Ni
2+
z dimetyloglioksymem
Wykonanie: w probówce umieszczamy 0,5 cm
3
słabo kwaśnego roztworu soli Ni
2+
, 0,5 cm
3
wody
destylowanej, 1,0 cm
3
roztworu dimetyloglioksymu i w końcu rozcieńczony amoniak do uzyskania
odczynu zasadowego.

7
WSKAZÓWKI DOTYCZĄCE WYKONYWANIA REAKCJI CHARAKTERYSTYCZNYCH
1.
Roztwór buforu amoniakalnego przygotowujemy w probówce przez rozpuszczenie w ok. 1,0 cm
3
1,0–2,0 M roztworu amoniaku jednej łyżeczki stałego chlorku amonowego.
2.
Reakcje wytrącania za pomocą AKT siarczków kationów IV grupy wykonujemy następująco
(chyba, że podano inaczej): w probówce szklanej (!) umieszczamy 0,5 cm
3
roztworu soli danego
kationu, 0,5 cm
3
wody destylowanej, 0,5 cm
3
roztworu buforu amoniakalnego, ok. 1,0 cm
3
roztworu AKT i ogrzewamy w łaźni wodnej.
Zaleca się, po dodaniu buforu amoniakalnego, sprawdzić papierkiem uniwersalnym pH roztworu
(powinien być żółty lub lekko niebieski – nie czerwony).
3. Wszystkie reakcje charakterystyczne (chyba, że podano inaczej), należy wykonywać
w następujący sposób: pobieramy ok. 5 cm
3
roztworu wodnego danego kationu, dodajemy ok. 0,5
cm
3
wody destylowanej a następnie ok. 0,5 cm
3
roztworu odczynnika chemicznego, z którym
wykonujemy reakcję.
4. Jeżeli badamy roztwarzanie wytrąconego osadu to postępujemy następująco:
wytrącony osad przemywamy dwukrotnie 1 cm
3
wody destylowanej. Za każdym razem
zostawiamy zawartość probówki na kilka minut w statywie aby osad opadł na dno probówki.
Następnie zlać ostrożnie roztwór nad osadem do drugiej czystej probówki. Dopiero do tak
przemytego osadu dodajemy odczynnika, za pomocą którego roztwarzamy osad.
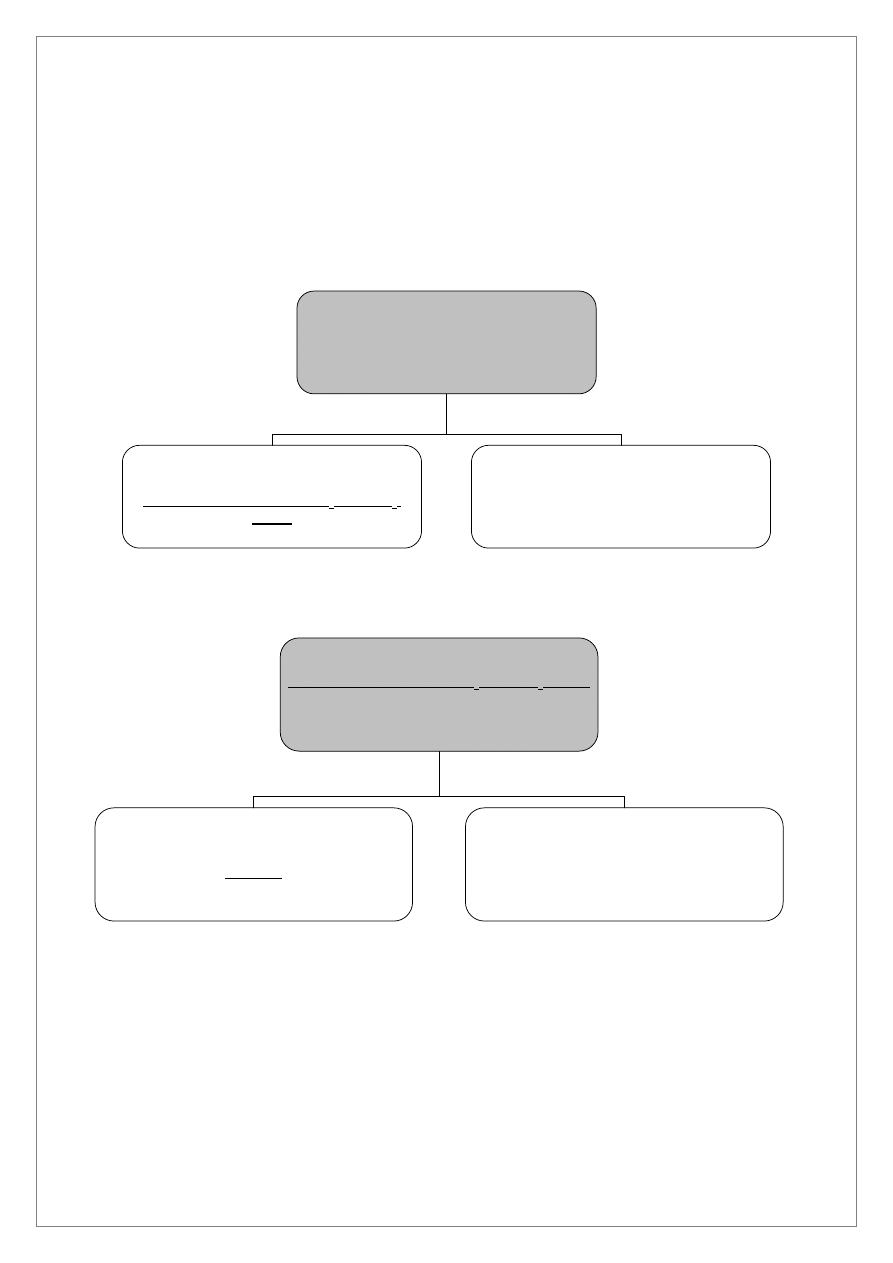
8
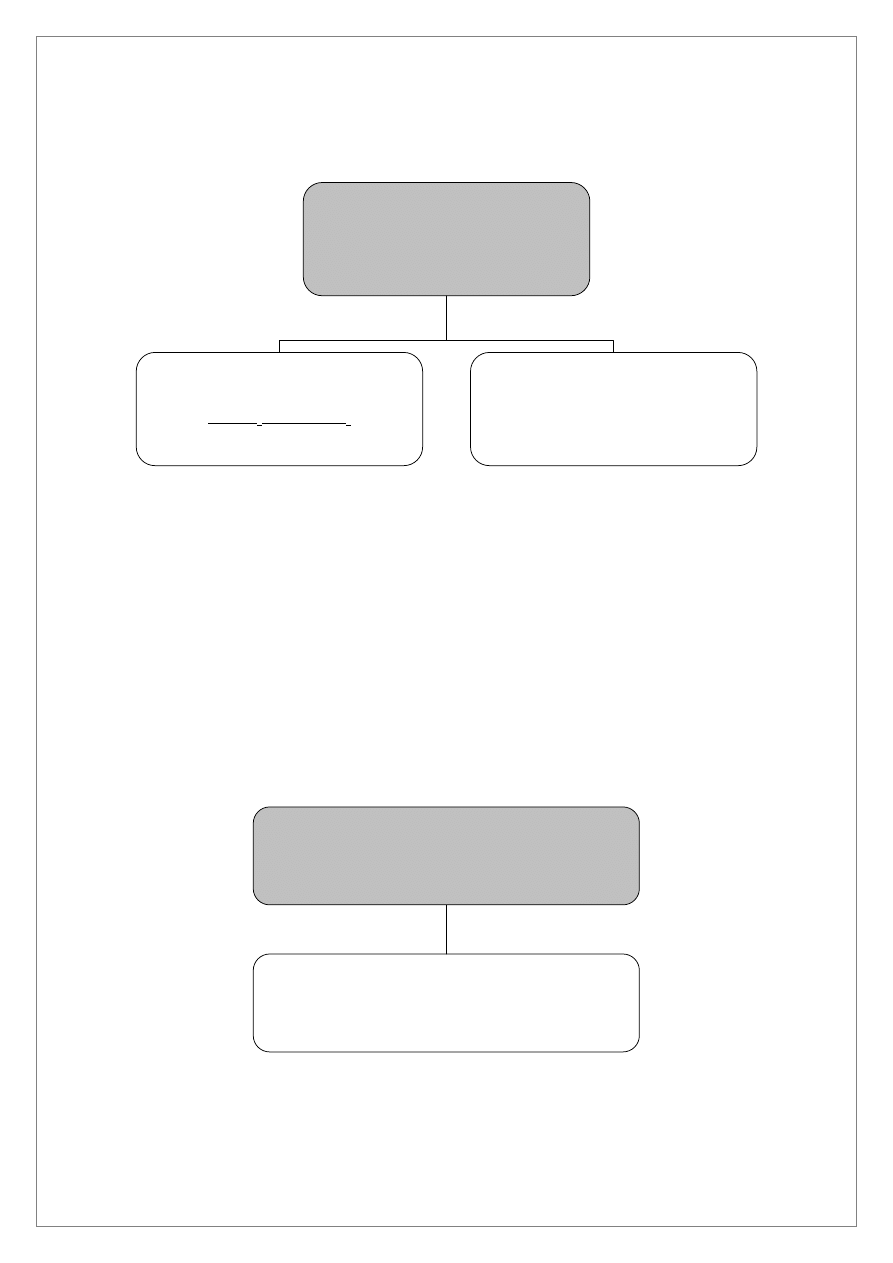
Co
2+
, Ni
2+
, Cr
3+
, Al
3+
, Zn
2+
, Mn
2+
, Fe
3+
+
1,0 cm
3
4M NH
4
Cl, kilka kropli stężonego
NH
3
·H
2
O, 2,0 cm
3
AKT, ogrzewanie
Osad I
NiS, CoS, MnS, ZnS, Al(OH)
3
, Cr(OH)
3
,
FeS, S
Roztwór 1
Osad I
NiS, CoS, MnS, ZnS, Al(OH)
3
, Cr(OH)
3
, FeS, S
+
2,0 cm
3
1M HCl
Osad II
NiS, CoS
Roztwór 2
Cr
3+
, Al
3+
, Zn
2+
, Fe
3+
, Mn
2+
ANALIZA SYSTEMATYCZNA KATIONÓW IV GRUPY
Co
2+
, Ni
2+
, Cr
3+
, Al
3+
, Zn
2+
, Mn
2+
, Fe
3+
Do 1,0 cm
3
roztworu zawierającego kationy IV grupy (roztwór C po oddzieleniu kationów III grupy) dodać
1,0 cm
3
4M NH
4
Cl oraz kilka kropel stężonego NH
3
·H
2
O do odczynu lekko zasadowego. Dodać 2,0 cm
3
AKT i ogrzewać na łaźni wodnej przez 30 minut. Odwirować. Wytrącony osad I zawiera siarczki kationów
IV grupy. W roztworze 1, po oddzieleniu osadu I, wykonać próbę na całkowite strącenie siarczków. Po
wykonaniu próby na całkowite strącenie roztwór 1 wylać do pojemnika na metale ciężkie.
Osad I przemyć wodą destylowaną, oddzielić osad przez odwirowanie. Roztwór po przemyciu odrzucić.
Do osadu I w probówce szklanej dodać 2,0 cm
3
1M HCl i mieszać bagietką przez 5 do 10 minut
(nie ogrzewać). W osadzie II pozostaną nie roztworzone czarne osady CoS i NiS a w roztworze 2 znajdą się
kationy Al
3+
, Cr
3+
, Zn
2+
, Mn
2+
, Fe
3+
.
Osad II przemyć dwukrotnie wodą destylowaną. Po przemyciu dodać 10–15 kropli 6M HCl, 10 kropli 3%
H
2
O
2
i ogrzewać, w szklanej probówce w łaźni wodnej. Po roztworzeniu osadu oddzielić wydzieloną siarkę
elementarną. Roztwór 3 zawierający jony Co
2+
i Ni
2+
podzielić na trzy części (w trzech różnych
probówkach).
Do I–szej probówki dodać stężonego NH
3
·H
2
O do uzyskania odczynu zasadowego oraz kilka kropli roztworu
dimetyloglioksymu. Powstanie różowego osadu świadczy o obecności jonów Ni
2+
.
Do drugiej probówki z roztworem 3 dodać 1,0 cm
3
alkoholu izoamylowego oraz łyżeczkę stałego KSCN.
Silnie wstrząsnąć zawartością probówki. Niebieskie zabarwienie warstwy alkoholowej świadczy o obecności
jonów Co
2+
.
Do trzeciej probówki dodać 5 kropli CH
3
COOH, 5 kropli roztworu CH
3
COONa oraz ok. 0,2 g stałego KNO
2
(nie NaNO
2
!), wymieszać. Powstanie żółtego osadu K
3
[Co(NO
2
)
6
] świadczy o obecności jonów Co
2+
.
9
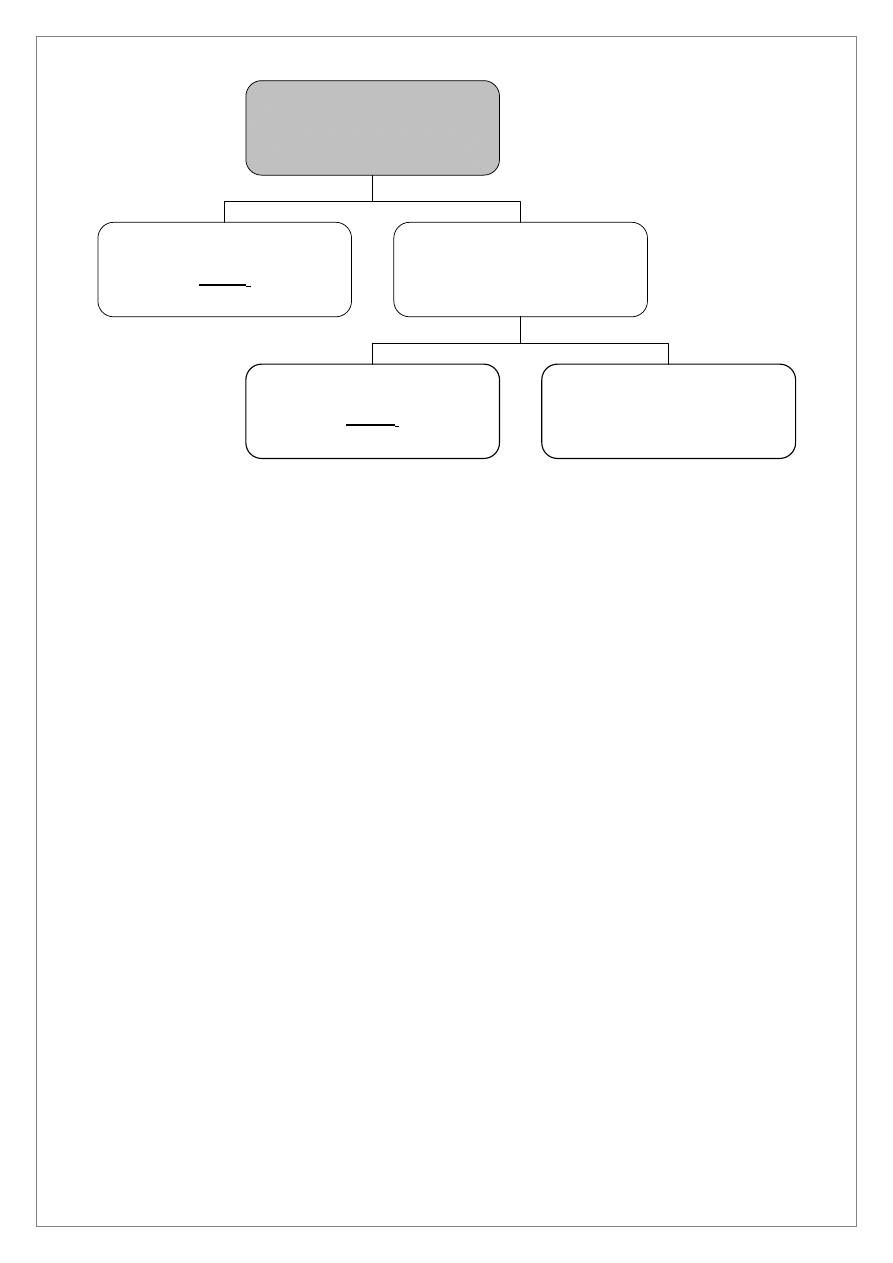
Roztwór 2
Cr
3+
, Al
3+
, Zn
2+
, Fe
3+
, Mn
2+
+
3M HNO
3
, ogrzewanie
6M NaOH, 3% H
2
O
2
, ogrzewanie
Osad III
Fe(OH)
3
i MnO·MnO
2
Roztwór 4
Al(OH)
4
-
, Zn(OH)
4
2-
, CrO
4
2-
Roztwór 4
Al(OH)
4
-
, Zn(OH)
4
2-
, CrO
4
2-
+
nadmiar 6M CH
3
COOH
Roztwór 4 (po zakwaszeniu)
Al
3+
, Zn
2+
, Cr
2
O
7
2-
, CH
3
COOH
Do roztworu 2 zawierającego jony Cr
3+
, Al
3+
, Zn
2+
, Fe
3+
, Mn
2+
dodać 10 kropli 3M HNO
3
i ogrzewać na
łaźni wodnej w celu usunięcia H
2
S. Po usunięciu H
2
S dodać 6M NaOH do uzyskania odczynu obojętnego
i 2–3 krople nadmiaru oraz 10 kropli 3% H
2
O
2
ogrzewając w łaźni wodnej. W wyniku reakcji wytrąci się
osad III zawierający Fe(OH)
3
i MnO·MnO
2
. W roztworze 4 znajdować się będą jony Al(OH)
4
-
, Zn(OH)
4
2-
,
CrO
4
2-
.
Osad III po przemyciu wodą destylowaną podzielić na dwie części.
Pierwszą część osadu III zawierającego Fe(OH)
3
i Mn·MnO
2
rozpuścić w 6M HCl. Do części tak
otrzymanego roztworu dodać kroplami roztwór KSCN. Krwistoczerwone zabarwienie roztworu świadczy o
obecności jonów Fe
3+
. Do drugiej części tego roztworu dodać kroplami roztwór K
4
[Fe(CN)
6
]. Niebieskie
zabarwienie roztworu świadczy o obecności jonów Fe
3+
.
Drugą część osadu III, zawierającego Fe(OH)
3
i Mn·MnO
2
badamy na obecność jonów Mn
2+
. Do tego osadu
dodać stężonego H
2
SO
4
i ogrzewać w parowniczce porcelanowej do ukazania się białych, gęstych dymów.
Następnie dodać stałego Pb
3
O
4
i 5 kropli stężonego HNO
3
, ogrzewając w parowniczce porcelanowej.
Fioletowe zabarwienie roztworu świadczy o obecności jonów Mn
2+
.
Do roztworu 4 dodać nadmiar 6M CH
3
COOH. Pobrać 10 kropli tego roztworu do drugiej probówki i dodać
kilka kropli roztworu Pb(CH
3
COO)
2
. Wytrącający się żółty osad PbCrO
4
ś
wiadczy o obecności jonów Cr
3+
.
Do następnej probówki pobrać 10 kropli roztworu 4 (zakwaszonego kwasem octowym), 1,0 cm
3
alkoholu
izoamylowego, 0,5 cm
3
1,5M H
2
SO
4
oraz 0,5 cm
3
3% H
2
O
2
. Wymieszać. Niebieskie zabarwienie warstwy
alkoholowej świadczy o obecności jonów Cr
3+
.
Jeżeli stwierdzono obecność jonów Cr
2
O
7
2-
, należy je usunąć w postaci BaCrO
4
.
W tym celu do pozostałej części roztworu 4 (po zakwaszeniu CH
3
COOH) zawierającego jony Al
3+
, Zn
2+
i Cr
2
O
7
2-
dodajemy kilka kropli roztworu Ba(NO
3
)
2
, odwirowujemy i osad BaCrO
4
odrzucamy.
Po wytrąceniu osadu BaCrO
4
do roztworu 4 (po zakwaszeniu) dodajemy nadmiar stężonego NH
3
·H
2
O do
uzyskania odczynu zasadowego i odwirowujemy.
10
Roztwór 4 (po zakwaszeniu)
Al
3+
, Zn
2+
, Cr
2
O
7
2-
, CH
3
COOH
+
Ba(NO
3
)
2
Osad
BaCrO
4
Roztwór
Al
3+
, Zn
2+
+
nadmiar stężonego
NH
3
·H
2
O
Osad IV
Al(OH)
3
Roztwór 5
Zn(NH
3
)
6
2+
Osad IV, zawierający Al(OH)
3
przemywamy dwukrotnie wodą destylowaną i roztwarzamy w 6M
CH
3
COOH. Z częścią tak otrzymanego roztworu wykonujemy reakcję charakterystyczną z alizaryną lub
amoniakiem.
Roztwór 5 dzielimy na dwie części. Do jednej części tego roztworu dodajemy 10 kropli AKT i ogrzewamy
w łaźni wodnej. Powstanie białego osadu świadczy o obecności jonów Zn
2+
.
Do drugiej części roztworu dodajemy 3M HCl do uzyskania odczynu kwaśnego, kilka kropli
(NH
4
)
2
[Hg(SCN)
4
]. Wytrącenie się białego osadu świadczy o obecności jonów Zn
2+
.
Wyszukiwarka
Podobne podstrony:
Kationy grupa IV
Elektronika Przemysłowa Laboratorium niestacjonarni Grupa IV
Grupa IV id 196513 Nieznany
Kationy grupa II pytania
analiza kationów gr IV i V
twiny, pomiar współos, GRUPA IV MC mgr
Kationy grupa II
pyt nasza grupa, IV rok, IV rok CM UMK, Dermatologia
Zaliczenie za kardiologii 1 grupa, IV rok, IV rok CM UMK, Kardiologia, giełdy
grupa iv
GIEŁDA 26 TERMIN POPRAWKA GRUPA V, IV rok, IV rok CM UMK, Neurologia, giełdy z maila, giełdy, neuro
Analiza leków Wykrywanie kationów grupa 4 i 5, Farmacja
kationy grupa I
GRUPA IV 2 id 196514 Nieznany
grupa iv
Kationy grupa I
Program zajęć korekcyjno - grupa IV, Terapia pedagogiczna
więcej podobnych podstron