ZAGADNIENIA EGZAMINACYJNE
1.
Wiązania chemiczne (jonowe, kowalencyjne, wodorowe); orbitale atomowe i
cząsteczkowe; wiązanie σ, wiązanie π, hybrydyzacja - jakie kąty są pomiędzy
zhybrydyzowanymi orbitalami sp, sp
2
i sp
3
?
2.
Wyjaśnić pojęcia: liczba atomowa, masa atomowa, liczba masowa, nukleony, nuklidy,
izotopy, izobary, izotony, moment dipolowy
3.
Wyjaśnić pojęcia: kwasowość, zasadowość, hemoliza, heteroliza, stopień dysocjacji, stała
dysocjacji, pK
a
, pH, iloczyn jonowy wody
Przykład I. Stężenie molowe jonów [H
+
] we krwi w temperaturze 25
o
C wynosi 6.0 x 10
-8
; (a)
czy krew ma charakter zasadowy czy kwaśny; (b) oblicz stężenie jonów wodorotlenowych we
krwi.
Przykład II. Wartość pK
a
jonu anilinowego, C
6
H
5
NH
3
+
, wynosi 4.6. Wyjaśnij, czy anilina jest
mocnie
jszą czy słabszą zasadą w porównaniu z metyloaminą, CH
3
NH
3
+
, dla której wartość
pK
a
w wodzie wynosi 10.6;
Przykład III. Stała dysocjacji kwasu mrówkowego, HCOOH, wynosi 1.77x10
-4
. Oblicz pK
a
tego kwasu.
Przykład IV. Który z kwasów w poniższych parach jest mocniejszy?
(a) CH
2
ClCOOH i CHCl
2
COOH
(b) CH
2
FCOOH i CH
2
BrCOOH
(c) CH
2
FCOOH i CH
2
FCH
2
COOH
(d) CH
3
OCH
2
COOH i CH
3
CHClCH
2
COOH
4.
Nazewnictwo alkanów; izomeria.
Przykład I: Narysuj oraz podaj nazwy alkanów lub cykloalkanów o wzorach: (a) C
5
H
12
posiada
jących tylko pierwszorzędowe atomy wodoru; (b) C
5
H
12
posiadających jeden
trzeciorzędowy atom wodoru, (c) C
5
H
12
posiadających tylko pierwszorzędowe i
drugorzędowe atomy wodoru, (d) C
5
H
10
posiadających jedynie drugorzędowe atomy wodoru i
(e) C
6
H
14
posiadających jedynie pierwszorzędowe i trzeciorzędowe atomy wodoru
Przykład II. Narysuj wzory strukturalne odpowiadające następującym nazwom IUPAC: (a)
2,2-dimetylo-4-propylooktan, (b) 1,3-dibromo-5-metylocykloheksan, (c) 4-chloro-3-etylo-
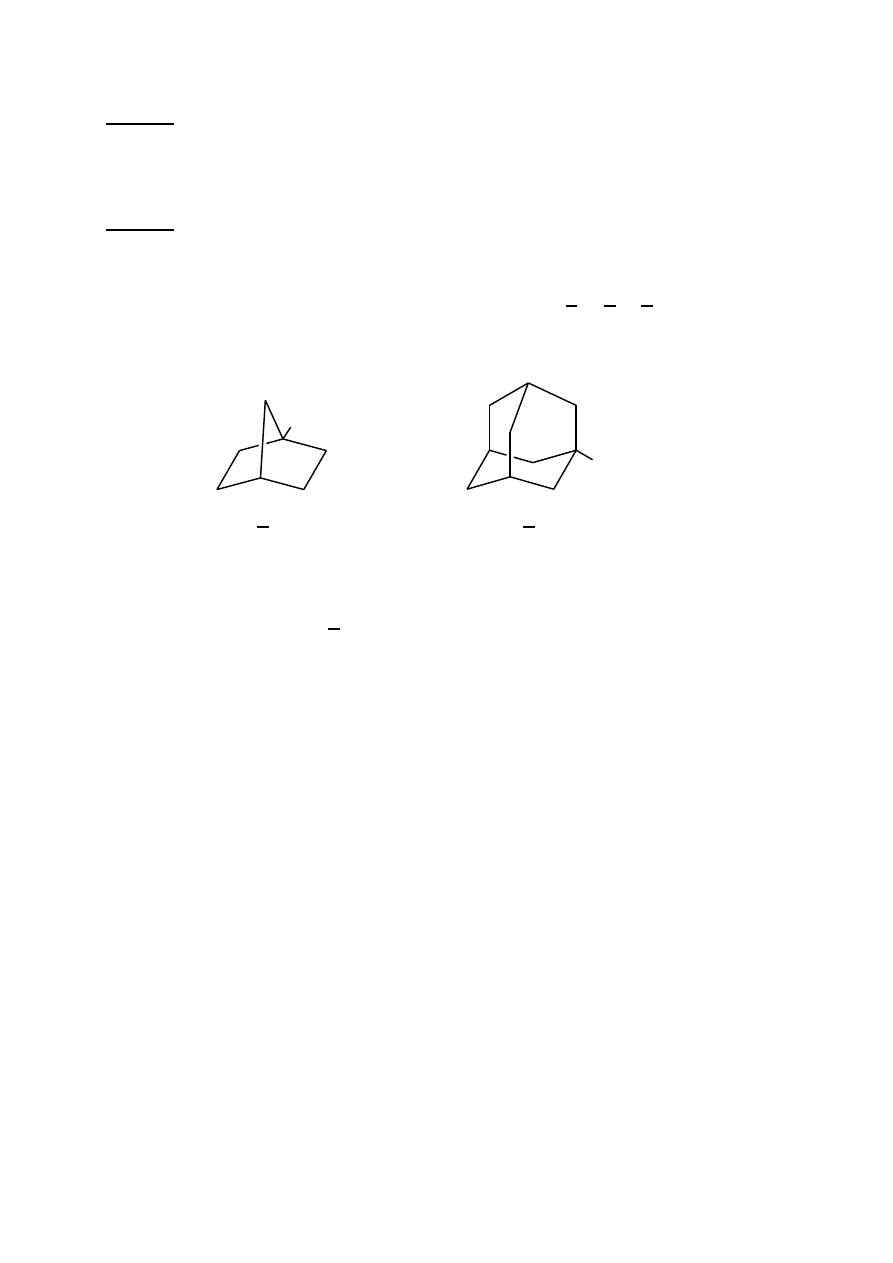
nonanal (d) 7-metylobicyklo[2.2.1]heptan
5.
Chlorowanie alkanów.
Przykład: (a) podaj dokładny mechanizm chlorowania metanu, (b) podaj nazwy wszystkich
produktów oraz ich względne ilości, które powstały w wyniku reakcji monobromowania 2,2-
dimetylobutanu.
6
. Izomeria alkenów (cis-trans, Z-E)
Przykład: Narysuj wzory strukturalne : (a) (E)-2-heksen, (b) (Z)-3-hepten, (c) (Z)-3-metylo-2-
heksen-5-yn
7.
Reakcje przyłączania do alkenów; reguła Markownikowa.
Przykład: (1) Napisz reakcje przyłączania bromu do: (a) 2-metylo-1-butenu i (b) 2-metylo-2-
butenu.(2)
Napisz reakcje przyłączania chlorowodoru do: (a) 2-metylo-1-butenu i (b) 2-
metylo-2-butenu.
8. Reakcje substytucji nukleofilowej S
N
1 i S
N
2; reakcje eliminacji E1 i E2.
Przy
kład: (1) Napisz dokładny mechanizm: (a) reakcji substytucji nukleofilowej chlorku t-
butylu w wodzie oraz (b) reakcji substytucji nukleofilowej chlorku sec-butylowego w
metanolu w obecności jonów HS
-
i omów czynniki wpływające na przebieg reakcji; (2) Napisz
reakcję solwolizy 1-bromo-1,1-dietylopropanu w metanolu w temperaturze 25
o
C; nazwij
otrzymane produkty
; (3) Czy poniżej przedstawione związki - (A) , (B) i (C) - ulegają reakcji
substytucji nukleofilowej w alkoholu etylowym? Jeśli tak, to jakiego typu jest to reakcja: S
N
1
czy S
N
2 ?; jeśli nie ulegają reakcji , to dlaczego?
Cl
Cl
(A) (B)
CH
3
(CH
2
)
8
CH
2
Cl (C)
9. Napisz wzory strukturalne: (a) 2,3,6-trinitrofenolu, (b) aniliny, (c) kwasu salicylowego, (d)
2-t-butylo-4-metylo-5-nitrofenolu, (e) 1,2,3-trimetylo-5-etylobenzenu, (f) kwasu pikrynowego,
(g) 2,4,6-trinitrotoluenu
10.
Oblicz energię rezonansu benzenu korzystając z następujących danych: entalpia
hydrogenacji etenu
– 28.6 kcal/mol; entalpia hydrogenacji benzenu -49.8 kcal/mol.
11. Napisz struktury rezonansowe dla: (a) fenolu, (b) aniliny, (c) nitrobenzenu, (d)
chlorobenzenu
12.
Napisz dokładny mechanizm: (a) chlorowania benzenu, (b) nitrowania benzenu, (c)
alkilowania benzenu
13.
Podaj sposób otrzymywania: (a) orto-nitrotoluenu, (b) meta-nitrotoluenu, (c) para –
nitrotoluenu
14. Podaj s
posób otrzymywania kwasów – orto, meta i para - nitrobenzoesowych.
15.
Napisz pięć dowolnych p-fenoli i uszereguj je według malejącej kwasowości.
16.
Napisz pięć dowolnych ketonów oraz podaj ich nazwy.
17.
Napisz dokładny mechanizm reakcji etylometyloketonu z bromkiem fenylomagnezowym.
Nazwij otrzymany produkt.
18.
Napisz dokładny mechanizm kondensacji aldolowej aldehydu octowego. Nazwij
otrzymany produkt.

19.
Napisz reakcję otrzymywania aldehydu cynamonowego, korzystając z aldehydu
benzoesowego i aldehydu octowego.
20. Napisz reakcje
etylofenyloketonu z: (a) etyloaminą, (b) hydroksyloaminą, (c) hydrazyną i
(d) fenylohydrazyną
21.
Napisz dokładny mechanizm reakcji aldehydu octowego z n-butanolem.
22. Narysuj trzy dowolne ketony alifatyczne
zawierające co najmniej 5 atomów węgla, nazwij
je oraz narysuj ich formy enolowe.
23.
Podaj podobieństwa i różnice w budowie i właściwościach alkoholi i eterów.
24.
Metody otrzymywania kwasów karboksylowych.
25.
Napisz reakcje otrzymywania pochodnych kwasów karboksylowych (estry, bezwodniki,
amidy, halogenki kwasowe). Uszereguj pochodne kwasów karboksylowych według malejącej
reaktywności.
26.
Napisz reakcję alkalicznej hydrolizy glicerydów; mechanizm myjącego działania mydła.
27. Metody otrzymywania amin.
28.
Napisz reakcje pozwalające na rozróżnienie rzędowości amin; test Hinsberga.
29.
Wyjaśnij, która z amin – cykloheksyloamina czy aminobenzen - jest mocniejszą zasadą.
30. Napisz metody otrzymywania alaniny.
31.
Jakie formę posiada glicyna w roztworze o pH = 1, a jaką w roztworze o pH = 14?
Wyjaśnij pojęcie punktu izoelektrycznego.
32.
Napisz wzory i nazwij wszystkie zasady purynowe i pirymidynowe wchodzące w skład
DNA.
Które z zasad purynowych i pirymidynowych łączą się w pary i dlaczego?
Wyszukiwarka
Podobne podstrony:
Wprowadzenie do psychologii biologicznej - zagadnienia egzamin, Testy
zagadnienia egzamin, psychologia, Psychologia biologiczna sem.I
1 9 zagadnienia egzamin biologia
ZAGADNIENIA EGZAMIN WYKLADY BIOCHEMIA, Biologia SGGW, rok 1
Zagadnienia egzaminacyjne z biologii sem, SZKOŁA, BIOLOGIA
Opracowane zagadnienia- strona 3, I rok, II semestr, biologia komórki, egzamin
zagadnienia egzamin10, Wprow. do psychologii biologicznej prof. Hanna Kmita - wykład
Zagadnienia z egzaminu wrzesień 2008, Szkoła, Biologia
Biol-ZAGADNIENIA egzamin, !Nauka! Studia i nie tylko, Biologia
biologia zagadnienia na egzamin II
Dydaktyka biologii ZAGADNIENIA
UKSW. Zagadnienia egzaminacyjne.Hist.Powsz.2009 2010, UKSW prawo PHPiP
Zagadnienia egzaminacyjne z mechatroniki Irok, Mechatronika, Wprowadzenie do mechatroniiki
UKSW. Zagadnienia egzaminacyjne.Hist.Powsz.2009 2010, Prawo UKSW I rok
więcej podobnych podstron