
Genom mitochondrialny kręgowców jest bardzo
zwarty
-
zredukowanie do minimum
ilości potrzebnych genów kodujących
tRNA
-
brak niefunkcjonalnych sekwencji
międzygenowych
-
geny
kodujące
rRNA
są
wyjątkowo
krótkie,
współczynnik
sedymentacji rRNA
dużej i małej podjednostki wynosi odpowiednio
16S i 12S
-
niektóre geny są skrócone i nie zawierają standardowych kodonów
terminacyjnych,
które są wprowadzane w procesie redagowania
przez
poliadenylację (końcowy kodon U lub UA w UAAAA…)
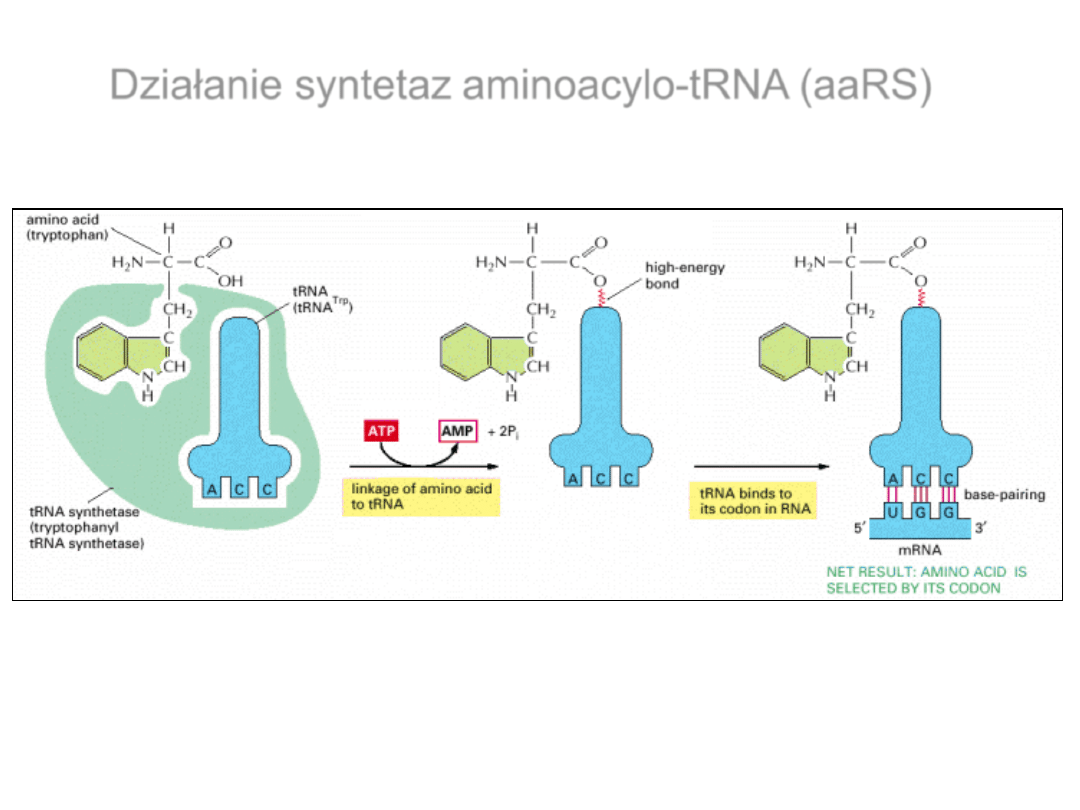
Działanie syntetaz aminoacylo-tRNA (aaRS)
Do aminoacylacji tRNA potrzebna jest hydroliza ATP
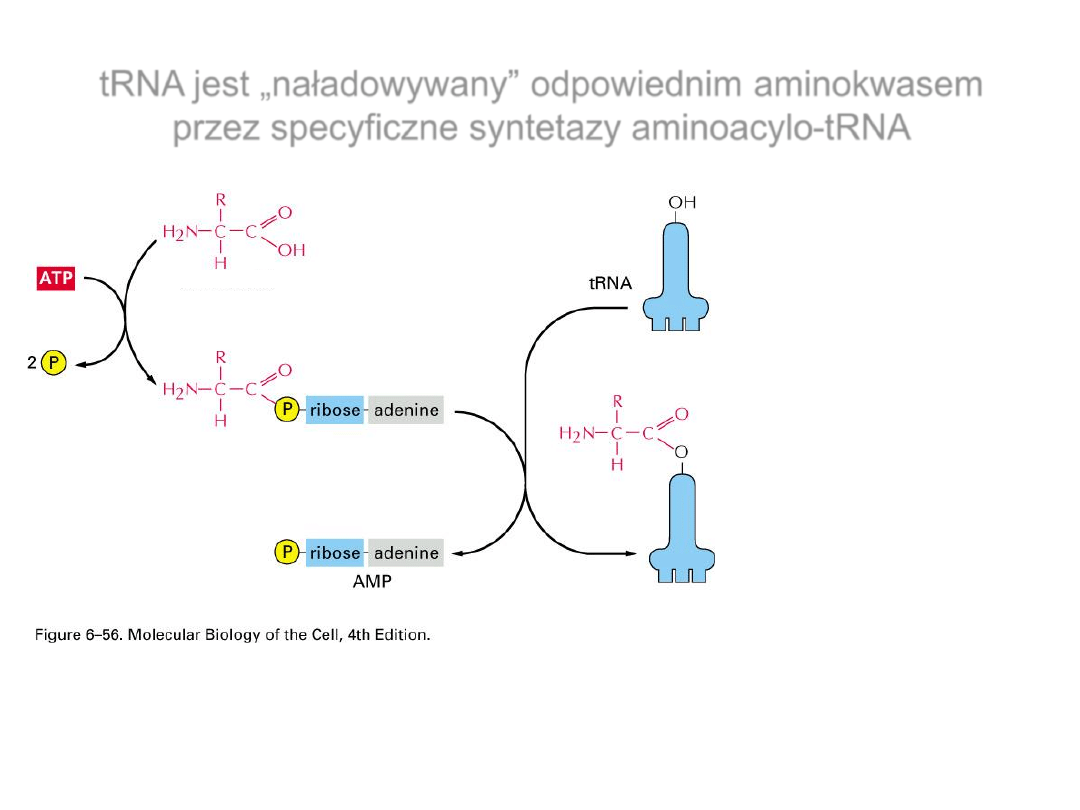
tRNA jest „naładowywany” odpowiednim aminokwasem
przez specyficzne syntetazy aminoacylo-tRNA
aminokwas
aminoacyloadenylan
aminoacylo-
tRNA
1.
2.
Dwa etapy reakcji
1.
AMP zostaje związany z
grupą karboksylową
aminokwasu
- powstaje aminoacyloadenylan
2.
aminoacyloadenylan reaguje
z odpowiednim,
nienaładowanym tRNA
-
reakcja z 2’OH lub 3’OH (w
zależności od syntetazy)
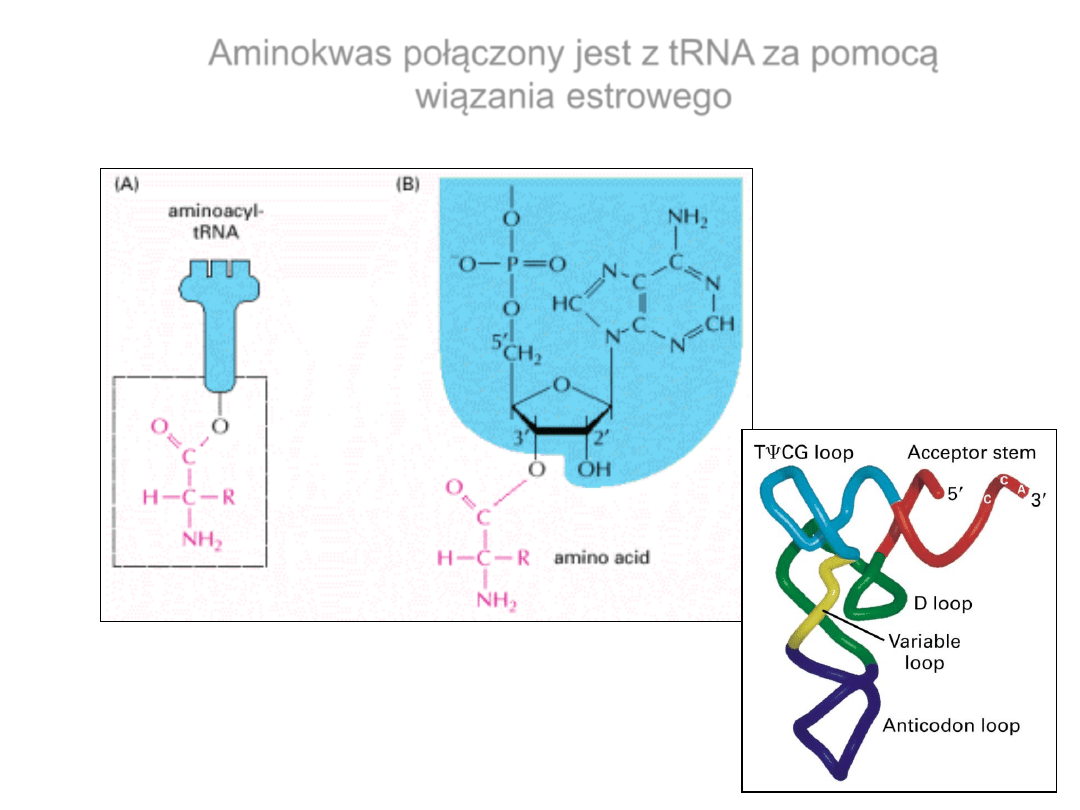
Aminokwas połączony jest z tRNA za pomocą
wiązania estrowego

Klasyfikacja syntetaz aminoacylo-tRNA
Klasa I
Klasa II
Arg (α)
Ala (α
4
)
Cys (α)
Asn (α
2
)
Gln (α)
Asp (α
2
)
Glu (α)
Gly (α
2
β
2
)
IIe (α)
His (α
2
)
Leu (α)
Lys (α
2
)
Met (α)
Phe (α
2
β
2
)
Trp (α
2
)
Ser (α
2
)
Tyr (α
2
)
Pro (α
2
)
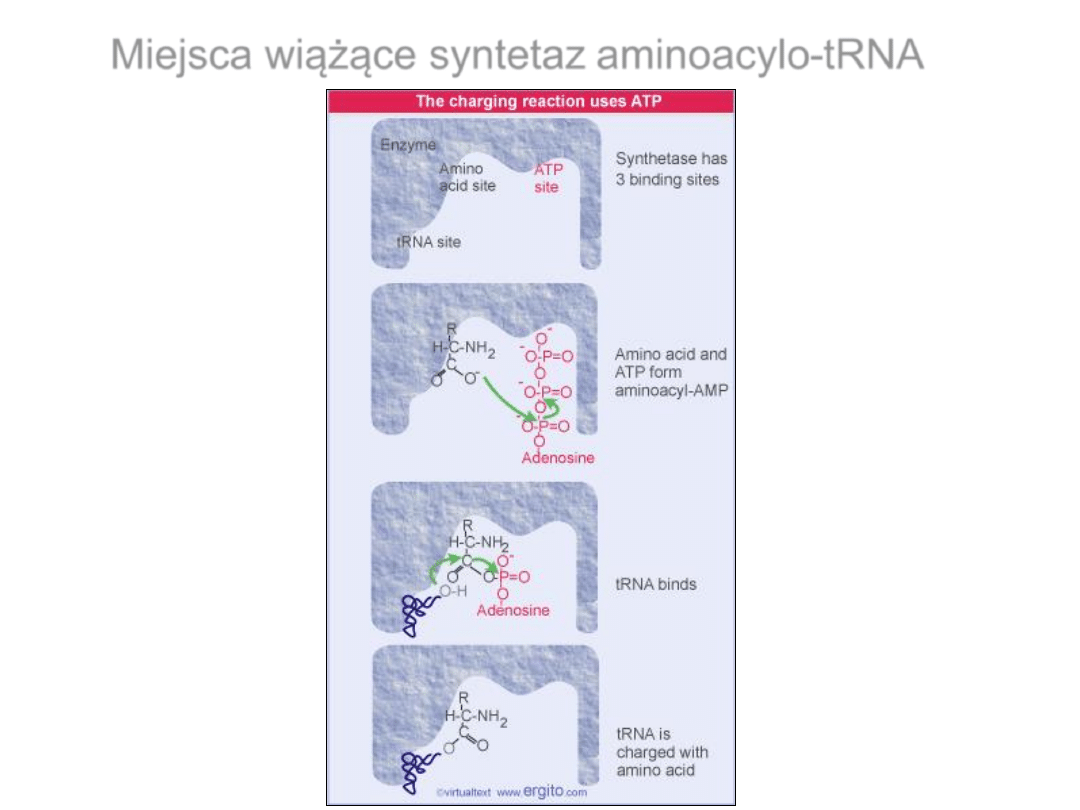
Miejsca wiążące syntetaz aminoacylo-tRNA
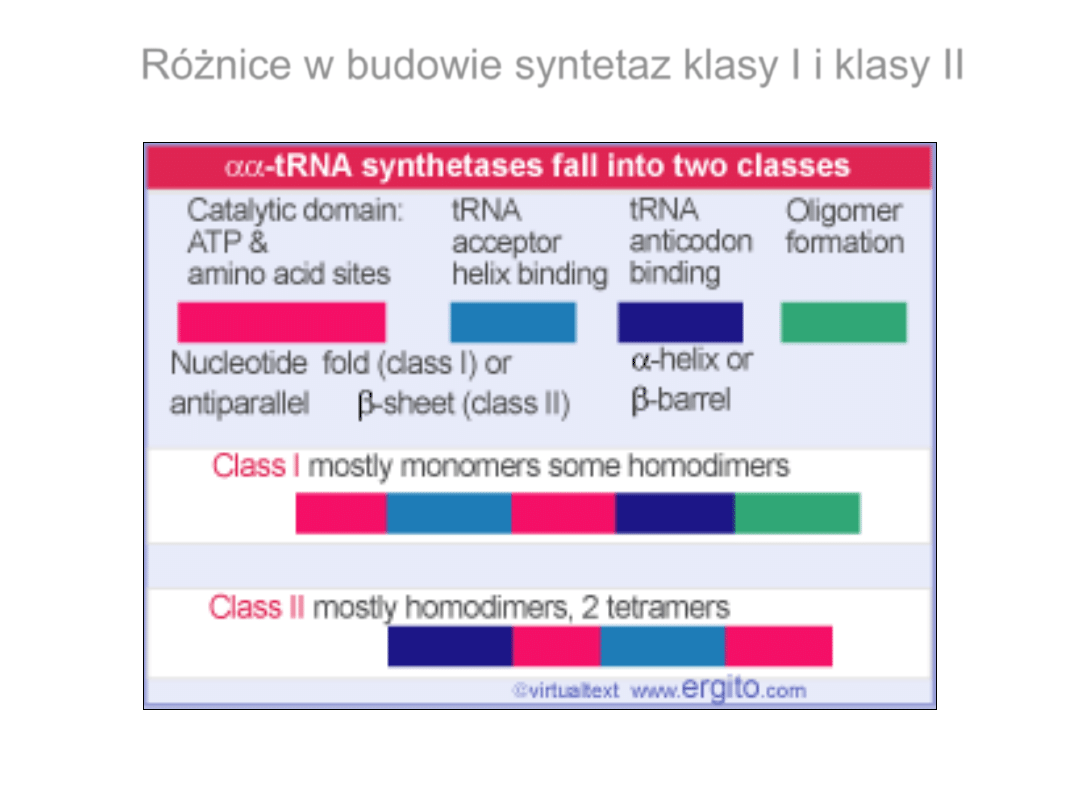
Różnice w budowie syntetaz klasy I i klasy II
Właściwości syntetaz aminoacylo-tRNA
Klasa aaRS
I
II
Charakterystyczna sekwencja
aminokwasowa
HIGH, KMSKS
1) a
d
Ga
h
xxa
h
xxPa
h
a
h
(2) a
d
a
h
a
h
xa
h
xxx(F/Y/H)RxE
(R/H)xxxFxxx(D/E)
(3) xa
h
Ga
h
Ga
h
Ga
h
ERa
h
a
h
a
h
a
h
a
h
Centrum katalityczne
struktura Rossmanna
struktura
antyrównoległa
Miejsce wiązania syntetazy do tRNA
mniejsza bruzda tRNA
większa bruzda tRNA
Miejsce aminoacylacji
przy końcowej
rybozie tRNA
2 ’OH
3 ’OH (z wyjątkiem PheRS)
Podklasy aaRS:
a
b
c
d
Arg, Cys, Ile, Leu, Met, Val
Tyr, Trp
Gin, Glu
His, Thr, Pro, Ser
Asp, Asn, Lys
Ala, Gly
Phe
Kamińska i wsp., 2002, Postępy Biochemii, 48, 189- 199
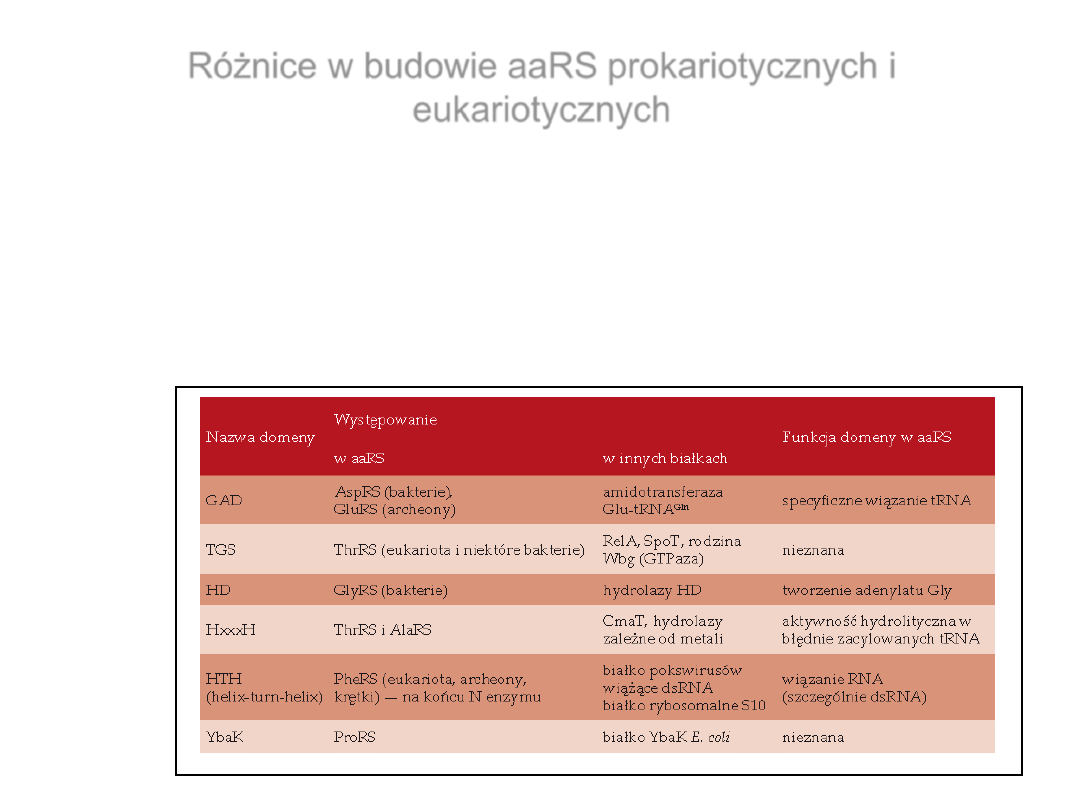
Różnice w budowie aaRS prokariotycznych i
eukariotycznych
-
najstarszą ewolucyjnie domeną aaRS jest centrum katalityczne
-
główne różnice w budowie dotyczą końców N- i C-terminalnych
-
różnice w strukturę aaRS prokariotycznych i eukariotycznych mają ogromne znaczenie w
projektowaniu leków
Domeny wspólne dla aaRS i innych białek
Skupińska i wsp., 2009, Postępy Biochemii, 55, 373- 384
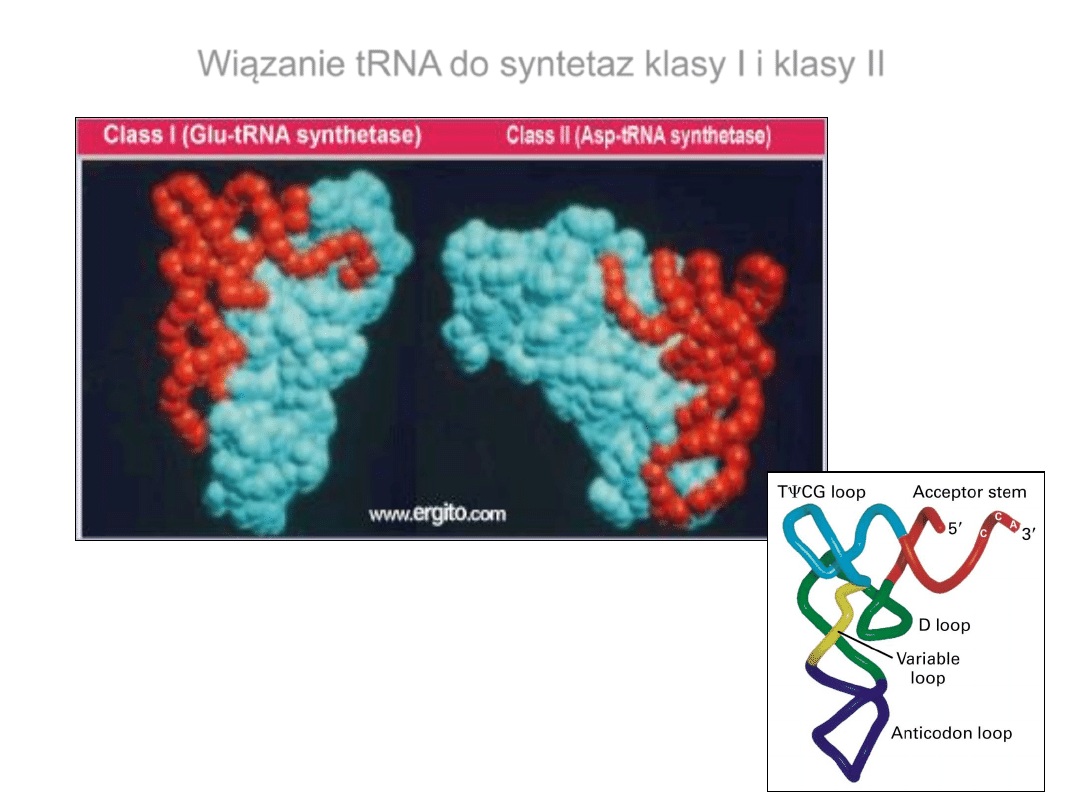
Wiązanie tRNA do syntetaz klasy I i klasy II
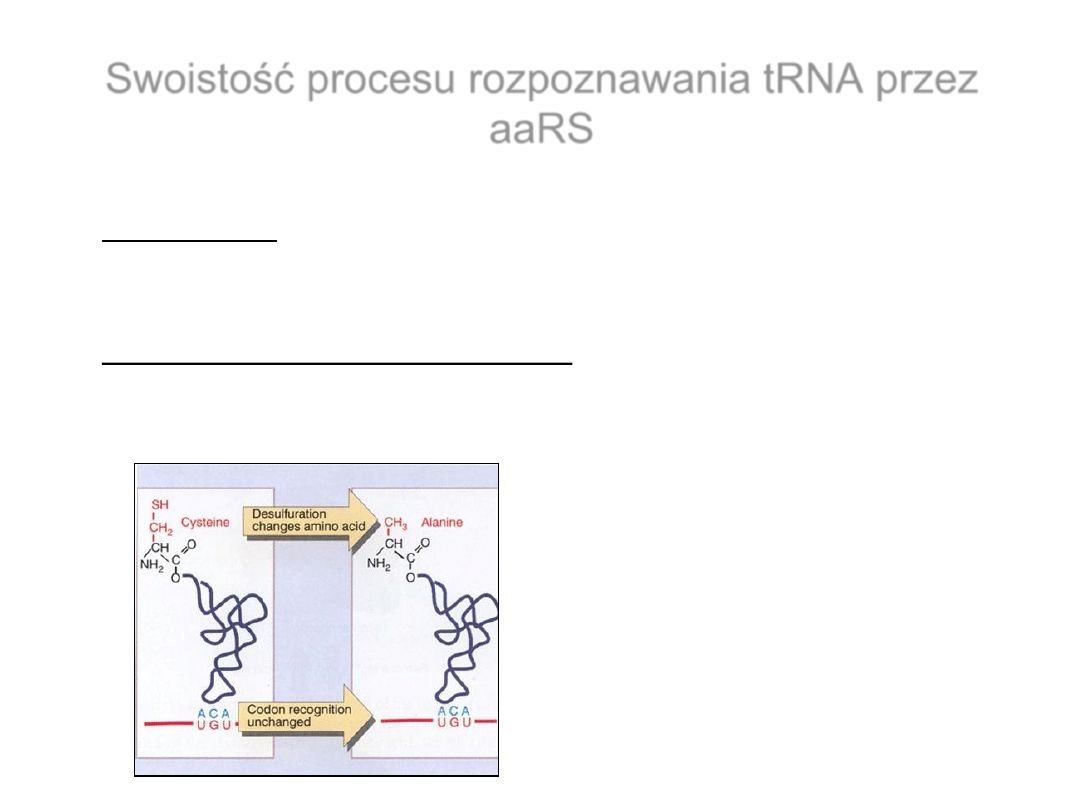
Swoistość procesu rozpoznawania tRNA przez
aaRS
• Rozpoznanie – identyfikacja danego tRNA przez odpowiednią
syntetazę dzięki specyficznym elementom strukturalnym tRNA
• Identyczność (tożsamość) tRNA – aktywność akceptorowa
tRNA
obejmująca
pozytywne
i
negatywne
elementy
rozpoznania
Interakcja
kodon-antykodon
decyduje
o
wbudowaniu
do
nowosyntetyzowanego
polipeptydu
tRNA
Ala
tRNA
Cys
3
C-G
70
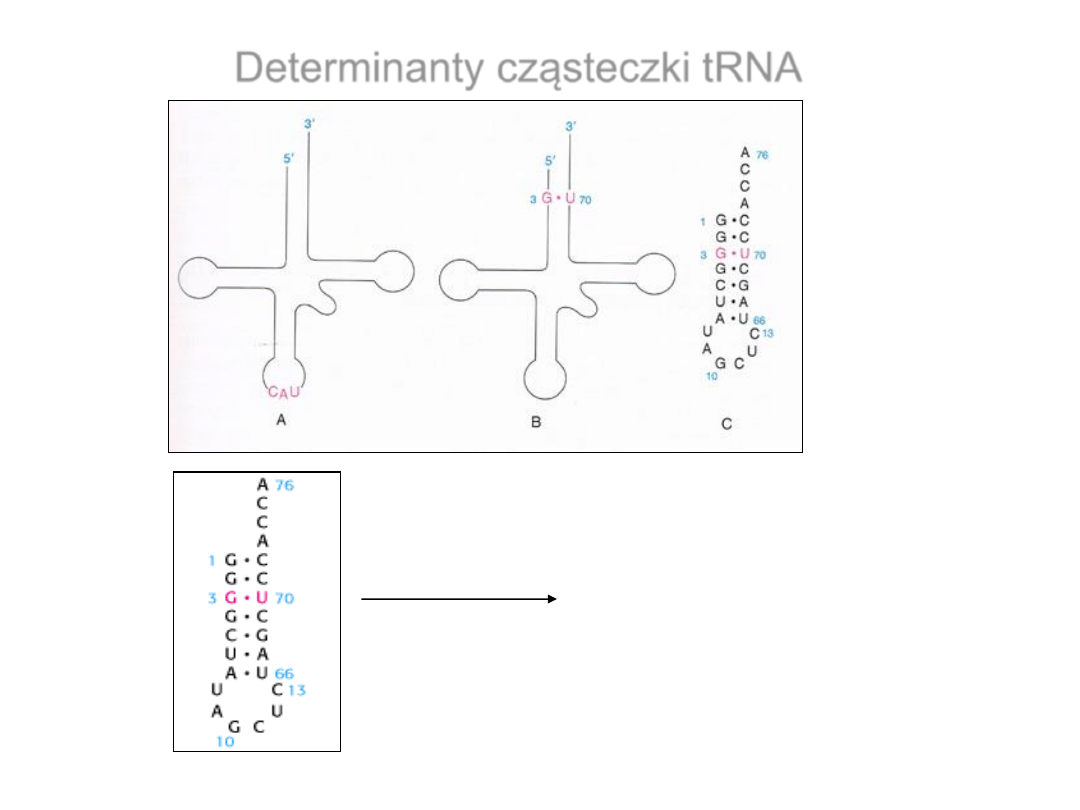
Determinanty cząsteczki tRNA
mini-tRNA

Antydeterminanty
cząsteczki tRNA
•
Antydeterminanty to pojedyncze lub sparowane zasady, które
uniemożliwią błędną aminoacylację
•
tRNA
Ile
modyfikacja L34 zapobiega błędnej aminoacylacji przez syntetazę
specyficzną dla tRNA
Met
•
Cząsteczki, które są substratami dla syntetaz aminoacylo-tRNA klasy I
zawierają antydeterminanty przeciwko enzymom klasy II (tRNA
Leu
/SerRS) i
odwrotnie (tRNA
Asp
/ArgRS)
•
Najprawdopodobniej wszystkie tRNA zawierają antydeterminanty
przeciwko kilku syntetazom
•
Enzym PheRS rozpoznaje i aminoacyluje z dużą wydajnością tRNA
Asp
do
którego wprowadzono główne determinanty fenyloalaniny

Syntetazy rozpoznają kilka charakterystycznych
zasad w tRNA
tRNA Mutacje w tRNA zmieniające oddziaływanie z syntetazą
Syntetazy klasy I
Walinowa 3 zasady antykodonu
Metioninowa 3 zasady antykodonu
Izoleucynowa modyfikacja w pozycji C34 ramienia antykodonowego
Glutaminiowa U35 w antykodonie; U1-A72 i G73 w ramieniu akceptorowym
Syntetazy klasy II
Fenyloalaninowa 3 zasady antykodonu; G20 w pętli D
Serynowa G1-C72; G2-C71; A3-U70 bp w ramieniu antykodonowym; C11-G24 w D
Alaninowa G3-U70 bp w ramieniu akceptorowym
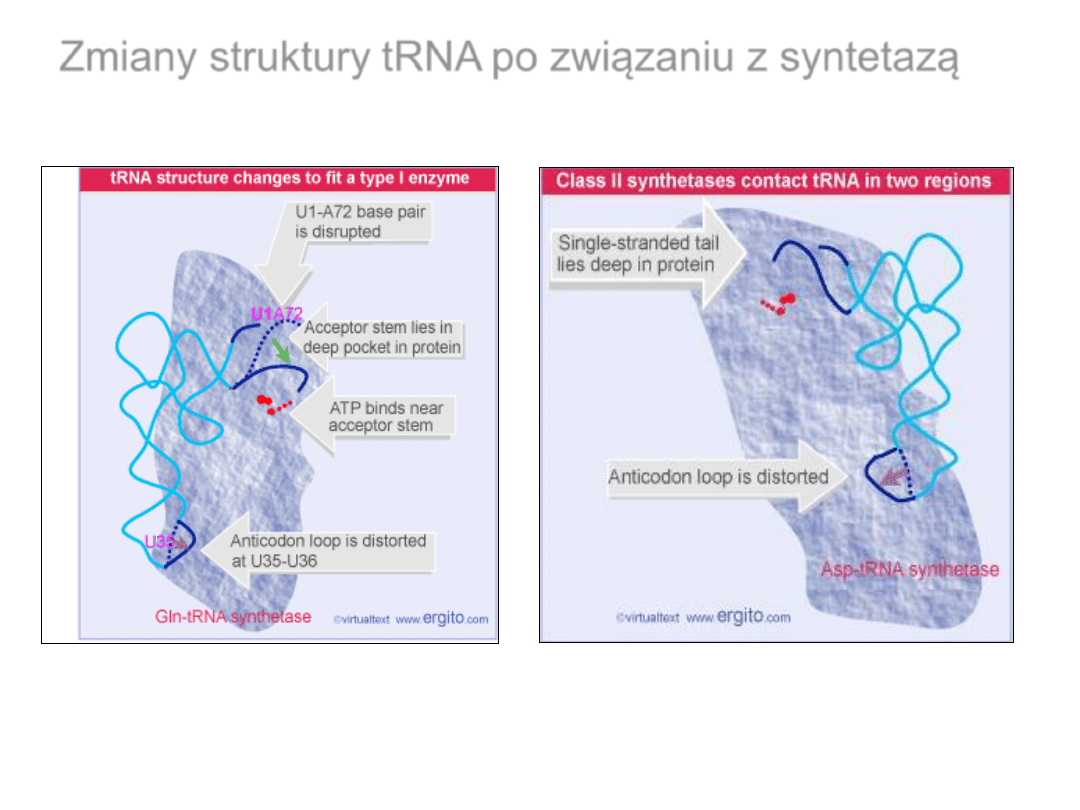
Zmiany struktury tRNA
po związaniu z syntetazą
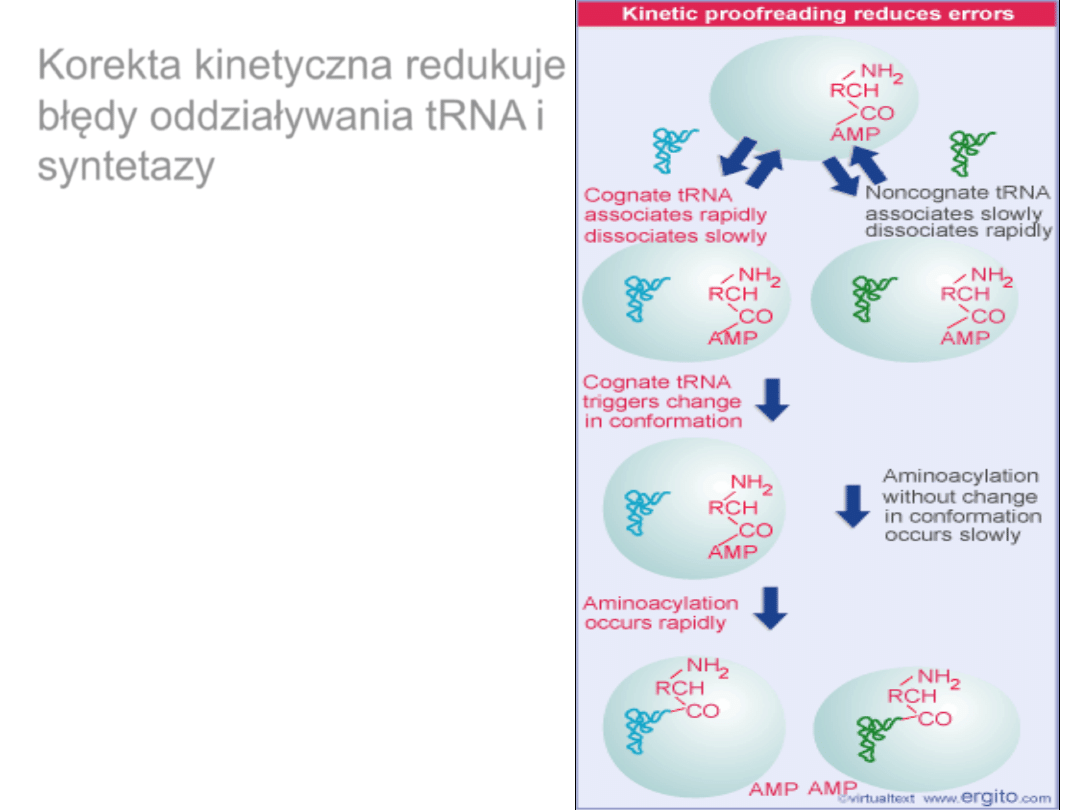
Korekta kinetyczna redukuje
błędy oddziaływania tRNA i
syntetazy
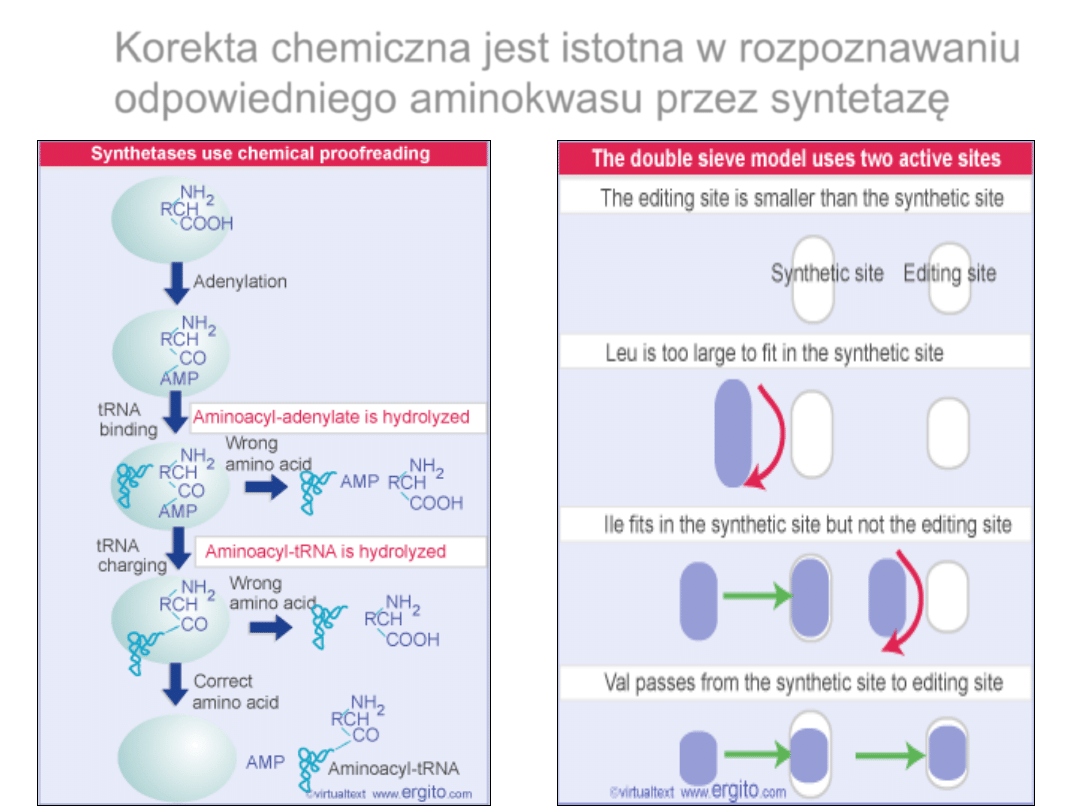
Korekta chemiczna jest istotna w rozpoznawaniu
odpowiedniego aminokwasu przez syntetazę
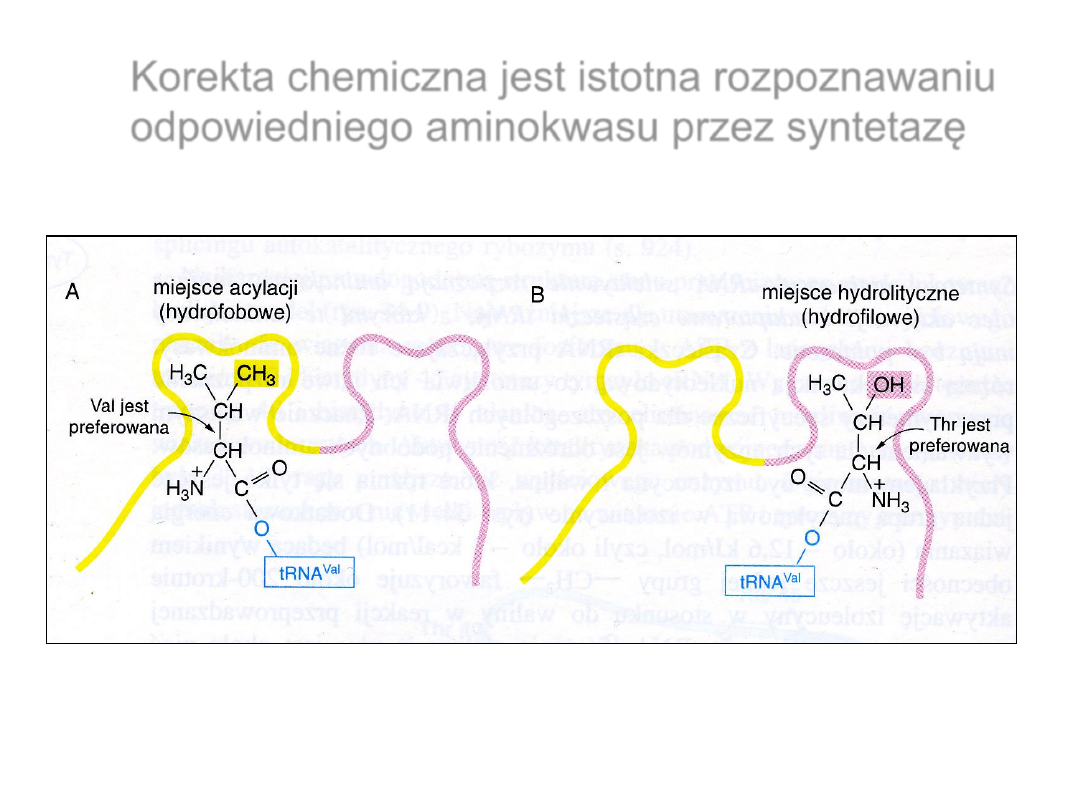
Korekta chemiczna jest istotna rozpoznawaniu
odpowiedniego aminokwasu przez syntetazę
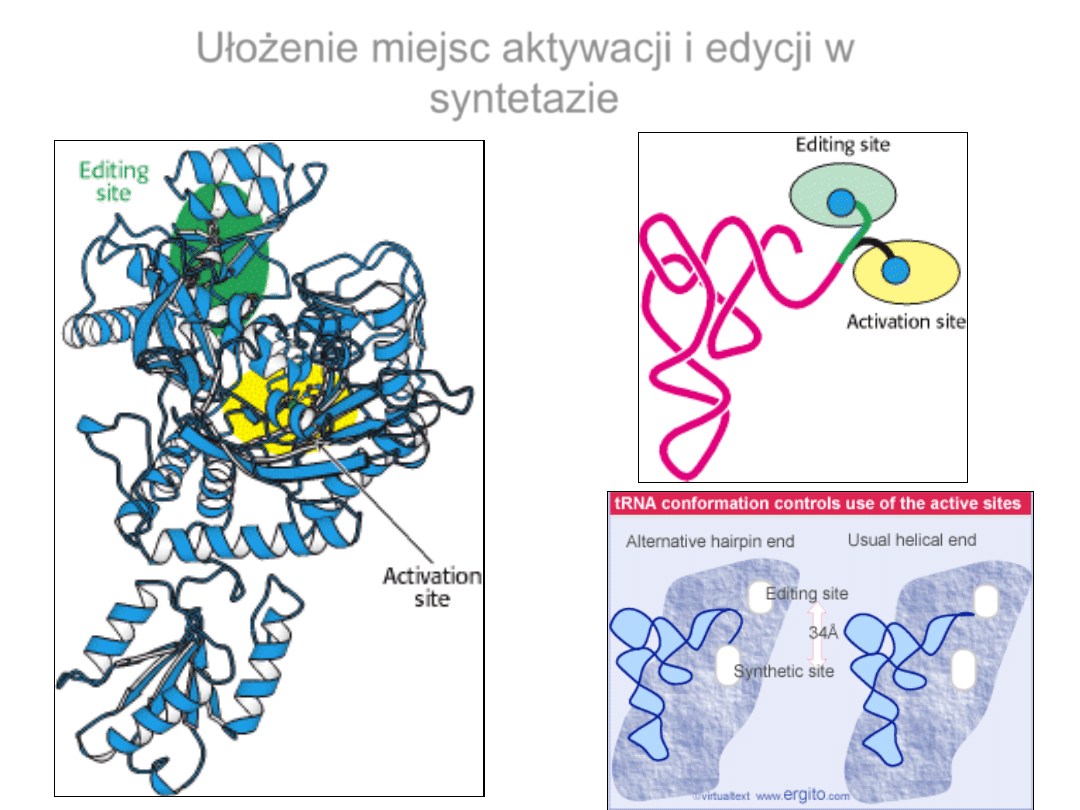
Ułożenie miejsc aktywacji i edycji w
syntetazie

aaRS jako cel molekularny w terapii
przeciwbakteryjnej
-
zapotrzebowanie na nowe leki
-
rozwój wiedzy w zakresie struktury i funkcji aaRS
-
podobieństwo poszczególnych enzymów w obrębie gatunku i pomiędzy
blisko spokrewnionymi bakteriami chorobotwórczymi
-
różnice w strukturze i działaniu syntetaz pochodzących z organizmów
odległych ewolucyjnie stwarzają szansę na opracowanie nowych leków
hamujących specyficznie tylko enzym bakteryjny
-
powszechność występowania syntetaz
-
brak u bakterii izoenzymów poszczególnych syntetaz
-
występowanie w obrębie aaRS wielu potencjalnych miejsc wiązanie
inhibitora
-
istnienie wielu naturalnych inhibitorów aaRS o niskiej toksyczności

Inhibitory syntetaz aminoacylo-tRNA
Substancje pochodzenia naturalnego
Inhibitory syntetyczne
Mupiorycyna (kwas psudomonowy)
Psudomonas fluorescens
Inhibitory na bazie cząsteczki
aminoacyloadenylanu z modyfikacją:
Borelidyna, Streptomyces albovinaceous
nietrwałego wiązania fosfodiestrowego
Agrocyna, Agrobacterium radiobacter
rybozy
adeniny
reszty aminokwasowej
na podstawie Skupińska i wsp., 2009, Postępy Biochemii, 55, 373- 384
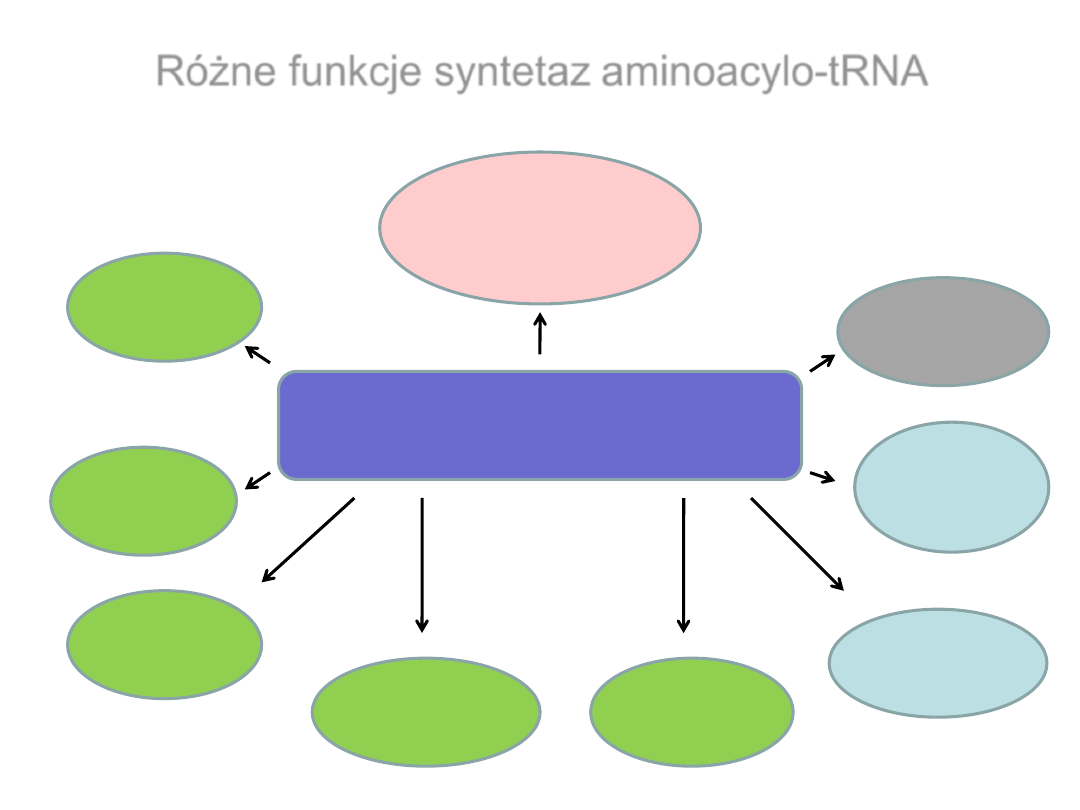
Różne funkcje syntetaz aminoacylo-tRNA
Syntetazy aminoacylo-tRNA
Aminoacylacja
Aminoacylacja
wirusowych
RNA
Biosynteza
chlorofilu
Regulacja
transkrypcji
Dojrzewanie
RNA
Apoptoza
Biosynteza
alarmonów
Aktywność
cytokin
Regulacja
translacji
Skupińska i wsp., 2009, Postępy Biochemii, 55, 373- 384

Rola aaRS
w etiologii chorób u ludzi
• Choroby autoimmunologiczne
-
miopatie zapalne (toczeń rumieniowaty, reumatoidalne zapalenie stawów,
zapalenie mięśni)
• Choroby układu nerwowego
- encefalopatie, ataksje, leukodystrofia
-
choroba Alzheimera i Parkinsona (w złogach β-amyloidu wykryto TrpRS)
• Choroby nowotworowe
-
podwyższony poziom aaRS w raku okrężnicy (MetRS), raku jelita grubego
(IleRS), raka piersi (LysRS), raka tarczycy (GlyRS), raku płuc i przewlekłej
białaczce szpikowej (PheRS)
• Udział MetRS w arteriosklerozie
-
homocystena błędnie rozpoznawana jest przez MetRS
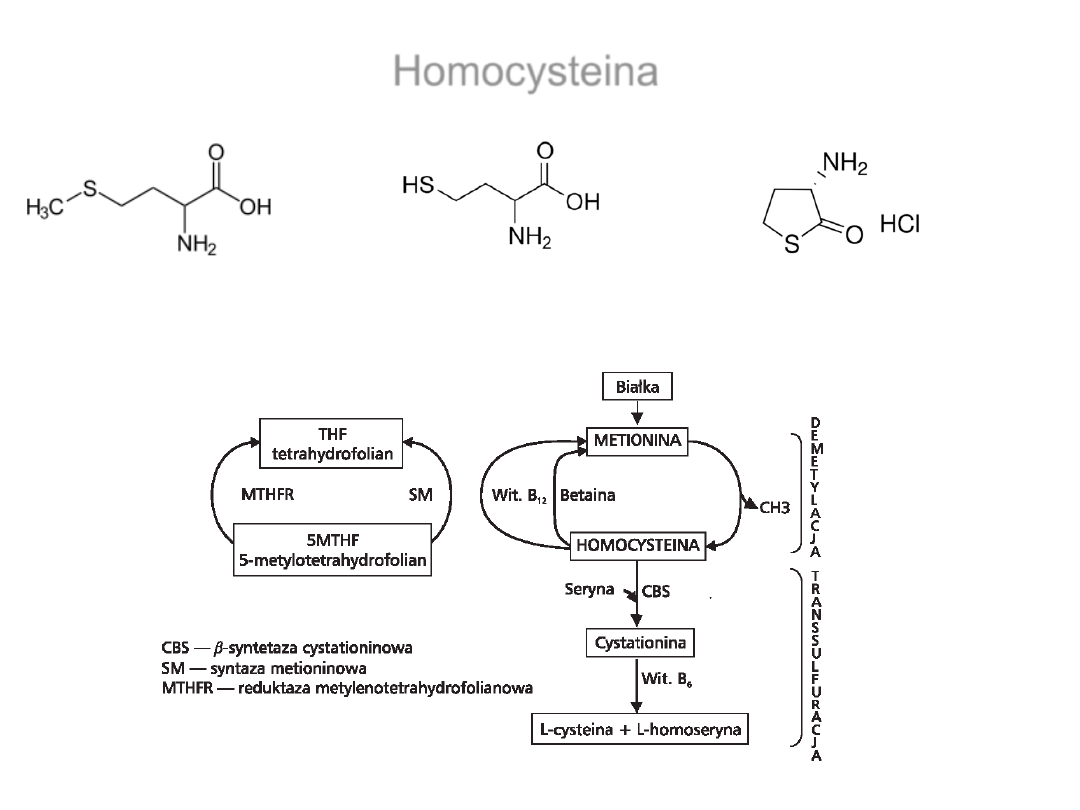
Homocysteina
Metionina (Met)
Homocysteina (Hey)
Tiolakton homocysteiny
Borowska i wsp., 2008. Diabetologia Praktyczna 2008, tom 9, 3
–4, 182–186
Szlak przemian homocysteiny w komórce
Wyszukiwarka
Podobne podstrony:
2014 BPEG część 8 regulacja translacji
2014 BPEG część 5 inicjacja translacji
2014 BPEG część 1 mRNA i tRNA
2014 BPEG część 9 fałdowanie i modyfikacje białek
2014 BPEG część 6 elongacja translacji
2014 BPEG część 2 kod genetyczny
2014 BPEG część 7 terminacja translacji
2014 BPEG część 4 rybosomy
BPEG część 10 systemy degradacji i autofagia
Inzynieria materialowa czesc obliczeniowa, Elektrotechnika AGH, Semestr III zimowy 2013-2014, Inżyni
Podstawy statystyki i ekonometrii 2014 część 1
Podstawy statystyki i ekonometrii 2014 część 2
2014 06 test tech czesc II
egzamin zawodowy MGR 2014 czesc Nieznany
Nowe Standardy Sprawozdawczosci wydanie maj 2014 r czesc II
Nowe Standardy Sprawozdawczosci wydanie czerwiec 2014 r czesc I
więcej podobnych podstron