2009-11-24
1
CHEMIA
Prowadzący
Dr Małgorzata Wojtkowska
WIŚ
p. 406
ZAKRES MATERIAŁU
-
Podstawowe prawa i pojęcia chemiczne
- Modele budowy atomu. Struktura elektronowa
atomu. Poziomy energetyczne i widmo atomu
wodoru wg Bobra. Dualizm korpuskularno-
falowy.
-
Budowa atomu w ujęciu kwantowym. Liczby
kwantowe. Orbitale atomowe-energia i symetria.
Konfiguracje elektronowe, zakaz Pauliego,
Reguła Hunda.
2009-11-24
2
Zmiany własności pierwiastków w obrębie grupy i
okresu (energia jonizacji, energia powinowactwa,
promienie atomowe i jonowe,
-
Elektroujemność, własności kwasowo-zasadowe
pierwiastków, tlenków i wodorotlenków,
-
Wartościowość, metaliczność i niemetaliczność,
amfoteryczność).
-
Związek budowy atomu z układem okresowym.
-
Cząsteczki i wiązania chemiczne. Reguła oktetu.
-
Rodzaje wiązań. Moment dipolowy wiązania i
cząsteczki. Wiązania sigma i pi. Delokalizacja
wiązań. Orbitale molekularne. Hybrydyzacja.
-
Budowa wybranych cząsteczek.
-
Związki kompleksowe. Budowa, nazewnictwo i
izomeria.
- Elementy kinetyki chemicznej. Energia aktywacji.
Równanie kinetyczne na szybkość reakcji.
-
Kataliza. Prawo działania mas – stan równowagi
chemicznej. Reguła przekory.
- Elementy termodynamiki chemicznej. Energia
wewnętrzna. Entalpia. I zasada termodynamiki,
prawo Hessa. Warunki standardowe. Obliczanie
efektów cieplnych reakcji. II zasada termodynamiki.
Entropia. Entalpia swobodna. Warunki
samorzutności reakcji, związek standardowej
entalpii swobodnej reakcji z wartością jej stałej
równowagi.
-
Równowaga chemiczna w roztworach elektrolitów.
Aktywność i współczynnik aktywności (obliczenia).
-
Teorie kwasów i zasad. Iloczyn jonowy wody. Skala
pH. Obliczanie pH kwasów, zasad i soli.
2009-11-24
3
-
Wskaźniki. Reakcje jonowe. Reakcje
strachania osadów. Iloczyn rozpuszczalności.
Efekt solny, efekt wspólnego jonu.
-
Utlenianie i redukcja. Stopię utlenienia.
Połówkowe, jonowe i cząsteczkowe równania
reakcji redox. Bilansowanie reakcji redox.
Szereg napięciowy metali i szereg
elektrochemiczny. Przewidywanie biegu
reakcji redox. Równowaga reakcji redox.
-
Ogniwa galwaniczne. Rodzaje elektrod. Wzór
Nernsta.
-
Procesy elektrolizy wodnych roztworów i
stopionych elektrolitów. Prawa Faradaya.
Zasady ZALICZENIA WYKŁADU
• EGZAMIN
• TRZY CZĘŚCIOWA FORMA ZDANIA
EGZAMINU W TZW. TERMINIE
ZEROWYM:
• Po serii 5 wykładów – sprawdzian
• Zaliczenie trzech sprawdzianów zwalnia z
EGZAMINU
2009-11-24
4
Podstawowe pojęcia
• Reakcje chemiczne są to przemiany w
czasie, których z jednych substancji
powstają inne o odmiennych
właściwościach.
• Reagenty są to substraty i produkty
łącznie.
• Substraty –substancje wzięte do reakcji
• Produkty – substancje otrzymane w
wyniku reakcji
Prawa chemiczne
• Prawo zachowania masy: Masa
substratów równa się masie produktów
reakcji
• Prawo stałości składu: Stosunek
pierwiastków w każdym związku
chemicznym jest stały i charakterystyczny
dla danego związku.
2009-11-24
5
• Prawo stosunków stałych - Prusta (1799) –
każdy zw. chemiczny ma stały skład ilościowy:
np. dwa atomy A i B o masie mA i mB tworzą
zw. AB , to stosunek mas tych pierwiastków jest
stały w tym związku: mA/mB= const.
• Prawo stosunków wielokrotnych: jeżeli dwa
pierwiastki łączą się ze sobą tworząc dwa lub
więcej zw. chemicznych, to ilości wagowe
jednego pierwiastka przypadająca na stałą ilość
drugiego pierwiastka pozostają do siebie w
stosunku prostych liczb całkowitych: np. tlenki
azotu.
• Prawo stosunków objętościowych Gay-
Lussaca (1808)
– prosta zależność liczbowa
objętości łączących się różnych gazów – musi
istnieć związek między liczbami reagujących
cząstek a zajmowaną objętością.
W tej samej temperaturze i pod tym samym
ciśnieniem jednakowe objętości różnych gazów
muszą zawierać jednakową liczbę cząstek – to
zauważył Dalton co było sprzeczne z jego teorią
atomistyczną:
• 1V N + 1V O = 2 V NO
• zatem x V N + xV N = 2x V NO
• a więc 1/2V N + 1/2V O = 1 V NO (nie zgodne z
teorią Daltona o niepodzielności atomów).
2009-11-24
6
• Prawo zachowania materii
• Reakcje chemiczne przeprowadzane w układzie zamkniętym (nie
wymieniającym z otoczeniem masy i energii) przebiegają bez
zmiany łącznej masy reagujących substancji.
• Masa całkowita układu reagującego jest taka sama przed jak i
po reakcji
•
m = const
• Einstein wykazał równoważność masy i energii:
E = mc2
• W reakcjach rozszczepienia czy syntezy jąder atomów znaczna
część masy przechodzi w energię promienistą i słuszne jest prawo
ogólniejsze – prawo zachowania materii : suma masy i energii w
układzie zamkniętym jest stała i nie zależy od zmian zachodzących
w układzie:
•
(m +E/c2) = const
• Można obliczyć, że rozszczepienie 1000 g 235U wyzwala energię
8.23x1013J, co po przeliczeniu daje masę 0.915 g uranu – co
stanowi 0.1% masy początkowej.
Prawo Avogadra
(sformułowane przez
Amadeo Avogadro)
W tych samych warunkach fizycznych tj. w
takiej samej temperaturze i pod takim samym
ciśnieniem, w równych objętościach różnych
gazów znajduje się taka sama liczba
cząsteczek".
1mol gazu
– 22,2 dm3
2009-11-24
7
• Atom jest to najmniejsza część pierwiastka
chemicznego zachowująca jeszcze jego
charakterystyczne właściwości
• Cząsteczka składa się z co najmniej 2 atomów.
Cząsteczka pierwiastka składa się z atomów tego
samego pierwiastka Cząsteczka związku chemicznego
składa się z atomów różnych pierwiastków
• Masa atomowa m
at
jest to masa atomu wyrażona w
jednostkach masy atomowej u
• Masa czasteczkowa m
cz
jest to masa atomu wyrażona w
jednostkach masy atomowej u
• Jednostką masy atomowej jest 1/12 masy atomu
węgla 12C u = 1/12 izotopu(12C) = 0,166 * 10(-23)g
• Liczba atomowa (Z) mówi o ilości protonów i elektronów
liczba masowa (A)
mówi o ilości nukleonów w jądrze. A
-
Z = liczba neutronów
• Nukleony = protony + neutrony
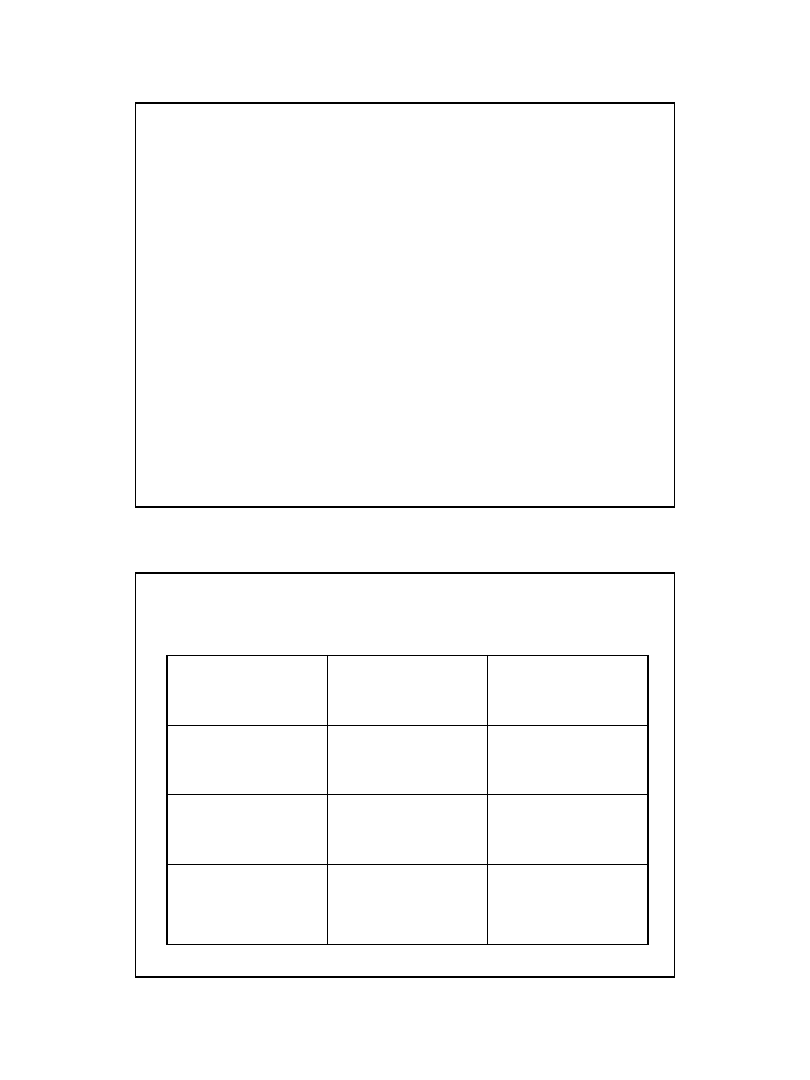
Atom
Nazwa
Promień (m)
Masa
Atom
ok. 10-10
różna w zależności
od pierwiastka
Jądro
ok. 10-15
ok. 99,9% masy
atomu
Elektron
tworzą chmurę o
promieniu
równym promieniowi
atomu
ok. 0,1% masy atomu
2009-11-24
8
Atom c.d.
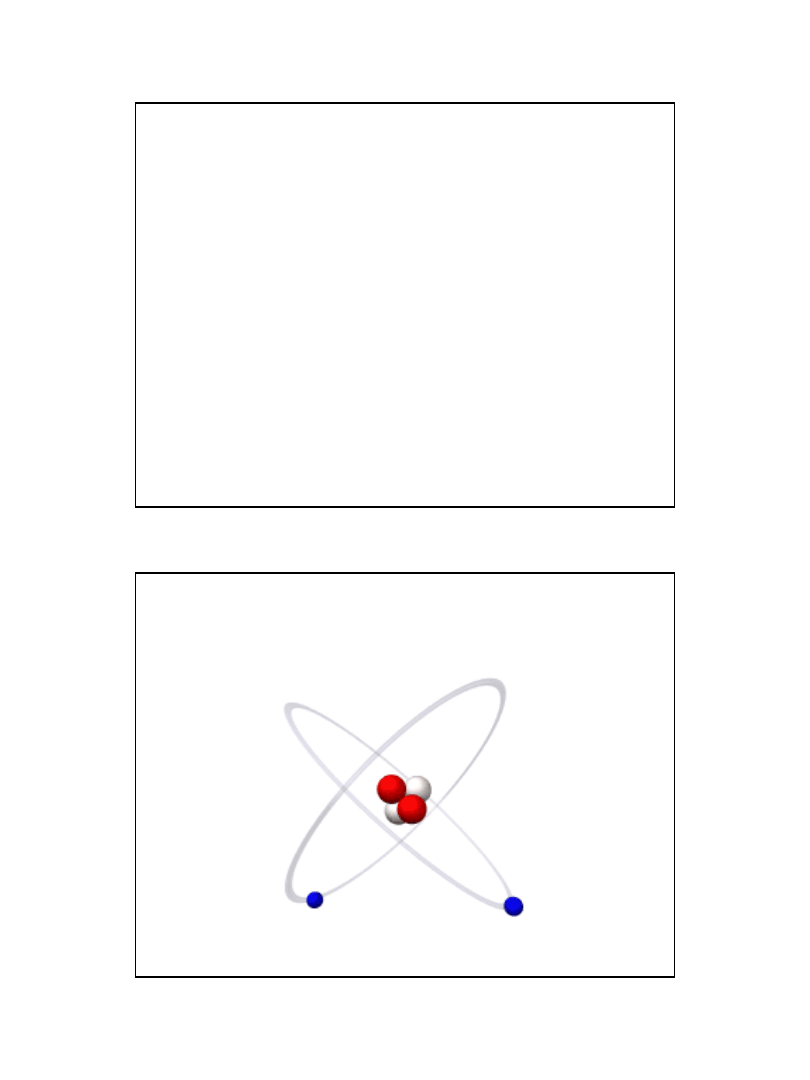
• Każdy atom składa się z jądra i elektronów przebywających w
przestrzeni pozajądrowej.
• Jądro składa się z protonów i neutronów, tzw. nukleonów
(wyjątkiem jest izotop wodoru w jądrze którego jest tylko proton).
• Liczbę protonów w jądrze podaje tzw. liczba atomowa Z, natomiast
liczbę nukleonów – tzw. liczba masowa A.
• Proton - ciężka cząstka elementarna, o masie 1,6726*10-27kg;
około 1 u. Proton ma ładunek +1 składnik jądra atomowego.
• Neutron - ciężka, elektrycznie obojętna cząstka elementarna o
masie 1,6748*10-
27kg; również około 1 u. składnik jądra
atomowego; swobodny -
nietrwały, rozpada się na proton z emisją
negatonu i antyneutrina.
• Elektron ma ładunek -1 i masę 0,00055 u.
Atom Helu
2009-11-24
9
Budowa jądra atomowego
• Jądro ma zawsze mniejszą masę, niż wynikałoby to z
sumowania mas składników tego jądra.
• Różnica pomiędzy sumą mas nukleonów tworzących
jądro danego atomu a rzeczywistą masą tego jądra to
tzw. defekt masy.
• Różnica ta odniesiona do jednostki masy atomowej
stanowi tzw.
względny defekt masy i jest miarą energii
wiązania elementów składowych jądra.
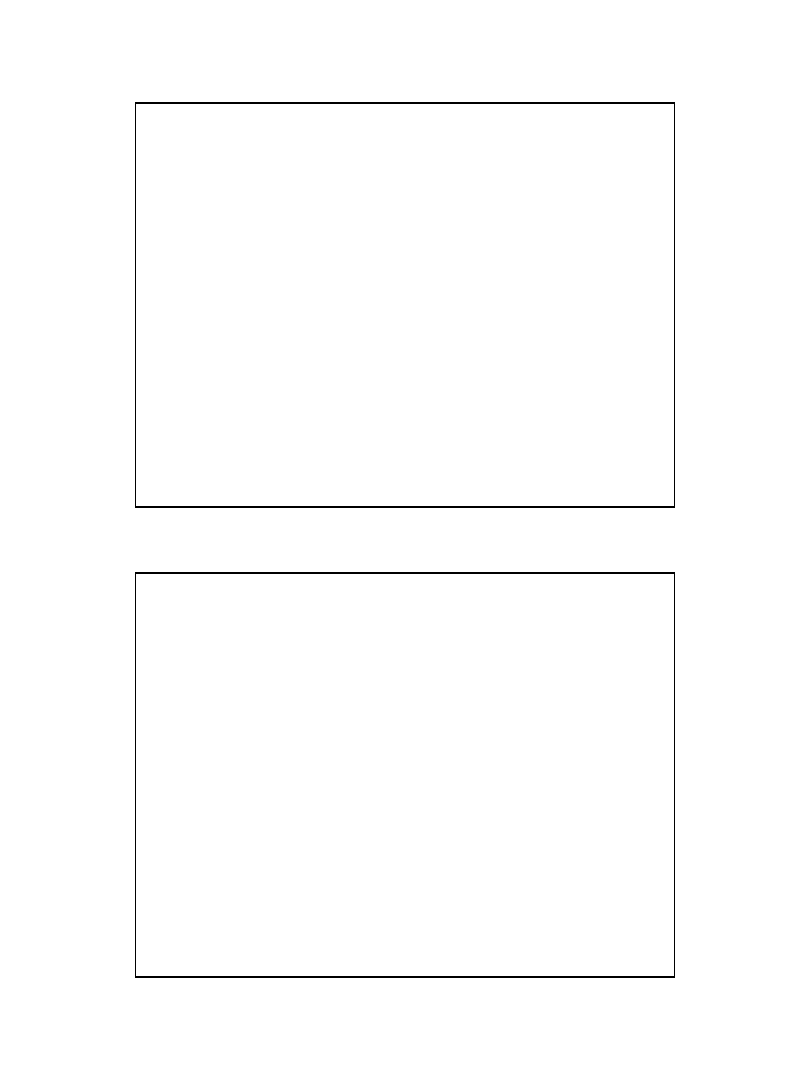
• Nuklid jest to zbiór atomów o tej samej liczbie atomowej i
tej samej liczbie masowej, np.
• 238 U
92
• Deficyt masy (niedobór masy, defekt masy) - różnica Δm między
sumą mas nukleonów wchodzących w skład jądra atomowego, a masą
jądra. Iloczyn niedoboru masy i kwadratu prędkości światła w próżni jest
równy energii wiązania w jądrze, ΔE.
ΔE = Δmc2
• Δm= xm
p
+ ym
n
– m
e(p,n)
• gdzie:
– nuklid zawierający y neutronów i x protonów (N + Z = A)
– mp = 1,00727 - masa protonu w j.m.a.
– mn = 1,00866 - masa neutronu w j.m.a
– mE - masa jądra nuklidu
– c = 3·108 m/s - prędkość światła w próżni
– 1 kg masy to równoważność energii Δm·c2 = 9·1016 J
– 1 g masy to równoważność energii 9·10(13)J
– jednostce masy atomowej (1 u = 1,66053873(13)·10-27 kg) odpowiada
energia 931 MeV
Przykład
różnica pomiędzy masą jądra atomowego, a sumą mas nuklidów składowych:
Dla jądra 4He o masie 4,00150 zawierającego 2 protony (mp = 1,00727) i 2
neutrony (mn =
1,00866) suma mas nukleonów wynosi 4,03186, a więc
deficyt masy Δm = 2mp + 2 mn - mHe = 0,03036 u, co odpowiada
2,73·109 kJ/mol.
2009-11-24
10
– atomy różnych pierwiastków o tej samej liczbie masowej, np.
– atomy tego samego pierwiastka o różnej liczbie masowej, np.
– atomy różnych pierwiastków o takiej samej liczbie neutronów,
lecz różnej liczbie masowej, np.
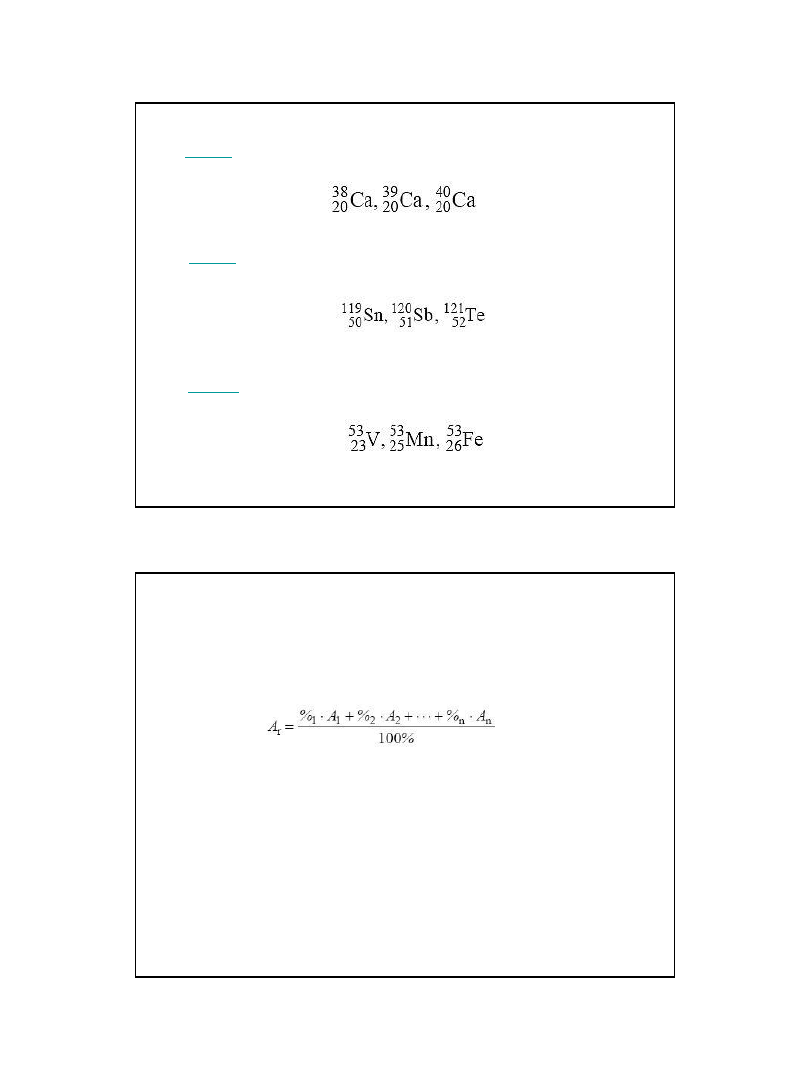
Masa atomowa i masa cząsteczkowa
• Masa atomowa (A) to masa atomu, wyrażona w atomowych jednostkach
masy [u], która stanowi średnią ważoną mas izotopów danego pierwiastka
występujących w przyrodzie:
• gdzie:
• %n – zawartość procentowa danego izotopu,
An
– masa tego izotopu (upraszczając, możemy wstawić do wzoru liczbę
masową tego izotopu).
Atomowa jednostka masy [u] to masa1/12 masy atomu izotopu węgla C-12
• Masa cząsteczkowa (Mr) jest sumą mas atomów wchodzących w skład
cząsteczki i też jest wyrażona w atomowych jednostkach masy [u].
2009-11-24
11
Mol i masa molowa
Mol
– jednostka liczności materii.
1mol = 6,02214179
±0,00000030 · 10(23) cząstek
Masa molowa
– masa pojedynczego atomu wyrażona w atomowych
jednostkach masy.
Masa cząsteczkowa – masa pojedynczej cząsteczki wyrażona w
atomowych jednostkach masy.
Atomowa jednostka masy
– odpowiada 1/12 masy izotopu węgla.
Liczba Avogadra -
określa liczbę atomów stanowiących 1 mol.
N
A
= 6,022137·10(23) mol-1
Jednostką masy molowej jest mol [mol].
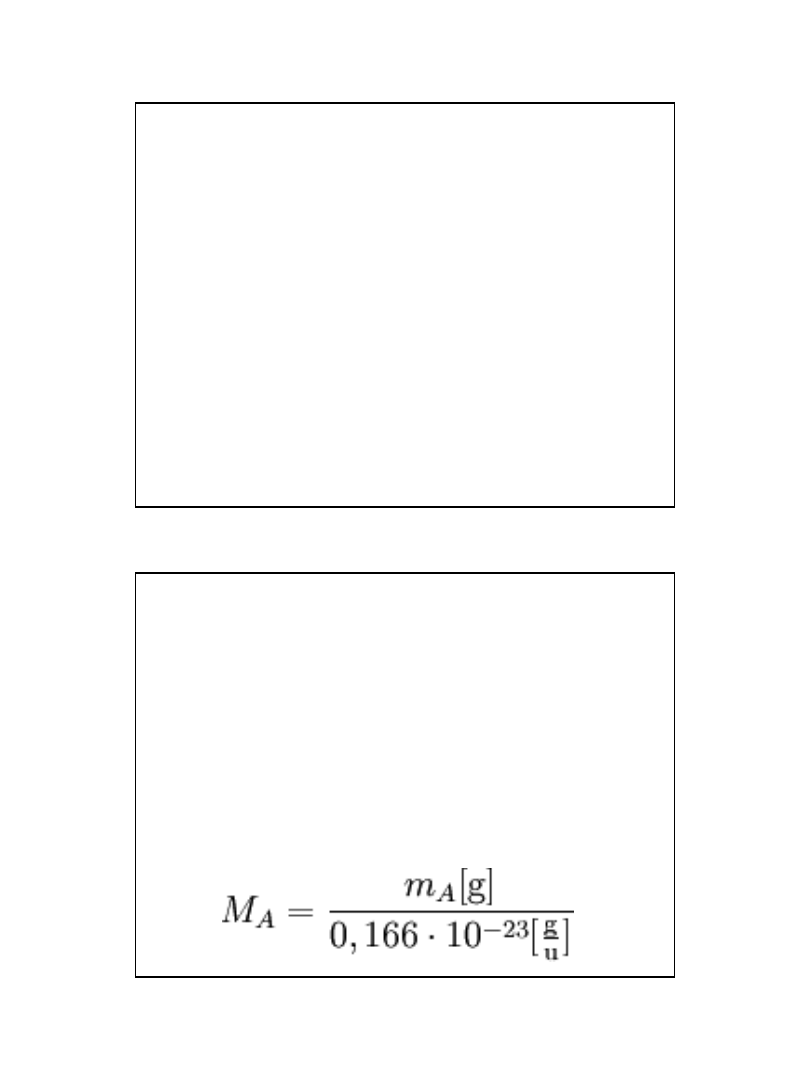
Masa atomowa
• Masa atomowa - liczba określająca ile razy masa
jednego reprezentatywnego atomu danego pierwiastka
jest większa od masy 1/12 izotopu 12C, (atom o średniej
masie wyliczonej proporcjonalnie ze wszystkich
stabilnych izotopów w danego pierwiastka, ze względu
na ich rozpowszechnienie na Ziemi. Masa atomowa jest
wyrażana w jednostkach masy atomowej [u].
• MA - masa atomowa
mA -
bezwzględna masa atomu
0,166·10-23 - 1/12 masy węgla

2009-11-24
12
Jednostka masy atomowej
• u, oznaczana także jako u (z ang. atomic
mass unit)
– jednostka masy, która w
przybliżeniu jest równa masie atomu wodoru,
została zdefiniowana jako 1/12 masy atomu
węgla 12C.
Liczba Avogadra -
określa liczbę atomów
stanowiących 1 mol.
N
A
Objętość molowa - objętość 1 mola gazu wyrażona
w dm3.
• Mol dowolnego gazu zajmuje objętość ok.
22,4 dm3 w tzw. warunkach normalnych
(0
°C czyli 273K, 1 atm, czyli 101325 Pa),.
• 1mol - 6,022137·10(23)at. – 22,4 dm3
2009-11-24
13
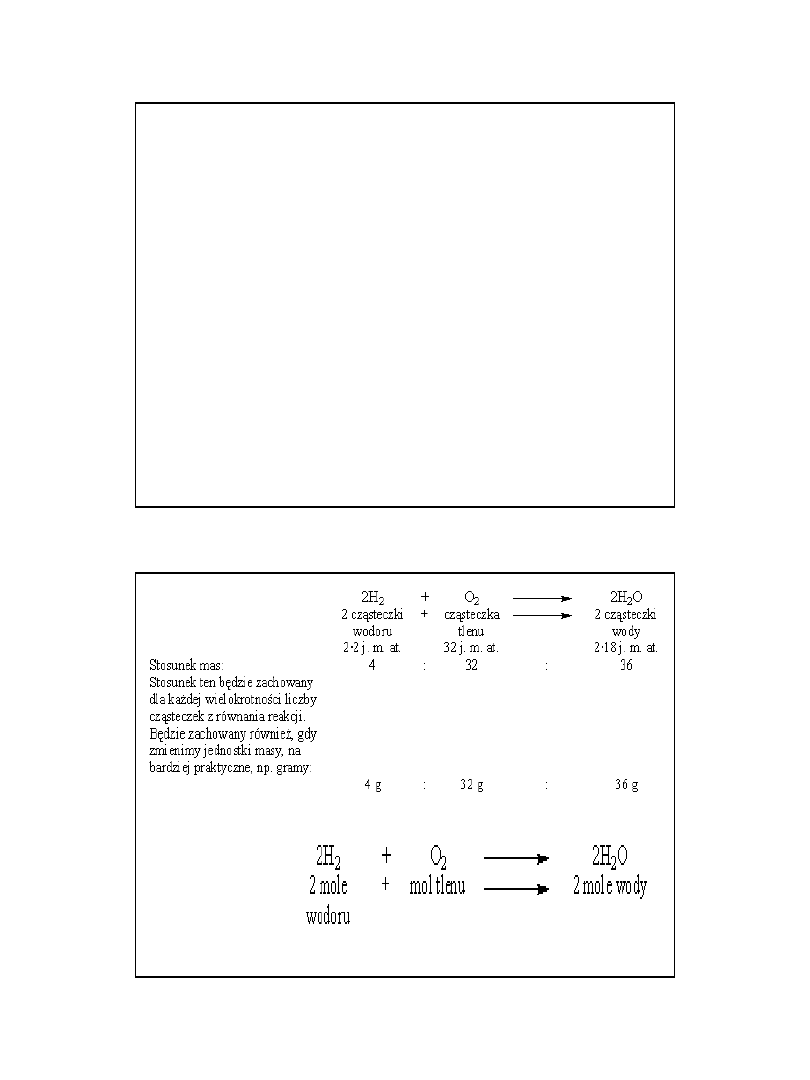
przykład
Dla :
• masy atomowe wodoru i tlenu, to odpowiednio,
1 j. m. at. i 16 j. m. at.;
• masy cząsteczkowe
wodoru H
2
- 2 j. m. at,
tlenu O
2
- 32 j
wody H
2
O - 18 j. m. at.
•Równanie reakcji z przykładu zinterpretujemy zatem:
2009-11-24
14
Postulaty teorii Daltona
John Dalton,
angielski uczony, opracował w 1804r. tezę atomistyczno -
cząsteczkową budowy materii. We współczesnej formie jest ona aktualna do
dzisiaj.
• Pierwiastek chemiczny złożony jest z bardzo małych cząstek,
które nazwano atomami.
•
• Wszystkie atomy danego pierwiastka wykazują identyczne
właściwości chemiczne.
•
• Atomy należące do różnych pierwiastków cechują
się odrębnymi własnościami fizycznymi oraz chemicznymi. W
przyrodzie jest tyle atomów ile pierwiastków.
•
• Atom określonego pierwiastka nie ulega przekształceniu w
innego rodzaju atom (który charakteryzuje inny pierwiastek) w
wyniku standardowej reakcji chemicznej
.
•
Postulaty teorii Daltona c.d.
• Tworzenie związków chemicznych przez pierwiastki
jest związane z łączeniem różnych atomów
(należących do różnych pierwiastków) w wyniku czego
powstają cząsteczki.
•
• Związek chemiczny składa się cząsteczek.
Cząsteczki, wchodzące w skład związku
chemicznego, są identyczne pod względem budowy i
właściwości.
•
• Rozkład związku chemicznego następuje w wyniku
rozpadu cząsteczek na atomy pierwiastków.
• Atomy należące do tego samego pierwiastka również
mogą tworzyć cząsteczki.
2009-11-24
15
• Odkrycie elektronu
• Joseph Thomson w 1896r podczas
doświadczeń z życiem rozrzedzonych
gazów odkrył elektron. Jest to cząstka
elementarna, składowa atomu, oznaczana
symbolem e-
. Charakterystykę elektronu
zestawiono poniższej
• Masa 0,00055u - 9,11 x 10-31kg
• Ładunek 1,6 x 10-19 C
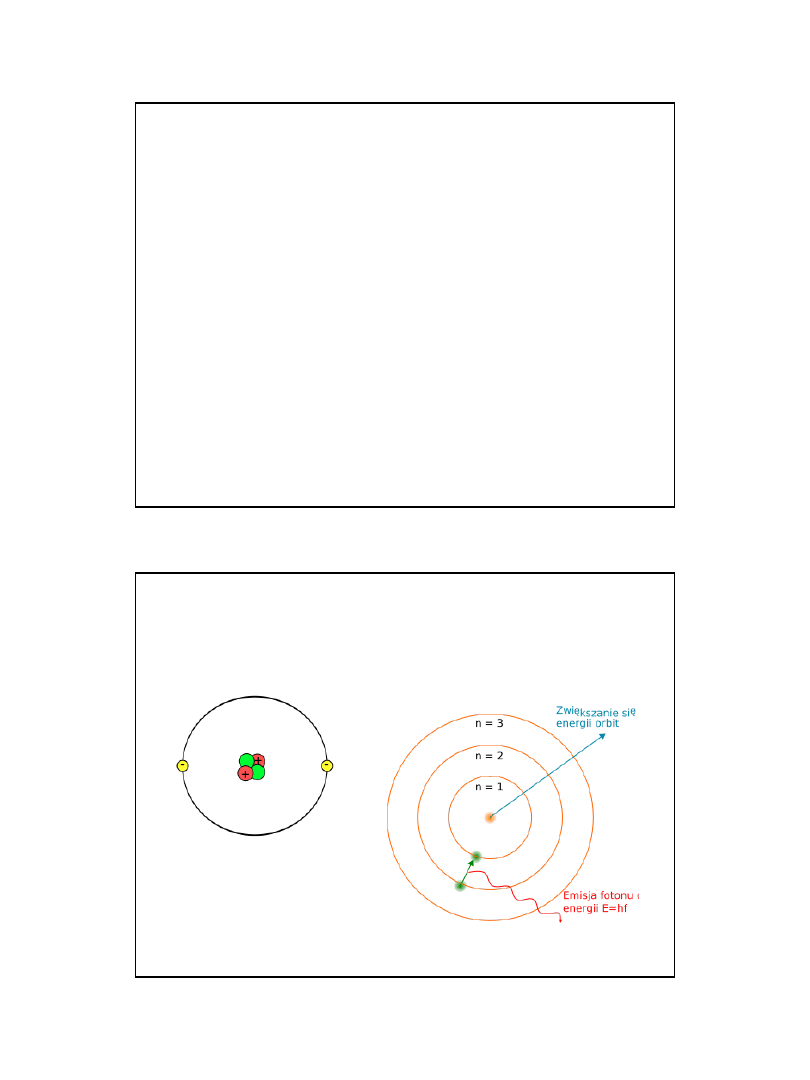
POSTULATY BUDOWY ATOMU BOHRA
Bohr (1913) teorię swą oparł na twierdzeniach , zwanych postulatami Bohra.
1.
Elektron w atomie może przebywać tylko w określonych stanach, o określonej
energii, zwanych stacjonarnymi
2.
Elektron w stanie stacjonarnym nie promieniuje (nie traci energii).
•
= E1 + E2 =
h
– wartość emitowanej energii podczas przejścia do stanu o
wyższej energii
.
3.
Dozwolone stany dla ruchu elektronu odpowiadają tylko pewnym
dozwolonym wartościom (kwantom) orbitalnego momentowi pędu
będącego wielokrotnością liczby h/2
: mvr =n(h/2
)
4.
W każdym z tych stanów elektron porusza się wokół jądra po
orbicie kołowej.
Tylko takie orbity są dozwolone, dla których iloczyn długości orbity
i pędu elektronu jest równy całkowitej wielokrotności stałej
Plancka.
2 rmv=nh ; n=1,2,3.......
2009-11-24
16
• Dwa pierwsze postulaty są poprawne i
zachowane w teorii kwantowej.
• Trzeci jest słuszny częściowo – moment
pędu elektronu jest wielkością stałą.
• Czwarty jest całkowicie niesłuszny –
elektron porusza się po orbicie kulistej.
• Bohr nie wyjaśnił dlaczego moment
pędu jest kwantowany – założenie to
dawało zgodność między
przewidywaniami a obserwacją.
• Dopiero w 1924 de Broglie podał wyjaśnienie –
każda poruszająca się cząstka ma falową naturę
(jak światło)
•
= h/mv
– długość faly jest b. mała w
porównaniu z wymiarami cząstki
• Dualizm korposkularny – cząstka posiada
masę i długość fali
• Zasada nieoznaczoności Heisenberga –
niemożliwość jednoczesnego, dokładnego
pomiaru położenia i pędu cząstki.
• Wyprowadził on wzór łączący masę cząstki
(m), prędkość (v) oraz energie kinetyczną (E):
E = mv2 / 2
2009-11-24
17
• Mimo pozornej poprawności modelu zrezygnowano z
niego, ponieważ zgodnie z elektrodynamiką klasyczną
poruszający się po okręgu (lub elipsie), a więc
przyspieszany, elektron powinien, w sposób ciągły,
wypromieniowywać energię i w efekcie "spadłby" na
jądro już po czasie rzędu 10-6 sekundy.
• Fakt, że tak się nie dzieje, nie dawał się wytłumaczyć
na gruncie fizyki klasycznej.
• Model Bohra został ostatecznie odrzucony również ze
względu na to, że:
-
nie dawało go się zaadaptować do atomów
posiadających więcej niż dwa elektrony
-
nie można było za jego pomocą stworzyć
przekonującej, zgodnej ze znanymi faktami
eksperymentalnymi teorii powstawania wiązań
chemicznych
Orbitalny model atomu helu i model
budowy atomu Bohra
2009-11-24
18
Model falowy
Teoria ta korzysta z praw mechaniki kwantowej.
Nie ma tu elektronu, jako korpuskuły, bo nie można go
dostrzec w określonym punkcie, a jedynie mówić o
prawdopodobieństwie jego występowania w
określonej przestrzeni.
Złożone wyrażenia matematyczne ustalają rozkład
gęstości elektronowej.
Stany energetyczne w atomie są określone, podobnie
jak w modelu Bohra, przez liczby kwantowe.
Teoria falowa w precyzyjniejszy niż wcześniej sposób,
opisuje zachowanie się atomów wieloelektronowych.
Pomimo wielu niedokładności w modelu Bohra,
czasem okazuje się on być przydatny przy
wyjaśnianiu prostych założeń chemicznych.
• W centralnej części atomu znajduje się dodatnio
naładowane jądro, w którym znajdują się protony i
neutrony.
• Za zwartą strukturę jądra atomowego odpowiadają siły
jądrowe.
• Natura tych sił nie została do dzisiaj poznana.
• Wokół jądra, w bardzo znacznej od niego odleglości
(biorąc pod uwagę rozmiar samego jądra), bezustannie i
z ogromną prędkością krążą po eliptycznych torach
elektrony.
• Między jądrem a elektronami istnieje wolna przestrzeń.
• Tę pozornie pustą przestrzeń wypełnia chmura
elektronowa i ich pole elektromagnetyczne.
• Elektrony krążą z ogromną prędkością i wykonują około
6 mld okrążeń na mikrosekundę.
• Bardzo trudno jest jednoznacznie powiedzieć w którym
konkretnie miejscu, znajduje się elektron w danej chwili.
• Elektron znajduje się wszędzie dokoła jadra i tworzy coś
w rodzaju chmury. Elektrony krążące w tej samej
odległości od jądra tworzą tzw. powłokę elektronową.

2009-11-24
19
Kwarki
• Fizycy odkryli, że protony i neutrony są zbudowane z jeszcze
mniejszych cząstek, zwanych kwarkami.
• Według naszej dotychczasowej wiedzy kwarki są jak punkty w
geometrii. Nie są one zbudowane z niczego innego.
W chwili obecnej, po wielu doświadczeniach sprawdzających tę
teorię, naukowcy podejrzewają, że kwarki i elektron są elementarne.
•
Istnieje sześć rodzajów kwarków. Trzy z nich mają ładunek +2/3e, a
pozostałe ładunek -1/3e. Nazwy kwarków pochodzą od pierwszej
litery angielskich nazw
• Proton składa się z 3 kwarków: 2 kwarków u i jednego d, a neutron
także z 3 kwarków, tyle że 2 kwarków d i jednego u.
Dzięki ułamkowym wartościom ładunku kwarków, cząstki
elementarne z nich zbudowane mają ładunek całkowity.
Kwarki
kwarki i elektrony są mniejsze niż 10 do potęgi -18 metra, jest wiec możliwe ze
nie maja one w ogóle żadnego rozmiaru. Jest tez możliwe, ze kwarki i
elektrony nie są cząstkami elementarnymi, ale zbudowane są z jeszcze
mniejszych cząsteczek.
atomy są zbudowane z protonowa, neutronowa i elektronowa.
Protony i neutrony są zbudowane z kwarków, które być może są
zbudowane z jeszcze bardziej podstawowych cząstek...
2009-11-24
20
Trwałość jądra
• Trwałość jądra jest utrzymywana dzięki siłom
jądrowym. Mają one bardzo niewielki zasięg
działania z powodu bardzo małego promienia
jądra atomowego, którego średnica jest równa
ok. 10(-15)
– 10(-14) m.
• Za trwałość jądra odpowiadają siły jądrowe
działające pomiędzy nukleonami, charakteryzują
się bardzo małym zasięgiem (rzędu 10-13 cm)
oraz brakiem związku z ładunkiem. Neutrony
oraz protony mogą wymieniać ładunek między
sobą na wskutek zderzeń. Energia związana z
oddziaływaniami między składnikami jądra
została określona jako energia wiązania jądra.
• Neutrony oraz protony mogą wymieniać ładunek
między sobą na wskutek zderzeń. Energia
związana z oddziaływaniami między składnikami
jądra została określona jako energia wiązania
jądra.
• Energię wylicza się z równania Einsteina:
E = mc2
• Jej wartość wskazuje na to jaka energia musi
być dostarczona, by rozbić jądro albo jaka ilość
jest wydzielona podczas jego tworzenia. Wzrost
energii wiązania oraz defektu masy czyni jądro
bardziej trwałe stabilne.

2009-11-24
21
Jądra trwałe to takie, które:
• Posiadają równe ilości protonów i
neutronów
• Posiadają parzyste ilości protonów oraz
neutronów
• Stosunek protonów do neutronów wynosi
2 : 3
W pozostałych przypadkach następuje
samorzutny rozpad.
Suma protonów oraz neutronów w zasadzie
jest równa masie jądra w jednostkach mas
atomowych u.
Wyszukiwarka
Podobne podstrony:
P1 podstawowe pojecia id 344421 Nieznany
CHEMIA I Podstawowe pojecia [t Nieznany
FANUC podstawy programowania id Nieznany
1 Podstawowe pojeciaid 9565 Nieznany (2)
Laboratorium Podstaw Fizyki id Nieznany
EZNiOS Log 12 13 w4 pojecia id Nieznany
CHEMIA I Podstawowe pojęcia
jezc w02 podstawy c windows id Nieznany
Cwiczenia 1 podstawy edycji id Nieznany
Podstawowe pojecia pedagogiczne Nieznany
2003 probna matura styczen 2003 Chemia podstawowa arkusz1 id 60 (2)
1 Podstawowe pojeciaid 8624 Nieznany (2)
Emocje podstawowe i pochodne id Nieznany
chemia nieorganiczna zadania id Nieznany
więcej podobnych podstron