1
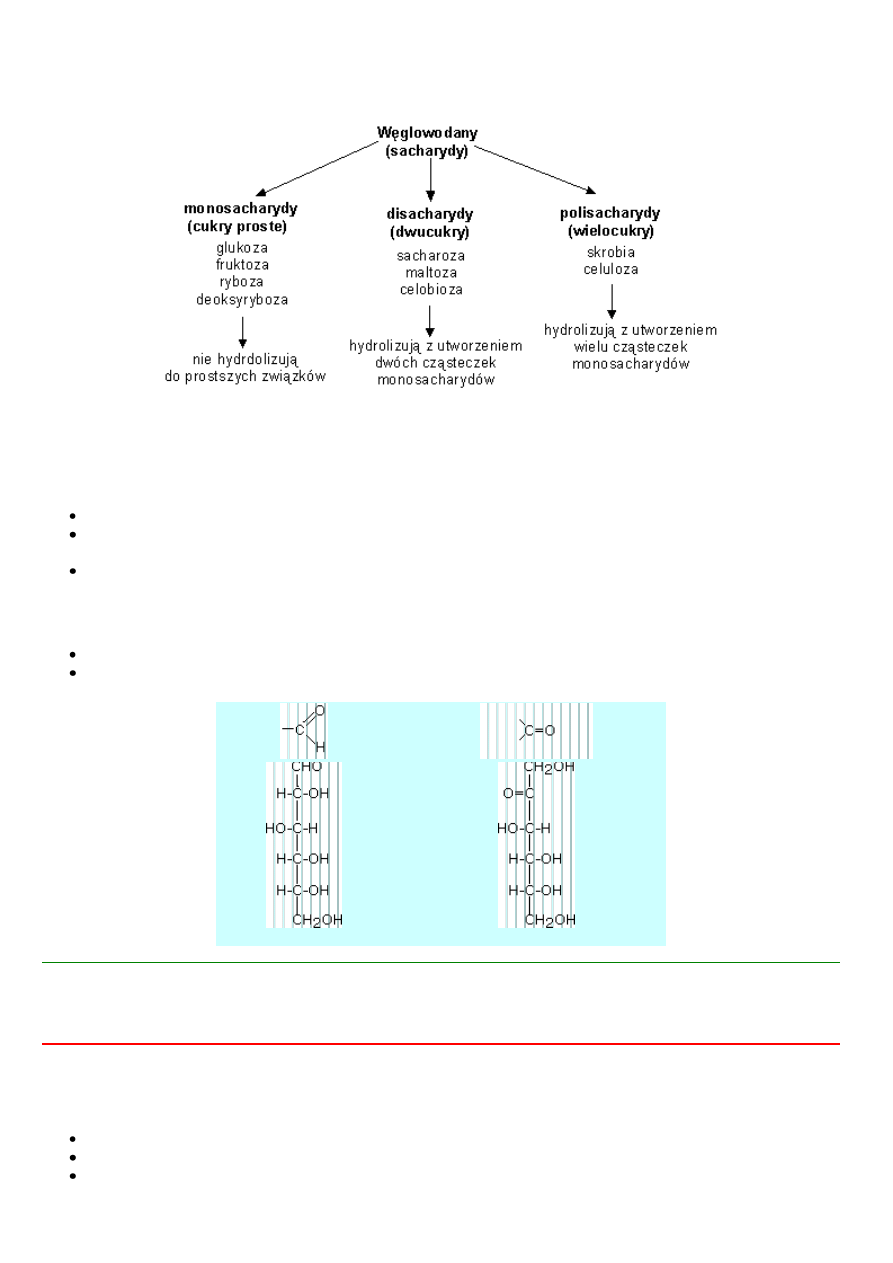
Węglowodany
Węglowodany swoja nazwę zawdzięczają stąd, że związki te na ogół można przedstawić wzorem empirycznym C
x
(H
2
O)
y
, w którym
węgiel przedstawia się jako uwodniony.
Zgodnie z nową definicją węglowodanami nazywamy wielowodorowe aldehydy oraz wielowodorowe ketony, a także związki, z
których takie hydroksyaldehydy lub ketony można otrzymać w wyniku hydrolizy.
węglowodan, który nie ulega hydrolizie do prostszych związków, nosi nazwę monosacharydu (cukru prostego).
węglowodan, którego cząsteczka hydrolizuje do dwóch cząsteczek monosacharydu, nazywa się disacharydem
(dwucukrem).
węglowodan, którego cząsteczka hydrolizuje do wielu cząsteczek monosacharydów, nazywa się polisacharydem
(wielocukrem, cukrem złożonym).
Według innego podziału
cukry które zawieraja w cząsteczce grupę aldehydowa nazywane są aldozami,
cukry zawierające grupę ketonową noszą ogólna nazwę ketoz.
Aldoza
Ketoza
Monosacharydy (cukry proste)
Monosacharydy, obok licznych grup wodorotlenowych, posiadają grupę aldehydową -CHO albo ketonową =C=O.
Zgodnie z obecnością tych grup cukry proste dzielimy na aldozy i ketozy
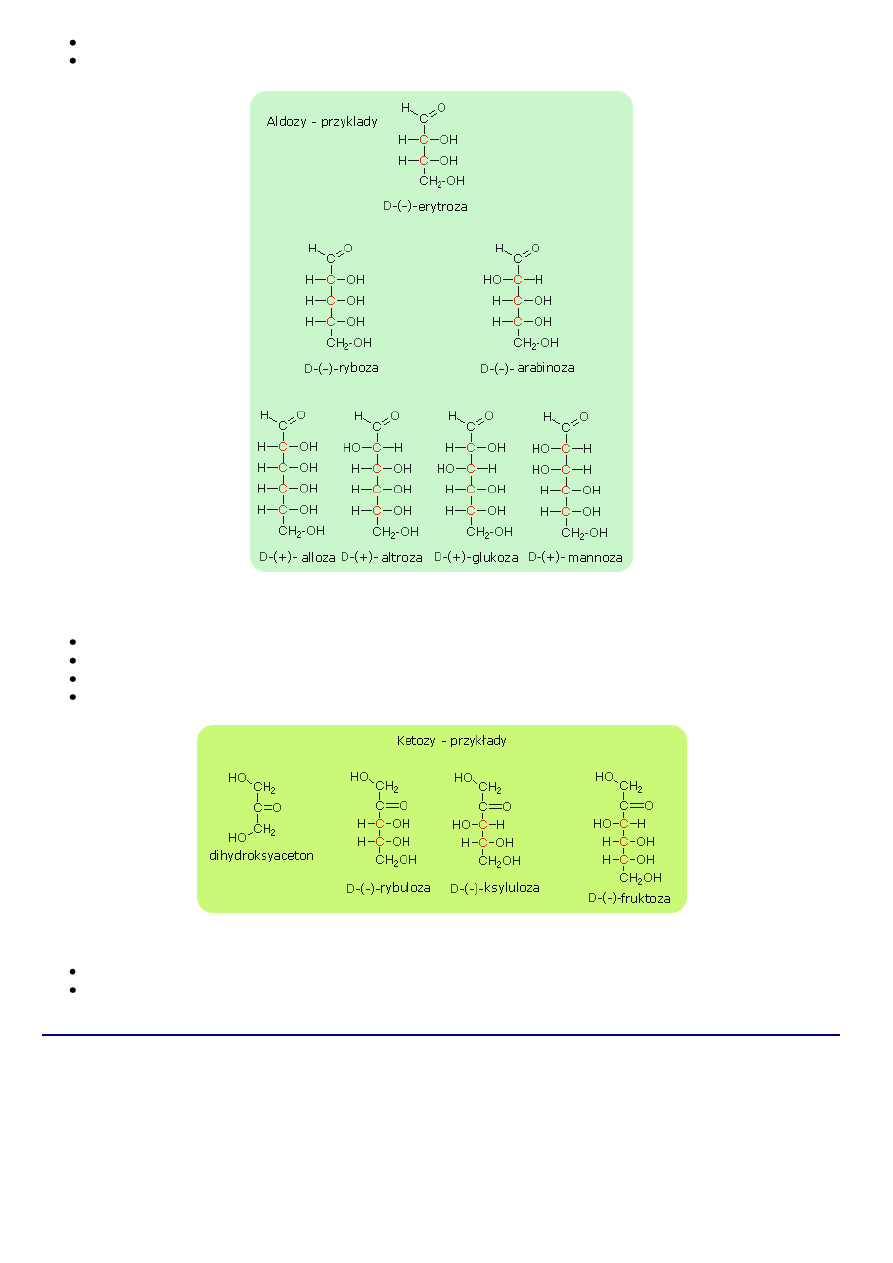
1. Nazewnictwo
W nazwach ogólnych cukrów prostych przyjęto zasadę uwidaczniania ilości atomów węgla albo atomów tlenu w cząsteczce.
Zgodnie z tą zasadą aldozy będą nazywane;
najprostszą aldozą jest aldehyd glikolowy CH
2
OH-CHO, który posiada dwa atomy węgla stąd nazwa aldodioza
CH
2
OH-CHOH-CHO - aldotrioza (trzy atomy węgla w cząsteczce)
CH
2
OH-(CHOH)
2
-CHO - aldotetroza (cztery atomy węgla w cząsteczce)
2
CH
2
OH-(CHOH)
3
-CHO - aldopentoza (pięć atomów węgla w cząsteczce)
CH
2
OH-(CHOH)
4
-CHO - aldoheksoza (sześć atomów węgla w cząsteczce)
Szereg ketoz, zaczyna się od cukrowca posiadającego trzy atomy węgla:
CH
2
OH-CO-CH
2
OH ketotrioza (trzy atomy węgla w cząsteczce)
CH
2
OH-CHOH-CO-CH
2
OH ketotetroza (cztery atomy węgla w cząsteczce)
CH
2
OH-(CHOH)
2
-CO-CH
2
OH ketopentoza (pięć atomów węgla w cząsteczce)
CH
2
OH-(CHOH)
3
-CO-CH
2
OH ketoheksoza (sześć atomów węgla w cząsteczce)
Oprócz nazw ogólnych dla poszczególnych grup cukrów prostych w nazewnictwie cukrów prostych stosuje się;
nazwy zwyczajowe
nazwy systematyczne
2. Sposoby rysowania wzorów cukrów
Atomy węgla w cząsteczkach cukrów prostych mogą mieć różne ułożenie przestrzenne i tworzyć łańcuchy lub zamknięte
pierścienie. Konfiguracje łańcuchowych form monosacharydów przedstawia się za pomocą wzorów Fischera, a ich przestrzenne
struktury pierścieniowe - za pomocą wzorów Hawortha. We wzorach Fischera atomy węgla łańcucha głównego ułożone są
pionowo w ten sposób, że grupa aldehydowa (lub ketonowa) znajduje się najwyżej. Pozostałe atomy lub grupy atomów zapisujemy
po lewej albo po prawej stronie łańcucha głównego.
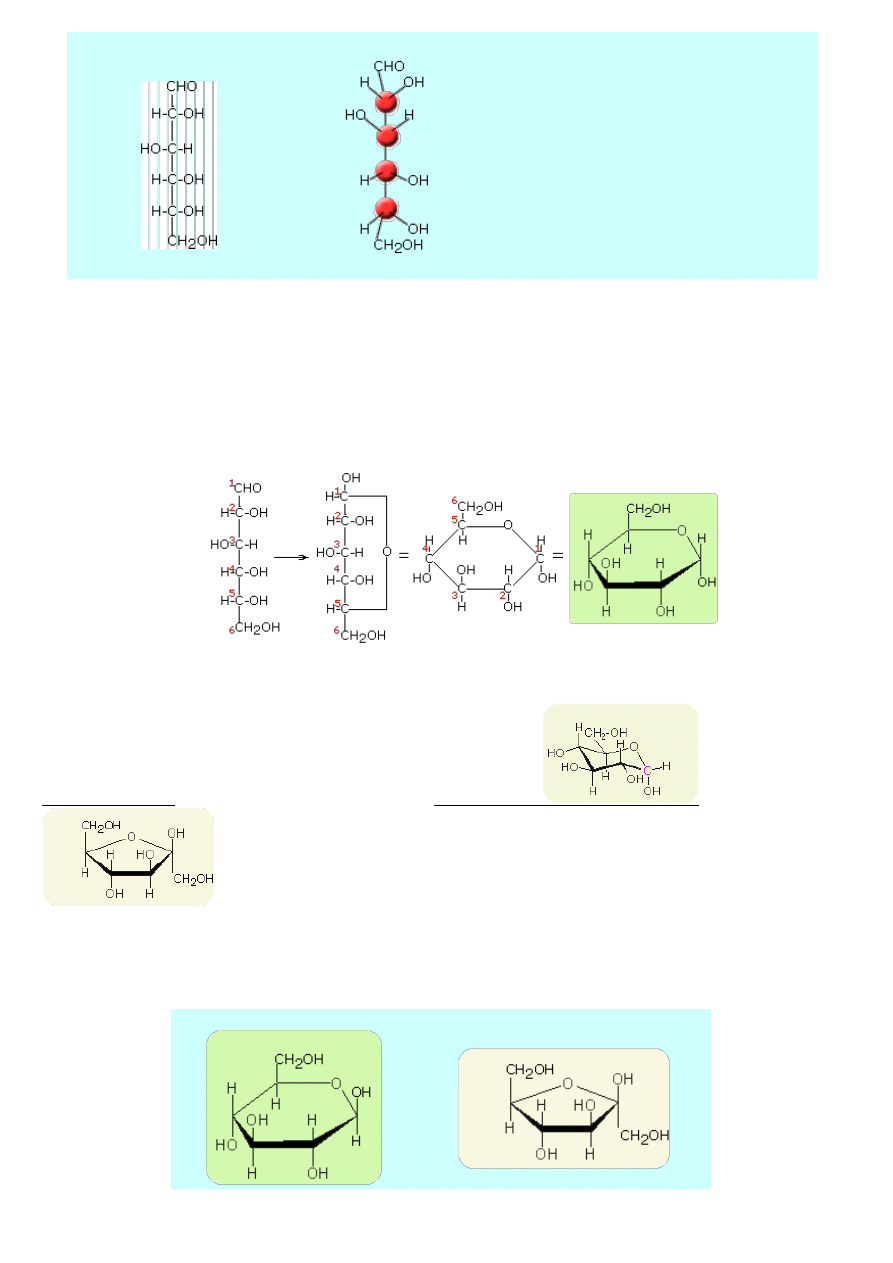
3
Wzór Fischera glukozy
Struktura przestrzenna glukozy
We wzorach tego rodzaju linie poziome
oznaczają w rzeczywistości wiązania
"wychodzące" ku nam z płaszczyzny papieru
(ekranu), a linie pionowe - wiązania
"odchodzące" od nas poza płaszczyznę papieru
(ekranu). Wiązania skierowane do tyłu mogą być
przedstawione za pomocą linii przerywanych,
natomiast skierowane do przodu za pomocą
strzałek.
Grupa aldehydowa (lub ketonowa) może reagować z grupą hydroksylową związaną z węglem C
4
lub C
5
w cząsteczce
monosacharydu. Wówczas pomiędzy atomem węgla C
1
i najczęściej C
5
w aldoheksosach (lub C
2
i C
5
w ketoheksosach) tworzy się
tzw. wiązanie półacetalowe. Cząsteczka aldoheksozy przyjmuje formę pierścienia sześcioczłonowego, natomiast cząsteczka
ketoheksozy - formę pierścienia pięcioczłonowego.
Monosacharydy tworzą półacetale o budowie pierścieniowej. Półacetale są uprzywilejowaną formš istnienia monosacharydów w
roztworach i jedynš ich formą w stanie krystalicznym. Strukturalne wzory cukrów, określające przestrzenne rozmieszczenie
podstawników, są przedstawiane wzorami Hawortha.
Według Hawortha - glukoza
W perspektywicznie zaznaczonych wzorach Hawortha sześcioczłonowy pierścień przedstawiany jest jako płaski sześciokąt. Nie
odpowiada to jednak rzeczywistości, gdyż w cukrach występuje stale forma krzeselkowa - patrz rysunek niżej
Forma krzesełkowa Jest to forma energetycznie korzystniejsza.
Obok przestrzenna konfiguracja fruktozy przedstawiona wzorem Hawortha.
Według wielkości pierścienia, monosacharydy nazywamy furanozami lub piranozami. W tym przypadku przed rdzeniem -furanoza
lub -piranoza umieszcza się przedrostek określający budowę cukru.
Glukopiranoza
Fruktopiranoza
4
Izomeria wsród węglowodanów
Węglowodany posiadają wiele chiralnych atomów wegla, co powoduje, że występują w postaci wielu stereoizomerów. Dlatego do
-
-, D-, L-, znaków (+), (-), które zawierają informacje o
konfiguracji cząsteczki oraz kierunku skręcania płaszczyzny światła spolaryzowanego.
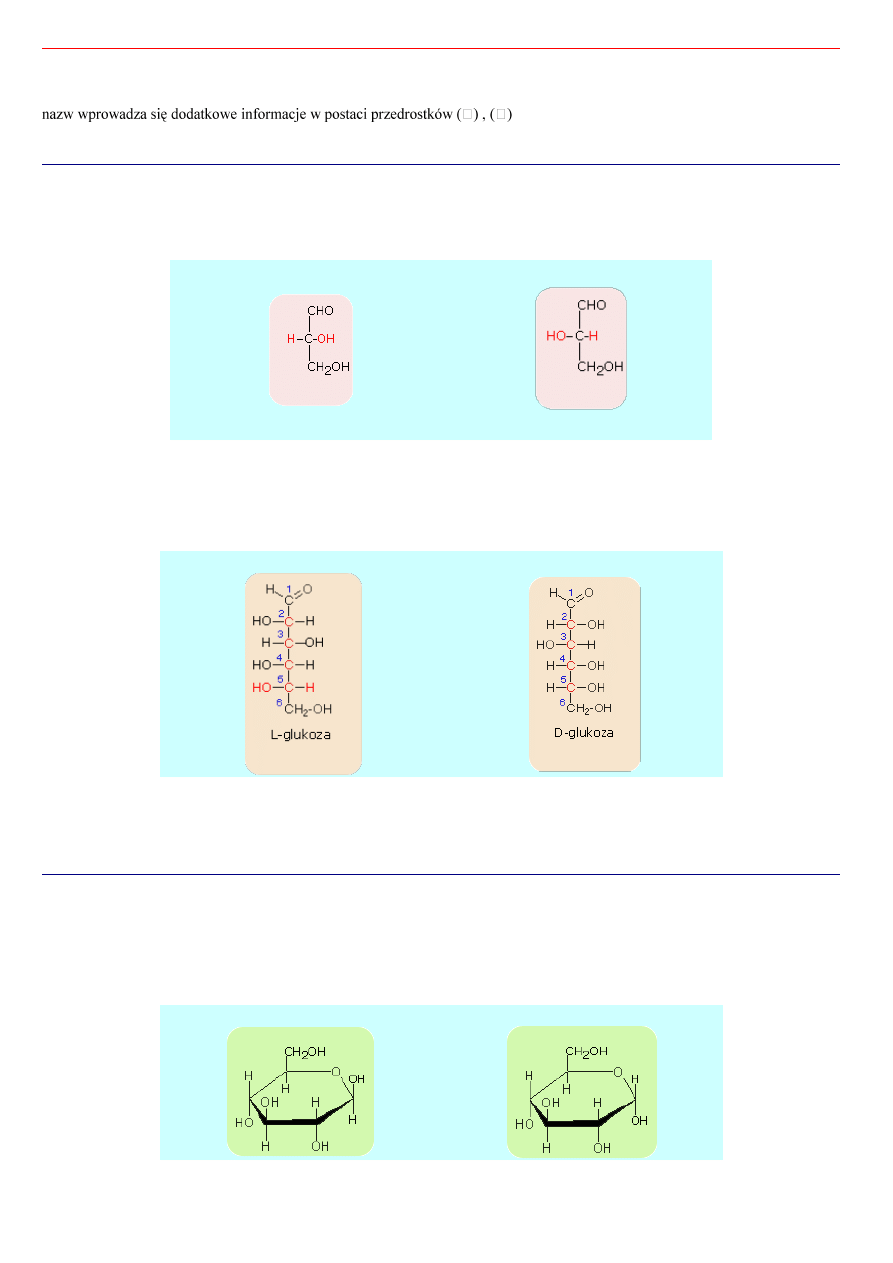
Izomery D- i L-
Punktem odniesienia dla konfoguracji D- i L- jest budowa cząsteczki aldehydu glicerynowego a konkretnie położenie
podstawników H- oraz HO- przy środkowym węglu.
D-aldehyd glicerynowy
L-aldehyd glicerynowy
Jeżeli cząsteczki cukrów prostych swoją budową nawiązuje do D-aldehydu glicerynowego, zaliczane są do szeregu D, natomiast
te, których budowa nawiązuje do L-aldehydu glicerynowego, zaliczane są do szeregu L.
Uporządkowanie na szeregi D i L następuje według konfiguracji podstawników, przy czym bierzemy pod uwagę to centrum
chiralności, które jest najbardziej oddalone od grupy karbonylowej.
L-Glukoza
D-glukoza
Z tego widzimy, że punktem wyjścia dla wyprowadzenia nazwy cukru jest poznanie jego budowy.
Udowodniono że cząsteczki cukrów prostych wykazują formę łańcuchową i pierścieniową, dlatego możemy przedstawiać je
różnymi wzorami chemicznymi, tj. liniowym według Fischera, cyklicznym oraz według Hawortha.
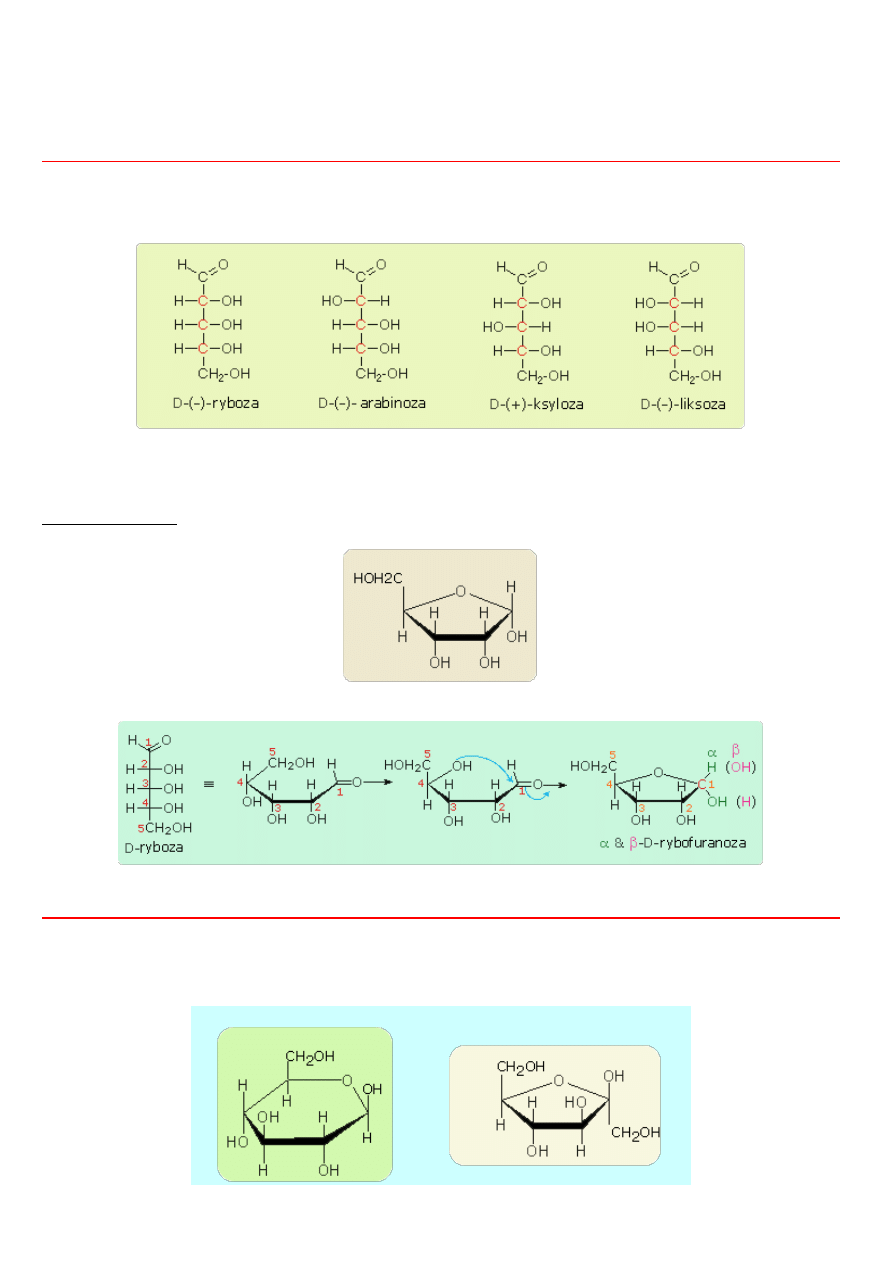
Izomery (α) i (β)
Przy zamknięciu pierścienia powstaje nowy asymetryczny atom węgla, ponieważ tam, gdzie przedtem wystepowało C=O w
podwójnym wiązaniu, znajdują się teraz cztery różne podstawniki. Wskutek tego możliwe są znowu dwie różne odmiany, które
określa się jako (alfa) i (beta). Przechodzą one łatwo jedna w drugą, prawdopodobnie poprzez formę aldehydową, która jednak w
stanie równowagi występuje w znikomym stężeniu.
α -D(+)-glukoza (glukopiranoza)
β -D(+)-glukoza (glukopiranoza)
5
Izomery (+) i (-)
Znaki (+) i (-) oznaczają kierunek skręcania płaszczyzny światła spolaryzowanego. Związki skręcające płaszczyznę światła w prawo
zaznacza się symbolem (+) przed nazwą związku, skręcające w lewo symbolem
(-). Stąd często nazwy D(+)-glukoza, D(-)-fruktoza, itd.
Pentozy
Pentozy C
5
H
10
O
5
Pentozy jako związki chemiczne odgrywają duże znaczenie fizjologiczne. najwazniejsze to:
Z szeregu pentoz najważniejsza jest ryboza, która wchodzi w skład kwasów rybonukleinowych (RNA) i kenzymów
nukleotydowych.
ryboza (rybofuranoza)
Niżej sposób zamykania pierścienia
W kwasach dezoksyrybonukleinowych (DNA) znajduje się ryboza odtleniona (dezoksy) i nie posiadająca tlenu na drugim węglu.
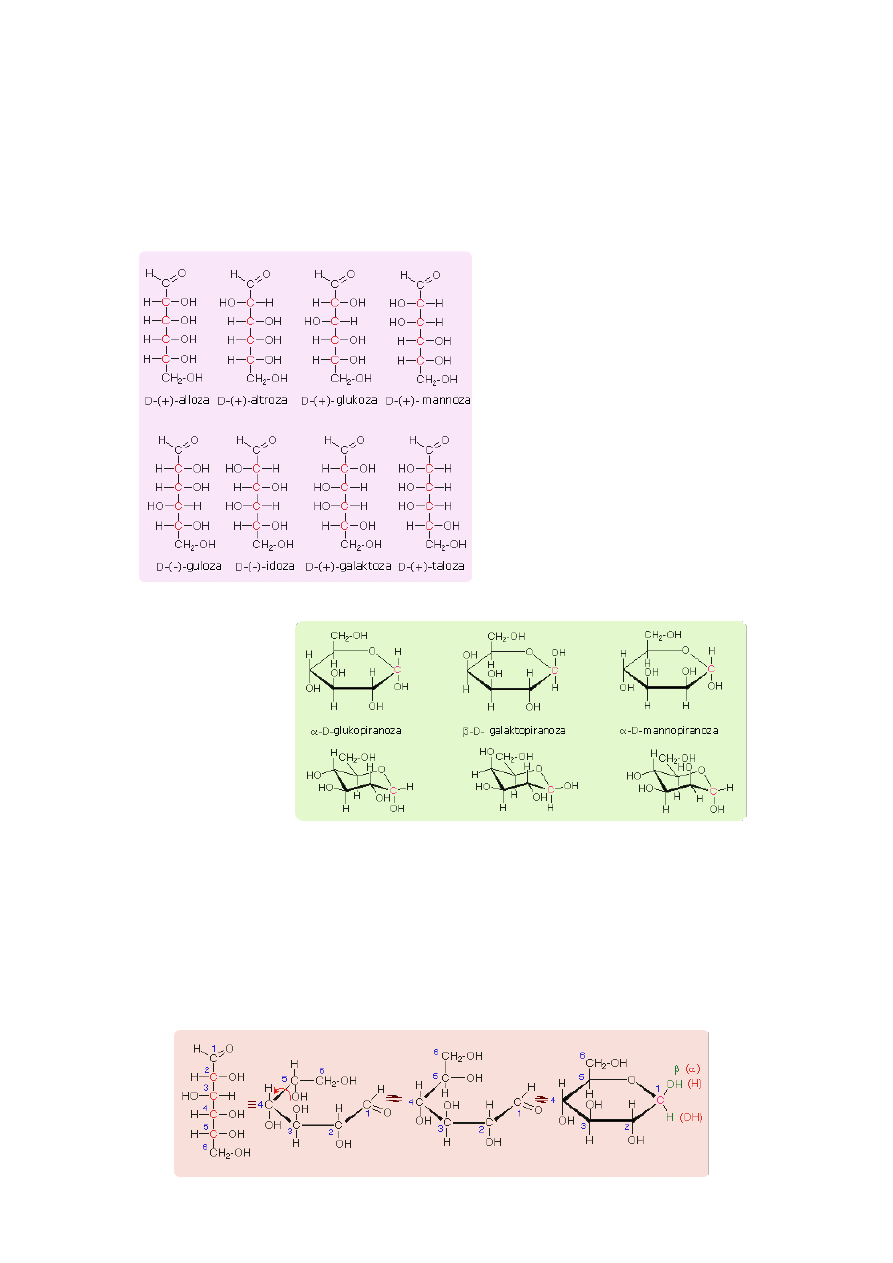
Heksozy
Heksozy C
6
H
12
O
6
. Najbardziej rozpowszechnioną z 16 aldoheksoz jest
D(+)-glukoza (cukier gronowy)
, a z ketoheksoz
D(-)-
fruktoza.
D(+)-glukoza (glikopiranoza)
D(-)-fruktoza (fruktopiranoza)
6
Aldoheksoza należy do grupy cukrów posiadających sześć atomów węgla w cząsteczce, o wzorze sumarycznym C
6
H
12
O
6
,
różniących się jednak strukturalnie, tzn. rozmieszczeniem atomów. Zjawisko to nosi nazwę izomerii.
Wszystkie węgle w cząsteczce cukru, według Fischera, połączone są w łańcuch prosty. Pierwszy węgiel grupy aldehydocukrów,
jakim jest aldoheksoza, tworzy grupę aldehydową -CHO, ostatni, tzn. szósty - grupę alkoholu I-szo rzędowego -CH
2
OH. Pozostałe
węgle (2,3,4,5) tworzą grupy alkoholowe II-go rzędowe i są zarazem węglami asymetrycznymi.
Obecność w cząsteczce czterech asymetrycznych węgli daje nam zgodnie z regułą N=2
n
, 16 izomerów, gdzie n - liczba
asymetrycznych węgli.
Z tych 16 izomerów aldoheksozy praktycznie znane są obecnie wszystkie. Otrzymano je albo na drodze syntezy laboratoryjnej, albo
przez wydzielenie ze źródeł naturalnych. Stwierdzono, że tylko trzy z tych izomerów: (+)-glukoza, (+)-mannoza i (+)-galaktoza
występują w znacznych ilościach.
Wybrane izomery aldoheksoz
Wybrane przykłady struktuy cyklicznych
Katoheksozy w odróżnieniu od aldoheksoz posiadają 3 asymetryczne atomy węgla. Stąd ilość izomerów w tej grupie cukrów
prostych wynosi 8.
Z ketoheksoz najbardziej znanym izomerem jest
D(-)-fruktoza
, która podobnie jak glukoza powszechnie występuje w owocach a
także - w połączeniu z glukozą - w dwucukrze, sacharozie.. Obydwa cukry tj. glukoza i fruktoza występują w świecie roślinnym
obok siebie, przeważnie w słodkich owocach i w miodzie.
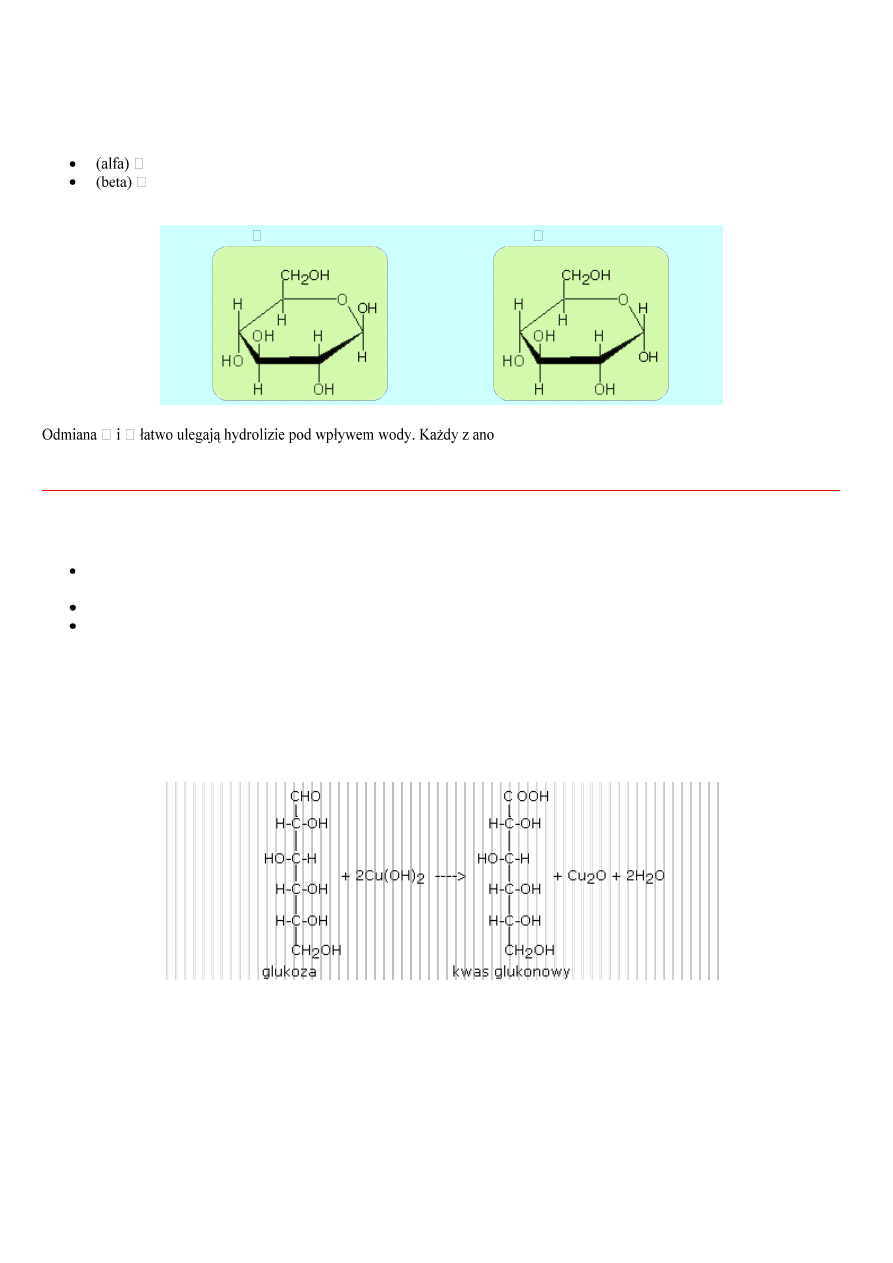
Glukoza jak i fruktoza posiadają strukturę liniowe i pierścieniowe. Sposób zamykania pierścienia dla glukozy pokazuje rysunek
13.1.
D(+)-glukoza -- > D-glukopiranoza
7
Rys.13.1 Przejście glukozy ze struktury liniowej w cykliczną
D(+)-glukoza jest hemiaacetalem, którego struktura odpowiada strukturze reakcji zachodzącej między grupą aldehydową a grupą
wodorotlenową przy atomie C-5 cząsteczki o otwartym łańcuchu. Ma ona cykliczną strukturę dlatego, że grupa aldehydowa i
alkoholowa są częściami tej samej cząsteczki.
Taka cykliczna struktura ma o jedno centrum chralności więcej niż struktura liniowa, w związku z tym istnieją dwie izomeryczne
odmiany D(+)-glukozy tj.
-D(+)-glukoza
-D(+)-glukoza
rózniącymi się konfiguracją wokół atomu węgla C-1. Takie dwa diastereoizomery nazywają się anomerami
-D(+)-glukoza
-D(+)-glukoza
merów w roztworze wodnym poprzez formę o otwartym
łańcuchu ulega przekształceniu w mieszaninę pozostającą w stanie równowagi, zawierającą oba izomery o strukturze
pierścieniowej.
3. Reakcje cukrów prostych
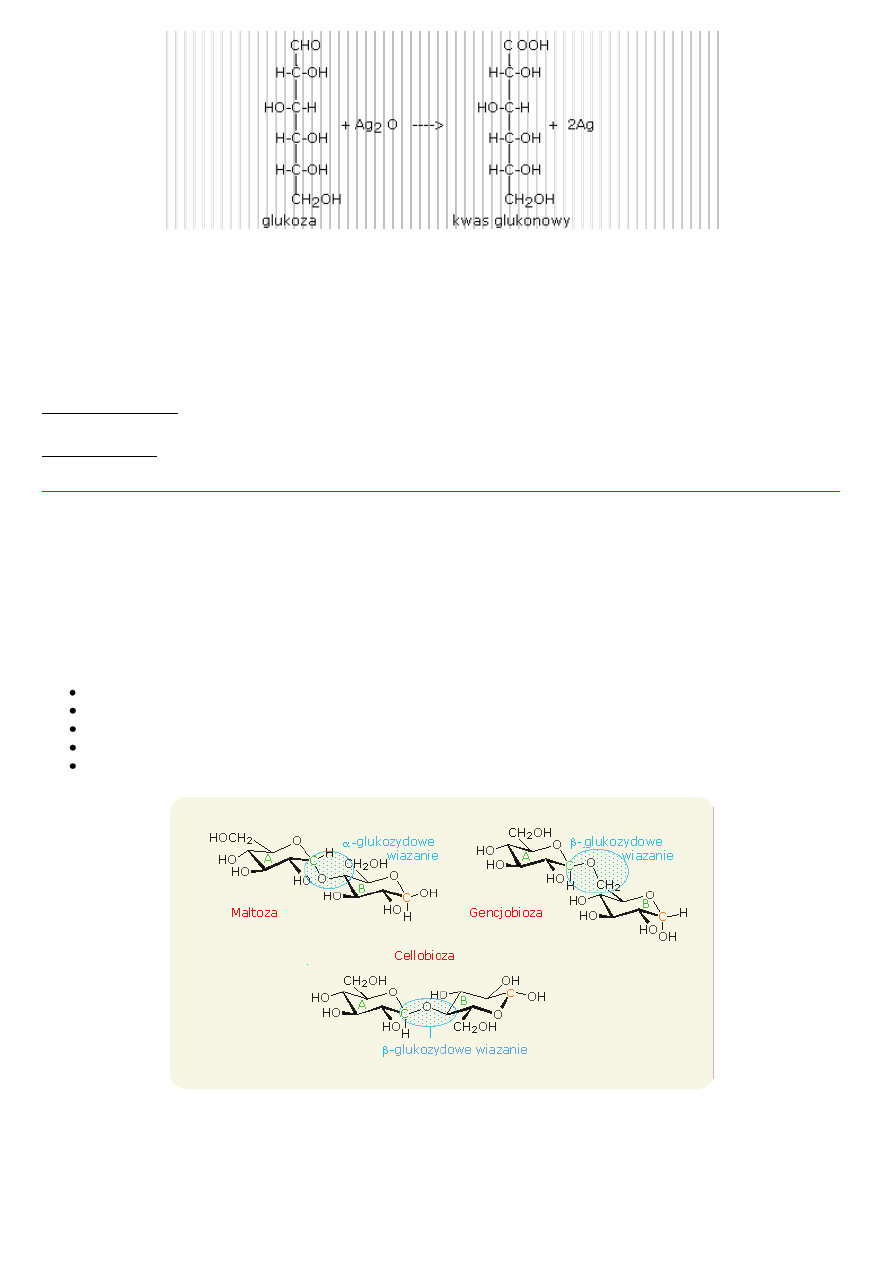
Cukry proste poddają się następującym reakcjom:
reakcji utleniania, gdzie czynnikiem utleniajacym może być odczynnik Fehlinga lub Tollensa, woda bromowa (utlenia
aldozy a nie utlenia ketoz), kwas azotowy, kwas nadjodowy HIO
4
tworzenia osazonów (reakcja z fenylohydrazyną i dotyczy tylko aldoz)
wydłużania i skracania łańcucha węglowego (dotyczy aldoz)
Odczynnik Fehlinga (roztwór siarczanu(VI)żelaza(II) + roztwr kwasu winowego) to roztwór min. wykorzystywany do wykrywania
substancji o własnościach redukujących a takimi są cukry proste.
Siarczan(VI) miedzi(II) CuSO
4
w środowisku zasadowym (NaOH) tworzy galaretowaty osad Cu(OH)
2
. Ogrzewany Cu(OH)
2
z
roztworem glukozy tworzy czerwonoceglasty osad tlenku miedzi(I) Cu
2
O.
CuSO
4
+ 2NaOH --> Cu(OH)
2
+ Na
2
SO
4
Reakcja z odczynnikiem Tollensa jest nazywana "próbą lustra". Reakcja ta już była opisana w rozdziale "Aldehydy i ketony". W
reakcji wydziela się srebro, które tworzy lustrzaną warstwę na ściankach naczynia (probówki).
8
Jedną z najwazniejszych przemian, jakiej podlega cukry w organizamch żywych jest glikoliza. Jest to proces przemiany glukozy w
tkankach i komórkach w wyniku czego uwalniana jest energia pokrywająca zapotrzebowanie energetyczne komórek.
Proces glikolizy jest bardzo złożony i bierze w nim udział zespół enzymów , koenzymów i aktywatorów. Schemat glikolizy można
przedstawić następująco:
glukoza --> kwas pirogronowy --> kwas mlekowy
Proces ten może przebiegać w warunkach beztlenowych lub przy dostatecznej ilości tlenu. Sumarycznie procesy te mozemy opisać
równaniami:
Przemiana beztlenowa
C
6
H
12
O
6
--> 2CH
3
CH(OH)COOH + 57kcal
Przemiana tlenowa
C
6
H
12
O
6
+ 6O
2
--> 6CO
2
+ 6H
2
O + 677kcal
Cukry złożone
Jeżeli cząsteczki cukrów prostych łączą się ze sobą, tak że jedna cząsteczka cukru prostego łączy się z grupą alkoholową drugiej
cząsteczki cukru, wówczas związki te nazywamy disacharydami (dwucukrami). Gdy więcej cząsteczek cukru łączy się ze sobą,
powstają odpowiednio trójcukrowce, czterocukrowce itd.
Cukry zawierające do ośmiu prostych reszt cukrowych przyjęto nazywać olisacharydami, jeżeli łączy się więcej reszt wówczas
nazywamy je polisacharydami.
Olisacharydy - małocząsteczkowe polisacharydy sa rozpuszczalne w wodzie i zdolne do krystalizacji. Olisacharydy z reguły mają
smak słodki. Podczas hydrolizy rozpadaja się na cząsteczki cukrów prostych. Najważniejszymi olisacharydami są disacharydy
(dwucukrowce), do których zaliczamy;
(+)-maltozę
(+)-cellobiozę
(+)-laktozę
(+)-sacharozę
(+)-gencjobiozę
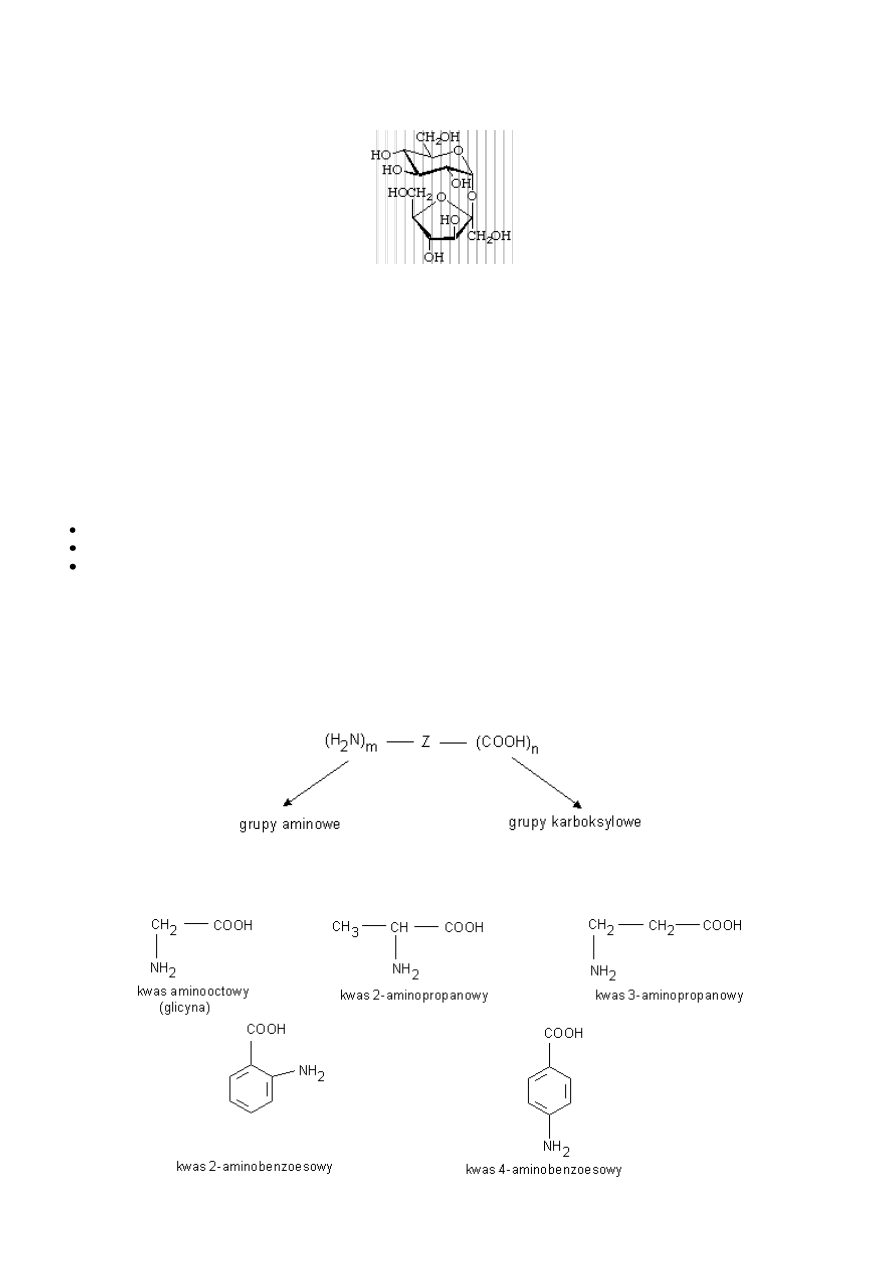
9
(+)-Sacharoza
Jest cukrem stołowym otrzymywanym z trzciny cukrowej lub buraków cukrowych. Bardzo słodka, dobrze rozpuszczalna w wodzie i
słabo w etanolu.
Ma wzór sumaryczny C
12
H
22
O
11
a strukturalny następujący
Nie redukuje ona odczynnika Tollensa ani Fehlinga, co wskazuje, że nie posiada własności redukujących (nie zawiera "wolnej"
grupy aldehydowej ani ketonowej).
W wyniku hydrolizy (+)-sacharozy pod wpływem rozcieńczonego, wodnego roztworu kwasu lub enzymu inwertazy powstają równe
ilości D-(+)-glukozy i D-(-)-fruktozy.
C
12
H
22
O
12
+ H
2
O --> C
6
H
12
O
6
(D-glukoza) + C
6
H
12
O
6
(D-fruktoza)
Hydrolizie towarzyszy zmiana znaku skręcalności z dodatniego na ujemny i dlatego proces ten nazywa się często inwersją (+)-
sacharozy a otrzymana lewoskretna mieszanina cukrów nosi nazwę cukru inwertowanego. Z cukrem inwertowanym możemy
spotkac się w miodzie, gdzie inwertazy dostarczają pszczoły.
Polisacharydy - są to wielocukrowce, które nie mają smaku słodkiego, podczas hydrolizy rozpadaja się na kilka cząsteczek
olisacharydów, a te z kolei rozpadają się na cząsteczki cukrów prostych. Do polisacharydów zaliczamy:
skrobię
gligogen
celulozę (błonnik)
Aminokwasy
Aminokwasy- związki dwufunkcyjne zawierające w swych cząsteczkach grupy karboksylowe i aminowe.
przykłady:
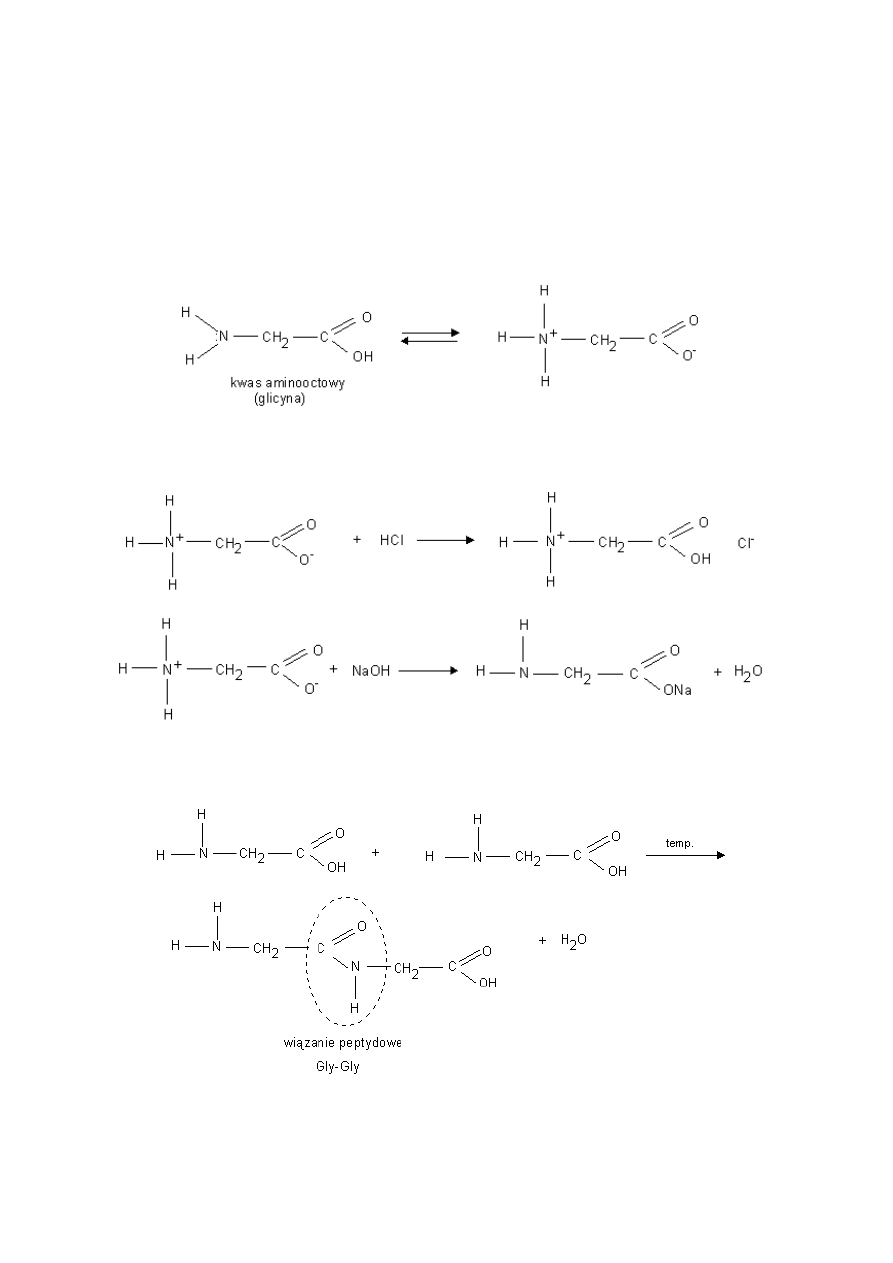
10
Właściwości fizyczne aminokwasów:
-są związkami krystalicznymi
-rozpuszczają się w rozpuszczalnikach polarnych (woda, alkohol etylowy), nie rozp. się w rozpuszczalnikach
niepolarnych (benzen, eter, heksan)
-mają wysokie temp topnienia
Właściwości chemiczne glicyny:
Roztwór wodny glicyny jest obojętny ponieważ obecne w cząsteczce grupy: karboksylowa i aminowa ulegają
wewnętrznemu zobojętnieniu. Tworzy się sól wewnętrzna w rezultacie przeniesienia jonu H+ od grupy karboksylowej
do aminowej.
a) Sól taka może reagować zarówno z kwasami jak i z zasadami.
b) Reakcja kondensacji - zachodzi pomiędzy grupą aminową i karboksylową dwóch aminokwasów.
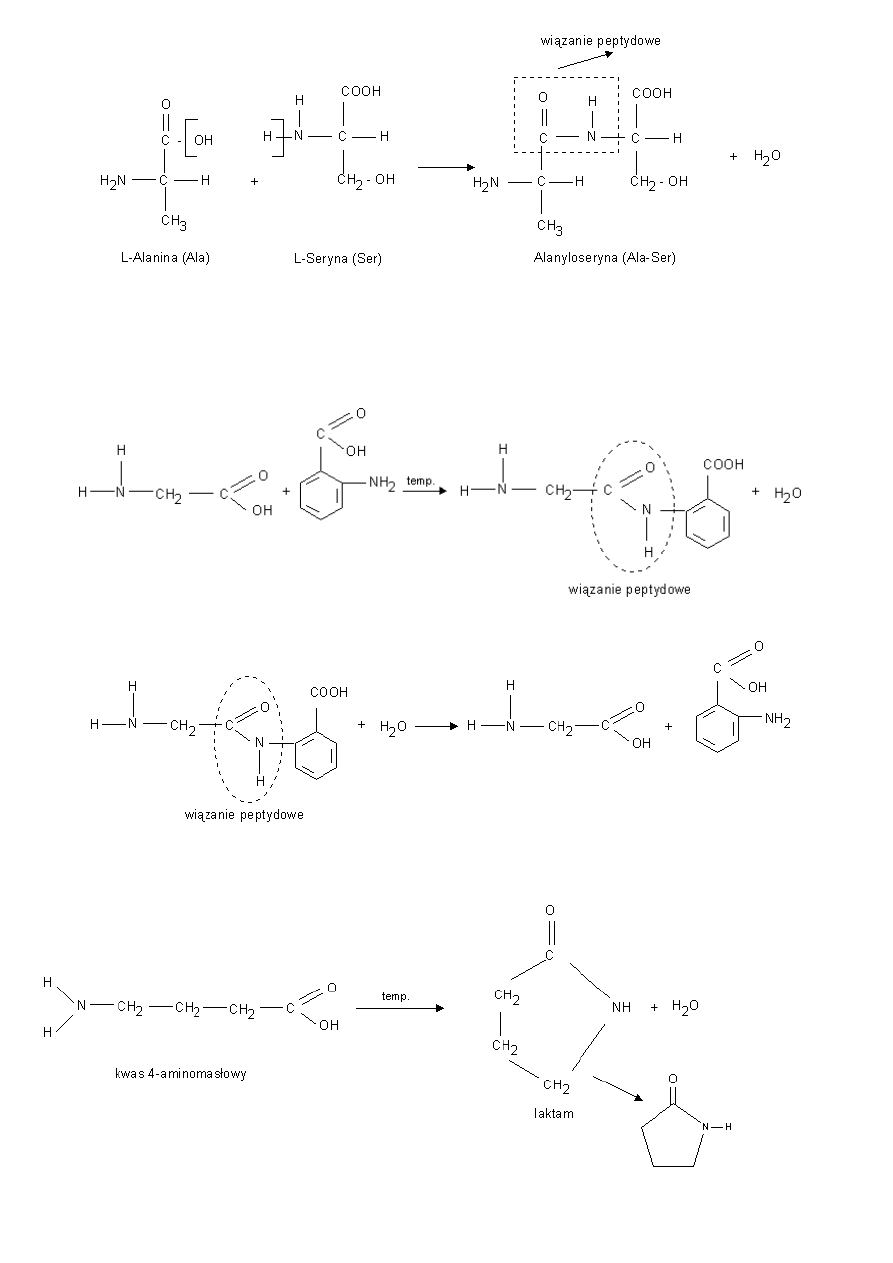
11
Powstały produkt nadal ma grupę aminową i karboksylową i może reagować dalej w reakcji kondensacji. Związki
powstałe w wyniku kondensacji aminokwasów,
noszą nazwę peptydów.
przykłady innych reakcji kondensacji:
Reakcją odwrotną do redakcji kondensacji jest reakcja hydrolizy.
Za pomocą tej reakcji można ustalić, z jakich aminokwasów składał się peptyd.
c) Reakcja kondensacji - zachodząca pomiędzy grupą aminową I karboksylową tego samego aminokwasu. -
wewnątrzcząsteczkowa reakcja kondensacji.
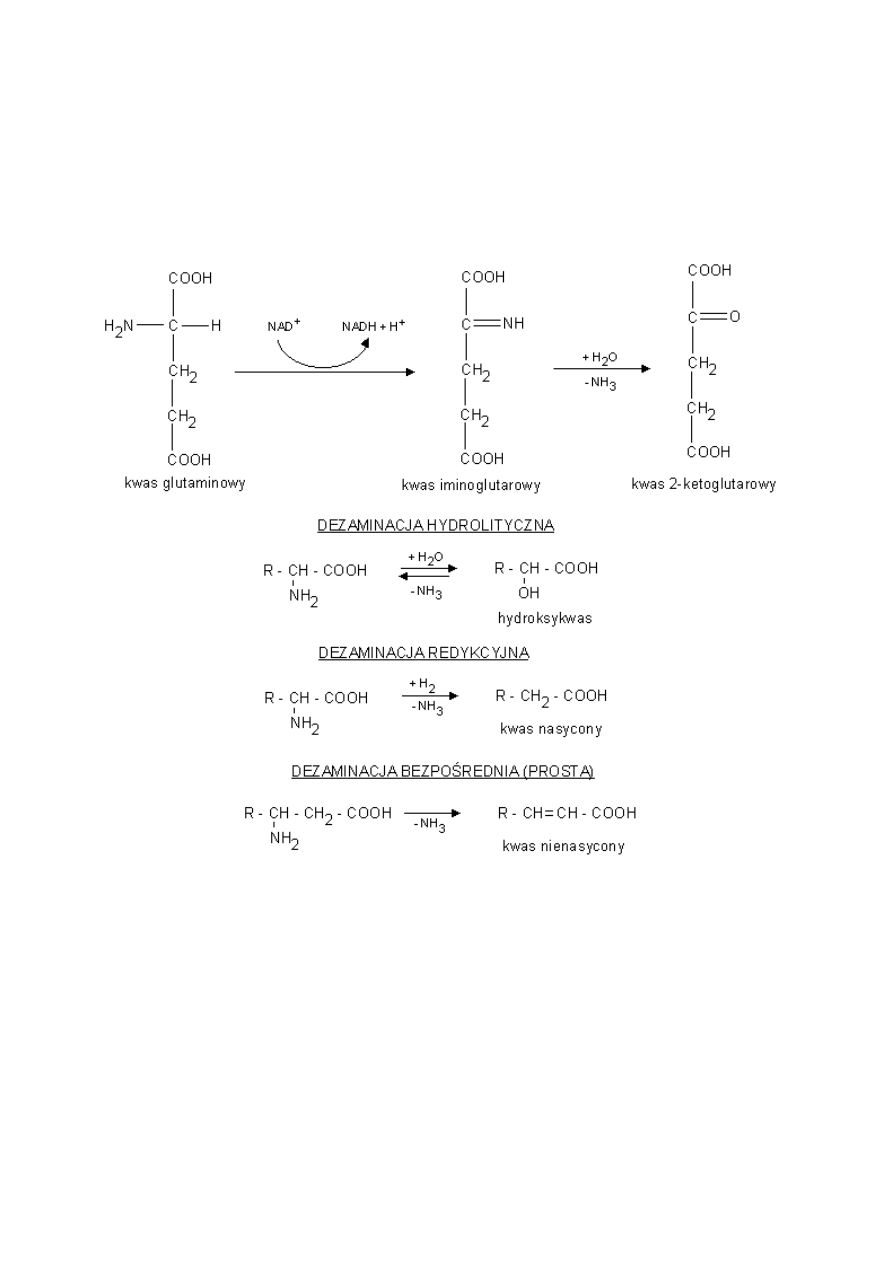
12
Pierścienie laktamowe są elementami składowymi penicyliny.
d) Reakcja dezaminacji
-proces transaminacji - zachodzi u kręgowców; prowadzi do powstania ketokwasów; akceptorem amoniaku z
aminokwasu jest ketokwas, który jest jednocześnie donorem tlenu na rzecz dezaminowanego aminokwasu.
-dezaminacja oksydacyjna - zachodzi u kręgowców; następuje odwodorowanie aminokwasu przy udziale enzymu
dehydrogenazy (koenzym FAD, rzadziej NAD+) do iminokwasu, następnie samorzutne dołączenie wody z odłączeniem
amoniaku.
-dezaminacja hydrolityczna - zachodzi u bakterii; prowadzi do powstania hydroksykwasów.
-dezaminacja redukcyjna zachodzi u bakterii; prowadzi do powstania kwasów nasyconych.
-dezaminacja bezpośrednia zachodzi u bakterii; prowadzi do powstania kwasów nienasyconych.
Punkt izoelektryczny (pI) - takie pH środowiska, przy którym cząsteczka aminokwasu w danych warunkach jest
obojętna. W punkcie izoelektrycznym cząsteczka nie ma wędrowania w polu elektrycznym.
Punkt izojonowy - taka wartość pH, przy której liczba protonów związanych z grupami -NH2 jest równa liczbie
protonów odszczepionych przez grupy -COOH. W tym punkcie przeciętny ładunek jest równy zeru. Punkt ten ma
wartość stałą i charakterystyczną dla danego aminokwasu lub białka.
Natomiast punkt izoelektryczny ulega zmianie, bo zależy od środowiska.
W roztworze o Ph większym od punktu izoelektrycznego cząsteczka występuje w postaci anionu, a poniżej pI - w
formie kationu. W punkcie izoelektrycznym jest najsłabiej rozpuszczalna, czyli najłatwiej ją strącić.
Podział aminokwasów:
a) ze względu na ilość grup karboksylowych i aminowych:
obojętne (1 grupa -NH2 1 grupa -COOH)
kwaśne (1 grupa -NH2 2 grupy -COOH)
zasadowe (2 grupy -NH2 1 grupa -COOH)
obojętne z układem cyklicznym
b) ze względu na polarność grup R w sąsiedztwie węgla a.
Wyszukiwarka
Podobne podstrony:
9 Ch organiczna WĘGLOWODANY
3 ch org zwiazki funkcyjne
cwiczenie 7 Aminokwasy id 125541
aminokwasy[1] id 59122 Nieznany (2)
zcho ch org errata
W4 ch org 2011 12
Aminokwasy 6 id 59098 Nieznany
zw org 2 kw kar id 593471 Nieznany
aminokwasy 8 id 59102 Nieznany
6 SEMINARIUM CHEMII ORGANICZNEJ Aminokwasy id 43882 (2)
kolokwium 4, organiczna, ch.org kolo
Bialka i weglowodany wyklad 4 id 84885 (2)
MOJE ch org 5
kolokwium 2, organiczna, ch.org kolo
egzamin 23.06.2008, organiczna, ch.org kolo
kolokwia zaliczeniowe 2001-2008, organiczna, ch.org kolo
kolokwium 1, organiczna, ch.org kolo
więcej podobnych podstron